Universidade do Minho
Escola de Ciências
Ângela Rafaela Cardoso Vilas Boas
Capacidade antioxidante de vinhos:
desenvolvimento de método
Tese de Mestrado
Mestrado em Técnicas de Caracterização e Análise Química
Trabalho efetuado sob a orientação de
Professora Doutora Fátima Bento
e de
DECLARAÇÃO
Nome: Ângela Rafaela Cardoso Vilas Boas
Título da dissertação:
Capacidade antioxidante de vinhos: desenvolvimento de método
Orientadora:
Professora Doutora Fátima Bento Co-orientador:
Doutora Natacha Fontes
Ano de conclusão: 2016
Designação do Mestrado: Mestrado em Técnicas de Caracterização e Análise Química
É AUTORIZADA A REPRODUÇÃO PARCIAL DESTA DISSERTAÇÃO APENAS PARA EFEITOS DE INVESTIGAÇÃO, MEDIANTE DECLARAÇÃO ESCRITA DO INTERESSADO, QUE A TAL SE COMPROMETE.
Universidade do Minho, 29 de Janeiro de 2016
Agradecimentos
Quero agradecer especialmente às minhas orientadoras, Professora Doutora Fátima Bento e Doutora Natacha fontes, pela orientação, acompanhamento e pela disponibilidade revelada ao longo de todo o trabalho, assim como o apoio, incentivo, críticas, correções e sugestões relevantes à execução deste projeto.
Agradeço à Sogrape Vinhos S.A. pela oportunidade de desenvolver este projeto com o fornecimento das amostras de vinho necessárias.
Um agradecimento especial, à Doutora Professora Dulce Geraldo pela disponibilidade, apoio e sugestões que foram essenciais para a concretização deste projeto.
Aos meus colegas de laboratório pela companhia, boa disposição e apoio durante a realização do meu projeto.
Aos meus amigos e ao Diogo, por me apoiarem e incentivarem nas alturas mais difíceis.
Por último, dirijo um agradecimento especial aos meus pais e ao meu irmão pelo apoio incondicional, incentivo, carinho, paciência, e toda a ajuda que me prestaram na superação dos obstáculos que foram surgindo ao longo desta caminhada.
Resumo
O vinho possuí uma grande diversidade de compostos fitoquímicos que incluem substâncias com capacidade antioxidante. Estas espécies têm a capacidade de reagir tanto com o oxigénio molecular como com outras espécies que se formam pela redução do oxigénio (espécies reativas de oxigénio). Esta propriedade, que serve de base à sua denominação, tem dado origem a inúmeros estudos que associam o consumo moderado de vinho à prevenção de doenças ligadas ao envelhecimento.
Este trabalho teve como objetivo principal testar o uso de métodos eletroquímicos na caraterização de antioxidantes em vinhos. Os métodos utilizados incluem métodos voltamétricos e a geração eletroquímica de radicais HO. Ainda que os métodos voltamétricos tenham sido alvo de vários estudos e publicações científicas, o seu conhecimento fora da comunidade científica é restrito. Por outro lado, o método baseado na geração eletroquímica de radicais hidroxilo é relativamente recente. A sua aplicação ainda não tinha sido testada em vinhos. Neste âmbito, foi também introduzida uma modificação ao método original pelo uso de uma sonda ótica que absorve na região do ultravioleta-visível (UV-vis), permitindo o uso de um espectrofotómetro corrente na deteção do consumo da sonda, em vez de um fluorímetro.
Os resultados obtidos através das técnicas voltamétricas de voltametria cíclica e de voltametria diferencial de impulso nas diferentes amostras de vinhos variam de forma semelhante. No entanto, os seus valores absolutos dependem fortemente quer da natureza do elétrodo quer da natureza da técnica voltamétrica.
Os resultados relativos à caraterização das amostras baseadas na reação com os radicais HO estão em concordância com os obtidos tanto pelas técnicas voltamétricas como pela quantificação de compostos fenólicos. Todos estes resultados indicam que os vinhos do Porto têm menor capacidade antioxidante que os vinhos de mesa tintos. A dificuldade em obter resultados idênticos prende-se com o facto das técnicas medirem propriedades diferentes, como também às diferenças entre as suas seletividades. Este último fator tem uma importância muito grande na análise de amostras de devido à complexidade da matriz.
Abstract
Wine possesses a wide variety of phytochemicals compounds, which include substances with antioxidant activity. These species are capable of reacting with molecular oxygen, as well as with other species formed by reduction of oxygen (reactive oxygen species). This property, which is at the basis of these species denomination, has given rise to numerous studies that relates a moderate consumption of wine to prevention of diseases associated with aging.
This study aimed to test the use of electrochemical methods in the characterization of antioxidant capacity of wine. The methods used include voltammetric techniques and the electrochemical generation of OH radicals. Although voltammetric methods have been the subject of several studies and scientific publications, its use outside the scientific community is restricted. On the other hand, the method based on the electrochemical generation of hydroxyl radicals is relatively recent. Its application has not yet been tested in wines. In this context, a modification of the original method by using an optical probe that absorbs in the ultraviolet-visible region (UV-vis) was also introduced, allowing the use of a current spectrophotometer for the detection of the probe consumption, rather than a fluorimeter.
Results obtained from the cyclic voltammetry and differential pulse voltammetry in the different wine samples display a similar trend. However, their absolute values depend strongly on both, the nature of the electrode and the nature of the voltammetric technique. Results concerning the characterization of samples based on reaction with OH radicals are in agreement with those obtained both by voltammetric techniques and by quantification of total phenolic compounds. All these results indicate that Port wines have lower antioxidant capacity than red table wines. The difficulty in obtaining identical results has to do with the fact that the different technics measure different properties, besides the differences associated with selectivity. This last factor has a great importance in the analysis of wine samples due to the complexity of the matrix.
Índice
Agradecimentos ... iii
Resumo ... v
Abstract ... vii
Índice ... ix
Índice de tabelas ...xiii
Índice de figuras ... xvii
Lista de abreviaturas e siglas ... xxiii
1. Objetivo ... 3
2. Introdução ... 3
Vinho ... 3
2.1.1 O que é? ... 3
2.1.2 Processo de produção do vinho ... 4
2.1.2.1 Vinificação dos vinhos de mesa tintos ... 5
2.1.2.2 Vinificação dos vinhos do Porto ... 7
2.1.3 Composição do vinho ... 7
2.1.3.1 Compostos flavonóides ... 10
2.1.3.2 Compostos não flavonóides ... 12
2.1.4 Desafios que o vinho apresenta ... 14
Antioxidantes ... 15
2.2.1 Mecanismos de ação na prevenção da oxidação... 15
2.2.2 Métodos de caracterização da capacidade antioxidante ... 18
2.2.2.1 Ensaios envolvendo transferência de átomos de hidrogénio (HAT) . 19 2.2.2.2 Ensaios envolvendo transferência eletrónica (ET) ... 21
2.2.2.3.1 Ensaios diretos ... 23 2.2.2.3.2 Ensaios indiretos ... 25 3. Parte experimental ... 33 3.1 Amostras ... 33 3.2 Reagentes e soluções ... 35 3.3 Métodos ... 38
3.3.1 Voltametria cíclica e voltametria diferencial de impulso ... 38
3.3.2 Eletrólises galvanostáticas ... 40
3.3.3 UV-Visível ... 41
3.4 Cálculo das incertezas ... 42
4. Resultados e Discussão ... 47
4.1 Análise voltamétrica dos antioxidantes em amostras de vinho ... 47
4.1.2 Análise voltamétrica do ácido gálico... 47
4.1.2.1 Voltametria cíclica ... 47
4.1.2.2 Voltametria diferencial de impulso ... 49
4.1.3 Curvas de calibração ... 50
4.1.3.1 Voltametria cíclica ... 50
4.1.3.2 Voltametria diferencial de impulso ... 53
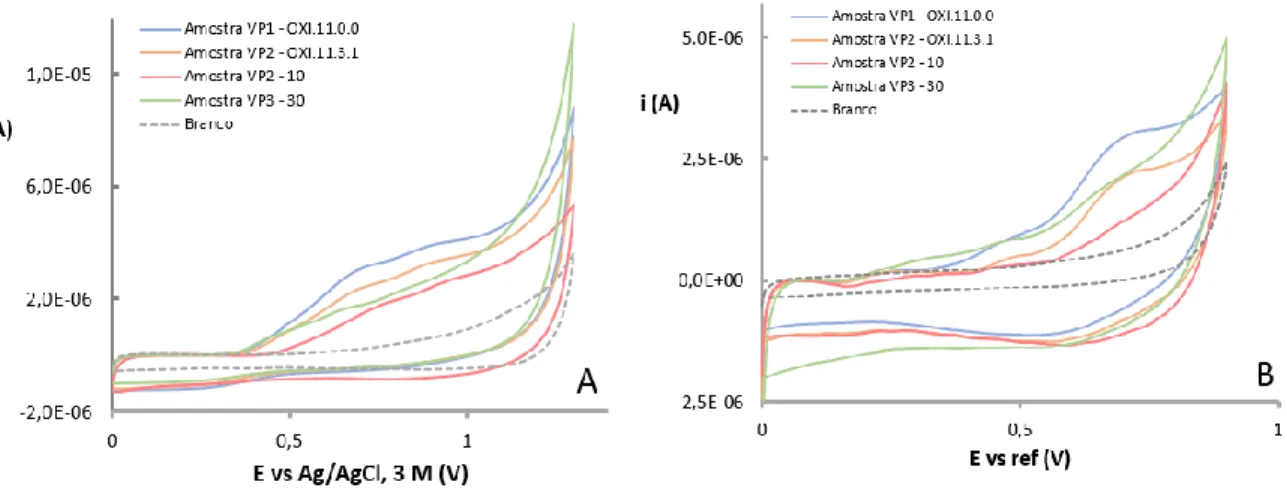
4.1.4 Análise voltamétrica das amostras de vinhos ... 55
4.1.4.1 Caracterização das amostras de vinho por voltametria cíclica ... 55
4.1.4.2 Caracterização das amostras de vinho por da voltametria diferencial de impulso ... 59
4.1.5 Análise quantitativa das respostas voltamétricas obtidas nas amostras de vinhos ... 62
4.1.5.2 Análise dos resultados de voltametria diferencial de impulso ... 65
4.1.6 Quantificação dos antioxidantes presentes no vinho por comparação com antioxidante de referência ... 66
4.2 Avaliação da capacidade antioxidante através da reação com radicais HO gerados por via eletroquímica ... 69
4.2.1 Caracterização espetroscópica da sonda ótica ... 69
4.2.2 Caracterização do consumo da sonda em eletrólises galvanostáticas .... 72
4.2.3 Caraterização da capacidade antioxidante do trolox a partir do consumo da sonda (RNO) ... 77
4.2.4 Caracterização da capacidade antioxidante das amostras de vinho ... 80
5. Conclusão ... 89
Índice de tabelas
Tabela 1: Composição química típica do vinho de mesa tinto32 ... 8
Tabela 2: Caracterização química dos vinhos de mesa tintos e vinhos do Porto ... 34
Tabela 3: Lista dos reagentes utilizados e respetivas características ... 35
Tabela 4: Parâmetros característicos dos voltamogramas obtidos numa solução de 0,5 mM de AG por VC com GCE e SPCE ... 49
Tabela 5: Parâmetros característicos dos voltamogramas obtidos para o ácido gálico 0,50 mM nos elétrodos GCE e SPCE por DPV ... 50
Tabela 6: Valores de declive, ordenada na origem, limite de deteção e de coeficiente de correlação para as retas de calibração apresentadas na Figura 18 ... 51
Tabela 7: Valores de declive, ordenada na origem, limite de deteção e de coeficiente de correlação para as retas de calibração apresentadas na Figura 20 ... 53
Tabela 8: Parâmetros característicos dos voltamogramas obtidos para as amostras de vinho de mesa tinto com GCE por VC. Os potenciais apresentados para o GCE são reportados ao Ag/AgCl, 3 M. ... 56
Tabela 9: Parâmetros característicos dos voltamogramas obtidos para as amostras de vinho de mesa tinto com SPCE por VC. Os potenciais apresentados para o SPCE são reportados ao elétrodo de referência impresso (Ag). ... 57
Tabela 10: Parâmetros característicos dos voltamogramas obtidos para as amostras de vinho do Porto com GCE por VC. Os potenciais apresentados para o GCE são reportados ao Ag/AgCl, 3 M ... 58
Tabela 11: Parâmetros característicos dos voltamogramas obtidos para as amostras de vinho do Porto com SPCE por VC. Os potenciais apresentados para o SPCE são reportados ao elétrodo de referência impresso (Ag) ... 58
Tabela 12: Parâmetros característicos dos voltamogramas obtidos para as amostras de vinho de mesa tinto com GCE e com SPCE por DPV. Os potenciais apresentados para o GCE são reportados ao Ag/AgCl, 3 M, enquanto que os relativos ao SPCE são reportados ao elétrodo de referência impresso (Ag) ... 60
Tabela 13: Parâmetros característicos dos voltamogramas obtidos para as amostras de vinho do Porto com GCE e com SPCE por DPV. Os potenciais apresentados para o GCE são reportados ao Ag/AgCl, 3 M, enquanto os relativos ao SPCE são reportados ao elétrodo de referência impresso (Ag) ... 61
Tabela 14: Capacidade antioxidante de amostras de vinho (tinto e Porto) expressas em equivalentes de concentração do ácido gálico para a técnica de VC e DPV utilizando o elétrodo de GC e SPCE ... 67
Tabela 15: Absorvância no comprimento de onda de 440 nm medida em soluções de diferentes concentrações de RNO em tampão fosfato, pH 7,4 ... 71
Tabela 16: Valor de p e kap do consumo do RNO (0,50 mM em tampão pH 3,2) durante a eletrólise ... 73
Tabela 17: Valores de p, de R e de kap obtidos a partir dos dados de consumo do RNO (0,50 mM em tampão fosfato pH 3,2, deteção a 440 nm) em eletrólises conduzidas a diferentes densidades de corrente (representados na Figura 34) ... 75
Tabela 18: Valores de p, coeficiente de correlação, kap e 1 / Δkap obtidos para o consumo do RNO na ausência e na presença de diferentes concentrações (0,10 mM, 0,25 mM, 0,50 mM) de T em tampão fosfato pH 3,2. Eletrólises efetuadas a corrente constante de 550 mA ... 78
Tabela 19: Valores da equação da função exponencial e do coeficiente de correlação obtidos para o consumo do RNO na presença de VT e VP a diferentes fatores de diluição (1/50 e 1/100 em tampão fosfato pH 3,2 deteção a 440 nm) durante a eletrólise a 550 mA ... 82
Tabela 20: Valores de p, kap e 1 / Δkap obtidos para o consumo do RNO na presença de VT e VP a diferentes fatores de diluição (1:50 e 1:100 em tampão fosfato pH 3,2 deteção a 440 nm) durante a eletrólise a corrente constante de 550 mA ... 83
Tabela 21: Valores da equação da reta e do coeficiente de correlação obtidos para a variação do kap de 0,50 mM de RNO em função do fator de diluição dos vinhos (1:50 e 1:100 em tampão fosfato pH 3,2 deteção a 440 nm) durante a eletrólise a corrente constante de 550 mA ... 84
Tabela 22: Quantificação das amostras de vinho de mesa tinto e vinho do Porto em equivalentes de T de acordo com a equação (24). O valor de referência que caracteriza a CAO do T é de 871,4 ± 354,1. ... 85
Índice de figuras
Figura 1: Esquema de classificação de vinhos4 ... 4
Figura 2: Estrutura química do fenol38 ... 9
Figura 3: Classes de compostos fenólicos presentes no vinho de mesa tinto42 ... 9
Figura 4: Estrutura base dos flavonóides43 ... 10
Figura 5: Estrutura química das flavonas e flavanonas45,46 ... 10
Figura 6: Estrutura química dos flavanóis e flavanonóis42 ... 11
Figura 7: Estrutura química dos flavonóis49 ... 11
Figura 8: Estrutura base das antocianinas51 ... 12
Figura 9: Estrutura química de ácidos benzóicos e ácidos cinâmicos38 ... 13
Figura 10: Estrutura base dos estilbenos58 ... 14
Figura 11: Alguns exemplos de ROS radicalares e não radicalares65 ... 16
Figura 12 - Célula de três elétrodos: elétrodo de trabalho (direita), elétrodo de referência (esquerda) e elétrodo secundário (centro) ... 38
Figura 13 - Representação de um SPCE ... 39
Figura 14 - Interface da DropSens (DRP-DSC) ... 39
Figura 16: Voltamogramas cíclicos obtidos a partir de soluções padrão de ácido gálico contendo 0,033 M de ácido tartárico a pH 3,2. Os voltamogramas foram registados a 100 mV s-1 usando: (A) um GCE e (B) um SPCE ... 48
Figura 17: Voltamogramas obtidos por DPV em soluções padrão de AG contendo 0,033 M de ácido tartárico a pH 3,2. Os voltamogramas foram registados usando: (A) um GCE e (B) um SPCE ... 49
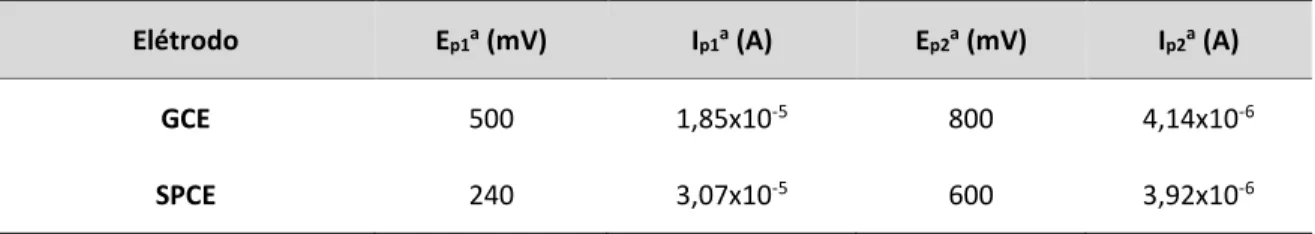
Figura 18: Curvas de calibração relativas à área dos voltamogramas cíclicos de ácido gálico obtidos com GCE e SPCE. A integração foi efetuada no intervalo de potencial de: (A) 900 mV (GCE) e (B) 750 mV (SPCE) ... 51
Figura 19: Comparação entre os resultados obtidos nas soluções padrão de AG, por voltametria cíclica usando o GCE e o SPCE (Figura 18). Os valores representados correspondem às áreas dos voltamogramas normalizadas para a área de cada um dos elétrodos. A reta traduz a equivalência dos métodos (y = x) ... 52
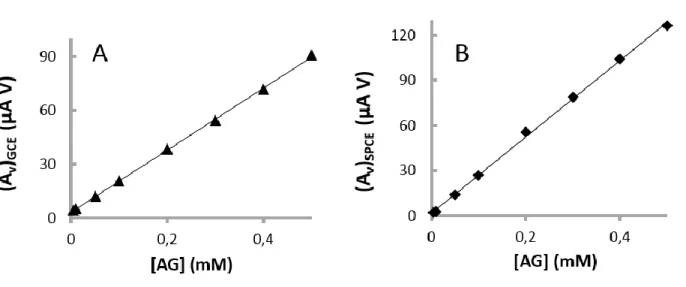
Figura 20: Curvas de calibração relativas à área dos voltamogramas diferencial de impulso de ácido gálico obtidos com GCE (A) e SPCE (B) ... 53
Figura 21: Comparação entre os resultados obtidos nas soluções padrão de AG, por voltametria diferencial de impulso usando o GCE e o SPCE (Figura 20). Os valores representados correspondem às áreas dos voltamogramas normalizadas pela área do respetivo elétrodo. A reta traduz a equivalência dos métodos (y = x) ... 54
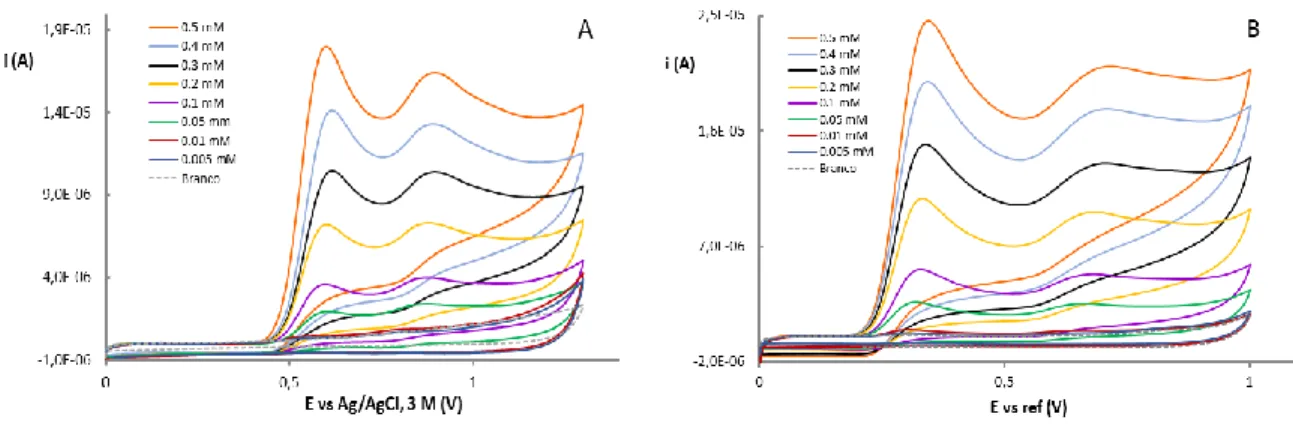
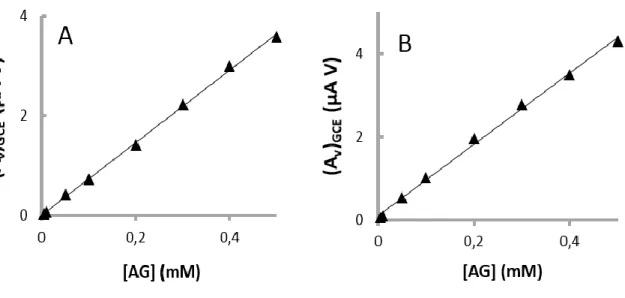
Figura 22: Voltamogramas cíclicos obtidos a partir de diferentes amostras de vinho de mesa tinto diluídas numa solução contendo 0,033 M de ácido tartárico a pH 3,2. Os voltamogramas foram registados a 100 mV s-1 usando: (A) um GCE e (B) um SPCE ... 56
Figura 23: Voltamogramas cíclicos obtidos a partir de diferentes amostras de vinho do Porto diluídas numa solução contendo 0,033 M de ácido tartárico a pH 3,2. Os voltamogramas foram registados a 100 mV s-1 usando: (A) um GCE e (B) um SPCE ... 58
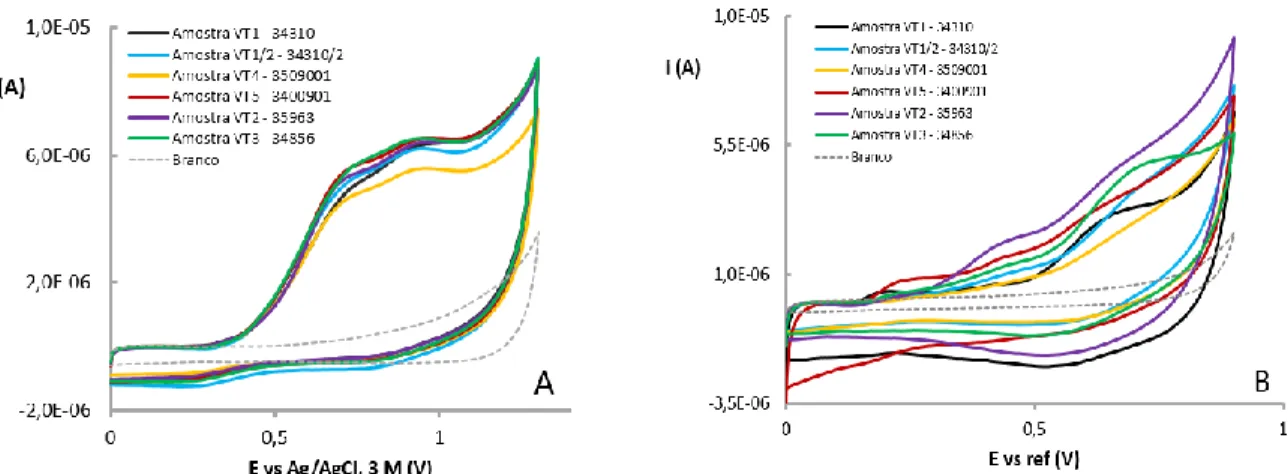
Figura 24: Voltamogramas de diferencial de impulso obtidos a partir de diferentes amostras de vinho de mesa tinto diluídas numa solução contendo 0,033 M de ácido tartárico a pH 3,2. Os voltamogramas foram registados usando: (A) um GCE e (B) um SPCE ... 59
Figura 25: Voltamogramas de diferencial de impulso obtidos a partir de diferentes amostras de vinho do Porto diluídas numa solução contendo 0,033 M de ácido tartárico a pH 3,2. Os voltamogramas foram registados usando: (A) um GCE e (B) um SPCE ... 61
Figura 26: Efeito da amplitude do intervalo de potencial correspondente aos valores das áreas dos voltamogramas cíclicos das amostras dos vinhos normalizados pela área do voltamograma relativo à amostra VT3 - 34856 integrados em diferentes intervalos de potencial: (A) áreas integradas para o intervalo de potencial de 600 mV e 900 mV obtidos com o GCE; (B) áreas integradas para o intervalo de potencial de 550 mV e 750 mV obtidos com o SPCE; (C) áreas integradas para o intervalo de potencial de 900 mV obtidos com GCE e áreas integradas para o intervalo de potencial de 750 mV obtidos com SPCE ... 64
Figura 27: Comparação entre os valores das áreas dos voltamogramas diferencial de impulso das amostras dos vinhos normalizados pela área do voltamograma relativo à amostra VT3 - 34856 integrados em valores de potenciais positivos obtido por dois elétrodos de trabalho diferentes ... 65
Figura 28: Correlação da entre os valores de capacidade antioxidante (expressas em equivalentes de concentração do ácido gálico) de amostras de vinho de mesa tinto e vinho do Porto obtidos através das duas técnicas voltamétricas (VC e DPV) para cada um dos elétrodos (GCE e SPCE) ... 68
Figura 29: Correlação entre os valores de capacidade antioxidante (expressas em equivalentes de concentração do ácido gálico) de amostras de vinho de mesa tinto e vinho do Porto obtidas pelos dois elétrodos, GCE e SPCE, para cada uma das técnicas voltamétricas (VC e DPV) ... 68
Figura 30: Espectros de absorção UV/Vis do RNO, 0,01 mM em tampão de fosfato (pH 7,4) ... 70
Figura 31: Reta de calibração do RNO em função da absorvância vs. concentração ao comprimento de onda de 440 nm... 70
Figura 32: Espetros de UV/Vis da amostra VT3 – 34856 a diferentes diluições juntamento com o RNO (0,004 mM em tampão fosfato pH 3,2) ... 72
Figura 33: Consumo do RNO (0,50 mM em tampão fosfato pH 3,2) por eletrólise galvanostática realizada a 550 mA ... 74
Figura 34: Consumo do RNO (0,50 mM em tampão fosfato pH 3,2) durante as eletrólises galvanostáticas efetuadas a diferentes intensidades de corrente: 22 mA, 117 mA, 275 mA, 440 mA e 550 mA. As medidas de absorvância foram realizadas a 440 nm ... 75
Figura 35: Efeito da densidade de corrente na velocidade aparente do consumo do RNO (0,50 mM em tampão fosfato pH 3,2, deteção a 440 nm) ... 76
Figura 36: Consumo do RNO (0,50 mM em tampão fosfato pH 3,2 deteção a 440 nm) na ausência e na presença de diferentes concentrações (0,10 mM, 0,25 mM, 0,50 mM) de trolox em tampão fosfato pH 3,2. Eletrólises efetuadas a corrente constante de 550 mA ... 78
Figura 38: Espetros de absorvância da sonda de RNO na presença de vinho (VT5 - 3400901, 1:50) a diferentes tempos da eletrólise a 550 mA ... 80
Figura 39: Consumo do RNO (0,50 mM em tampão fosfato pH 3,2) na ausência e na presença de vinho (VT5 - 3400901) a diferentes concentrações (1:50 e 1:100) durante a eletrólise a corrente constante de 550 mA ... 81
Figura 40: Espetros de absorvância da sonda de RNO na presença de vinho (VP3 - 30, 1:50) a diferentes tempos da eletrólise a 550 mA ... 81
Figura 41: Consumo do RNO (0,50 mM em tampão fosfato pH 3,2) na ausência e na presença de vinho (VP3 - 30) a diferentes concentrações (1:50 e 1:100) durante a eletrólise a corrente constante de 550 mA ... 82
Figura 42: Representação do inverso da variação do kap de 0,50 mM de RNO em função do fator de diluição do vinho (1:50 e 1:100 em tampão fosfato pH 3,2) durante a eletrólise a corrente constante de 550 mA: (A) vinhos de mesa tintos e (B) vinhos do Porto ... 84
Figura 43: Comparação entre os valores dos polifenóis, Eq.AG (mM) e Eq.T (mM) obtidos para as amostras de VT ... 86
Lista de abreviaturas e siglas
[AO]0 - Concentração de antioxidante presente na amostra
A - Absorvância
AAPH - 2,2-azobis(2-amidino-propano) dihidrocloreto
ABTS - 2,2-azinobis-(3-etil-benzotiazolin-6-sulfonato)
AG – Ácido gálico
Ag - Prata
AO – Antioxidante
C – Concentração
CAO – Capacidade antioxidante
DNA - Ácido desoxirribonucleico
DPPH - 2,2- difenil-1-picrilhidrazilo
DPV – Voltametria diferencial de impulso
Ep - Potencial do pico
Epa - Potencial do pico anódico
Epc - Potencial do pico catódico
Eq - Equivalentes
ER - Elétrodo de referência
ES - Elétrodo secundário
ET - Transferência eletrónica
FA - Fermentação alcoólica
FML - Fermentação maloláctica
FRAP - Ferric Ion Reducing Antioxidant Parameter
GCE - Elétrodo de carbono vítreo
HAT - Transferência de átomos de hidrogénio
HO – Radical hidroxilo
I – Intensidade de corrente
Ip – Intensidade do pico
Ipa – Intensidade do pico anódico
Ipc – Intensidade do pico catódico
j – Densidade de corrente
kap – Constante de velocidade aparente
ko2 - Constante de velocidade de evolução de oxigénio
kp,si - Constante de velocidade relativa à reação dos produtos formados
ks,e - Constante de velocidade da oxidação da espécie por transferência eletrónica
direta
ks,ho - Constante de velocidade da reação entre s e os radicais hidroxilo
ksc - Constante de velocidade das reações de captura de radicais
Ldd – Limite de deteção
Nsc – Coeficiente estequiométrico das reações de captura de radicais
ORAC – Oxygen Radical Absorbance Capacity
Pt - Platina
R – coeficiente de correlação
Redox – Oxidação-Redução
RNO - N,N-Dimetil-4-nitrosoanilina
ROS - Espécies reativas de oxigénio
ROS - Espécies reativas de oxigénio
S – Espécie química
Sa - Incerteza associada à ordenada na origem
Sb – incerteza associada ao declive
SPCE - Screen-printed carbon electrode
T - Trolox
TEAC - Trolox Equivalent Antioxidant Capacity
TRAP - Total Radical-trapping Antioxidant Parameter
UV-Vis – Ultravioleta-Visível
VC - Voltametria cíclica
VP - Vinho do Porto
Vs. - Versus
VT - Vinho de mesa tinto
Z – Número de eletrões
Δkap – Variação da constante de velocidade aparente λ – Comprimento de onda
1. Objetivo
Este trabalho teve como objetivo principal a demonstração da utilização de métodos eletroquímicos na caraterização de antioxidantes em vinhos. Ainda que os métodos voltamétricos tenham sido alvo de vários estudos e publicações científicas, o seu conhecimento fora da comunidade científica é restrito.
O método baseado na geração eletroquímica de radicais hidroxilo é relativamente recente. A sua validação em vinhos constituiu um dos objetivos deste trabalho. Neste âmbito, foi também introduzida uma modificação ao método original pelo uso de uma sonda ótica que absorve na região do ultravioleta-visível (UV-vis), permitindo o uso de um espectrofotómetro corrente na deteção do consumo da sonda, em vez de um fluorímetro.
2. Introdução
No presente capítulo será feita uma breve descrição acerca do vinho: o que é, como é processado a sua composição química e os desafios que esta bebida apresenta.
Será ainda apresentada uma breve descrição acerca dos antioxidantes: a sua importância para o Homem e para a preservação dos vinhos e ainda os métodos mais comuns usados na sua caracterização.
Vinho
2.1.1 O que é?
O vinho é uma bebida alcoólica resultante da fermentação parcial ou total do sumo proveniente das uvas esmagadas ou maceradas. Sendo que a concentração de açúcares presente no mosto1, sumo das uvas, determina o potencial teor alcoólico do vinho2.
De acordo com o Parlamento Europeu e o Conselho da União Europeia, existem diversas formas de classificar um vinho, quanto à origem, à classe, à cor e quanto ao teor
de açúcar3. Na Figura 1, está representado um esquema de classificação de vinhos mais comum em Portugal4.
Em Portugal, é comum a distinção popular entre vinho verde e vinho maduro. Sendo que o vinho verde é todo o vinho produzido a noroeste de Portugal, na atual região demarcada para a produção de vinhos verdes situada entre o Douro e o Minho5. Contudo,
existem autores que defendem que a designação “vinho verde” reconhece todos os vinhos produzidos a partir de uvas que não atingiam plenamente o seu grau de maturação6.
O vinho do Porto distingue-se dos vinhos comuns pelas suas características particulares, sendo designado como um vinho licoroso ou fortificado. É produzido a partir de uvas tintas provenientes na Região Demarcada do Douro, sob condições específicas. Apesar de ser um vinho produzido na região do Douro e armazenado nas caves de Vila Nova de Gaia, esta bebida alcoólica adotou a designação “Vinho do Porto” a partir da segunda metade do século XVII por ser exportada para todo o mundo a partir desta cidade7.
2.1.2 Processo de produção do vinho
Para a produção do vinho é necessário um conjunto de técnicas, ao qual se dá o nome de vinificação8. Existem vários processos de vinificação, sendo estes diferentes conforme os vinhos que queremos obter como produto final9. Neste trabalho serão apenas focados os relativos à vinificação do vinho de mesa tinto e do vinho do Porto.
Classificação do vinho
Vinho de mesa
tinto Vinho Rosé Vinho Branco Vinho Licoroso
Vinho Espumante
2.1.2.1 Vinificação dos vinhos de mesa tintos
Após a vindima, mecânica ou manual, e após a pesagem e descarregamento das uvas para um tapete, onde é feita a seleção das uvas, segue-se um conjunto de operações conforme o vinho pretendido10. Essas opções são transcritas em seguida11.
Desengace
Consiste na eliminação de engaços verdes. Pode optar-se por não haver desengace uma vez que os engaços secos e lenhificados vão conferir um maior teor de taninos ao vinho, contribuindo assim para uma maior longevidade do mesmo12. No entanto, esta é uma opção bastante usada uma vez que é difícil garantir que os engaços estejam todos suficientemente lenhificados e assim evitamos que se adicionem ao vinho sabores vegetais ou herbáceos que prejudicam a qualidade final do vinho12.
Esmagamento
A grande maioria dos vinhos de mesa tintos é produzida com esmagamento dos bagos logo depois do desengace. É possível fazer o desengace e o esmagamento da uva em simultâneo com uma única máquina que realiza estas duas operações em sequência13.
Adição de produtos enológicos
É possível que sejam adicionados certos produtos para garantir a integridade e qualidade do produto final. Os mais utilizados são: i) o dióxido de enxofre, devido à sua capacidade em dissolver compostos fenólicos presentes, melhorando o aroma e a cor do vinho14, sendo também utilizado como antioxidante evitando o desenvolvimento de microrganismos; ii) o ácido tartárico que corrige a acidez do vinho15; iii) as enzimas pectolíticas que vão diminuir a viscosidade do mosto e vão contribuir para a extração dos compostos ligados à cor, aos aromas e à estrutura do vinho16; iv) nitrogénio para favorecer o crescimento das leveduras, condicionando o seu metabolismo nas direções pretendidas17.
Maceração pré-fermentativa
Este processo é usado para aumentar a extração de pigmentos, taninos e aromas presentes das películas e que estes se dissolvam no mosto18. Os vinhos obtidos apresentam níveis superiores de compostos fenólicos e antocianinas quando comparados com vinhos sem recurso a esta técnica19–21.
Inoculação com leveduras
Através da adição controlada de leveduras é possível limitar a população de leveduras que irão fermentar o mosto, garantindo, não haver desvios fermentativos que comprometam a qualidade do produto final desejado22.
Fermentação alcoólica (FA)
Este processo corresponde ao conjunto de reações químicas realizadas por leveduras (por exemplo: Saccharomyces cerevisiae23,24, Saccharomyces bayanus23,25, Klockera
apiculata26), que transformam a glicose e a frutose em etanol e dióxido de carbono.
Fermentação maloláctica (FML)
Após a vindima ainda existem ácidos presentes nas uvas, como o ácido tartárico, o ácido málico, o ácido cítrico, entre outros. Acontece que o ácido málico torna os vinhos de mesa tintos microbiologicamente muito instáveis e se este ácido não for eliminado antes do engarrafamento, poderá haver a formação de gás dentro da garrafa, o que não é desejável. Assim, a FML é realizada por bactérias lácticas27 e consiste na transformação do ácido málico em ácido láctico com libertação de dióxido de carbono. Com a conversão do ácido málico em ácido lático, o vinho perde alguma acidez, ficando mais equilibrado28,29. Este processo ocorre habitualmente logo após a fermentação alcoólica se a temperatura não baixar excessivamente. Caso a temperatura baixe repentinamente, é possível oxigenar a bebida até então produzida, provocando uma pequena oxidação da mesma e promovendo, assim, a estabilidade da cor, maior intensidade aromática e maior complexidade do vinho30. Nesta fase também se utilizam barricas de madeira em vez de
garrafas para iniciar o processo de envelhecimento do vinho. Durante este processo podem ocorrer modificações físico-químicas e sensoriais na bebida, resultantes da extração e degradação de diversos componentes da madeira31.
2.1.2.2 Vinificação dos vinhos do Porto
O vinho do Porto distingue-se dos vinhos comuns pelas suas características particulares, caracterizando-se pelo seu volume alcoólico elevado e pelo seu teor de açúcar. A sua produção é idêntica à do vinho de mesa tinto, ocorrendo apenas uma fermentação alcoólica parcial, interrompida pela adição de aguardente vínica de alta qualidade a 77%. A concentração em açúcar nos Vinhos do Porto pode variar entre 40 g/L e 130 g/L (extra seco a muito doce). A diferentes concentrações de açúcar correspondem diferentes alturas de interrupção da fermentação alcoólica pela adição de aguardente, ou seja, para obter vinhos mais doces interrompe-se a FA mais cedo e para obter vinhos mais secos interrompe-se a FA mais tarde11.
2.1.3 Composição do vinho
A composição do vinho é bastante complexa e o conhecimento da sua composição permite compreender melhor todos os fenómenos relacionados com a capacidade antioxidante presente nos vinhos.
O vinho é composto essencialmente por água e etanol (Tabela 1), contendo aproximadamente, 5% de outros compostos tais como açúcares, ácidos orgânicos e sais de inorgânicos e orgânicos32. O etanol tem um papel importante na estabilidade, longevidade e qualidade do vinho, variando o seu teor entre 10% e 13%. O glicerol, que é um produto secundário da fermentação alcoólica, proporciona ao vinho suavidade e contribui para a sua qualidade sensorial33. Os principais açúcares presentes na uva são a glicose e a frutose e estes são responsáveis pelo teor de álcool no vinho, no entanto, devido à presença de açúcares não fermentescíveis na uva como a xilose e a arabinose, o vinho mantém sempre uma quantidade residual de açúcar.
Tabela 1: Composição química típica do vinho de mesa tinto32
Compostos Vinho de mesa tinto (%)
Etanol 10 Água 85 Glicerol 1,1 Açúcares 0,05 Ácidos orgânicos 0,6 Outros 3,25
Os ácidos orgânicos presentes no vinho podem ser provenientes da uva, como o ácido tartárico, o ácido málico e o ácido cítrico, ou formarem-se durante fermentação, como o ácido succínico, o ácido lático e o ácido acético. Estes ácidos orgânicos são importantes para a estabilização e conservação das propriedades organoléticas do vinho34,35. A acidez do vinho classifica-se em acidez fixa ou acidez volátil dependendo dos ácidos presentes, sendo a acidez total a soma de ambas. Os ácidos tartárico, málico, succínico, cítrico e láctico contribuem para a acidez fixa do vinho (são ácidos não destiláveis) enquanto que a acidez volátil depende da presença do ácido acético36. De acordo com o Parlamento Europeu e o Conselho da União Europeia, a acidez total é expressa em miliequivalentes por litro (mEq/L) ou em gramas de ácido tartárico por litro (g ácido tartárico/L)37.
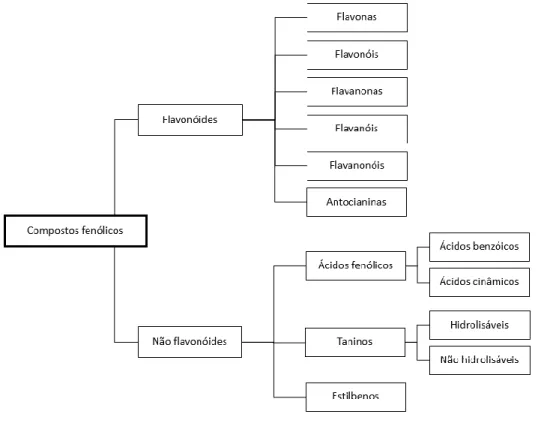
Outros compostos presentes no vinho, em maior abundância no vinho de mesa tinto, são os compostos fenólicos (Figura 2)38. Estes compostos desempenham um papel importante nas características sensoriais do vinho uma vez que são responsáveis por algumas das suas propriedades organoléticas como a cor, o aroma, a acidez e a adstringência39. Os compostos fenólicos tem despertado grande interesse na comunidade científica devido à sua elevada capacidade antioxidante40. De um modo geral, os fenóis são compostos químicos que possuem um anel aromático com um ou mais substituintes hidroxilo. Podem conter outros substituintes na estrutura, estando presentes em ácidos orgânicos ou em açúcares41.
São conhecidos milhares de compostos fenólicos42 nos vinhos. Usualmente estes podem
ser divididos em duas categorias: flavonóides e não flavonóides (Figura 3).
Figura 2: Estrutura química do fenol38
Figura 3: Classes de compostos fenólicos presentes no vinho de mesa tinto42
2.1.3.1 Compostos flavonóides
Os compostos flavonóides caracterizam-se pela presença de 15 átomos de carbono e 1 átomo de oxigénio na sua estrutura base, consistindo em 2 anéis aromáticos ligados por um anel pirano (Figura 4)43.
De acordo com vários autores, os flavonóides demostraram ter atividade antiviral, anticancerígena e antibacteriana44. Os principais compostos desta classe presentes no vinho de mesa tinto são as flavonas, os flavonóis, as flavanonas, os flavanóis, os flavanonóis e as antocianinas.
Flavonas e Flavanonas
As flavonas caracterizam-se por possuírem na sua estrutura uma ligação dupla e um grupo carbonilo, enquanto que as flavanonas não apresentam a ligação dupla no anel de pirano (Figura 5)45,46. Estes compostos são conhecidos por ter uma importante atividade antioxidante, prevenindo a oxidação do vinho47.
Figura 4: Estrutura base dos flavonóides43
Flavanóis e Flavanonóis
Os flavanóis caracterizam-se por apresentarem um grupo hidroxilo ligado ao anel de pirano, sendo os flavanonóis idênticos aos flavanóis à exceção do grupo hidroxilo ligado ao anel de pirano (Figura 6)42. Ambos presentes no vinho, são responsáveis por conservarem as propriedades organoléticas ideais dos vinhos, nomeadamente a estabilidade da cor e do sabor48.
Flavonóis
Os flavonóis são caracterizados pela presença de uma ligação dupla e dois grupos funcionais, o grupo carbonilo e o grupo hidroxilo (Figura 7)49, no anel de pirano. Estes compostos são importantes para a conservação do vinho pois protegem as antocianinas da condensação e da polimerização oxidativa, permitindo a preservação da cor avermelhada dos vinhos de mesa tintos envelhecidos50.
Figura 6: Estrutura química dos flavanóis e flavanonóis42
Antocianinas
As antocianinas são pigmentos naturais e caracteriza-se por deterem como estrutura base um núcleo flavílio geralmente glicosado (Figura 8)51. Estes são responsáveis pela coloração vermelha e azul das cascas das uvas e também do vinho de mesa tinto. As antocianinas reagem com taninos não hidrolisáveis para originar estruturas que possibilitam a estabilidade da cor, tanto nos vinhos de mesa tintos novos como nos envelhecidos52.
2.1.3.2 Compostos não flavonóides
Estes correspondem a compostos fenólicos como os ácidos fenólicos, os taninos e os estilbenos.
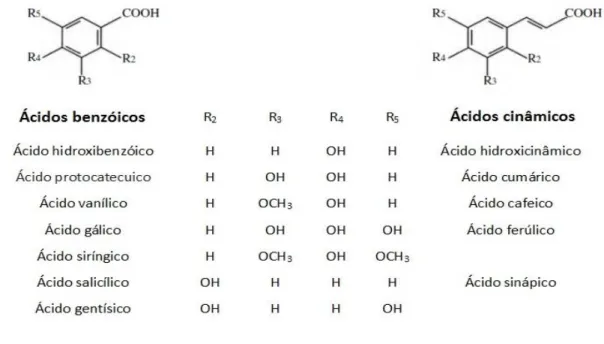
Ácidos fenólicos
Os ácidos fenólicos são geralmente divididos em dois grupos: os ácidos benzóicos e os ácidos cinâmicos. Estes ácidos existem predominantemente como ácidos hidroxibenzóicos e hidroxicinâmicos, que podem ocorrer na sua forma livre ou conjugada53. A sua estrutura química é composta por um anel de benzeno, um grupo carboxílico e um ou mais grupos hidroxilo (Figura 9)38.
Foram identificados vários tipos de ácidos hidroxibenzóicos tanto nas uvas como no vinho mas os mais abundantes são: ácido gálico, o ácido vanílico e ácido siríngico. Os ácidos hidroxicinâmicos estão na origem do escurecimento dos vinhos e os mais abundantes são: ácido cafeico, ácido ferúlico e ácido sinápico54. Segundo os autores Terrier, Poncet-egrand e Cheyner, os ácidos benzóicos encontram-se no vinho em menores proporções relativamente aos ácidos cinâmicos55.
Taninos
Os taninos são compostos fenólicos responsáveis pelas propriedades adstringentes do vinho e dividem-se em duas classes: os taninos hidrolisáveis e os taninos não hidrolisáveis (ou taninos condensados). Os taninos hidrolisáveis são ésteres de glicose e de ácidos fenólicos e os mais abundantes são: taninos gálicos (derivado do ácido gálico) e os taninos elágicos (derivado do ácido elágico). Os taninos condensados são oligómeros e polímeros formados pela condensação de duas ou mais unidades de flavanol e flavandiol56.
A sensação de adstringência é mais marcada pela presença de taninos condensados do que de taninos hidrolisáveis. Segundo Cheynier, o atenuar da adstringência com o envelhecimento do vinho é consequência da polimerização dos taninos condensados57.
Estilbenos
Os estilbenos caracterizam-se pela presença de dois anéis aromáticos ligados por uma ponte de eteno (Figura 10)58. O estilbeno de maior relevância no vinho é o 3,5,4-trihidroxiestilbeno (resveratrol). Este composto é produzido na pele das uvas e é transferido para o vinho no momento da fermentação do mosto. Está presente em maiores concentrações no vinho de mesa tinto em comparação com o vinho branco e mostrou ter um efeito antimicrobiano59.
2.1.4 Desafios que o vinho apresenta
O vinho é produzido desde a pré-história até aos dias de hoje por quase todas as civilizações. Ao longo dos tempos, o processo de vinificação sofreu grandes alterações. Inicialmente a qualidade dos vinhos dependia fortemente das condições climáticas, do ano da colheita e da temperatura ambiente a que ocorria a fermentação. Atualmente, a inoculação de leveduras selecionadas no mosto é uma prática enológica comum, pois fornecem ao vinho características organoléticas que o enriquecem, permitindo obter vinhos com boa qualidade e manter a sua homogeneidade, independentemente do ano de colheita60.
A caraterização química do vinho, que contém várias centenas de compostos, levou ao desenvolvimento de metodologias que permitissem detetar e quantificar esses compostos presentes numa matriz de grande complexidade61. Apesar de inicialmente terem sido identificados impactos negativos ao consumo do vinho, pois decorriam da sua ingestão em excesso, atualmente vários estudos associaram efeitos benéficos ao seu consumo moderado. Alguns autores sugerem que o consumo moderado de vinho previne doenças cardiovasculares, diabetes tipo II, demência e declínio cognitivo62,63. Alguns estudos demonstraram existir uma correlação significativa entre a atividade antioxidante de vários vinhos e o seu teor em compostos fenólicos. O vinho de mesa tinto é considerado como tendo mais efeitos benéficos para a saúde quando comparado com os vinhos branco e rosé devido há presença de um maior teor em antioxidantes64.
Antioxidantes
2.2.1 Mecanismos de ação na prevenção da oxidação
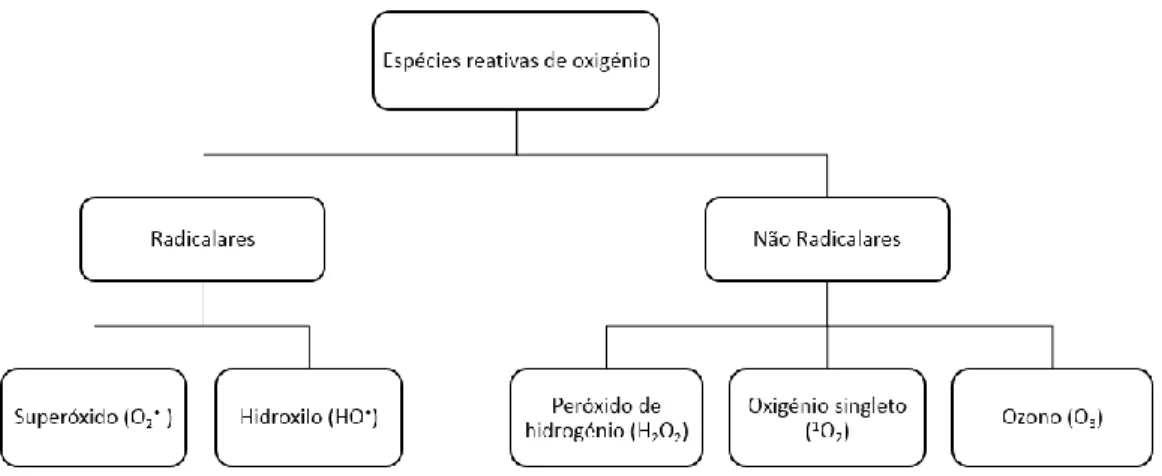
A oxidação, quer nos organismos vivos quer no mundo natural, está associada à presença de espécies oxidantes. Estas espécies podem ser o oxigénio, ou espécies que se formam a partir do oxigénio e que são vulgarmente denominadas por espécies reativas de oxigénio (ROS).
Tal como está ilustrado na Figura 11, as ROS podem, de acordo com a sua natureza classificar-se em dois grupos, as radicalares e as não-radicalares65.
As mais reativas são os radicais livres, que apresentam na sua estrutura eletrões na camada de valência desemparelhados. Estes radicais reagem com outras moléculas, oxidando-as e provocando reações em cadeia66. Os radicais livres, como o radical superóxido, O2•⁻, e o radical hidroxilo, HO•, estão associados ao stress oxidativo.
Os radicais livres podem ser produzidos pelos próprios organismos como produto de uma determinada reação metabólica (endógenas) ou ser provenientes do meio externo ao sistema (exógenas)67. O stress oxidativo tem lugar quando a produção de radicais livres
ocorre a uma velocidade superior à capacidade do organismo para as eliminar e reparar os danos produzidos. A acumulação destes danos está na origem de diversas doenças degenerativas.
Os compostos que têm a capacidade para prevenir ou retardar a oxidação de outras substâncias são denominados de antioxidantes (AO). Os AO podem ser classificados em dois grupos, as enzimas antioxidantes, como a catálase e a peroxidase e os antioxidantes de baixo peso molecular. Estes últimos podem ser endógenos, como o α-tocoferol (Vitamina E) o ácido ascórbico (Vitamina C), substâncias naturais, como os carotenóides, ou moléculas sintéticas como o trolox (6-hidroxi-2,5,7,8-tetrametilcroman-2-carboxílico)68. Um antioxidante pode ter ação scavenger quando elimina os radicais, convertendo-os em espécies menos reativas, ou redutora, reduzindo estas espécies por transferência eletrónica69. Esta reação pode traduzir-se por um processo de oxidação-redução (redox) do tipo do representado na equação (1)68.
𝐴𝑂
𝑟𝑒𝑑+ 𝑅𝑂𝑆 → 𝐴𝑂
𝑜𝑥𝑖+ 𝐻
2𝑂
(1)
Importância para o Homem
Com o avançar da idade, a produção de radicais livres excede a sua degradação e sobreleva os mecanismos de defesa natural e de reparo celular no nosso organismo70.
O radical hidroxilo é a espécie mais reativa de todas as espécies reativas de oxigénio, sendo capazes de reagir com a maioria dos constituintes celulares incluindo lípidos, proteínas e DNA. O radical menos reativo é o O2•⁻. Estudos revelam que o radical hidroxilo está envolvido no desenvolvimento de doenças cardiovasculares71, doença de Parkinson e Alzheimer65, cancro72 e envelhecimento73. Os antioxidantes possuem a capacidade de converter ou neutralizar as espécies reativas de oxigénio, evitando assim a formação de lesões nas células. Os antioxidantes também têm a capacidade de reparar as lesões causadas pelos radicais, removendo os danos e reconstituindo as células danificadas70,74.
Através de vários estudos, concluiu-se que a inclusão dos antioxidantes numa dieta equilibrada e a prática regular de atividade física são de grande importância para a diminuição do risco do desenvolvimento de doenças associadas à acumulação de radicais livres, além de influenciarem positivamente na qualidade de vida do ser humano75,76.
Importância para a preservação dos vinhos
O vinho possuí uma grande variedade de produtos fitoquímicos que incluem as vitaminas e os antioxidantes. Os antioxidantes presentes no vinho são denominados de polifenóis. Do ponto de vista tecnológico, os antioxidantes estão associados à oxidação do vinho. Dada a sua suscetibilidade em reagir com os ROS, estes previnem a oxidação de outros constituintes, prolongado o tempo de vida de prateleira de um vinho77. Por outro lado, os processos relativos ao envelhecimento dos vinhos estão intimamente ligados à presença de antioxidantes. Durante a maturação e o envelhecimento dos vinhos de mesa tintos, os compostos fenólicos sofrem reações redox, de polimerização e de complexação com compostos como as proteínas, polissacarídeos ou metais. Entre os compostos mais reativos destacam-se as antocianinas e os flavanóis78,79. Consequentemente as antocianinas
e os taninos condensados vão sendo gradualmente transformadas em oligómeros e polímeros mais estáveis e com características físicas e químicas diferentes dos seus precursores, contribuindo para uma mudança nas propriedades organoléticas do vinho, tais como a cor e o sabor78,80. Em 2004, Sanza e colaboradoresestudaram a evolução de compostos
fenólicos de baixo peso molecular em vinhos, em função das diferentes espécies de madeira, dos diferentes tempos de envelhecimento e verificaram que o tempo de envelhecimento foi o principal fator para as mudanças de concentração dos compostos. Constataram um aumento nos níveis de ácido gálico e ácido ferúlico81. Claro está que a concentração dos compostos
fenólicos no vinho depende da variedade da casta, do clima, do solo e das técnicas de produção e envelhecimento do vinho82. No entanto, devido à presença destes compostos antioxidantes, é possível preservar as características organoléticas do vinho e até melhorá-las. Alguns produtores de vinho adicionam aditivos com a finalidade de melhorar as características do produto final, como por exemplo a adição de dióxido de enxofre. O dióxido de enxofre, para além de ser um antioxidante, conserva o vinho e evita o desenvolvimento de microrganismos. Este composto dá origem aos sulfitos83.
Na União Europeia, os sulfitos são representados pelo código E220-E228, excluindo o E225, e considerados, a partir de 2005, como alergénicos se a sua quantidade exceder 10 miligramas por litro. Uma vez ultrapassado este valor, é obrigatória a sua indicação no rótulo, na respetiva lista, pelo nome da categoria: conservante e o nome ou número do aditivo84.
2.2.2 Métodos de caracterização da capacidade antioxidante
Os atuais métodos para a avaliação da capacidade/atividade antioxidante são classificados de acordo com o tipo de reação em que o ensaio se baseia. Usualmente os métodos dividem-se em métodos HAT, quando o método envolve reações de transferência de um átomo de hidrogénio e em métodos ET, quando se baseiam em reações de transferência de eletrões. Ainda que possam ocorrer em simultâneo reações do tipo HAT e ET o mecanismo dominante é determinado pela estrutura e propriedades quer do AO quer
reações envolvendo reagentes ou radicais que são adicionados ou gerados in situ, utilizando reagentes específicos86,87.
Dadas as diferenças entre os dois grupos de métodos, ensaios HAT e ensaios ET, a informação obtida através destes não é muitas vezes comparável. Enquanto os ensaios baseados em HAT permitem estimar a capacidade do AO em inibir reações em cadeia iniciadas por ROS radicalares, os ensaios ET avaliam o carácter redutor dos AO.
2.2.2.1 Ensaios envolvendo transferência de átomos de hidrogénio (HAT)
A caracterização de antioxidantes baseados em ensaios HAT baseia-se na caracterização cinética da reação entre o AO e uma ROS específica, envolvendo uma reação de competição entre o AO e uma sonda por espécies reativas de oxigénio. Na equação (2) está representada a reação base em ensaios HAT85.
𝑅𝑂𝑆
●+ 𝐴𝑂𝐻 → 𝑅𝑂𝑆𝐻 + 𝐴𝑂
● (2)Na maioria destes ensaios o antioxidante e o substrato competem por radicais peroxilo (ROS●). Estes radicais podem ser produzidos através da decomposição térmica de compostos azo88. A reatividade relativa nos ensaios HAT é determinada pela energia da ligação do átomo de hidrogénio no grupo dador do antioxidante89. Existem vários ensaios baseados em reações HAT, sendo os mais utilizados os ensaios de Oxygen Radical
Absorbance Capacity (ORAC) e Total Radical-trapping Antioxidant Parameter (TRAP)90.
Ensaio ORAC
Este ensaio foi desenvolvido por Cutler e Cao em 199391 e testa a capacidade do antioxidante em quebrar uma reação em cadeia, típica dos radicais. Assim, a reatividade do antioxidante é avaliada face ao radical peroxilo, que é gerado a partir da decomposição
térmica de compostos azo, como o AAPH (2,2-azobis(2-amidino-propano)dihidrocloreto). O radical peroxilo reage com uma sonda fluorescente e forma um produto não fluorescente, podendo o consumo da sonda fluorescente ser facilmente quantificado por fluorescência. Num ensaio posterior, a adição do antioxidante inibe o consumo da sonda, sendo a quantificação efetuada com base nas diferenças das áreas sob as curvas de decaimento da fluorescência, na ausência e presença do antioxidante92–94.
Este método tem sido bastante utilizado na caracterização da capacidade antioxidante de alimentos, frutas, extratos vegetais95 e nos vinhos96–99.
Ensaio TRAP
O ensaio TRAP foi desenvolvido por Wayner e colaboradores em 1985100 sendo este ensaio bastante similar ao ensaio de ORAC, tendo como principal objetivo a determinação da atividade antioxidante no plasma sanguíneo. Tal como no ensaio de ORAC são utilizados radicais peroxilo gerados a partir do composto azo AAPH. Após a adição de AAPH ao plasma sanguíneo, a oxidação é monitorizada a partir, por exemplo, do controlo do oxigénio consumido durante a reação, com um elétrodo de oxigénio. O período em que a oxidação é inibida pelos antioxidantes do plasma é comparado ao valor obtido com um antioxidante de referência (normalmente o Trolox), sendo então quantitativamente relacionado com a capacidade antioxidante do plasma87.
Este método utiliza a técnica de “lag fase”, ou seja, avalia somente o período de inibição da atividade do radical pelo oxidante. Este ensaio não pode ser considerado um método de determinação total dos radicais gerados, tal como acontece no ensaio de ORAC, que combina tanto o tempo de inibição como a percentagem de inibição da ação do radical pelo antioxidante101.
2.2.2.2 Ensaios envolvendo transferência eletrónica (ET)
Nos ensaios ET, a atividade AO é caracterizada pela capacidade que um antioxidante possui para reduzir um composto oxidante num tempo predeterminado. Comparativamente aos ensaios HAT, os ensaios ET são mais lentos, requerendo algum tempo até estarem completos e por isso, a determinação da atividade AO é baseada na percentagem de decaimento do produto em vez da análise cinética88. Os ensaios envolvendo ET detetam a capacidade de um antioxidante em transferir um eletrão para reduzir um determinado composto, incluindo metais, carbonilos e radicais. Na equação (3) está representada a reação base em ensaios ET69,90.
𝑂𝑥𝑖𝑑𝑎𝑛𝑡𝑒 + 𝑒
−(𝑑𝑜 𝐴𝑂) → 𝑂𝑥𝑖𝑑𝑎𝑛𝑡𝑒
𝑟𝑒𝑑+ 𝐴𝑂
𝑜𝑥𝑖(3)
Atualmente existem diferentes ensaios baseados em mecanismos ET sendo os mais comuns os ensaios de Trolox Equivalent Antioxidant Capacity (TEAC), Ferric Ion Reducing
Antioxidant Parameter (FRAP) e os ensaios de scavenging do radical DPPH.
Ensaio TEAC
Este método foi desenvolvido por Rice-Evans e Miller em 1993102 e consiste na monitorização do radical ABTS+● produzido pela oxidação do ABTS (2,2-azinobis-(3-etil-benzotiazolin-6-sulfonato)), na sequência da adição de uma amostra contendo um AO. A medição é realizada considerando o grau de descoloração da solução, associada à extensão da reação com o radical ABTS+●.
Em termos de quantificação, o valor da absorvância (proporcional à concentração de ABTS+● que ficou por reagir) é medido após um tempo de reação fixo. Os resultados são expostos em equivalentes de trolox103. Este método é bastante simples e por isso muito utilizado para medir a capacidade antioxidante de várias amostras, inclusive nos vinhos,
onde vários autores utilizaram este método para avaliar a capacidade antioxidante de vinhos bancos e vinhos de mesa tintos 97,104–106.
Ensaio FRAP
Este ensaio baseia-se na capacidade dos antioxidantes de reduzir o complexo de tripiridilis-triazina férrico ([Fe(III)-(TPTZ)2]3+), formando-se um complexo azul intenso [Fe(II)-(TPTZ)2]2+ em meio acido.
Como potenciais problemas identificados relativamente a este método é a sua incapacidade em detetar AO que atuam por transferência de átomos de hidrogénio. Simultaneamente, podem se constituir potenciais interferentes compostos que não possuindo capacidade antioxidante, apresentam um potencial de redução mais baixo que o par redox Fe(III)/Fe(II). Outro facto a considerar, é que o Fe(II) pode contribuir para a formação de radicais hidroxilo e o valor da capacidade antioxidante pode ser sobrestimado. Compostos que absorvam no mesmo comprimento de onda que o complexo podem também contribuir para uma sobrestimava da capacidade antioxidante90,107.
Ensaio de scavenging do radical DPPH
O ensaio de scavenging do radical DPPH (2,2- difenil-1-picrilhidrazilo) aplica-se para
testar a capacidade dos compostos atuarem como scavengers de radicais livres ou como dadores de átomos de hidrogénio. Este ensaio baseia-se na captura do radical DPPH pelo composto antioxidante, sendo o radical DPPH reduzido, formando-se a difenil-picril-hidrazina (equação (4))108,109.
𝐷𝑃𝑃𝐻
●+ 𝐴𝑂𝐻 → 𝐷𝑃𝑃𝐻 + 𝐴𝑂
●+ 𝐻
+(4)
O radical DPPH é estável e apresenta coloração arroxeada, contudo, na forma reduzida apresenta uma coloração amarelada. A quantidade de DPPH consumido pelo antioxidante
no ensaio relaciona-se com a capacidade antioxidante da amostra. O resultado do ensaio é expresso pelo parâmetro EC50, ou seja, a concentração de antioxidante que promove um decréscimo de 50% da concentração do radical DPPH iniciale quanto menor o valor de EC50, maior a capacidade antioxidante da amostra110.
Uma das grandes limitações do método baseado no uso de DPPH é a inexistência deste ou de radicais similares nos sistemas biológicos, sendo que as análises espectroscópicas podem ser afetadas pela presença de outros compostos com cor, como os carotenoides, uma vez que absorvem a comprimentos de onda semelhantes aos do radical DPPH111.
Nos últimos anos este método tem sido utilizado para quantificar antioxidantes em sistemas biológicos complexos e em alimentos e bebidas, inclusive vinhos112.
2.2.2.3 Métodos eletroquímicos
Como alternativa aos métodos clássicos anteriormente referidos, têm surgido trabalhos que recorrem a métodos eletroquímicos.
Os métodos eletroquímicos são utilizados não só para a deteção direta dos AO, através de processos de transferência eletrónica direta, como em processos indiretos. Os processos indiretos podem incluir os sistemas de deteção de sensores, ou mesmo a geração de espécies reativas in situ que são usadas para reagir com os AO.
2.2.2.3.1 Ensaios diretos
Estes ensaios fazem uso das características de eletroatividade dos AO, que sendo importantes agentes redutores são facilmente oxidados, em elétrodos inertes. A reação apresentada na equação (5) traduz a oxidação de compostos antioxidantes em elétrodos inertes85.
A utilização de métodos eletroquímicos permite obter parâmetros físico-químicos como o número de eletrões envolvidos na reação de redox, a constante de velocidade e o potencial formal do elétrodo. Estes parâmetros permitem avaliar a ação redutora dos antioxidantes e identificar o mecanismo da reação envolvida113.
Métodos voltamétricos
Uma das técnicas mais utilizadas para avaliar a capacidade antioxidante é a voltametria cíclica (VC). Chevion e colaboradores114 foram pioneiros das abordagens voltamétricas e utilizaram a voltametria cíclica como forma de avaliar o poder antioxidante de alimentos e amostras biológicas. Estes autores relacionaram o potencial de pico de oxidação (Epa) com a atividade antioxidante. Assim, os baixos valores de potencial do pico de oxidação obtidos nos voltamogramas registados para as amostras biológicas eram uma medida da sua elevada atividade antioxidante. Outros parâmetros utilizados na caraterização de AO por VC são a intensidade da corrente de pico anódica (Ipa) e a área sob o varrimento anódico, que são proporcionais à concentração de espécies redutoras presentes na amostra114. A partir da quantificação destes parâmetros é normalmente caracterizada a capacidade antioxidante.
Firuzi e colaboradores115aplicaram a VC ao estudo da oxidação de vários flavonóides em diferentes soluções tampão e diferentes valores de pH. Estes autores constataram que existia uma boa correlação entre os potenciais de pico de oxidação e as propriedades antioxidantes obtidas no ensaio de FRAP. Compostos com menor valor de Epa apresentam maior capacidade antioxidante pelo ensaio de FRAP115.
Kilmartin e colaboradores, aplicaram a VC para a caracterização dos vinhos e dos AO presentes no vinho numa solução a pH 3,3 e obtiveram uma boa correlação entre as medidas voltamétricas, sendo possível caracterizar e estimar o total de antioxidantes presentes nos vinhos116,117.
Apesar da VC apresentar baixo custo e rapidez, não permitem uma análise quantitativa precisa da capacidade antioxidante uma vez que não traduzem o consumo da espécie
reativa (ou oxidante) pelo AO. Assim, a VC tem sido principalmente utilizada em estudos preliminares e comparativos, através da análise do potencial de pico de oxidação118.
Para além da voltametria cíclica114, a voltametria diferencial de impulso119 e a amperometria120–122 têm vindo a ser usadas na caraterização da capacidade antioxidante em diferentes amostras, inclusive amostras de vinho. Com estas técnicas é possível simular o pH das matrizes biológicas ou outras amostras (como o vinho)123 em que a avaliação da capacidade antioxidante seja de levado interesse.
2.2.2.3.2 Ensaios indiretos
Nos ensaios indiretos os AO são caraterizados a partir de reações com espécies formadas electroquimicamente, ou envolvendo a deteção eletroquímica de espécies consumidas ou formadas na reação com os AO. As titulações coulométricas124 são um exemplo deste tipo de métodos.
Korotkora125 e colaboradores desenvolveram ensaios eletroquímicos para a avaliação
da capacidade antioxidante, baseados em informações sobre a redução eletroquímica do oxigénio. Para tal, foi aplicada a técnica da voltametria diferencial de impulso (DPV) a diversas amostras sintéticas, chá verde, vinagre e produtos farmacêuticos para a determinação da capacidade antioxidante registando a corrente de redução do oxigénio num elétrodo de filme de mercúrio125.
A geração de radicais constitui uma tarefa importante que por vezes requer o uso de métodos caros, e por isso pouco acessíveis à maioria dos laboratórios, como é o caso da radiólise e fotólise. Os métodos eletroquímicos constituem uma forma alternativa de produzir radicais, de uma forma mais acessível e simples.
Radical superóxido
A determinação da atividade antioxidante foi efetuada pelo registro da corrente de redução eletroquímica do oxigénio. Este método tem como base a formação do radical superóxido e o efeito do antioxidante na sua concentração e foi desenvolvido por Korotkora e colaboradores125. A reação entre o antioxidante e o radical superóxido resulta no decréscimo da concentração do radical junto à superfície do elétrodo. A corrente resultante da redução do oxigénio diminui e esta diminuição pode ser utilizada como forma de avaliar a atividade antioxidante70,126. Nas equações (6), (7), (8), (9) e (10) estão representadas as reações químicas de redução eletroquímica do oxigénio70.
𝑂
2+ 𝑒
−⇌ 𝑂
2●− (6)𝑂
2●−+ 𝐻
+⇌ 𝐻𝑂
2 (7)𝐻𝑂
2+ 𝐻
++ 𝑒
−⇌ 𝐻
2𝑂
2 (8)𝐻
2𝑂
2+ 2𝐻
++ 2𝑒
−⇌ 2𝐻
2𝑂
(9)𝑂
2+ 2𝐻
++ 2𝑒
−⇌ 𝐻
2𝑂
2 (10)O radical superóxido, ao contrário da maioria dos radicais livres, é inativo. Em meio aquoso, a sua reação principal é a dismutação na qual se traduz uma molécula de peróxido de hidrogénio e uma molécula de oxigénio.
Radical hidroxilo
A forma mais comum usada na geração de radicais hidroxilo é a partir da decomposição do peróxido de hidrogénio envolvendo iões metálicos, como o Fe2+ (equação 12). O método, baseado na reação de Fenton, é descrito pelas seguintes reações:
O
2+ 2H
++ 2e
−→ H
2𝑂
2 (11)𝐹𝑒
2++ H
2
𝑂
2→ 𝐹𝑒
3++ 𝐻𝑂
−+ 𝐻𝑂
● (12)A possibilidade de gerar os radicais hidroxilo sem recorrer ao uso de percursores químicos é sem dúvida vantajosa pois diminuí a ocorrência de reações paralelas entre os AO e os percursores dos radicais como o peróxido de hidrogénio ou os iões ferro.
No nosso grupo foi desenvolvido um método para a caraterização de AO baseado na geração eletroquímica de radicais hidroxilo através da electro-oxidação da água127–129. Este método permite gerar diretamente, e de forma controlada, radicais hidroxilo recorrendo a eletrólises galvanostáticas, tendo-se identificado a formação de produtos hidroxilados em diferentes posições do anel quando estas eletrólises eram realizadas na presença de compostos aromáticos127. A geração de radicais HO ocorre como um intermediário da reação de evolução de oxigénio tal como se descreve nas equações (13), (14):
𝐻
2𝑂 → 𝐻𝑂
●+ 𝐻
++ 𝑒
− (13)2 𝐻𝑂
●→ 𝑂
2+ 2𝐻
++ 2𝑒
− (14)Os radicais HO ficam adsorvidos na superfície do ânodo e reagem com substâncias orgânicas que são consumidas a uma velocidade que é determinada por um conjunto de variáveis, nomeadamente das condições em que são realizadas as eletrólises e da própria reatividade dessas mesmas substâncias127.
A utilização deste método para a caraterização de antioxidantes pressupõe a utilização de uma espécie que é utilizada como sonda, cuja velocidade de consumo é monitorizada na ausência e na presença de antioxidantes.
Considerando um caso genérico de uma sonda (S) que é eletroativa, o seu consumo poderá ser descrito pelas seguintes equações:
𝑆 → 𝑃
𝑆,𝑖+ 𝑒
− (16)A constante de velocidade que correspondente ao seu consumo na ausência de AO é traduzida pela seguinte equação128,130:
𝑘
𝑎𝑝0=
𝑗𝑧𝐹
𝑘𝑆,𝐻𝑂
2𝑘𝑂2+𝐶𝑆
+ 𝑘
𝑆,𝑒 (17)Onde j é a densidade de corrente (A m-2); F é a constante de Faraday, z corresponde ao número de eletrões utilizados na produção do radical HO a partir da água; 𝑘𝑆,𝐻𝑂 é a constante de velocidade da reação entre S e os radicais HO; 𝑘𝑂2 é a constante de velocidade
de evolução de oxigénio e
𝑘
𝑆,𝑒 é a constante de velocidade da oxidação da espécie por transferência eletrónica direta e CS é definido como:𝐶𝑆 = 𝑛
𝑆𝑘
𝑆,𝐻𝑂[𝑆] + ∑ 𝑛
𝑃𝑆,𝑖𝑘
𝑃𝑆,𝑖 𝐻𝑂[𝑃
𝑆,𝑖]
(18)Onde 𝑘𝑃𝑆,𝑖 𝐻𝑂 é a constante de velocidade relativa à reação dos produtos formados a
partir da oxidação de S e 𝑃𝑆,𝑖, com os radicais HO; 𝑛𝑆 e 𝑛𝑃𝑆,𝑖 são os coeficientes
estequiométricos das reações de S e de 𝑃𝑆,𝑖 com os radicais HO.
A concentração de radicais hidroxilo à superfície do ânodo na presença de AO é menor, dependendo da eficiência com que esse AO reage com os radicais. A concentração de radicais será tanto menos quanto maior for a velocidade com que os AO os eliminem, o que depende da sua concentração, da constante de velocidade da sua reação e da estequiometria da reação. A equação (19) traduz esta dependência128,130:
𝑘
𝑎𝑝𝐴𝑂=
𝑗𝑧𝐹
𝑘𝑆,𝐻𝑂