UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR
MARCELA CRISTINA RABELO
TERMOESTABILIDADE DE ENZIMAS DOS SUCOS DE GRAVIOLA E CAJU
TERMOESTABILIDADE DE ENZIMAS DOS SUCOS DE GRAVIOLA E CAJU
Dissertação submetida à Coordenação do Curso de Pós-Graduação em Bioquímica do Departamento de Bioquímica e Biologia Molecular da Universidade Federal do Ceará como requisito para a obtenção do título de Mestre em Bioquímica. Área de Concentração: Bioquímica Vegetal.
Orientadora: Profa. Dra. Maria Raquel Alcântara de Miranda.
TERMOESTABILIDADE DE ENZIMAS DOS SUCOS DE GRAVIOLA E CAJU
Dissertação submetida à Coordenação do Curso de Pós-Graduação em Bioquímica da Universidade Federal do Ceará como requisito parcial para a obtenção do título de Mestre em Bioquímica com área de concentração em Bioquímica Vegetal.
Aprovada em _____/_____/_____
BANCA EXAMINADORA
Profa. Dra. Maria Raquel Alcântara de Miranda (Orientadora) Universidade Federal do Ceará
Pesquisador Dr. Carlos Farley Herbster Moura Embrapa Agroindústria Tropical
Pesquisador Dr. Edy Sousa de Brito Embrapa Agroindústria Tropical
À Deus pela saúde e paz.
À professora Dra. Maria Raquel Alcântara de Miranda pela orientação, compreensão e confiança, fatores fundamentais para o desenvolvimento de trabalho.
Ao pesquisador Dr. Edy Sousa de Brito e seu orientando Jeferson pelo apoio na elaboração e realização do delineamento experimental e fornecimento de suco.
Ao pesquisador Dr. Carlos Farley Herbster Moura pelo fornecimento de frutos necessários para o desenvolvimento desse estudo.
Ao professor Dr. Enéas Gomes Filho pelo auxílio quanto ao cálculo e análise de dados cinéticos.
À Thaís Andrade pela ajuda na bancada e aos demais colegas do Laboratório de Bioquímica e Fisiologia de Frutos da UFC, Aurelice Barbosa, Luciana de Siqueira, Marília Freiras, Roberta Lopes, Frederico, Mônica Lopes, Jessika Golçalves, Kellina Oliveira, Sérgio Dantas e Ana Lívia Brasil pelo auxílio e agradável convivência durante o desenvolvimento deste trabalho.
Ao programa de pós-graduação em Bioquímica do departamento de Bioquímica e Biologia Molecular da Universidade Federal do Ceará pelo auxílio em minha formação.
À EMBRAPA Agroindústria Tropical.
75 °C por 30 min foi considerado o melhor, enquanto que para o suco de graviola, o tratamento a 55 °C por 30 min mostrou-se já eficiente em reduzir a atividade residual de enzimas que levariam a uma depreciação do suco sem comprometer a atividade de enzimas desejáveis.
characteristics as similar as possible to in natura produce, besides ensuring the microbiological safety. However, processing and storage of fruit juice triggers a range of complex biochemical reactions that may lead to losses of desirable or development of unpleasant flavors. Enzymes such as peroxidases and pectinases may compromise the quality and shelf-life of juices and therefore should be inactivated. This work´s objective was to evaluate the thermostability of enzymes from cashew apple and soursop juices. Juices were prepared as ripe soursop pulp was homogenized with a domestic blender and diluted in water distilled (1:1) meanwhile, ripe cashew apples were expeller-pressed. The juices were submitted to different thermal treatments (55, 65, 75, 85 and 95 °C) for different periods of times (1, 3, 5, 10, 15, 20 and 30 min) and then, evaluated for activity of enzymes: superoxide dismutase (SOD), catalase (CAT), ascorbate (APX) and guaiacol (G-POD) peroxidases, pectinamethylesterase (PME) and polygalacturonase (PG). For the cashew juice, SOD activity was highly resistant to thermal treatments as the exposure to 95 °C initially decreased its activity followed by a recovery and maintenance of 74% of residual activity, after 30 min. APX residual activity initially declined under all temperatures tested, but then increased, especially at 55 °C. PME from cashew juice was thermoresistant as the 55 °C treatment increased its activity 10-fold and the greater temperatures did not differ from control. PG and PME presented similar thermostability patterns as the lower tested temperatures stimulated their activities and the higher temperatures did not alter them. For the soursop juice, the 85 and 95 °C treatments totally inactivated SOD, after 3 min. The G-POD was inactivated after 1 min, at 65 °C. The PME was thermolabile and treatment at 95 °C caused the greatest reduction in activity, 39%, after 30 min. Treatments at 95 and 85 °C led to the greatest inactivation of PG to 26 and 18%, respectively, after 30min. The enzymes from cashew apple juice were more resistant to heating than those from soursop juice, indicating that characteristics particular to each fruit species and the different preparation methods influenced their thermostability. As a conclusion, the treatment at 75 °C for 30 min was considered optimum for cashew juice enzyme inactivation, whereas 55 °C for 30 min was efficient for the soursop juice in reducing significant amounts of the residual activity of enzymes that would lead to quality loss without compromising the activity of desirable enzymes.
1. Atividade residual da SOD nos sucos de caju (A) e graviola (B) em relação ao tempo sob diferentes temperaturas.. . . 25 2. Atividade residual da APX no suco de caju (A) e G-POD no suco de graviola (B) em
relação ao tempo sob diferentes temperaturas. . . 28 3. Atividade residual da CAT em suco de caju sob diferentes temperaturas, em relação ao tempo. . . 33 4. Atividade residual da PME nos sucos de caju (A) e graviola (B) em relação ao tempo
sob diferentes temperaturas. . . .35 5. Atividade residual da PG nos sucos de caju (A) e graviola (B) em relação ao tempo
1. Atividade específica de enzimas do suco de caju e graviola não tratados termicamente. . . . .23 2. Parâmetros cinéticos estimados para a inativação térmica da SOD em suco de caju e
graviola. . . 26 3. Parâmetros cinéticos estimados para a inativação térmica da APX do suco de caju e
da G-POD do suco de graviola. . . .31 4. Parâmetros cinéticos estimados para a inativação térmica da CAT em suco de caju.. 33 5. Parâmetros cinéticos estimados para a inativação térmica da PME de sucos de caju e
graviola. . . 38 6. Parâmetros cinéticos estimados para a inativação térmica da PG em sucos de caju e
2. REVISÃO BIBLIOGRÁFICA. . . 3
2.1 Importância nutricional e econômica do suco de frutas. . . 3
2.2 Processamento de sucos. . . 3
2.3 Enzimas antioxidantes e responsáveis pelo escurecimento. . . .5
2.3.1 Dismutase do superóxido. . . 5
2.3.2 Peroxidases . . . .6
2.3.3 Polifenoloxidase . . . 7
2.3.4 Catalase . . . .8
2.4 Enzimas hidrolíticas de componentes da parede celular vegetal. . . 9
2.4.1 Pectinametilesterase. . . 10
2.4.2 Poligalacturonase. . . 11
2.5 Cajueiro (Anacardium occidentale L.) . . . .12
2.6 Gravioleira (Annona muricata L.) . . . .13
3. OBJETIVOS. . . .15
4. METODOLOGIA. . . 16
4.1 Preparo do suco. . . 16
4.2 Tratamento térmico. . . 16
4.3 Análise de proteínas totais. . . 16
4.4 Análise de enzimas antioxidantes e responsáveis pleo escurecimento. . . 17
4.4.1 Obtenção do extrato. . . 17
4.4.2 Atividade da dismutase do superóxido. . . 17
4.4.3 Atividade da peroxidase do ascorbato. . . 18
4.4.4 Atividade da peroxidase do guaiacol. . . 18
4.4.5 Atividade da catalase. . . 18
4.4.6 Atividade da polifenoloxidase. . . . 19
4.5 Análise de enzimas hidrolíticas de componentes da parede celular vegetal. . . 19
4.5.1 Atividade da pectinametilesterase. . . 19
4.5.2 Atividade da poligalacturonase. . . 20
4.6 Análise dos dados. . . 21
5.1 Enzimas antioxidantes e responsáveis pelo escurecimento. . . 24
5.1.1 Dismutase do superóxido. . . 24
5.1.2 Peroxidases. . . 27
5.1.3 Polifenoloxidase. . . . 31
5.1.4 Catalase. . . . . . 32
5.2 Enzimas hidrolíticas de componentes da parede celular. . . 34
5.2.1 Pectinametilesterase. . . .34
5.2.2 Poligalacturonase. . . .39
6. CONCLUSÕES. . . .44
1. INTRODUÇÃO
Uma dieta que é rica em frutos e vegetais tem sido associada com a proteção contra doenças cardiovasculares (BAZZANO et al., 2002) e alguns tipos de câncer (VAN‟T VEER et al., 2000). Por isso, a demanda por alimentos mais saudáveis tem aumentado continuamente por parte dos consumidores, o que contribui para o crescente consumo de suco de frutas observado nos últimos anos (SANCHO et al., 2007). Na última década, a indústria brasileira de sucos mostrou um rápido e intenso crescimento, principalmente devido ao aumento no interesse em sucos de frutas, uma vez que estes produtos foram fortemente associados a benefícios para a saúde (NIELSEN, 2008).
O Brasil é pioneiro e líder no aproveitamento do pedúnculo de caju (Anacardium occidentale L.), o qual é uma excelente fonte de vitamina C chegando a apresentar de quatro a cinco vezes o conteúdo de vitamina C dos frutos cítricos (cerca de 50 mg/100 mL) (MENEZES et al., 1995). O segmento de sucos é considerado da maior importância no aproveitamento industrial do pedúnculo de caju com grande potencial no mercado nacional e internacional (CAMPOS et al.,2002; COSTA et al.,2000; SKLIUTAS et al.,2000).
Assim como o cajueiro, a gravioleira (Annona muricata L.) representa um enorme potencial agroeonômico para a região Nordeste do Brasil. A polpa de seu fruto é branca e macia, de sabor doce e é também uma boa fonte de vitaminas do complexo B sendo principalmente destinada a indústria de sucos (TEIXEIRA et al., 2006; LIMA, 2006).
A industrialização de produtos alimentícios visa à obtenção de produtos com características sensoriais e nutricionais próximas ao produto in natura e que sejam seguros sob o ponto de vista microbiológico. Nas operações de processamento e durante o armazenamento de suco de frutas ocorrem transformações, que podem resultar em perdas no sabor e/ou aparecimento de cor, sabor e aroma desagradáveis devido à várias reações bioquímicas complexas entre seus constituintes (GAVA, 1985).
Os sucos naturais também podem apresentar atividade de algumas enzimas, como as peroxidases e polifenoloxidase, as quais promovem alterações na cor (escurecimento enzimático) e off-flavor, e as pectinases como a pectinametilesterasee a poligalacturonase , as quais degradam compostos oriundos da matriz de pectina da parede celular das células vegetais que comprometem a qualidade e tempo de vida útil desses sucos, devendo, portanto, ser inativadas durante os processamentos pelos quais esses produtos passam.
comum para aumentar a vida de prateleira de sucos, possibilitando inibição do crescimento de microrganismos ou a inativação de enzimas (ELES-MARTÍNEZ et al., 2007). Porém, dependendo da temperatura e do tempo de exposição, além da espécie vegetal utiliza para o preparo do suco, algumas destas enzimas podem permanecer ativas mesmo após a aplicação de calor.
2. REVISÃO BIBLIOGRÁFICA
2.1 Importância nutricional e econômica de suco de frutas
A demanda por alimentos mais saudáveis tem aumentado continuamente por parte dos consumidores, o que contribui para o crescente consumo de suco de frutas observado nos últimos anos (SANCHO et al., 2007). Uma dieta que é rica em frutos e vegetais tem sido associada com a proteção contra doenças cardiovasculares (BAZZANO et al., 2002) e alguns
tipos de câncer (VAN‟T VEER et al., 2000). Essa propriedade está relacionada à presença de fibras solúveis e compostos antioxidantes. No passado, os pesquisadores não conseguiam definir a diferença entre os efeitos benéficos do consumo de frutas e seus respectivos sucos. Dessa forma, a descoberta de que os sucos apresentam efeitos similares ao do fruto íntegro só ocorreu nos últimos anos (RUXTON et al., 2006). Em recomendações sobre a prevenção contra doenças cardiovasculares e câncer, a Organização Mundial de Saúde (2003) não faz nenhuma distinção entre frutos e sucos. O consumo mundial de suco de frutas em 2010 chegou a 38,7 bilhões de litros, ficando à frente de bebidas como vinho e leite aromatizado, com 27,4 e 14,5 bilhões de litros, respectivamente (CITRUSBR, 2012).
Na última década, a indústria brasileira de sucos mostrou um rápido e intenso crescimento, principalmente devido ao aumento no interesse em sucos uma vez que estes produtos foram fortemente associados a benefícios para a saúde. Segundo uma pesquisa do Ibraf (2011), a exportação de sucos não fermentados do Brasil cresceu 7,72% entre 2009 e 2010. Os sucos são fontes de nutrientes como vitaminas, minerais e fibras solúveis. Dependendo do fruto, fitoquímicos como polifenóis, especialmente os flavonóides, os quais conferem proteção à saúde humana, podem também estar presentes (MINTEL, 2004).
2.2 Processamentos de sucos
A alta perecibilidade das frutas associada à ausência e/ou deficiência de técnicas adequadas de manuseio, transporte e armazenamento têm gerado grandes perdas, as quais podem ser reduzidas pelo processamento.
íons metálicos) ou um impacto negativo (perda de nutrientes). Durante o processamento, o suco é exposto a diversos fatores que podem interferir na sua estrutura e composição nutricional, sendo que temperatura, luz, oxigênio, umidade e pH do meio são os fatores que mais contribuem para essa alteração (CORREIA et al., 2008).
Muitos são os processos empregados com o intuito de produzir alimentos estáveis e seguros como a refrigeração, congelamento, desidratação, salga, adição de açúcar, acidificação, fermentação, pasteurização, esterilização, utilização de pulsos elétricos, tecnologia de barreiras ou métodos combinados, entre outros (SOUZA FILHO et al., 1999). O processamento com emprego de calor, processamento térmico, é o método mais comum para aumentar a vida de prateleira dos produtos, possibilitando a inativação ou inibição do crescimento de microrganismos e enzimas (ELES-MARTÍNEZ et al., 2007). A aplicação de calor como forma de processamento de alimentos pode ocorrer de diversas formas. Os principais tratamentos térmicos utilizados na indústria de alimentos são: branqueamento, esterilização e pasteurização.
O branqueamento consiste em um tratamento prévio que utiliza água em ebulição ou vapor por um tempo e uma temperatura pré-estabelecidos, tendo como finalidade inativar enzimas responsáveis por reações de deterioração, que causam alterações sensoriais e nutricionais (PROCHASKA et al., 2000). Esse tratamento também reduz a carga microbiana inicial do produto, promove o amaciamento de tecidos vegetais, facilitando o envase e removendo o ar dos espaços intercelulares, no caso de vegetais enlatados (AZEREDO, 2004). O branqueamento também é empregado no processo de esterilização comercial com o objetivo de remover gases dos tecidos de alimentos e pré-aquecer o produto, diminuindo o tempo de uso da autoclave (SILVA, 2007).
O processo de esterilização consiste em uma operação unitária, na qual os alimentos são aquecidos a uma temperatura suficientemente elevada, durante minutos ou segundos, visando à destruição total de microrganismos e inativação de enzimas capazes de deteriorar o produto durante o armazenamento (FELLOWS, 1994). Para definir o tempo de tratamento que deverá ser aplicado, faz-se necessário conhecer a resistência térmica, tanto dos microrganismos como das enzimas presentes, a velocidade de penetração de calor no alimento, o seu estado físico e as propriedades térmicas do alimento e do material de envase (SILVA et al., 2000).
prolongamento da vida útil dos alimentos durante vários dias ou meses (FELLOWS, 2000). A temperatura de pasteurização e o tempo de duração utilizados dependem da carga de contaminação do produto e das condições de transferência de calor através do mesmo. O tratamento térmico pode ser feito de duas formas: pasteurização lenta (62-65 °C/ 30 min) e pasteurização rápida (72-75 °C/ 15-20 s) (EVANGELISTA, 2001).
O tratamento térmico mostra-se eficiente na inativação de enzimas pelo fato de o calor promover desnaturação de proteínas por modificação em sua estrutura conformacional, a qual é fundamental para a atividade enzimática e evitar que o substrato atinja o sítio ativo de sua respectiva enzima (MARTÍNEZ et al., 2006). Independente da técnica utilizada, o tratamento térmico tem a finalidade de eliminar possíveis microrganismos que poderiam estar presentes no produto final e inativar enzimas tais como peroxidases, pectinametilesterase e poligalacturonase, que, quando ativas, depreciam o valor nutricional e qualidade sensorial de produtos alimentícios à base de frutas, em especial os sucos. Porém, dependendo da temperatura e do tempo de exposição, além da espécie vegetal utilizada no preparo do suco, algumas destas enzimas podem permanecer ativas mesmo após a aplicação de calor.
2.3 Enzimas antioxidantes e responsáveis pelo escurecimento
O estresse oxidativo é um desequilíbrio entre a capacidade oxidativa e antioxidativa nas células vegetais (ARORA et al., 2002) e desta forma, o estresse é definido como uma condição biótica ou abiótica que interrompe, restringe ou acelera o processo metabólico normal do organismo (HODGES, 2003). Assim, mudanças nas condições ambientais como umidade, injúrias mecânicas, normalmente observadas durante a extração de suco de frutas, e variações de temperatura, dentre outras, podem causar danos oxidativos nas células vegetais, bem como em órgão como um todo, como o são os frutos e, consequentemente, em seus derivados (ALSCHER et al.,1997).
2.3.1 Dismutase do superóxido
Cu/Zn-SOD no citosol, Cu/Zn e/ou Fe- SOD no cloroplasto e Mn-SOD na mitocôndria. As SOD‟s são consideradas importantes agentes antioxidantes, porém em elevadas concentrações nas células animais e bacterianas podem induzir disfunções e morte celular (BAKER E ORLANDI, 1995). Jiao e Wang (2000) determinaram a atividade de enzimas antioxidantes no suco de seis diferentes cultivares de amoras pretas (Rubus sp) e evidenciaram a presença da enzima SOD com atividade entre 8,62 a 13,98 UAE.mg de proteína-1. Lacan e Baccou (1998) analisaram a correlação entre enzimas antioxidantes e retardamento da senescência em duas variedades de melão (Cuccumis melo L.) e observaram elevada atividade da enzima SOD na variedade de vida útil longa quando comparada à variedade de vida útil curta. Portanto, tal efeito dessa enzima antioxidante também poderia elevar a vida útil do suco dessa variedade.
2.3.2 Peroxidases
As peroxidases são enzimas antioxidantes essenciais para o sistema de detoxificação celular que regula os níveis internos de peróxido de hidrogênio, reduzindo este às custas da oxidação de outros compostos. Em vegetais, as peroxidases são encontradas na forma de várias isoenzimas, variando no tipo de substrato doador de elétrons utilizado, estabilidade térmica, peso molecular, ponto isoelétrico e propriedades imunológicas (ROBINSON, 1991).
A peroxidase do ascorbato (APX, EC, 1.11.1.1) é a mais importante na detoxificação do H2O2 catalisando sua redução usando o poder redutor do ácido ascórbico ou vitamina C (NOCTOR E FOYER, 1998).
Outra classe de peroxidases (G-POD, EC 1.11.1.7.) utiliza o poder redutor de compostos fenólicos para degradar o peróxido de hidrogênio. Substratos fenólicos artificiais como o guaiacol podem ser utilizados nas análises de peroxidases dessa classe, independente de qual seja seu substrato natural (LOPEZ et al., 1994; MIKA E LUTHJE, 2003; PASSARDI et al., 2005). A atividade dessas enzimas é indesejada em sucos por ser responsável pelo desenvolvimento de off-flavor e off-colours, os quais correspondem à formação de sabor e coloração, respectivamente, endesejáveis.
promovem as características indesejáveis citadas) é muito extensa. As peroxidases utilizam tanto um substrato oxidante, usualmente o H2O2, quanto um redutor (ROBINSON, 1991).
As peroxidases são geralmente as enzimas mais termoestáveis encontradas em frutos e vegetais, o que faz com que ela seja utilizada como um indicador de inativação enzimática após determinados tratamentos térmicos (ANTHON et al., 2002), sendo essa estabilidade dependente do tecido e da espécie (ROBINSON, 1991). Estudos que avaliaram o comportamento cinético da atividade de peroxidases de extratos de couve-flor (Brassica oleracea var. Botrytis) submetidos a tratamento térmico mostraram que esta enzima mantém 100% de sua atividade inicial (atividade residual) mesmo após uma exposição por 30 min a 50 °C. Quando a temperatura aumenta para 85 °C, a atividade cai para 11,6%, restando apenas 2,1% a 100 °C (RAYAN et al., 2011). Anthon et al. (2002) observaram que a peroxidase de suco de tomate da cultivar CXD 199 foi rapidamente inativada a 72 °C, apresentando menor estabilidade térmica que PME e PG desse mesmo suco. Já a peroxidase de suco de cenoura apresenta uma alta termoestabilidade, mantendo-se ativa mesmo após 150 min de exposição a 70 °C (JAKOB et al., 2010).
2.3.3 Polifenoloxidase
O escurecimento observado quando a maioria das frutas e dos vegetais é amassada, cortada, triturada ou processada em suco, é oriunda de reações catalisadas pela enzima polifenoloxidase (PPO). A ação dessa enzima em várias frutas e vegetais in natura acarreta perdas econômicas consideráveis, além de diminuição da qualidade nutritiva e alteração do sabor (ARAÚJO, 1999).
eliminar completamente a atividade dessa enzima em produtos de origem vegetal. No entanto, a PPO é relativamente estável sob armazenamento a temperatura abaixo de zero (YORUK E MARSHALL, 2006; ZAWISTOWSKI et al., 1991).
De acordo com Weemaes et al. (1998), a inativação da polifenoloxidase por tratamento térmico é o método mais eficaz para controlar o escurecimento enzimático. Esses autores estudaram a estabilidade térmica da PPO em extrato de maçã, abacate, uva, pêra e ameixa e a inativação térmica dessa enzima foi descrita como cinética de primeira ordem. No entanto, no caso da ameixa, uma queda na atividade enzimática foi observada nos primeiros 30 s. Como a PPO presente na ameixa é formada por pelo menos duas isoenzimas, é possível que o decaimento inicial rápido causado pelo aquecimento seja devido à isoenzima com menor estabilidade. O decréscimo mais lento foi decorrente da isoenzima mais termoestável.
2.3.4 Catalase
2.4 Enzimas hidrolíticas de componentes da parede celular vegetal
A estrutura da parede celular dos vegetais é formada por polissacarídeos, que podem ser divididos de acordo com suas propriedades físico-químicas em: substâncias pécticas, hemicelulose e celulose. As substâncias pécticas são a pectina e o ácido péctico. A pectina é um polímero hidrofílico contendo blocos de ácido galacturônico parcialmente esterificados com grupos metoxila e blocos com outros açúcares como a arabinogalactose, galactose e arabinose em uma estrutura altamente ramificada. O ácido péctico ou ácido galacturônico é o resultado da desmetoxilação da pectina (IPPA, 2011).
A pectina é classificada como um agente suspensor e funciona como um estabilizante em sucos proporcionando a manutenção da sua turbidez (BABYLON, 2011). Além disso, pectinas e polissacarídeos pécticos estão emergindo como ingredientes alimentares bioativos. Pectina de toranja é usada industrialmente como estabilizante e suplemento alimentar, pois melhora a nutrição e o desenvolvimento físico infantil. Esses oligogalacturonídeos e seus produtos de degradação por enzimas pectinolíticas são classificados como “probióticos” por serem não digeríveis, ou seja, não são hidrolisados na parte superior do trato gastrointestinal e podem ser usados como promotores de saúde em nutrição humana e animal por estimularem seletivamente o crescimento e/ou a atividade de bactérias do colo intestinal (LANG et al., 2000).
A capacidade de produtos derivados de frutas como purês, polpas e sucos em manter sua porção sólida em suspensão, ou seja, manter sua viscosidade por toda a sua vida útil depende principalmente da quantidade e qualidade do material péctico presente em solução (BEMILLER, 1986; CHOU et al., 1987). A perda de viscosidade e, consequentemente, da qualidade e aceitação por parte dos consumidores de sucos de frutas é uma conseqüência direta de alterações na estrutura da matriz de pectina da parede celular vegetal (VAN BUREN, 1979).
resíduos vegetais, degomagem de fibras nas indústrias têxteis e de papel, nutrição animal, enriquecimento protéico de alimentos infantis e extração de óleos (UENOJO et al., 2007).
2.4.1 Pectinametilesterase
A enzima pectinametilesterase (PME; EC 3.1.1.11) provoca redução na turbidez e viscosidade de sucos comerciais (KIMBALL, 1991). É uma enzima que está presente principalmente na lamela média e junções celulares e pode ser encontrada em diferentes isoformas as quais variam com a espécie vegetal e, no caso de frutos, com o estádio de maturação (TUCKER et al., 1982). Todas as isoformas compreendem apenas uma cadeia polipeptídica com massa molecular variando de 10 a 60 kDa (ALONSO et al., 1997; GIOVANE et al., 1990).
A PME catalisa a hidrólise de grupos metoxil da pectina formando ácidos pécticos como produtos de sua reação. Essa enzima atua preferencialmente em um grupo metil-éster de uma unidade de galacturonato próxima a uma unidade não esterificada de galacturonato. A redução no grau de metoxilação da pectina, catalisada pela PME pode provocar diversas alterações em relação à textura e firmeza de produtos vegetais (TIJSKENS et al., 1999).
A remoção dos grupos metoxil da cadeia de ácido poligalacturônico a qual forma a matriz de pectina leva a um aumento no número de grupos carboxílicos livres, os quais podem se ligar a cátions e gerar ligações cruzadas na cadeia de pectina. A formação dessas ligações cruzadas é indesejável em sucos, pois faz com que haja a formação de agregados de pectina, os quais podem precipitar e reduzir o aspecto homogêneo do suco (ANTHON et al., 2002). Dessa forma, para a manutenção da qualidade de sucos, os processamentos industriais objetivam a inativação da PME tornando-a uma das enzimas mais importantes na industrialização e preservação de frutos, sucos e outros produtos industrializados que envolvem a presença ou a ausência de pectina intacta (ALONSO et al., 1997 ). Além disso, a PME também torna a pectina suscetível à ação catalítica da enzima poligalacturonase, a qual atua somente em segmentos da cadeia de pectina que foram desmetiladas por ação da PME (ANTHON et al., 2002).
enzimas que poderiam estar formando complexos com substâncias reguladoras e/ou inibidoras. Além disso, a elevada atividade da PME sob altas temperaturas nessa espécie pode estar sendo promovida pela associação dessa enzima a outras biomoléculas que lhe conferem termoestabilidade (LEITE et al., 2006). Assis et al. (2000) estudaram a PME em acerola (Malpighia emarginata DC.) e observaram uma redução de cerca de 90% na atividade dessa enzima em 2 min de incubação a 106 °C. Cameron e Grohmann (1996) estudando isoenzimas de suco cítrico observaram que uma das isoformas da PME era mais termoestável mantendo 49,2% de sua atividade inicial após 1 min de incubação a 95 °C. Javeri e Wicker (1991) relataram que a PME em pêssego (Prunus pérsica (L.) Batsch) perde 77% de sua atividade quando incubada por 5 min a 65 °C e é completamente inativada a 70 °C por 5 min. Seymour et al. (1991) isolaram duas isformas de PME de toranja (Citrus paradis) e verificaram que elas diferiam em relação à quantidade de carboidratos a elas associados. Com a remoção desses carboidratos, houve uma diminuição da estabilidade térmica, sugerindo que essas moléculas contribuem para a estabilidade térmica da PME.
Um estudo com a PME de cinco cultivares de tomate (Lycopersicon esculentum Mill.) (LARATA et al., 1995) mostrou que uma delas tinha elevada estabilidade térmica e isso explicaria a perda de consistência de alguns produtos industriais derivados de tomate durante o armazenamento. Macdonald et al. (1997) utilizando um ensaio de fluxo contínuo, isolaram quatro isoformas de PME de limão (Citrus limonum) e observaram que uma delas mostrou alta estabilidade térmica, mantendo a sua atividade mesmo após ser armazenada a 86 °C por 9 min. Os autores atribuíram a desestabilização do suco de limão à termoestabilidade desta isoforma.
2.4.2 Poligalacturonase
termostável conhecida como -subunidade, a qual promove a termoestabilidade dessa isoforma (FACHIN et al., 2003).
A atividade da PG já foi encontrada em vários sucos de frutos. Em produtos a base de tomate, um aumento na solubilidade de constituintes da parede celular é devido a ação da poligalacturonase, o que leva a uma redução na viscosidade do produto final (LOPEZ et al., 1997). Para evitar danos relacionados à ação da PG, sua inativação é normalmente realizada por processamento térmico, porém há poucos dados na literatura sobre a cinética de inativação dessa enzima (GOULD, 1992). Fachin et al. (2003), analisaram a atividade da poligalacturonase em suco de tomate (Lycopersicon esculentum Mill.) tratado por 5 minutos com temperaturas variando de 40 a 90 °C e observaram duas fases de inativação, a primeira em torno de 55 °C e a segunda a aproximadamente 65 °C, o que sugere a presença de duas isoenzimas de PG com diferentes termoestabilidades. Anthon et al. (2002), estudando cinética de inativação da PG em sucos de tomates da cultivar 199 CXD, observaram que a isoforma termoestável PG1 mantinha-se ainda ativa com 15% da atividade inicial quando o suco era exposto a 85 °C, enaquanto que a PG2 foi completamente inativada a 75 °C.
2.5 Cajueiro (Annacardium occidentade L.)
O cajueiro (Anacardium occidenlale L.) pertence à família Anacardiaceae, a qual inclui árvores e arbustos tropicais e subtropicais. Esta família possui cerca de 60 gêneros e 400 espécies, englobando ainda a mangueira (Mangifera indica L.), os cajás e a cirigüela pertencentes ao gênero Spondias (CRANE E CAMPBELL, 1990; JOHNSON, 1973). É uma planta xerófila, rústica e típica de clima tropical. Originária do Brasil, do litoral nordestino, a árvore espalhou-se para diversos países da África e para a Índia (PARENTE et al., 1991).
Planta de porte baixo é um caráter da maior importância em frutíferas perenes. No cajueiro, clones comerciais do tipo anão-precoce possuem este caráter, que facilita práticas de manejo (como poda e combate a pragas e doenças) de difícil execução ou inviáveis em pomares de cajueiro do tipo comum. A uniformidade da copa é importante no arranjo e manipulação das plantas, com reflexos positivos para o manejo do pomar e para a produção (BARROS et al., 2000).
pedúnculo (maçã ou pseudofruto) desenvolvendo-se mais intensamente durante as duas últimas semanas. O fruto e o pedúnculo caem juntos e espontaneamente após sete a oito semanas (WUNNACHIT E SEDGLEY, 1992).
O pedúnculo do cajueiro é carnoso, suculento e apresenta grande variação de tamanho desde 3 cm até 20 cm de comprimento por 3 cm até 12 cm de largura, com peso entre 15 g a 200 g, formatos diversos e cor variando desde o amarelo-canário até o vermelho vinho (BARROS et al., 1984).
O Brasil é pioneiro e líder no aproveitamento de pedúnculo de caju. Entretanto, a adstringência decorrente da presença natural de taninos vem sendo tradicionalmente referida como um dos principais obstáculos contra o aumento das exportações dos pedúnculos de caju (AGOSTINI-COSTA et al., 2003). Os taninos são constituídos por compostos fenólicos com peso molecular relativamente elevado, solúveis em água, que formam complexos razoavelmente fortes com proteínas e outros polímeros (JOSLYN, 1964). Por causa da concentração bastante elevada de taninos no pedúnculo do caju, esse grupo de compostos desempenha importante papel na determinação do sabor. O pedúnculo do caju é uma excelente fonte de vitamina C, chegando a apresentar quatro a cinco vezes o teor de vitamina C dos frutos cítricos (MENEZES et al., 1995). De acordo com Garruti et al. (2002), pseudofrutos do clone CCP 76 cultivado sob condições de sequeiro apresentaram coloração do amarelo-alaranjado ao laranja e características sensoriais como elevada suculência e maciez, sabor e aroma doce; já as amostras de clones BRS 189, cultivadas sob as mesmas condições, apresentaram coloração vermelho-alaranjado, forte aroma doce e elevada adstringência.
2.6 Gravioleira (Annona muricata L)
A gravioleira (Annona muricata L) é considerada a mais tropical das anonáceas, família onde estão incluídas plantas como a ateira, pinha ou fruta-do-conde, condessa, araticum, biribá e cherimóia. É uma espécie nativa da América Tropical, porém há controvérsias quanto ao seu lugar de origem (STANDLEY, 1973).
Brasília. No entanto, a alta perecibilidade do fruto e o curto período de conservação após a colheita respondem por altos índices de perdas (MOSCA et al., 1997).
O fruto da gravioleira é uma baga com inúmeros carpelos verdes vulgarmente
denominados de “acúleos” ou “espinhos”, com peso variando de 0,9 a 10 kg (LEÓN, 1987).
De acordo com Corrêa (1978), esse fruto tem forma irregular, elipsóide e pode medir 30 cm de comprimento por 12 cm de largura, apresentando epiderme verde‐escuro, espessa e areolada. A polpa é branca sucosa, macia, de sabor doce, um pouco fibrosa, com sementes de cor castanha ou preta e, além disso, é também uma boa fonte de vitaminas do complexo B (LIMA, 2006; TEIXEIRA et al., 2006).Durante o amadurecimento desses frutos há um aumento no conteúdo de ácido ascórbico, sacarose, frutose e glicose, além de um aumento na atividade das enzimas amilase, poligalacturonase e celulase (PAULL, 1982).
3 OBJETIVOS
Esse trabalho teve como objetivo geral avaliar o efeito do tratamento térmico sobre a atividade das enzimas dismutase do superóxido, peroxidases, polifenoloxidase, catalase, pectinametilesterase e poligalacturonase nos sucos de caju e graviola.
Objetivos específicos a serem avaliados são:
- Analisar qual tratamento seria o mais eficiente a fim de promover a inativação das enzimas indesejadas sem afetar a qualidade do suco;
4 METODOLOGIA
4.1 Preparo dos sucos
Pedúnculos de Anacardium occidenlale L. do clone CCP76, no estádio maduro e com coloração alaranjada foram utilizados para a obtenção do suco prensado, conforme descrito por Abreu (2001). O preparo do suco consiste basicamente na prensagem do pedúnculo com prensa do tipo EXPELLER da marca CEIL com uma força de 730 N.
Para a obtenção do suco de graviola, frutos maduros da variedade „Crioula‟ ou „Nordestina‟ tiveram suas sementes e casca removidas para a obtenção de aproximadamente 4 kg de polpa, a qual foi homogeneizada em aparelho liquidificador doméstico da marca Walita com água destilada, em uma proporção de 1:1.
4.2 Tratamento térmico
Para ambas as espécies analisadas, o suco foi distribuído em tubos de ensaio contendo 50 mL cada, e então transferidos para banho-Maria onde permaneceram por 1, 3, 5, 10, 15, 20 e 30 minutos nas temperaturas de 55, 65, 75, 85 e 95 °C. Ao término de cada período, o suco foi imediatamente transferido para banho de gelo e em seguida acondicionado em frasco devidamente etiquetado e armazenado a –80 °C, até o dia de análise. As amostras foram separadas em três repetições as quais foram analisadas em duplicata quanto à atividade das enzimas dismutase do superóxido, catalase, peroxidases do ascorbato e guaiacol, poligalacturonase e pectinametilesterase.
4.3 Análise de proteínas totais
4.4 Análise de enzimas antioxidantes e responsáveis pelo escurecimento
4.4.1 Obtenção do extrato
Para a obtenção do extrato, 1 g de suco foi homogeneizada em vortex com 5 mL de solução tampão contendo fosfato de potássio monobásico 0,1 M e EDTA 0,1 mM, pH 7,0, por 1 min. Em seguida, o homogeneizado foi centrifugado a 5000 rpm e 4 ºC por 40 min. O material precipitado foi descartado e o sobrenadante foi recolhido e congelado a –18 ºC para posterior utilização como extrato para a análise das enzimas dismutase do superóxido, peroxidase do ascorbato e guaiacol e catalase.
4.4.2 Atividade da dismutase do superóxido
4.4.3 Atividade da peroxidase do ascorbato
Para a determinação da atividade da enzima peroxidase do ascorbato (APX, EC 1.11.1.1), 1350 µL de solução tampão fosfato de potássio monobásico 0,05 M e EDTA 0,05 mM pH 6,0 foram colocados em banho-Maria a 30 ºC e adicionados 50 µL de extrato, 50 µL de solução de peróxido de hidrogênio 0,03 M e 50 µL de ácido ascórbico 0,015 M. A mistura foi homogeneizada em vortex e analisada em espectrofotômetro a 290 nm em um intervalo de 5 min. As amostras foram analisadas em duplicata. Essa marcha analítica visa a análise da atividade da APX presente nos extratos a partir da mensuração da decrescente concentração de ácido ascórbico, o qual é oxidado durante a degradação de peróxido de hidrogênio, como foi descrito por Nakano e Asada (1981). A atividade média foi expressa como µmol H2O2.mg de proteína-1.min, considerando que é necessário dois mols de ácido ascórbico para reduzir um mol de H2O2 (AMANKO et al.,1994).
4.4.4 Atividade da peroxidase do guaiacol
O extrato enzimático utilizado na análise dessa enzima é o mesmo utilizado para a análise das enzimas antioxidantes. Para essa análise, 950 µL de solução tampão de fosfato de potássio monobásico 0,1 M e EDTA 0,1 mM, pH 7,0, foram mantidos a 30 °C por 10 min e, em seguida, foram adicionados 500 µL de solução de guaiacol 0,2 M, 500 µL de solução de H2O2 e 50 µL de extrato enzimático. A solução resultante foi homogeneizada em vortex e, então, sua absorbância foi medida em espectrofotômetro a 470 nm em um intervalo de 5 minutos (AMANKO et al.,1994). A média dos resultados foi expressa em µmol de H2O2.min -1
. mg de proteína.
4.4.5 Atividade da catalase
intervalo de 5 min de acordo com Beers e Sizer (1952). Essa análise foi realizada em triplicata e a atividade média foi expressa como µmol H2O2.mg de proteína-1.min.
4.4.6 Atividade da polifenoloxidase
Para a obtenção do extrato, 5 g de suco foi homogeneizada em vortex com 10 mL de solução tampão contendo fosfato de potássio monobásico 50 mM e 1% de PVP, pH 7,0, por 1 min. Em seguida, o homogeneizado foi centrifugado a 5000 rpm e 4 ºC por 40 min. O material precipitado foi descartado e o sobrenadante foi recolhido e congelado a –18 ºC para posterior utilização como extrato para a análise das enzimas antioxidante.
Para essa analise, uma mistura de reação contendo 300 µL de extrato e 1,85 mL de solução tampão fosfato de potássio 0,1 M com catecol 0,1 M, pH 6,0 (preparada no momento da análise), foi acondicionada em banho-Maria a 30 °C por 30 min. Tal ensaio visa a formação de quinonas e pigmentos de coloração escura resultantes da ação da PPO, presente no extrato, sobre o substrato presente na solução tampão (catecol). Ao término do tempo de acondicionamento, 800 µL de solução de ácido perclórico 0,2 N foram adicionados à mistura para que a reação da PPO fosse paralisada. Essa mistura final foi centrifugada a 5000 rpm por 5 min e o sobrenadante submetido à leitura em espectrofotômetro a 395 nm (WISSEMANN et al., 1980).
4.5 Análise de enzimas hidrolíticas de componentes da parede celular vegetal
4.5.1 Atividade da pectinametilesterase
O extrato para a análise da PME (PME; EC 3.1.1.11) foi obtido a partir de uma adaptação do método proposto por Korner et al. (1980), onde o suco (5 g) foi homogeneizado em 20 mL de solução de NaCl 0,2 M gelada e filtrado em papel de filtro. O filtrado foi utilizado como extrato para a análise de atividade dessa enzima e o conteúdo total de proteínas foi determinado segundo a metodologia de Bradford (1976).
M, pH 7,0. A solução final foi titulada com NaOH 0,1 M até que o pH da mesma se mantivesse em 7,0 ± 0,09 por 10 min. Uma unidade de atividade dessa enzima é definida como a quantidade de enzima capaz de desmetilar pectina correspondendo ao consumo de 1 mol de NaOH.min-1.g de massa fresca, sendo a média representada como UAE.mg de proteína-1.
4.5.2 Atividade da poligalacturonase
Inicialmente, 12,5 g de suco foram homogeneizados com 25 mL de água destilada gelada e, em seguida, foram centrifugados a 5000 rpm por 10 min a 4 °C. O sobrenadante foi descartado e o precipitado foi ressuspenso em 10 mL de água destilada e submetido a uma nova centrifugação nas mesmas condições da primeira. Esse passo foi repetido ainda uma terceira vez, até que o sobrenadante foi descartado e o precipitado ressuspenso em NaCl 1 M, e teve seu pH aferido para 6,0 por meio de adição de solução de NaOH 1M, sendo então mantido em repouso a 4 °C por 1 h. Ao final desse período, a solução foi submetida a uma nova centrifugação a 5000 rpm e 4 °C por 20 min. O sobrenadante resultante desse processo foi separado como o extrato. O conteúdo total de proteínas foi determinado segundo a metodologia de Bradford (1976).
A análise de atividade da poligalacturonase (PG, EC 3.2.1.15) baseia-se na determinação da quantidade de açúcar redutor liberado em solução devido à atividade desta enzima quando em um meio contendo condições ótimas de temperatura, pH e concentração de substrato. Dessa forma, foram preparados dois ensaios. No primeiro ensaio, 3 mL de extrato enzimático foram adicionados a 3 mL de água destilada, gerando uma solução final da qual foi retirada uma alíquota (AR-1) de 1,5 mL para a determinação da concentração de açúcares redutores pelo método do DNS. No segundo ensaio, 3 mL de extrato enzimático foram adicionados a 3 mL de solução de ácido poligalacturônico 0,25% em tampão acetato de sódio 37,5 mM, pH 5,0. Essa solução foi mantida em banho-Maria a 30 °C por 3 h (condições para que a enzima atue sobre seu substrato e libere açúcar em solução). Ao final, a reação da PG foi interrompida por exposição à água em ebulição (100 o C). Então, foi retirada uma alíquota (AR-2) de 1,5 mL para a determinação da concentração de açúcares redutores pelo método do DNS. A subtração do valor de AR-1 por AR-2 foi utilizado nos cálculos para determinação da atividade média da poligalacturonase, a qual foi expressa µmol de açúcares redutores. min -1
A determinação de açúcares redutores (AR) é realizada em meio alcalino, no qual os açúcares redutores reduzem o ácido 3,5 dinitro salicílico (DNS) à ácido amino-5-nitrossalicílico, enquanto que, o grupamento aldeído é oxidado a ácido aldônico. O ácido 3-amino-5-nitrossalicílico é um produto de cor laranja, sendo a intensidade da coloração correspondente a concentração de AR (MILLER, 1959).
Para quantificar o conteúdo de açúcares redutores, 1,5 mL da amostra e 1000 µL do reagente DNS foram homogeneizados em vortex e depois submetidos à água fervente (100 o
C) por 5 min. A água fervente é necessária para que haja a reação de redução do DNS, a qual só ocorre sob elevadas temperatura. Após o tempo de reação, o tubo de ensaio é imediatamente transferido para banho de gelo para que a reação seja interrompida. Após a solução ter atingido a temperatura ambiente, adiciona-se água destilada à mesma até um volume final de 10 mL e, então, procede-se a medição em espectrofotômetro a 540 nm. O cálculo da concentração de AR é feito com o auxílio de uma curva padrão preparada com concentrações previamente estabelecidas de glicose e é dado em µg de AR.g de massa fresca -1
.
4.6 Análise dos dados
4.6.1 Cálculo da atividade residual
Os resultados de atividade de todas as enzimas analisadas foram expressos como porcentagem (%) da atividade residual média, a qual é calculada a partir da razão entre o valor médio de atividade específica (A) encontrado no suco para um determinado tempo de tratamento e a atividade média específica inicial (A0) que representa a atividade no suco não tratado, multiplicado por 100.
4.6.2 Cálculo de parâmetros cinéticos
5 RESULTADOS E DISCUSSÕES
Os tratamentos térmicos são utilizados para manter a estabilidade de produtos alimentícios a fim de remover microorganismos e inativar enzimas, tais como as peroxidases e as pectinases que poderiam deteriorar o produto final, reduzindo assim seu tempo de vida útil (CORREIA et al., 2008). O tratamento térmico mostra-se eficiente na inativação de enzimas pelo fato do calor promover a desnaturação de proteínas por modificação de sua estrutura conformacional, evitando que o substrato chegue até o sítio ativo de sua respectiva enzima (MARTÍNEZ et al., 2006). Porém, esse tipo de processamento também pode acarretar perdas nutricionais e levar à inativação de compostos que, quando presentes, aumentam os índices de qualidade e aceitação desses produtos, como é o caso dos antioxidantes enzimáticos e não enzimáticos que atuam na eliminação de espécies reativas de oxigênio (EROs), as quais depreciam a qualidade e o tempo de prateleira de alimentos de origem vegetal. Todavia, não há relatos na literatura sobre os efeitos do tratamento térmico na atividade de enzimas antioxidantes.
A Tabela 1 mostra os valores de atividade específica das enzimas analisadas nos sucos que não foram submetidos a tratamento térmico (suco controle ou tempo zero), a qual serviu de referência para o cálculo da atividade residual.
Tabela 1. Atividade específica de enzimas do suco de caju e graviola não tratados termicamente
Enzima Suco Atividade Específica
SOD
(UA.mg proteína-1)
Caju 7,14 ± 0,03
Graviola 10,72 ± 0,04 APX
(µmol H2O2.min-1.mg proteína)
Caju 0,60 ± 0,00
G-POD
(µmol H2O2.min-1.mg proteína)
Graviola 0,02 ± 0,00
PPO
(UAE.min-1.mg proteína)
Caju Grviola
- - CAT
(µmol H2O2.min-1.mg proteína)
Caju 74,00 ± 0,06
Graviola -
PME
(UAE. min-1.mg proteína)
Caju 501,84 ± 32,1 Graviola 7128,15 ± 45,3 PG
(mol AR.min-1.mg protein)
5.1 Enzimas antioxidantes e responsáveis pelo escurecimento
5.1.1 Dismutase do superóxido
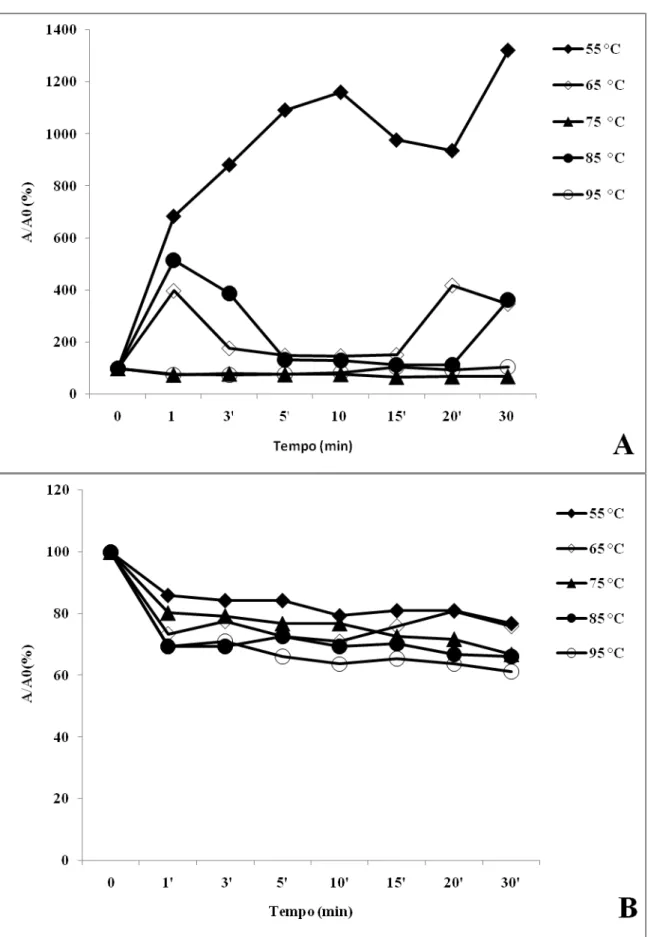
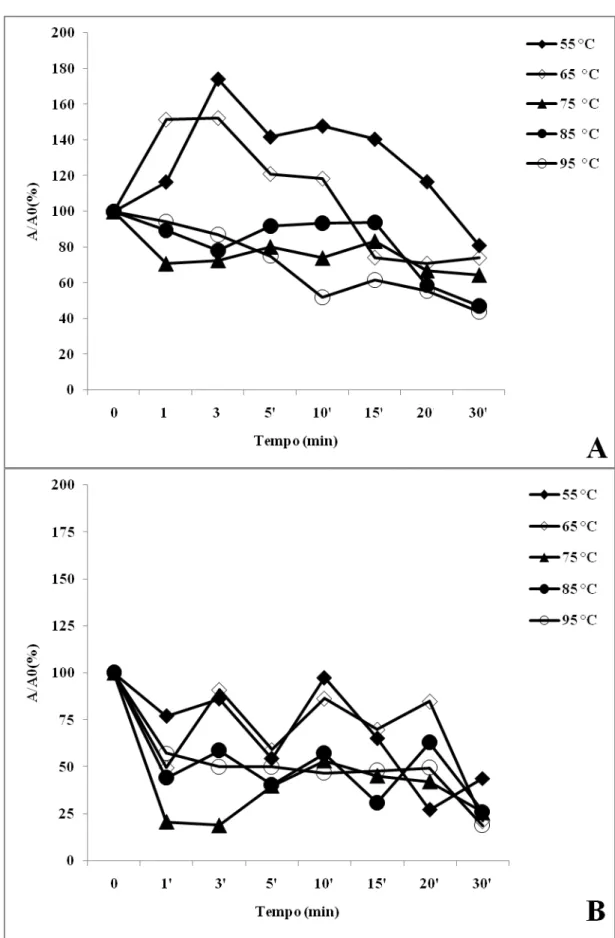
Dismutase do superóxido são metaloenzimas que apresentam um papel chave na proteção contra o estresse oxidativo (MORAN et al., 2003; SANTOS et al., 2000). As Figuras 1(A e B) mostram os resultados de atividade da dismutase do superóxido nos sucos de caju e graviola submetidos a tratamento térmico, respectivamente. No suco de caju, a SOD mostrou uma resistência ao tratamento térmico, de modo que em 55 °C a atividade dessa enzima pouco foi alterada, mantendo-se sempre com mais de 80% de sua atividade residual até o fim do tratamento. A exposição a 65 °C provocou uma redução na atividade dessa enzima após 5 min de tratamento, que se manteve por todo o experimento chegando a 45% de redução na atividade residual ao final dos 30 min de exposição. Aos 75 °C há uma queda quase linear na atividade da SOD nos 15 min iniciais de tratamento chegando a atividade residual a 61,5%. O tratamento a 85 °C provoca as maiores perdas na atividade dessa enzima logo no início do tratamento com perda de 63% após 1 min e após essa queda inicial, o aumento no tempo de exposição a essa temperatura provoca uma relativa manutenção na atividade residual da SOD, mostrando que a enzima do suco de caju apresenta uma elevada resistência a altas temperaturas. Para corroborar com essa afirmação, a exposição desse suco a 95 °C resultou em um decréscimo no primeiro minuto e depois, em uma recuperação e manutenção da atividade até os 30 min, quando atingiu 74%.
A Tabela 2 mostra os valores de alguns parâmetros cinéticos calculados para a atividade da SOD após o tratamento térmico. A constante de inativação k reflete a propriedade de inativação das enzimas de modo que, quanto maior for o seu valor, maior será a inativação. Os valores de k foram muito baixos para a enzima proveniente do suco de caju em todos os tratamentos, refletindo sua elevada estabilidade térmica. A SOD do suco de graviola não foi inativada pelo tratamento a 55 °C (Figura 1B), mas os elevados valores de k em temperaturas a partir de 65 °C mostram sua sensibilidade a esses tratamentos.
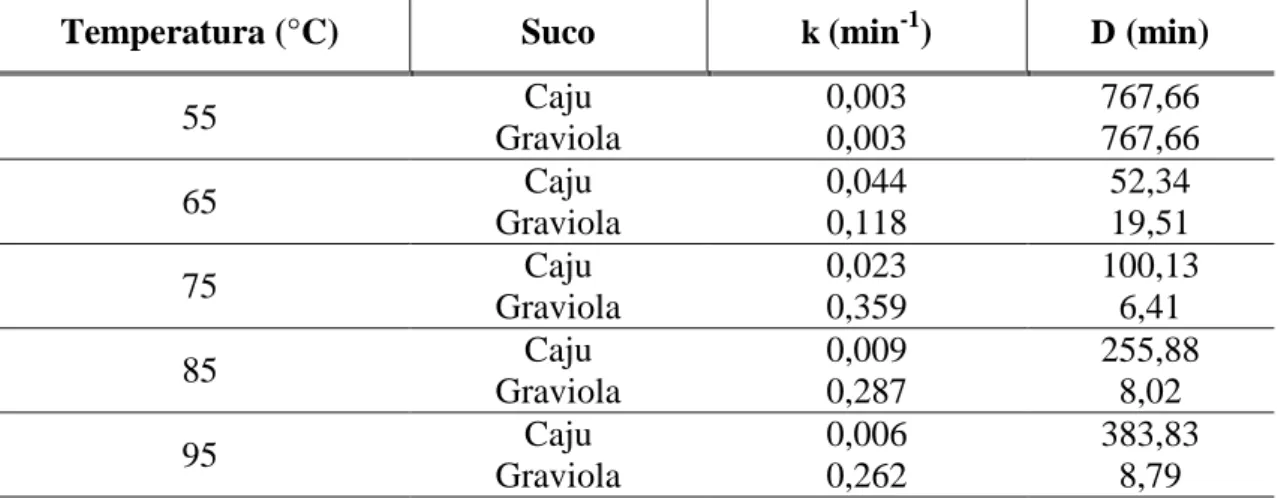
Tabela 2. Parâmetros cinéticos estimados para a inativação térmica da SOD em suco de de caju e graviola.
Temperatura (°C) Suco k (min-1) D (min)
55 Caju 0,003 767,66
Graviola 0,003 767,66
65 Caju 0,044 52,34
Graviola 0,118 19,51
75 Caju 0,023 100,13
Graviola 0,359 6,41
85 Caju 0,009 255,88
Graviola 0,287 8,02
95 Caju 0,006 383,83
Graviola 0,262 8,79
Já o parâmetro D está relacionado com o tempo necessário para reduzir em 90% a atividade enzimática inicial de modo que, quanto maior for o seu valor, mais lentamente a enzima está sendo inativada. O valor D (767,66) do suco de caju tratado a 55 °C pode ser associado ao baixo valor k indicando que dificilmente será inativada nessas condições. Aos 95 °C, os valoresde D mostram que a SOD do suco de caju demoraria 383,8 min, enquanto a de graviola demoraria 8,7 min para reduzir em 90% sua atividade. Então, como pôde ser visto a SOD proveniente do suco de caju mostrou-se muito mais resistente ao tratamento térmico do que a do suco de graviola e essa diferença pode ser devido às diferenças próprias de cada espécie vegetal e à forma de preparo de cada suco, prensagem e homogeneização, respectivamente. O suco de caju apresentou uma maior quantidade de partículas em suspensão, o que pode ter contribuído para uma maior estabilidade térmica de suas enzimas, uma vez que estas são protegidas pela presença de outras biomoléculas, tais como proteínas, carboidratos e pectinas (WHITAKER, 1972).
°C por 6 min é capaz de reduzir significativamente os conteúdos de antioxidantes não enzimáticos como o ácido ascórbico e antocianinas, além de promover uma redução na capacidade antioxidante total. Na literatura não há relatos sobre temperatura ótima, estabilidade térmica e comportamento cinético da SOD para que sejam comparados aos dados encontrados nesse trabalho.
5.1.2 Peroxidases
A peroxidase (POD) é do grupo das oxidoredutases, sendo capaz de catalisar um grande número de reações oxidativas que resultam em alterações de sabor e coloração de frutos e seus derivados (VÁMOS-VIGYÁZÓ, 1981). Para evitar essas reações indesejáveis, tratamentos térmicos capazes de inativar essas enzimas são usualmente empregados para a preservação desses produtos alimentícios (WILLIAMS et al.,1986). As peroxidases são geralmente consideradas as enzimas mais termoestáveis em plantas (KHAN et al., 1993). Como consequência dessa termoestabilidade, elas têm sido amplamente usadas como um indicador de tratamentos térmicos em alimentos processados (KHAN et al., 1993; CLEMENTE, 2002).
No suco de caju, a atividade residual da peroxidase do ascorbato sofreu um declínio em sua atividade residual logo no primeiro minuto de todos os tratamentos aplicados e depois voltou a aumentar principalmente a 55 °C atingindo menos de 80% ao final dos 30 min. As demais temperaturas testadas tenderam a reduzir atividade por até 20 min, então quando se pôde observar um novo aumento. Esses resultados indicam que a temperatura mais baixa utilizada estimulou a APX e que as demais temperaturas inicialmente a reduziram, porém ao final, isoformas mais resistentes foram ativadas.
No suco de graviola, o tratamento a 55 °C promoveu uma redução lenta na atividade residual da G-POD, a qual manteve apenas 54,1% de sua atividade residual após 30 min. As temperaturas igual e acima de 65 °C provocaram uma drástica queda na atividade logo no primeiro minuto de tratamento levando à inativação dessa enzima, apesar desta ser considerada pela literatura como uma enzima termoresistente.
A atividade da G-POD não foi detectada em suco de caju, o que sugere que possíveis alterações na coloração devido a reações que provocam escurecimento não se devem à ação dessa enzima. Damasceno et al. (2008) concluíram que o escurecimento observado em suco de caju durante seu armazenamento pós-tratamento térmico era devido à degradação da vitamina C e não à ação enzimática.
Um outro estudo mostrou que diferentes temperaturas de pasteurização reduziram a atividade de peroxidases na polpa de graviola (TEIXEIRA et al., 2006). Após um segundo a 70 °C, a atividade residual dessa enzima caiu para 57,4% chegando até 27,4%, após 5 min. Nesse mesmo trabalho, a aplicação de temperaturas mais elevadas não resultou em menores atividadese, apesar da pasteurização acima de 80 °C não ter inativado a peroxidase na polpa de graviola, os autores consideraram o tratamento aplicado como bastante eficiente na conservação desses produtos. Esses resultados mostram que a peroxidase na polpa de graviola mostrou-se muito mais resistente a elevadas temperaturas do que as formas presentes no suco aqui analisado. Essa diferença de resultados pode ser devido ao processamento que desintegra a estrutura dos tecidos e/ou à ação de diferentes isoformas de peroxidases que podem apresentar diferentes estabilidades térmicas. Há uma grande variedade de isoformas dessa enzima em plantas superiores, onde mais de 40 genes são codificadores de isoperoxidases e várias outras isoformas podem ser geradas por modificações transcricionais e pós-traducionais (DE MARCO et al., 1995; WELINDER et al., 1996).
comportamento de inativação foi não linear. Assim, a maior inativação enzimática foi obtida na temperatura de 85 °C e com tempo de exposição de 10 min. No entanto, observou-se que os tratamentos térmicos utilizados não foram suficientes para a total inativação dessa enzima. Valderrama et al. (2001) observaram um comportamento similar a esse quando estudaram essa enzima em maçãs. A peroxidase de suco de cenoura apresentou uma alta termoestabilidade mantendo-se ativa mesmo após 150 min de exposição a 70 °C (JAKOB et al., 2010)
A atividade de peroxidases de extratos de couve-flor (Brassica oleracea var. Botrytis) submetidos a tratamento térmico manteve-se em 100% mesmo após uma exposição por 30 min a 50 °C (RAYAN et al., 2011). Quando a temperatura aumenta para 85°C, a atividade cai para 11,6% restando apenas 2,1%, a 100 °C. Um trabalho com suco de laranja mostrou que a peroxidase era quase completamente inativada em temperaturas acima de 62 °C (HIRSCH et al., 2008). Esses resultados se assemelham aos apresentados aqui com o suco de graviola. Anthon et al. (2002) também observaram que a peroxidase de suco de tomate CXD 199 foi rapidamente inativada a 72 °C, apresentando uma menor estabilidade térmica do que PME e PG desse mesmo suco.
Publicações anteriores descreveram uma forte influência do pH do extrato enzimático, além da temperatura, sobre a estabilidade térmica das peroxidases (MCLELLAN et al., 1995; CLEMENTE et al., 1995; CLEMENTE, 2002). De modo que há uma inativação total das POD quando em pH 3,5 e expostas a temperaturas acima de 76 °C por 30 s. Abbo et al. (2006) observaram um aumento na acidez de sucos de graviola após um processo de pasteurização. Isso pode explicar a baixa resistência térmica da G-POD encontrada aqui no suco de graviola que resultaria do fato de o tratamento térmico promover uma redução no pH do meio propiciando uma desestabilização de tais enzimas.
Tabela 3. Parâmetros cinéticos estimados para a inativação térmica da APX do suco de caju e da G-POD do suco de graviola.
Temperatura (°C) Suco k (min-1) D (min)
55 Caju - -
Graviola 0,028 82,50
65 Caju 0,014 164,50
Graviola 0,190 12,12
75 Caju 0,021 109,66
Graviola 0,168 13,70
85 Caju 0,073 31,54
Graviola 0,224 10,28
95 Caju 0,037 62,24
Graviola 0,236 9,75
Os elevados valores de constante de inativação refletem a baixa estabilidade térmica da G-POD no suco de graviola. Uma rápida inativação dessa enzima também foi observada por Anthon et al. (2002) ao analisarem POD de suco de tomate das cultivares CXD 199 e BOS 3155 tratados a 70 °C,onde encontraram valores para k de 0,026 e 0,032 s-1 e para D de 1,5 e 1,2 min, respectivamente. Segundo esses autores, os resultados observados foram surpreendentes, uma vez que a POD é uma das enzimas mais termoestáveis encontradas em frutas e legumes.
Os efeitos do tratamento térmico a 66 °C também já foram analisados sobre PODs provenientes de suco de brócolis, cenoura e batata. Foi observado que há duas isoformas dessa enzima em brócolis, as quais diferem quanto a sua constante de inativação (k 0,264 e 0,015 min -1). Já o suco de cenoura apresentou quatro isoformas de POD, para as quais o k sobre essa temperatura foi 3,48; 3,78; 0,0051 e 0,254 min -1. No suco de batata também foram observadas quatro isoformas dessa enzima com valores de k de 42,52; 12,68; 0,0064 e 8,29 min -1. O conhecimento desse parâmetro cinético, o qual reflete a diferença na estabilidade térmica dessas isoformas, pode ser útil na escolha de um tratamento térmico mais eficiente no sentido de inativar completamente a POD (POLATA et al., 2009).
5.1.3 Polifenoloxidase
determinação precisa da PPO é um desafio, o que pode ser constatado nos numerosos métodos descritos na literatura. Isto devido as quinonas formadas durante o curso da reação enzimática, proveniente de reações secundárias, substratos não reagentes, oxigênio e outros constituintes da enzima. Estas reações levam à formação de moléculas poliméricas complexas interferindo na análise. A existência de outras enzimas com propriedades similares, tais como peroxidases, podem causar erro na medida da atividade da PPO.
A PPO pode funcionar como um mecanismo de defesa que é ativado quando vegetais e seus derivados são submetidos a condições de estresse. Em um trabalho com suco de caju, Queiroz et al. (2011) observaram que houve um aumento de cinco vezes na atividade da PPO após um período de 24 h a 27 °C e um aumento de apenas duas vezes após 24 h a 40 ° C, mostrando um efeito negativo da temperatura sobre a atividade dessa enzima. Já Zhao et al. (2005) relataram um aumento na atividade de enzimas relacionadas a condições de estresse, inclusive da PPO, em mudas de pepino (Cucumis sativus L.) após estresses simultâneos. Aquino-Bolaños e Mercado-Silva (2004) observaram uma ativação da PPO em extratos de (Pachyrizus erosus L. Urban) após danos mecânicos e armazenamento a 20 °C.
A estabilidade térmica e as propriedades térmicas da PPO têm sido citadas em diversos trabalhos. O problema é que, em alguns são realizadas análises em condições experimentais diferentes, para estudar características das enzimas, em outros, o estudo é sobre diferentes procedimentos de extração e purificação e, portanto torna-se difícil uma comparação direta entre os resultados obtidos (WEEMAES et al., 1998).
5.1.4 Catalase
A catalase é uma enzima que converte o H2O2 em H2O e O2 e é considerada umas das enzimas antioxidantes mais ativas em produtos vegetais (BREUSEGEM et al., 2001). O suco de graviola preparado nesse trabalho não apresentou atividade significativa dessa enzima, portanto a Figura 3 mostra a atividade residual da CAT somente no suco de caju submetido a diferentes temperaturas.
Figura 3. Atividade residual da CAT em suco de caju sob diferentes temperaturas, em relação ao tempo.
Os resultados sugerem que nesse suco há mais de uma isoforma de CAT com diferentes resistências às temperaturas aplicadas, o que explicaria a variabilidade observada na atividade residual. De acordo com Scandalios et al. (1997), catalases são homoproteínas tetraméricas que existem como múltiplas isoenzimas codificadas por genes nucleares. Não há relatos de estudos relacionados à atividade e/ou ao comportamento cinético da CAT sob tratamento térmico para que sejam comparados aos obtidos nesse trabalho.
Tabela 4. Parâmetros cinéticos estimados para a inativação térmica da catalase em suco de caju.
Temperatura (°C) k (min-1) D (min)
55 0,007 329,00
65 0,008 287,87
75 0,028 82,25
85 0,019 121,21
5.2 Enzimas hidrolíticas de componentes da parede celular
Uma das características físicas mais importantes em sucos de frutas é sua turbidez e, portanto, é um dos principais alvos dos tratamentos de conservação como o tratamento térmico que objetiva a inativação das enzimas hidrolíticas de componentes da parede celular (RIVAS et al., 2006). Enquanto,a PME catalisa a desesterificação da pectina liberando ácido péctico com menor grau de esterificação, a PG catalisa a clivagem hidrolítica das ligações 1-4 do ácido péctico acarretando na perda de viscosidade e na separação de fases durante o armazenamento de sucos. Assim, essas enzimas atuam em conjunto, uma vez que o produto da reação da PME serve como substrato para a ação da PG (FACHIN et al., 2003).
5.2.1 Pectinametilesterase
A PME proveniente do suco de graviola se apresentou pouco susceptível ao aquecimento. Todas as temperaturas de tratamento reduziram a atividade da PME de graviola no primeiro minuto e depois se seguiu uma estabilidade pelos 30 min de exposição. Inicialmente, a 55 °C, a atividade residual dessa enzima decaiu em 15% enquanto a 85 e 95 °C, a atividade decaiu aproximadamente em 30%. O tratamento a 95 °C apresentou a maior redução na atividade da PME em suco de graviola atingindo quase 39% após 30 min.
Resultados semelhantes aos observados para o suco de caju foram encontrados por Leite et al. (2006) em um estudo com goiabas (Psidium guajava L., cv. Paluma), onde observou-se que a atividade da PME aumentou após 30 min de exposição a 75 °C e permaneceu significativamente alta mesmo após 8h a 90 °C. Segundo os autores, esse comportamento é possível devido à liberação de enzimas que poderiam formar complexos com substâncias reguladoras e/ou inibidoras. Além disso, a elevada atividade da PME sob altas temperaturas nessa espécie pode estar sendo promovida pela associação dessa enzima a outras biomoléculas que lhe conferem termoestabilidade.
Esses resultados mostram que a inativação da PME após o aquecimento dos sucos de caju, e mesmo o de graviola, está muito aquém da necessária em termos de conservação e manutenção de atributos de qualidade como viscosidade e turbidez esperados por esse tipo de tratamento, sugerindo que temperaturas mais elevadas ou por períodos mais longos seriam mais eficientes para esse intuito. Um estudo com a PME de cinco cultivares de tomate mostrou que uma delas tinha elevada estabilidade térmica e isso explicaria a perda de consistência de alguns produtos industriais derivados de tomate durante o armazenamento (LARATA et al., 1995). Macdonald et al. (1997) isolaram quatro isoformas de PME de limão e observaram que uma delas apresentava uma alta estabilidade térmica mantendo a sua atividade mesmo após ser mantida a 86 °C por 9 min. Os autores atribuíram a desestabilização do suco de limão à termoestabilidade desta isoforma. Já Cameron e Grohmann (1996), estudando isoformas de PME de suco cítrico, observaram que uma das isoformas era mais termoestável, mantendo 49,2% de sua atividade inicial após 1 min a 95 °C.
respectivamente)decaiu para 2% após um tratamento a 98 °C por 21 s. Seymour et al. (1991) isolaram duas isoformas de PME de toranja (Citrus paradis) e verificaram que elas diferiam em relação à quantidade de carboidratos a elas associados. Com a remoção desses carboidratos, houve uma diminuição da estabilidade térmica, sugerindo que essas moléculas contribuem para a estabilidade térmica da PME. Isso poderia explicar as diversas variações citadas em relação à estabilidade térmica da PME.
Além das isoformas, outros fatores que podem fazer com que haja divergência de resultados é o pH e o grau de purificação das amostras contendo a enzima. Sentandreu et al. (2005) relataram atividade residual da PME de 1 a 4% em diversos sucos cítricos após um aquecimento contínuo a 85 ou 90 °C por 10 s. Uma redução no pH dos sucos pode levar a um aumento na sensibilidade térmica da PME, o que pode contribuir para uma variação em sua atividade (ROUSE et al., 1952). Em um estudo com tomates, Fachin et al. (2002) demonstraram que a PME purificada pode ser mais termoestável do que aquela proveniente de um extrato bruto. Porém, o uso dessa enzima na indústria de alimentos como indicador de tratamento térmico requer uma análise sem etapas prévias de purificação, uma vez que é o comportamento desses extratos brutos provenientes do suco processado que possuem maior relevância.
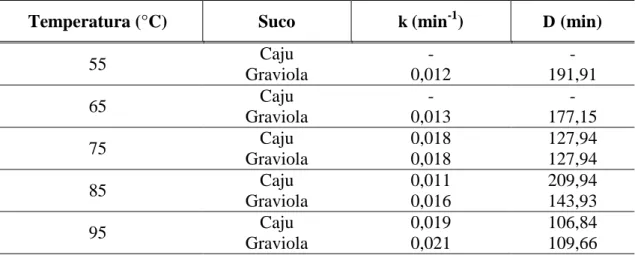
Tabela 5. Parâmetros cinéticos estimados para a inativação térmica da pectinametilesterase de sucos de caju e graviola.
Temperatura (°C) Suco k (min-1) D (min)
55 Caju - -
Graviola 0,012 191,91
65 Caju - -
Graviola 0,013 177,15
75 Caju 0,018 127,94
Graviola 0,018 127,94
85 Caju 0,011 209,94
Graviola 0,016 143,93
95 Caju 0,019 106,84
Graviola 0,021 109,66
A cinética de inativação térmica da PME já foi bem estudada em produtos à base de tomate, havendo uma variação significativa na literatura entre os valores encontrados para esses parâmetros. Em análise de PME de suco de tomate submetido a tratamentos sob diversas temperaturas, Terefe et al. (2009) encontraram valores de constante de inativação entre 0,026 min-1 a 60 °C e 0,57 min-1 a 75 °C, os quais correspondem a valores D de 89 e 4,04 min, respectivamente. A inativação da PME alcançada para esse suco de tomate a 60 °C só é conseguida para o suco de graviola a 95 °C (k = 0,021 min-1), o que reflete a elevada estabilidade térmica dessa enzima em graviola. Raviyan et al. (2005) encontraram valores D que variaram de 1,5 a 36,4 min em estudos de inativação da PME a 70 °C, um valor muito mais baixo do que foi encontrado neste trabalho para os sucos de caju e graviola, o que reflete a alta estabilidade térmica dessa enzima nesses dois sucos. Anthon et al. (2002) relataram valores D de 7,2 e 10,4 min para a inativação térmica a 70 °C de PME em suco de tomate para as cultivares BOS 3155 e CXD-199, respectivamente. Nos sucos de caju e graviola aqui analisados, os valores a 75 °C foram maiores indicando que seria necessário um tempo dez vezes maior para atigir o mesmo nível de inativação.