UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Dissertação de Mestrado
“
Obtenção de matrizes dopadas com metais de transição:
estudo da atividade catalítica em reações de química fina"
Autor: Anderson Gabriel Marques da Silva
Orientadora: Profª. Drª. Patricia A. Robles-Dutenhefner
UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Anderson Gabriel Marques da Silva
“
Obtenção de matrizes dopadas com metais de transição: estudo
da atividade catalítica em reações de química fina
”
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia de Materiais da REDEMAT, como parte integrante dos requisitos para obtenção do título de Mestre em Engenharia de Materiais
Área de concentração: Processos de Fabricação
Orientadora: Profª. Drª. Patricia A. Robles-Dutenhefner
Agradecimentos
Agradeço a Deus por ter me dado todas as oportunidades que me levaram a chegar até aqui e pela força nos momentos de desânimo.
Aos meus pais, Rui e Vânia, e aos meus irmãos Isa e Alisson por sempre pregarem a educação como prioridade, pelo carinho, criação e incentivo que sempre foi me dado durante minha vida.
Ao companheiro Thenner, pelo convívio e carinho durante todos esses anos e pela paciência de me aturar, principalmente, nos momentos adversos. Certamente tudo isso me incentivou a concretizar mais esse objetivo.
À professora e orientadora Patrícia, por ter acreditado no meu potencial há muitos anos atrás e ter se tornado ao longo dos anos além de orientadora, uma conselheira, psicóloga e como ela costuma dizer “a mãe fora de casa” só que mais implicante.
Ao professor e amigo Humberto Fajardo, pelos muitos incentivos dados, por acreditar no meu potencial e pelas inúmeras horas dedicadas a esse projeto, contribuindo muito para meu crescimento como profissional.
Ao professor Anderson Dias, pelas muitas conversas que tivemos durante esse tempo, por dividir seu extenso conhecimento, sua experiência e irreverência, que certamente tiveram uma grande contribuição para minha formação.
Às meninas do laboratório, Isabela, Juliana e, em especial, Débora, por ter me acompanhado nesses dois últimos anos, contribuindo para que esse trabalho fosse concluído.
À Universidade Federal de Ouro Preto e ao programa de pós-graduação da REDEMAT, pela infraestrutura e oportunidade.
E a todos que de alguma forma contribuíram para que esse trabalho se concretizasse.
“A tarefa não é tanto ver aquilo que
ninguém viu, mas pensar o que ninguém
pensou sobre aquilo que todo mundo
SUMÁRIO
CAPÍTULO 01 ... 3
1. INTRODUÇÃO ... 4
1.1. Processo sol-gel ... 4
1.2. Peneiras moleculares microporosas e mesoporosas ... 8
1.3. Matrizes mesoporosas ordenadas ... 9
1.4. Aplicação catalítica: reações de acoplamento Suzuki ... 12
1.4.1. Acoplamentos carbono-carbono (C-C) ... 12
1.4.2. Acoplamento Suzuki : importância e aplicações ... 13
1.4.3. Acoplamento Suzuki: sistemas catalíticos ... 15
1.4.4. Acoplamento Suzuki: mecanismo ... 16
1.5. Nanociência e nanotecnologia ... 20
1.6. Catálise por ouro ... 21
2. OBJETIVOS ... 24
3. EXPERIMENTAL ... 25
3.1. Preparo dos catalisadores Pd/SiO2 e Au-Pd/SiO2 via processo sol-gel... 25
3.2. Preparo dos catalisadores Pd/MCM-41 e Au-Pd/MCM-41 ... 25
3.3. Caracterização dos catalisadores ... 25
3.4. Ensaios catalíticos de acoplamento Suzuki ... 26
4. RESULTADOS E DISCUSSÕES ... 27
4.1. Caracterização dos catalisadores ... 27
4.2. Acoplamento Suzuki ... 32
4.3. Reforma a vapor do etanol ... 36
5. CONCLUSÕES ... 37
6. REFERÊNCIAS BIBLIOGRÁFICAS ... 38
CAPÍTULO 02 ... 48
1. INTRODUÇÃO ... 49
1.1. O Foco 1: o bagaço de cana e a cadeia produtiva de etanol... 49
1.2. Remediação ambiental ... 50
1.5. Indústria de Química Fina ... 52
1.6. O Foco 2: A cadeia produtiva nacional de óleos essenciais... 54
2. OBJETIVOS ... 57
3. EXPERIMENTAL ... 58
3.1. Preparo dos catalisadores SCB2-Co e SCB2-Cr a partir do bagaço de cana-de-açúcar modificado com anidrido succínico ... 58
3.2. Preparo dos catalisadores EB-Cr e EB-Co a partir do bagaço de cana-de-açúcar modificado com dianidrido de EDTA ... 58
3.3. Caracterização dos catalisadores ... 59
3.4. Testes de oxidação catalítica ... 60
4. RESULTADOS E DISCUSSÕES ... 61
4.1. Caracterização dos catalisadores ... 61
4.2. Testes de desempenho catalítico ... 66
5. CONCLUSÕES ... 70
6. REFERÊNCIAS BIBLIOGRÁFICAS ... 71
ANEXO I ... 77
LISTA DE FIGURAS
Figura 1. Modelo esquemático do processo sol-gel ... 4
Figura 2. Esquema da obtenção de materiais pelo processo sol-gel ... 6
Figura 3. Mecanismo do processo de hidrólise catalisados por (I) base e (II) ácido. ... 7
Figura 4. Representação da polimerização da rede tridimensional de sílica ... 8
Figura 5. Arranjos estruturais da família M41S: a-hexagonal (MCM-41), b-cúbica (MCM-48), c-lamelar (MCM-50). ... 10
Figura 6. Mecanismo LCT de formação da estrutura MCM-41 ... 11
Figura 7. Principais reações de acoplamento C-C reportadas na literatura ... 12
Figura 8. Síntese de biarilas a partir a reação Suzuki entre haletos de arila e ácidos arilborônicos, respectivamente. ... 13
Figura 9. Cristais líquidos que podem ser obtidos por acoplamento Suzuki ... 13
Figura 10. Anti-inflamátorios que podem ser obtidos por acoplamento Suzuki ... 14
Figura 11. Estruturas químicas do Valsartan e Boscalid produzidos pela Novartis e BASF, respectivamente ... 14
Figura 12. Esquema simplificado do ciclo catalítico da reação Suzuki ... 16
Figura 13. Sistema catalítico proposto por Suzuki e colaboradores para a síntese de biarilas 17 Figura 14. Sistema catalítico proposto por Gronowitz e colaboradores para a síntese de biarilas e heterobiarilas[53] ... 17
Figura 15. Sistema catalítico proposto por Lipshutz para a síntese de biarilas à temperatura ambiente[57]. ... 18
Figura 16. Sistema catalítico proposto por Sun para a síntese de biarilas utilizando cloretos de arila e Pd/C[38] ... 19
Figura 17. Comparação entre a escala nanométrica e métrica. ... 20
Figura 18. Influência do tamanho de partículas na coloração de soluções de ouro. ... 22
Figura 19. Difratogramas dos catalisadores de sílica dopada com paládio e ouro tratados termicamente a 550ºC (*Au(0) /PdO)... 28
Figura 22. Padrões SAXS dos catalisadores: (a) Au-Pd/MCM-41 e (b) Pd/MCM-41 ... 32
Figura 23. Condição de síntese de biarilas via acoplamento Suzuki-Miyaura ... 33
Figura 24. Composição do mercado de química fina no Brasil[41] ... 53
Figura 25. Estruturas químicas de monoterpenos e derivados ... 54
Figura 26. Comparação da balança comercial brasileira de forma quantitativa e em termos de valor monetário para os óleos essenciais e produtos para a indústria de fragrâncias[40]. ... 54
Figura 27. Fluxograma da cadeia produtiva de suco e óleo essencial de laranja ... 55
Figura 28. Interconexão entre setores industriais para a produção de insumos de química fina ... 56
Figura 29. Proposta com as principais idéias do trabalho ... 57
Figura 30. Rota de síntese utilizada para preparo dos catalisadores SCB2-Co e SCB2-Cr. .... 58
Figura 31. Rota de síntese utilizada para preparo dos catalisadores EB-Co e EB-Cr. ... 59
Figura 32. Espectros FTIR comparativos (a) B e SCB1; (b) B e EB ... 62
Figura 33. Difratogramas das amostras Cr/BMS2 e Cr/BME ... 63
LISTA DE TABELAS
LISTA DE NOTAÇÕES
Al-Alumínio Au-Ouro
BET-Brunauer-Emmett-Teller BJH-Barret-Joyner-Halenda CMC-Concentração micelar crítica Co-Cobalto
CO-Monóxido de carbono
CoCl2.6H2O-Cloreto de cobalto (II) hexahidratado Cr-Cromo
CrCl3.6H2O-Cloreto de cromo (III) hexahidratado CTAB-Brometo de cetiltrimetilamônio
CTAC-Cloreto de cetiltrimetilamônio Cu-Cobre
DMF-Dimetilformamida DRX-Difração de raios X
EB-Bagaço modificado com EDTA
EDTA-Ácido etilenodiamino-N, N, N’,N’-tetraacético EtOH-Etanol
FTIR-Espectroscopia infravermelho com transformada de Fourier H2-Gás hidrogênio
HAuCl4-Ácido cloroáurico HCl-Ácido clorídrico HF-Ácido fluorídrico
HMS-Hexagonal mesoporous solids
ICP-AES-Espectrometria de emissão atômica com plasma indutivamente acoplado IUPAC-International union of pure and applied chemistry
LCT-Liquid crystal templating M41S-Móbil 41 Synthesis
N2-Nitrogênio molecular O2-Oxigênio molecular Pd-Paládio
Pd(OAc)2-Acetato de paládio II PdO-Oxido de paládio
PdCl2-Cloreto de paládio II
PNSB-Pesquisa nacional de saneamento básico RTP-Redução à temperatura programada SAXS-Espalhamento de raios X a baixo ângulo SBA-15-Santa Bárbara Amorfous No15 SCB-Bagaço succinilado
SiCl4-Tetracloreto de silício SiO2-Sílica
Resumo
Este trabalho foi dividido em duas partes independentes. No capítulo 1, foram preparados catalisadores heterogêneos via processo sol-gel e via MCM-41 utilizando sílica como matriz e os metais transição Pd e Pd como dopantes. Os compósitos de Pd e Au-Pd foram caracterizados por difração de raios X (DRX), análise de adsorção-dessorção de N2 através da equação BET e do método BJH, redução à temperatura programada (RTP), espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES) e espalhamento de raios X a baixo ângulo (SAXS). O desempenho catalítico dos compósitos foi avaliado em reações de acoplamento Suzuki através de um sistema catalítico no qual uma série de haletos de arila e o ácido fenilborônico foram utilizados como substratos. Os resultados dos testes indicaram a obtenção de biarilas em rendimentos entre 50 e 99%. Nos testes de reciclo, os catalisadores não mostraram perda significativa da atividade (< 5%). A presença do metal ouro em catalisadores de paládio provocou um aumento na atividade catalítica. Além disso, os catalisadores preparados por MCM-41 também se mostraram mais ativos que os catalisadores preparados por sol-gel.
No capítulo 2, foi desenvolvido um processo sustentável que abrange as cadeias produtivas da indústria sucroalcooeira e da química fina interconectado com o desenvolvimento sustentável das mesmas através da valorização de resíduos como o bagaço de cana. Este material orgânico foi utilizado como adsorvente na remoção de contaminantes ambientais e como matriz de catalisadores heterogêneos na valorização de matéria-prima nacional, via oxidação seletiva de componentes dos óleos essenciais, gerando produtos de alto valor agregado. O esquema abaixo representa o resumo gráfico do trabalho.
Abstract
This work was divided into two independent parts. In the chapter 1, heterogeneous catalysts were prepared by sol-gel and MCM-41 using silica as matrix and the Pd and Au-Pd as dopants. The Au-Pd and Au-Au-Pd composites were characterized by X-ray diffraction (XRD), adsorption of N2 through the BET equation and the BJH method, temperature programmed reduction (TPR), inductively coupled plasma-atomic emission spectroscopy (ICP-AES) and small-angle X-ray scattering (SAXS).The catalytic performance of the catalysts was evaluated in Suzuki coupling reactions using a catalytic system in which several aryl halides and phenylboronic acid were used as substrates. The Biaryls were obtained in yields between 50-99%. In recycle tests, the catalysts did not show significant loss of activity (<5%). The presence of gold metal on the palladium catalysts showed an increase in the catalytic activity as compared to the palladium monometallic catalysts. Furthermore, the catalysts prepared by MCM-41 were more active than the catalysts prepared by sol-gel.
In the chapter 2, we have developed a process that relates the productive chains of the ethanol and Fine Chemicals industries interconnected with the sustainable development of themthrough the valorization of waste such as sugarcane bagasse. This organic material was used as adsorbents for the removal of environmental contaminants and as heterogeneous catalysts for adds value to national biodiversity raw materials. The catalytic application selected was the selective oxidation of essential oils, obtaining products of high added value.
The diagram below represents the abstract
Graphical Abstract
Waste: Sugarcane
bagasse
Use of bagasse as adsorbent for environmental remediation of heavy metals Application of Cr-containing adsorbent as heterogeneous catalyst
Adding value to essential oils through the use of adsorbents as heterogeneous
catalysts
Obtaining compounds of interest to the fragrance and food companies Removal of
chromium in effluent using a
Capítulo 01
Preparo e caracterização de materiais
mesoporosos: obtenção de matrizes de sílica à base
de Pd e Au-Pd para utilização como catalisadores
1. Introdução
Catalisadores heterogêneos têm numerosas aplicações industriais, sendo utilizados na indústria química, petroquímica, farmacêutica, agroquímica e outras[1-5].
Um catalisador heterogêneo é composto de sítios ativos que irão catalisar a reação (normalmente metais de transição) na superfície de um sólido inerte, que é conhecido como suporte ou matriz[6-7]. Usualmente, possuem áreas superficiais elevadas (até 1600m2g-1) e são desejáveis para maximizar o número de sítios ativos por unidade de volume do reator[8]. Dessa forma, a busca por rotas de síntese eficientes para obtenção destes materiais é um desafio para químicos, físicos, engenheiros de materiais e outros profissionais afins.
1.1. Processo sol-gel
A polimerização inorgânica, mais conhecida como "processo sol-gel", é um método geral para a preparação de óxidos inorgânicos à temperatura ambiente e via úmida (ou seja, em solução), sendo descoberto por Ebelmann em 1846[9]. Em seu trabalho pioneiro, ele descreveu a preparação da sílica a partir de SiCl4 e álcool após observar a ocorrência de um processo de gelatinização, obtendo assim, um sólido transparente e no formato do recipiente.
O processo sol-gel ganhou notoriedade em 1932, quando Kistler[10] demonstrou em seus estudos que a estrutura do gel não era desfeita em algumas condições específicas de secagem, permitindo comprovar a existência do esqueleto da estrutura do sólido no interior do gel. Além disso, também demonstrou que era possível ter o controle da porosidade destes materiais, viabilizando a obtenção de sólidos de interesse industrial com elevadas, médias e baixas áreas superficiais. Em 1939, este processo foi utilizado pela primeira vez em escala industrial, quando os pesquisadores Geffcken e Bergen[11] (da empresa Schott Glass) desenvolveram um processo de síntese e deposição de filmes finos de óxidos metálicos sobre vidros.
No final da década de 60 e início de 70, a indústria cerâmica começou a se interessar pela química do sol-gel, uma vez que este processo possibilita o controle das taxas de hidrólise e condensação de alcóxidos durante a preparação de vidros multicomponentes[11]. No entanto, somente após demonstrarem que compostos sólidos podiam ser produzidos pela secagem desses géis, que se verificou uma grande expansão na aplicação deste processo para as inúmeras áreas da indústria.
Desde então, ocorreu uma explosão do uso do processo sol-gel em diversos campos da tecnologia, tais como a fabricação de materiais para isolamento térmico e acústico, catalisadores, materiais vítreos avançados e materiais com propriedades ópticas[12-16].
A síntese destes colóides[17,18] utiliza precursores de um metal ou elemento metalóide cercado por vários ligantes reativos, água e um catalisador (ácido ou base). A sílica (SiO2) é a matriz inorgânica mais utilizada pelo processo sol-gel, por ser versátil e inerte, possibilitando a fabricação de materiais com inúmeras propriedades. Além disso, possui menor custo associado quando comparado a outras matrizes como titânia, zircônia e céria.
Os precursores de sílica mais utilizados são o tetrametilortosilicato (TMOS) e o tetraetilortosilicato (TEOS). A Equação (1.1) evidência o resultado global da hidrólise de um precursor de sílica Si(OR)4(R=Me, Et, iPr) em presença de um catalisador.
SiO
2(s)+ EtOH
(l)Cat
Si(OR)
4(l)+ 2H
2O
(l)que o originou, podendo ser submetidos a distintos tratamentos térmicos para a obtenção de géis secos com diferentes propriedades. O processo ainda permite a produção de cerâmicas com variadas formas e configurações geométricas: filmes, pós, monolitos, placas e fibras[17,18]. A Figura 2 ilustra as principais etapas para a obtenção de materiais pelo processo sol-gel.
Figura 2. Esquema da obtenção de materiais pelo processo sol-gel
A polimerização inorgânica é um processo bastante semelhante à polimerização orgânica. O mecanismo de propagação dessa reação[17,18] é bastante complexo, uma vez que o crescimento da cadeia polimérica pode ocorrer em todas as extremidades em que sejam possíveis ocorrer reações de hidrólise. A fase inicial de uma síntese sol-gel envolve a reação de hidrólise do precursor metálico/metalóide na qual,moléculas de água “atacam” o
Si-OR + H
2O
Si-OH + ROH
Si-OH +
Si-OH +
Si-O-Si +
Si-OH
Si-OR
ROH
Si-O-Si +
(1.2)
(1.3)
(1.4)
H
2O
A formação das espécies intermediárias é termodinamicamente favorável. No entanto, cineticamente pode demandar dias ou semanas para que ocorra o término da polimerização[18]. Dessa forma, o processo pode ser acelerado com a utilização de ácidos ou bases inorgânicas, de modo que a reação ocorra com catálise básica ou ácida, gerando produtos com propriedades finais diferentes. Estas reações intermediárias foram estudadas
por Zerda e Hoang’s[19] e esquematizaram o mecanismo de hidrólise do precursor alcóxido conforme a Figura 3.
Figura 3. Mecanismo do processo de hidrólise catalisados por (I) base e (II) ácido.
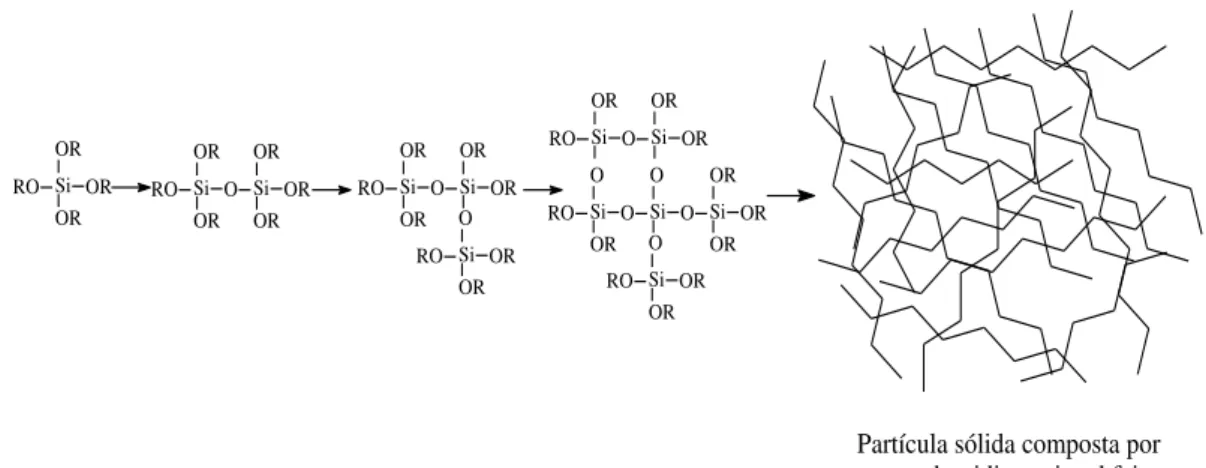
À medida que as reações de hidrólise, homocondensação e heterocondensação evoluem, cadeias poliméricas cada vez maiores e/ou mais ramificadas são formadas através de ligações em ponte do tipo oxo, hidroxo e alcóxidos residuais, dando origem à formação de oxopolímeros (polímeros ramificados) e, em seguida, aos óxidos hidratados (Figura 4). Este processo é conhecido como gelificação.
Si OR OR OR RO RO OR O OR Si Si OR OR OR OR OR Si Si OR O OR RO RO OR OR O Si Si O OR OR RO RO OR O O Si Si O O OR OR Si Si OR O RO OR OR OR Si
Partícula sólida composta por uma rede tridimensional feita de ligações Si-O-Si
Figura 4. Representação da polimerização da rede tridimensional de sílica
1.2. Peneiras moleculares microporosas e mesoporosas
Em 1932, Mcbain[20] utilizou o termo “peneiras moleculares” para definir um conjunto de zeólitas naturais que exibem capacidade adsortiva seletiva em função do seu diâmetro de poros e/ou geometria, polaridade, etc. Dessa forma, para que um material fosse considerado uma peneira molecular, deveria ter a capacidade de separar componentes de uma mistura com base nos parâmetros de diferença de tamanho ou funcionalidade química. Naquela época, somente duas classes de peneiras moleculares eram conhecidas: as zeólitas e os carvões, sendo ambos microporosos.
As cavidades e canais de dimensões bem definidas das peneiras moleculares e suas propriedades intrínsecas tais como, a capacidade de realizar adsorção seletiva de moléculas entre poros, troca-iônica, possuírem estabilidade térmica e alta área superficial, conferem a esses materiais um grande campo de aplicação tecnológica tal como, fotosensores, semicondutores, catalisadores, adsorventes e o uso em liberação controlada de fármacos [21-26].
De acordo com a IUPAC[27], as peneiras moleculares podem ser classificadas em três grupos específicos de acordo com a faixa de distribuição de tamanho de poros. A Tabela I apresenta a classificação das peneiras moleculares.
Tabela I. Classificação de peneiras moleculares de acordo com o tamanho de poros
Classificação Tamanho de poros (nm) Exemplos de materiais
Microporoso <2 ZSM-5, Cloverita
Mesoporoso 2-50 MCM-41, SBA-15
Macroporoso >50 Resinas poliméricas
1.3. Matrizes mesoporosas ordenadas
A primeira síntese de um material mesoporoso ordenado foi descrita em uma patente em 1969. Entretanto, devido à falta de dados analíticos, suas principais características não foram reconhecidas[28]. Em 1992, pesquisadores da Mobil Oil Corporation sintetizaram em meio alcalino uma nova classe de materiais mesoporosos baseados em silicatos com estrutura de poros ordenados, com tamanho e formato de poros bem definidos e ajustáveis, na faixa de 1,6 a 10nm[29]. Esta família foi denominada de M41S (Móbil 41: Synthesis). A inovação desses materiais foi a utilização de surfactantes como direcionadores ou template
de arranjo estrutural, no lugar de espécies catiônicas ou aniônicas largamente utilizadas.
Após a divulgação da síntese das peneiras moleculares mesoporosas pela Mobil, um grande interesse foi despertado na comunidade científica nas áreas de mecanismos de formação[30], caracterização[31-32], síntese de novos materiais[33] e controle da morfologia[34].
Figura 5. Arranjos estruturais da família M41S: a-hexagonal 41), b-cúbica (MCM-48), c-lamelar (MCM-50).
A sílica mesoporosa MCM-41 é a membro da família M41S mais pesquisada e apresenta uma distribuição estreita de tamanho de poros entre 1,0 e 2,0nm, arranjo hexagonal de poros monodimensionais, excelente estabilidade térmica até 700ºC, altos valores de área superficiais (até 1200m2/g) e acessibilidade de moléculas grandes no interior dos poros[29,33,35].
A síntese desses materiais é realizada por policondensação hidrolítica (processo sol-gel modificado) de um alcóxido de silicato como o TEOS. A reação é realizada em água e na presença de um surfactante que atua como um modelador da geometria e do tamanho do poro. A interação de estruturas organizadas de surfactantes com as espécies de silicatos em solução cumpre um papel muito importante na formação da estrutura mesoporosa [29,35].
ordenada. .
Figura 6. Mecanismo LCT de formação da estrutura MCM-41
Após a divulgação e repercussão da síntese da peneiras moleculares da família M41S, muitos pesquisadores concentraram seus estudos no desenvolvimento de novos sólidos mesoporosos a base de silicatos. Dessa forma, outras famílias de materiais mesoporosos se consolidaram, expandindo significativamente seus potenciais de aplicação nos mais diversos campos. Entre eles, destaca-se a sílica mesoporosa com estrutura hexagonal altamente ordenada, SBA-15[36], que é sintetizada utilizando surfactantes comerciais em forte meio ácido, resultando em uma rede hexagonal de mesoporos apresentando diâmetros de poros de aproximadamente 6,0nm, o qual é significativamente maior que o valor de 1,5-2,0nm característico da estrutura do MCM-41.
A faixa de tamanho de poros desses novos materiais depende significativamente do surfactante utilizado e das condições de síntese. A Tabela II expõe as principais famílias de materiais mesoporosos a base de silicatos.
Tabela II. Principais famílias de sílicas mesoporosas Tipo Surfactante Geometria
de poros
Diâmetro de poro (nm)
Área Específica (m2/g)
MCM
(Mobil Crystalline Material)
CTABa Hexagonal 1,5-20 Até 1400
HMS
(Hexagonal Mesoporous Solids)
CTACb Canais
tridimensionais
2-3 Até 1200
SBA
(Santa Bárbara)
P123c hexagonal 5-10 até 800
a Brometo de cetiltrimetilamônio (CTAB)
b Cloreto de cetiltrimtilamônio (CTAC)
1.4. Aplicação catalítica: reações de acoplamento Suzuki
1.4.1. Acoplamentos carbono-carbono (C-C)
As reações de acoplamento C-C têm ganhado grande notoriedade na comunidade científica nos últimos 30 anos[37,38] por possibilitar a construção de moléculas complexas, de grande interesse industrial através de uma ou poucas etapas reacionais. Antes da descoberta destas reações, demandavam-se inúmeras etapas com rendimentos globais inferiores e tempos de reação muito superiores.
A reação de acoplamento C-C[37] é um termo genérico para definir uma classe de reações em que dois fragmentos de hidrocarbonetos se ligam com o auxílio de um catalisador de um metal de transição. Embora cada reação de acoplamento C-C tenha sua característica intrínseca, algumas etapas são comuns para todas[39-40], como a utilização de um metal de transição como catalisador e a ocorrência de adição oxidativa de haleto ou triflato orgânico ao respectivo metal. Outra característica é a utilização de compostos organometálicos (-Zn, -Cu, -Al, organo-boro). Algumas reações de acoplamento C-C ganharam tanta evidência que ficaram intituladas pelo nome do pesquisador que a desenvolveu (Figura 7). De maneira geral, a reação ocorre entre compostos orgânicos ou organometálicos (nucleófilos) e haletos orgânicos (eletrófilos).
R
2
Cl
R1 +
Cl
R1 +R2 BR3 R1 R2
Cl
R1 +
Cl
R1 +R2 ZnX R1 R2
Cl
R1 +R2 SnR3 R1 R2
(Heck) (Suzuki) (Negishi) (Sonogashira) (Stille) Cat base Cat base Cat base Cat base Cat base Cl
R1 +R2 MgX Catbase R1 R2 (Kumada-Corriu)
R2
R1
R2
R2 R1
1.4.2. Acoplamento Suzuki : importância e aplicações
A reação de Suzuki [39,41-42] é um tipo de acoplamento C-C em que um composto organometálico do tipo organoboro reage com um haleto orgânico, catalisados por complexos de Pd(0), para formar ligações entre carbonos de diferentes tipos de hibridização. Suzuki e seus coautores[39,41-42] deram início a um grande avanço para a ciência, reportando a possibilidade da formação de ligações aril-aril, vini-vinil e alquil-alquil e dessa forma, possibilitou a construção de moléculas complexas e de grande importância industrial, como fármacos, corantes, polímeros, herbicidas e novos materiais[43,44]. A Figura 8 ilustra a formação da ligação aril-aril a partir de um haleto de arila e um ácido arilborônico.
X
R
B(OH)2
R'
+
R
R'
Cat
Figura 8. Síntese de biarilas a partir a reação Suzuki entre haletos de arila e ácidos arilborônicos, respectivamente
Em relação ao desenvolvimento de novos materiais a partir da reação Suzuki, existem relatos do desenvolvimento de cristais líquidos[45], oximas[46] , polímeros[47] e drogas [48]. A Figura 9 ilustra alguns cristais líquidos que podem ser sintetizados por acoplamento Suzuki.
Uma das aplicações mais importantes é a síntese de fármacos. A utilização da reação Suzuki é um elemento chave para o desenvolvimento de um processo simples e com poucas etapas de processo. Existem relatos da síntese de anti-inflamatórios importantes como o ibuprofeno e naproxeno[49] (Figura 10), drogas para o combate da malária, antibióticos, fármacos para o tratamento de tumores na mama e anti-virais.
OH
O
H
3CO
CHCOOH
CH
3Ibuprofeno
Naproxeno
Figura 10. Anti-inflamátorios que podem ser obtidos por acoplamento Suzuki
Em relação a processos que atualmente utilizam a reação de acoplamento Suzuki em escala industrial, pode-se citar os caso da síntese do fungicida Boscalid (fabricado pela BASF de São Paulo[50]) e o anti-hipertensivo Valsartan[51] (produzido pela Novartis). A Figura 11 ilustra as estruturas do Valsartan e do Boscalid.
Figura 11. Estruturas químicas do Valsartan e Boscalid produzidos pela Novartis e BASF, respectivamente
1.4.3. Acoplamento Suzuki: sistemas catalíticos
Em relação aos substratos utilizados em sistemas catalíticos capazes de realizar o acoplamento Suzuki é importante ressaltar alguns pontos[38,39]. Na literatura, é relatada a utilização da reação para a formação de ligações entre grupos arila, vinila e alquila. Contudo, o acoplamento C-C entre anéis aromáticos é o mais utilizado devido à sua grande aplicação industrial.
Embora existam várias opções disponíveis de compostos organometálicos à base de boro, os ácidos borônicos são os mais utilizados por apresentarem características importantes como baixa toxicidade, serem inertes em água e resistentes à oxidação ao ar. Para os haletos de arila, a ordem de reatividade para a adição oxidativa é I > OTf > Br > Cl, sendo um comportamento coerente, uma vez que é inversamente proporcional à energia de ligação carbono-halogênio[39,41]. Os cloretos de arila são os substratos mais promissores para serem utilizados em escala industrial por serem os de menores custos, de fácil obtenção e com grande disponibilidade no mercado. Contudo, são os menos reativos da classe de haletos para a reação Suzuki.
Em relação aos grupos substituintes em haletos de arila, é necessário ressaltar que, tal como na substituição nucleofílica, a presença de grupos eletrorretiradores aumenta a reatividade do substrato, uma vez que o anel se torna ainda mais eletrodeficiente. A presença de grupos eletrodoadores promove o efeito contrário ao citado.
Quanto ao catalisador para reação Suzuki[38-40,42], a maiorias dos sistemas catalíticos utilizam complexos de paládio em fase homogênea. Inúmeros trabalhos têm sido publicados nas últimas décadas com o intuito de desenvolver catalisadores ativos e recicláveis à base de complexos de paládio. No entanto, a reação em fase homogênea representa um gargalo quando se transpõe para a escala industrial, pois muitas etapas de purificação de produtos e recuperação do catalisador são necessárias para este tipo de processo. Trabalhos recentes têm relatado o desenvolvimento de catalisadores heterogêneos à base de paládio que são ativos para a reação Suzuki, embora problemas relativos à lixiviação da fase metálica, baixa conversão e rendimentos de produtos têm sido relatados.
catalisadores heterogêneos. A maioria dos trabalhos relatados na literatura utiliza solventes organoclorados ou hidrocarbonetos como diclorometano, triclorometano, n-hexano, cicloexano, etc.
Dessa forma, esforços têm sido direcionados para alcançar melhorias na reação de Suzuki, projetando materiais sólidos com propriedades catalíticas à base de paládio, de modo a realizar um acoplamento seletivo, de menor custo e com etapas de purificação mais simplificadas.
1.4.4. Acoplamento Suzuki: mecanismo
O ciclo catalítico da reação Suzuki[39,41,42] ocorre de maneira similar aos outros mecanismos de acoplamento C-C. Na primeira etapa, ocorre a adição oxidativa do haleto de arila para a esfera de coordenação do metal de transição (normalmente Pd para a reação Suzuki) ou complexo de metal de transição. Dessa forma, o metal M é oxidado de MM2+.
1.4.5. Acoplamento Suzuki: evolução da síntese de biarilas
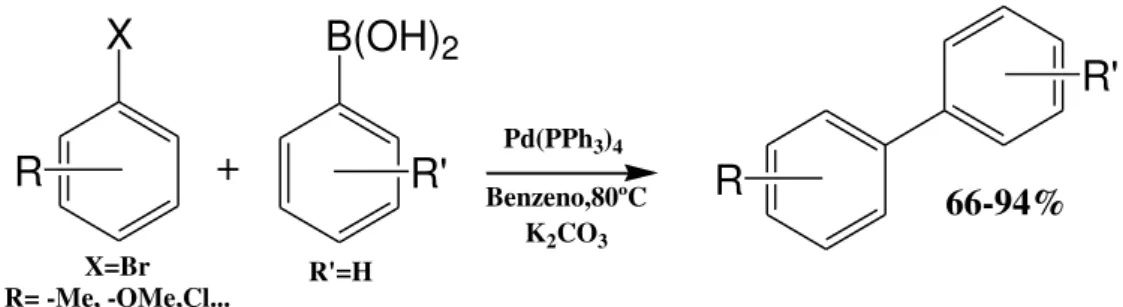
No início da década de 80, Suzuki e seus colaboradores[39,41,42] avançaram os estudos de reações de acoplamento reportando a descoberta da formação de ligações aril-aril catalisadas por paládio e utilizando ácidos borônicos como nucleófilo. Neste trabalho, uma série de brometos de arila substituídos foi utilizada para reagir com o ácido fenilborônico em presença de um complexo de paládio coordenado com fosfinas (Figura 13). A dificuldade reportada por Suzuki neste trabalho inicial é que o sistema não funcionava para substratos ortossubstituidos. Somente após 11 anos, em 1992, o mesmo grupo de pesquisadores propôs um novo sistema em que obtiveram biarilas ortossubstituidas em rendimentos entre 50-94%.
X
R
B(OH)
2R'
+
R
R'
Pd(PPh3)4
Benzeno,80ºC
K2CO3 66-94%
X=Br
R= -Me, -OMe,Cl... R'=H
Figura 13. Sistema catalítico proposto por Suzuki e colaboradores para a síntese de biarilas
Com os primeiros trabalhos publicados sobre a reação Suzuki e a grande repercussão causada na comunidade científica, muitos pesquisadores investiram no estudo da reação e contribuíram para a evolução da reação. Em 1984, Gronowitz[53] reportou a reação entre tiofenos para a síntese de anéis condensados via reação Suzuki (Figura 14).
S S
(HO)2B R R Br
+
S R
S R
3% Pd(PPh3)4
DME,H2O, K2CO3
57-70%
Figura 14. Sistema catalítico proposto por Gronowitz e colaboradores para a síntese de biarilas e heterobiarilas[53]
chave na eficiência catalítica de acoplamento de arilas. Eles mostraram que o mesmo processo pode acontecer na ausência de fosfinas através de um processo eficiente e mais limpo[55].
Outra contribuição relevante é a realização das reações de acoplamento Suzuki a temperatura ambiente. Anderson e coautores[56] foram um dos primeiros a propor um sistema ativo, obtendo biarilas substituídas com rendimentos de até 90%. No entanto, o sistema demandava 18 horas de reação e utilizava TlOH, uma base com alta toxicidade (Figura 15). Muitos outros trabalhos posteriores ao de Anderson foram publicados aprimorando o estudo da reação Suzuki a temperatura ambiente. Lipshutz e coautores[57-58] obtiveram biarilas ortosubstituídas com rendimentos entre 80 e 100%. No entanto, a dependência de elevados tempos de reação ainda é um fator limitante para alguns substratos. X R B(OH)2 + R R' TlOH 10% DMA,20ºC,18h
Pd(PPh3)4
X I Br I Br I Br R 2-NO2 4-NO2 2-OMe 2-OMe 4-OMe 4-OMe Rend.(%) 78 77 49 10 71 90
Figura 15. Sistema catalítico proposto por Lipshutz para a síntese de biarilas à temperatura ambiente[57]
Um dos primeiros estudos de catalisadores Suzuki sem o uso de ligantes auxiliares foi realizado ainda em 1994[61]. Neste estudo, os pesquisadores utilizaram um brometo de arila e um ácido fenilborônico substituído, catalisados por Pd(OAc)2, para produzir uma estrutura antifúngica, com rendimentos de até 96% para o produto de acoplamento. Em outro trabalho, Bussolari e coautores[62] desenvolveram um outro sistema em que utilizava catalisadores livre de ligantes.
Com a necessidade do desenvolvimento de processos mais eficientes e com minimização de etapas de processo, impulsionaram-se os estudos para a utilização de catalisadores heterogêneos na década de 90. Marck e colaboradores[63], reportaram o desenvolvimento de um sistema para síntese de biarilas utilizando iodetos, brometos e cloretos de arila e ácido fenilborônico catalisado por Pd/C. No entanto, problemas de lixiviação de paládio foram evidenciados. Em outro trabalho, Jang[64] descreveu um sistema utilizando paládio suportado em poliestireno funcionalizado com anéis aromáticos, reportando rendimentos entre 68-99% e em até 11 horas de reação. No mesmo, trabalho é citado a reutilização do catalisador até 10 vezes sem perda da atividade. No entanto, não discute se houve lixiviação de conteúdo metálico durante a reação.
Sun[38] desenvolveu um sistema utilizando Pd/C como catalisador e utilizou o ácido fenilborônico e uma série de cloretos de arila substituídos para realizar o acoplamento. Rendimentos de até 95% foram obtidos após 24 horas (Figura 16).
Cl R B(OH)2 + R Pd/C 5%
K2CO3
DMA,H2O
5mL,80ºC,24h R 4-NO2 4-CN 4-CF3 4-OMe 4-OMe Rend.(%) 93 95 83 32 36 (48h)
Figura 16. Sistema catalítico proposto por Sun para a síntese de biarilas utilizando cloretos de arila e Pd/C[38]
reportada a utilização de inúmeras matrizes como sílica, alumina, titânia, polímeros orgânicos, etc.
A utilização de outros metais de transição como catalisadores na reação Suzuki é reportada na literatura. Muitos estudos foram realizados com o metal níquel obtendo bons resultados para as reações de acoplamento[37,65]. Recentemente, tem sido reportado a utilização de catalisadores de ouro em reações de acoplamento Suzuki apresentando excelentes atividades catalíticas[66-67]. Ainda assim, outros estudos utilizando catalisadores bimetálicos Au-Pd demonstraram excelentes atividades catalíticas para reações de acoplamento C-C. No entanto, nenhum estudo foi encontrado visando estudar a influência do metal ouro em reações de acoplamento catalisadas por paládio.
1.5. Nanociência e nanotecnologia
A nanociência e a nanotecnologia[68] são áreas da ciência que estudam a aplicação de materiais com dimensões muito reduzidas, entre 1 e 100 nanômetros, e visa principalmente, o desenvolvimento de novos materiais e dispositivos. Um nanômetro corresponde a 10-9m ou um milionésimo de um milímetro e, em ordem de grandeza, corresponde a comparar o tamanho da lua com uma pequena moeda (Figura 17).
Figura 17. Comparação entre a escala nanométrica e métrica
No inicio da década de 60, a nanociência começou a ser proposta pelo físico Richard Feynman[69] (Prêmio Nobel da Física 1965), que causou grande repercussão na comunidade científica ao sinalizar a possibilidade do desenvolvimento de estruturas
pequena que ocasionaria a redução do tamanho de máquinas, provocando o aumento da velocidade de processamento das informações, entre outras aplicações.
No entanto, devido à falta de tecnologia para o desenvolvimento de novos equipamentos que permitissem a visualização e manipulação dos átomos, poucos progressos foram alcançados até os anos 80. As maiores contribuições até então foram as pesquisas pioneiras em biologia molecular bioquímica e nanotecnologia realizadas por Eric Drexler[70], popularizando o termo nanociência em seus artigos. No final dos anos 80, os pesquisadores da IBM criaram o primeiro microscópio de varredura por tunelamento (STM) possibilitando a manipulação e a geração de imagens reais de materiais na escala nanométrica e atômica, impulsionando os estudos em nanotecnologia[71]. Desde então, a nanotecnologia tem despertado um grande interesse nas diversas áreas da ciência por apresentar materiais com características químicas e físicas peculiares e distintas dos materiais convencionais[72,73].
Em catálise, muitas aplicações têm sido baseadas no uso de nanopartículas, especialmente utilizando metais nobres como ouro, paládio, rutênio e platina[69]. A catálise realizada por nanoestruturas é chamada de nanocatálise e se tornou uma das mais promissoras subáreas da nanociência[69]. O alvo central da nanocatálise é o controle de reações químicas através da mudança do tamanho, composição química e morfologia dos catalisadores e, pela mudança na cinética, usando nanopartículas como centros reacionais. A preparação de catalisadores usando os princípios da nanociência abre novas perspectivas para a melhoria e o aumento de atividade de catalisadores já conhecidos em catálise heterogênea, a heterogeneização de catalisadores homogêneos ou mesmo a descoberta de novas propriedades catalíticas desconhecidas no material maciço e, portanto, a fabricação de novos catalisadores.
1.6. Catálise por ouro
Embora a síntese de nanopartículas de metais de transição tenha sido reportada nas últimas décadas, essa tecnologia pode ser vista ainda em 440a.C. através da taça de Licurgo[74] contendo nanopartículas de ouro e prata.
nanotecnologia, através do estudo de nanopartículas de ouro, ou mesmo o emprego deste metal em catalisadores homogêneos[75,76].
As nanopartículas de ouro são as mais estáveis devido ao fato desse metal não apresentar tendência a formar óxidos como a grande maioria dos outros elementos da tabela periódica. Além disso, essas partículas apresentam fascinantes propriedades, relacionadas com a grande variedade de ligantes usados para síntese e as propriedades dependentes do tamanho das partículas como: eletrônicas, magnéticas e ópticas. Devido a essas propriedades, essas partículas vêm sendo estudadas com possibilidades de aplicação em áreas da biologia[77], catálise[78], eletrônica[79] e outros.
Embora o ouro na forma maciça seja amarelo, nanopartículas de ouro podem exibir diferentes cores dependendo do tamanho das partículas, variando entre azul, vermelho e violeta (Figura 18). Com dimensões entre 2 e 10nm, as nanopartículas de ouro apresentam coloração vermelha bastante intensa, devido a transições entre as bandas eletrônicas que acomodam os elétrons superficiais (bandas de plasmons superficiais)[83]. Entretanto, em tamanhos maiores as nanopartículas passam a exibir uma coloração tendendo ao violeta, devido ao aumento na densidade de estados eletrônicos e, consequentemente, diminuição da energia de transição entre as bandas. Desse modo, as nanopartículas com diâmetros médio iguais a 9, 15, 22, 48 e 99nm apresentam máximos de absorção em 517, 520, 521, 533, 575nm, respectivamente, em meio aquoso[80].
2. Objetivos
Preparar matrizes de sílica mesoporosa ordenada MCM-41 dopadas com os metais Pd e Au-Pd bimetálico.
Obter matrizes de sílica via processo sol-gel dopadas com metais de transição Pd e Au-Pd.
Caracterizar os compósitos através das técnicas difração de raios X (DRX), análise de adsorção-dessorção de nitrogênio através da equação BET e do método BJH, redução à temperatura programada (RTP), espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES) e espalhamento de raios X a baixo ângulo (SAXS).
Avaliar a atividade catalítica dos compósitos em reações de acoplamento Suzuki.
Avaliar a influência do método de preparo no desempenho catalítico dos compósitos preparados.
3. Experimental
3.1. Preparo dos catalisadores Pd/SiO2 e Au-Pd/SiO2 via processo sol-gel
Os catalisadores 5,0%p/p Pd/SiO2 e 3,0%Au-3,0%Pd/SiO2 foram preparados via processo sol-gel através da hidrólise de 16,0mL de tretaetilortosilicato (TEOS, Sigma-Aldrich) em solução aquosa contendo etanol, na presença dos precursores metálicos de ouro e paládio (HAuCl4 e PdCl2, Sigma-Aldrich). Durante a hidrólise do TEOS,
adicionou-se 0,5mL de HClconc. e 50L de HFconc. A hidrólise do TEOS foi feita utilizando razão molar de H2O/TEOS igual a 5mol/mol e de EtOH/TEOS foi de 2,7mol/mol. O géis resultantes foram secos a 110oC e calcinados na temperatura de 550oC.
3.2. Preparo dos catalisadores Pd/MCM-41 e Au-Pd/MCM-41
Os catalisadores foram preparados na porcentagem de 5%p/p para o monometálico e 3%p/p de cada metal para o bimetálico. Os metais foram inseridos por incorporação direta de Pd e Au na estrutura da sílica mesoporosa MCM-41. TEOS, PdCl2 e HAuCl4 (Sigma-Aldrich) foram utilizados como precursores e brometo de cetiltrimetilamônio (CTAB, Sigma-Aldrich) como surfactante. A solução contendo o CTAB em água deionizada foi adicionada à solução de TEOS (10% do volume total) em água e hidróxido de tetrametilamônio (TMAOH, Sigma-Aldrich). A mistura foi agitada por 30 minutos e a seguir, adicionou-se o precursor metálico e o restante de TEOS. A mistura permaneceu em autoclave a 40oC por 24 horas e então filtrou-se o sólido formado, que em seguida foi calcinado a 550oC para a retirada do surfactante. A proporção molar utilizada de TEOS/CTAB/TMAOH/água foi de 1/12/28/26.
3.3. Caracterização dos catalisadores
A determinação do teor total de ouro e paládio contido nos catalisadores foi realizada através da técnica de espectrometria de emissão atômica por plasma indutivamente acoplado (ICP-AES) em um instrumento Spectro Ciros CCD.
40mA, λ = 0,15418nm). A faixa de varredura utilizada foi de 2θ = 12-50° com velocidade de 5°/min.
A redutibilidade da superfície metálica dos catalisadores foi determinado através da técnica de redução à temperatura programada (RTP) em um equipamento de Quantachrome ChemBET-300 equipado com um detector de condutividade térmica. Antes da análise, 150mg da amostra foram colocadas em uma célula de quartzo, aquecido durante 2 horas a 200ºC sob uma corrente de He e, em seguida, resfriada até a temperatura ambiente. As medidas foram realizadas entre 30 e 800oC em fluxo de 5% H2/N2, aumentando a temperatura linearmente a uma taxa de 10°C.min-1.
As características texturais das matrizes foram determinadas a partir das isotermas de adsorção de nitrogênio a -196ºC utilizando um Autosorb-Quantachrome-IQ. As amostras (200mg) foram degaseificadas por 2 horas a 300ºC antes da análise. As áreas superficiais específicas foram determinadas pela equação de Brunauer-Emmett-Teller (método BET) a partir das isotermas de adsorção na faixa de pressão relativa de 0,07<P/Po<0,3. O volume total de poros foi obtido a partir da quantidade de N2 adsorvido à pressão relativa próxima da unidade. O diâmetro médio de poros foi determinado pelo método Barrett-Joyner-Halenda (BJH).
As análises de espalhamento de raios X a baixo ângulo (SAXS) foram realizadas no laboratório nacional de Luz síncrotron (LNLS, Campinas, Brasil), utilizando um difratômetro Huber-423 de três círculos. A configuração do SAXS foi equipada com um monocromador Si(111) , gerando um feixe horizontalmente concentrado. O comprimento
de onda incidente de raios X, o foi de 1,488nm a faixa de varredura foi de,
aproximadamente, 2 = 0-10°.
3.4. Ensaios catalíticos de acoplamento Suzuki
(instrumento Shimadzu QP5000, coluna capilar DB5, 70eV) por meio da comparação com espectros de massas de padrões dos mesmos.
Nos experimentos de reciclagem, após a extração dos produtos, os reagentes foram adicionados à fase líquida contendo o catalisador, haleto de arila (1,0mmol), ácido fenilborônico (1,2mmol), KOH (2,0mmol), tetradecano (120mg), sendo seguido o mesmo procedimento dos testes catalíticos descritos acima.
4. Resultados e Discussões
4.1. Caracterização dos catalisadores
15 20 25 30 35 40 45 50
Au-Pd/SiO2
In
te
si
da
de
(u
.a
.)
2
Pd/SiO2
Au-Pd/MCM-41
Pd/MCM-41
*
*
*
*
Figura 19. Difratogramas dos catalisadores de sílica dopada com paládio e ouro tratados termicamente a 550ºC (*Au(0) /PdO)
temperatura entre 323-373K[94,97], o que está de acordo com o observado para os compósitos preparados.
0 100 200 300 400 500 600 700 800
Au-Pd/MCM-41
Pd/MCM-41 Au-Pd/SiO2
Pd/SiO2
Temperatura (ºC)
C
on
su
m
o
de
H
2(u
.a
.)
Figura 20. Perfis de redução a temperatura programada para os catalisadores dopados com ouro e paládio
A Tabela III apresenta os valores das características texturais dos catalisadores obtidos por fisiossorção de N2. A Figura 21 apresenta as isotermas adsorção-dessorção de N2 dos catalisadores e suas respectivas distribuições BJH de tamanho de poros.
Observa-se que entre os catalisadores utilizando os suportes de sílica sol-gel e sílica MCM-41 há um aumento bastante significativo na área superficial, favorecido pelo alto ordenamento na distribuição do tamanho de poros da sílica MCM-41.
As isotermas dos catalisadores Pd/SiO2 e Au-Pd/SiO2 são correspondentes ao tipo IV (na classificação IUPAC), o que é típico de materiais mesoporosos[96,97]. A aparência da histerese é atribuída ao tipo H1 em que é apresentada em altas pressões relativas (P/Po≈0,7-0,9) e pode estar relacionado com a formação de mesoporosidade textural. As curvas de distribuição de tamanho de poro (Figura 21) para os catalisadores apresentaram perfil monomodal com um intervalo estreito de variação do tamanho dos poros entre 2-6nm.
Os catalisadores Pd/MCM-41 e Au-Pd/MCM-41 apresentaram isotermas também do tipo IV (na classificação IUPAC) (Figura 21)[96,97]. As histereses observadas são atribuídas ao tipo H3 contendo loops bem definidos e que não exibem qualquer adsorção limite em altas pressões relativas. Conforme tem sido relatado, materiais com histerese H3 apresentam os poros em formatos de cunhas, cones e/ou placas. As curvas de distribuição de tamanho de poros para os compósitos obtidos por MCM-41 apresentaram uma distribuição ainda mais estreita do que os catalisadores preparados através do método sol-gel, apresentando um intervalo entre 1,8-2,1nm com máximo em 2,0nm.
Tabela III.Características texturais obtidas por adsorção de N2 dos catalisadores de sílica
Catalisador Conteúdo Metálico Pd (%) Au (%)
Área superficial BET (m2/g)
Volume total de poros
(cm3/g)
Diâmetro médio de poros BJH
(Å)
Pd/SiO2 4,9 - 259 0,90 33
Pd/MCM-41 4,8 - 552 1,35 19
Au-Pd/SiO2 2,9 2,8 268 0,61 47
0 20 40 60 80 100 120 140 160 180 0,00 0,01 0,02 0,03 0,04 0,05 0,06 0,07
0,0 0,2 0,4 0,6 0,8 1,0
0 200 400 600 800 1000 1200 Pore Diameter/D,Å dV /d D /c m 3 .g -1 Å -1 Pd/SiO2 Au-Pd/SiO2 Pd/MCM-41 Au-Pd/MCM-41
Pressão relativa (P/Po)
V
ol
um
e
ad
so
rv
id
o
(c
m
3.g
-1)
Figura 21. Isotermas de adsorção de N2 de Pd/SiO2, Au-Pd/SiO2, Pd/MCM-41 e Au-Pd/MCM-41 e as suas respectivas curvas de distribuição de tamanho de poros utilizando o método BJH
2 3 4 5 6 7 8
(a)
(110)(200) (100)
In
te
n
si
ty
(u
.a
)
2
Pd-Au/MCM-41
2 3 4 5 6 7 8
(b)
(110) (100)
2
In
te
n
si
ty
(
u
.a
)
Pd/MCM-41
Figura 22. Padrões SAXS dos catalisadores: (a) Au-Pd/MCM-41 e (b) Pd/MCM-41
4.2. Acoplamento Suzuki
como solvente, sob uma atmosfera de ar e sem o uso de ligantes auxiliares aos metais Pd e Au.
Os catalisadores Pd e Au-Pd/SiO2 e Pd e Au-Pd/MCM-41 foram avaliados na reação de acoplamento de diferentes haletos de arila com ácido fenilborônico (Figura 23), obtendo-se os produtos de acoplamento correspondentes (Tabelas IV e V). Como mostrado na Tabela IV, tanto para Pd como Au-Pd/SiO2, a reação de acoplamento de Suzuki entre p-bromotolueno e ácido feniborônico resultaram nos produtos acoplados correspondentes em rendimento quase quantitativo (Tabela IV, exp. 3 e 4). Além disso, altos valores de rendimentos foram obtidos utilizando haletos com grupos substituintes eletrodoadores tais como –OMe (Tabela IV, exp. 1 e 2). Considerando que a etapa limitante da reação Suzuki é a adição oxidativa, a presença de haletos contendo grupos substituintes fortermente eletrodoadores (grupos desativantes frente à sustituição nucleofílica) deveria diminuir a taxa da adição oxidativa e a atividade global dos catalisadores. Neste contexto, os rendimentos mais baixos obtidos para o acoplamento utilizando haletos com grupos subtituintes eletrorretiradores tais como o p-bromonitrobenzeno ou p-bromobenzaldeído foram inesperados (Tabela IV, exp. 5-8). Mais estudos são necessários para explicar estes resultados, que poderiam estar associados a efeitos de superfície subtrato-catalisador durante a etapa da adição oxidativa. O substrato cloreto de benzila foi acoplado apenas em rendimentos moderados (Tabela IV, exp. 9 e 10). Uma vez que este é um substrato ativo para a reação de acoplamento Suzuki em sistemas homogêneos, como por exemplo Pd(OAc)2/PPh3[99], os resultados também indicam a presença de efeitos de superfície e, como consequência, que o sistema catalítico funcione efetivamente como um catalisador heterogêneo.
Br
R´
+
(HO)2B
R''
R´
R''
catalyst NaOH (4 equiv.)
tetradecane, H2O 80oC, 2-4 h
Tabela IV.Reações de Suzuki-Miyaura catalisadas por Pd/SiO2 e Au-Pd/SiO2 (sol-gel)a
Exp. Haleto de arila
(R’=H) Produto
Catalisador (M/SiO2)
Rendimentob,c (%)
2 h 4 h
1 Br
MeO
Ph
MeO
Pd 57 69(65d)
2 Au-Pd 68 81(78d)
3 Br
C H3
Ph
C H3
Pd 90 96
4 Au-Pd 92 99
5 Br
OCH
Ph
OCH
Pd 41 53
6 Au-Pd 44 60
7 Br
O2N
Ph
O2N
Pd- 26 48
8 Au-Pd 40 61
9 CH2Cl CH2Ph Pd 34 50
10 Au-Pd 39 59
a condições de reação: [ácido arilborônico]=1,2mmol, [haleto de arila]=1,0mmol, catalisador=0,130g,
H2O (20mL), T=80oC.
b rendimentos determinados por GC utilizando tetradecano como padrão interno e baseados no
consumo de haleto de arila consumido
c Como coprodutos foram detectados produtos de homoacoplamento e de redução de haletos em
quantidades mínimas
Tabela V.Reações de Suzuki-Miyaura catalisadas por Pd/MCM-41 e Au-Pd/MCM-41a
Exp. Haleto de arila
(R’=H) Produto
Catalisador (M/SiO2)
Rendimentob,c (%)
2 h 4 h
1 Br
MeO
Ph
MeO
Pd 70 85(83d)
2 Au-Pd 76 88(87d)
3 Br
C H3
Ph
C H3
Pd 95 99
4 Au-Pd 94 99
5 Br
OCH
Ph
OCH
Pd 55 70
6 Au-Pd 58 84
7 Br
O2N
Ph
O2N
Pd 36 72
8 Au-Pd 50 79
9 CH2Cl CH2Ph Pd 55 72
10 Au-Pd 62 88
a condições de reação: [ácido arilborônico]=1,2mmol, [haleto de arila]=1,0mmol, catalisador=0,130g,
H2O (20mL), T=80oC
b rendimentos determinados por GC utilizando tetradecano como padrão interno e baseados no
consumo de haleto de arila consumido
c Como coprodutos foram detectados produtos de homoacoplamento e de redução de haletos em
quantidades mínimas
d reciclo do catalisador
redução dos compósitos de MCM-41 não fosse realizada antes dos ensaios catalíticos. Os catalisadores de Pd e Au-Pd/MCM-41 apresentaram melhores desempenhos do que Pd e Au-Pd/sol-gel, provavelmente devido à maior área superfícial e volume de poros, o que pode melhorar a dispersão dos metais e a acessibilidade de substratos orgânicos aos centros metálicos.
A influência do metal ouro foi verificada em cada experimento das Tabelas IV e V. Para ambos os suportes, o aumento relativo no rendimento foi verificado através de todos os experimentos, não importando se o grupo substituinte no haleto de arila foi eletrodoador ou eletrorretirador (Tabelas IV e V). Alguns relatos na literatura têm mostrado o aumento da atividade de um catalisador adicionando o ouro em materiais dopados com paládio. Esse aumento no desempenho catalítico tem sido atribuído a formação de nanoparticulas de ouro abaixo de 10nm, mudanças estruturais do catalisador pela adição de ouro ou ainda possiveis modificações na estrutura eletrônica dos centros metálicos cataliticamente ativos[100-102].
Os testes de reciclo dos catalisadores de Pd e Au-Pd foram avaliados utilizando-se a reação entre p-bromoanisol e ácido fenilborônico. Após o primeiro ciclo catalítico, os catalisadores foram filtrados, lavados com água destilada e etanol e secos a 100ºC por 2 horas. Em seguida, os catalisadores foram avaliados em um novo lote de reagentes. Todos os catalisadores, incluindo Pd e Au-Pd em sílica (Tabela IV, exp. 1 e 2) ou de MCM-41 (Tabela V, exp. 1 e 2), foram reutilizados obtendo rendimentos de até 80% para o produto de acoplamento após três vezes de reuso e sem uma alteração significativa na atividade catalítica (Tabelas IV e V, exp. 1 e 2).
A utilização de um sistema sem ligantes, a capacidade de reciclagem do catalisador, a realização de reações em condições amenas e estáveis, bem como a utilização de água como solvente são condizentes com os princípios da química verde para a produção de produtos químicos menos poluentes e fazem deste sistema catalítico, uma alternativa promissora para a obtenção de biarilas substituidas em elevados rendimentos.
4.3. Reforma a vapor do etanol
5. Conclusões
6. Referências bibliográficas
[1] LIMA, S.M.; SILVA, A.M.; COSTA, L.O.O.; GRAHAM, U.M.; JACOBS, G.; DAVIS, B.H.; MATTOS, L.V.; NORONHA, F.B. Study of catalyst deactivation and reaction mechanism of steam reforming, partial oxidation, and oxidative steam reforming of ethanol over Co/CeO2 catalyst. Journal of Catalysis, v.268, p.268-28, 2009.
[2] HUANG, J.; REMPEL, G.L. Ziegler-Natta catalysts for olefin polymerization: Mechanistic insights from metallocene systems. Progress in Polymer Science, v.20, n.3, p.459-526, 1995.
[3] ROBLES-DUTENHEFNER, P.A.; ROCHA, K.A.S.; SOUZA, E.M.B.;
GUSEVSKAYA, E.V. Cobalt-catalyzed oxidation of terpenes: Co-MCM-41 as an efficient shape-selective heterogeneous catalyst for aerobic oxidation of isolongifolene under solvent-free conditions. Journal of Catalysis, v.265, n.1, p.72-79, 2009.
[4] INOUE, S.; NAKAJIMA, T.; KIKUCHI, Y. Synthesis of single-wall carbon nanotubes from alcohol using Fe/Co, Mo/Co, Rh/Pd catalysts. Chemical and Physical Letters, v.406, n.1-3, p.184, 2005.
[5] SEKER, E.; GULARI, E. Single step sol–gel made gold on alumina catalyst for selective reduction of NOx under oxidizing conditions: effect of gold precursor and reaction conditions. Applied Catalysis A, v.232, p.203-217, 2002.
[6] ERTL, G.; KNOZINGER, H.; SCHUTH, F.; WEITKAMP, J. Handbook of Heterogeneous Catalysis, Second edition, EUA, Wiley, 1997.
[7] SHELDON, R.A.; KOCHI, J.K. Metal-catalyzed oxidations of organic compounds: mechanistic principles and synthetic methodology including biochemical processes, First edition, London, Academic Press, 1981.
[8] HOLDERICH, W.F.; BARNISCK, B.; SHELDON, S.A.; BEKKUM, H. Fine Chemicals through Heteregeneous Catalysis, First edition, Weinheim, Wiley-VCH, 2001.
[9] EBELMANN, M.C.R. Acad. Sci. Paris, v.25, p.854, 1847. EBELMANN, J. J. Ann. v.57, p.331, 1846.
[11] HENCH, L.L.; Ulrich, D.R. Science of ceramic chemical processing, First Editon, EUA, Wiley, 1986.
[12] DUNN, B.; ZINK, J.I. Optical properties of sol–gel glasses doped with organic molecules. Journal of Materials Chemistry, v.1, n.6, p.903-913, 1991.
[13] LEE, J.H.; KO K.H.; PARK, B.O. Electrical and optical properties of ZnO transparent conducting films by the sol–gel method. Journal of Crystal Growth, v.247, n.1– 2, p.119–125, 2003.
[14] NAJAFI, S.I.; TOUAM, T.; SARA, R.; ANDREWS, M. P.; FARDAD, M.A. Sol-Gel Glass Waveguide and Grating on Silicon. Journal of Lightwave Technology, v.16, n.9, p.1640, 1998.
[15] YANTASEE, W.; RUTLEDGE, R. D.; CHOUYYOK, W.; SUKWAROTWAT, V.;
ORR, G.; WARNER, C. L.; WARNER, M. G.; FRYXELL, G. E.; WIACEK, R. J.; TIMCHALK, C.; ADDLEMAN, R.S. Functionalized Nanoporous Silica for the removal of heavy metals from biological systems: adsorption and application. Applied Materials and Interfaces, v.2, p.2749-2758, 2010.
[16] PARK, Y. M.; LEE, J. Y.; CHUNG, S. H.; PARK, I. S. LEE, S. Y.; Esterification of used vegetables oils using the heterogeneous WO3/ZrO2 catalyst for production of biodiesel. Bioresource Technology, vol.101, p.559-561, 2010.
[17] BRINKER, C.J.; SHERER, G.W. Sol-gel Science, First Edition, New York, Academic Press Inc, 1990.
[18] CORRIU, R.; ANH, N.T. Molecular Chemistry of Sol-gel Derived Nanomaterials, First Edition, EUA, Wiley, 2009.
[19] ZERDA, T. W.; HOANG, G. Journal of Non-Crystaline Solids, v.109, n.1, p.9, 1989.
[20] MCBAIN, J.M. The Sorption of Gases and Vapors by Solids, First Edition, Madinson, 1932.
[22] YANG, S.M.; YANG, H.; COOMBS, N.; SOKOLOV, L.; KRESGE, C. T.; OZIN, G. A. Morphokinetics growth of mesoporous silica curved shapes. Advanced materials, v.11, p.52, 1999.
[23] SUN, Y.; ZHU, L.; LU, H.; WANG, E.; LIN, S.; JIANG, D.; XIAO, F. Sulfated zirconia supported in mesoporous materials. Applied Catalysis A: General, v.237, p.21–31, 2002.
[24] MA, Y.; TONG, W.; ZHOU, H.; SUIB, S.L. A review of zeolite-like porous materials. Microporous and Mesoporous Materials, v.37, p.243-252, 2000.
[25] SHEN, H.; JUDEH, Z.M.A.; CHING, C.B.; XIA, Q. Comparative studies on alkylation of phenol with tert-butyl alcohol in the presence of liquid or solid acid catalysts in ionic liquids. Journal of molecular catalysis A, v.212, p.301-308, 2004.
[26] BECK, J.S.; VARTULI, J.C.; ROYH, W.J.; LEONOWICZ, M.E.; KRESGE, C.T.; SCHMITT, K.D. ; CHU, C.T.W.; OLSON, D.H.; SHEPPARD, E.W.; McCullen, S.B.; HIGGINS, J.B.; SCHLENKER, J.L. A new family of mesoporous molecular sieves prepared with liquid crystal templates A. Journal of American Chemical Society. V.114, p.108-134, 1992.
[27] SING, K.S.W.; EVERETT, D.H.; HAUL, R.A.W. MOSCOU, L.; PIEROTTI, R.A.; ROUQUEROL, J.; SIEMIENIEWSKA, T. Reporting physisorption data for gas-solid systems with special reference to the determination of surface area and porosity. Pure & Applied Chemistry, v.57, n.4, p.603-619.
[28] CHIOLA, V.; RITSKO, J.E.; VANDERPOOL, C.D. US Patent, 3556725, 1971.
[29] KRESGE, C. T.; LEONOWICZ, M. E., MICHAEL, E.; ROTH, W. J.; VARTULI, J. C. Synthetic mesoporous crystalline material. US Patent, 5098684, 1992.
[30] GÖLTNER, C.G.; ANTONIETTI, M. Mesoporous materials by templating of liquid crystalline phases. Advanced materials, v.9, p.431-436, 1997.
[31] RENZO, F.D.; TESTA, F.; CHEN, J. D; CAMBON, H.; GALAMEAU, A.; PLEE, D.; FAJULA, F. Textural control of micelle-template mesoporous effects of co-surfactants and alkalinity. Microporous Mesoporous Materials, v.28, p.437-446, 1999.
[33] MA, Y.; TONG, W.; ZHOU, H.; SUIB, S.L. A review of zeolite-like porous materials. Microporous and Mesoporous Materials, v.37, p.243-252, 2000.
[34] YANG, S.M.; YANG, H.; COOMBS, N.; SOKOLOV, L.; KRESGE, C.T.; OZIN,
G.A. Morphokinetics growth of mesoporous silica curved shapes. Advanced materials,
v.11, p.52, 1999.
[35] BECK, J.S.; VARLUTI, J.C.; ROTH, W.J.; LEONOWICZ, M.E.; KRESGE, C.T; SCHIMITT, K.D.; CHU, C.T.W.; OLSON, D.H.; SHEPPARD, E.W.; McCULLEN, S.B.; HIGGINS, J. B.; SCHLENKER, J. A new family of mesoporous molecular sieves prepared with liquid crystal templates. Journal American Chemical Society, v.114, p.10834-10843, 1992.
[36] WANG, Y. NOGUCHI, M.; TAKAHASHI, Y.; OHTSUKA, Y. Synthesis of
SBA-15 with different pore sizes and the utilization as supports of high loading of cobalt catalysts. Catalysis Today, v.68, n.1–3, p.3–9, 2001.
[37] NEGISHI, E. Palladium- or nickel-catalyzed cross coupling. A new selective method for carbon-carbon bond formation. Accounts of Chemical Research, v.15, n.11, p.340–348, 1982.
[38] PHAN, N.T.S.; SLUYS, M.V.D.; JONES, C.W. On the Nature of the Active Species in Palladium Catalyzed Mizoroki–Heck and Suzuki–Miyaura Couplings – Homogeneous or Heterogeneous Catalysis, A Critical Review. Advanced Synthesis and Catalysis, v.348, n.6, p.609–679, 2006.
[39] MIYAURA, N.; Suzuki, A. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chemical Reviews, v.95, n.7, p.2457–2483, 1995.
[40] YIN, L.; LIEBSCHER J. Carbon−Carbon Coupling Reactions Catalyzed by Heterogeneous Palladium Catalysts. Chemical Reviews, v.107, p.133−173, 2007.
[41] SUZUKI, A. Recent advances in the cross-coupling reactions of organoboron derivatives with organic electrophiles, 1995–1998. Journal of Organometallic Chemistry, v.576, n.1–2, p.147–168, 1999.