U F O P - C E T E C - U E M G
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Dissertação de Mestrado
"Síntese e caracterização de derivados do anidrido
piromelítico"
Autor: Marcos Antônio Ribeiro
Orientador: Prof. Dr. Genivaldo Júlio Perpétuo
U F O P - C E T E C - U E M G
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Marcos Antônio Ribeiro
"Síntese e caracterização de derivados do anidrido piromelítico"
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia de Materiais da REDEMAT, como parte integrante dos requisitos para a obtenção do título de Mestre em Engenharia de Materiais.
Área de concentração: Análise e seleção de materiais
Orientador:
Prof. Dr. Genivaldo Júlio Perpétuo
Catalogação: sisbin@sisbin.ufop.br
R484s Ribeiro, Marcos Antônio.
Síntese e caracterização de derivados do anidrido piromelítico [manuscrito] / Marcos Antônio Ribeiro. – 2008.
x, 106 f.: il. color., grafs., tabs.
Orientador: Prof. Dr. Genivaldo Júlio Perpétuo.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Escola de Minas. Rede Temática em Engenharia de Materiais.
Área de concentração: Análise e seleção de materiais.
1. Anidridos - Teses. 2. Raios X - Teses. 3. Ligação de hidrogênio - Teses. 4. Benzeno - Teses. I. Universidade Federal de Ouro Preto. II. Título.
Agradecimentos
Agradeço aos meus pais, Antônio e Terezinha, pelo amor e dedicação aos filhos. Às minhas irmãs. Sem o apoio da minha família nunca alcançaria os meus objetivos.
Ao Professor Genivaldo pela orientação científica e amizade desde a iniciação científica, sempre confiando no meu trabalho.
À Professora Alceni pelo seu espírito investigativo, disposição e objetividade que me in-centivaram.
Aos colegas Bruno Gama, Carlúcio Lacerda, Júlio César e Tácia e demais técnicos pelo apoio nos trabalhos de laboratório.
Ao Dr. Jan Janczak pela condução dos experimentos de difração de raios X.
Às agências de fomento CNPq, FAPEMIG e a REDEMAT/UFOP pelo suporte financeiro.
À comunidade GNU/Linux, responsável pela construção de quase a totalidade dos softwa-res utilizados ao longo do trabalho.
Aos amigos Erildo Dorico e Carlos Felipe pelos agradáveis bate papos.
Ao amigo Leandro Gurgel pela amizade e suporte científico.
Ao amigo Victor e esposa pela amizade e suporte em Ouro Preto.
Sumário
Sumário i
Lista de Figuras iii
Lista de Tabelas vi
Lista de abreviaturas vii
Resumo ix
Abstract x
1 Química Supramolecular 1
1.1 Estruturas supramoleculares . . . 3
1.2 Ligação de hidrogênio . . . 5
1.2.1 Ligações de hidrogênio fortes . . . 8
1.2.2 Ligações de hidrogênio fracas . . . 11
1.3 Grupos carboxila em estruturas supramoleculares . . . 16
1.4 O ácido 1,2,4,5 benzenotetracarboxílico . . . 19
2 Objetivos 23 3 Metodologia 24 3.1 Reações químicas . . . 24
SUMÁRIO
3.1.2 Reação de preparação dos complexos metálicos . . . 26
3.2 Espectroscopia na região do infravermelho . . . 27
3.3 Análises térmicas . . . 28
3.4 Espectrometria de Massas . . . 31
3.5 Difração de raios X por cristais . . . 34
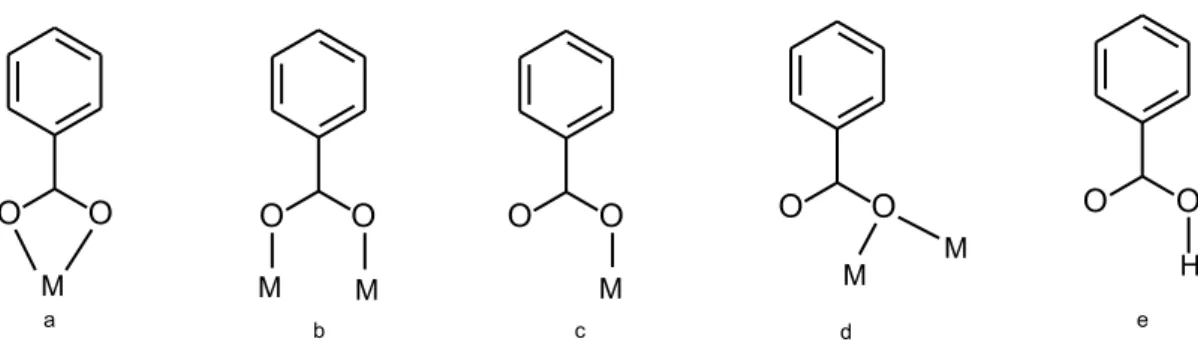
3.6 Cálculosab initio . . . 38
4 Resultados e discussão 47 4.1 Reação de obtenção do composto bifuncional - PMNH2 . . . 47
4.2 Caracterização do PMNH2 . . . 49
4.2.1 Espectroscopia na região do Infravermelho (IV) . . . 50
4.2.2 Espectrometria de Massas . . . 52
4.3 Análises térmicas . . . 55
4.4 Análise conformacional via cálculosab initio . . . 61
4.5 Análise estrutural e degradação da amida . . . 76
5 Conclusões 94
Lista de Figuras
1.1 Relação entre uma molécula, grupos funcionais e synthons supramoleculares,
adaptado de Desiraju[1] . . . 4
1.2 Três maneiras de se obter estruturas equivalentes partindo das estruturas de res-sonância propostas para as ligações de hidrogênio fortes homonucleares, adap-tada de [2] . . . 10
1.3 Correlação da distância H· · ·O com o ângulo formado na interação C−H· · ·O em cristais de carboidratos, adaptado de[3] . . . 13
1.4 Geometrias de coordenação equivalentes para grupos doadores diferentes, adap-tada de [3] . . . 14
1.5 As duas conformações encontradas para a hidroxila em cristais[4], (a) synpla-nare (b)antiplanar . . . 16
1.6 Modos de interação dos ácidos carboxílicos, (a) dímero e (b) cadeia . . . 17
1.7 Cadeia infinita formada por ácidos dicarboxílicos . . . 17
1.8 Cadeias formadas por ácidos carboxílicos 1,2 dissubstituídos . . . 17
1.9 Dímero formado pelas ligações de hidrogênio centrossimétricas em amidas . . 18
1.10 Grupos carboxilatos encontrados em estruturas derivados do BTEC. . . 21
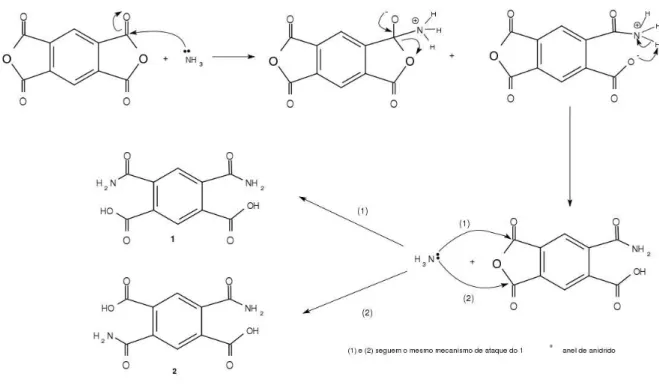
2.1 Reação entre o PMDA e a amônia . . . 23
3.1 Reação de formação do PMNH2 . . . 24
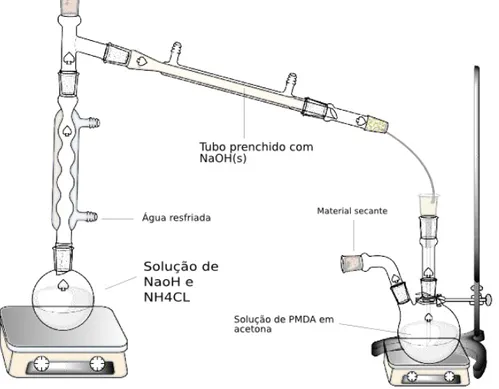
3.2 Esquema da montagem para a realização da reação de obtenção do PMNH2 . . 25
3.3 Termograma da decomposição do oxalato de cálcio monohidratado em atmos-fera inerte e a 5oC/min . . . . 29
LISTA DE FIGURAS
3.5 Esquema de um espectrômetro de massas por tempo de vôo (TOF), adaptada de
[5] . . . 33
3.6 Esquema de um espectrômetro de massasion trap[6] . . . 34
3.7 Fatores de espalhamento para diferentes átomos e íons em função de S= sinλθ reproduzida de Luger[7]. . . 35
3.8 Célula unitária monoclínica . . . 36
4.1 Reação de formação de amônia . . . 47
4.2 Proposta de mecanismo de reação de amônia com o PMDA . . . 48
4.3 Espectro na região do infravermelho do PMDA . . . 50
4.4 Espectro da região do infravermelho do PMNH2 . . . 51
4.5 Espectro na região do infravermelho do PMDA e PMNH2 . . . 52
4.6 Espectro de Massas do PMNH2 . . . 52
4.7 Estruturas detectadas pelo espectrômetro de massas . . . 53
4.8 Estruturas dos fragmentos do PMNH2, massa e espectro de massas . . . 53
4.10 Estrutura detectada pelo espectrômetro de massas . . . 54
4.9 Espectros de Massas relativo a presença do composto derivado do PMDA com um grupo funcional amida e do PMNH2 . . . 54
4.11 Estruturas dos derivados do PMDA encontrados na solução de PMNH2 em me-tanol . . . 54
4.12 Espectro de massas dos derivados do PMDA encontrados na solução de PMNH2 em metanol . . . 55
4.13 Curva TG e DTG do PMDA em atmosfera de N2 . . . 56
4.14 Curva DTA do PMDA em atmosfera de N2 . . . 56
4.15 Reação de formação do PMDA a partir do BTEC em atmosfera de N2 . . . 57
4.16 Curva TG e DTG do BTEC em atmosfera de N2 . . . 57
4.17 Curva DTA do BTEC em atmosfera de N2 . . . 58
4.18 Curva TG e DTG do PMNH2 em atmosfera de N2 . . . 59
4.19 Curva DTA do PMNH2 em atmosfera de N2 . . . 60
LISTA DE FIGURAS
4.21 Isômeros formados pela reação de amônia anidra com PMDA . . . 61
4.22 Ângulos e comprimentos de ligação obtidos para o PMDA com o conjunto de funções de base B3LYP/6-311G** . . . 62
4.23 Superfície equipotencial da densidade eletrônica do PMDA calculada com o conjunto de funções de base B3LYP/6-311G** . . . 62
4.24 Estruturas dos confôrmeros derivados do PMNH2 . . . 63
4.25 Estrutura otimizada do confôrmero1bamino . . . 65
4.26 Estrutura otimizada do confôrmero1acarboxi . . . 66
4.27 Estrutura otimizada do confôrmero1aminoinv . . . 67
4.28 Estrutura otimizada do confôrmero2bamino . . . 69
4.29 Estrutura otimizada do confôrmero2aamino. . . 70
4.30 Estrutura otimizada do confôrmero2acarboxi . . . 71
4.31 Estrutura otimizada do confôrmero2aaminoinv . . . 72
4.32 Estrutura otimizada do confôrmero2acarboxi . . . 73
4.33 Estruturas derivadas do PMNH2 . . . 75
4.34 Representação ortep do compostoIII(elipsóides a 50% probabilidade, átomos de H esféricos) e indexação da unidade assimétrica. . . 78
4.35 Estrutura cristalina e ligações de hidrogênio formadas no compostoIIIvista ao longo do eixoa. . . 81
4.36 Estrutura cristalina do compostoVIII(elipsóides com 50% de probabilidade) e átomos de hidrogênio esféricos. . . 82
4.37 Empacotamento cristalino da estrutura do compostoVIIIe a geometria formada em torno do Zn2+visto do eixoa. . . 84
4.38 Ligações de hidrogênio formadas na estrutura cristalina do compostoVIIIvisto do eixoa. . . 86
4.39 Unidade assimétrica do compostoIX, elipsóides com 50% de probabilidade e átomos de hidrogênio esféricos. . . 87
4.40 Estrutura do composto IXao longo da direção a, mostrando os octaedros for-mados e a sua conectividade. . . 90
Lista de Tabelas
1.1 Parâmetros referentes aos tipos de ligação de hidrogênio, adaptada de [9] . . . 8
3.1 Quantidades de PMNH2, dos metais de transição e dos solventes utilizados na preparação dos complexos metálicos. . . 26
4.1 Solubilidade do PMNH2 frente a solventes diferentes . . . 49
4.2 Energias HF/SCF (kcal mol−1), ângulos de ligação∠
1e∠2(o), comprimentos
(Å), e ângulos das ligações de hidrogênio intramoleculares dos confôrmeros estudados do PMNH2 . . . 74
4.3 Valores calculados e experimentais para comprimentos de ligações selecionadas no PMNH2 . . . 76
4.4 Dados cristalográficos das estruturas cristalinas estudadas . . . 77
4.5 Comprimentos e ângulos de ligação selecionados para o compostoIII . . . 79 4.6 Ligações de hidrogênio formadas no compostoIIIe seus parâmetros geométricos 81 4.7 Comprimentos e ângulos de ligação selecionados para o cristal do compostoVIII. 83 4.8 Ligações de hidrogênio formadas no compostoVIIIe seus parâmetros
geomé-tricos. . . 85
Lista de abreviaturas
PMNH2 - mistura isomérica composta pelo 4,6-bis(aminocarbonil) ácido isoftálico e do 2,5-bis(aminocarbonil) ácido tereftálico
PMDA - 1,2,4,5 benzenotetracarboxílico anidrido ou anidrido piromelítico
BTEC - 1,2,4,5 benzenotetracarboxílato
PA - proton afinidade
CAHB -charge assisted hydrogen bond
RAHB -resonance assisted hydrogen bond
CSD -Cambridge Structural Database
H4BTEC - ácido 1,2,4,5 benzenotetracarboxílico
H2BTEC2− - ácido 1,2,4,5 dihidrogenobenzenotetracarboxílico
IV - Espectroscopia na Região do Infravermelho
DRX - Difração de Raios X
DSC - Análises Térmicas Diferencial
TGA - Análises Térmicas Termogravimétricas
MS - Espectrometria de Massas
TOF -Time of flight
LCMS-IT-TOF -Liquid Cromatrography Mass spectrometry
HF - Hartree Fock
SCF -Self consistent field
STO -Slater type orbitals
GTO -Gaussian Type Orbitals
LISTA DE ABREVIATURAS
TZ -Triple zeta basis
SV -Split valence basis
DFT -Density functional theory
CI -Configuration interaction
MP2 - Moller-Pleaset
KS - Kohn-Sham
Resumo
No presente estudo foram obtidos compostos isoméricos, o 4,6-bis(aminocarbonil) ácido isof-tálico (1) e 2,5-bis(aminocarbonil) ácido tereftálico (2) através da reação de amônia anidra com anidrido piromelítico em dimetil cetona a temperatura ambiente. O isômeros não foram isolados, e a mistura, nomeada PMNH2, foi caracterizada por métodos físicos à temperatura ambiente. Cálculos quantum-químicos foram realizados para estudo conformacional e com-paração com resultados experimentais. Um total de oito conformações do composto 1, seis do composto 2 e o 1,2,4,5 benzenotetracarboxilato (BTEC) foram simuladas por cálculos ab initio, utilizando conjunto de funções base até o nível B3LYP/6-311G∗∗+. Há a formação de ligações de hidrogênio intramoleculares do tipo O−H· · ·O, N−H· · ·O e O−H· · ·N, contudo essas se mostraram desestabilizar o confôrmero. As estruturas que não formaram ligações de hidrogênio intramoleculares tem um conteúdo energético menor que as que formaram. Amos-tras cristalinas foram obtidas a partir da mistura em solução aquosa de PMNH2 com os íons Cu2+, Zn2+ e Co2+. Os cristais foram analisados por difração de raios X de monocristais. O processo de hidrólise de amidas por catálise intramolecular explica a formação dos com-plexos 1,2,4,5 benzenotetracarboxilato de triaquacobre(II) di-hidratado (C10H20O18Cu2;C2/c;
a=12,116(2)Å, b=18,091(4)Å, c=9,5910(19)Å eβ =112,90(3)o; z=4); 1,2,4,5 ben-zenotetracarboxilato de diaquazinco(II) (C5H5O6Zn;P21/n;a=5,246(1)Å,b=16,320(3)Å, c=8,114(2)Å e β =97,95(1)o; z=4) e 1,2,4,5 benzenotetracarboxilato diaquacobalto(II) tri-hidratado (C20H24O25Co3; P21/n; a= 9,521(2)Å, b=11,075(2)Å, c= 14,020(3)Å e
β =104,13(2)o;z=4). A presença de moléculas de água desempenham um importante papel na estrutura, como na coordenação do metal de transição ou pela sua participação em diversas ligações de hidrogênio intermoleculares observadas. Foram observadas ligações de hidrogênio de moderadas a fracas, com o parâmetros d(H· · ·O) e D(O· · ·O) da menor sendo 1,6911(38)e
2,5742(53)Å e da maior ligação de hidrogênio 2,424 e 3,099Å, respectivamente. Os metais de
transição Cu2+ e Zn2+ são pentacoordenados por átomos de oxigênios dos grupos carboxilatos
e de moléculas de água. O Zn2+ apresentou como geometria de coordenação uma bipirâmide
Abstract
In the present study isomers of 4,6-bis (aminocarbonyl) isophthalic acid (1), and 2,5-bis (amino-carbonyl) terephthalic acid (2) were obtained through reaction of anhydrous ammonia and pyro-mellitic anhydride in solution of dimethyl ketone at room temperature. The mixture (PMNH2) was characterized by physical methods. Quantum-chemical calculations were carried out for comparison with experimental results and for conformational analysis.Ab initiocalculations up to the B3LYP/6-311G∗∗+level were used to simulate the gas-phase geometry of the conformers: eight conformations of1, six of2and one of the 1,2,4,5 benzenetetracarboxylato (BTEC). Intra-molecular O−H· · ·O, N−H· · ·O and O−H· · ·N hydrogen bonds were observed and correlated to molecular stability. Crystalline samples grow in water solution of PMNH2, Cu2+, Zn2+ and
Co2+ ions and were analysed by means of X-ray single-crystals diffraction. Hydrolysis of the amide groups leads to formation of the salts: triaquacopper(II) 1,2,4,5 benzenetetracarboxy-lato dihydrate (C10H20O18Cu2;C2/c;a=12.116(2)Å,b=18.091(4)Å,c=9.5910(19)Å and
β =112.90(3)o; z=4); diaquazinc(II) 1,2,4,5 benzenetetracarboxylato (C5H5O6Zn; P21/n; a= 5.246(1)Å, b=16.320(3)Å, c=8.114(2)Å and β =97.95(1)o; z=4) and diaquaco-balt(II) 1,2,4,5 benzenotetracarboxylato trihydrate (C20H24O25Co3; P21/n; a= 9.521(2)Å, b =11.075(2)Å, c= 14.020(3)Å and β =104.13(2)o; z =4). The water molecules have an important role in the crystal structures, specially in the hydrogen bonding interactions and metal coordination. The former can be classified in mean and weak hydrogen bonds, since the d(H· · ·O) and D(O· · ·O) geometrical parameters are in the range 1.691(4)−2.574(5)Å for
the shorter, and 2.424(3)−3.099(3)Å for the longer hydrogen bonds, respectively. The ionic
sites are penta-coordinated (for Cu2+ and Zn2+ transition metals) and hexa-coordinated (Co2+)
by oxygen atoms from water and from carboxylate groups. In the crystal structure the Co2+ cations are separated by 3.553(1)Å. The distorted trigonal bipyramid coordination geometry of
Capítulo 1
Química Supramolecular
O termo química supramolecular foi introduzido primeiramente por Lehn em 1969[10, 11], de-vido aos seus estudos dos compostos de inclusão e dos criptatos. Em 1987 Pedersen, Cram e Lehn foram agraciados com o premio Nobel de Química pelo seus pioneirismos nos estudos de estruturas supramoleculares e na química de reconhecimento, e colocaram o tema definitiva-mente no cenário da química moderna. A Química supramolecular, de acordo com a definição de Lehn, é a química além das moléculas[10]. Essa definição é um tanto vaga e imprecisa, uma mais completa que envolve o termo supermolécula é também atribuída a Lehn e diz que uma supermolécula é uma espécie organizada, criada a partir da associação de duas ou mais espécies químicas mantidas juntas por forças intermoleculares.
Tendo em vista a definição que invoca as interações intermoleculares, a química supramo-lecular baseia-se nessas interações, tal como a química orgânica clássica baseia-se nas ligações covalentes[12]. Assim o entendimento da química supramolecular fundamenta-se no estudo das interações intermoleculares que mantém o sistema ligado e essas interações não são somente aditivas, são cooperativas.
Comparando as energias típicas de uma ligação covalente (200−400kJ mol−1) com as energias da interações intermoleculares, é claro que o segundo tipo tem valores muito menores, porém o número de interações desse tipo numa estrutura pode ser muito maior do que as de ligações covalentes. As interações intermoleculares eletrostáticas do tipo íon-íon têm valores de energia que variam de 4 a 40kJ mol−1, as ligações de hidrogênio de 1−80kJ mol−1e interações
não menos importantes, mas com contribuições energéticas menores (> 4kJ mol−1) tais como
as forças dispersivas de London, íon-dipolo induzido e interações dipolo-dipolo são típicas de estruturas supramoleculares. Em qualquer estrutura supramolecular um grande número de interações intermoleculares é possível, mas somente poucas são observadas de fato[10, 13].
interações intermoleculares têm papel decisivo nas propriedades dos mesmos.
De acordo com Desiraju[11] as interações intermoleculares podem ser divididas em duas classes: as isotrópicas (forças de médio alcance) e as anisotropias (forças de longo alcance). As primeiras estão relacionadas a moléculas individuais, um exemplo, são as forças de Van de Waals, definindo assim a forma individual de moléculas, o tamanho e também o empacotamento dessas. As forças anisotrópicas, por sua vez determinam a orientação intermolecular e envolvem átomos com cargas parciais.
A química de reconhecimento trata das supermoleculas que são capazes de reconhecer uma outra molécula específica, átomo ou íon de maneira a se ligar a esse de forma única, como se fosse uma chave com o seu segredo. O reconhecimento de um sítio é determinado pela geometria e também pelas interações não covalentes, ou seja, interações intermoleculares. Desta maneira, a química de reconhecimento torna-se objeto de estudo tendo o mesmo ponto de vista dos compostos supramoleculares. Exemplos de sistemas em que a química de reconhecimento está presente são as reações enzimáticas.
Tanto em sistemas supramoleculares quanto na química de reconhecimento, as ligações de hidrogênio são as interações intermoleculares que exercem maior influencia na estrutura. Resumidamente, em uma ligação de hidrogênio X−H· · ·A, o átomo de hidrogênio atua como uma ponte entre dois átomos, X que é nomeado doador e A, receptor. Os dois últimos sempre aparecem com um caráter eletronegativo, com uma carga parcial ou formal negativa. O átomo de hidrogênio, por sua vez, aparece com uma deficiência de elétrons, tendo então um caráter ácido.
Uma ligação de hidrogênio pode ser considerada forte ou convencional (20−40kJ mol−1) quando X e A aparecem como átomos muito eletronegativos, como na N−H· · ·O, por exemplo. Nos casos onde X ou A, ou ambos, são de moderados a fracamente eletronegativos, a ligação de hidrogênio é fraca ou não convencional (2−20kJ mol−1). Casos extremos envolvendo íons do tipo HF–2a força da ligação de hidrogênio pode alcançar valores aproximadamente covalentes (17kJ mol−1). As ligações de hidrogênio também não se limitam a somente a dois átomos,
pode se estender a outros átomos, formando assim ligações bifurcadas e trifurcadas. Por fim, temos as ligações de hidrogênio que vêem sendo mais recentemente estudadas, envolvendo as ligaçõesπ entre carbonossp2esp, tais como C−−C e C−−−C.
As ligações de hidrogênio devem ser tomadas como uma interação complexa, composta por uma mistura pronunciada de interação covalente, eletrostática ou de Van de Waals; como consequência tem-se um interação que abrange uma ampla faixa energética[9, 14].
1.1. ESTRUTURAS SUPRAMOLECULARES
possíveis e também na pouca diferença energética entre as diversas possibilidades. Então, como tentativa de predizer uma estrutura supramolecular, deve se usar grupos funcionais que maxi-mizem a força de um determinado tipo de interação, a fim de que essa se torne predominante na estrutura supramolecular[10, 13, 15].
A preocupação em prever como as interações intermoleculares influenciam na formação e na maneira como se formam as estruturas supramoleculares é objeto de estudo da Engenharia de Cristais. Na Engenharia de Cristais, a preocupação do cientista que trabalha com estrutu-ras supramoleculares é planejar e controlar o empacotamento cristalino para obter um cristal com propriedades específicas. A estratégia a para prever como as interações intermoleculares vão atuar no empacotamento cristalino é procurar por padrões adotados por grupos funcionais específicos e usar a robustez desses grupos para criar novas estruturas. Os grupos funcionais específicos que apresentam um padrão de comportamento em estruturas supramolecuares são chamadossynthons[11]. O que qualifica parte de uma molécula como sendo umsynthoné a sua repetividade, que é fundamental no sucesso da engenharia de cristais.
O desenvolvimento da engenharia de cristais está ancorado nas suas aplicações em ciência dos materiais, onde a alteração ou a obtenção de materiais com propriedades especificas atra-vés de uma síntese racional é planejada. As aplicações correntes para materiais desenvolvidos a partir da engenharia de cristais são na área de catálise[16, 17], onde a presença de poros é funda-mental, e estruturas supramoleculares podem ser obtidas com grandes volumes vazios dentro de seu cristal. Na área de dispositivos eletrônicos/magnéticos há também grandes aplicações[15], já que pode haver mudanças do estado químico dentro de um cristal sem alteração pronunciada na sua estrutura cristalina, graças a interações intermoleculares. Outras estruturas supramole-culares podem atuar como sensores, por apresentar propriedades específicas quando em contato com um determinado tipo de moléculas. No campo biomédico, estruturas supramoleculares podem ser utilizadas para o controle de radicais livres, como reagentes puramente quirais e não como uma mistura isomérica e também devido à presença de estruturas polimórficas, podem ser seletivas em alguns tipos de reações e além de agir como um fármaco[11].
1.1 Estruturas supramoleculares
Até recentemente, cristais orgânicos, inorgânicos e organometálicos eram tratados separados e independentemente. Com o avanço da química supramolecular, como área de investigação das interações intermoleculares e, em particular, da sua influência nas propriedades de compostos cristalinos, a segregação veio sendo suplantada pela unificação dos estudos estruturais com propriedades físicas e químicas específicas e comuns aos materiais[18].
1.1. ESTRUTURAS SUPRAMOLECULARES
que exibem propriedades pré-determinadas, utilizando o conhecimento das interações intermo-leculares que poderão compor predominantemente o arranjo cristalino. Este conhecimento pode ser resumido como um estudo correlacionado de estrutura e propriedades, as quais são direta-mente dependentes dos grupos funcionais presentes, que por sua vez são os responsáveis pelo tipo de interação intermolecular, podendo ser elas: i) de médio alcance; ii) longo alcance ou iii) fortes. As primeiras são interações isotrópicas, responsáveis pelo empacotamento molecular es-pecífico no cristal. O segundo tipo, de origem eletrostática, como as ligações de hidrogênio, são as responsáveis pelos efeitos mais tênues no cristal e também pela orientação das interações in-termoleculares. Por fim, o último tipo, é característico de ligações metal-metal, e metal-ligante e são importantes em sistemas orgânico-metálicos [1].
Os grupos funcionais presentes em uma molécula ou íon determinam a sua reatividade e também a maneira como essas vão interagir com a vizinhança. Considerando que determina-dos grupos funcionais interagem de maneira sistemática para formar ligações intermoleculares com a vizinhança, não é tarefa simples prever a estrutura cristalina formada. Analisando uma estrutura cristalina em termos das interações intermoleculares, deve-se reconhecer a unidade es-trutural que se repete, que são geralmente pequenas. Essas unidades geralmente são compostas de grupos funcionais e resultam em arranjos com direcionamento específicos. Devido à relevân-cia que estas unidades possuem na estrutura, assumiram a denominação específica desynthon. A relação entre uma molécula, grupos funcionais esynthonssupramoleculares é apresentada na figura 1.1.
Figura 1.1: Relação entre uma molécula, grupos funcionais esynthonssupramoleculares, adap-tado de Desiraju[1]
Deseja-se que um synthonseja capaz de formar muitas estruturas cristalinas distintas, ou seja, que ele tenha como atributo a facilidade de formar estruturas supramoleculares indepen-dente dos tipos de estruturas químicas ao qual ele se liga. Torna-se necessário então identificar
es-1.2. LIGAÇÃO DE HIDROGÊNIO
trutura de um cristal resulta efetivamente do planejamento dos synthons e isso pode ser feito conhecendo-se efetivamente as interações intermoleculares que ocorrem nessas estruturas, já que as mesmas são determinadas pelo tipo desynthonpresente.
Um cristal orgânico pode ser considerado uma estrutura supramolecular perfeita, pois as forças que são responsáveis pelo empacotamento molecular são fracas quando comparadas com as ligações covalentes presentes nas moléculas. Definindo de maneira mais abrangente, considera-se um cristal orgânico como uma rede onde as moléculas são os nós e as interações in-termoleculares são as conexões entre os nós. A classificação de um estrutura cristalina orgânica em redes de uma, duas ou três dimensões é de grande importância na engenharia de cristais por-que essas considerações revelam grande similaridade entre estruturas formadas por diferentes moléculas. Essa similaridade é explicada pela grande variedade de interações intermoleculares que podem aparecer em uma rede [1]. Em muitos casos, interações intermoleculares fortes, do tipo O−H· · ·O e N−H· · ·O, e também as fracas, tais como C−H· · ·X, halogênio-halogênio, ou até mesmo C· · ·H e C· · ·C são as interações responsáveis por conectar cada ponto da rede.
Para sistemas organo-metálicos os grupos ligantes vão se interligar aos íons metálicos de acordo com a coordenação mais adequada para aquele íon. A maneira na qual um íon metá-lico é coordenado por um ligante com átomos diferentes pode ajudar a predizer como será o empacotamento do cristal. Como os íons metálicos são situados freqüentemente no centro das estruturas moleculares, sendo então blindados por essas, fatores importantes nas estruturas mo-leculares poderão ser aplicados nesse sistema híbrido. As porções periféricas dos compostos de coordenação são essencialmente orgânicas, e sendo essas de suma importância no empacota-mento cristalino, a discussão do arranjo espacial desses compostos mistos pode ser aproximado a de uma estrutura orgânica-cristalina [1].
Existem estratégias para o desenvolvimento de estruturas cristalinas que formam redes uni, bi e tridimensional. Pode-se também trabalhar em uma rota retrossintética, analisando que tipo de grupos funcionais devem ser usados para se obter um determinado arranjo cristalino, com propriedades específicas.
1.2 Ligação de hidrogênio
1.2. LIGAÇÃO DE HIDROGÊNIO
considerava-se uma ligação de hidrogênio como sendo uma ligação química formada entre um átomo de hidrogênio e outros dois átomos. Porém, de acordo com a teoria de orbital de valên-cia, o átomo de hidrogênio possui somente um orbital estável (1s), permitindo que ele forme somente uma ligação covalente. Segundo Pauling, a atração do átomo de hidrogênio por dois átomos é fortemente atribuída a forças iônicas e que o número de coordenação do hidrogênio não poderia exceder a dois, devido ao fato que um terceiro átomo de coordenação aumentaria em muito a energia repulsiva do sistema[21]. A última definição foi considerada a mais apro-priada por quase meio século, sendo vastamente aplicada de 1950-60. Os estudos das ligações de hidrogênio ficaram estagnados nas duas décadas seguintes, e tomaram um forte impulso na década de 90.
Uma outra definição é dada por Desiraju[19] que diz que uma ligação de hidrogênio, X−H···A, é uma interação onde um átomo de hidrogênio é atraído por dois átomos, X e A, e que o átomo de hidrogênio atua como ponte entre esses dois.
As definições dadas anteriormente para a ligação de hidrogênio podem ser denominadas como clássicas [9]. Hoje se sabe que as ligações de hidrogênio são um fenômeno muito mais amplo do que as definições iniciais. Atualmente tem-se conhecimento de que ligações de hi-drogênio fortes se comportam como ligações covalentes em muitas das suas propriedades, en-quanto que outras são tão fracas que há dificuldade para distingui-las de uma interação de van der Waals. O fato do fenômeno ser tão amplo é que existem regiões contínuas de transição de diferentes efeitos como ligação covalente, ligações iônicas, interação cátion-π e interações de
van der Waals. Diante das dificuldades para definir limites para uma ligação de hidrogênio, é necessário que a sua definição seja mais geral e flexível. Pimentel e McClellan[9] deram a se-guinte definição: "Uma ligação de hidrogênio existe: i) se há evidência de uma ligação química; ii) se há evidência que essa ligação é envolvida estericamente a um átomo de hidrogênio já li-gado com outro átomo". Essa definição é muito interessante pois não define a natureza química dos participantes, não é feita nenhuma restrição em termos geométricos, porém o átomo de hi-drogênio já deve estar envolvido com uma outra ligação química. Uma falha dessa definição é que, se ela for aplicada com muito rigor, caracterizará interações que são puramente de van der Waals como sendo uma ligações de hidrogênio. Também interações de três centros e dois elétrons, onde os elétrons da ligação X−H são doados em direção a um centro eletro-deficiente, podem ser confundidas com interação do tipo ligação de hidrogênio. Para contornar tais proble-mas, foi proposta a definição que se segue[9]: Uma interação X−H···A é chamada de ligação de hidrogênio: i) se isso constitui uma ligação local; e ii) se X-H atua como próton doador para A. Esta segunda exigência implica que uma ligação de hidrogênio pode ser tratada como uma reação de transferência de próton, onde A é uma base.
1.2. LIGAÇÃO DE HIDROGÊNIO
respectivamente, como interação de hidrogênio simples, bifurcada e trifurcada.
A energia das ligações de hidrogênio pode ser expressada por uma soma de diferentes par-celas, onde a energia total é o somatório dos termos: eletrostático, polarização, transferência de carga, dispersão e um de repulsão. As características geométricas de cada componente são notadamente distintas. O termo eletrostático tem característica direcional e de longo alcance. O termo de polarização decresce rapidamente em um fator de r-4e o termo de transferência de
carga decresce agudamente, em uma razão de e-r. Os dois termos restantes são frequentemente combinados em um único contribuinte de van der Waals isotrópico. Outros autores[2], adici-onam mais um termo no somatório das componentes participantes na ligação de hidrogênio, o termo de energia covalente. Cada um desses termos terá um peso maior, dependendo da com-binação doador-receptor, e também da geometria da interação. De maneira geral, entre todos, o termo eletrostático reduz suavemente com o acréscimo da distância, o que faz que esse con-tribuinte seja dominante a longas distâncias . Em ligações de hidrogênio moderadas, o termo eletrostático é preponderante, mas o termo de transferência de carga e também o termo de van der Waals estão presentes. Para ligações de hidrogênio fracas, o termo de dispersão é maior do que o termo eletrostático. As ligações de hidrogênio que são consideradas fortes e muito fortes tem quase que totalmente a contribuição do termo covalente. Os modelos descritos são um tanto simplificados para descrever ligações de hidrogênio fortes, pois é forte contribuição covalente desta interação não pode ser negligenciada [9].
Nos casos em que a polaridade dos grupos X−H ou A, ou de ambos, for reduzida, ocorre a diminuição do termo eletrostático enquanto que o termo de van der Waals é muito menos afetado por essa mudança, assim esse último ganha peso e a ligação de hidrogênio que tinha características direcionais, ganha características isotrópicas. Face a tal, nos casos em que a polaridade de X−H e A for reduzida a zero, ocorre a transição de uma ligação de hidrogênio para uma interação de van der Waals, onde há interação entre dipolos ou dipolos induzidos, que têm um fator de dependência de r-6. De maneira análoga, na outra extremidade da escala de
energia, isto é, em direção a região de comportamento covalente das ligações de hidrogênio, também acontece uma transição.
Situação semelhante à descrita anteriormente é observada para uma ligação de hidrogênio simétrica, X−H−X, onde o H é compartilhado igualmente entre os dois átomos. Nesta situação não é possível distinguir entre o átomo doador e o receptor de prótons, ou entre uma ligação covalente ou não covalente X· · ·H.
1.2. LIGAÇÃO DE HIDROGÊNIO
são puramente coulombianas, contudo preservando a direcionalidade das ligação de hidrogênio.
Algumas interações são limítrofes entre ligações de hidrogênio e interação cátion-π. Quando
um doador de próton, por exemplo, o NH+
4, interage com uma nuvem π, os dipolos são
orien-tados em direção a essa nuvem, e a força dessa interação vai depender da polaridade desse grupo.
As ligações de hidrogênio existem em uma vasta extensão de comprimentos; apesar de não haver nenhuma barreira natural nessa faixa de valores, pode-se classificá-las como: fracas, for-tes e intermediárias. Jeffrey adicionou o termo moderado, para designar ligações de hidrogênio cuja energia se situa entre a energia nas moléculas de água e nos carboidratos, compreendendo valores de 4−15kcal mol−1. As ligações de hidrogênio com energias acima e abaixo dessa faixa são classificadas, respectivamente, como fortes e fracas [9]. Na tabela 1.1 são apresenta-dos parâmetros relacionaapresenta-dos aos três tipos de ligação de hidrogênio.
Tabela 1.1: Parâmetros referentes aos tipos de ligação de hidrogênio, adaptada de [9]
Forte Moderada Fraca
Tipo de interação Fortemente covalente Principalmente eletrostática Eletrostática/ dispersiva
Comprimento de ligação H· · ·A (Å) 1,2-1,5 1,5-2,2 >2,2
Relação X−H e H· · ·A X−H≈H· · ·A X−H < H· · ·A X−H≪H· · ·A
Direcionalidade Forte Moderada Fraca
Ângulo de ligação(o) 170-180 >130 >90
Energia de ligação (kcal mol−1) 15-40 4-15 <4
1.2.1 Ligações de hidrogênio fortes
A quase 60 anos, sabe-se que em algumas ligações de hidrogênio (X−H· · ·A) não se consegue precisar aonde o próton está ligado covalentemente[22], ele é atraído igualmente pelo grupos doadores de elétrons na ligação. Esse tipo de ligação de hidrogênio recebeu o nome de ligação de hidrogênio forte ou muito forte, e a representação da mesma passou a ser e X· · ·H· · ·A. O estudo dessas ligações de hidrogênio não tão comuns se dá principalmente por técnicas tais como espectroscopia na região do infravermelho e Raman, difração de raios X e de nêutrons e ressonância magnética nuclear de H1.
De maneira geral, uma ligação de hidrogênio forte tem valores de distância (X· · ·A) en-curtados em relação as outras ligações de hidrogênio, ângulos (X−H· · ·A) próximos da li-nearidade, e na espectroscopia de infravermelho surge uma banda muito larga [22] abaixo de 1500cm-1.
1.2. LIGAÇÃO DE HIDROGÊNIO
ligação de hidrogênio como uma reação de transferência de próton, um ligação moderada pode ser considerada um estágio inicial, enquanto que uma ligação forte pode ser considerada um estágio avançado de prototropismo.
O estudo das ligações de hidrogênio fortes foi iniciado em experimentos espectroscópicos em solução, assim, determinou-se que essas ligações são formadas somente se os valores depka
dos pares de receptor e doador na ligação forem da mesma ordem de grandeza. Se esses valores diferem muito, a ligação é moderada ou iônica, respectivamente seriam representadas como X−H· · ·Y e X–−H· · ·Y+ e sabe-se que o caráter covalente dessas duas últimas é diminuto. Como os valores depkasão definidos somente para soluções, outro parâmetro se faz necessário
para se estabelecer a formação de ligações de hidrogênio fortes, a próton afinidade (PA)[2].
Gilli e seus colaboradores estudaram extensivamente as ligações de hidrogênio fortes e esse estudo teve inicio com as ligações homonucleares, que são as ligações do tipo X−H· · ·X. Eles propuseram um modelo em que a energia da interação é dada pelo somatório de um termo cova-lente, um eletrostático e um repulsivo. A expressão matemática sugerida para o termo covalente é obtida assumindo que a ligação de hidrogênio é uma ligação covalente de três centros e qua-tro eléqua-trons que pode ser expressa pela combinação linear de duas estruturas de ressonância (−O−H···O=←→ −O–· · ·H−O+=). Para demonstrar a validade desse modelo teórico uma análise do banco de dados cristalográfico de Cambridge foi executada, sendo selecionadas as ligações de hidrogênio intra e intermoleculares com d(O· · ·O) 6 2,69Å e ângulo O−H· · ·O ≥ 165o. Os resultados obtidos[2] mostram que quanto menor a distância entre os átomos de oxigênio maior o caráter covalente da interação e para as ligações de hidrogênio muito fortes ( d (O· · ·O)6 2,50Å) pode considera-las como sendo uma interação de três centros e quatro
elétrons totalmente delocalizada. Além disso, para o caso de ligações de hidrogênio homonu-cleares a relação força/comprimento é valida para toda faixa de distâncias d(O· · ·O).
Com o aumento do caráter covalente da ligação de hidrogênio, percebe-se um aumento da distância O−H, e uma movimentação do próton em direção a uma posição simétrica em relação aos dois átomos de oxigênio[23]. Nas ligações de hidrogênio muito fortes, essa simetria final do próton exerce um papel fundamental na estabilização dessa ligação.
Essas ligações de hidrogênio homonucleares fortes e muito fortes aparecem em somente três classes distintas. Partindo-se das estruturas de ressonância (−O−H···O=←→ −O–· · ·H−O+=) pela adição de um elétron tem-se a formação da classe A, pela subtração de um elétron forma-se a classe B e por fim, quando se conecta os dois átomo de oxigênio por um sistemaπ conjugado
1.2. LIGAÇÃO DE HIDROGÊNIO
por um sistemaπ conjugado recebem do nome de RAHB (resonance assisted hydronge bond).
Figura 1.2: Três maneiras de se obter estruturas equivalentes partindo das estruturas de resso-nância propostas para as ligações de hidrogênio fortes homonucleares, adaptada de [2]
Exemplos de ligações de hidrogênio fortes e muito fortes homonucleares e seus parâmetros geométricos, vibracionais e de ressonância magnética podem ser encontrados no artigo escrito por Emsley [22]. Os valores encontrados nesse artigo são de ligações homonucleares formadas por di-haletos ânions (HX–
2), ligações do tipo O· · ·O e N· · ·N.
Em resumo, para as ligações de hidrogênio homonucleares tem-se que: i - ligações de hidrogênio fracas tem a predominância de forças eletrostáticas, mas à medida que as forças dessas interações aumentam, o caráter covalente aumenta também, ii- ligações de hidrogênio muito fortes são essencialmente ligações covalentes de três centros e quatro elétrons, iii - a ligação de hidrogênio mais forte deve ser homonuclear e simétrica, e somente nessa situação as duas formas de ressonância X−H· · ·X↔X· · ·H−X serão isoenergéticas eiv- a condição de
∆PAmínimo entre o doador e o receptor deve ser atendida.
1.2. LIGAÇÃO DE HIDROGÊNIO
mais parecidas forem as formas de ressonância, X−H· · ·Y↔X· · ·H−Y. Sendo assim é sim-ples estabelecer que uma ligação heteronuclear será, em regra, mais fraca que uma homonuclear, fato que também pode ser corroborado pela diferença dos valores dePAde X e Y.
Diante dos fatos expostos acima, inicialmente pode-se aumentar a força de uma ligação de hidrogênio heteronuclear pela introdução de substituintes químicos que consigam diminuir o ∆PA entre o átomo doador e receptor na ligação de hidrogênio e/ou faça com que o
con-teúdo energético das duas formas de ressonância X−H· · ·X↔X· · ·H−X seja o mais próximo possível[23].
Apesar de ser possível a formação de ligações de hidrogênio heteronucleares fortes, pou-cas estruturas foram identificadas até então, uma pequena perda de simetria no sistema leva a formação de uma estrutura molecular ou de uma estrutura iônica[9].
1.2.2 Ligações de hidrogênio fracas
Ligações de hidrogênio formadas por doadores e receptores fracos foram admitidas como sendo de pouca importância até antes da década de 80, quando esse panorama começou a mudar e hoje em dia sabe-se que esse tipo de interação é muito importante, tanto na química estrutural quanto na biologia[9, 3, 24, 19].
Uma boa definição para esse tipo de interação foi dada por Desiraju[19], que escreveu que uma ligação de hidrogênio fraca é uma interação do tipo X−H· · ·A, onde o átomo de hidrogênio forma uma ponte entre as espécies X e A, das quais uma ou ambas podem ser de baixa ou moderada eletronegatividade. Em particular, essa definição se torna apropriada porque não usa a palavra ligação, que tem um sentido químico intrínseco, na definição.
O primeiro exemplo dado de uma ligação de hidrogênio fraca foi a interação C−H· · ·O, contudo nem sempre ela foi considerada como pertencente a essa classe de interação inter-molecular. A idéia que o grupo C−H poderia ser envolvida, em uma interação eletrostática é atribuída a Glasstone, que em 1937 explicou a formação e as propriedades físicas de líquidos complexos como o dímero formado pela associação de clorofórmio e acetona. Logo em se-guida, espectroscopistas classificaram esse tipo de interação como uma ligação de hidrogênio fraca. Entretanto os 50 anos seguintes, o progresso no estudo dessas interações foi lento e em alguns períodos até estagnado.
1.2. LIGAÇÃO DE HIDROGÊNIO
Taylor e Kennard fizeram em 1982 um trabalho conclusivo em relação as interações C−H· · ·O, e as classificaram como ligações de hidrogênio onde o tipo de interação é eletrostático, ocor-rendo em certas faixas de distância (C· · ·O, 3-4Å) e de ângulos (C−H· · ·O, 90-180o)[25].
Nas ligações de hidrogênio fracas do tipo C−H· · ·O, grupos doadores fortes ou ativados, na média, tem menores distâncias de contato com o receptor que espécies menos ativadas. Para clo-roalcanos, a separação doador-receptor decresce do mais halogenado até o menos halogenado. Igualmente, ocorre um decréscimo da distância doador-receptor dos alcinos até os alquenos. Os resultados[3] descritos acima mostram claramente a influência da acidez do grupo C−H na força ou distância receptor-doador. Então há uma dependência direta da acidez do grupo doador e da distância característica da ligação de hidrogênio formada. Outro fator importante também é a polaridade do grupo C−H, onde um acréscimo na polarização desse grupo leva a uma diminuição da distância H· · ·O, por exemplo, distância de 2,2Å para o clorofórmio e 2,6Å encontrada para o grupo metil da acetona[26]. Para grupos fracamente doares é observado tam-bém o efeito da ativação, já que as distâncias C· · ·O das ligações de hidrogênio formadas por esses grupos decresce também com o grau de ativação dos mesmos, fato observado no CH3CN (3,33Å), SO(CH3)2(3,41Å) e CO(CH3)2(3,49Å)[26].
O efeito da basicidade do grupo receptor também exerce influência na força da ligação de hidrogênio formada, embora menos pronunciado que o efeito da acidez no grupo doador. Para um mesmo grupo doador, a variação do grupo receptor de C−−O, C−OH e C−O−C leva a variações de 0,1 Å ou mais. Os dados apresentados por Steiner[26] sugere a seguinte ordem de força para os grupos doadores mais comuns nesse tipo de ligação de hidrogênio: C−−O > NO2>
S−−O > C−OH > C−O−C. Essa ordem coincide exatamente com a ordem de polaridade desses grupos.
Em relação a direcionalidade da ligação C−H· · ·O para pequenas distâncias de H· · ·O (<2,4Å) observou-se que o ângulo da ligação de hidrogênio tende a linearidade[3, 25], sendo mais freqüente valores de ângulos na faixa de 150-160o. O resultado acima mostra que esse
1.2. LIGAÇÃO DE HIDROGÊNIO
Figura 1.3: Correlação da distância H· · ·O com o ângulo formado na interação C−H· · ·O em cristais de carboidratos, adaptado de[3]
Assim como nas ligações de hidrogênio fortes (por exemplo O−H· · ·O) em que a força da ligação O−H é reduzida e conseqüentemente o comprimento dessa ligação química aumenta[2], nas ligações de hidrogênio fracas observa-se o mesmo resultado, porém com uma intensidade bem menor [28]. O enfraquecimento da ligação C−H pode ser observado por espectroscopia na região do infravermelho e principalmente por difração de nêutrons que fornece resultados melhores. Steiner em um trabalho de revisão doCSD(Cambridge Structural Database) mostrou que há uma correlação entre o comprimento C−H e a distância H· · ·O, e que estatisticamente esse aumento de comprimento é na ordem de 0,01Å para contatos H· · ·O menores que 2,4Å.
Nas ligações de hidrogênio pode ocorrer um fenômeno conhecido como cooperatividade. As ligações de hidrogênio podem formar estruturas continuas, no caso dos cristais essas estrutu-ras permitem a formação de estrutuestrutu-ras bi e tridimensionais. Devido a polarização ou até mesmo a transferência de carga nessas estruturas continuas a soma da energia do sistema ligado é maior que a soma das energias individuais de cada ligação (E(H· · ·A)n> n·(H· · ·A))[14]. Dois
dife-rentes sistemas podem produzir esse efeito, o primeiro deles é causado por grupos funcionais que podem atuar como doador e receptor na ligação de hidrogênio simultaneamente, freqüente-mente formando cadeias do tipo Oδ–−Hδ+· · ·Oδ–−Hδ+· · ·Oδ–. A polarização mutua faz com
que cada ligação de hidrogênio tenha um ganho de aproximadamente 20% na sua energia[3]. O outro mecanismo, já discutido no tópico anterior é o RAHB (resonance assisted hydronge bond).
compor-1.2. LIGAÇÃO DE HIDROGÊNIO
tamento para ligações de hidrogênio do tipo C−H· · ·X. Um exemplo de sistema que pode atuar dessa maneira é o C−−−C−H···Y, que pode atuar como doador na ligação de hidrogênio ( C−H ) e pode ser também receptor na ligação de hidrogênio X−H···π simultaneamente.
Apesar das ligações de hidrogênio do tipo C−H· · ·O possuírem um pequeno conteúdo energético, elas são em alguns casos suficientes para dirigir um caminho de cristalização dentre um número de possibilidades distintas. Embora tenham uma pequena influência individual, a partir do momento que se formam um número grande dessas interações e na ausência de ligações de hidrogênio mais fortes, esse tipo de ligação de hidrogênio exerce papel relevante na estabilização de uma estrutura cristalina[27, 3], como esquematizado na figura 1.4, que mostra um sistema onde moléculas de água estão coordenadas por ligações de hidrogênio mais fortes e são substituídas por ligações C−H· · ·O.
Figura 1.4: Geometrias de coordenação equivalentes para grupos doadores diferentes, adaptada de [3]
Diante do exposto anteriormente, há evidencias suficientes para considerar as interações do tipo C−H· · ·O como ligações de hidrogênio, que possuem tal qual as ligações O−H· · ·O e O−H· · ·O, contribuintes eletrostáticos e interação atrativa de longo alcance. A força e o comprimento da ligação de hidrogênio C−H· · ·O depende da acidez do grupo C−H.
Tal como as ligações de hidrogênio fracas do tipo C−H· · ·O, outro tipo de ligação de hidro-gênio vem sendo muito estudada recentemente[9]. Essas ligações de hidrohidro-gênio se caracterizam pela presença de um receptorπ, que pode ser devido a existência de um anel aromático, de um
grupo alquino (C−−−C), alqueno (C−−C), etc. A representação mais adequada para esse tipo de ligação de hidrogênio é X−H· · ·π pois pode haver uma grande variedade de grupos
doado-res, desde grupos fortes O−H como também grupos fracamente doadores (C−H); além disso o grupo receptorπ apresenta uma ampla faixa de basicidade[9, 29, 19]. Ligações de hidrogênio
do tipo X−H· · ·π tem a sua importância em química estrutural e principalmente na biologia,
onde o estudo dessas ligações tem importantes implicações no planejamento de fármacos, onde esse tipo de ligação é responsável pela estabilização de biomoléculas[24, 11].
Uma característica interessante da ligação de hidrogênio X−H· · ·π é que mesmo tendo
um caráter muito hidrofóbico, é mantido alguma natureza eletrostática suficiente para que al-gum vestígio de ligação de hidrogênio ainda persista[24]. Vendo desta maneira, encontramos as ligações de hidrogênio X−H· · ·π na região transição entre ligação de hidrogênio e
1.2. LIGAÇÃO DE HIDROGÊNIO
seja, não há consenso em relação as propriedades direcionais do mesmo. Para as ligações de hidrogênio C−H· · ·πsendo o receptorπum grupo fenil, alguns autores, por exemplo, afirmam
que o grupo doador C−H interage com o centro do anel aromático, outros estabeleceram que o grupo doador interage com um ou mais átomos de carbono do anel[24].
As ligações de hidrogênio do tipo X−H· · ·π com doadores fracamente polares, como por
exemplo o C−H· · ·π, são interessantes de serem estudadas devido a larga faixa de polaridade
que esses grupos podem ter. Dentro desta idéia, um grupo em particular, C−−−C−H, se destaca por poder atuar como receptor e também como doador simultaneamente[29]. Essa importante característica pode levar à formação de cadeias e anéis, C−−−C−H· · ·C−−−C−H· · ·C−−−C−H ou O−H· · ·C−−−C−H· · ·O−H que são equivalentes topologicamente às cadeias formadas por liga-ções de hidrogênio com grupos O−H, evidenciando novamente o fenômeno da cooperatividade, os contatos contínuos aumentam a força de cada contado em relação à sua atuação individual.
Os resultados dos estudos apresentados por Steiner[29] mostram que, para curtos contatos de grupos C−H suficientemente ácidos com grupos receptoresπ (C−−−C, C−−C, arenos), essas interações possuem as propriedades essenciais para serem consideradas ligações de hidrogênio fracas. Do ponto de vista direcional, as ligações de hidrogênio exibem ângulos C−H· · ·π perto
da linearidade e valores pequenos de d(H· · ·π), abaixo de 2,5Å, que são parâmetros
caracte-rísticos de ligações de hidrogênio fracas. O espectro de infravermelho exibe o alongamento da ligação C−H, sendo a freqüência de estiramento para essa ligação diminuída de 20cm-1quando
comparado em soluções com solventes apolares, esse desvio é o mesmo encontrado para as ligações C−H· · ·O.
O fato de ocorrer ativação tanto no receptor e doador nas ligações C−H· · ·π e isso levar a
um aumento da força dessa interação é um bom indicativo que essas interações sejam ligações de hidrogênio[19].
Outros tipos de ligação de hidrogênio, menos comuns, são estudadas e caracterizadas como ligações de hidrogênio fracas. Ligações de hidrogênio denominadas por hidretos metálico, M−H· · ·A, e as ligações onde um metal de transição rico em elétrons (X−H· · ·A) são encon-tradas em compostos organometálicos[30, 9].
1.3. GRUPOS CARBOXILA EM ESTRUTURAS SUPRAMOLECULARES
1.3 Grupos carboxila em estruturas supramoleculares
O grupo carboxila é um dos mais fortes e comuns synthons encontrados em estruturas supra-moleculares. Isto ocorre devido à sua grande capacidade de complexar com metais e à possi-bilidade de formação de ligações de hidrogênio inter- e intramoleculares. Com essa gama de possibilidades, cristais contendo esse grupo podem exibir desde arranjos lineares até arranjos tridimensionais, dependendo principalmente da presença de um ligante e ou de co-ligantes que alteram a estrutura cristalina[31]. As estruturas cristalinas poliméricas formadas por ácidos carboxílicos são inerentemente polares,[20, 12] no estado sólido o grupo O−H do ácido pode adotar duas conformações distintas, uma synplanar e outra antiplanar para o ângulo diedral O−−C−O−H, 0o ou 1800 respectivamente. A primeira delas se mostrou de 2−4kcal mol−1
mais estável, dependendo da técnica empregada na determinação. Esse resultado é bastante consistente, já que a conformação antiplanar ocorre somente quando o grupo O−H participa de uma ligação de hidrogênio intramolecular, particularmente em ácidos di-carboxílicos 1,2 dissubstituídos. Abaixo, na figura 1.5 são mostradas as duas conformações.
Figura 1.5: As duas conformações encontradas para a hidroxila em cristais[4], (a) synplanare (b)antiplanar
Os ácidos carboxílicos podem formar ligações de hidrogênio bastante efetivas e direcionais levando freqüentemente à formação de dímeros não só em estado sólido como também em fase gasosa[32]. Os ácidos mono-carboxílicos geralmente formam anéis isolados devido a ligações de hidrogênio entre as moléculas ao longo de um eixo, raramente ocorrendo a formação de estruturas estendidas, por isso, eles não são muito utilizados na engenharia de cristais. A justi-ficativa para isso é que outras interações além da−C(O)−−O· · ·H−O exercem um importante papel na ordenação cristalina de longo alcance, além disso, a natureza centrossimétrica dos dí-meros na organização do cristal indica que os cristais serão tipicamente não polares[20]. Além das estruturas anteriores, ácidos mono-carboxílicos podem formar um tipo de estrutura rara em que cada carboxila está ligada a duas outras carboxilas vizinhas via O−H· · ·O, denominada
1.3. GRUPOS CARBOXILA EM ESTRUTURAS SUPRAMOLECULARES
Figura 1.6: Modos de interação dos ácidos carboxílicos, (a) dímero e (b) cadeia
Já os ácidos di-carboxílicos formam cadeias unidimensionais de moléculas em zig-zag[33, 31] que se estendem pela estrutura cristalina. Cada carboxila se liga a uma outra, via pares cíclicos de O−H· · ·O como mostrado na figura 1.7. Ácidos di-carboxílicos que contêm grupos carboxila que são antiparalelos entre si, frequentemente formam cadeias em que as moléculas são interligadas por simetria de translação, já os que contém grupos carbonila que não são antiparalelos não podem se ligar apenas pela operação de translação, tornando-se necessárias operações de simetria adicionais[4].
Figura 1.7: Cadeia infinita formada por ácidos dicarboxílicos
Quando se trata dos ácidos di-carboxílicos que são 1,2 dissubstituídos pode-se separá-los em duas classes, uma que contém ligação de hidrogênio intramolecular e uma que não tem. Conseqüentemente, as moléculas pertencentes à primeira classe podem interagir via uma liga-ção O−H· · ·O−−C, entre um doador O−H que não participa da interação intramolecular e um carbonila que participa, formando assim, não uma cadeia ligada por pares cíclicos, mas uma cadeia que se assemelha a umcatâmer. A figura 1.8 ilustra a situação.
Figura 1.8: Cadeias formadas por ácidos carboxílicos 1,2 dissubstituídos
Um exemplo de ácido di-carboxílico considerado excelente e simples para construção de estruturas planares é o ácido teraftálico. A rigidez e a disposição das carboxilas na posiçãopara
1.3. GRUPOS CARBOXILA EM ESTRUTURAS SUPRAMOLECULARES
Nos poli-ácido carboxílicos pode ocorrer a formação de estruturas cristalinas mais com-plexas. Dependendo da orientação espacial dos grupos e da presença de grupos volumosos nessas estruturas, muito dos poli-ácidos apresentaram estruturas poliméricas mais complexas, com duas e ou três dimensões de crescimento.
Os ligantes aromáticos poli-carboxílicos são bons para a construção de polímeros de coor-denação e estruturas supramoleculares, devido à sua boa coorcoor-denação com os metais de transi-ção.
O grupo funcional amida é constituído de uma carbonila (C−−O) ligada a um átomo de nitrogênio. As amidas podem ser primárias, quando somente um átomo de carbono é ligado ao átomo de nitrogênio, quando a mesma possui o número máximo de átomos de carbono ligados a ela, recebe o nome de amida terciária. As amidas são um importante grupo funcional porque é a ligação entre os aminoácidos que formam as proteínas dos sistemas vivos, além disso elas também são importantes nas estruturas supramoleculares e tem sido objeto de estudo na engenharia de cristais[20].
Em amidas primárias o grupo CO−NH2 é planar formando ângulos de ligação muito pró-ximos de 120o e a força eletrostática da ligação de hidrogênio é alcançada quando o vetor
da ligação N−H é colinear com os pares de elétrons livres do átomo de oxigênio, ou seja, quando o próton está direcionado ao par de elétrons livres, portanto longe da carga positiva do núcleo[34, 35, 36]. A ligação de hidrogênio ideal formada por amidas primarias, N−H· · ·O é provavelmente a mais linear possível e com os ângulos C−−O· · ·N e C−N· · ·O perto de 120o. Diante disso, a ligação de hidrogênio formada entre grupos amida que mais se aproxima da idealidade é dos dímeros, tal qual formada nos ácidos carboxílicos, que é a forma que apa-rece a maioria das amidas, formando assim uma ligação de hidrogênio centrossimétrica, como ilustrado pela figura 1.9[35]. O outro átomo de hidrogênio ligado ao átomo de nitrogênio, em grupos centrossimétricos, forma uma ligação de hidrogênio adicional com outro átomo de oxigênio de outra amida. Leiserowitz[35] determinou que as amidas que formam dímeros cen-trossimétricos podem se empacotar de três formas diferentes, que são assim classificadas pela operação de simetria responsável por formar a ligação de hidrogênio.
Figura 1.9: Dímero formado pelas ligações de hidrogênio centrossimétricas em amidas
1.4. O ÁCIDO 1,2,4,5 BENZENOTETRACARBOXÍLICO
que as formas diméricas são mais instáveis[4]. Nessas estruturas também há a possibilidade de formação de uma ligação de hidrogênio adicional pelo outro átomo de hidrogênio não envolvido com a carboxila do ácido, então esse pode interagir com algum grupo carboxila disponível na estrutura[4].
1.4 O ácido 1,2,4,5 benzenotetracarboxílico
Ligantes aromáticos e outros ácidos poli-carboxílicos rígidos são bons para serem usados na construção de estruturas supramoleculares e ou polímeros de coordenação, graças à sua capa-cidade de complexar metais em diferentes modos, formar ligações de hidrogênio com grande facilidade, e a sua excelente estabilidade química[37, 38, 39, 40, 41].
O interesse no estudo dos complexos formados por metais de transição e ligantes aromáti-cos poli-carboxíliaromáti-cos é devido a essas estruturas serem encontradas em aplicações bioquímicas, no estudo de interações magnéticas de longo alcance[42] através de unidades de ligação, com separações de 5-12Å entre os centros magnéticos, em dispositivos de memória[15], e em inú-meras aplicações industriais, como por exemplo na cobertura de metal e couro, em , no aumento da resistência térmica de polímeros, como agente antiestático para acabamento têxtil, em deter-gentes e na indústria de corantes[43]. As aplicações ligadas a e também em separação seletiva devem-se à porosidade do material, que pode ser ajustada por uma pequena variação nas condi-ções de formação da estrutura ou até mesmo por inserção de outras moléculas no meio[44, 16].
Um dos ligantes aromáticos policarboxílicos que se mostra adequado à construção de es-truturas supramoleculares é o ácido 1,2,4,5 benzenotetracarboxílico (H4BTEC), devido às suas
propriedades em formar interações intermoleculares fortes e em coordenar metais de transição. A presença de quatro grupos carboxila do H4BTEC permite a ele uma grande versatilidade ao
complexar com íons metálicos, já que esses grupos podem aparecer completamente ou parcial-mente desprotonados[45] induzindo assim uma coordenação variada que, como conseqüência, tem a formação de estruturas com alta dimensionalidade. Do ponto de vista da formação das estruturas supramoleculares, a presença de oito átomos de oxigênio carboxílicos eleva em muito o número de ligações de hidrogênio que pode se formar, como também o número de ligações de hidrogênio independentes, já que, dependendo das condições de formação dos cristais, esses átomos de oxigênio poderão atuar como doadores (se estiverem na forma ácida) nas ligações de hidrogênio ou como receptores, caso ocorram na forma de carboxilatos. A possibilidade de mu-dança na orientação das carbonilas em relação ao ângulo formado entre elas e o anel também é fator facilitador na formação de estruturas supramoleculares. O H4BTEC apresenta grande
simetria molecular, característica que é útil no processo de crescimento de cristais[40].
1.4. O ÁCIDO 1,2,4,5 BENZENOTETRACARBOXÍLICO
e nela o ácido encontra-se complemente protonado e diidratado. Todos os parâmetros geométri-cos encontrados para o resíduo orgânico estão dentro dos valores descritos por Allen et al[47], sendo que merece destaque que duas carboxilas desviam do plano do anel aromático de 17,9o enquanto que as duas outras se aproximam da perpendicularidade, apresentando um desvio de 74,4o. Esses desvios são causados pelo efeito de repulsão entre as duas carbonilas
adjacen-tes. Anormalidades também são observadas nos ângulos que compreendem dois átomos de carbono do anel e o átomo de carbono carbonílico, essas também são explicadas pelo efeito de repulsão entre as carbonilas adjacentes que ocasionou um abertura do ângulo de ligação para 122,4o. Logicamente, a orientação das carboxilas é função do ambiente químico, podendo
elas girarem livremente em busca de uma situação de energia mínima. A estrutura relada[46] forma uma rede tridimensional, onde quatro tipos de ligações de hidrogênio O−H· · ·O são formadas. Os resíduos orgânicos, como era de se esperar, formam uma cadeia e essas são em-pilhadas e unidas pelas duas moléculas de hidratação. Apesar de poder aparecer na forma de monocarboxilato até a de tetracarboxilato, as formas que são mais comumente encontradas são as que formam estruturas simétricas, ou seja o ácido duplamente desprotonado e totalmente desprotonado[44]. Na forma de H2BTEC2− há a formação de duas ligações de hidrogênio
O−H· · ·O intramolecular[48].
O H4BTEC é um importante material de partida para a industria plástica e o plástico puro
obtido com esse reagente é usado na indústria aerospacial devido às suas excelentes proprie-dades térmicas e mecânicas. Esse poliácido também é usado na separação de lantanídeos de soluções contendo MnII, CoII, MgII, etc, devido à sua natureza polidentada. Outra aplicação é
na cromatografia iônica, onde a solução formada dele é usado como eluente.
O derivado iônico, 1,2,4,5 benzenotetracarboxilato (BTEC), pode complexar facilmente com dois íons metálicos para criar uma cadeia usando um dos dois grupos carboxilato que estão em relaçãopara. Desta maneira os outros dois íons não coordenados com o metal usualmente são envolvidos em ligações de hidrogênio. Quando ocorre a protonação destes grupos, o que pode ser controlado pelo pH de trabalho, estes podem atuar como doador e ou receptor de elétrons nas ligações de hidrogênio, possibilitando a formação de complexas estruturas com alto grau de dimensionalidade[49].
1.4. O ÁCIDO 1,2,4,5 BENZENOTETRACARBOXÍLICO
Figura 1.10: Grupos carboxilatos encontrados em estruturas derivados do BTEC.
Assim, numerosos estudos foram realizados para um melhor entendimento das estruturas supramoleculares derivadas do H4BTEC e alguns metais de transição. Em alguns desses
tra-balhos encontra-se também outros ligantes orgânicos nas estruturas, esses por sua vez têm a função de promover variações na dimensionalidade das estruturas ou de formar ligações de hi-drogênio mais efetivas como é o caso de compostos aromáticos contendo nitrogênio[51][52]. Tendo em vista a excelente capacidade do H4BTEC em forma compostos supramoleculares,
especialmente os polímeros de coordenação tridimensionais contendo vazios estruturais[40] a inclusão de ligantes quelantes com átomos de nitrogênio como doadores pode inibir a expan-são, ou crescimento, das redes poliméricas e assim pode-se obter polímeros de coordenação com baixa dimensionalidade.
Estruturas derivadas do H4BTEC contendo o íon CuIIforam reportadas em 1982, na forma
de BTEC e recentemente procedeu-se o estudo de ligações de hidrogênio curtas em compostos contendo esse mesmo íon[53]. Nesse mesmo estudo foram caracterizadas estruturas contendo o di-hidrogênio 1,2,4,5 benzenotetracarboxilato (H2BTEC2−) e também o
benzenotetracarbo-xilato. Na primeira delas os ângulos de torção encontrados para os grupos carboxila se asse-melham ao encontrados por Takusagawa[46] e não foram encontradas ligações de hidrogênio intramolecular nessa estrutura, sendo as ligações de hidrogênio intermoleculares classificadas como moderadas. Um estrutura diferente da encontrada por Usubaliev foi caracterizada[37] recentemente e nessa estrutura observa-se que dois grupos carboxilatos posicionados em para
atuam como ponte entre dois centros metálicos, produzindo então uma estrutura que se estende em duas direções, 2D. As ligações de hidrogênio encontradas nessa estrutura formam uma es-trutura 3D em forma de canais. Além das eses-truturas citadas anteriormente, encontra-se também outras em que há inclusão de outros ligantes nitrogenados[37], sendo que alguns desses apre-sentaram propriedades magnéticas interessantes[37, 50, 54, 49].
Os íons ZnII aparecem em vários trabalhos[55, 48, 56, 57, 58, 17] complexados por
deri-vados do H4BTEC. Nos trabalhos de Diniz et al as estruturas reportadas são constituídas do
H2BTEC2−, o íon ZnII e águas de hidratação, produzindo uma estrutura cristalina onde o
1.4. O ÁCIDO 1,2,4,5 BENZENOTETRACARBOXÍLICO
trabalhos foram realizados com o objetivo da produção de estruturas supramoleculares deriva-das do H4BTEC com a inclusão de ligantes orgânicos nitrogenados[17, 57], devido à formação
de grandes redes estendidas com espaços vazios, compostos relatados são promissores nas pes-quisas de materiais que são capazes de absorverem gases, tais como NH3e CH4[17].
Um bom candidato para a construção de estruturas supramoleculares derivadas H4BTEC
é o CoII que possui um número de coordenação variável (4-6), tem grande flexibilidade em formar ligações coordenadas em larga faixa de comprimentos (1,9-2,4Å) e possui também ou-tras propriedades interessantes do ponto de vista da química de coordenação[59]. Algumas estruturas supramoleculares de derivados do H4BTEC com o CoII são hexacoordenadas por
átomos de oxigênio de moléculas de água unicamente[60, 59, 48], já outras estruturas exibem um coordenação mista[59], sendo composto por átomos de oxigênio carbonílicos e também providos de moléculas de água. Usando a técnica de síntese hidrotermal foram obtidos estru-turas supramoleculares em que o íon CoIIestá coordenado somente por oxigênios carbonílicos; essa característica confere a essas estruturas grande proximidade dos centros metálicos, que tem como conseqüência o aparecimento de propriedades magnéticas relevantes[59][44]. Es-truturas na forma de camadas de cátions e de ânions foram descritas para a mesma classe de derivados, contudo com a adição de ligantes orgânicos nitrogenados[61]. Além dessas estru-turas contendo doadores-N, outros exemplos de estruestru-turas que formam camadas aniônicas e que têm propriedades magnéticas devido à proximidade dos íons metálicos foram recentemente caracterizadas[52, 49, 17].
De maneira geral o H4BTEC e seus derivados oferecem grande possibilidade de formação
de estruturas supramoleculares de diferentes dimensionalidade e aplicações, merecem destaque complexos com NiII[62??, 51, 17], MnII[62, 44, 60] que formam estruturas com alto grau de dimensionalidade, com sítios vazios para adsorção de gases e propriedades de troca magnética.
Exemplos menos comuns de estruturas supramoleculares contendo derivados do H4BTEC
e de metais são as que contém AgII onde aparece um curto contato[63] para Ag−Ag e de es-truturas contendo VIII que apresenta um curioso comportamento magnético. Lantanídios[40] também são encontrados participando de estruturas supramoleculares com esse ligante e for-mam canais que são ocupados por moléculas de água, que podem ser retiradas da esfera de coordenação do metal facilmente liberando espaço nesses canais.
![Figura 1.1: Relação entre uma molécula, grupos funcionais e synthons supramoleculares, adap- adap-tado de Desiraju[1]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15699472.628794/19.892.141.809.694.931/figura-relação-molécula-grupos-funcionais-synthons-supramoleculares-desiraju.webp)
![Tabela 1.1: Parâmetros referentes aos tipos de ligação de hidrogênio, adaptada de [9]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15699472.628794/23.892.112.846.491.652/tabela-parâmetros-referentes-aos-tipos-ligação-hidrogênio-adaptada.webp)
![Figura 1.2: Três maneiras de se obter estruturas equivalentes partindo das estruturas de resso- resso-nância propostas para as ligações de hidrogênio fortes homonucleares, adaptada de [2]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15699472.628794/25.892.124.788.205.622/maneiras-estruturas-equivalentes-estruturas-propostas-ligações-hidrogênio-homonucleares.webp)
![Figura 1.3: Correlação da distância H · · · O com o ângulo formado na interação C−H · · · O em cristais de carboidratos, adaptado de[3]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15699472.628794/28.892.178.712.110.492/figura-correlação-distância-ângulo-interação-cristais-carboidratos-adaptado.webp)
![Figura 3.4: Termograma diferencial hipotético de um polímero, adaptado de [5]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15699472.628794/45.892.279.617.761.1020/figura-termograma-diferencial-hipotético-de-um-polímero-adaptado.webp)
![Figura 3.5: Esquema de um espectrômetro de massas por tempo de vôo (TOF), adaptada de [5]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15699472.628794/48.892.266.632.360.626/figura-esquema-espectrômetro-massas-tempo-vôo-tof-adaptada.webp)
![Figura 3.7: Fatores de espalhamento para diferentes átomos e íons em função de S = sinθ λ reproduzida de Luger[7].](https://thumb-eu.123doks.com/thumbv2/123dok_br/15699472.628794/50.892.179.758.113.489/figura-fatores-espalhamento-diferentes-átomos-função-reproduzida-luger.webp)