UNIVERSIDADE DE LISBOA FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA ANIMAL
Modulação das funções da célula dendrítica por variantes
clonais de Burkholderia cenocepacia isoladas de um doente
com fibrose quística
Marília de Jesus Santos Pereira
Dissertação
Mestrado em Biologia Humana e Ambiente
UNIVERSIDADE DE LISBOA FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA ANIMAL
Modulação das funções da célula dendrítica por variantes
clonais de Burkholderia cenocepacia isoladas de um doente
com fibrose quística
Marília de Jesus Santos Pereira
Dissertação
Mestrado em Biologia Humana e Ambiente
Dissertação orientada por:
Professora Doutora Maria de Guadalupe Cabral (orientação externa)
CEDOC – Faculdade de Ciências Médicas da Universidade Nova de Lisboa
Professora Doutora Augusta Gama (orientação interna)
Faculdade de Ciências da Universidade de Lisboa
PÁGINAS INICIAIS
:
AGRADECIMENTOS NOTA PRÉVIA
RESUMOS ÍNDICES
i AGRADECIMENTOS
Em primeiro lugar agradeço ao Departamento de Imunologia da Faculdade de Ciências Médicas e ao Instituto de Biotecnologia e Bioengenharia do Instituto Superior Técnico, por me receberem no seu laboratório, em particular às Professoras Doutoras Paula Videira e Isabel Sá-Correia pela oportunidade oferecida, por acreditarem no meu trabalho e pelo apoio no âmbito desta dissertação.
À minha orientadora, a Professora Doutora Guadalupe Cabral, pela amizade, preocupação, confiança, paciência e disponibilidade. Agradeço ainda a ajuda constante, o apoio na revisão desta dissertação e todos os conhecimentos que me transmitiu.
O meu agradecimento à Professora Doutora Augusta Gama pela disponibilidade de aceitar co-orientar este trabalho, pela amizade, simpatia e dedicação.
Às Doutoras Carla Coutinho e Zélia Silva e ao Doutor Hélio Crespo, pela amizade, ajuda e bons conselhos.
Às mestres Mylène Carrascal, Mariana Silva e Teresa Veríssimo e às mestrandas Graça Marques e Inês Iria, pela amizade, boa disposição, entreajuda e partilha de conhecimentos, tornando mais fácil e animado cada dia de trabalho.
Aos restantes membros de ambos os departamentos, por estarem sempre disponíveis para ajudar e ensinar, em especial à D. Glória e à D. Luísa pela simpatia e disponibilidade e à D. Filomena, pela boa disposição e companhia.
Quero agradecer também à Professora Doutora Deodália Dias pela coordenação no mestrado de Biologia Humana e Ambiente, por todo o apoio e motivação.
À minha família, pela presença constante e ajuda incondicional ao longo do meu percurso de vida, em particular aos meus pais, Vítor e Maria do Carmo, por todo o carinho, paciência, apoio, incentivo e por me ajudarem a ser quem sou hoje.
Às minhas amigas e companheiras de casa, Catarina e Filipa, pela amizade, por me ouvirem, ajudarem, encorajarem nas longas noites de estudo e pelas palhaçadas e momentos divertidos que passamos desde a licenciatura e que continuaremos a passar.
Aos meus amigos e aos “Fiches”, pelo companheirismo e amizade, em especial à Raquel Duarte e ao Gonçalo Lidónio, pela amizade desenvolvida ao longo destes dois anos de mestrado, por me ouvirem, animarem, por me fazerem sempre acreditar em mim sem desanimar, pelos momentos de descontração e divertimento e por serem grandes amigos.
iii NOTAPRÉVIA
Esta dissertação foi desenvolvida no âmbito de um projeto (orientado pela Professora Doutora Guadalupe Cabral) do grupo de Glicoimunologia1, liderado pela Professora Doutora Paula Videira, pertencente ao Centro de Estudos de Doenças Crónicas da Faculdade de Ciências Médicas da Universidade Nova de Lisboa (CEDOC/FCM-UNL).
O desenvolvimento deste trabalho deu origem à seguinte comunicação em forma de poster:
M.J. Pereira, C. Coutinho, A. Lopes, I. Sá-Correia, P.A. Videira, M.G. Cabral. 2013
“Modulation of dendritic cell functions by clonal variants of Burkholderia
cenocepacia isolated from a cystic fibrosis patient” – 36th European Cystic Fibrosis Conference, 12-15 June 2013, Lisboa Portugal.
1
Esta dissertação teve como referência a revista Immunology: The journal of cells molecules, systems
and technologies da British Society for Immunology, pois, é uma revista conceituada na área e na qual o
v RESUMO
As bactérias do complexo Burkholderia cepacia (Bcc) são responsáveis por infeções respiratórias severas em indivíduos suscetíveis, em particular doentes com fibrose quística (FQ). Estas bactérias são especialmente temidas devido à sua elevada transmissibilidade, à sua inerente resistência à terapia antimicrobiana e ao risco de síndrome da cepacia.
Tem sido descrito que Burkholderia cenocepacia, uma das bactérias mais virulentas do Bcc, possui mecanismos que lhe permite evadir a resposta imune do hospedeiro, através da modulação das funções de células fagocíticas. De entre estas, as células dendríticas (DCs) desempenham um papel essencial na defesa do hospedeiro contra agentes patogénicos invasores, relacionando a resposta imune inata e adaptativa. Contudo, o seu papel no desenvolvimento da estratégia evasiva de B. cenocepacia ao sistema imune do hospedeiro, permanece pouco esclarecido.
Para clarificar esta questão, neste trabalho foi estudada a interação das DCs com 4 variantes clonais de B. cenocepacia, isoladas de um mesmo doente com FQ. Concretamente, pretendeu-se verificar se existiam diferenças entre estas variantes ao nível de: internalização pelas DCs, capacidade de inibirem e/ou induzirem o processo de maturação das DCs, efeito na viabilidade das DCs e a consequência imunológica, em termos da ativação da resposta adaptativa. Demonstrou-se então que as variantes clonais consideradas mais virulentas, com base em dados anteriores, são as mais internalizadas pelas DCs. Todas as variantes, mas especialmente a última isolada imediatamente antes da morte do doente não induzem a maturação das DCs, processo que normalmente acontece nestas células em resposta a patogénios e que é essencial para ativar uma resposta adaptativa efetora. Foi também a última variante clonal isolada do doente que induziu mais morte celular (apoptose) nas DCs, reforçando a ideia de que é a variante mais virulenta. Apesar destes resultados, as DCs após internalização das várias bactérias, mas especialmente com a última variante, são capazes de estimular a expressão de IFN-γ em células T, sugerindo a indução de uma resposta adaptativa efetora. No entanto, este resultado não exclui a hipótese de que a modulação das funções das DCs pelos isolados de B. cenocepacia seja um importante contributo para restringir, pelo menos parte desta resposta, sendo necessário mais estudos para esclarecer este assunto.
vi Palavras-chave:
Complexo Burkholderia cepacia (Bcc) Células Dendríticas (DCs) Internalização Maturação Apoptose Ativação de células T Imunomodulação
vii ABSTRACT
Bacteria of the Burkholderia cepacia complex (Bcc) are responsible for severe respiratory infections in susceptible individuals, particularly patients with cystic fibrosis (CF). These bacteria receive special attention duo to their high transmission, inherent resistance to antimicrobial therapies and risk of cepacia syndrome.
It has been reported that Burkholderia cenocepacia, one of the most virulent Bcc bacteria, have mechanisms that allow the evasion to the host immune response by modulating phagocytic cells functions. Among them, dendritic cells (DCs) play an essential role in host defense against invading pathogens, creating a link between the innate and adaptive immune response. However, its role in the development of the evasive strategies of B. cenocepacia to elude host immune system, remains poorly understood.
To clarify this issue, in this work we studied the interaction of DCs with 4 clonal variants of B. cenocepacia isolated from the same CF patient. Specifically, we wanted to determine whether there were differences between these variants in terms of: internalization by DCs, ability to inhibit and / or induce the maturation of DCs, effect on the viability of DCs and immunologic consequence, in terms of activation of the adaptive response. It was demonstrated the clonal variants considered more virulent, based on previous data, were better internalized by DCs. All variants, but especially the last variant isolated from the patient, immediately before its death, did not induce DCs maturation, a process that typically occurs in these cells in response to pathogens which is essential to enable an adaptive effector response. It was also the last variant isolated from the patient which induced more cell death (apoptosis) in DCs, reinforcing the idea that this variant is more virulent. Despite these results, DCs after internalizing the various bacteria, but especially the last variant, is capable of stimulating the expression of IFN-γ by T cells, suggesting the induction of an effector adaptive response. However, this result does not exclude the possibility that the modulation of DCs functions by B.
cenocepacia clonal variants may be an important contribution to restrict, at least part, of
viii Keywords:
Burkholderia cepacia complex (Bcc) Dendritic cells (DCs) Internalization Maturation Apoptosis T cells activation Immunomodulation
ix ÍNDICE
Agradecimentos --- i
Nota Prévia --- iii
Resumo --- v
Palavras-chave --- vi
Abstract --- vii
Keywords --- viii
Índice de Figuras --- xiii
Índice de Tabelas --- xvii
Índice de Anexos --- xix
Abreviaturas e Siglas --- xxi
1. Introdução --- 1
1.1. Complexo Burkholderia cepacia e Burkholderia cenocepacia spp. --- 1
1.2. Relevância Clínica --- 3
1.2.1. Isolados Burkholderia cenocepacia spp. --- 7
1.2.2. O papel do Lipopolissacarídeo (LPS) --- 9
1.3. Sistema imunitário --- 11
1.3.1. Imunidade Inata --- 11
1.3.2. Imunidade Adaptativa --- 13
1.4. Células Dendríticas --- 16
1.5. Introdução ao tema de tese --- 20
2. Materiais e Métodos --- 23
2.1. Isolados de Burkholderia cenocepacia, meio, condições de crescimento e inativação. --- 23
2.2. Obtenção de DCs derivadas de monócitos humanos --- 25
2.2.1. Método de microesferas imunomagnéticas e coluna LS --- 25
2.2.2. Método de aderência celular ou “Panning” --- 27
2.3. Técnicas --- 28
2.3.1. Citometria de Fluxo --- 28
2.3.2.Reação de polimerização em cadeia em tempo real (RT-PCR) quantitativo --- 29
2.4. Avaliação da Internalização de B. cenocepacia pelas DCs --- 30
x
2.4.2. Ensaios de Internalização --- 31
2.5. Avaliação do estado de maturação das DCs na presença de isolados clonais de B. cenocepacia. --- 32
2.6. Avaliação da viabilidade celular das DCs na presença de isolados clonais de B. cenocepacia --- 33
2.7. Avaliação da consequência imunológica, em termos de ativação de células T, na presença dos isolados clonais de B. cenocepacia --- 35
2.7.1. Extração de RNA e transcrição reversa para DNA complementar (cDNA)---36
2.7.2. RT-PCR --- 36
2.8. Análise Estatística --- 38
3. Resultados --- 39
3.1. Estudo da internalização dos isolados clonais de B. cenocepacia por DCs 39 3.1.1. Internalização dos isolados clonais de B. cenocepacia viáveis, por DCs ---39
3.1.2. Internalização dos isolados clonais de B. cenocepacia inativados, por DCs---40
3.2. Avaliação da influência dos isolados clonais de B. cenocepacia na maturação das DCs--- 42
3.2.1. Maturação das DCs na presença de isolados clonais de B. cenocepacia viáveis --- --- 42
3.2.2. Comparação da maturação das DCs na presença de isolados clonais de B. cenocepacia viáveis vs inativados vs LPS --- 45
3.3. Avaliação da morte celular das DCs na presença dos 4 isolados clonais de B. cenocepacia --- 51
3.4. Análise das consequências imunológicas em termos de ativação de células T da incubação das DCs na presença de B. cenocepacia --- 53
4. Discussão --- 57
4.1. Os isolados clonais de B. cenocepacia mais virulentos são mais internalizados pelas DCs, quando viáveis --- 57
4.2. Os isolados clonais de B. cenocepacia inibem a expressão de alguns marcadores de maturação em DCs, quando viáveis --- 60
4.3. O último isolado de B. cenocepacia a ser recolhido afeta mais a viabilidade das DCs do que os isolados recolhidos numa fase mais precoce da infeção ---- 64
xi
4.4. Apesar dos isolados de B. cenocepacia inibirem a maturação das DCs,
conseguem induzir alguma ativação dos linfócitos T --- 65
Perspectivas Futuras --- 69
Conclusão --- 71
Bibliografia --- 73
xiii ÍNDICEDEFIGURAS
Figura 1.1 - Árvore filogenética do género Burkholderia --- 2
Figura 1.2 – Característica do epitélio das vias aéreas de um doente com FQ. --- 4
Figura 1.3 - Esquema ilustrativo da estrutura do lipopolissacarídeo (LPS) de uma
bactéria Gram-negativa. --- 10
Figura 1.4 – Esquema ilustrativo dos vários componentes da resposta adaptativa -
Resposta humoral e celular, iniciada por células dendríticas (DCs). --- 13
Figura 1.5 – Esquema ilustrativo da resposta imune --- 16
Figura 1.6 – Maturação das células dendríticas (DCs). --- 19
Figura 1.7 – Cronologia dos isolados clonais obtidos do doente J colonizado com B.
cenocepacia. --- 21
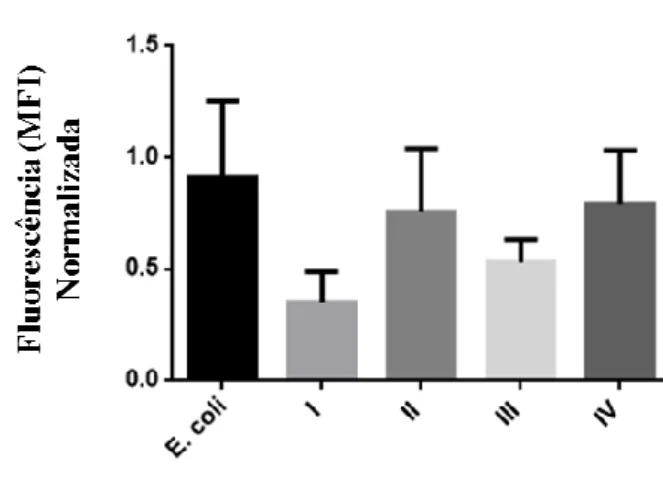
Figura 3.1 - Análise por citometria de fluxo da internalização dos isolados I, II, III, IV
de B. cenocepacia e E. coli (controlo), marcadas com FITC e viáveis, por DCs após 6 horas de incubação. --- 39
Figura 3.2 - Análise por citometria de fluxo da internalização dos isolados I, II, III, IV
de B. cenocepacia marcados com FITC e inativados (por calor) e E. coli (controlo, também marcada e inativada) por DCs após 6 horas de incubação --- 41
Figura 3.3 – Análise por citometria de fluxo da interação de DCs com cada variante
clonal de B. cenocepacia (isolados I, II, III ou IV), e E. coli. (controlo positivo), mostrando a expressão de HLA-DR na superfície de DCs após a incubação destas com as respetivas bactérias vivas. --- 43
xiv
Figura 3.4 – Análise por citometria de fluxo da interação de DCs com cada variante
clonal de B. cenocepacia (isolados I, II, III ou IV), e E. coli. (controlo positivo), mostrando a expressão de CD80 (a) e CD86 (b) na superfície de DCs após a incubação destas com as respetivas bactérias vivas. --- 44
Figura 3.5 – Análise por citometria de fluxo da interação de DCs com cada variante
clonal de B. cenocepacia (isolados I, II, III ou IV), e E. coli. (controlo positivo), mostrando a expressão de CD83 na superfície de DCs após a incubação destas com as respetivas bactérias vivas. --- 45
Figura 3.6 – Análise por citometria de fluxo da interação de DCs com cada variante
clonal de B. cenocepacia (isolados I, II, III ou IV), e E. coli. (controlo positivo), mostrando a expressão de HLA-DR na superfície de DCs após a incubação com as respetivas bactérias vivas (preto), inativas (cinzento claro) e LPS (cinzento escuro). -- 47
Figura 3.7 – Análise por citometria de fluxo da interação de DCs com cada variante
clonal de B. cenocepacia (isolados I, II, III ou IV), e E. coli. (controlo positivo), mostrando a expressão de CD80 (a) e CD86 (b) na superfície de DCs após a incubação com as respetivas bactérias vivas (preto), inativas (cinzento claro) e LPS (cinzento escuro). --- 49
Figura 3.8 – Análise por citometria de fluxo da interação de DCs com cada variante
clonal de B. cenocepacia (isolados I, II, III ou IV), e E. coli. (controlo positivo), mostrando a expressão de CD83 na superfície de DCs após a incubação com as respetivas bactérias vivas (preto), inativas (cinzento claro) e LPS (cinzento escuro). -- 50
Figura 3.9 – Análise por citometria de fluxo da viabilidade celular de DCs incubadas
durante 12 horas com cada um dos isolados de B. cenocepacia (isolados I, II, III ou IV), e E. coli. --- 52
xv
Figura 3.10 – Análise por citometria de fluxo da morte celular de DCs incubadas
durante 12 horas com cada um dos isolados de B. cenocepacia (isolados I, II, III ou IV), e E. coli ou na ausência de bactérias (DCs). Os resultados obtidos representam valores médios da percentagem de células vivas (azul), células em fase inicial de apoptose (vermelho), células em fase tardia de apoptose (verde) e células necróticas (roxo). ---- 53
Figura 3.11 – Análise da quantidade relativa de mRNA dos genes das proteínas IFN-γ
(a) e FOXP3 (b) entre as co-culturas de células T com DCs previamente incubadas durante 6 horas com cada um dos isolados de B. cenocepacia (isolados I, II, III ou IV),
E. coli (amostras em estudo) e as co-culturas de células T com DCs incubadas por igual
xvii ÍNDICEDETABELAS
Tabela 2.1 – Denominação dada a cada isolado no decorrer da dissertação. --- 24
xix ÍNDICEDEANEXOS
Anexo I - Constituição de soluções utilizadas neste trabalho --- 83
Anexo II – Figuras complementares deste trabalho --- 84
Anexo III – Resultados de trabalhos anteriores --- 89
xxi ABREVIATURASESIGLAS
7 - ADD - 7-amino-actinomicina D
APC - Aloficocianina (“Allophycocianin”)
APCs - Células apresentadoras de antigénios (“Antigen presenting
cells”)
ASL - Líquido de superfície das vias respiratórias (“Airway surface
liquid”)
Bcc - Complexo Burkholderia cepacia (“Burkholderia cepacia
complex”)
B. cenocepacia - Burkholderia cenocepacia B. cepacia - Burkholderia cepacia B.multivorans - Burkholderia multivorans
CD - Antigénios de diferenciação (“Cluster of differentiation”) cDNA - Ácido desoxirribonucleico complementar
CFTR - Regulador de condutância transmembranar (“Cystic fibrosis
transmembrane conductance regulator”)
CFUs - Unidades formadoras de colónias (“Colony forming units) Cl- - Iões cloro
CO2 - Dióxido de carbono
DCs - Células dendríticas (“Dendritic cells”) DGC - Doença Granulomatose Crónica DNA - Ácido desoxirribonucleico
E. coli - Escherichia coli
ENaC - Canal epitelial de sódio (“Epithelial sodium channel”) EUA - Estados Unidos da América
FITC - Isotiocianato de Fluresceína (“Fluorescein isothiocyanate”) FT-IRS - Espectroscopia de infravermelhos transformados de Fourier
(“Fourier transform infrared spectroscopy”)
FQ - Fibrose quística
FSC - Direção longitudinal (“Forward Scatter”) GAPDH - Desidrogenase gliceraldeído 3-fosfato
GM-CSF - Fator de estimulação de colónias granulócitos-macrófagos
(“Granulocyte macrophage colony-stimulating factor”)
HLA-DR - Antigénios leucocitários humanos (“Human leucocyte
antigens”)
IL - Interleucina IFN-γ - Interferon gama
IPS - Instituto Português do Sangue IST - Instituto Superior Técnico
LB - Luria-Bertani LPS - Lipopolissacarídeo
xxii
assisted laser desorption ionization time”)
MFI - Intensidade média de fluorescência (“Mean Fluorescence intensity”)
MHC-I - Complexo Major de Histocompatibilidade da classe-I (“Major histocompatibility complex – class I”)
MHC-II - Complexo Major de Histocompatibilidade da classe-II (“Major histocompatibility complex – class II”)
min. - Minutos µl - Microlitros mL - Mililitros
MLST - Tipagem de sequência multi locus (“Multi locus Sequence
Typing”)
mRNA - Ácido ribonucleico mensageiro Na+ - Iões sódio
NaCl - Cloreto de Sódio Na2CO3 - Carbonato de sódio
NK - “Natural killer” nm - Nanómetros
OD - Densidade óptica (“optical density”)
P. aeruginosa - Pseudomonas aeruginosa
PAMPs -
-
Padrões moleculares associados a patogénios (“pathogen-associated molecular patterns”)
PBMCs -
-
Células mononucleares do sangue periférico (“peripheral blood mononuclear cells”)
PBS - Tampão de fosfato salino (“Phosphate buffered saline”) PCL - Liquido Periciliar (“Periciliary Liquid”)
PE - Ficoeritrina (“Phycoerythrin”)
PI - Iodeto de Propídeo (“Propidium iodide”)
PRRs - Recetores de reconhecimento padrão (“Pattern recognition
receptors”)
PS - Fosfatidilserina (“Phosphatidylserine”) RPM - Rotações por minuto
rRNA - Ácido ribonucleico ribossómico
RT-PCR - Reação de polimerização em cadeia em tempo real
S. aureus - Staphylococcus aureus
SSC - Direção transversal (“Side scatter”) Tc - - Linfócitos T citotóxicos
TCR - Recetor de células T (“T cells receptor”) Th - Linfócitos T auxiliares (“T helper”) TLR - Receptor Toll-like (“Toll like receptor”)
TNF - Fator de necrose tumoral (“Tumor necrosis factor”) Treg - Linfócitos T reguladores
1 1. INTRODUÇÃO
1.1. Complexo Burkholderia cepacia e Burkholderia cenocepacia spp.
Burkholderia cepacia (B. cepacia) foi descrita primeiramente por Walter
Burkholder em 1950 ficando conhecida como Pseudomonas cepacia (P. cepacia), um agente associado ao apodrecimento bacteriano da cebola 1. Mais tarde, com a evolução das técnicas taxonómicas de análise genómica e sequenciação verificou-se que bactérias do género Pseudomonas eram fenotipicamente semelhantes, mas com diferenças significativas ao nível genómico (baseados na homologia do RNA) levando a uma reclassificação das suas espécies. Nomeadamente, P. cepacia juntamente com outras espécies do género Pseudomonas foram transferidas para o género Burkholderia, em homenagem ao trabalho de Burkholder 2.
Por volta dos anos 90, tornou-se evidente pelos métodos de identificação, a existência de uma grande heterogeneidade dentro da espécie B. cepacia, o que tornou difícil a sua correta identificação 2, levando Vandamme e os seus colaboradores 3 a realizar um estudo taxonómico polifásico. Este estudo incluiu a análise dos ácidos gordos, hibridação DNA-DNA e DNA-rRNA, que revelou que isolados de B. cepacia provenientes de amostras clínicas humanas como de doentes com Fibrose Quística (FQ), outras amostras clínicas humanas e do meio ambiente pertenciam a pelo menos cinco espécies genómicas diferentes ou genomovars, coletivamente referidos como Complexo Burkholderia cepacia (Bcc) 3.
O termo genomovar foi então introduzido para denotar espécies fenotipicamente semelhantes, mas geneticamente distintas 3, partilhando um nível relativamente baixo de homologia DNA-DNA (30-60%) 3. As espécies pertencentes a este complexo partilham uma elevada semelhança na sequência genómica do rRNA 16S (> 97,5%), possuem genomas grandes (7,5-8,5 Mb), constituídos por múltiplos replicões que lhes concedem grandes capacidades metabólicas (Fig.1.1) 4.
O Bcc é constituído atualmente por 17 genomovars distintos que se distribuem de forma heterogénea e ubíqua no ambiente 56, tendo grande capacidade de adaptabilidade e persistência, prosperando em múltiplos nichos 7, englobando um conjunto de bactérias patogénicas oportunistas contaminantes universais de soluções cosméticas, farmacêuticas, estéreis, água e equipamento descartável, levando a doenças nosocomiais e pseudoepidémicas. Por outro lado, em humanos, tem sido notavelmente associada a
2
infeções em indivíduos imunocomprometidos (indivíduos maioritariamente hospitalizados, com baixas defesas ou doentes suscetíveis) 6.
Figura 1.1 - Árvore filogenética do género Burkholderia – Parte do género Burkholderia em que são destacadas algumas espécies pertencentes ao complexo Burkholderia cepacia (adaptado de 4).
Muitas espécies são patogénicas para plantas, animais e humanos, o que deixa evidente a grande versatilidade e complexidade das interações que este género é capaz de estabelecer 8, 9. Nas últimas décadas tem emergido como patogénio oportunista, e desde então o interesse neste género de bactéria aumentou, e novas espécies foram descritas.
O genomovar mais comum do Bcc e que tem vindo a causar grande preocupação é
Burkholderia cenocepacia (B. cenocepacia), uma bactéria gram-negativa, em forma de
3
imprevisível e variável curso clínico, que varia do transporte assintomático a pneumonia necrotizante e septicemia 3, culminando com o rápido e incontrolável declínio da função pulmonar em 20% dos indivíduos imunocomprometidos 11, nomeadamente em doentes com FQ e Doença Granulomatosa Crónica (DGC), sendo uma das bactérias mais problemáticas para estes doentes 12, 13. Este patogénio é normalmente isolado a partir da expetoração de doentes com FQ e é transmissível entre eles, demonstrando multirresistência a fármacos antimicrobianos 10. Contudo a gravidade e morte resultante desta doença depende do estado clínico e predisposição dos indivíduos no momento de infeção.
1.2. Relevância Clínica
Nos anos 80, vários relatórios reportaram infeções de doentes com FQ com membros de Bcc (ainda não descrito nessa altura). Em 1984, foi descrita pela primeira vez a prevalência destes organismos, na colonização e infeção de doentes com FQ, conduzindo ao “síndrome da cepacia” – uma pneumonia necrotizante com septicemia que cerca de 20% dos doentes infetados com Bcc desenvolve e que conduz invariavelmente à sua morte. 2.
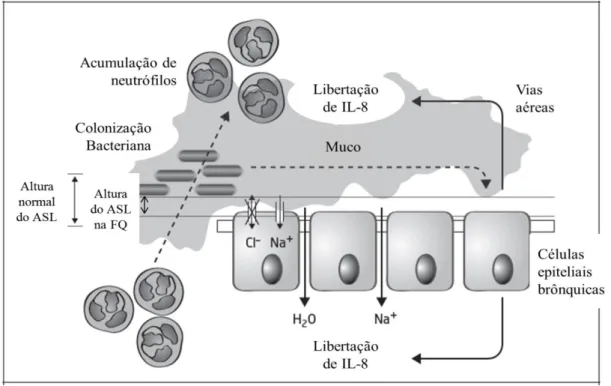
A FQ é uma desordem genética autossómica recessiva, normalmente letal, descrita pela primeira vez em 1938 14, que afeta maioritariamente caucasianos e é provocada pela mutação no gene CFTR que codifica para a proteína cística reguladora da condutância transmembranar da fibrose (CFTR). Esta mutação provoca alterações no controlo do movimento dos iões sódio e cloro, havendo bloqueio no efluxo destes últimos, através da membrana apical das células epiteliais glandulares, resultando no seu acúmulo intracelular 15, 16 (Fig.1.2).
A suscetibilidade destes doentes a patogénios deve-se à deficiência do sistema de
clearance mucociliar, que está normalmente ativo, atuando como barreira protetora
contra toxinas e patogénios, eliminando partículas e agentes infeciosos das vias aéreas, mas que, pela incapacidade de CFTR mutado, torna-se inativo, facilitando a colonização de uma camada de muco viscoso que é geralmente controlado pelo líquido de superfície das vias aéreas (ASL) 17.
O ASL é constituído por duas partes, o liquido periciliar (PCL) e o muco. O PCL está em contato direto com as células epiteliais e tem o papel importante de promover e
4
manter o batimento dos cílios, mantendo o ambiente com baixa viscosidade e separando o muco da superfície das células epiteliais. O muco, por sua vez, tem a função de remover os patogénios inalados, aprisionando-os e destruindo-os com as moléculas que o constituem e que têm atividade antimicrobiana, como a lisozima e a mucina. Esta é então uma importante barreira física e química da imunidade inata (ver secção 1.3.1) ao nível das vias respiratórias 18, 19.
Deste modo, para que o ASL consiga atuar na imunidade inata, é necessário manter uma baixa viscosidade no meio e o ASL hidratado. Neste caso, o balanço osmótico é mantido pelo transporte de iões Cl- para fora das células epiteliais, para que consequentemente haja inibição da entrada de Na+. O transportador CFTR expele o cloro, e regula negativamente o transportador de sódio, ENaC (canal epitelial de iões sódio). Como resultado há saída de água, mantendo assim o ASL hidratado 18, 19 (Fig.1.2).
Figura 1.2 – Característica do epitélio das vias aéreas de um doente com FQ – CFTR mutado provoca o aumento de produção de muco e um ASL reduzido e desidratado, facilitando a colonização microbiana por Pseudomonas e outras espécies. Os PAMPs (padrões moleculares conservados associados a agentes patogénicos microbianos) ativam a sinalização dos TLR (recetores toll-like) nas células epiteliais para aumentar o recrutamento de neutrófilos e a expressão de IL-8 (interleucina-8) para o lúmen do pulmão. Estes neutrófilos secretam fatores que ativam ainda mais o epitélio das vias aéreas levando à inflamação (adaptado de 20).
5
Com o transportador CFTR mutado, o transporte de cloro para fora das células é bastante reduzido ou nenhum, sendo que, contrariamente ao mecanismo anterior, o cloro entra para acompanhar o movimento do sódio, pois não existindo o controlo negativo sobre o transportador de sódio, ambos os iões entram nas células. Devido ao balanço osmótico a água entra também para as células epiteliais e como consequência, a concentração de muco aumenta bastante, e este fica aderente às células epiteliais, havendo achatamento dos cílios, e a não remoção dos patogénios, pois o aumento de viscosidade do muco (característica desta doença) dificulta a migração dos neutrófilos que acabam por não encontrar os patogénios, levando à infeção 17, 19 (Fig. 1.2). Esta adesão do muco coloca os patogénios em contato direto com as células, promovendo a partir daí uma resposta pro-inflamatória. Outras perturbações no sistema imune derivadas da mutação no gene CFTR têm sido documentadas, sendo a mais notada a fraca produção de radicais de oxigénio por parte dos fagócitos com vista a matar os patogénios fagocitados 18 (ver secção 1.3).
Dados clínicos sugerem que a doença pulmonar é iniciada por uma quebra do sistema de defesa das vias aéreas do hospedeiro e propagada pela incapacidade de limpeza eficaz da infeção 21.
Assim, a principal causa de morbilidade e mortalidade nestes doentes deve-se à infeção respiratória crónica e à resposta inflamatória sustentada por patogénios oportunistas como Staphylococcus aureus, P. aeruginosa, Haemophilus influenzae e principalmente B. cenocepacia 2.
Apesar dos mecanismos que possibilitam a colonização e a patogénese dos membros do Bcc não estarem ainda completamente esclarecidos, vários fatores de virulência têm sido identificados, como é o caso de adesinas associadas a pilus, flagelo, LPS (constituinte da parede das células das bactérias gram-negativas) e outros exopolissacarídeos 11, 13, sistemas de secreção do tipo II, III, IV e VI 22, 23, sideróforos, catalases e superóxido dismutases, proteases, lípases 11 e sistemas de “quorum sensing” (um sistema de resposta a estímulos, regulando a expressão de genes de acordo com a densidade populacional) 24. A distribuição dos fatores de virulência nas diferentes espécies do Complexo tem sido investigada, verificando-se a existência de diferenças na severidade da infeção de acordo com a (s) espécie (s) presente (s).
A rápida identificação da espécie do Bcc que infeta o doente é de extrema importância, como tal, vários esforços estão a ser feitos no sentido de melhorar o diagnóstico. Os métodos de identificação devem conseguir distinguir o Bcc de outras
6
bactérias gram-negativas, bem como, deverão conseguir distinguir qual a espécie dentro do Complexo. Para tal, normalmente são usados meios de crescimento seletivos, testes bioquímicos, amplificação de genes como 16S rRNA, recA 4 e outra combinação de 7 genes conservados de MLST (“Multi Locus Sequence Typing”) para identificar mais precisamente a espécie 25. Podem também ser usadas análises de todo o conteúdo celular dos ácidos gordos e proteínas tal como análises do genoma inteiro 4.
A infeção por B. cenocepacia é particularmente problemática, uma vez que pode ser transmitida de doente para doente 16, 21. Para além disso, a grande dificuldade de erradicação de B. cenocepacia prende-se com o elevado nível de resistência intrínseca a antibióticos clinicamente relevantes como aminoglicosídeos, polimixinas e à maioria dos -lactâmicos, uma vez que utiliza mecanismos de inativação enzimática, modificação de drogas, impermeabilidade da parede celular e bombas de efluxo ativo para sobreviver aos mesmos 16, 26. Tal resistência deve-se às constantes mutações que têm vindo a sofrer e ao aparecimento de novas estirpes, sendo que, estas e nomeadamente os isolados de doentes mostram-se mais resistentes a doses maiores e a um maior número de antibióticos 7.
Atualmente, B. cenocepacia e Burkholderia multivorans são as espécies que mais frequentemente se encontram nas infeções respiratórias dos doentes com FQ, afetando cerca de 90% destes doentes, tendo B. cenocepacia aumentado a sua prevalência nos últimos 5 anos, sendo a principal causa de morte destes doentes 16, 27.
Existem evidências crescentes de que as infeções persistentes causadas por B.
cenocepacia podem ser, em parte, devido à capacidade deste microrganismo invadir e
sobreviver intracelularmente em células humanas, sendo as principais células afetadas as células epiteliais respiratórias e os macrófagos pulmonares. Contudo os fatores bacterianos específicos envolvidos na persistência de B. cenocepacia no trato respiratório e a sua interação com componentes do sistema imune inato nos pulmões e vias aéreas ainda permanecem por esclarecer 28, 29.
Deste modo, os factos anteriormente descritos ilustram bem a relevância da variabilidade individual do doente e a sua capacidade de resposta à infeção por B.
cenocepacia, destacando assim a importância de perceber o papel da resposta imunitária
7
1.2.1. Isolados Burkholderia cenocepacia spp.
Durante a infeção crónica das vias respiratórias de um doente com FQ por B.
cenocepacia, esta bactéria apresenta uma evolução clonal com múltiplas variantes
fenotípicas, que se estabelecem nas vias aéreas. Esta ocorrência de evolução clonal durante a colonização pulmonar crónica deve-se possivelmente à pressão seletiva à qual estas bactérias estão sujeitas no ambiente pulmonar dos doentes com FQ, resultante, por exemplo, das defesas imunológicas do hospedeiro, da terapia antimicrobiana, da disponibilidade de nutrientes ou da limitação de oxigénio, tal como já foi descrito para
P. aeruginosa 5, 31.
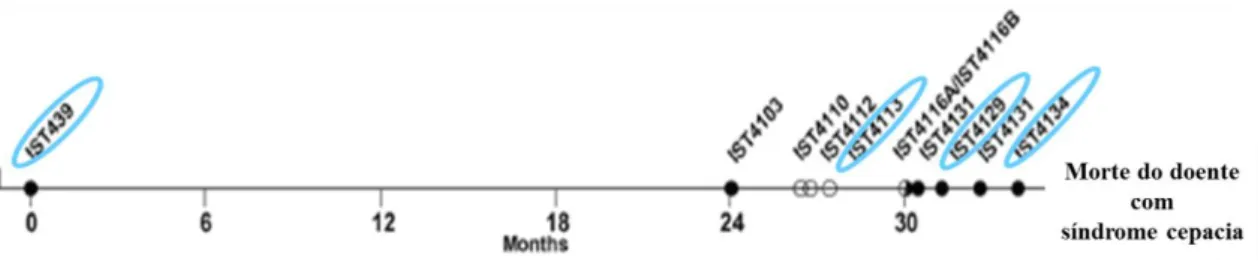
Num estudo realizado pelo grupo de investigação em Ciências Biológicas do Instituto de Biotecnologia e Bioengenharia do Instituto Superior Técnico (IBB/IST), em colaboração com o Hospital de Santa Maria, em Lisboa, foi feita uma avaliação fenotípica de uma série de características relevantes de 11 variantes clonais sequenciais de B. cenocepacia obtidas a partir do mesmo doente com FQ (doente J), que estava cronicamente colonizado com a mesma estirpe de B. cenocepacia, pelo período de três anos e meio, até à sua morte com síndrome da cepacia 5. Este estudo veio providenciar novos conhecimentos acerca da complexa estratégia desenvolvida por esta bactéria, de forma a adaptar-se às condições de stresse, tendo-se verificado de uma maneira geral, que do primeiro isolado até ao último, todas as variantes clonais obtidas ao longo do curso da infeção, sofreram alterações genéticas adaptativas relacionadas predominantemente com as vias metabólicas da bactéria, sendo que a alteração mais notada é a elevada resistência a antibióticos nos isolados após um período de tratamento agressivo 32.
Deste conjunto de 11 variantes clonais, 4 têm sido particularmente examinados, nos últimos anos, nomeadamente, o IST439, o primeiro isolado recuperado do doente, o qual se pensa ter iniciado a infeção; o IST4113, obtido três anos mais tarde, depois de um período de infeção exacerbada e terapia intravenosa, sendo considerado o mais resistente; o IST4129, isolado intermédio que apresenta características diferentes dos restantes, com baixa resistência a antibióticos e por fim, o IST4134, o último isolado recuperado do doente imediatamente antes da morte 32-34 (isolados também escolhidos no estudo desta dissertação pelas suas distintas características).
As propriedades do isolado que possivelmente inicia a infeção pulmonar (IST 439) diferem significativamente daquelas exibidas pelos outros isolados obtidos durante o
8
período de infeção que varia entre os 29 e 41 meses após o isolamento do 1º isolado. Assim, pode considerar-se que o IST 439 (designado nesta dissertação por isolado I) tem uma morfologia colonial lisa, forma alongada, um valor de potencial zeta negativo (medida indireta da carga da superfície celular), pouco hidrofóbico, com crescimento pouco eficiente quando limitado em ferro e com um tamanho de biofilme e exopolissacárido intermédio 5, 33.
Por outro lado, o isolado IST 4113 (designado nesta dissertação por isolado II) apresenta uma morfologia colonial áspera, grande tamanho celular e colónias rugosas em forma circular, tendo um valor zeta positivo e sendo mais hidrofóbico. Este isolado pode ainda ser caracterizado por um tamanho de biofilme e exopolissacárido maior que no isolado I, um grande enovelamento de proteínas e estabilização, sugerindo uma maior síntese de proteínas, atividade de reparação de DNA, capacidade de absorção de ferro e resistência ao stresse 5. Características que lhe conferem maior resistência a diferentes classes antimicrobianas como β-lactâmicos e aminoglicosídeos em relação a outros isolados, facto comprovado por Mira e colaboradores 33.
Em relação ao isolado IST4129 (designado nesta dissertação por isolado III) pode-se referir a sua pode-semelhança colonial com o isolado I, enquanto o isolado IST4134 (designado nesta dissertação por isolado IV) apresenta uma morfologia colonial intermédia e biofilme pequeno, sendo semelhante ao isolado II 5.
A análise comparativa das sequências genómicas destes isolados está em curso, pela equipa do IST, e os seus dados de proteómica quantitativa têm revelado que alterações no conteúdo de diferentes proteínas estão de acordo com as alterações na expressão genómica, nos diferentes isolados. Interessantemente foi também descoberto que os isolados II e IV têm maior capacidade de invadir as células epiteliais e abrir junções de oclusão numa linha celular de epitélio bronquial (Madeira et al., submetido).
De um modo geral, estas descobertas, reforçam o conceito do papel crucial dos mecanismos de adaptação de B. cenocepacia ao ambiente do hospedeiro no estabelecimento das infeções crónicas. No entanto, muito permanece ainda por esclarecer.
9
1.2.2. O papel do Lipopolissacarídeo (LPS)
Uma vez que para causar infeção nos seres humanos são necessários componentes bacterianos, vários estudos do Bcc focaram-se na identificação de fatores de virulência
35
a fim de desenvolver métodos para controlar patogénios gram-negativos e para curar o choque séptico (consequência grave da maioria das infeções bacterianas que gera falência generalizada dos órgãos). Deste modo, um dos fatores de virulência mais importantes das bactérias gram-negativas é a molécula lipopolissacarídeo (LPS) 36, um componente glicolipídico, essencial para a sobrevivência das bactérias gram-negativas, nomeadamente algumas patogénicas 37, 38, que se distribui pela superfície da célula bacteriana, induzindo uma grande resposta imune que pode levar a danos celulares 39. No caso das bactérias do Bcc, pensa-se que a infeção seja, pelo menos em grande parte, mediada pelo LPS.
O LPS consiste na ligação covalente entre um lípido e um polissacarídeo, sintetizado no citoplasma, atuando como um protótipo de endotoxina. Este pode ser reconhecido pelo recetor toll-like 4 (TLR4), um recetor presente na superfície das células imunitárias (como veremos na secção 1.3.1).
Este componente glicolipídico representa uma barreira defensiva que ajuda as bactérias a resistir a compostos antimicrobianos e ao stresse ambiental no qual estão envolvidas 36, destacando-se em processos de interações, adesões, reconhecimento e colonização bactéria-hospedeiro 40, sendo considerado o anfitrião da bactéria.
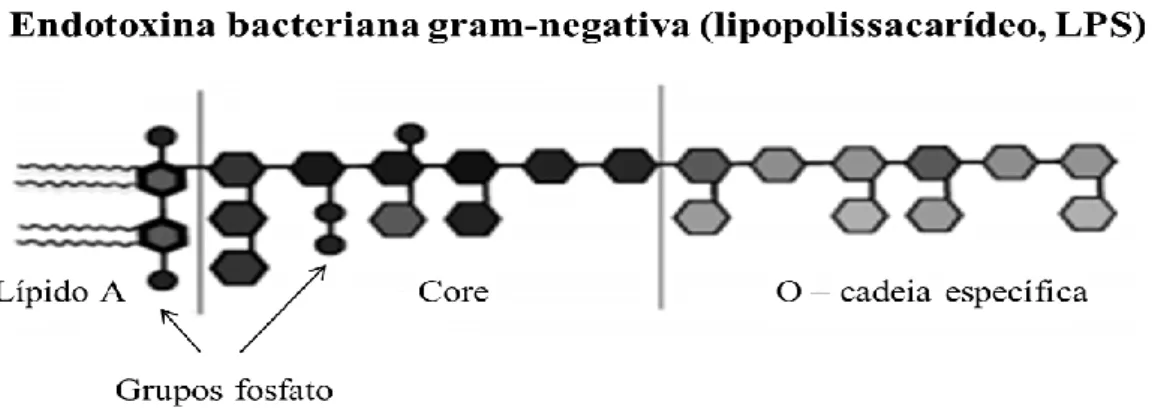
O LPS é constituído por três componentes, sendo eles, dois núcleos polissacarídeos, o antigénio O e o lípido A 37, 38 (Fig. 1.3). O componente antigénio O é um oligossacárido, que se localiza na superfície da célula bacteriana, sendo o componente estrutural principal do LPS que diferencia as várias estirpes bacterianas como
Escherichia coli, Salmonella enterica, e Vibrio cholerae. Este antigénio O não é
importante para a toxicidade da bactéria 39.
Por outro lado, a porção de lípido A localiza-se no folheto exterior da membrana, sendo a secção responsável pela toxicidade da molécula, originando efeitos tóxicos e consequentemente, induzindo graves respostas imunitárias 38.
10
Figura 1.3 - Esquema ilustrativo da estrutura do lipopolissacarídeo (LPS) de uma bactéria Gram-negativa. O LPS é constituído pelo antigénio O (cadeia de lipopolissacarídeo específico O), dois núcleos Oligossacáridos e o lípido A, componentes essenciais para a diferenciação de estirpes e virulência das bactérias (adaptado 36).
O antigénio é exposto na superfície mais externa da célula bacteriana, sendo um alvo para o reconhecimento e acolhimento de componentes do Sistema Imunitário.
Quando existem elevadas concentrações de LPS e as células bacterianas são lisadas pelo sistema imunitário, os fragmentos de membrana contendo lípido A são libertados para a circulação, causando diarreia, febre, e choque séptico, normalmente fatal. No entanto, em concentrações baixas, o lípido A, é um ativo imunomodulador, que pode induzir a resistência não específica tanto para bactérias como para infeções virais 38.
Tal como em outras bactérias gram-negativas, o LPS de Bcc induz uma forte resposta imunológica, nomeadamente através da indução da expressão de citocinas pró-inflamatórias, tais como, o fator de necrose tumoral (TNF), interleucina-6 (IL-6) e interleucina-8 (IL-8), o que contribui para a lesão das células do hospedeiro. Contudo estas bactérias contêm um LPS com uma estrutura pouco usual que diminui as cargas aniónicas da sua superfície celular, contribuindo para a inibição da ligação e subsequente efeito de antibióticos catiónicos, desempenhando um papel importante na resistência a muitos antibióticos 35.
Assim, embora ainda controverso, a função do LPS tem estado sob investigação experimental há vários anos, devido ao seu importante papel na ativação de vários fatores de transcrição e à produção de vários tipos de mediadores envolvidos no choque séptico, como o lípido A.
11
1.3. Sistema imunitário
O sistema imunitário tem como principal função garantir a integridade funcional do nosso corpo, protegendo-o e eliminando potenciais ameaças que o coloquem em risco. Deste sistema, fazem parte todos os órgãos, mecanismos de ação, células e moléculas que vão, especificamente reconhecer e eliminar uma enorme variedade de agentes invasores estranhos 41, 42.
Uma função exclusiva deste sistema é o reconhecimento, que permite discriminar o que é “próprio” (self) do que é “estranho” (non-self). Uma vez reconhecido o organismo estranho, o sistema imune recruta várias células e moléculas que se organizam na elaboração de uma resposta inata e adaptativa, de forma a eliminar e/ou neutralizar eficazmente o organismo estranho 42.
1.3.1. Imunidade Inata
A imunidade inata não é específica, no entanto oferece a primeira linha de defesa contra agentes estranhos ao corpo. Assim, alguns dos componentes desta imunidade são as barreiras físicas, como a pele, as mucosas epiteliais e movimento de cílios e fluidos, que conferem proteção não só fisicamente mas também pelas substâncias químicas por elas produzidas (mucinas, lisozimas, entre outras); o complemento; os fagócitos e as células “Natural Killer” (NK) 43
. Os fagócitos, sendo um dos principais componentes desta imunidade, compreendem os macrófagos, neutrófilos e as células dendríticas (DCs). Tanto os macrófagos como os neutrófilos são efetores importantes e estão envolvidos na remoção imediata dos agentes patogénicos através de mecanismos de indução de morte intracelular dos patogénicos fagocitados e recetores inflamatórios locais. Por outro lado, as DCs, apesar da sua capacidade fagocítica, não estão diretamente envolvidas na destruição de agentes infeciosos, contudo são potentes células apresentadoras de antigénios, conseguindo migrar rapidamente dos tecidos para os nódulos linfáticos, ativar os linfócitos em repouso e iniciar respostas imunes específicas, como irá ser desenvolvido mais à frente 44.
Assim, a eliminação dos patogénios pode ser efetuada direta ou indiretamente pelos neutrófilos, macrófagos e DCs, através do processo de fagocitose. Este processo inicia-se através do reconhecimento, por parte dos fagócitos, do agente infecioso diretamente pelos recetores celulares, ou indiretamente, pelos anticorpos ligados a esses agentes, que
12
assim facilitam a fagocitose, formando-se extensões de membrana dos fagócitos à sua volta devido a modificações do citoesqueleto, nomeadamente nos filamentos de actina, que após a fusão dessas extensões membranares formam um fagossoma, que maturado torna-se um fagolisossoma, dentro do qual o patogénio será destruído, pela ação de hidrolases e de radicais livres de oxigénio 45. Estas células estão envolvidas também no desencadeamento da resposta inflamatória, pela libertação de citocinas.
O reconhecimento inato é efetuado por recetores que reconhecem padrões moleculares conservados associados a agentes patogénicos microbianos (PAMPs) e que são referidos como recetores de reconhecimento padrão (PRR), reconhecendo padrões que não se encontram no organismo, sinal da presença de agentes patogénicos 46. Os PRR estão associados a células, como é o caso dos recetores toll-like (TLR). Estes recetores desempenham um papel chave no sistema imune inato, bem como no sistema digestivo, sendo expressos na membrana de células fagocitárias, como monócitos, neutrófilos, macrófagos e células dendríticas, que reconhecem os PAMPs, ativando a resposta imune 43.
Vários TLR são conhecidos, no entanto dois são especialmente encontrados em bactérias gram-negativas, nomeadamente TLR2 e TLR4. O TLR2 reconhece o lipopolissacarídeo (LPS) encontrado nas bactérias gram-negativas, tendo sido desde há muito reconhecido que a exposição dos mamíferos a pequenas quantidades de LPS purificado conduz a uma resposta inflamatória aguda, sendo que, o mecanismo para este efeito é a resposta através de um TLR em macrófagos que reconhece o LPS e provoca uma resposta inflamatória após a exposição 43. Por outro lado, TLR4 foi reconhecido em células CD14, funcionando como um dímero que depende de uma pequena proteína MD-2 (complexo recetor), para o reconhecimento de LPS. No entanto, CD14 também facilita a apresentação de LPS ao MD-2 39.Assim, a ligação a CD14 e/ou a TLR4 e/ou ao MD2, promove a secreção de citocinas pró-inflamatórias nos vários tipos de células, mas especialmente em macrófagos e células B.
Deste modo, os TLRs adquirem total relevância pois fazem o reconhecimento do patogénio e estimulam a resposta inflamatória contra agentes infeciosos, especialmente em bactérias gram-negativas porque estão presentes as proteínas e endotoxinas do LPS
39
. Quando as barreiras atrás referidas são quebradas, a resposta inata continua através de outros componentes humorais e celulares. Como componentes humorais temos o exemplo das proteínas pertencentes à via do complemento, que se encontram em circulação no sangue sobre a forma inativa, mas que na presença de infeção, interagem
13
entre si com a finalidade de eliminar o agente infecioso, quer promovendo a sua lise, quer facilitando a fagocitose e induzindo a resposta inflamatória 43.
1.3.2. Imunidade Adaptativa
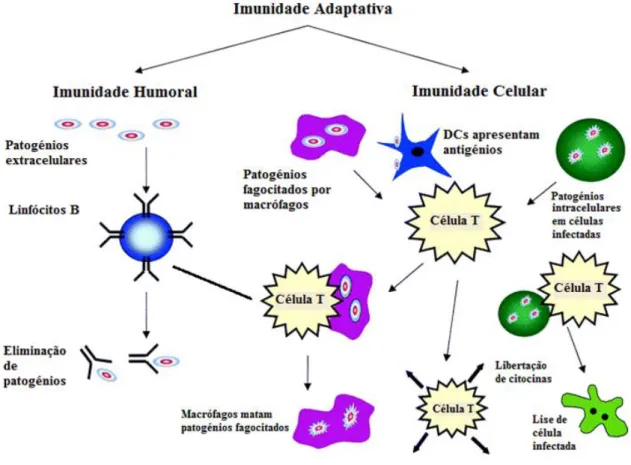
Enquanto a imunidade inata reconhece padrões comuns a todos os microorganismos, respondendo a todos de igual forma, a imunidade adaptativa (também conhecida por imunidade antigénio-especifica ou adquirida) é específica, pois reconhece diferentes moléculas em microorganismos distintos, dirigindo uma resposta específica para os mesmos. Este tipo de imunidade é caracterizado pela formação de uma memória imunitária, que permite a criação de respostas mais vigorosas quando há exposição repetida de um mesmo microrganismo 43. Esta imunidade pode ser dividida em dois tipos de resposta: a humoral e a celular (Fig. 1.4).
Figura 1.4 – Esquema ilustrativo dos vários componentes da resposta adaptativa - Resposta humoral e celular, iniciada por células dendríticas (DCs). As subpopulações de células T não se encontram diferenciadas neste esquema (adaptado de 47).
14
A resposta humoral é mediada por anticorpos, que reconhecem diferentes tipos de antigénios e promovem diversos mecanismos efetores (neutralização e fagocitose), sendo produzidos por linfócitos B, de forma a combater agentes patogénicos extracelulares e toxinas. De facto, quando um linfócito B reconhece um antigénio, inicia um processo de expansão clonal, em que as células originadas irão dividir-se entre plasmócitos produtores de anticorpos, e em células B de memória (Fig. 1.4) 48. Por outro lado, a resposta celular é mediada por linfócitos T (ou células T) que promovem a destruição de agentes intracelulares apresentados por fagócitos, ou mesmo células tumorais, ou segregam várias citocinas, que desempenham um papel central na ativação tanto de células T, como de células B e outras células que participam na resposta imune
43
. Contudo estes linfócitos T não reconhecem diretamente os antigénios como os linfócitos B 49.
Mais especificamente, existem dois tipos principais de linfócitos T: os T citotóxicos (Tc) e os T auxiliadores (Th,). Os linfócitos Tc, também designados CD8+ (pela
expressão da molécula CD8 na sua superfície), reconhecem antigénios intracelulares processados e apresentados à superfície da célula infetada, ligados a moléculas do Complexo Major de Histocompatibilidade de classe I (I). As moléculas de MHC-I encontram-se em todas as células nucleadas, e quando um antigénio intracelular é reconhecido pelos linfócitos Tc, estes exercem a sua toxicidade sobre a célula infetada, eliminando-a. Por outro lado, os linfócitos Th, também designados por CD4+ (pela
expressão da molécula CD4 na sua superfície), reconhecem antigénios extracelulares, processados e apresentados nas moléculas do Complexo Major de Histocompatibilidade de classe II (MHC-II), presentes nas células apresentadoras de antigénios (APCs), nomeadamente linfócitos B, macrófagos e DCs 48. Os linfócitos Th quando ativados
segregam citocinas com um importante papel na determinação do tipo de resposta imunitária. Assim, dependendo das citocinas que segregam, dividem-se ainda maioritariamente em três subpopulações: Th1, Th2 e Th17 (Fig. 1.5).
Os Th1 segregam elevados níveis de interleucina-2 (IL-2), fator de necrose
tumoral alfa (TNF-α) e interferon gama (IFN-γ) (citocinas pró-inflamatórias), sendo essenciais na promoção da imunidade celular (ativação de linfócitos Tc, macrófagos e
outras células), promovendo uma resposta mediada por células imunes contra patogénios intracelulares invasivos 50, 51. Por outro lado, os Th2 são importantes na
produção de anticorpos, produzindo uma variedade de citocinas anti-inflamatórias, incluindo a IL-4, IL-5, IL-6, IL-10, e IL-13, promovendo uma resposta imune humoral
15
contra patogénios extracelulares, prevenindo doenças parasitárias e estão envolvidos nas respostas alérgicas e produção de IL-17 52. Ambas as células Th1 e Th2 produzem
menores quantidades de TNF-α e IL-13 50, 51. Já os Th17 são importantes para eliminar
principalmente agentes microbianos e promovem bastante inflamação, combatendo também infeções extracelulares 53.
Algumas citocinas promovem claramente a inflamação e são chamadas de citocinas pró-inflamatórias, ao passo que outras citocinas suprimem a atividade das citocinas pró-inflamatórias e são chamados de citocinas anti-inflamatórias. A definição funcional das citocinas anti-inflamatórias é a capacidade destas inibirem a síntese de IL-1, fator de necrose tumoral (TNF), e outras grandes citocinas pró-inflamatórias. Por exemplo, IL-4, IL-10 e IL-13 são ativadoras de linfócitos B. No entanto, a IL-4, IL-10 e IL-13 também são citocinas anti-inflamatórias. O facto de estas citocinas também serem anti-inflamatórias deve-se à sua capacidade para suprimirem a expressão de genes de citocinas pró-inflamatórias, tais como IL-1 e TNF 54.
Portanto, um "equilíbrio" entre os efeitos das citocinas pró-inflamatórias e anti-inflamatórias é pensado para determinar o resultado da doença, seja a curto ou longo prazo. De facto, alguns estudos têm dados sugerindo que a susceptibilidade da doença é geneticamente determinada pelo equilíbrio ou expressão de qualquer citocina pro-inflamatória ou anti-pro-inflamatória 54.
A regulação da ativação das células T pelas citocinas anti-inflamatórias é um elemento crucial no controlo do início deste processo sendo que as citocinas produzidas no microambiente local definem o tipo de resposta moduladora que será gerada 50, 51.
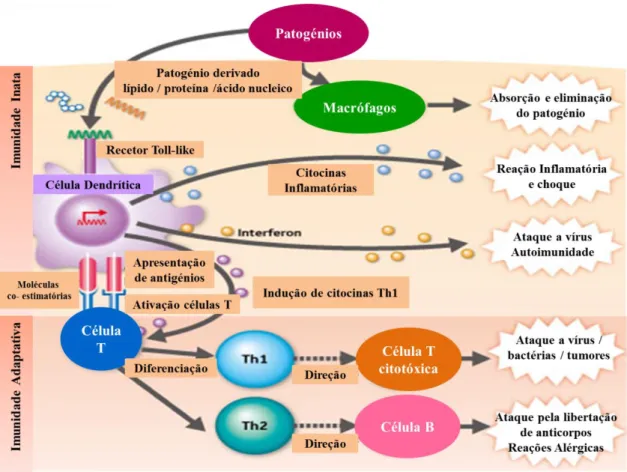
Como tal, para ativação e proliferação destes linfócitos, são então necessários três sinais. O primeiro sinal consiste no reconhecimento do péptido antigénico, que está ligado à molécula de MHC pelo recetor dos linfócitos T (TCR) 49. O segundo baseia-se na interação de membros da família de moléculas co-estimulatórias, como CD80 e CD86, antigénios de diferenciação presentes na superfície das DCs, com recetores CD28 ou CTLA-4 na superfície dos linfócitos T 55. Sinais adicionais, como citocinas provenientes de células da resposta inata e das DCs 56 são também essenciais (Fig. 1.5).
16
Figura 1.5 – Esquema ilustrativo da resposta imune – Resposta Inata e Adaptativa, iniciada por DCs ou
macrófagos, células capazes de ativar as células T de repouso e de iniciar uma resposta imunológica primária e de memória. Neste esquema as subpopulações de células T encontram-se diferenciadas (adaptado de 57).
Existem ainda os linfócitos T reguladores que têm um papel importante na regulação, manutenção e tolerância da resposta imune, podendo suprimi-la. Esta subpopulação de linfócitos também tem um papel relevante na tolerância do cancro, reprimindo respostas imunes anti-tumorias 58.
1.4. Células Dendríticas
As células dendríticas (DCs) foram descobertas por Ralph Steinman em 1973, são um componente essencial do sistema imune e estão presente em todos os mamíferos
59-61
17
celular diversa, localização anatómica (pele, vias aéreas, tecidos, sangue e espaços interstícios de órgãos linfáticos), estado de maturação e função imunológica 62, 63.
As DCs atuam como “sentinelas” do sistema imunitário, sendo fundamentais no início e regulação da resposta imune inata e adaptativa 64, estando envolvidas na captura e apresentação de antigénios e na indução de resposta pelas células T 65. Assim, as DCs são potentes células apresentadoras de antigénios (APCs), e as mais especializadas na ativação das células T de repouso, responsáveis por iniciar uma resposta imunológica primária e de memória, modulando o tipo de resposta imune adaptativa 44, 66.
O tráfico de DCs é crucial para a execução das funções normais das mesmas e está interligado aos principais recursos de DCs, como a maturação e a imunogenecidade 65.
A maturação destas células consiste num extenso processo de diferenciação dependente de estímulos e é irreversível, provocando alterações morfológicas, nomeadamente a perda de estruturas/placa de adesão, reorganização do citoesqueleto, aquisição de alta mobilidade celular (que permite a migração das DCs dos tecidos para zonas de linfócitos T nos nódulos linfáticos) e outras alterações fenotípicas e funcionais. Deste modo, a DC passa por dois estádios, o imaturo e o maturo 67.
No estado imaturo, as DCs encontram-se a “patrulhar” o microambiente em que se encontram, sendo caracterizadas por uma elevada capacidade de internalização e processamento de antigénios, apresentando uma baixa expressão de moléculas de MHC-II à superfície e outras moléculas co-estimulatórias (CD80, CD86 e CD83), capturando os antigénios que estão presentes por fagocitose (consiste na captura de microrganismos, ou fragmentos de células apoptóticas e necróticas, envolvendo um reconhecimento por recetores da superfície celular), macropinocitose (internalização de grandes quantidades de fluido extracelular e solutos nele dissolvidos, com formação de grandes vesículas) ou por endocitose mediada por recetores (processo semelhante à fagocitose, contudo, as pequenas partículas endocitadas ligam-se a proteínas recetoras específicas concentradas em determinados locais da membrana plasmática, formando uma pequena depressão na membrana que está coberta por clatrina) 43, 59, 67, 68. Esta captura é claramente relevante no processamento eficiente de antigénios e apresentação dos seus produtos aos linfócitos T via moléculas MHC 64. Após internalização dos antigénios, as DCs degradam-nos, transformando-os em pequenos péptidos que se vão ligar a moléculas MHC 49, 69, enquanto vão migrando da periferia para os nódulos linfáticos, através da linfa, onde os antigénios processados são apresentam às células T
18
promovendo a sua ativação (Fig. 1.6). Neste processo são libertadas citocinas pró-inflamatórias e quimiocinas que são estimuladas pela presença do antigénio 59, 63.
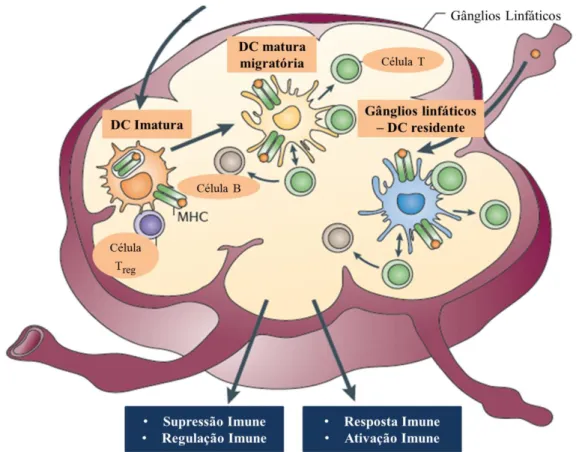
As DCs maturas perdem a capacidade de captura de antigénios mas tornam-se extremamente eficientes na apresentação de antigénios e ativação das células T, onde se inicia a resposta adaptativa (Fig. 1.6). No entanto, as DCs que chegam aos nódulos linfáticos imaturas, têm também um papel relevante na resposta imunitária, nomeadamente na indução de tolerância, podendo em vez de ativar a resposta imunológica efetora específica, impedir a eliminação ou favorecer a anergia do antigénio, sendo que esta sua vertente é também fisiologicamente muito importante, por exemplo para evitar a autoimunidade 70. Assim, a apresentação de antigénios derivados de microorganismos deverá resultar na ativação de células T efetoras, enquanto a apresentação de antigénios próprios deve levar à inibição das células T efetoras e ou ativação das células T reguladoras (Fig.1.6) 63. Esta ativação de células T é fortemente influenciada e controlada pelo tipo de sinais das DCs, nomeadamente pela expressão e produção de várias citocinas (como referido na seção 1.3.2), podendo comprometer a ativação T para distintas funções efetoras 71.
Alguns patogénios, no entanto, desenvolvem meios de modular as funções das DCs, suprimindo a sua maturação adequada, prevenindo uma resposta imune efetora, e/ou ativando uma resposta T reguladora, por forma a garantir a sua persistência no organismo e infeção bem-sucedida 51, 72.
De facto, os vários mecanismos que permitem a interação entre as DCs e os microrganismos, por exemplo, os vários tipos de recetores, com diferentes particularidades, modulam a função das DCs na direção adequada, nomeadamente conduzindo à expressão de diferentes sinais (tipo de citocinas e quimiocinas, grau de maturação), que influenciam criticamente o tipo de resposta imune contra os microrganismos em causa.
19
Figura 1.6 – Maturação das células dendríticas (DCs). No estado imaturo, as DCs capturam o antigénio por endocitose nos tecidos, migrando da periferia para os nódulos linfáticos através dos órgãos aferentes, onde os antigénios se apresentam às células T e as estimulam. Neste processo são libertadas citocinas pró-inflamatórias e quimiocinas que são estimuladas pela presença do antigénio, degradando-os em pequenos péptidos que se ligam a moléculas MHC, migrando posteriormente para os gânglios linfáticos. Aqui, as DCs maturas, apresentam os antigénios processados às células T dando inicio à resposta adaptativa (adaptado de 60).
As DCs têm também um papel importante na imunidade antitumoral, pois têm capacidade para apresentar antigénios tumorais às principais células T efetoras revertendo a tolerância patológica a tumores. Por essa razão, as DCs têm vindo a ser estudadas como possíveis vacinas celulares anti-cancro 66. Assim, melhorar as imunoterapias anti-cancro parece depender muito de como a imunogenecidade, sobrevivência e migração das DCs é regulada, pelo que, é muito importante encontrar formas que modulem a apresentação de antigénios, a capacidade migratória e a viabilidade das DCs 59.
20
1.5. Introdução ao tema de tese
As infeções respiratórias crónicas constituem uma das manifestações mais graves do quadro clínico dos doentes com FQ. As bactérias do Bcc têm surgido como os patogénios oportunistas mais temidos, dado o seu potencial para se propagarem, a sua inerente resistência à terapia antimicrobiana, o risco de síndrome de cepacia (pneumonia acompanhada por septicemia) e uma marcada redução na esperança média de vida destes doentes.
O Bcc tem assim ganho cada vez mais atenção por parte da comunidade científica devido ao perigo que representa para os doentes com FQ, estando em estudo os mecanismos de infeção e invasão e a sua interação com o hospedeiro.
Vários estudos parecem demonstrar que a adaptação das bactérias do Bcc ao pulmão dos doentes com FQ, sobretudo B. cenocepacia (espécie mais isolada nestes doentes), está associada à sua persistência e infeções invasivas. Sugerem ainda que estes patogénios possuam mecanismos que lhes permitam evadir-se da resposta imune anto-bacteriana do hospedeiro 13. Nomeadamente através de alterações na função normal das células fagocíticas e destruição destas 73. Os neutrófilos e macrófagos, que geralmente destroem os patogénios invasores, são ineficazes na eliminação de bactérias do Bcc, podendo ficar infetados, uma vez que estas bactérias podem ser capazes de sobreviver dentro destas células 29, 74.
As DCs, residentes no pulmão, atuando como mediadores cruciais entre imunidade inata e adaptativa em resposta a infeções pulmonares podendo, portanto, desempenhar um papel importante na patogénese das bactérias do Bcc. De facto, dados recentes da literatura, demonstraram que B. cenocepacia, ao contrário de B. multivorans, interfere com o normal funcionamento das DCs, induzindo uma resposta inflamatória acentuada (comprovado pelo aumento de expressão de citocinas pró-inflamatórias), inibindo a maturação das DCs após a fagocitose (como se verificou por análise dos marcadores de maturação e de co-estimulação CD80 e CD86), induzindo mesmo a sua morte celular (necrose) 73.
No entanto, não há muitos estudos posteriores que aprofundem esta questão ou clarifiquem os mecanismos subjacentes a esta modulação das DCs por B. cenocepacia.
Uma vez que patogenicidade das bactérias do Bcc, especialmente B. cenocepacia, pode estar relacionada com a sua capacidade de adaptação ao sistema imunitário do ambiente pulmonar do hospedeiro suscetível, e tendo em conta a enorme relevância das