EFICÁCIA E SEGURANÇA DE UMA VACINA ORAL DE
ROTAVIRUS HUMANO ATENUADO CONTRA
GASTROENTERITE GRAVE POR ROTAVIRUS, DURANTE
OS PRIMEIROS DOIS ANOS DE VIDA EM CRIANÇAS EM
BELÉM, PARÁ, BRASIL
Dissertação apresentada para obtenção do grau de Mestre em Doenças Tropicais, Núcleo de Medicina Tropical, Universidade Federal do Pará. Área da Concentração: Clínica das Doenças Tropicais.
Orientador: Prof. Dr. Alexandre da Costa Linhares Co-orientadora: Profa Dra. Eliete da Cunha Araújo
PROGRAMA DE PÓS-GRADUAÇÃO EM DOENÇAS TROPICAIS ÁREA DE CONCENTRAÇÃO: CLÍNICA DAS DOENÇAS TROPICAIS
MARIA CLEONICE AGUIAR JUSTINO
EFICÁCIA E SEGURANÇA DE UMA VACINA ORAL DE
ROTAVIRUS HUMANO ATENUADO CONTRA
GASTROENTERITE GRAVE POR ROTAVIRUS, DURANTE
OS PRIMEIROS DOIS ANOS DE VIDA EM CRIANÇAS EM
BELÉM, PARÁ, BRASIL
EFICÁCIA E SEGURANÇA DE UMA VACINA ORAL DE
ROTAVIRUS HUMANO ATENUADO CONTRA
GASTROENTERITE GRAVE POR ROTAVIRUS, DURANTE
OS PRIMEIROS DOIS ANOS DE VIDA EM CRIANÇAS EM
BELÉM, PARÁ, BRASIL
Dissertação apresentada para obtenção do grau de Mestre em Doenças Tropicais, Núcleo de Medicina Tropical, Universidade Federal do Pará. Área da Concentração: Clínica das Doenças Tropicais.
Orientador: Prof. Dr. Alexandre da Costa Linhares
Co-orientadora: Profa Dra. Eliete da Cunha Araújo
Data da aprovação: ___/___/______
Banca Examinadora:
_______________________________________ - Orientador Dr. Alexandre da Costa Linhares
_____________________________________ - Co-orientadora Dra. Eliete da Cunha Araújo
_____________________________________ Dra. Márcia Bitar Portela
_____________________________________ Dra. Rita Catarina Medeiros de Sousa
_____________________________________ Dra. Rosa Helena Porto Gusmão
Dados Internacionais de Catalogação-na-Publicação (CIP) Biblioteca do Núcleo de Medicina Tropical
_________________________________________________________ Justino, Maria Cleonice Aguiar.
Eficácia e segurança de uma vacina oral de rotavírus humano atenuado contra gastroenterite por rotavírus durante os primeiros dois anos de vida em crianças em Belém, Pará, Brasil: / Maria Cleonice Aguiar
Justino; Orientador, Alexandre da Costa Linhares. – 2009.
Dissertação (Mestrado) – Universidade Federal do Pará, Núcleo de Medicina Tropical, Programa de Pós-Graduação em Doenças Tropicais, Belém, 2009.
1.Vacina – Doenças - Tratamento. 2.Rotavírus - Belém. 3.
Gastroenterite – Belém. 4. Crianças – Doenças – Tratamento – Belém.I. Linhares, Alexandre da Costa, orient. II. Título.
Ao meu amado e inesquecível pai, cujos
ensinamentos de amor e sabedoria sempre estarão
presentes em minha caminhada.
Ainda ecoa em meus ouvidos o seu:
“_ Capricha garota!”.
À minha linda filha Maria Clara, cujo sorriso repleto de carinho e ternura me abastecia de amor nas solitárias madrugadas.
Ao meu pequeno Vítor por estar sempre próximo, a espreita de um “beijinho” da mamãe.
À filha do coração Letícia, que no auge da adolescência demonstrou sua enorme
generosidade cedendo‐me seu quarto para redigir essa dissertação.
Ao Dr. Alexandre Linhares, que me permitiu conhecer o real significado da palavra
Mestre, ao compartilhar de forma incomparável seu conhecimento científico. Expresso
aqui a minha eterna admiração e agradecimento pela maravilhosa oportunidade de
aprender consigo, todos os dias.
À Dra. Eliete Araújo, minha profunda gratidão pelos sábios conselhos sempre permeados
de doçura.
À colega Consuelo Oliveira, que me apresentou o fascinante mundo da pesquisa clínica.
Às minhas queridas companheiras de jornada, Yllen Miranda e Érika Abreu, pela valiosa
amizade e incentivo nos momentos mais difíceis.
Ao Dr. Lúzio Ramos pelo constante incentivo aos meus desafios profissionais.
Ao Instituto Evandro Chagas, por acolher os profissionais permitindo sua busca por
conhecimento.
À Coordenação do Curso de Mestrado, pelo empenho no aprimoramento do curso.
À toda a equipe do estudo Rota‐023, tão completamente empenhada na construção de
um sonho possível.
À equipe do estudo Rotavírus Caso‐Controle, pelo apoio incondicional , especialmente à
Lídia Piedade, incansavelmente atenciosa.
À Cláudia Sousa, que me ajudou com seus preciosos conhecimentos de informática.
À todos os pais/responsáveis legais, por terem permitido a participação de suas crianças
nesse estudo entendendo a importância de sua realização.
“Um sonho começa a ser realidade quando
homens e mulheres sonham juntos, olham para além
das limitações e ousam caminhar caminhos novos, às
vezes pedregosos, às vezes escorregadios, sempre
desafiantes.”
Abraham Lincoln
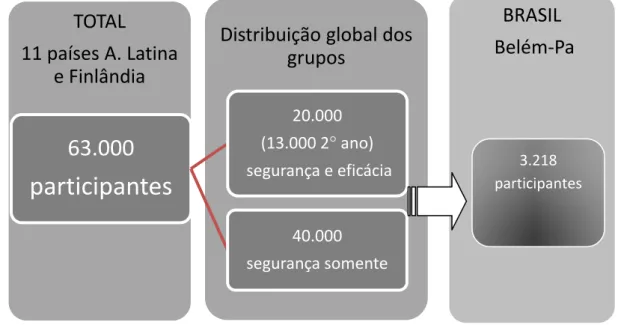
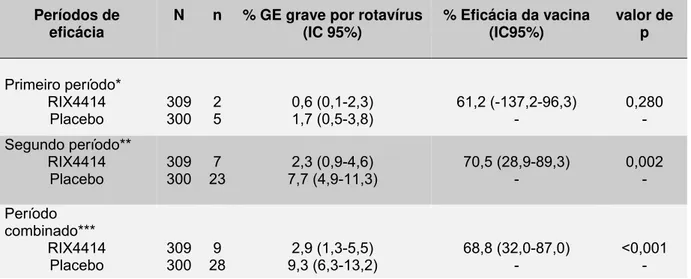
grave entre crianças com idades inferiores a 5 anos, tanto nos países desenvolvidos quanto naqueles em desenvolvimento, com pico de incidência entre 6 e 24 meses de vida. Em termos globais, estima-se que pelo menos 500.000 óbitos por ano se associem a esse enteropatógeno. Um extenso ensaio clínico de fase III, randomizado na proporção de 1:1, controlado por placebo e duplo-cego, envolvendo 11 países da América Latina e a Finlândia se levou a efeito objetivando-se avaliar a eficácia e segurança de uma vacina atenuada, de origem humana, contra rotavírus, denominada RIX4414. Na totalidade, recrutaram-se mais de 63.000 crianças. Em Belém, Pará, tais estudos envolveram 3.218 indivíduos aos quais se administraram duas doses de vacina ou placebo, no segundo e quarto meses de idade. Desse total avaliou-se um subgrupo de 653 crianças quanto à eficácia da vacina, com acompanhamento ao longo de 1 a 2 anos, quando se registraram 37 episódios de GE grave por rotavírus, 75,6% (28/37) dos quais no grupo placebo e 24,3% (9/37) entre os vacinados, daí se inferindo eficácia da vacina de 68,8% (IC95% 32.0-87,0) nos primeiros dois anos de vida. No que se refere à intensidade desses episódios, notou-se maior eficácia contra os classificados como muito graves (escore de Ruuska & Vesikari ≥ 15), alcançando níveis de 83% (IC95% 22-96). No grupo placebo observou-se risco cumulativo, quanto ao desenvolvimento de gastroenterite grave por rotavírus, 4 vezes superior em relação ao vacinado. Quanto aos sorotipos de rotavírus G1 e não-G1, evidenciou-se proteção de 51% (IC95% -30 – 81) e 82% (IC95% 37-95), respectivamente, denotando-se proteção tanto homotípica quanto heterotípica. De particular relevância se constituiu a proteção frente ao G9 [93% (IC95% 47-99)], dado o caráter emergente global desse sorotipo, além do seu potencial quanto a desencadear quadros diarréicos rotineiramente mais graves. A eficácia da vacina contra episódios de GE de qualquer etiologia alcançou 35,3% (IC95% 11,6-52,9), do que se depreende o expressivo impacto em potencial da vacinação contra rotavírus em termos de saúde pública. No que se refere à segurança desse imunizante, não se observaram diferenças significativas do ponto de vista estatístico, entre os grupos vacina e placebo, no que concerne à ocorrência de eventos adversos graves. Não se registrou qualquer caso de intussuscepção entre os sujeitos participantes, mercê de extensiva vigilância ativa nos hospitais de referência. Os resultados encontrados nesse estudo corroboram os já descritos em ensaios multicêntricos como um todo, em vários continentes, consolidando os indicadores quanto à eficácia e segurança da vacina RIX4414 quando administrada em duas doses a crianças saudáveis.
Palavras-chave: Rotavírus. Vacina. Gastroenterite. Eficácia. Segurança.
Rotaviruses are recognised as the leading cause of severe gastroenteritis in children aged less than five years in both developed and developing countries, with highest incidence rates between 6 and 24 months of life. On a global scale, recent estimates indicate that annually rotaviruses cause at least 500,000 deaths. A large phase III clinical trial was undertaken in 11 Latin American countries and Finland with an attenuated, human-derived vaccine strain, including recruitment of more than 63,000 children. This was a randomised, double-blind, placebo-controlled trial in which more than 63,000 infants were randomly assigned to receive two oral doses of either RIX4414 or placebo at a proportion of 1:1. The main purposed of this study was to evaluate both protective efficacy and safety of RIX4414. As part of the original study, 3,218 children were enrolled in Belém, Pará, to whom two doses of either vaccine or placebo were administered at 2 and 4 months of age. A subset of infants (n = 653) was evaluated throughout 1 – 2 years in order to assess efficacy of RIX4414 vaccine. Overall, 37 gastroenteritis episodes of severe rotavirus gastroenteritis were recorded of which 75.6% (28/37) and 24% (9/37) in the placebo and vaccine recipients, respectively. The level of rotavirus vaccine protection was higher [83% (CI95% 22 – 96)] against very severe rotavirus gastroenteritis, yielding a ≥ 15 score as calculated with a 20-point Ruuska & Vesikari scale. The cumulative hazard of a first episode of severe gastroenteritis was about four-fold lower in the vaccine group throughout the 2-years’ efficacy period, as compared to the placebo group. The protection rates against severe gastroenteritis caused by G1- and- non-G1 serotypes were 51% (CI95% -30-81) and 82% (CI95% 37-95), respectively, denoting efficacies against rotavirus strains both homologous and heterologous to the vaccine strain. Of importance, the vaccine afforded significant protection [93% (CI95%47-99)] against G9 serotype which has been regarded as a globally emergent strain, besides of being related to more severe gastroenteritis. Also reflecting a vaccine efficacy, there was a significant reduction, by 35.3% (CI95% 11.6-52.9), in the rate of all-cause hospitalisation for gastroenteritis, a finding of potential major public health impact. With regards to safety of RIX4414 vaccine, there were no overall statistically significant differences when the rates of serious adverse events were compared for vaccine group and placebo group. No cases of intussusception were reported during the entire follow-up period, through broad and active surveillance in paediatric clinics in the study area. Results obtained in this study confirm previous findings from worldwide several multi-centric trials that sustain both protective efficacy and safety of RIX4414 when administered in a 2-dose schema to healthy infants.
Figura 1 – Representação esquemática da partícula viral de rotavírus 22 Quadro 1 – Diversidade antigênica dos rotavírus 23 Figura 2 – Representação esquemática dos eventos relacionados à indução de
diarreia por rotavírus e arquitetura normal do intestino delgado 27 Quadro 2 – Composição das vacinas licenciadas 55 Quadro 3 – Intervalos entre as visitas/contatos do estudo 64 Figura 3 – Fluxograma das visitas de seguimento durante o estudo 66 Figura 4 – Recrutamento e distribuição global dos grupos (11 países da América
Latina e Finlândia) 68
Figura 5 – Distribuição dos grupos no Brasil, Belém, Pará 69 Quadro 4 – Composição da vacina RIX4414 e placebo 70 Quadro 5 – Sistema de avaliação clínica da intensidade das gastroenterites (Ruuska
& Vesikari, 1990) 74
Figura 6 – Distribuição dos sujeitos entre os grupos e perdas ocorridas ao longo do
seguimento 77
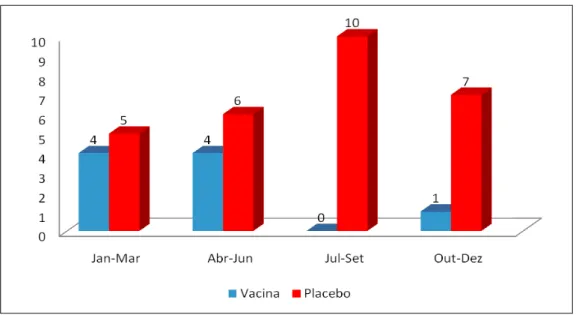
Gráfico 1 – Distribuição dos episódios de GE grave por rotavírus de acordo com o
intervalo entre as visitas 80
Gráfico 2 – Distribuição temporal dos episódios de GE grave por rotavírus nos
grupos vacina e placebo 81
Gráfico 3 – Intensidade da GE grave por rotavírus, de acordo com escores de Ruuska & Vesikari, nos grupos vacina e placebo 86 Gráfico 4 – Risco cumulativo quanto à ocorrência de GE grave por rotavírus em
relação ao número de dias após a dose 1, nos grupos vacina e placebo 88 Quadro 9 – Índice de mortalidade infantil no Brasil no ano de 2001 e nos
Tabela 1 - Características demográficas dos sujeitos incluídos no estudo 78 Tabela 2 – Distribuição dos sorotipos circulantes de rotavírus entre os sujeitos com
GE grave nos grupos vacina e placebo 82
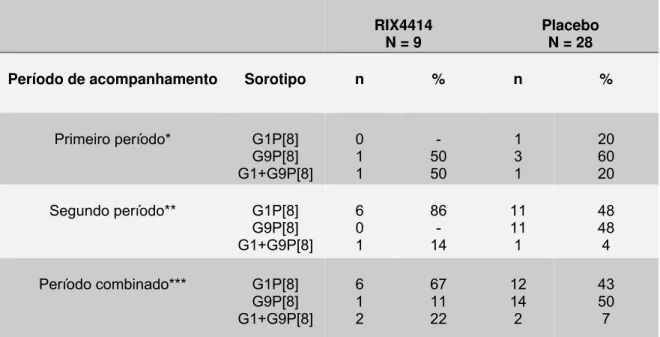
Tabela 3 – Eficácia da vacina RIX4414 contra GE grave por rotavírus de acordo com
o período de seguimento 83
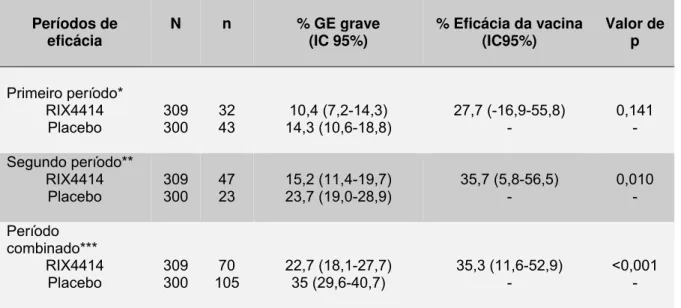
Tabela 4 – Eficácia da vacina RIX4414 contra GE grave de qualquer etiologia de
acordo com o período de seguimento 84
Tabela 5 – Características de gravidade dos episódios de GE grave por rotavírus durante o período combinado de eficácia 85 Tabela 6 – Eficácia da vacina RIX4414 em relação aos sorotipos de rotavírus nos
grupos vacina e placebo 87
Tabela 7 – Número de EAG classificados de acordo com MedDRA ou termo
preferido, entre as visitas 1 e 3 89
Tabela 8 – Número de sujeitos com EAG classificados pelo MedDRA ou termo
preferido, entre as visitas 3 e 4 91
Tabela 9 – Número de sujeitos com EAG classificados pelo MedDRA ou termo
preferido, entre as visitas 4 e 6 92
Tabela 10 – Óbitos registrados durante todo o seguimento do estudo de acordo com a classificação MedDRA e número de dias após dose 1 da vacina ou
APL - Aglutinação com partículas de látex
DNA - Deoxyribonucleic acid
EAG – Evento adverso grave
EGPA - Eletroforese em gel de poliacrilamida
ELISA- Enzyme-linked immunosorbent assay
EUA – Estados Unidos da América
GAVI – Global Alliance for Vaccines and Immunization
GE – Gastroenterite
IEC - Instituto Evandro Chagas
IgA – Imunoglobulina A
IgG – Imunoglobulina G
IS – Intussuscepção
MedDRA – Medical Dictionary for Regulatory Activities
MS - Ministério da Saúde
Nm - Nanômetro
NSP4 – No structural protein 4
RNA - Ribonucleic acid
RRV-TV – Rhesus human, reassortant, tetravalent rotavirus vaccine
RT-PCR - Reação em cadeia da polimerase precedida da transcrição reversa
SAGE – Strategic Advisory Group of Experts
SIDA – Síndrome da Imunodeficiência Adquirida
SRO – Sais de reidratação oral
SVS - Secretaria de Vigilância Sanitária
TCLE - Termo de Consentimento Livre e Esclarecido
TRO -Terapia de reidratação oral
V1 – Visita 1
V2 – Visita 2
V3 – Visita 3
V4 – Visita 4
V6 – Visita 6
VP – Viral protein
WHO – World Health Organization
2 JUSTIFICATIVA 17
3 OBJETIVOS 18
3.1 OBJETIVO GERAL 18
3.2 – OBJETIVOS ESPECÍFICOS 18
4. REVISÃO DA LITERATURA 20
4.1 HISTÓRICO 20
4.2 AGENTE ETIOLÓGICO 20
4.3 INTERAÇÃO VÍRUS-CÉLULA 24
4.4 PATOGENIA 25
4.5 EPIDEMIOLOGIA 29
4.6 IMUNIDADE 33
4.7 QUADRO CLÍNICO 35
4.8 DIAGNÓSTICO LABORATORIAL 37
4.8.1 Ensaio imunoenzimático (ELISA) 38 4.8.2 Aglutinação com partículas de látex (APL) 39
4.8.3 Microscopia eletrônica 39
4.8.4 Eletroforese em gel de poliacrilamida (EGPA) 40
4.8.5 Biologia molecular 40
4.8.5.1 Hibridização (dot-blot) 40
4.8.5.2 Reação em cadeia da polimerase precedida da
transcrição reversa (RT-PCR) 41
4.8.5.3 Sequenciamento genômico 41
4.8.6 Culturas celulares 41
4.8.7 Métodos sorológicos 42
4.9.3 Zinco 44
4.9.4 Adsorbantes 44
4.9.5 Antiespasmódicos 45
4.9.6 Probióticos 45
4.9.7 Nitazoxanida 45
4.9.8 Racecadotril 46
4.10 CONTROLE E PROFILAXIA 46
4.10.1 Vacinas licenciadas 49
4.10.1.2 Vacina pentavalente de origem bovino-humana (PRV) 49 4.10.1.3 Vacina atenuada de origem humana (RIX4414) 50 4.10.1.4 Vacina de origem animal, cepa G10P[12] oriunda de ovinos 54 4.10.2 Outras candidatas a vacina em processo de desenvolvimento 55 4.10.3 Desafios para o futuro 57
5 CASUÍSTICA E MÉTODOS 59
5.1 ÁREA DO ESTUDO 59
5.2 DESENHO DO ESTUDO 59
5.3 TAMANHO DA AMOSTRA 59
5.4 SELEÇÃO DA POPULAÇÃO ESTUDADA 61
5.4.1 Critérios de Inclusão 62
5.4.2 Critérios de exclusão 62
5.4.3 Contra-indicações à vacina subseqüente 63
5.5 CONSIDERAÇÕES ÉTICAS E REGULADORAS 63
5.8 IMUNZAÇÃO 71
5.9 AVALIAÇÃO DE EFICÁCIA 72
5.10 AVALIAÇÃO DE SEGURANÇA 75
6 RESULTADOS 76
6.1 RESULTADOS DE EFICÁCIA 79
6.2 RESULTADOS DE SEGURANÇA 88
7 DISCUSSÃO 96
8 CONCLUSÃO 108
REFERÊNCIAS BIBLIOGRÁFICAS 110
APÊNDICES 121
1 INTRODUÇÃO
Rotaviroses são as causas mais comuns de gastroenterite (GE) grave com desidratação em crianças abaixo de 5 anos em todo o mundo, com pico de incidência entre 6 e 24 meses de idade (Parashar, 2006; WHO 2007). À luz de estimativas recentes, o impacto global da doença causada por rotavírus assim se quantifica: pelo menos 25 milhões de atendimentos ambulatoriais e 2 milhões de hospitalizações, daí resultando aproximadamente 500.000 óbitos (Parashar et al., 2006). Estudos na América Latina indicam que os rotavírus causam 75 mil hospitalizações e 15 mil óbitos a cada ano. No Brasil, especificamente, estima-se que num cenário sem a vacina ocorram anualmente 2 mil mortes associadas aos rotavírus (Parashar et al., 2006; WHO, 2007; Constenla et al., 2008).
nítida segurança de ambas as vacinas, ora se impõem análises no tocante à efetividade vacinal e à vigilância pós-comercialização dos eventos adversos graves (Ruiz-Palacios et al., 2006; Vesikari et al., 2006; WHO 2007).
2 JUSTIFICATIVA
O Rotavírus é o principal agente causador de gastroenterite (GE) grave em crianças, tanto nos países desenvolvidos quanto em desenvolvimento. Recentes estimativas apontam que o rotavírus é responsável por mais de um terço de todas as hospitalizações causadas por diarréia e por aproximadamente 527.000 óbitos anualmente entre crianças abaixo de 5 anos, sendo que a maior parte desses óbitos ocorre nos países em desenvolvimento. O pico de incidência de GE grave por rotavírus ocorre entre 6 e 24 meses de idade (Parashar et al., 2006; WHO, 2007; Linhares et al., in Coura 2005).
A vacinação é o método mais efetivo para reduzir os casos de GE grave por rotavírus, impondo-se como prioritário o desenvolvimento de um imunizante que confira proteção precoce e duradoura (Linhares et al., 2008; Linhares e Villa, 2006; WHO, 2007).
Uma vacina oral de rotavírus humano atenuado RIX4414 (RotarixTM) foi licenciada em vários países após amplo estudo realizado na América Latina, (Linhares et al., 2008; Araújo et al., 2007; Ruiz-Palacios et al., 2006).
3. OBJETIVOS
3.1 OBJETIVO GERAL
Analisar aspectos da eficácia e segurança de duas doses da vacina oral de rotavírus humano atenuado RIX4414 (RotarixTM) na prevenção de GE grave por
rotavírus num subgrupo de crianças que participou de um estudo de fase III randomizado (1:1), duplo-cego, controlado por placebo no Brasil, em Belém, Pará.
3.2 OBJETIVOS ESPECÍFICOS
_ Avaliar se duas doses da vacina RIX 4414 podem prevenir GE grave causada por rotavírus sorotipos G1 e não G1 no período de 2 semanas após a dose 2 até o primeiro ano de vida.
_ Avaliar se duas doses da vacina RIX 4414 podem prevenir GE grave causada por rotavírus sorotipos G1 e não G1 no período de 2 semanas após a dose 2 até o segundo ano de vida.
_ Avaliar se duas doses da vacina RIX 4414 podem prevenir GE grave de qualquer etiologia no período de 2 semanas após a dose 2 até o primeiro ano de vida.
_ Avaliar se duas doses da vacina RIX 4414 podem prevenir GE grave de qualquer etiologia no período de 2 semanas após a dose 2 até o segundo ano de vida.
_ Avaliar a segurança da vacina RIX 4414 em termos da ocorrência de intussuscepção dentro de 31 dias após qualquer dose da vacina/placebo.
_ Avaliar a segurança da vacina RIX 4414 em termos da ocorrência de intussuscepção desde a administração da dose 1 até o primeiro ano de vida.
4. REVISÃO DA LITERATURA
4.1 HISTÓRICO
Há aproximadamente 45 anos ocorreu a descoberta dos rotavírus que infectam o homem por Bishop et al. (1973), ao analisarem seções ultrafinas da mucosa dudodenal de crianças diarreicas por meio da microscopia eletrônica. Esse evento ampliou a demonstração da etiologia viral nas gastroentrites agudas. Na ocasião, o patógeno foi denominado Orbivírus, devido a sua semelhança morfológica com gênero anteriormente identificado (Kapikian et al., 2001). A evidenciação de dupla camada proteica em sua estrutura determinou a subsequente denominação, Duovírus. O termo rotavírus, derivado do latim, foi posteriormente consagrado devido ao aspecto radiado de suas partículas (Linhares et al., in Coura,
2005).
A detecção do rotavírus no Brasil se deu em 1976, em Belém, Pará, por ocasião de estudos de quadros diarreicos agudos em crianças atendidas em um ambulatório público de pediatria (Linhares et al., 1977). Posteriormente, estudos em várias regiões do país consolidaram a importância desse agente na patogênese das gastroenterites infantis agudas (Pereira et al., 1993; Linhares, 1997; Linhares, 2000).
4.2 AGENTE ETIOLÓGICO
Os rotavírus pertencem à família Reoviridae e se constituem no gênero
não possui envelope. Sete grupos de rotavírus (A a G) são descritos, mas somente os dos grupos A, B, e C infectam seres humanos. Os rotavírus do grupo A são os que mais frequentemente infectam os seres humanos (Dennehy., 2007; Angel J. et al., 2007).
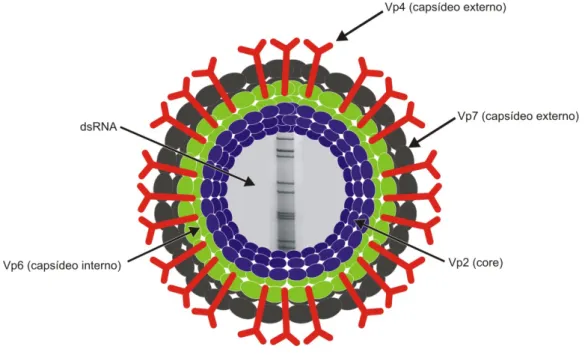
O vírus é composto por seis proteínas estruturais (VP1, VP2, VP3, VP4, VP6 e VP7) que formam três camadas concêntricas, quais sejam, capsídeos externo, intermediário e interno, e outras seis não estruturais (NSP1-NSP6). A camada interna envolve o core, o qual contém em seu interior o genoma viral constituído por 11 segmentos de ácido ribonucleico com dupla cadeia (dsRNA), além da enzima transcriptase e das proteínas VP1, VP2 e VP3 (Figura 1). Cada um desses segmentos “codifica” a síntese de uma determinada proteína viral (VP, viral protein), exceto o segmento 11 que codifica duas VPs. A camada intermediária é
constituída pela proteína VP6, aquela presente em maior quantidade. O capsídeo externo é formado pelas proteínas VP7 (780 moléculas/vírion) e VP4 (60 dímeros ou trímeros), as quais definem o tipo viral.
Presentemente são reconhecidos 14 sorotipos e 31 diferentes genótipos “P”, com base na proteína VP4. Além disso, 14 sorotipos diversos e 23 genótipos “G”, com base na especificidade inerente à VP7 (Solberg et al, 2009).
A VP7 é a glicoproteína que forma a matriz do capsídeo externo, constituindo-se no antígeno dominante na superfície viral, sendo responsável pela determinação dos sorotipos G. Essa glicoproteína também é reconhecida como indutora de anticorpos neutralizantes, incluindo aqueles sorotipo-específicos.
animais. Uma vez sob clivagem, a VP4, por ação da tripsina pancreática, desdobra-se nos componentes antigênicos VP5* e VP8*, subunidades proteicas associadas à virulência dos rotavírus, uma vez que desencadeiam o processo de penetração viral na célula (Ward et al., 2008).
Figura 1 – Representação esquemática da partícula viral de rotavírus (Figura produzida na ASCOM, IEC).
Bresee, 2000; Ward et al., 2008; Hyser e Estes, 2008). Em Belém, análises procedidas por Mascarenhas et al. (2006) sugeriram que a proteína NSP4 pode não representar o único determinante de virulênca dos rotavírus.
A classificação dos rotavírus é baseada num sistema binário que inclui as combinações dos tipos VP7 e VP4 em diferentes sorotipos/genótipos, o que confere enorme diversidade antigênica a esse agente viral (O’Ryan e Matson, 2006; Gray et al., 2008). A proteína VP6 media a definição de grupo e subgrupo. A nomenclatura vigente aplicada à classificação binária das amostras de rotavirus compreende, em sequência, as especificidades G e P [sorotipo (se disponível) e genótipo entre colchetes] conforme o Quadro 1.
Quadro 1 – Diversidade antigênica dos rotavírus
Classificação Diversidade Determinado por
Grupos A-E VP6
Subgrupo I, II, I+II, Não I e Não II VP6
Tipo G G1-G23 VP7
Tipo P P1-P31 VP4
Genótipo NSP4 A-E NSP4
rotavírus que infectam o homem, a maioria das amostras virais exibe as seguintes dualidades G e P: G1P[8] (a predominante), G2P[4], G3P[8], G4P[8] e G9P[8]. Reveste-se de particular relevância no contexto da infecção humana a emergência, em escala global, dos tipos virais dotados da especificidade G9 (Girard MP et al., 2006; Ebrahim JG, 2008). Recentemente, o tipo G12 tem sido detectado na Índia com crescente frequência e pode representar o próximo genótipo emergente de rotavírus em escala global (Angel et al., 2007; Gray et al., 2008).
4.3 INTERAÇÃO VÍRUS-CÉLULA
Após a ingestão, os rotavírus infectam os enterócitos maduros no topo das vilosidades intestinais do intestino delgado, principalmente no jejuno, principal sítio de replicação dos rotavírus. O capsídeo externo se associa diretamente ao processo infeccioso, atuando na adesão celular, penetração através da membrana e entrada na célula. Experimentos em animais indicam que a subunidade proteica VP8*, consequente à clivagem da proteína VP4 por tripsina pancreática, inicia o processo de penetração viral nas células epiteliais maduras que revestem as vilosidades,
desenvolvidas e agrupadas em áreas denominadas viroplasmas, localizadas próximas ao retículo endoplasmático (RE). Então, tais partículas atravessam para o interior do RE por ação da NSP4, que atua como um receptor intracelular. As partículas adquirem um envelope transitório devido à membrana do RE, que posteriormente desaparece, havendo a sua substituição por uma fina camada de proteína que constitui o capsídeo externo. Por fim ocorre a liberação de partículas virais maduras, contendo 3 camadas proteicas, por meio da lise celular (Angel et al, 2007; Estes, Kapikian, 2007).
4.4 PATOGENIA
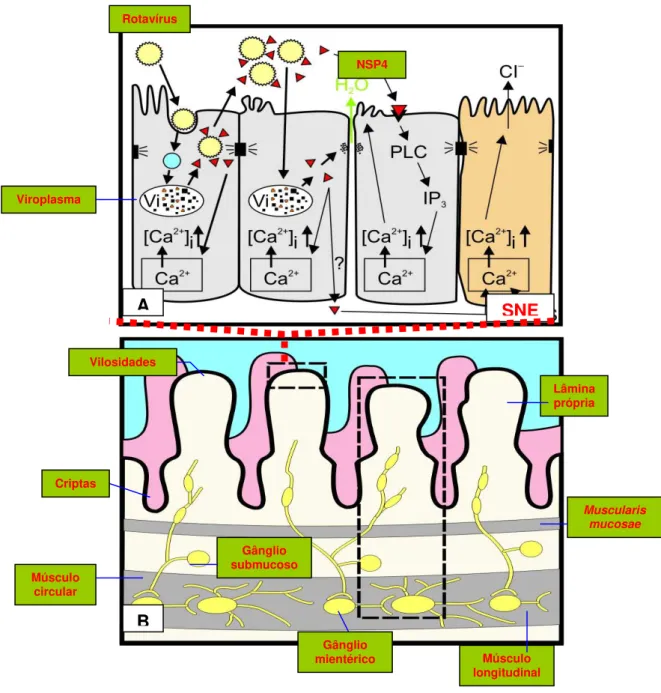
Os mecanismos envolvidos na patogênese das infecções por rotavírus não estão completamente elucidados, embora estudos em animais demonstrem que o enterócito infectado apresenta uma glicoproteína não estrutural denominada NSP4, cuja propriedade enterotoxigênica promove a desestabilização da membrana celular ativando a fosfolipase C. Tal mecanismo levaria ao aumento das concentrações intracelulares do íon cálcio (Ca++), com secreção do íon cloreto (Cl-) e
água para o lúmen instestinal ocasionando a diarreia secretora (Franco et al. 2006; Ward et al., 2008, Greenberg, Estes, 2009).)
Figura 2 – Representação esquemática dos eventos relacionados à indução da diarréia por rotavírus (A) e arquitetura normal do intestino delgado (B) (Figura
adaptada de Ramig et al., 2004).
Embora ainda prevaleça o conceito de que as rotaviroses constituem doença puramente entérica, mais recentemente Blutt et al (2006) demonstraram antigenemia/viremia nas infecções por rotavírus em ratos, outros animais e humanos, sendo a replicação intestinal desse agente necessária para o estabelecimento da viremia e detecção de antígenos virais no sangue. Em 2007
A SNE
B Vilosidades
Lâmina própria
Criptas
Gânglio submucoso
Muscularis mucosae
Músculo circular
Gânglio
mientérico Músculo longitudinal NSP4
Rotavírus
esse mesmo grupo realizou investigação de antigenemia no soro de crianças hospitalizadas por GE (57 positivos para rotavírus nas fezes e 41 negativos), crianças com bronquiolite de etiologia viral conhecida (n=58) e desconhecida (n=17), crianças sem infecção e sem doenças crônicas (n=17) e adultos saudáveis (28). Foi confirmado que 90% (51/57) das crianças com fezes positivas para rotavírus apresentavam antigenemia por esse agente, comparados com 12% (5/41) nos pacientes com diarréia e amostras fecais negativas para rotavírus, 12% (2/17) nas crianças com bronquiolite de etiologia viral desconhecida, e nenhuma entre crianças e adultos sem diarreia. Os pesquisadores concluíram que a maior parte das crianças que são infectadas por rotavírus apresenta viremia, sugerindo um envolvimento extra-intestinal na patogênese dos rotavírus. O impacto desse achado nas manifestações clínicas da infecção por rotavírus permanece desconhecido (Blutt et al., 2007).
Pesquisadores de Nova Delhi analisaram o sangue de 102 pacientes que desenvolveram diarreia causada por rotavírus e 64% deles apresentaram antigenemia/viremia dentro de 72 horas após o surgimento da diarréia, sendo encontrado o tipo G1 como o mais frequentemente associado à viremia em relação aos outros sorotipos (Ray et al., 2006) . Em conclusão, esse estudo sugere que a antigenemia/viremia por rotavírus é comum em seres humanos durante a infecção natural, embora a detecção de antígenos no soro seja inferior àquela encontrada nas fezes.
aliando a genotipagem dessas cepas virais oriundas de amostras de fezes às obtidas também do soro, podendo detectar infecções mistas em pacientes com gastroenterite aguda.
O melhor entendimento a respeito do mecanismo da diarréia causada por rotavírus provavelmente possibilitará novas estratégias para tratamento e prevenção da doença.
4.5 EPIDEMIOLOGIA
Os rotavírus são a causa mais comum de gastroenterite grave e desidratação em crianças com idades abaixo de cinco anos, tanto nos países industrializados como naqueles em desenvolvimento, sendo responsável por aproximadamente 25 milhões de visitas médicas ambulatoriais. Ainda, cerca de 2 milhões de hospitalizações e aproximadamente 500.000 óbitos por ano globalmente. Desse total, 85 % ocorrem em países pobres. Nos Estados Unidos da América (EUA) ocorrem anualmente cerca de 2,7 milhões de episódios de gastroenterite causadas por rotavírus; 55.000-70.000 hospitalizações e 20-60 óbitos, com um custo de U$ 1 bilhão de dólares a cada ano. (Girard et al., 2006;; Parashar et al., 2006; ACIP/CDC 2009)
inferior à observada naqueles desenvolvidos (6-8 meses versus 14-18 meses de idade respectivamente), sendo este um fator adicional a contribuir para o agravamento da doença nos países mais pobres, além das dificuldades envolvendo o acesso à terapia de reidratação e o número ainda elevado de crianças desnutridas (Girard et al, 2006).
Um estudo conduzido por Kane et al. (2004), para caracterizar a epidemiologia das diarreias causadas por rotavírus na América Latina, detectou índices de hospitalização entre 31-38%, sendo que 90% destas ocorreram em crianças abaixo dos 2 anos de idade. No Brasil, estima-se que nos primeiros 5 anos de vida uma em cada cinco (205 por 1.000) crianças necessite de atendimento médico ambulatorial devido a gastroenterite associada aos rotavírus. Além disso, uma em cada 29 (35 por 1.000) é hospitalizada, e uma em cada 1.429 (0,7 por 1.000) criança morre devido a complicações devidas à diarréia por rotavírus (Constenla et al., 2008). No contexto das desigualdades sócioeconômicas existentes entre as regiões do País, observam-se índices variáveis de óbitos para cada 100.000 crianças, sendo de 34,2% e 7,6% no nordeste e sudeste, respectivamente (Sartori et al., 2008).
O mecanismo de transmissão mais frequente é pela via fecal/oral, diretamente de pessoa a pessoa ou indiretamente através de fômites dos indivíduos infectados, contendo cerca de 1012 partículas virais por grama do espécime fecal (WHO, 2007). Há evidências sugerindo que a transmissão também possa ocorrer através da via respiratória, o que não implicaria, entretanto, multiplicação no trato respiratório (Gray et al., 2008). Reinfecções por rotavírus são comuns, embora a primeira infecção seja a mais expressiva clinicamente.
Em climas temperados, a incidência de gastroenterite por rotavírus ocorre tipicamente em picos durante o inverno, enquanto que nos países de clima tropical a infecção incide de forma mais uniforme ao longo de todo o ano (WHO, 2007). Estudos conduzidos por Pitzer et al. (2009) demonstraram que nos anos de 2007 e 2008 o uso em larga escala da RotateqTM no EUA retardou em 2-4 meses a ocorrência sazonal dos rotavírus, além de reduzir substancialmente sua magnitude em relação às epidemias dos anos anteriores.
A ocorrência universal das infecções por rotavírus mostra claramente que o acesso à água tratada e às condições sanitárias adequadas não promove impacto na redução da transmissão do vírus (WHO, 2007).
A distribuição geográfica dos diferentes tipos de rotavírus humano varia amplamente. Rotavírus do tipo G1P[8] são mais frequentes na América do Norte, Europa e Austrália do que na América do Sul, Ásia e África, e tem sido o tipo viral mais frequentemente encontrado nos últimos 30 anos (Angel et al., 2007)
Estudos até a década de 1990 evidenciavam uma predominância dos tipos G1-G4, mas desde então o G9P[8] ou G9P[6] tem emergido em todo o mundo, tendo sido isolados em 4,1% consoante estudos recentes (Angel et al., 2007).
Embora a relação entre sorotipos de rotavírus e virulência não tenha sido claramente estabelecida, na América Latina ensaios clínicos com vacina contra rotavírus demonstraram maior associação de episódios graves de GE envolvendo o sorotipo G9 em comparação com o G1 (escores de Vesikari de 16 e 11, respectivamente), além de associação com maior índice de desidratação grave (0% no grupo com sorotipo G1 e 47% com G9) (Linhares et al., 2006).
O novo tipo G12, detectado na Índia, tem ocorrido de forma crescente em escala global, com especificidade P[8] ou P[6], podendo representar o próximo genótipo emergente e talvez determinar uma mudança no cenário atual das estratégias voltadas à vacinação contra rotavírus (Angel et al., 2007).
A distribuição epidemiológica dos sorotipos de rotavírus sugere que a imunidade sorotipo-específica tem um papel importante, mas não exclusivo, na proteção, como um claro indicador de que proteção heterotípica também ocorre e é clinicamente significativa (Franco et al., 2006).
4.6 IMUNIDADE
Embora os mecanismos envolvidos na resposta imune à infecção e desenvolvimento de doença por rotavírus não estejam completamente elucidados, admite-se que haja o envolvimento de anticorpos sistêmicos e dos produzidos na mucosa intestinal, além da imunidade mediada por células (Dennehy 2007; Gray et al. 2008). Estudos em modelos animais têm sido especialmente importantes para incrementar o entendimento da imunidade nas infecções por rotavírus. Diversos estudos sugerem que os anticorpos neutralizantes dirigidos às proteínas VP4 e VP7 são indutores de proteção (Dennehy, 2007; Ward, 2008).
natural, 40% das crianças estão protegidas contra infecção subsequente por rotavírus, 75% contra diarréia, e 88% frente às diarreias graves. Episódios recorrentes de infecção conferem progressivo aumento na proteção. Admite-se que nenhuma criança que tenha apresentado duas infecções prévias por rotavírus desenvolva gastroentetite grave subsequentemente (Dennehy, 2007). Ressalte-se que rotavírus de tipos G distintos reservam entre si proteínas idênticas dos pontos de vista sorológico e genotípico, característica determinante da proteção cruzada (Ward, 2008).
Níveis séricos de anticorpos IgG e IgA contra rotavírus, detectados após infecção natural, têm sido correlacionados com proteção nos estudos conduzidos nos países desenvolvidos e em desenvolvimento, particularmente contra episódios graves de diarreia. A IgA presente no lúmen intestinal devido ao fenômeno de transudação, reflete os níveis séricos dessa imunoglobulina. Estima-se que os anticorpos intestinais confiram maior proteção contra a doença causada por rotavírus do que aqueles circulantes (Ward et al., 2008). Em termos gerais, admite-se que participam desadmite-se processo os anticorpos específicos das clasadmite-ses IgA e IgG, dirigidos às proteínas VP7, VP4, VP6 e NSP4.
O papel da imunidade celular tem sido cada vez mais evidenciado em diversos estudos. Os linfócitos B parecem envolvidos na produção dos anticorpos específicos IgA e IgG, induzindo proteção contra doença subsequente. Os linfócitos citotóxicos T CD8+ e CD4+, por sua vez, promoveriam a resolução do quadro infeccioso (Dennehy, 2007; Angel et al., 2007; Ward et al., 2008).
anticorpos maternos passivamente, seja via transplacentária, seja pela ingestão de leite materno (Linhares et al., 1989).
Em pacientes imunocomprometidos, a infecção natural por rotavírus não é regularmente associada à acentuação de quadros graves de diarreia, embora a excreção viral possa apresentar-se prolongada. Entretanto, indivíduos que são imunocomprometidos devido à imunodeficiência congênita, transplante de órgãos ou de medula óssea, algumas vezes experimentam quadros de gastroenterite grave prolongada e por vezes fatal (WHO, 2007).
4.7 QUADRO CLÍNICO
O espectro clínico das rotaviroses é amplo, abrangendo desde quadros assintomáticos, frequentes na fase neonatal, transitórios, com diarreia de leve intensidade até gastroenterites graves que podem levar à desidratação (WHO, 2007). Classicamente, após um período de incubação de 1 a 2 dias, o quadro se instala de forma abrupta através do surgimento de febre e vômitos, seguidos de diarreia aquosa e explosiva, sem sangue, com duração de aproximadamente 3-8 dias (WHO, 2007; Gray et al., 2008).
causadas por rotavírus resulta da combinação de mecanismos osmótico e secretor (Gray et al., 2008).
A febre normalmente se apresenta durante 24-48 horas, e denota caráter moderado, porém pode alcançar temperaturas superiores a 39°C em 30% das crianças (ACIP/CDC, 2009).
Os vômitos geralmente são intensos e, apesar de terem duração aproximada de 24-48 horas, podem tornar-se incoercíveis dificultando muitas vezes a terapia de reidratação oral. Não raro os vômitos podem ocorrer de forma isolada ou preponderarem em relação ao quadro diarreico. O mecanismo pelo qual os rotavírus causam vômitos não é conhecido.
Além da tríade clássica, ou seja, vômitos, febre e diarreia, eventualmente ainda se observam sintomas como náuseas e cólicas abdominais de intensidade variável. Manifestações extraintestinais associadas aos rotavírus, como otites, quadros respiratórios, hepatite transitória, intussuscepção e enterite necrotizante poderiam ser explicadas como decorrentes do caráter sistêmico da infecção recentemente demonstrada em estudos (Blutt et al., 2006; Gray et al., 2008;).
A excreção viral ocorre desde o período de incubação, com pico entre 72-96 horas após o início dos sintomas, estendendo-se até 8-10 dias mesmo após a resolução do quadro. Estudos conduzidos por Staat et al. (2002) correlacionam a excreção viral ao quadro clínico apresentado, ensejando a formulação da hipótese de que há relação direta entre intensidade da excreção viral e a exuberância dos sintomas.
isotônica, distúrbios eletrolíticos, desequilíbrio ácido-básico, notadamente a acidose metabólica e estado de choque, com desfecho eventualmente fatal.
As complicações advindas do quadro infeccioso por rotavírus assumem particular magnitude entre crianças nos países em desenvolvimento, devido à dificuldade no acesso aos serviços de pronto atendimento em saúde. Paralelamente, registrem-se condições mórbidas associadas como a desnutrição, baixo peso ao nascer, prematuridade e infecções associadas a outros patógenos.
4.8 DIAGNÓSTICO LABORATORIAL
Nas infecções por rotavírus, apesar de o quadro clínico constituir um forte indicador da doença, particularmente em crianças com idades inferiores a cinco anos, é de suma importância obter a confirmação laboratorial deste agente. A pronta detecção do mesmo pode auxiliar o julgamento médico, especialmente diante da suspeita de enteroinfecção por Escherichia coli enterotoxigênica, a qual evolui de
forma indistinta das rotaviroses. Além do interesse clínico, a confirmação laboratorial do agente é extremamente importante para corroborar os dados de vigilância epidemiológica.
Considerando o fato de que os rotavírus são excretados nas fezes em elevadíssimas concentrações (>1012 partículas virais/grama de fezes), este material
Embora haja uma ampla diversidade de testes diagnósticos comercialmente disponíveis, os ensaios imunoenzimáticos para detecção dos antígenos de rotavírus diretamente em espécimes fecais constituem-se no método mais sensível. Um espectro de métodos laboratoriais mais avançados pode ser utilizado para a diferenciação do tipo viral, posteriormente. Tanto a infecção natural quanto a vacinação induzem a produção de anticorpos que são detectados por meio de métodos sorológicos (WHO, 2007). A maioria dos procedimentos laboratoriais empregados visa essencialmente à detecção da proteína estrutural VP6 dos rotavírus, integrantes do grupo A (Gray et al., 2008).
4.8.1 Ensaio imunoenzimático (ELISA)
O ELISA (enzyme-linked immunosorbent assay) é a técnica mais
difundida e prática para a detecção de rotavírus, representando o método de escolha mais sensível para a detecção de antígenos virais em espécimes clínicos. Os múltiplos kits imunoenzimáticos em uso comercial são de rápida execução, embora
nem sempre disponíveis a preços razoáveis. Esses ensaios incluem anticorpos policlonais ou monoclonais dirigidos ao antígeno VP6 dos rotavírus pertencentes ao grupo A. A aplicação dos testes imunoenzimáticos dirigidos aos grupos B e C de rotavírus se restringe a alguns grandes centros de pesquisa. Em escala limitada, existem kits comerciais contendo anticorpos monoclonais específicos para a
4.8.2 Aglutinação com partículas de látex (APL)
Este sistema envolve basicamente suspensão contendo microesferas de látex devidamente sensibilizadas com anticorpos monoclonais para a proteína VP6, que ao contato com preparações positivas para rotavírus promovem aglutinação nitidamente visível das partículas examinadas contra superfície escura. Trata-se de um recurso prático, rápido (resultados em até 5 minutos), de relativo baixo custo (em geral até 3 vezes inferior ao do ELISA) e sensibilidade comparável à do ELISA, justificando a recomendação do uso rotineiro em laboratórios ambulatoriais e hospitalares.
4.8.3 Microscopia eletrônica
4.8.4 Eletroforese em gel de poliacrilamida (EGPA)
A EGPA (polyacrylamide gel electrophoresis) é um método de execução
simples, sensível e específico para a detecção do RNA viral, considerando que o genoma dos rotavírus representa expressiva parcela do conteúdo fecal na vigência do quadro agudo da doença. Sua sensibilidade é comparável à do ELISA, com a vantagem de permitir a identificação de diferentes perfis genômicos ou eletroferotipos das amostras virais, mesmo daqueles rotavírus caracterizados como atípicos (integrantes dos grupos B, C, D, E ou F). Daí se revelar um método importante em termos epidemiológicos, especialmente em situações epidêmicas.
4.8.5 Técnica da biologia molecular
Abrange procedimentos diagnósticos modernos empregados para a detecção do genoma viral e enseja a classificação dos rotavírus em múltiplos genótipos, estabelecidos com base nas especificidades inerentes às proteínas VP4 e VP7 dos rotavírus (Linhares et al., in Coura 2005); sua aplicação ainda está restrita
em larga escala à pesquisa científica.
4.8.5.1 Hibridização (dot-blot)
Baseada na utilização de sondas de RNA marcadas com enzimas ou radioisótopos que se ligam a fitas complementares do DNA alvo do vírus, o qual se transferiu para uma membrana de nylon, formando híbridos (RNA-DNA). A captura
4.8.5.2 Reação em cadeia da polimerase precedida da trancrição reversa (RT-PCR) Fundamenta-se na amplificação enzimática dos genes 9 (tipos G) e 4 (tipos P), utilizando-se primers específicos (sondas moleculares), ou seja,
sequências de bases homólogas àquelas contidas em RNA presente no espécime clínico analisado. Apresenta alta especificidade e sensibilidade 100.000 vezes superior àquela do EGPA, e se constitui em recurso relevante nos estudos epidemiológicos, já que permite a identificação de genótipos circulantes com base nas especificidades das proteínas VP4 e VP7. Ressalte-se que, atualmente, a RT-PCR constitui o procedimento caracterizado como “padrão-ouro” no diagnóstico das infecções por rotavírus.
4.8.5.3 Sequenciamento genômico
Possibilita a genotipagem das amostras pela análise das sequências de nucleotídeos ou aminoácidos, além de permitir a identificação de possíveis mutações ou alterações nessas sequências. Sua aplicação, entretanto, é restrita à investigação científica (Mascarenhas et al., 2007; Gabbay et al., 2008).
4.8.6 Culturas celulares
4.8.7 Métodos sorológicos
Utiliza-se técnica imunoenzimática para a mensuração dos níveis séricos de IgG ou IgA, estabelecendo-se diagnóstico a partir da elevação das concentrações desses anticorpos. Não apresenta valor prático como diagnóstico, sendo mais utilizado nos testes envolvendo vacinas contra rotavírus, visando à caracterização da resposta imune específica em relação aos tipos vacinais.
4.9. TRATAMENTO
O tratamento da gastroenterite causada por rotavírus baseia-se principalmente na reposição precoce das perdas hidroeletrolíticas causadas pelos episódios de vômito e diarreia, conduta também recomendada no tratamento das diarreias agudas de quaisquer etiologias (WHO, 2005). Até o momento não há droga antiviral eficaz a ser utilizada no combate aos rotavírus.
4.9.1 Sais de reidratação oral (SRO)
duração da diarreia, promove diminuição do volume das fezes e restabelece o equilíbrio hidroeletrolítico, com menor necessidade de reposição de fluidos via intravenosa em relação à utilizada anteriormente (Hahn S et al., 2001; Duggan et al., 2004). Os SRO devem ser oferecidos após a reconstituição do conteúdo do pacote num litro de água limpa.
No Brasil ainda se encontra disponível para uso em toda a rede de saúde a formulação dos SROs contendo glicose, cloro e sódio nas concentrações padrões de 111, 80 e 90 mEq/L, respectivamente. De acordo com a OMS (2006), cada país deve planejar a introdução do SRO de baixa osmolaridade na dependência dos estoques disponíveis da formulação antiga, devendo-se evitar a circulação dos dois produtos concomitantemente.
A TRO é eficaz na maioria dos casos e deve ser administrada mesmo na vigência de vômitos, em pequenos volumes e a intervalos curtos após cada evacuação diarreica. O volume a ser administrado dependerá da avaliação do estado de hidratação da criança, podendo variar de 50-100 ml/kg em 4-6 horas, ou 50-200 ml após cada episódio diarréico, até que a diarreia desapareça.
Reserva-se a administração de fluidos por via parenteral para os casos graves, com comprometimento da consciência, estado de choque ou vômitos incoercíveis, podendo-se administrar solução glicofisiológica em volumes de até 50 ml/kg durante 1-4 horas.
4.9.2 Alimentação
porções, a fim de manter o aporte dos nutrientes necessários ao seu desenvolvimento e prevenir a perda de peso durante a infecção. O aumento da ingesta de líquidos diversos não substitui a alimentação da criança. Fórmulas lácteas especiais só são indicadas em casos de intolerância à lactose naquelas crianças que fazem uso habitual do leite de vaca, sendo necessário então o uso de fórmulas a base de soja, ou mesmo isentas de lactose (WHO, 2006).
4.9.3 Zinco
Diversos estudos têm demonstrado que a suplementação de zinco durante o episódio diarreico reduz a duração, a severidade e a incidência de diarreias nos 2-3 meses seguintes à terapia, além de incrementar o apetite. A OMS passou a recomendar formalmente a administração de zinco, na dose de 10-20 mg/dia, sob a forma de sal (acetato, sulfato, gluconato), durante 10-14 dias tão logo se inicie o processo diarréico. Lactentes abaixo de 6 meses de idade devem receber 10 mg/dia de zinco, e acima dessa idade 20mg/dia, manipulados artesanalmente e diluídos em pequena quantidade de líquido (água, leite materno, etc) (Strand TA, et al. 2002; Bhatnagar S et al., 2004; WHO, 2006; Ferraz IS et al., 2007).
4.9.4 Adsorbantes (caolin, pectina, colestiramina)
4.9.5 Antiespasmódicos (difenoxilato, loperamida)
O uso dessas substâncias pode retardar a eliminação dos líquidos e sais que já fluíram para a luz intestinal, bem como de toxinas produzidas pelo agente causador, podendo prolongar a doença (WHO, 2005).
4.9.6 Probióticos
São microrganismos vivos compostos por fungos e/ou bactérias ácido-lácticas não patogênicas, como os lactobacilos (Lactobacillus GG) e bifidobactérias
(Saccharomyces boulardii), cuja função consistiria em auxiliar no combate ao agente
causador da diarreia através da restauração da flora intestinal normal podendo trazer algum benefício ao hospedeiro. Não existem evidências científicas até o momento que recomendem formalmente seu uso no tratamento de gastroenterites (Salazar-Lindo et al., 2004; WHO, 2005).
4.9.7 Nitazoxanida
avaliação de seu mecanismo de ação, e frente a dados clínicos como redução dos episódios de vômitos e febre.
4.9.8 Racecadotril
Droga antissecretora que agiria reduzindo o número de episódios diarreicos, foi avaliada somente em adultos, não havendo ainda estudos envolvendo sua eficácia em crianças (Cezsard & Salazar-Lindo, 2005).
4.10 CONTROLE E PROFILAXIA
Diante das extensas epidemias de rotaviroses que se repetem a cada ano em países desenvolvidos, a despeito das excelentes condições de saneamento e higiene, prevalece o conceito de que práticas higiênicas como a lavagem das mãos, saneamento básico adequado e os cuidados com água e alimentos não determinam sensível impacto no controle e profilaxia das infecções por rotavírus. A profilaxia mais efetiva contra as gastroenterites causadas por rotavírus consiste na administração de vacinas.
Um objetivo realístico para as vacinas contra rotavírus consiste em simular a proteção contra a doença, a exemplo do que ocorre após uma infecção natural.
No tocante às vacinas pioneiras contra rotavírus, o primeiro grupo compreendeu amostras de origens bovina e símia (estratégias “Jennerianas”). Nesse contexto se destacaram as cepas RIT 4237 e WC3, ambas obtidas a partir de rotavírus bovinos (sorotipo G6) e atenuadas via passagens sucessivas em linhagens celulares e adaptadas a temperaturas progressivamente mais baixas. Essas candidatas a vacina, embora eficazes nos testes de campo em países desenvolvidos, falharam nas regiões tropicais (Ward et al., 2008).
Uma cepa de origem símia, MMU 18.006 (ou RRV- rhesus rotavirus),
sorotipo G3, emergiu como uma candidata promissora, na medida em que conferiu expressiva proteção contra episódios diarreicos graves; entretanto, induziu importantes efeitos colaterais, principalmente a febre. Além disso, sua eficácia somente se demonstrou expressiva naquelas regiões onde o tipo homólogo ao da vacina, G3, prevalecia (Kang, 2006).
Posteriormente, conjugaram-se à RRV outros três rotavírus
geneticamente reestruturados, exibindo identidades antigênicas com aqueles de origem humana pertencentes aos sorotipos G1, G2 e G4, sendo denominada RRV-TV (rhesus-human, reassortant, tetravalent rotavirus vaccine). Avaliou-se a RRV-TV
em duas concentrações distintas, quais sejam, 4 x 104 pfus (plaque-forming units) e
4 x 105 pfus em 5 países envolvendo aproximadamente 15.000 crianças com idades
inferiores a 6 meses, a quem se administraram 3 doses da vacina ou placebo.
concentração de 4 x 105 pfus, pela Food and Drugs Administration (FDA), EUA em
1998. Sob a designação comercial de RotashieldTM (Wyeth-Lederle, Philadelphia, PA) a vacina foi incorporada ao programa americano de imunizações em regime de 3 doses aplicadas aos 2, 4 e 6 meses de idade.
O uso da RRV-TV foi interrompido após 1 ano da sua comercialização, devido à associação com aumento do número de casos de intussuscepção; na ocasião, mais de 600.000 crianças foram imunizadas. À época de sua retirada do mercado dos EUA, nenhum outro país havia ainda introduzido a vacina globalmente. O risco de intussuscepção foi mais elevado dentro das 2 semanas após a administração da primeira dose, sendo estimado em 1 para 10.000 vacinas administradas (Dennehy PH, 2007; ACIP/CDC, 2009).
Alguns pesquisadores sugeriram que a associação com intussuscepção era mais expressiva de acordo com a idade apresentada no momento da administração da primeira dose, ocorrendo maior risco entre crianças com idades superiores a 90 dias, comparativamente àquelas imunizadas aos 2 meses. Entretanto, após revisão dos dados disponíveis, o “Global Advisory Committee on Vaccine Safety”, da OMS, concluiu que o risco de intussuscepção associada à RRV-TV era maior entre crianças vacinadas com idades superiores a 60 dias, porém não
havia evidências suficientes para concluir que o seu uso em crianças abaixo dessa idade estivesse relacionado a menor risco (CDC, 2009).
Ainda não se elucidou plenamente o mecanismo envolvido na patogênese da intussuscepção desencadeada pela RRV-TV. Não obstante, 3 hipóteses são
oferecido; e “replicação viral”, atribuindo aos vírus RRV, especificamente, o potencial
deletério. (Offit P; 2002).
4.10.1 Vacinas licenciadas (Quadro 2)
4.10.1.2 Vacina pentavalente de origem bovino-humana (PRV)
Denominada comercialmente de RotateqTM e produzida pela Merck, Inc, EUA, consiste em formulação pentavalente de origem bovino-humana, atenuada, que compreende re-estruturação envolvendo as proteínas VP7 dos rotavírus que mais infectam o homem: G1, G2, G3, e G4, e o tipo mais comum de VP4, P[8]. Um extenso estudo voltado à eficácia evidenciou índices protetores de 74 e 98% contra diarreias em geral e os quadros graves, respectivamente (Kang G, 2008). Estudos de segurança envolvendo mais de 70.000 crianças, em particular nos EUA e Europa, onde metade das crianças recebeu vacina, não evidenciaram aumento do risco de instussuscepção, comparativamente ao grupo que recebeu placebo. A vacina foi administrada em 3 doses, nos 2˚, 4˚, e 6˚ meses de vida, via oral. Esse estudo evidenciou também nítida eficácia da RotateqTM frente aos múltiplos sorotipos, incluindo amostras G1, G2, G3, G4 e o emergente G9.
Recentes investigações demonstraram que a eficácia da PRV contra
Em parceria com a PATH (Program for Appropriate Technology in Health), a Merck
planeja conduzir estudos clínicos na África e Ásia (Dennehy, 2007).
Na Nicarágua, Patel et al. (2009) conduziram um estudo caso-controle em quatro hospitais, durante um ano, tendo demonstrado que a efetividade do esquema completo com Rotateq (3 doses) foi de 46% (IC95% 18-64%) em prevenir hospitalização devido à infecção por rotavírus; 58% (IC95%, 30-74%) contra diarreia grave por rotavírus e 77% (IC95%, 39-92%) contra diarreia muito grave por rotavírus. Nesse estudo, cerca de 55% dos casos e controles tinham recebido o esquema completo de vacinação. Tais achados evidenciam menor risco de diarreia grave por rotavírus em crianças abaixo de 2 anos de idade na Nicarágua, porém os níveis de proteção mostraram-se inferiores àqueles observados nos ensaios clínicos conduzidos nos países desenvolvidos.
Atualmente, a RotateqTM encontra-se licenciada nos EUA, Américas Central e do Sul, África, Europa e Pacífico Ocidental. A faixa etária preconizada para administração da primeira dose da RotateqTM é entre 6-12 semanas de idade, com intervalo mínimo de quatro semanas para administração da segunda e terceira doses da vacina, cujo limite máximo de idade não deve ultrapassar 32 semanas.
4.10.1.3 Vacina atenuada de origem humana (RIX 4414)
Trata-se de vacina humana atenuada produzida pela GlaxoSmithKline Biologicals (GSK), Rixensart, Bélgica, derivada da amostra original 89-12 isolada de uma criança naturalmente infectada por rotavírus, com especificidade G1P[8], após clonagem e passagens sucessivas em culturas celulares, daí advindo a cepa vacinal propriamente dita, RIX 4414, denominada comercialmente RotarixTM (Angel J et al.,
Estudos de fases II e III foram conduzidos em cerca de 31 países, envolvendo aproximadamente 100.000 crianças. Muitos desses estudos foram levados a efeito em países pobres da América do Sul e Ásia, estratégia que facilitou o licenciamento nessas regiões, bem como a sua pré-qualificação pela OMS, em 2007, daí advindo a disponibilidade da vacina em populações com elevado índice de gastroenterite por rotavírus.
Na América Latina, as investigações caracterizadas como de fase II (duplo-cegas e controladas por placebo) envolveram 2.155 dessas crianças no Brasil, México e Venezuela, daí resultando indicadores satisfatórios quanto à sua imunogenicidade e segurança, além da eficácia na prevenção das gastroenterites graves por rotavírus. Com efeito, na concentração de 10 5,8ffu (fluorescent foci units)
por dose, a vacina alcançou níveis protetores de 70% e 86% contra todas as gastroenterites por rotavírus e aquelas caracterizadas como graves, respectivamente, observando-se a sua administração no segundo e quarto meses de vida. Assinale-se que a vacina conferiu proteção de aproximadamente 60%, já após a primeira dose nesses países. A taxa de eventos adversos graves registrados entre as crianças vacinadas e as que receberam placebo foram comparáveis, mostrando que a vacina foi bem tolerada (Linhares et al., 2006). Não houve diferença nos níveis protetores da vacina, comparadas crianças desnutridas àquelas hígidas (Perez-Schael et al., 2007).
acompanhamento dos mesmos por um ano. Com efeito, ao longo dos 31 dias após cada dose, registraram-se 6 casos desse processo obstrutivo intestinal entre os que receberam o imunizante e 7 naqueles a quem se administrou placebo (p=0,78). Um subgrupo de 20.000 crianças foi acompanhado para avaliação de eficácia, alcançando níveis de proteção de 85% contra gastroenterites graves e hospitalizações por rotavírus (Ruiz-Palacios et al., 2006).
A vacina também demonstrou elevada eficácia em prevenir gastroenterites de qualquer gravidade causada pelo tipo predominante G1 (92%), e os sorotipos G3, G4 e G9 (88%) (Dennehy, 2007). No que se refere a hospitalizações devidas a gastroenterites ou diarreias de qualquer etiologia, evidenciou-se proteção de 42%, o que representa uma significativa redução no impacto global das gastroenterites (Ruiz-Palacios et al., 2006).
Ainda no contexto desses estudos, um subgrupo (n=15.183) foi acompanhado até os dois anos de idade para avaliar a manutenção da eficácia, a qual alcançou 80,5%. Ressalte-se que a proteção contra hospitalizações por gastroenterite causada por rotavírus e outros agentes etiológicos foi de 83% e 40%, respectivamente. O acompanhamento durante o segundo ano também corroborou os achados prévios quanto à inexistência de eventos adversos graves, em particular a intussuscepção (Ruiz-Palacios et al., 2006).
G9, com nítida proteção em relação ao tipo G2, de 86%. No tocante à segurança, registrou-se apenas um caso de intussuscepção, ocorrido 8 dias após a administração da segunda dose (Vesikari et al., 2007).
Na África do Sul e República do Malauí, a avaliação da eficácia da RotarixTM frente aos episódios graves de GE, inclusive em crianças infectadas pelo HIV, revelou que os dados obtidos em conjunto alcançam proteção de 61% (IC95% 44,0-73,2), evidenciando o desempenho satisfatório da vacina em regiões de extrema pobreza e grande prevalência de co-morbidades como SIDA e malária (Cunliffe et al., 2009).
Na Europa, Omenñaca et al (2009) avaliaram a imunogenicidade, em termos de imunoglobulina A, da RotarixTM em prematuros, evidenciando-se 75,9%
de conversão sorológica (IC95% 56,5-89,7) no grupo com idade gestacional entre 27-30 semanas e 88,1% (IC95% 5,0-53,8) naqueles com idade gestacional entre 31-36 semanas, consolidando a eficácia da resposta imunológica e sua administração a crianças prematuras .
Análises secundárias recentes na América Latina e Europa reúnem evidências de que um esquema vacinal incompleto (1 dose apenas) confere proteção, 89,8% (IC95% 8,9-99,8) e 62,5% (IC95% 16,0-83,8), respectivamente, apesar de ocorrer em níveis inferiores ao observado nas crianças que receberam o esquema vacinal completo (López et al., 2006, Vesikari et al., 2006).
Ainda na Europa, estudos envolvendo o acompanhamento de gêmeos na mesma família detectaram amostra viral da vacina em pelo menos um espécime fecal entre 18,8% de gêmeos que receberam placebo, sugerindo transmissão horizontal decorrente da imunização em larga escala com a RotarixTM (Rivera L,
Estudos conduzidos na Austrália para avaliação do impacto após o uso em larga escala de ambas as vacinas, RotarixTM e RotateqTM , demonstraram declínio na notificação de GE por rotavírus em crianças abaixo de 2 anos de 53% no ano de 2007 e 65% em 2008, redução também observada entre crianças com mais de 2 anos de idade, em comparação aos dados coletados antes da introdução dessas vacinas no programa de imunizações denotando efeito benéfico direto e indireto da vacinação (Lambert et al., 2009).
Até o momento, a RotarixTM está licenciada para uso em 2 doses, por volta do segundo e quarto meses de vida, em cerca de 100 países distribuídos na América Latina, Ásia, África, União Européia, além do Canadá e Estados Unidos (Cheuvart et al., 2009). A faixa etária preconizada para administração da primeira dose é entre 6-14 semanas de idade, com intervalo mínimo de quatro semanas até a segunda dose, que deve ser administrada até 24 semanas e 6 dias de idade.
4.10.1.4 Vacina de origem animal, cepa G10P[12] oriunda de ovinos
Quadro 2 – Composição das vacinas licenciadas
Vacina Fabricante Amostra viral
RotarixTM GlaxoSmithKline G1P[8],
humana
RotateqTM Merck G1, G2, G3, G4, P[8], bovino humana
LLR Lanzou Institute G10P[12],
Ovina
4.10.2 Outras candidatas a vacina em processo de desenvolvimento
Apesar de já disponíveis duas vacinas contra rotavírus, licenciadas para uso nos programas de imunização de vários países, outras candidatas têm sido investigadas. Destas, três merecem destaque, quais sejam: cepa UK, obtida a partir de reestruturação genética bovino-humana, RV3 (G3P[6]), origem humana neonatal, e bovino-humana neonatal 116E (G9P[11]) (Ward et al., 2008).
A cepa UK ensejou a preparação de rearranjo genético envolvendo rotavírus de origens bovina e humana, com especificidades antigênicas para os tipos G1, G2, G3 e G4. No momento, essa formulação tem sido utilizada em estudos de fase II na Finlândia, onde se denotou eficácia e segurança satisfatórias. Brasil (Instituto Butantã, São Paulo), Índia e China ora se empenham na produção dessa vacina, a partir da transferência de tecnologia do National Institutes of Health,
A cepa humana neonatal RV3 (G3P[6]), desenvolvida por Ruth Bishop na Austrália, mostrou-se segura e bem tolerada quando administrada via oral em lactentes de 3 meses de idade. Em estudo de fase II no qual se administrou um esquema com 3 doses da vacina na concentração de 105 ffu/dose, a despeito de
imunogenicidade reduzida demostrada pela IgA, os sujeitos que a receberam se mantiveram moderadamente protegidos (46%) contra a doença no período de acompanhamento (Barnes et al., 2002; Dennehy, 2007).
Também obtida de neonatos que foram infectados e se mantiveram assintomáticos na Índia, na década de 1980, a cepa 116E (G9P[11]) é fruto de rearranjo genético, atenuada naturalmente, envolvendo rotavírus humano e bovino. A sua estrutura genômica contempla gene VP4, oriundo de amostra bovina, e os outros 10 genes de origem humana. Em estudos de fase I, controlados por placebo, denotou-se significativo potencial imunogênico inerente a essa amostra (Ward et al., 2008).
4.10.3 Desafios para o futuro
Estudos de vigilância pós-“marketing” são absolutamente necessários para: (a) monitorar o impacto da vacina na circulação das cepas de rotavírus; (b) avaliar a possibilidade da pressão de seleção causada pela vacina; (c) mensurar a extensão da proteção cruzada entre os diferentes sorotipos, incluindo os tipos considerados não usuais e emergentes G9 e G8; (d) determinação das taxas relativas à ocorrência de intussuscepção (WHO, 2007; Grimwood K e Bines JE, 2007; Parashar and Glass, 2008; CDC/ACIP, 2009). Estudos caso-controle visando à análise da efetividade das vacinas em condições reais são fortemente recomendados para avaliação desses desafios.
Atendendo às recomendações da OMS, ora se desenvolve um estudo caso-controle, de base hospitalar, multicêntrico, no Brasil (Instituto Evandro Chagas, Belém, Pará) e no Panamá, com vistas à avaliação da efetividade da RotarixTM em uma população de crianças nascidas após a data de sua liberação, nestes países, e hospitalizadas devido à GE; paralelamente a esse cenário ocorre a vigilância da circulação de cepas de rotavírus nessa população.
Considerando que o impacto da doença causada por rotavírus é maior nos países em desenvolvimento, os custos inerentes à implementação de uma vacina no programa de imunizações representa outro desafio a ser vencido (WHO, 2007; Ward et al, 2008) . A par disso, a Global Alliance for Vaccines and Immnunization (GAVI) recentemente proporcionou suporte a países menos
desenvolvidos para promoverem a compra de vacinas contra rotavírus, baseada em recomendações da OMS (Grimwood K e Bines JE, 2007; Ward et al., 2008)
índices que variam entre <50% e 90%, provavelmente devido ao estrito limite de idade para administração da primeira e segunda doses da vacina (tanto RotarixTM quanto RotateqTM), requerendo pessoal técnico muito bem treinado para observar o limite etário máximo para receber o esquema vacinal (Grimwood K e Bines JE, 2007; WHO, 2007; Ward et al ., 2008).
Em abril de 2009 a OMS, através do grupo “Strategic Advisory Group of Experts” (SAGE), revisou dados recentes de efetividade e segurança das duas
vacinas contra rotavírus (RotarixTM e RotateqTM) e recomendou que a vacinação contra rotavírus fosse incluída em todos os programas nacionais de imunização, especialmente naqueles países onde o número de óbitos por doenças diarreica seja maior ou igual à 10% de mortalidade entre crianças com idade abaixo de 5 anos.
O grupo SAGE recomendou ainda que ambas as vacinas harmonizassem
a faixa etária preconizada para sua administração, sendo agora entre 6-15 semanas de idade para a primeira dose, com a última dose sendo administrada no máximo até 32 semanas. A expansão da faixa etária para o uso dessas vacinas pode potencialmente elevar a taxa de cobertura vacinal da primeira dose de 57% para 70% e de 36% para 54% para o esquema vacinal completo em países em desenvolvimento (WHO, 2009).