Enquête sur les interactions entre le médiateur et les facteurs de transcription généraux dans l'ARN polymérase II. Le médiateur de transcription de l’ARN polymérase II a été découvert chez Saccharomyces cerevisiae dans les années 1990. Au cours de ma thèse nous nous sommes donc intéressés aux liens entre le Médiateur et d'autres facteurs protéiques clés dans le mécanisme de transcription de l'ARN polymérase II : les facteurs généraux.
La transcription des gènes de classe II
Séquences régulatrices de l'ADN
- Structure du promoteur
- Les éléments de régulation
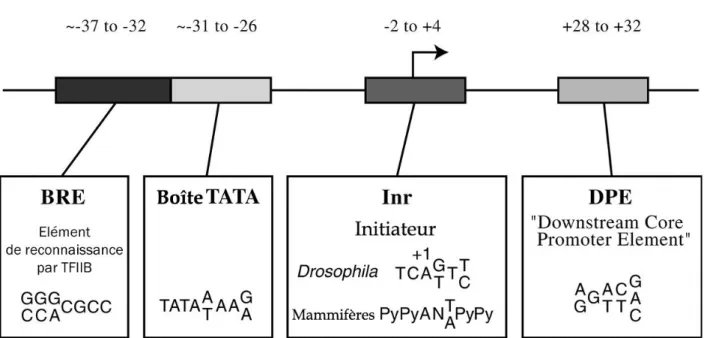
La liaison entre le TBP et la boîte TATA peut être limitante à l'étape d'initiation de la transcription (Klein et Struhl, CHAPITRE I : TRANSCRIPTION DES GÈNES DE CLASSE II 1994). Elle agit en synergie avec la boîte TATA et participe à la transcription des gènes qui en sont dépourvus (Emami et al., 1997). Les séquences d'ADN liées par des protéines impliquées dans le contrôle de l'expression des gènes jouent un rôle important dans la régulation de la transcription.
Les facteurs généraux de la transcription par l'ARN polymérase II
- TFIID
- TFIIA
- TFIIB
- TFIIF
- TFIIE
- TFIIH
BRE est reconnu par le complexe TFIIB grâce à une séquence consensus G/C G/C G/A CGCC (Lagrange et al., 1998). En effet, il lie le complexe TBP/ADN, ce qui augmente l'affinité du TBP pour la boîte TATA ( Imbalzano et al., 1994 ). Enfin, ce facteur permet le recrutement de Pol II en interagissant directement avec TFIIF (Ha et al., 1993).
L'ARN Polymérase II
- Organisation de l'ARN polymérase II
- Le domaine Carboxy-terminal de Rpb1 (CTD)
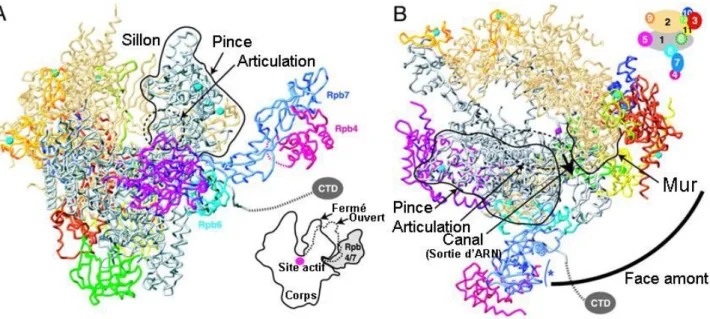
- Structure de l'ARN Polymérase II
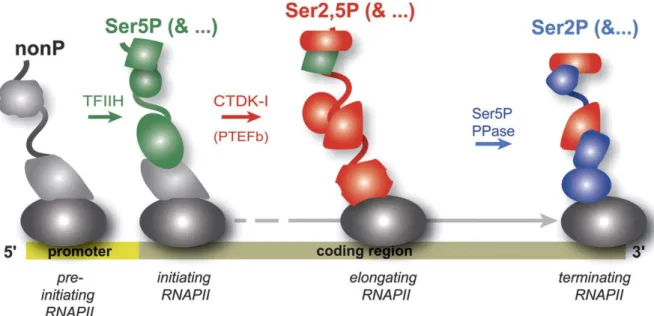
Cela indique que ces deux sous-unités sont impliquées dans les processus d’initiation et d’élongation de la transcription. Des études d'immunoprécipitation de la chromatine (ChIP) ont permis de déterminer le profil de phosphorylation de Pol II sur les gènes transcrits (Figure 3). La résolution de la structure de Pol II par diffraction des rayons X a constitué une avancée majeure pour la recherche transcriptionnelle (Cramer et al., 2000 ; Cramer et al., 2001) (Figure 4).
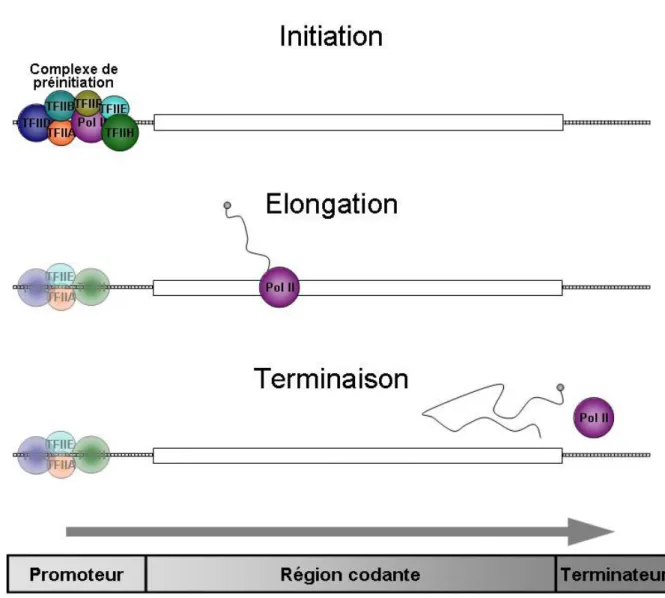
La transcription par l’ARN polymérase II
- Initiation de la transcription
- Elongation de la transcription
- Terminaison de la transcription
In vitro, le complexe THO/TREX, dont les sous-unités sont impliquées dans l'exportation de l'ARN et l'élongation de la transcription, permet d'éviter les hybrides ARN/ADN (Chavez et al., 2000 ; Strasser et al., 2002). Cependant, l'enzyme s'arrête fréquemment sur des sites préférés in vitro (Uptain et al., 1997). Fcp1 peut déphosphoryler le CTD provoquant un blocage de l'enzyme qui permettra le clivage, la libération de l'ARN et le recyclage de Pol II (Chambers et al., 1995 ; Kamada et al., 2003 ; Proudfoot et al., 2002).

La transcription dans un contexte chromatinien
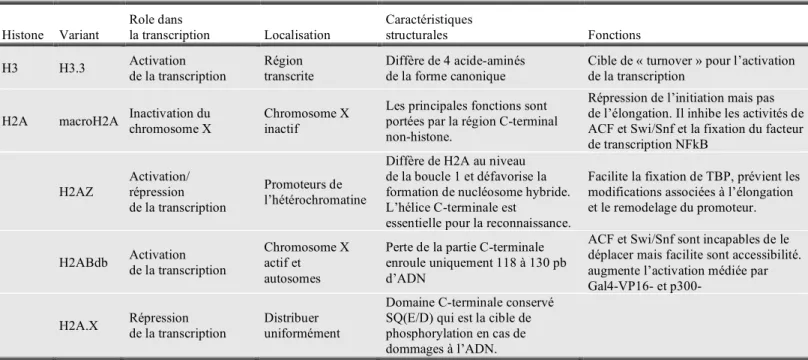
- Variants et modifications des histones associées à la transcription
- Initiation de la transcription dans un contexte chromatinien
- L’élongation de la transcription dans un contexte chromatinien
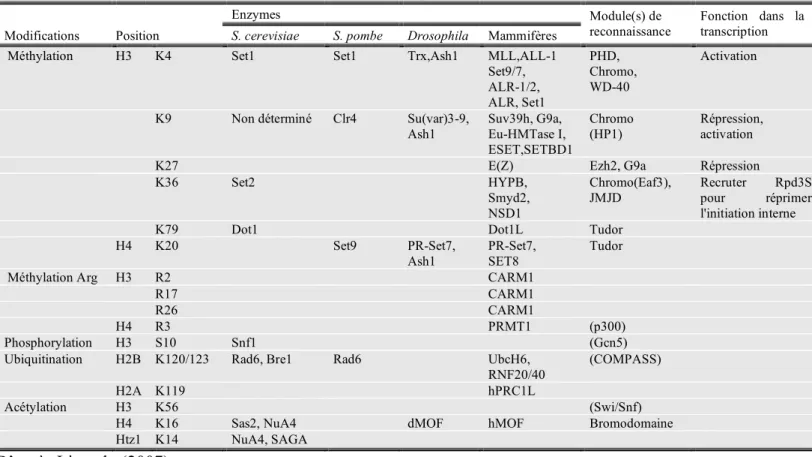
Plus précisément, 200 pb de séquences sans nucléosomes existent autour des promoteurs de gènes (Yuan et al., 2005). L'acétylation des histones H3 et H4, qui est souvent associée à l'activation transcriptionnelle, s'avère également plus importante dans ces régions et est proportionnelle au niveau de transcription des gènes (Pokholok et al., 2005). Le complexe SWI/SNF, qui porte l'activité acétyl transférase (HAT) souvent associée à l'activation transcriptionnelle, est nécessaire à la fluidisation des premiers nucléosomes ( Corey et al., 2003 ).
La régulation de la transcription
- Les répresseurs
- Les activateurs
- Les coactivateurs
Ils agissent en favorisant la formation du complexe d'initiation ou en modifiant la structure de la chromatine pour la rendre plus favorable à la transcription (Naar et al., 2001). Ce type de modification entraîne généralement un amincissement de la chromatine et favorise la transcription. Le rôle des complexes de remodelage de la chromatine ne semble pas se limiter à la transcription.

Le facteur général de la transcription TFIIH
Les sous-unités de TFIIH
- Le cœur de TFIIH
- Le sous-complexe TFIIK/CAK
En revanche, il ne semble jouer aucun rôle lors de la transcription (Coin et al., 2006). Enfin, le module CAK/TFIIK ne semble pas impliqué dans le NER (Svejstrup et al., 1995). Son activité kinase pourrait même inhiber l'activité du TFIIH dans ce processus (Araujo et al., 2000).
La structure de TFIIH
Il joue un rôle structurel extrêmement important car il participe avec XPD/Rad3 à l'association des deux modules TFIIH ( Feaver et al., 2000 ; Keogh et al., 2002 ). Des études réalisées avec des mutants sensibles à la température de Tfb3 chez la levure ont révélé son implication dans la progression du cycle cellulaire et le NER ( Feaver et al., 2000 ; Jona et al., 2002 ). La superposition des modèles TFIIH humain et levure montre que les complexes adoptent la même organisation et présentent ainsi une similarité remarquable.
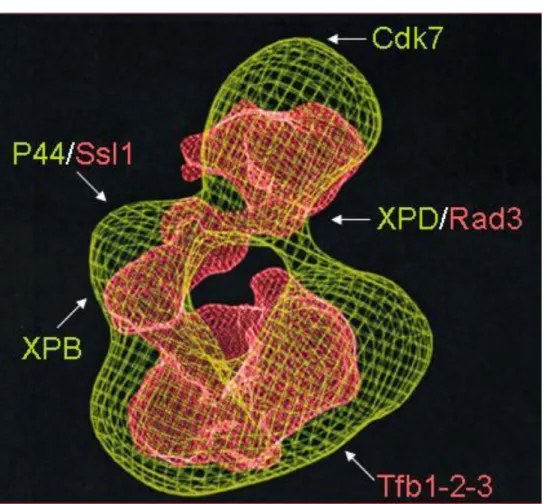
Les fonctions de TFIIH
- Rôle dans la réparation de l'ADN
- Rôle dans le cycle cellulaire
- Rôle dans l'initiation de la transcription par l'ARN polymérase II
Le rôle de la protéine MAT1 est de stabiliser l'association Cdk7 et cycline H (Fisher et al., 1995). TFIIH permettrait ainsi la régulation de ces récepteurs et le contrôle de l'activation transcriptionnelle de leurs gènes cibles. Cette réduction est équivalente à celle observée chez le mutant Rpb1 de la sous-unité Pol II (Holstege et al., 1998).
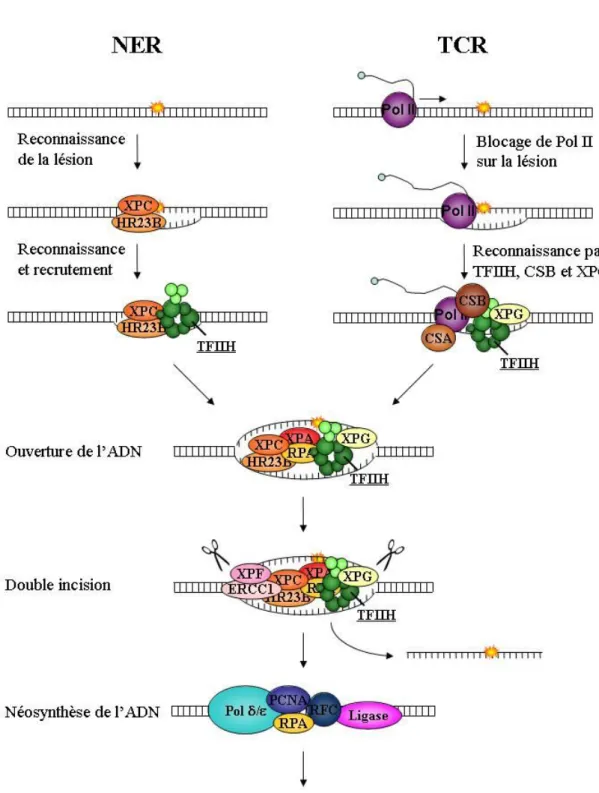
Le facteur d’élongation TFIIS
Identification et caractérisation de TFIIS
Une étude biophysique récente utilisant des molécules Pol II isolées in vitro a montré que TFIIS augmente la force exercée par Pol II. Le facteur TFIIS favorise donc la progression de Pol II au cours de l'élongation en réduisant la durée des pauses et en augmentant la force de Pol II pour l'aider à traverser les nucléosomes. Si le bloc persiste, la pause est suivie d'une rétraction de Pol II, qui éloigne l'extrémité 3' de l'ARNm naissant du site actif.
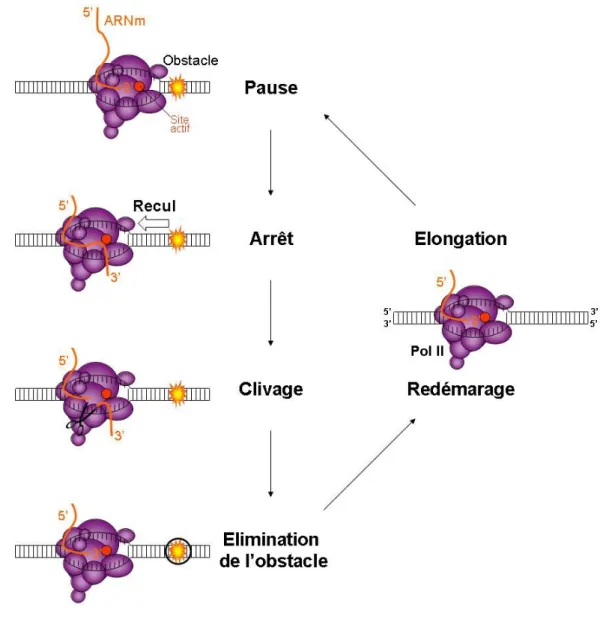
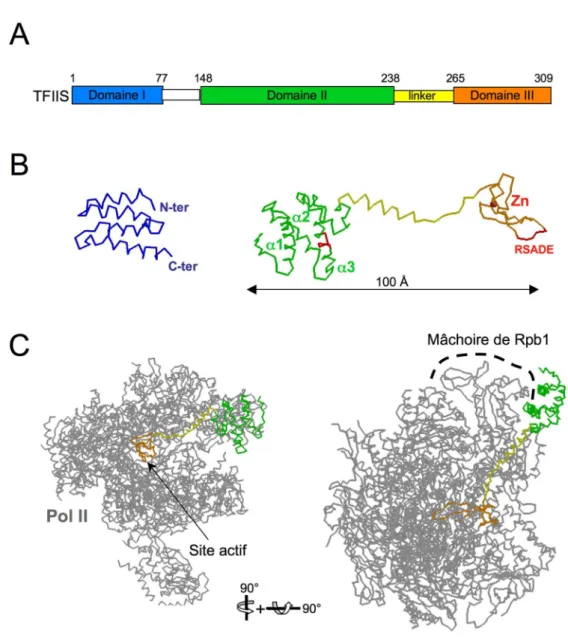
Structure et mode d’action de TFIIS
Panneau de droite : Structure des domaines II et III obtenue par diffraction des rayons X du complexe TFIIS/Pol II. Les résidus basiques requis pour la liaison de TFIIS à Pol II et le motif RSADE essentiel à l'activité de clivage sont indiqués en rouge. Le Domaine II joue donc un rôle clé au sein de TFIIS puisqu'il est responsable de son association avec Pol II.
Le Médiateur de la transcription par l'ARN polymérase II
Le Médiateur de Saccharomyces cerevisiæ
- Découverte et caractérisation du Médiateur
- Organisation et structure du Médiateur de S. cerevisiae
Récemment, une 25ème sous-unité a été découverte simultanément dans notre laboratoire et celui de Claes Gustafsson (Guglielmi et al., 2004 ; Linder et Gustafsson, 2004). Enfin, le module Cdk8 copurifie indépendamment du reste des sous-unités par purification à l'aide du tag TAP (Borggrefe et al., 2002). Un modèle du complexe Mediator associé à Pol II a été obtenu à la résolution de 40 Å (Asturias et al., 1999).
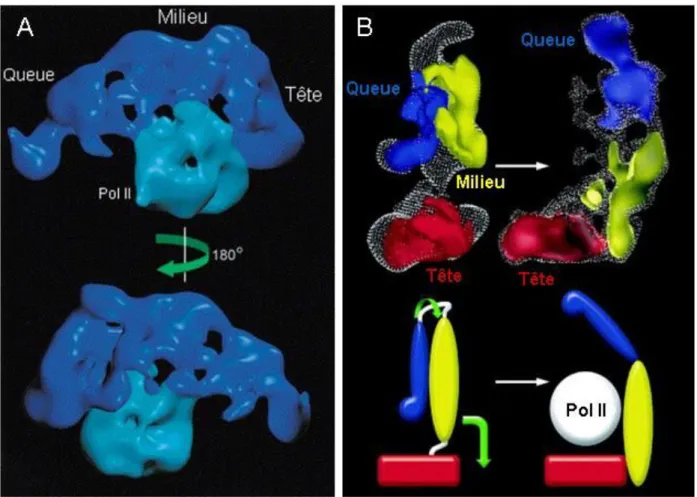
Le Médiateur des animaux
- Identification et composition
- Conservation du Médiateur
- Interactions entre le Médiateur et les activateurs spécifiques
- Interactions entre le Médiateur et l'ARN polymérase II
- Interaction entre le Médiateur et les facteurs généraux
- Etudes du recrutement du Médiateur sur l’ADN in vivo
- Le Médiateur et les autres coactivateurs
- Le Médiateur, une plateforme pour la réinitiation
- Activité de modification des histones du Médiateur
- Régulation négative de la transcription par le Médiateur
- Le Médiateur : un facteur général de la transcription
La caractérisation du Mediator purifié a ensuite montré que le complexe interagit avec le CTD in vitro (Myers et al., 1998). De même, le Mediator purifié à partir de cellules murines interagit directement avec le CTD (Jiang et al., 1998). Le médiateur stimule la transcription basale et activée in vitro en présence de facteurs de transcription généraux (Kim et al., 1994).
De plus, la structure du complexe TFIIB/Pol II a été résolue par cristallographie ( Bushnell et al., 2004 ). L'étude du gène inductible GAL1 a montré que le Médiateur se lie à l'UAS indépendamment des facteurs de transcription généraux (Kuras et al., 2003). La fixation de Met4 permettrait le recrutement indépendant de Mediator et de SAGA (Leroy et al., 2006).
De tels changements sont souvent associés à un amincissement de la chromatine et favoriseraient la transcription (Li et al., 2007). Ce profil de phosphorylation au niveau du promoteur conduirait à une inhibition de la transcription par Pol II (Hengartner et al., 1998b). De plus, le module peut également activer la transcription de certains gènes (van de Peppel et al., 2005).
De plus, Mediator est essentiel à la régulation de la transcription par des activateurs spécifiques (Kim et al., 1994 ; Takagi et Kornberg, 2006).
Contexte du travail
Ces deux complexes sont des coactivateurs intervenant dans la phase d'initiation. Pour définir l'association entre Mediator et TFIIS et déterminer les activités de TFIIS impliquées dans cette interaction génétique, nous avons analysé le co-létalité entre DST1 et MED31. Étonnamment, nous avons constaté que le domaine II et l'éditeur de liens TFIIS complètent la double suppression de DST1 et MED31 (dst1-! med31-!).
In vitro, ce mutant est altéré dans l'association de TFIIS avec Pol II (Awrey et al., 1998). Nous avons ensuite étudié, par ChIP, l'association des TFIIS sur les promoteurs et ORFs de gènes dont le niveau d'expression est affecté sur une puce à ADN dans le contexte med31. Conformément à un rôle lors de l'initiation, nous avons observé que TFIIS occupe le promoteur de ces gènes.
Nous avons ensuite montré que le recrutement du TFIIS est indépendant de celui de la Pol II. Toutes ces données nous permettent de proposer un nouveau rôle pour TFIIS lors de la phase d'initiation de la transcription ou TFIIS via son interaction avec. RÔLE DU MÉDIATEUR ET DU TFIIS DANS L'ÉTAPE D'INITIATION Rpb1 joue un rôle commun avec le Médiateur dans le recrutement du promoteur de l'ARN polymérase II.
De plus, cette étude suggère un rôle pour Mediator et SAGA dans le recrutement de TFIIS (Kim et al., 2007).
Article 1
Thus, we propose that TFIIS is required for optimal occupancy of Pol II at the promoters of a subset of S. We found that the capacity of TFIIS to stimulate the hydrolytic activity of Pol II was dispensable in med31-. Structural and biochemical data suggest that a basic patch of the TFIIS II domain is essential for Pol II binding ( 7 , 8 ).
This observation suggested that the Pol II-binding function of TFIIS is essential in medicine. Requirement of R200 residue of TFIIS and Med31 for Pol II recruitment to a subset of yeast promoters. TFIIS domain II is required for the recruitment of Pol II to the promoter of ADH1, MET17, and VTC3.
The growth defect observed in the dst1-R200A mutant could be due to lower Pol II recruitment or stability at affected promoters. On the contrary, recruitment of Pol II was diminished twofold on promoters and coding sequences in dst1-R200A med31-. As Pol II occupancy was diminished at ADH1, MET17 and VTC3 promoters and ORFs in dst1-R200A med31-.
Importantly, this novel function of TFIIS is independent of its cleavage activity but requires its Pol II binding domain.

Contexte du travail
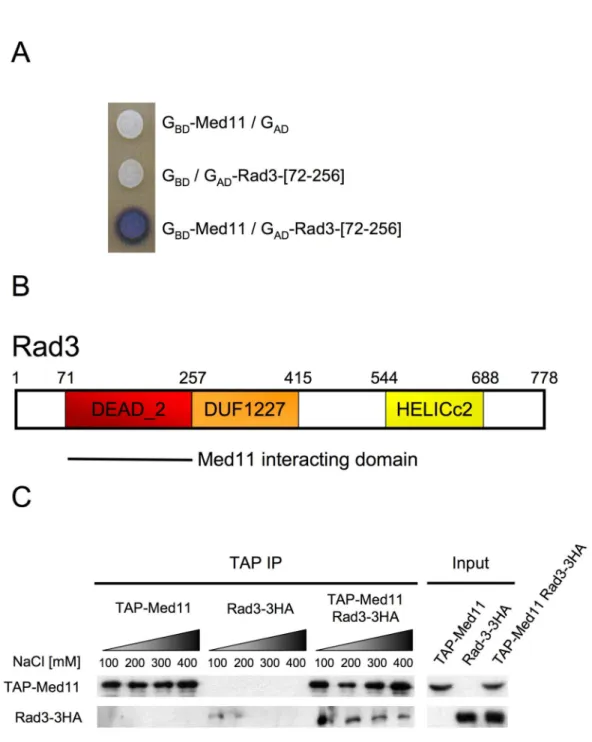
Nous avons observé que seul le mutant défectueux pour toutes les interactions Med11 connues (med11-L82P) affecte l'intégrité du module. Ces trois mutants ont ensuite permis d'étudier le rôle du Médiateur dans la création du PIC. En revanche, les trois mutants réduisent l'occupation des derniers participants au PIC : Pol II, TFIIE et TFIIH.
Étonnamment, contrairement à la séquence d’assemblage in vitro, le mutant med11-G107S, spécifiquement affecté par l’interaction entre Med11 et Med17, présente un défaut d’occupation de Pol II sans affecter celle de TFIIE et TFIIH. Le mutant med11-T47A, affecté par l'interaction avec Rad3, réduit spécifiquement l'occupation du module TFIIK. Enfin, le mutant med11-L82P, affecté pour toutes les interactions testées, réduit l'occupation de Pol II, TFIIE et de l'ensemble du complexe TFIIH sur la chromatine.
Ces trois mutants indiquent que Mediator affecte l'établissement du PIC en favorisant indépendamment l'occupation de Pol II et TFIIH/TFIIE et en stabilisant la connexion entre TFIIK et le noyau TFIIH. Ainsi, nous avons pu constater, conformément à la diminution du niveau d'occupation du module TFIIK sur le promoteur du gène ADH1, que le niveau de phosphorylation du CTD diminuait chez le mutant med11-T47A. Nous nous sommes ensuite assurés que le mutant Med11-T47A n'était pas affecté dans cette activité.
Tous ces résultats indiquent que Mediator affecte l'assemblage du PIC en favorisant l'occupation de Pol II indépendamment de TFIIH et TFIIE et en stabilisant le complexe TFIIH.
Article 2
Role of mammalian transcription factors IIF, IIS, and IIX during RNA polymerase II elongation. Mapping the location of TFIIB in the RNA polymerase II transcription preinitiation complex: a model for the structure of PIC. Opposing effects of Ctk1 kinase and Fcp1 phosphatase at Ser 2 of RNA polymerase II C-terminal domain.
Yeast NC2 binds to the RNA polymerase II initiation complex and selectively affects transcription in vivo. A protein kinase that phosphorylates the C-terminal repeat domain of the largest subunit of RNA polymerase II. Binding of the histone methyltransferase Set2 to RNA polymerase II plays a role in transcription elongation.
Two cyclin-dependent kinases promote RNA polymerase II transcription and formation of the scaffold complex.