UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
EOSINÓFILOS E PROTEÍNA CATIÔNICA EOSINOFÍLICA NA URINA: UMA NOVA ABORDAGEM PARA O DIAGNÓSTICO DA INFLAMAÇÃO RENAL NO LÚPUS
ERITEMATOSO SISTÊMICO
TEREZA NEUMA DE SOUZA BRITO
ii
TEREZA NEUMA DE SOUZA BRITO
EOSINÓFILOS E PROTEÍNA CATIÔNICA EOSINOFÍLICA NA URINA: UMA NOVA ABORDAGEM PARA O DIAGNÓSTICO DA INFLAMAÇÃO RENAL NO LÚPUS
ERITEMATOSO SISTÊMICO.
ORIENTADORA: PROFA. DRA. VALÉRIA SORAYA DE FARIAS SALES CO-ORIENTADORA: PROFA. DRA. MARIA JOSÉ PEREIRA VILAR
NATAL/RN 2011
iii
Catalogação da publicação na fonte B862e
Brito, Tereza Neuma de Souza.
Eosinófilos e proteína catiônica eosinofílica na urina: uma nova abordagem para o diagnóstico da inflamação renal no lúpus eritematoso sistêmico / Tereza Neuma de Souza Brito. – Natal/RN, 2011.
62f.: il.
Orientadora: Profª Drª Valéria Soraya de Farias Sales. Co-orientadora: Profª Drª Maria José Pereira Vilar.
Tese (Doutorado em Ciências da Saúde) - Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde.
1. Eosinófilos – Tese. 2. Proteína catiônica eosinofílica – Tese. 3. Lúpus eritematoso sistêmico – Tese. I. Sales, Valéria Soraya de Farias. II. Vilar, Maria José Pereira. III. Título.
iv
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
v
TEREZA NEUMA DE SOUZA BRITO
EOSINÓFILOS E PROTEÍNA CATIÔNICA EOSINOFÍLICA NA URINA: UMA NOVA ABORDAGEM PARA O DIAGNÓSTICO DA INFLAMAÇÃO RENAL NO LÚPUS
ERITEMATOSO SISTÊMICO
BANCA EXAMINADORA: Presidente da Banca
Profa. Dra.Valéria Soraya de Farias Sales – UFRN Membros da Banca
Profa. Dra. Valéria Soraya de Farias Sales - UFRN Prof. Dr. Max Victor Carioca Freitas - Externo
Profa. Dra. Profa. Dra. Amália Cinthia Meneses do Rego - Externo Prof. Dr. Maurício Galvão Pereira - UFRN
Prof. Dra. Elaine Lira Medeiros Bezerra - UFRN
vi
“Sei que meu trabalho é uma gota no oceano,
mas sem ele o oceano seria menor”.
vii
DEDICATÓRIA Dedico este trabalho a...
Deus, por ter me dado força, fé, sabedoria e esperança para ser perseverante e alcançar com as suas bênçãos mais uma vitória em minha vida. Pelo amor incondicional, sem limites...
Meu marido Ribamar e a meus filhos Ana Luiza e André Luiz, razões maiores da minha vida..., a meu genro João Luis e a nora Albirea Shinobu
viii
AGRADECIMENTOS
Aos pacientes, pela disponibilidade e pela lição de incentivo, apesar de toda a sintomatologia da doença, não se negaram em participar da pesquisa.
Ao Programa de Pós-graduação em Ciências da Saúde pela oportunidade de realizar esse trabalho e pelos conhecimentos adquiridos durante todo este periodo.
A minha orientadora, Profa Dra Valéria Soraya de Farias Sales primeiramente por ter
aceitado me orientar, pelos ensinamentos em imunologia, pela amizade, companheirismo e pelo apoio.
A minha co-orientadora Profa Dra Maria José Pereira Vilar, obrigada pela disposição em ajudar, discutir e ensinar. Sua participação foi fundamental para o desenvolvimento desse trabalho.
A Dr José Bruno Almeida pelo apoio e incentivo constantes para que se faça uma Uroanálise de qualidade e pelas correções e sugestões no trabalho.
A Maria do Carmo Cardoso de Medeiros (Carminha) pelos ensinamentos e ajuda na imunofluorescência.
A Juliana Cavalcante e Dra. Luiza Karla P. Arruda (USP-RP) pela grande ajuda na realização das dosagens da ECP.
A todas as pós-graduandas do laboratório de imunologia clínica pela grande ajuda nas fosforilações da imunologia, pelas “cytokines” e também pela amizade.
ix
Mikelison) e ao pessoal da sala de coleta (Giliane Lemos, Lúcia Jacinto, Ana Júlia e Alexandro) que não mediram esforços para ajudar no trabalho.
Aos funcionários: do HUOL, Virtolino Neto, Oscar e Elisângela, pela ajuda na coleta e transporte das amostras até o laboratório.
A Dona Amélia Silva de Morais e Evanilda Lopes da Silva, do DACT, pelo cuidado em manter todo o laboratório sempre pronto para realização das análises. Vocês foram fundamentais para que as análises fossem corretas.
Aos residentes da enfermaria de reumatologia pela ajuda no preenchimento do protocolo clínico e do Mex-SLEDAI.
Aos meus amigos e colegas farmacêuticos Zélia Maria de Sousa (Zelinha), Edna Marques de Araújo Silva, Maria Goretti do Nascimento Santos, Geraldo Barroso C. Júnior, Ana Claúdia Galvão Freire Gouveia, Sandra Resende de Andrade, Ivanaldo Amâncio da Silveira, Maiza Rocha Abrantes, Elizabeth (Eliuza), Tatiana Xavier e Ivonete Batista de Araújo pela torcida e pela ajuda intelectual e espiritual constantes e também por dividir comigo as angústias dessa etapa da vida.
A Vivian Silbiger e André Luchesi pela ajuda na organização do artigo e nas dúvidas de informática.
Aos professores e colegas da Bioquímica Clínica e da Uroanálise pelo incentivo e apoio..
x
LISTA DE ABREVIATURAS E SIGLAS ACR - American College of Rheumatology
AIN - Acute interstitial nephritis
Anti-dsDNA - Anti-double-stranded DNA AUC – Área sob a curva
CEP- Comitê de Ética em Pesquisa, C3 e C4- complementos 3 e 4 Cr - Creatinina
ECP - Proteína Catiônica Eosinofílica EDN - Neurotoxina Derivada do Eosinófilo eGFR - Estimated glomerular filtration rate EPO - Peroxidase do Eosinófilo
EPX - Proteína X do eosinófilo FEIA - Fluoroenzymeimmunoassay
GM-CSF - Fator estimulador de colônias de granulócitos-macrófagos HPF - High power field
HUOL – Hospital Universitário “Onofre Lopes” IFN-γ - Interferon-γ
IL-5 – Interleucina 5
IQR – Range Interquartílico kDA – Quilo Daltons
xi LTC4 e LTD4 – Leucotrieno 4
MCP - Proteínas quimioatrentes de monócitos
MEX-SLEDAI - Mexican version of the SLE Disease Activity Index Mg - Miligrama
MIP-1α - Proteína inflamatória do macrófago
NIA – Nefrite Intersticial Aguda PAF - Fator ativador de plaquetas Pg - Picograma
Pr - Proteína
RNase A – Ribonuclease A
ROC - Receiver operating characteristic SD – Desvio Padrão
SLE – Systemic lupus erythematosus
TGF α/β - Fator de transformação do crescimento
TNF-α - Fator de necrose tumoral
uECP - Proteína Catiônica Eosinofílica Urinária
UFRN – Universidade Federal do Rio Grande do Norte VIP - Peptídeo vasoativo intestinal
xii
LISTA DE TABELAS Artigo 1
Table 1: Baseline characteristics and laboratory parameters observed for select patients per group, of all SLE patients included (n=74).
Table 2: Laboratory values for 74 SLE subjects with and without renal disease.
Table 3: Results of correlation between variables of the study and laboratory results that evaluate the involvement of renal function and disease activity in SLE.
xiii
LISTA DE FIGURAS Artigo 1
Figure 1: Eosinophiluria by Hansel´s stain (400X) (arrow).
Figure 2: Curve of receiver operating characteristic (ROC) in SLE patients to detect cut-off of eosinophiluria, uECP and uECP-Cr ratio, classified by state variables Pr/Cr ratio ≥2 (A) and eGFR ≤60 mL/min (B):
Artigo 2
xiv SUMÁRIO
1 INTRODUÇÃO 16
2 REVISÃO DA LITERATURA 18
3 ANEXAÇÃO DE ARTIGOS 23
3.1 ARTIGO 1.Resumo expandido 24
3.1.1 Abstract 25
3.2 ARTIGO 2 26
3.2.1 Abstract 27
3.2.2 Introdution 28
3.2.3 Patients and methods 30
3.2.4 Results 34
3.2.5 Discussion 36
3.2.6 Key Messages 41
3.2.7 Acknowledgements 41
3.2.8 References 42
4 COMENTÁRIOS, CRÍTICAS E SUGESTÕES 51
5 APÊNDICES 56
6 ANEXOS 57
6.1 Anexo 1 – Protocolo clínico 57
6.2 Anexo 2 – Mex-SLEDAI 58
6.3 Anexo 3 - Parecer do Comitê de Ética 59
xv RESUMO
O objetivo desse trabalho foi investigar o eosinófilo e a proteína catiônica eosinofílica (ECP) na urina de pacientes com Lúpus Eritematoso Sistêmico (LES), com e sem nefrite lúpica, como possíveis marcadores de inflamação renal. Foram estudados 74 pacientes com LES 20 com evidência clínica e laboratorial de nefrite lúpica (LN grupo) e 54 sem envolvimento renal (não-LN grupo) quanto à eosinofilúria e ECP urinária (uECP). A eosinofilúria foi observada através da coloração de Hansel e as concentrações de ECP urinária foram obtidas por fluoroenzimaimunoensaio e em seguida corrigidas pela creatinina urinária (uECP/uCr). As variáveis do estudo foram comparadas com a hematúria glomerular, relação proteína/creatinina urinária (uPr/uCr), creatinina sérica, clearance de creatinina estimado, anti-dsDNA, níveis séricos dos complementos C3 e C4, relação IL-5 urinária/creatinina e com o Índice de atividade da doença LES (Mex-SLEDAI). A avaliação preditiva da eosinofilúria e uECP foi observada através da curva ROC e o nível de significância do estudo foi p valor<0,05. Os resultados mostraram que a eosinofilúria e as concentrações da uECP e uECP/uCr foram mais elevadas nos pacientes do LN grupo em relação ao não-LN grupo (p<0,001 para todos). Essas variáveis mostraram uma correlação estatisticamente significativa com a hematúria, dismorfismo eritrocitário glomerular, cilindrúria, relação uPr/uCr, creatinina sérica, clearance de creatinina estimado, anti-dsDNA, relação IL-5 urinária/creatinina e com o Mex-SLEDAI (p<0,05). Os resultados da curva ROC mostraram uma melhor performance (área sob a curva-AUC) para a uECP/uCr, usando como variável de classificação a uPr/uCr (AUC=0,94) e o clearance de creatinina estimado (AUC=0,84), p<0,0001. Conclui-se que dentre as variáveis do estudo, a uECP/uCr pode servir como um novo marcador de inflamação renal em pacientes com LES.
16
1 INTRODUÇÃO O Lúpus Eritematoso Sistêmico (LES) é uma doença autoimune, multifatorial caracterizada pela produção de auto-anticorpos, formação de imunocomplexos e inflamação em diferentes órgãos, sendo o rim um dos órgãos mais afetados. Sua patogênese é desencadeada tanto por fatores genéticos, ambientais e hormônios sexuais quanto por anormalidades do sistema imune inato e adaptativo. A ativação anormal de células T, B e células apresentadoras de antígenos tem como resultado final a produção dos auto-anticorpos patogênicos altamente específicos, a ativação do sistema complemento e a presença de células inflamatórias em órgãos-alvo [1-4].
Dentre as células envolvidas na fisiopatologia de inúmeros processos inflamatórios estão os eosinófilos, que são recrutadas para o local da inflamação onde modulam a resposta imune inata e adaptativa através de uma série de mecanismos, tais como secreção de proteínas catiônicas, citocinas pró-inflamatórias, quimiocinas, mediadores lipídicos e expressão de receptores para citocinas, imunoglobulinas, complemento, dentre outros [5-7].
17
A proteína catiônica eosinofílica (ECP) vem sendo estudada como marcador em processos inflamatórios do trato respiratório, dermatite atópica e outras doenças inflamatórias [12], mas no LES não foi encontrado relato na literatura.
18
2 REVISÃO DA LITERATURA
Estudos epidemiológicos de prevalência e incidência de LES em todo o mundo apresentam resultados bem variáveis. A incidência está na faixa de 1 a 10/100.000 habitantes/ano e a prevalência de 16 a 70/100.000 habitantes/ano. Acomete mais predominantemente as mulheres, entre 20 e 30 anos de idade [14]. No Brasil, particularmente no Nordeste, na cidade de Natal onde a exposição aos raios ultravioletas é intensa, a incidência é de 8,7/100.000 habitantes [13].
O envolvimento renal no LES ocorre em aproximadamente 25 a 60% dos pacientes e tem um espectro de severidade muito variado podendo evoluir, em cerca de 10 a 15%, para uma doença renal terminal, a qual contribui significativamente para morbidade e mortalidade desses pacientes. A biópsia renal é o padrão ouro para classificar o tipo histológico de nefrite, no entanto, como é um procedimento invasivo e com riscos de hemorragia e infecção, não é uma metodologia satisfatória para monitorar o envolvimento renal, que exige um monitoramento de longo prazo. O advento da precisão de biomarcadores para prever, diagnosticar e monitorar a nefrite lúpica será uma grande conquista na ajuda aos pacientes com LES [15-19].
19
diversos estudos tem sugerido uma possível contribuição das células T helper (Th2). Foi observado que os imunocomplexos são constituídos por imunoglobulinas IgM, IgG e IgA bem como por IgE e já foi constadada a presença de IgE auto-reativa no soro de alguns pacientes com LES sem associação à atopia e alergia [20-22].
Dentre as células que desempenham importante papel na resposta Th2, o eosinófilo, que é um leucócito multifuncional das doenças alérgicas, parasitárias e que participa no reparo do tecido vem sendo apontado como uma célula envolvida na modulação da resposta imune inata e adquirida [23].
O eosinófilo é também um componente do microambiente imune local, tem atividade autócrina e quando ativado secreta para o local da inflamação, proteínas citotóxicas, presentes em seus grânulos secretórios secundários ou específicos. São elas, a Proteína Básica Principal (MPB), Proteína Catiônica Eosinofílica (ECP), Neurotoxina Derivada do Eosinófilo/Proteína X do eosinófilo (EDN/EPX) e a Peroxidase do Eosinófilo (EPO) [5-7, 23].
Além das proteínas catiônicas, o eosinófilo também secreta as interleucinas, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12, IL-13, IL-18, fator de transformação do crescimento (TGF α/β), fator estimulador de colônias de
granulócitos-macrófagos (GM-CSF), fator de necrose tumoral (TNF-α) e
interferon-γ (IFN-interferon-γ)], mediadores lipídicos como o leucotrieno 4 (LTC4 e LTD4) e fator
20
inflamatória do macrófago (MIP-1α), a RANTES, proteínas quimioatrentes de
monócitos MCP – 3 e 4, a substância P e o peptídeo vasoativo intestinal (VIP) [5, 6, 23].
A Proteína Catiônica Eosinofílica (ECP), é uma glicoproteína com peso molecular entre 18 e 21 kDa, pertencente à superfamília das ribonucleases A (RNase A). Corresponde a cerca de 30% das proteínas dos grânulos do eosinófilo e está envolvida na resposta imune. As concentrações de ECP nos fluidos biológicos indicam a ativação e degranulação do eosinófilo e são usadas para o diagnóstico e monitoramento de doenças inflamatórias [12, 24-26].
A presença de eosinófilos na urina foi primeiramente sugerida por Galpin e colaboradores (1978), que acharam essa célula na urina em nove pacientes que tinham nefrite intersticial aguda induzida por meticilina e não encontraram em outros pacientes com deficiência renal por outras causas. [27]
A eosinofilúria pode refletir uma resposta inflamatória não específica, mas a sua investigação tem sido associada a várias condições clínicas que afetam os rins e o trato urinário, especialmente os casos de nefrite intersticial aguda (NIA) induzida por fármacos [9-11].
21
A variação circadiana da ECP sérica e da EPX sérica e urinária foi analisada e mostrou níveis máximos dessas proteínas durante a noite e no período matinal. Isto sugere que estudos de marcadores inflamatórios no sangue e na urina devem ser realizados para validação e que os marcadores inflamatórios não exibem apenas uma variação circadiana, mas também podem sofrer influências das variações sazonais e espontâneas do dia-a-dia [29]. A presença de eosinofilúria e detecção da ECP, em extratos de urina foram evidenciadas em crianças escolares da Tanzânia infectados pelo Schistosoma haematobium e que
apresentavam alterações patológicas na bexiga [24].
Em uma experiência com 183 pacientes com diversas condições clínicas, sendo as mais comuns, infecção do trato urinário e nefrite intersticial aguda, que tiveram suas urinas testadas para eosinofilúria, utilizando a coloração de Hansel, foi constatado, que a mesma é um bom indicador de NIA [10]. Estudo em 148 pacientes, dos quais 44 apresentavam diagnóstico de comprometimento do trato genitourinário com presença de leucócitos na urina foi encontrado eosinofilúria em 9 pacientes na proporção de 1/500 a 1/100 e em 2 pacientes valores superiores a 1/100. De 15 pacientes com NIA, 6 tinham eosinofilúria positiva acima de 1/100 e em 36 pacientes com outras falhas renais, dez apresentavam positividade acima de 1/100 [30].
22
23
3 ANEXAÇÃO DE ARTIGOS
Artigo 1: Resumo Expandido: Publicado: Clinical Chemistry and Laboratory Medicine. Volume 46, Pages: S689–S772, ISSN (Online) 1437-4331, August 2008. Published Online: August 2008. Impact Factor: 1,89
Artigo 2- Enviado para publicação em 07 de setembro de 2011 no periódico Rheumatology e recebeu o número RHE-11-1135 .
24 Artigo 1
Title
EOSINOPHILURIA: FINDINGS FREQUENT OR SPORADIC?
Freire S.A.V.1, Oliveira T.V.C.1, Silva C.G.O.1, Pereira R.M.1, Xavier C.E.S.1, Cavalcanti J.E.C.1, Sales V.S.F.1, Vilar M.J.P.2, Brito T.N.S.1
1Clinic Analysis and Toxicology Department, Federal University of Rio Grande do
Norte, Natal, 59012-570 Brazil
2University Hospital Onofre Lopes, Federal University of Rio Grande do Norte,
Natal, 59012-570 Brazil H019 – Abstract
Introduction The eosinophiluria may reflect an inflammatory response is not specific, but their investigation has been associated with several clinical conditions that affect the kidneys and urinary tract, especially the cases of acute nephritis interstitial (NIA) induced by drugs or immune complex.
Objective. This study aimed to analyze the occurrence of eosinophiluria in samples of urine with leukocytes.
25
Results The results showed that about the clinical indication, 62.38% (n=64) of the patients had some nephropathy and 37.62% (n=38) did not. Among the patients who had kidney disease, 46.03% (n = 29) had lupus nephritis, 15.87% (n = 10) ITU, 9.52% (n = 6) IRC and 7.93% (n = 5) GNDA. Among those who did not have kidney disease, the systemic lupus erythematosus (SLE) was the most frequent with 57.89% (n = 22) of cases. The eosinophiluria was positive in 36.63% (n = 37) patients with an average 109 ± 2.98 eosinophils high power field.
Conclusions The findings of eosinophiluria were discrete and more frequent in patients with lupus nephritis and systemic lupus erythematosus without clinical indication of nephritis.
Keys words. eosinophiluria; systemic lupus erythematosus; Hansel’s stain; leukocytes.
26 Artigo 2
Title
Eosinophil and eosinophil cationic protein in urine: a new approach to diagnosis of renal inflammation in systemic lupus erythematosus.
Author names
Tereza N S Brito1, Maria J Vilar2, José B Almeida3, Juliana A Cavalcante4, Ana L S B Faria4, Sarah D V Medeiros5, Maria C C Medeiros6, Telma M A M Lemos7, Edna M A Silva1, Vanessa M A Silva5, Luanda B F C Souza7, Luisa K P Arruda8, Tatiana
X Costa5, Geraldo B Cavalcanti Júnior1, Vivian N Silbiger7, Valéria S F Sales1. Author affiliation
1 Department of Clinical and Toxicological Analysis, Postgraduate program in
Health Sciences, Federal University of Rio Grande do Norte, Natal-RN, Brazil.
2 Division of Rheumatology, Department of Clinical Medicine, Postgraduate
program in Health Sciences, Federal University of Rio Grande do Norte, Natal-RN, Brazil.
3 Division of Nephrology, Department of Integrated Medicine, Federal University of
Rio Grande do Norte, Natal-RN, Brazil
4 Clinical Hospital, University of São Paulo, Ribeirão Preto-SP, Brazil.
5.Postgraduate program in Health Sciences, Federal University of Rio Grande do
Norte, Natal-RN, Brazil
6 Hospital Universitario Onofre Lopes, Federal University of Rio Grande do Norte,
27
7.Department of Clinical and Toxicological Analysis, Postgraduate in
Pharmaceutical Sciences, Federal University of Rio Grande do Norte, Natal-RN, Brazil.
8 Department of Clinical Medicine, Faculty of Medicine of Ribeirão Preto, University
of São Paulo (FMRP-USP), Ribeirão Preto-SP, Brazil.
Corresponding author:
Dr. Valéria Soraya de Farias Sales, Rua General Cordeiro de Farias, Faculdade de Farmácia, 2o andar, Disciplina Imunologia Clinica, Departamento de Analises Clinicas e Toxicológicas, Centro de Ciências da Saúde, Petrópolis, Natal-RN, Brazil. Email: vsfsales2011@hotmail.com; Fax number: (84)3342-9797.
ABSTRACT
Objective: To investigate eosinophils and eosinophil cationic protein in urine (uECP) in patients with systemic lupus erythematosus (SLE), either with or without lupus nephritis (LN), as a possible urinary marker of renal inflammation.
anti-double-28
stranded DNA (anti-dsDNA), serum levels of complement (C3 and C4), uIL-5/Cr ratio, and SLE disease activity index. To assess the predictive performance of study variables, receiver operating characteristic (ROC) curves were constructed. A significant level was p value < 0.05.
Results: Patients of the LN group had higher eosinophiluria, uECP, and uECP/Cr ratio levels than patients of the non-LN group (p<0.001 for all). These variables showed a statistically significant correlation with erythrocyturia, glomerular dysmorphic erythrocyte, casts, Pr/Cr ratio, serum creatinine, eGFR, anti-dsDNA, uIL-5/Cr, and SLE disease activity index (all p<0.05). The ROC curve results demonstrated the best performance (area under curve - AUC) of the ECP/Cr ratio using a state variable Pr/Cr ratio (AUC=0.94) and eGFR (AUC=0.84), p<0.0001. Conclusion: These findings indicate that among the study variables the uECP/Cr ratio could serve as a novel urinary marker of renal inflammation in SLE patients. Keywords
Eosinophils, Systemic Lupus Erythematosus, Eosinophil cationic protein.
INTRODUCTION
29
Although the precise pathogenesis of LN has not been fully elucidated, it is mostly attributable to the glomerular deposition of immune complexes and imbalance of the cytokine homeostasis,[7] which leads to a cascade of inflammatory events with recruitment of mononuclear cells, such as T cells, macrophages, and dendritic cells [8]. There is considerable evidence of the role of Th1 cells, Th17, and regulatory T (Treg) in SLE, and several studies have suggested a possible contribution of Th2 cells [9].
Among the cells that can secrete cytokines capable of promoting T-cell proliferation, activation of Th1, or Th2 polarization is the eosinophil. This is a granulocyte that has been pointed out in modulating both innate and adaptive immune responses. In response to the diverse stimuli, eosinophils are recruited from the circulation to inflammatory foci where they modulate immune responses through an array of mechanisms, such as secretion of cationic proteins and expression of receptors for cytokines, immunoglobulins, complement, and mRNA for a number of Toll-like receptors. They can initiate antigen-specific immune responses by acting as antigen-presenting cells [10-14].
30
Regarding cytokines, IL-5 is the most specific to the eosinophil lineage being responsible for selective differentiation, regulating growth, activation, and survival of eosinophils [10, 15].
Based on the findings of eosinophils in the urine of SLE patients, treated at the Rheumatology Unit of University Hospital Onofre Lopes (HUOL), Federal University of Rio Grande do Norte, Natal, Brazil, a region with high incidence of this disease [16], and on the role of eosinophils in various inflammatory diseases, this study was proposed with the aim of evaluating the eosinophiluria and urinary ECP levels of SLE patients, either with or without LN, as a possible urinary marker to renal inflammation of SLE patients.
PATIENTS AND METHODS Study population
Seventy-four patients with SLE diagnosis according to the American College of Rheumatology (ACR) [1] criteria, age ≥ 18 years, were selected in the rheumatology unit (HUOL-UFRN). Informed consent was obtained from the patients after approval by the local ethics committee, number 044/2006. The study was conducted according to the ethical guidelines of our institution (UFRN) and the Declaration of Helsinki. Disease activity was assessed by the Mexican version of the SLE Disease Activity Index (MEX-SLEDAI) [17].
31
glomerulonephritis. The presence of renal disease activity was defined by MEX-SLEDAI score ≥ 6 and by the presence of all of the following in the urine test: haematuria ≥ 1+, proteinuria ≥ 2+, active urinary sediment with erythrocyturia defined as ≥ 5 cells/ high power field (HPF or 40× magnification), casts (erythrocyte and/or granular, fatty, waxy, and renal tubular epithelial cells), and glomerular dysmorphic erythrocytes. In addition, the patients of the LN group also had to present serum creatinina ≥ 1mg/dL, low eGFR ≤ 60 mL/min, high proteinuria 24-hours ≥ 3g/L, high protein in the first morning urine (spot urine) corrected by creatinine (Pr/Cr ratio) ≥ 3, positive titers of anti-dsDNA (≥1:40), and decreased concentrations of serum C3 and C4 (Table 1).
Included in the LN group were only patients who received prednisone (≥ 1 mg/kg/day) for treatment of nephritis, up to a maximum of one week. Only three of these patients also received one intravenous pulse cyclophosphamide (0.5 g/m2
body surface area) in the same period. All patients in group LN also received antimalarial drugs, calcium channel blockers, angiotensin-converting enzyme (ACE) inhibitors, proton pump inhibitors, and diuretics.
32 Laboratory measurement
The laboratory evaluation, including the stool analysis of all patients, was performed twice, and 10 mL of venous blood, the midstream first morning urine, and urine of 24 hours were collected from each patient. The venous blood to clot for 60 min at 24oC, followed by centrifugation (10 min, 24oC, 1600g), and the
resulting serum samples were tested for anti-dsDNA, creatinine, eGFR, C3, and C4.
Standard urinalysis for glomerular dysmorphic erythrocyte, eosinophiluria, protein, and creatinine was performed in the first morning urine, midstream, and the supernatant (followed by centrifugation 5 min, 24oC, 400 g) was stored at -80oC
until analysis of uECP and uIL-5. Following the standard protocol used in laboratories, 24-h urine was collected and stored in the refrigerator. Next, this sample was measured and centrifuged (5 min, 24oC, 400 g) for determination of
proteinuria and glomerular filtration rate (creatinine clearance). Urinalysis was performed by experienced personnel following the good quality control procedures.
In this study, proteinuria was defined as Pr/Cr ratio, due to a strong correlation between the results found by two methods and in accordance with the recommendation of the Renal Disease Subcommittee of the American College of Rheumatology Ad Hoc Committee on Systemic Lupus Erythematosus Response Criteria [18].
33
eosinophiluria [19]. Importantly, this method is analyzer dependent and was observed by three experienced analyzers.
The uECP measurements were performed by the Pharmacia CAP System® ECP FEIA (fluoroenzymeimmunoassay) (Pharmacia, Uppsala, Sweden), with a coefficient of variation of 2.5%, according to the instructions of the manufacturer. The test is designed as a sandwich immunoassay. Inter- and intra-assay coefficients of variation were less than 8% and the detection limit was 0.5 µg/L. The uECP was determined following the same instructions used for serum ECP, and uECP levels were corrected to urine creatinine (uECP/Cr ratio) with results expressed as micrograms per milligram of creatinina (µg/mgCr).
The concentrations of uIL-5 were determined by quantitative sandwich enzyme immunoassay (Quantikine® Minneapolis, United States of America), according to the manufacturer’s instructions. This immunoassay is a solid phase ELISA designed to measure IL-5 levels in cell culture supernates, serum, plasma, and urine; the detection limit was <3,0 pg/mL. Concentrations of uIL-5 levels were corrected to urine creatinine (uIL-5/Cr ratio) and results were expressed as picrograms per milligram of creatinina (pg/mgCr).
Statistical analyses
34
and renal function tests was assessed using Pearson and Spearman's rank correlation coefficient.
Categorical variables were compared by chi-square test and continuous variables were compared by Student's t-test and Mann-Whitney U test. A receiver operating characteristic curve (ROC curve) was constructed using state variables, Pr/Cr ratio ≥ 2, and estimated GFR≤ 60 mL/min for comparison with eosinophiluria, uECP, and uECP/Cr ratio. Outcomes were determined by area under the ROC curve (AUC), sensitivity, and specificity tables. Two-tailed p-values less than 0.05
were regarded as statistically significant. Assuming a significance level (α) of 0.05
and a power (β) of 80%, the sample size used was able to detect statistical
significance for differences between groups of 1.5 points in eosinophiluria, 3.9 units in uECP, and 6.5 units in uECP/Cr ratio.
RESULTS
Baseline characteristics of patients
35 Laboratory findings
Eosinophiluria (as shown in Figure 1) was observed in 45% (n=9) of the patients in the LN group and 5.6% (n=3) in the non-LN group. The mean of eosinophiluria was significantly higher in patients in the LN group than that for patients in the non-LN group (p<0.001). The concentrations of uECP, uECP/ratio,
uIL-5, and uIL-5/Cr ratio were higher in the LN group than in the non-LN group (p
<0.05), (Table 2).
In addition, a statistically significant correlation was observed between study variables and active renal disease parameters, such as haematuria, glomerular dysmorphic erythrocyte, casts, Pr/Cr ratio, serum creatinine, eGFR, anti-dsDNA, serum C4, and SLE disease activity index (all p<0.05). Moreover, the strongest association was observed between uECP/Cr ratio and parameters: haematuria (rs=0.76), Pr/Cr ratio (rs=0.75), serum creatinine (rs=0.70), and MEX-SLEDAI
(rs=0.72), p<0.001. Urinary IL-5 and uIL-5/Cr ratio showed a statistically significant
correlation with eosinophiluria, uECP, and uECP/Cr ratio (p<0.05) (Table 3). The uIL-5/Cr also showed a statistically significant correlation with MEX-SLEDAI (rs=0.41), p<0.01.
36
(defined by Pr/Cr), and a sensitivity of 94%, a specificity of 66.7%, and AUC of 0.84 (defined by eGFR), p<0.001 all (Table 4).
DISCUSSION
The present study was the first investigating eosinophiluria and uECP as a possible urinary marker to evaluate renal inflammatory activity of SLE patients. The first step to achieve this objective was selecting SLE patients with and without renal inflammatory activity according to pre-established clinical and laboratorial data. Lupus nephritis is an organ-specific autoimmune disease characterized by intra-renal activation of inflammatory cells and the formation of glomerular, tubular, and interstitial lesions [20]. Interestingly, this study revealed a significant increase in eosinophiluria and uECP in patients with LN compared to patients without LN.
Lupus nephritis requires long-term monitoring over several years, as flares may occur, as well as progressive deterioration of renal function. Renal biopsy remains the gold standard to assess disease severity, while multiple biopsies to gauge treatment efficacy are not feasible due to their invasive nature with risks of bleeding and infection, thereby presenting a less satisfactory method for monitoring renal involvement in SLE [21, 22].
37
Urinary biomarkers may also reflect to some extent the degree of tubular dysfunction, rather than purely reflecting underlying glomerular pathology [26]. A biomarker that can forecast lupus nephritis flare well before thresholds of proteinuria, renal function, and urine sediment that signal clinical flare are reached would be a valuable tool [27]. Thus, novel biomarkers that are able to discriminate lupus renal activity and its severity, predict renal flares, and monitor treatment response and disease progress are clearly necessary [24, 25].
The clinical and laboratory differences presented between the two groups of patients selected for this study were consistent with literature data. Marks et al. [28] found that LN patients had higher urine albumin/creatinine ratios versus non-nephritis patients. Rubinstein et al. [29] found proteinuria (Pr/Cr ratio) greater than 2.0, decreased creatinine clearance, and SLE disease activity index (SLEDAI) ≥4 in SLE patients with biopsy-proven nephritis. A study by Guo et al. [30] found in patients with LN class IV, values of 24-h proteinuria≥ 3.0 g/day, increased serum creatinine, and a mean SLEDAI ≥9 in all patients, suggesting that most SLE patients that merged with renal diseases were in the active stage.
38
study, were similar to the findings of other authors in studies conducted in patients with acute interstitial nephritis (AIN), as published by Corwin et al. [32] (a sensitivity
of 63%) and Ruffing et al. [33] (a sensitivity of 40% and specificity of 72%).
Eosinophils in urine may be associated with a variety of clinical conditions, so some patients with indicator diseases were excluded in our study. There are no systematic studies of kidney diseases which are associated with increased amounts of eosinophils kidney [32, 34]. Therefore, no biopsies in this study could evaluate whether the positive eosinophiluria was due exclusively to eosinophils kidney.
39
Studies show that during inflammation whole eosinophil granules are released from disrupted cells and those internal proteins are subsequently released differentially through the process of piecemeal degranulation. Among the components of these granules, ECP is RNAse A superfamily, protein rich in arginine residues, which gives a high concentration of positive charges, promoting a strong attraction for molecules negatively charged existing in cell membranes [37]. This property may explain its cytotoxic power in the cell membranes causing the formation of pores or channels on the surface of the membrane, disrupting its lipid structure and possibly facilitating the entry of other cytotoxic molecules. Sensitive assays have been developed for its measurement in biological fluids which have contributed to the understanding of the role of the eosinophils in disease [10, 15].
40
Inflammatory diseases tend to share common pathways and thus many a potential biomarker will not be specific for a particular disease. Few biomarkers for SLE have been validated and employed for making clinical decisions given the complex etiopathogenesis, heterogeneous clinical manifestations, and varying rates of disease progression among individual SLE patients [3, 27].
In the present study, the uIL-5 had higher concentration in the LN group and after being corrected by creatinine (uIL-5/Cr ratio) showed better correlation with ECP/Cr ratio and MEX-SLEDAI. No article has yet been published in the literature showing the uIL-5/Cr in SLE. The increased levels of uIL-5 can justify the appearance of eosinophils and ECP in urine of the SLE patients studied because the cytokine IL-5, which is a key Th2 cytokine in eosinophil biology, is involved in eosinophil differentiation, maturation, and migration of these cells [38].
41
Our findings not only suggest that uECP/Cr ratio may be a urinary biomarker of renal inflammatory activity in SLE patients but also shows the need to investigate the role of eosinophils in the inflammatory process of nephritis in patients with systemic lupus erythematosus.
KEY MESSAGES
• Increased urinary eosinophils and uECP/Cr ratio levels in patients with history of lupus nephritis.
• Urinary ECP/Cr ratio could serve as a novel marker of renal inflammation in SLE.
Acknowledgements: We received a grant from Phadia Diagnostic Ltda for this research and would like to express our gratitude to them, and thank our patients for their participation.
Conflict of interest statement: All authors declare that they have no competing interests.
Funding statement: This publication was made possible by Postgraduate program in Health Sciences, Integrated Laboratory of Clinical Analysis and University Hospital Onofre Lopes, all of the Federal University of Rio Grande do Norte and Clinical Hospital, University of São Paulo. Its content is solely the responsibility of the authors.
42
(fluoroenzymeimmunoassay) assays. SDVM, MCCM, LBFCS and TNSB performed the ELISA (IL-5), Immunofluorescence (Anti-dsDNA, ANA) and Immunoturbidimetric (C3, C4) assays. TNSB, TMAML, EMAS, VMAS, TXC, MJV and VSFS contributed to the sample collection and data acquisition.
REFERENCES
1. Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997;
40:1725.
2. Gordon C, Jayne D, Pusey C, et al. European consensus statement on the terminology used in the management of lupus glomerulonephritis. Lupus
2009;18:257-63.
3. Liu CC, Ahearn JM. The search for lupus biomarkers. Best Pract Res Clin
Rheumatol 2009;23:507-23.
4. Borchers AT, Naguwa SM, Shoenfeld Y, Gershwin ME. The geoepidemiology of systemic lupus erythematosus. Autoimmun Rev 2010;9:A277-87.
5. Lightstone L. Lupus nephritis: where are we now? Current Opinion in
Rheumatology 2010;22:252-6.
6. Valesini G, Conti F. The Persistent Challenge of Lupus Nephritis. Clin Rev
Allergy Immunol 2011;40:135-7 doi:10.1007/s12016-010-8210-6 [published Online
First: 2 September 2010.
43
Rheum Dis 2010;69:2034-41 doi: 10.1136/ard.2009.124636 [published Online
First: 14 May 2010.
8. Tucci M, Stucci S, Strippoli S, Silvestris F. Cytokine overproduction, T-cell activation, and defective T-regulatory functions promote nephritis in systemic lupus erythematosus. J Biomed Biotechnol 2010;2010:1-6.
9. Charles N, Hardwick D, Daugas E, IIIei GG, Rivera J. Basophils and the T helper 2 environment can promote the development of lupus nephritis Nat Med
2010;16:701-7.
10. Rothenberg ME, Hogan SP. The eosinophil. Annu Rev Immunol
2006;24:147-74.
11. Jacobsen EA, Taranova AG, Lee NA, Lee JJ, Ariz, S. Eosinophils: Singularly destructive effector cells or purveyors of immunoregulation? Journal of Allergy and
Clinical Immunology 2007;119:1313-20.
12. Hogan SP, Rosenberg HF, Moqbel R, et al. Eosinophils: Biological Properties and Role in Health and Disease. Clinical & Experimental Allergy 2008;38:709-50.
13. Woschnagg C, Rubin J, Venge P. Eosinophil cationic protein (ECP) is processed during secretion. J Immunol 2009;183:3949-54.
14. Kampe M, Stolt I, Lampinen M, Janson C, Stalenheim G, Carlson M. Patients with allergic rhinitis and allergic asthma share the same pattern of eosinophil and neutrophil degranulation after allergen challenge. Clinical and Molecular Allergy
44
2011;12:1-20 doi: 10.1186/1465-9921-12-10 [published Online First: 14 January 2011.
16. Vilar MJP, Sato EI. Estimating the incidence of systemic lupus erythematosus in a tropical region (Natal, Brazil). Lupus 2002;11:528-32.
17. Bombardier C, Gladman DD, Urowitz MB, Caron D, Chang CH. Derivation of the sledai. A disease activity index for lupus patients. Arthritis & Rheumatism
1992;35:630-40.
18. Liang MH, Schur PH, Fortin P, et al. The American college of rheumatology response criteria for proliferative and membranous renal disease in systemic lupus erythematosus clinical trials. Arthritis & Rheumatism 2006;54:421-32.
19. Nolan CR, Anger MS, Kelleher SP. Eosinophiluria--a new method of detection and definition of the clinical spectrum. N Engl J Med 1986;315:1516-9.
20. Chan RW-Y, Lai FM-M, Li EK-M, et al. Messenger RNA expression of RANTES in the urinary sediment of patients with lupus nephritis. Nephrology
2006;11:219-25.
21. Christopher-Stine L, Siedner M, Lin J, et al. Renal biopsy in lupus patients with low levels of proteinuria. The Journal of Rheumatology 2007;34:332-5.
22. Kon T, Yamaji K, Sugimoto K, et al. Investigation of pathological and clinical features of lupus nephritis in 73 autopsied cases with systemic lupus erythematosus. Mod Rheumatol 2010;20:168-77.
23. Leung YY, Szeto CC, Tam LS, et al. Urine protein-to-creatinine ratio in an untimed urine collection is a reliable measure of proteinuria in lupus nephritis.
45
24. Manoharan A, Madaio MP. Biomarkers in lupus nephritis. Rheum Dis Clin
North Am 2010:6:131-43.
25. Mok CC. Biomarkers for lupus nephritis: a critical appraisal. J Biomed
Biotechnol 2010;2010:1-11 doi:10.1155/2010/638413 [published Online First: 22
March 2010.
26. Adhya Z, Borozdenkova S, Karim MY. The role of cytokines as biomarkers in systemic lupus erythematosus and lupus nephritis. Nephrology Dialysis Transplant
2011;0:1-8 doi: 10.1093/ndt/gfq860 [published Online First: 03 March 2011.
27. Rovin BH, Zhang X. Biomarkers for lupus nephritis: the quest continues. Clin J
Am Soc Nephrol 2009;4:1858-65.
28. Marks SD, Shah V, Pilkington C, Tullus K. Urinary monocyte chemoattractant protein-1 correlates with disease activity in lupus nephritis. Pediatr Nephrol
2010;25:2283-8.
29. Rubinstein T, Pitashny M, Levine B, et al. Urinary neutrophil gelatinase-associated lipocalin as a novel biomarker for disease activity in lupus nephritis.
Rheumatology (Oxford) 2010;49:960-71.
30. Guo Q, Lu X, Miao L, Wu, M, Lu S, Luo P.. Analysis of clinical manifestations and pathology of lupus nephritis: a retrospective review of 82 cases. Clin
Rheumatol 2010;29:1175-80.
31. Li Y, Tucci M, Narain S, et al. Urinary biomarkers in lupus nephritis.
Autoimmunity Reviews 2006;5:383-8.
46
33. Ruffing KA, Hoppes P, Blend D, Jarjoura D, Whittier FC. Eosinophils in urine revisited. Clin Nephrol 1994;41:163-6.
34. Sutton JM. Urinary eosinophils. Arch Intern Med 1986;146:2243-4.
35. Tyagi P, Barclay D, Zamora R, et al. Urine cytokines suggest an inflammatory response in the overactive bladder: a pilot study. International Urology and
Nephrology 2010;42:629-35.
36. Shamri R, Xenakis J, Spencer L. Eosinophils in innate immunity: an evolving story. Cell and Tissue Research 2011;343:57-83.
37. Mallorquí-Fernández G, Pous J, Peracaula R, et al. Three-dimensional crystal structure of human eosinophil cationic protein (RNase 3) at 1.75 Å resolution.
Journal of Molecular Biology 2000;300:1297-307.
47
Figure 1: Eosinophiluria by Hansel´s stain (400X) (arrow).
Figure 2: Curve of receiver operating characteristic (ROC) in SLE patients to detect cut-off of eosinophiluria, uECP and uECP-Cr ratio,classified by state variables Pr/Cr ratio ≥2 (A) and eGFR ≤60 mL/min (B):
48
ROC curve B: uECP/Cr ratio (AUC=0.84); Eosinophiluria (AUC=0.72); uECP (AUC=0.66);
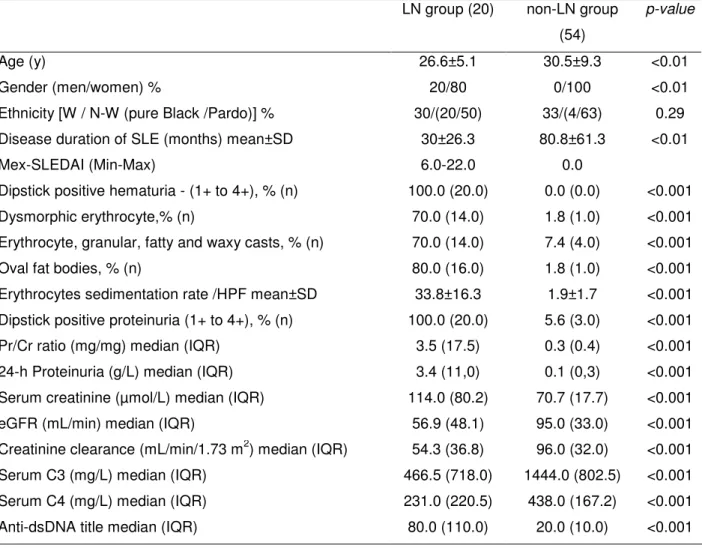
Table 1. Baseline characteristics and laboratory parameters observed for select patients per group, of all SLE patients included (n=74).
LN group (20) non-LN group
(54)
p-value
Age (y) 26.6±5.1 30.5±9.3 <0.01
Gender (men/women) % 20/80 0/100 <0.01
Ethnicity [W / N-W (pure Black /Pardo)] % 30/(20/50) 33/(4/63) 0.29 Disease duration of SLE (months) mean±SD 30±26.3 80.8±61.3 <0.01
Mex-SLEDAI (Min-Max) 6.0-22.0 0.0
Dipstick positive hematuria - (1+ to 4+), % (n) 100.0 (20.0) 0.0 (0.0) <0.001 Dysmorphic erythrocyte,% (n) 70.0 (14.0) 1.8 (1.0) <0.001 Erythrocyte, granular, fatty and waxy casts, % (n) 70.0 (14.0) 7.4 (4.0) <0.001
Oval fat bodies, % (n) 80.0 (16.0) 1.8 (1.0) <0.001
Erythrocytes sedimentation rate /HPF mean±SD 33.8±16.3 1.9±1.7 <0.001 Dipstick positive proteinuria (1+ to 4+), % (n) 100.0 (20.0) 5.6 (3.0) <0.001 Pr/Cr ratio (mg/mg) median (IQR) 3.5 (17.5) 0.3 (0.4) <0.001 24-h Proteinuria (g/L) median (IQR) 3.4 (11,0) 0.1 (0,3) <0.001 Serum creatinine (µmol/L) median (IQR) 114.0 (80.2) 70.7 (17.7) <0.001 eGFR (mL/min) median (IQR) 56.9 (48.1) 95.0 (33.0) <0.001 Creatinine clearance (mL/min/1.73 m2) median (IQR) 54.3 (36.8) 96.0 (32.0) <0.001 Serum C3 (mg/L) median (IQR) 466.5 (718.0) 1444.0 (802.5) <0.001 Serum C4 (mg/L) median (IQR) 231.0 (220.5) 438.0 (167.2) <0.001 Anti-dsDNA title median (IQR) 80.0 (110.0) 20.0 (10.0) <0.001 Number of individuals in parentheses. Continuous variables are presented as means and standard deviation (±), medians, and interquartile range (IQR, in parentheses) and were compared by Student's t tests and Mann-Whitney U tests.
Categorical variables were compared by chi-square test.
HPF,high power field or 400X; C3, complement 3; C4, complement 4.
Ethnicity: W=White; N-W= Not-White (pardo = Brazilian descendants of black, white and
49
Table 2. Laboratory values for 74 SLE subjects with and without renal disease.
LN group (20) non-LN group (54) p-value
Eosinophiluria, % (n) 45.0 (9.0) 5.6 (3.0) <0.001
Eosinophils sedimentation rate /HPF 1.7 (1.2) 0.17 (0.0) <0.001 Urinary ECP (µg/L), median (IQR) 4.1 (4.2) 2.0 (0.0) <0.001 Urinary ECP/Cr ratio (µg/mgCr) median
(IQR)
93.5 (70.2) 33.1 (19.7) <0.001
Urinary IL-5 (pg/mL) median (IQR) 84.0 (185.2) 46.1 (63.43) <0.001 Urinary IL-5/Creatinina ratio (pg/mgCr)
median (IQR)
231.9 (270.7) 81.3 (112.4) <0.001
Number of individuals in parenthesis. Continuous variables are presented as means and standard deviation (±), medians and interquartile range (IQR, in parenthesis) and were compared by Student's t-tests and Mann-Whitney-U tests. Categorical variables were compared by chi-square test.
50
Table 3. Results of correlation between variables of the study and laboratory results that evaluate the involvement of renal function and disease activity in SLE.
Correlation coefficient, rs (Spearman)
Eosinophiluria Urinary ECP
ECP/Cr ratio p value
Haematuria 0.52 0.49 0.76 p<0.001
Glomerular dysmorphic erythrocyte 0.51 0.56 0.52 p<0.001
Casts 0.44 0.45 0.63 p<0.001
Pr/Cr ratio 0.46 0.55 0.75 p<0.001
Serum creatinine 0.59 0.57 0.70 p<0.001
eGFR -0.54 -0,47 -0.61 p<0.001
Anti-dsDNA 0.26 0.27 0.58 p<0.001
Serum C3 -0.21 -0.16 -0.30 p<0.05
Serum C4 -0.28 -0.44 -0.31 p<0.05
Urinary IL-5 0.31 0.32 0.27 p<0.05
Urinary IL-5/Cr (pg/mgCr) 0.36 0.28 0.50 p<0.001
Mex-SLEDAI 0.41 0.44 0.72 p<0.001
51
Table 4. Results of the ROC curve analyses using SLE patients with and without lupus nephritis to detect cut-off levels of eosinophiluria, urine ECP and ECP/Cr ratio.
The cut-off of Eosinophiluria, ECP/Cr and uECP (classified by state variables Pr/Cr ratio ≥2 and eGFR ≤60 mL/min) were 1/ field (HPF), 42.2 µg/mgCr and 2.25 µg/L, respectively. AUC, area under the ROC curve; IC, Confidence interval; Pr/Cr ratio, protein-creatinine ratio; eGFR, estimated glomerular filtration rate; HPF,high power field or 400X; ECP, eosinophil cationic protein; ECP/Cr ratio, eosinophil cationic protein-creatinine ratio.
Criterion for renal
inflammation in SLE- state variable Pr/Cr ratio
AUC Asymptotic
95% IC
Sensitivity Specificity p value
Eosinofiluria 0.55 0.35 - 0.75 69.2% 82.0% p>0.05
Urinary ECP 0.62 0.40 – 0.83 53.0% 87.0% p>0.05
ECP/Cr ratio 0.94 0.88 – 1.00 90.0% 67.4% p<0.0001
Criterion for renal
inflammation in SLE- state variable eGFR
AUC Asymptotic
95% IC
Sensitivity Specificity p value
Eosinofiluria 0.72 0.50 - 0.82 69.2% 82.0% p<0.005
Urinary ECP 0.66 0.49 – 0.82 73,90% 94.0% p=0.05
52
4 COMENTÁRIOS, CRÍTICAS E SUGESTÕES
O anteprojeto que deu origem a essa tese foi intitulado “Eosinófilos e Proteína Catiônica Eosinofílica: achados em pacientes com Lúpus Eritematoso Sistêmico”, aprovado sob o número 044/2006, CEP-UFRN. Todas as sugestões do CEP-UFRN foram acatadas e o anteprojeto foi adequado para cumpri-las. Foi elaborado a partir de um estudo piloto com o objetivo de identificar a freqüência de eosinofilúria em pacientes que apresentavam comprometimento renal e realizavam o exame de urina (sumário com sedimentoscopia) no Laboratório da Disciplina de Uroanálise.
Esse estudo mostrou que dentre os pacientes que apresentavam eosinofilúria, as que tinham indicação clínica de LES e nefrite lúpica apresentavam uma maior positividade. Então foi decidido que seria analisado na urina desses pacientes, não só o eosinófilo, mas também a proteína catiônica do eosinófilo, a IL-5 que é uma das citocinas responsáveis pela ativação do eosinófilo e também a IgE. Os artigos apresentando os resultados referentes a estas duas últimas variáveis estão em fase de redação.
53
residentes e dos alunos de iniciação científica do Curso de Farmácia, no decorrer da execução do projeto, foi de suma importância pela possibilidade de um contato diário com os pacientes e entre os participantes do grupo de pesquisa e acompanhamento desde o diálogo diário necessário para anuência do termo de consentimento livre e esclarecido até a condução de soluções nas intercorrências. As dificuldades com as quais nos deparamos foram relacionadas à disponibilidade dos pacientes para coleta do sangue e da urina, devido a um quadro clínico muito complexo, principalmente as pacientes do grupo com evidências de nefrite lúpica. Para tanto, o preenchimento e assinatura do termo de consentimento livre e esclarecido, em algumas vezes, teve que se adequar a disponibilidade e condição clínica do paciente. Ainda relacionado às dificuldades, pode-se citar a luta para conseguir doação de reagentes, pois o projeto não teve financiamento.
A partir dos primeiros resultados da freqüência de eosinofilúria foi elaborado um trabalho de conclusão de curso orientado pela doutoranda, intitulado “Eosinofilúria: achados freqüentes ou esporádicos?” o qual foi apresentado no 20th International Congress of Clinical Chemistry and Laboratory Medicine- XXXV Brazilian Congress of Clinical Analysis-VIII Brazilian Congress of Clinical Citology, Fortaleza – Brasil. O resumo expandido “Eosinophiluria: findings frequent or
sporadic?” foi publicado em Clinical Chemistry and Laboratory Medicine, 2008.
54
especificidade das variáveis, determinadas na urina, que podem ser usadas como marcador de inflamação renal no LES. Parte dos resultados está no manuscrito que foi submetido ao periódico Rheumathology intitulado “Eosinophil and eosinophil cationic protein in urine: a new approach to diagnosis of renal inflammation in systemic lupus erythematosus”, 2011.
No momento encontra-se em fase de redação um artigo abordando além da eosinofilúria e a ECP, a IL-5 e a IgE urinárias. Os aspectos trabalhados no presente estudo estão em consonância com as pesquisas atuais na busca de descoberta de biomarcadores urinários que proporcionem além do diagnóstico precoce, o monitoramento do envolvimento renal em pacientes com LES.
55
5 APÊNDICE Participação em Congressos
DIAS, S. S. A., LOPES, Luciana Larissa Fonseca, BRITO, Ana Luiza de Souza, SILVA, Leila Priscilla P, LIMA, Rosaninny Maria Moura, Walesca Cecília Costa de Oliveira, LEMOS, Telma Maria de Araújo Moura, BRITO, T. N. S. Avaliação do dismorfismo eritrocitário glomerular em pacientes com hematúria. In: 33 Congresso Brasileiro de Análises Clínicas e 6 Congresso Brasileiro de Citologia Clínica, RBAC, v. 2, 2006.
BRITO, T. N. S., FONSECA, A. G., BATISTA, J. I., MOTA, G. R., PEREIRA, R. M., OLIVEIRA, F. K. J. Q. Perfil laboratorial da função renal em pacientes portadores de Lupus Eritematoso Sistêmico In: 36 Congresso Brasileiro de Análises Clínicas - 9 Congresso Brasileiro de Citologia Clínica, RBAC, v. 41, p. 1B-66B, 2009
BRITO, T. N. S., MEDEIROS, S., ARAUJO, M., SILVA, E. M. A., LOPES, D. R., MELCHUNA, K., LIMA, A., VILAR, M. J. P., SALES, V. S. F. Immunological and biochemical findings in patients with Systemic Lupus Erythematosus In: XXXIII Meeting of the Brazilian Society for Immunology / II Extra Section of Clinical Immunology, Intervention in the Immune System, 2008.
BARBOSA, K. C. C. S., NASCIMENTO, G. B., SILVA, E. M. A., SILVA, E. M. A., BRITO, T. N. S. Avaliação da taxa de filtração glomerular em pacientes com doença renal: comparação entre dois métodos. In: 34o Congresso Brasileiro de
56
6 ANEXOS 6.1 Protocolo Clínico
Universidade Federal do Rio Grande do Norte
Centro de Ciências da Saúde
Programa de Pós-Graduação em Ciências da Saúde
EOSINÓFILOS E PROTEÍNA CATIÔNICA EOSINOFÍLICA: ACHADOS EM PACIENTES COM LUPUS ERITEMATOSO SISTÊMICO
DATA: ____________________ RG HUOL: __ IDENTIFICAÇÃO:___________________________________________________ Data de nascimento:__________________ Idade: _____________
ENDEREÇO (referência):_____________________________________ Telefones: _________________________________________
Sexo: ( ) F ( ) M Cor(auto-denominada): ( ) Branca ( ) Pardo ( ) Preto ( ) Amarelo
Peso___________ Altura_______________
Início da doença (mês/ano): _______________________
Número de “pulsos” com ciclofosfamida: _________________
57 6.2 MEX-SLEDAI
NOME:_________________________________________________________
DATA___/___/_____ NUM___________ SCORE TOTAL_______________
Pontuação se as alterações estão presentes na ocasião da visita ou nos 10 dias precedentes
PESO DESCRITOR DEFINIÇÃO
8 Alteração neurológica Psicose. Acidente cérebro-vascular. Convulsão.
Síndrome mental-orgânica (alteração da função mental com alterações clínicas flutuantes da memória, função intelectual, além da incapacidade de
concentrar atenção ao meio ambiente, insônia e aumento ou diminuição da atividade psicomotora). Mononeurite. Mielite.
6 Alteração renal Cilindrúria. Hematúria> 5 hem/campo. Proteinúria >
0,5 g/l urina simples. Creatinina > 5 mg/dL.
4 Vasculite Ulceração, gangrena, nódulos dolorosos nos dedos,
infarto periungueal, splinter hemorrágico. Biópsia ou angiografia revelando vasculite.
3 Hemólise /
Trombocitopenia
Hb < 12 g/dL e reticulocitose corrigida > 3%. Trombocitopenia < 100.000
3 Miosite Fraqueza muscular proximal com elevação da CPK
2 Artrite Mais de 2 articulações com edema e derrame
2 Alteração mucocutânea Rash malar. Ulceração naso-faríngea. Alopecia.
2 Serosite Pleurisia. Pericardite. Peritonite.
1 Febre / Fadiga Febre > 38 graus e fadiga inexplicada.
59
7 REFERÊNCIAS 1. Borchers AT, Naguwa SM, Shoenfeld Y, et al. The geoepidemiology of systemic lupus erythematosus. Autoimmun Rev. 2010;9(5):A277-87.
2. Gualtierotti R, Biggioggero M, Penatti AE, et al. Updating on the pathogenesis of systemic lupus erythematosus. Autoimmunity Reviews. 2010.
doi:10.1016/j.autrev.2010.09.007
3. Kim HA, Jeon JY, Yoon JM, et al. Beta 2-microglobulin can be a disease activity marker in systemic lupus erythematosus. Am J Med Sci. 2010;339(4):337-40.
4. Ortega LM, Schultz DR, Lenz O, et al. Review: Lupus nephritis: pathologic features, epidemiology and a guide to therapeutic decisions. Lupus.
2010;19(5):557-74.
5. Rothenberg ME, Hogan SP. The eosinophil. Annu Rev Immunol.
2006;24:147-74.
6. Jacobsen EA, Taranova AG, Lee NA, et al. Eosinophils: Singularly destructive effector cells or purveyors of immunoregulation? Journal of Allergy and Clinical
Immunology. 2007;119(6):1313-20.
7. Hogan SP, Rosenberg HF, Moqbel R, et al. Eosinophils: Biological Properties and Role in Health and Disease. Clinical & Experimental Allergy.
2008;38(5):709-50.
8. Dolff S, Abdulahad WH, van Dijk MC, et al. Urinary T cells in active lupus nephritis show an effector memory phenotype. Ann Rheum Dis. 2010; 69:2034-41.
60
9. Nolan CR, 3rd, Anger MS, Kelleher SP. Eosinophiluria--a new method of detection and definition of the clinical spectrum. N Engl J Med.
1986;315(24):1516-9.
10. Corwin HL, Bray RA, Haber MH. The detection and interpretation of urinary eosinophils. Arch Pathol Lab Med. 1989;113(11):1256-8.
11. Wilson DM, Salazer TL, Farkouh ME. Eosinophiluria in atheroembolic renal disease. Am J Med. 1991;91(2):186-9.
12. Bystrom J, Amin K, Bishop-Bailey D. Analysing the eosinophil cationic protein - a clue to the function of the eosinophil granulocyte. Respiratory Research.
2011;12(1):10 doi: 10.1186/1465-9921-12-10.
13. Vilar MJP, Sato EI. Estimating the incidence of systemic lupus erythematosus in a tropical region (Natal, Brazil). Lupus. 2002;11(8):528-32.
14. Chiu YM, Lai CH. Nationwide population-based epidemiologic study of systemic lupus erythematosus in Taiwan. Lupus. 2010;19(10):1250-5.
15. Villegas-Zambrano N, Martinez-Taboada VM, Bolivar A, et al. Correlation between clinical activity and serological markers in a wide cohort of patients with systemic lupus erythematosus: an eight-year prospective study. Ann N Y Acad Sci.
2009;1173:60-6.
16. Kon T, Yamaji K, Sugimoto K, et al. Investigation of pathological and clinical features of lupus nephritis in 73 autopsied cases with systemic lupus erythematosus. Mod Rheumatol. 2010;20(2):168-77.
17. Lightstone L. Lupus nephritis: where are we now? Curr Opin Rheumatol.
61
18. Rubinstein T, Pitashny M, Levine B, et al. Urinary neutrophil gelatinase-associated lipocalin as a novel biomarker for disease activity in lupus nephritis.
Rheumatology (Oxford). 2010;49(5):960-71.
19. Valesini G, Conti F. The Persistent Challenge of Lupus Nephritis. Clin Rev
Allergy Immunol. 2010. doi:10.1007/s12016-010-8210-6.
20. Atta AM, Sousa CP, Carvalho EM, et al. Immunoglobulin E and systemic lupus erythematosus. Brazilian Journal of Medical and Biological Research.
2004;37:1497-501.
21. Atta AM, Santiago MB, Guerra FG, et al. Autoimmune Response of IgE Antibodies to Cellular Self-Antigens in Systemic Lupus Erythematosus.
International Archives of Allergy and Immunology. 2010;152(4):401-6.
22. Charles N, Hardwick D, Daugas E, et al. Basophils and the T helper 2 environment can promote the development of lupus nephritis. Nat Med.
2010;16(6):701-7.
23. Kampe M, Stolt I, Lampinen M, et al. Patients with allergic rhinitis and allergic asthma share the same pattern of eosinophil and neutrophil degranulation after allergen challenge. Clinical and Molecular Allergy. 2011;9:1-10.
doi:10.1186/1476-7961-9-3.
62
25. Boix E, Carreras E, Nikolovski Z, et al. Identification and characterization of human eosinophil cationic protein by an epitope-specific antibody. J Leukoc Biol.
2001;69(6):1027-35.
26. Zagai U, Lundahl J, Klominek J, et al. Eosinophil cationic protein stimulates migration of human lung fibroblasts in vitro. Scand J Immunol. 2009;69(4):381-6.
27. Howard L, Corwin MD, HH. M. The significance of eosinophiluria [special report]. Award lectures and Special reports. 1987;87(4):520-2.
28. Lose G, Frandsen B. Eosinophil cationic protein in urine in patients with urinary bladder tumors. Urol Res. 1989;17(5):295-7.
29. Wolthers OD, Heuck C. Circadian variations in serum eosinophil cationic protein, and serum and urine eosinophil protein X. Pediatric Allergy and
Immunology. 2003;14(2):130-3.
30. Ruffing KA, Hoppes P, Blend D, et al. Eosinophils in urine revisited. Clin
Nephrol. 1994;41(3):163-6.
31. Adhya Z, Borozdenkova S, Karim MY. The role of cytokines as biomarkers in systemic lupus erythematosus and lupus nephritis. Nephrology Dialysis