BRENO TERCIO SANTOS CARNEIRO
SincronizaÄÅo dos Ritmos de Atividade Motora e Temperatura
Central Ç Disponibilidade de Glicose em Ratos
Dissertação apresentada à Universidade Federal do Rio Grande do Norte como pré-requisito para obtenção do título de mestre em Psicobiologia.
BRENO TERCIO SANTOS CARNEIRO
SINCRONIZAÇÃO DOS RITMOS DE ATIVIDADE MOTORA E TEMPERATURA CENTRAL À DISPONIBILIDADE DE GLICOSE EM RATOS
Dissertação apresentada à Universidade Federal do Rio Grande do Norte como pré-requisito para obtenção do título de mestre em Psicobiologia.
Orientador: John Fontenele Araujo
Divis€o de Servi•os T‚cnicos
Cataloga•€o da Publica•€o na Fonte. UFRN / Biblioteca Central Zila Mamede Carneiro, Breno Tercio Santos.
Sincroniza•€o dos ritmos de atividade motora e temperatura central ƒ disponibilidade de glicose em ratos / Breno Tercio Santos Carneiro. – Natal, RN, 2010.
81 f. : il.
Orientador: John Fontenele Araujo.
Disserta•€o (mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Bioci…ncias. Programa de P†s-Gradua•€o em Psicobiologia.
1. Comportamento alimentar – Disserta•€o. 2. Ritmos circadianos – Disserta•€o. 3. Rato – Alimenta•€o e ra•‡es – Disserta•€o. I. Araujo, John Fontenele. II. Universidade Federal do Rio Grande do Norte. III. Tˆtulo.
Tˆtulo: Sincroniza•€o dos ritmos de atividade motora e temperatura central ƒ disponibilidade
de glicose em ratos
Autor: Breno Tercio Santos Carneiro
Data da defesa: 10 de agosto de 2010
BANCA EXAMINADORA:
_________________________________________________________
Prof. Dr. Luiz Silveira Menna Barreto
Escola de Artes, Ci…ncias e Humanidades – USP
_________________________________________________________
Prof. Dra. Carolina Virgˆnia Mac…do de Azevedo
Departamento de Fisiologia – UFRN
________________________________________________________
Prof. Dr. John Fontenele Araujo (orientador)
AGRADECIMENTOS
Agradeço, primeiramente, à minha mãe pelo apoio sempre incondicional. Em segundo lugar, agradeço a John pela orientação, e pelos ensinamentos e discussões relevantes nos últimos seis anos, que com certeza são e continuarão sendo parte da minha vida.
Agradeço a todos os professores do programa de pós-graduação em psicobiologia e aos meus colegas da turma de 2008, que de forma direta ou indireta contribuíram para este trabalho. Agradeço ainda a todos os colegas de laboratório que de alguma forma ajudaram na realização dos experimentos, a citar: Fabiano, Diego, Nathália, Caio, Bruna e Miguel.
RESUMO
ABSTRACT
SUM‰RIO
1. INTRODUÇÃO 7
2. OBJETIVO 11
2.1. OBJETIVO GERAL 11
2.2. OBJETIVOS ESPECŠFICOS 11
3. HIPÓTESE E PREDIÇÃO 12
4. METODOLOGIA 12
4.1. EXPERIMENTO 1 –ESTUDO PILOTO 12
4.2. EXPERIMENTO 2 –RESTRIÇÃO ALIMENTAR EM CLARO-ESCURO 14
4.3. EXPERIMENTO 3 – RESTRIÇÃO ALIMENTAR EM CLARO-ESCURO E ESCURO
CONSTANTE 16
4.4. EXPERIMENTO 4 – RITMO DE TEMPERATURA CENTRAL DURANTE RESTRIÇÃO
ALIMENTAR 18
4.5. AN‰LISE DE DADOS 20
4.6. ‹TICA 22
5. RESULTADOS 22
5.1. EXPERIMENTO 1 –ESTUDO PILOTO 22
5.2. EXPERIMENTOS 2 E 3 –RESTRIÇÃO ALIMENTAR EM CLARO-ESCURO 25
5.3. EXPERIMENTO 3 –RESTRIÇÃO ALIMENTAR EM ESCURO CONSTANTE 31
5.4. EXPERIMENTO 4 – RITMO DE TEMPERATURA CENTRAL DURANTE RESTRIÇÃO
ALIMENTAR 33
6. DISCUSSÃO 38
7. CONCLUSÃO 48
REFERÊNCIAS 49
ANEXOS 57
PARECER DA COMISSŒO DE ‹TICA NO USO DE ANIMAIS 57
ARTIGO 1 59
1. INTRODUÇÃO
Na maioria dos animais, os ritmos circadianos1são sincronizados primariamente pelo ciclo claro-escuro (CE) imposto pelo movimento de rotação da terra. Entretanto, a alternância entre claro e escuro não é a única pista sincronizadora circadiana presente na natureza. Outros sinais ambientais, tais como a presença de um co-específico (Mistlberger & Skene 2004) e a disponibilidade de alimento (Mistlberger 1994; Stephan 2002) também sincronizam ritmos comportamentais e fisiológicos. A energia provida pela alimentação é indispensável para o funcionamento do organismo, ou seja, o alimento permite a sobrevivência do indivíduo. Uma vez que a alimentação é uma necessidade básica, não é de surpreender que estratégias que aperfeiçoam a aquisição e a ingestão de alimento tenham evoluído nos animais.
escuro, e o padrão de sono REM se inverte, mostrando maior número de episódios durante a fase de escuro (Mieda et al. 2004; Roky et al. 1999). Isto indica que a ingestão de alimento num horário fixo pode de alguma forma, alterar o funcionamento de regiões cerebrais responsáveis pela regulação do ciclo sono-vigília. Modificações nestas variáveis permitem ao organismo estar comportamentalmente e fisiologicamente preparado para se alimentar quando o alimento se torna disponível.
Em geral, a atividade antecipatória pode ser observada, comportamentalmente, por volta do quarto dia de restrição alimentar. Diversos aspectos do comportamento de antecipação têm sido estudados nas últimas décadas, como sua independência do núcleo supraquiasmático, e suas propriedades de: limite circadiano, ressincronização com transientes após mudança no horário da alimentação e persistência em condições constantes (ver Mistlberger 1994).
sincronização. Além disso, resultados de experimentos onde são empregados avanços ou atrasos do horário de alimentação favorecem a idéia de que o processo de sincronização ocorre através de um mecanismo de arrastamento. A mudança no horário de alimentação leva à ressincronização através de uma fase de transientes, após a qual a atividade antecipatória se torna ajustada à nova fase de alimentação (Stephan 1984). Por último, Coleman et al. (1982) e Clarke & Coleman (1986) mostraram que a antecipação ao alimento também apresenta persistência em condições constantes. Após sincronização ao horário de alimentação, ratos foram submetidos à privação total de alimento por três dias. Nesses dias, os animais exibiram aumento da atividade motora na mesma fase que exibiam anteriormente durante a restrição alimentar, o que indica a natureza oscilatória subjacente ao processo de sincronização por alimento.
A observação de Stephan de que ratos com lesão do núcleo supraquiasmático continuavam exibindo atividade antecipatória ao alimento levou à idéia da existência de um oscilador sincronizado por alimento. Desde então, muitos pesquisadores têm tentado, sem sucesso, identificar este oscilador (ver Davidson 2006), sendo que esta busca continua intensa e repleta de controvérsias (Gooley et al. 2006; Landry et al. 2006, 2007; Moryia et al. 2009). Uma questão específica dentro da sincronização por alimento que tem recebido pouca atenção ao longo dos anos é: quais os sinais relacionados com a ingestão de alimento são importantes para a sincronização? E conseqüentemente, quais são as vias que conduzem informação sobre a disponibilidade de alimento para as estruturas cerebrais relacionadas com a expressão de variáveis que sincronizam ao horário de alimentação?
Stephan (1990) mostraram que ratos com seccionamento do nervo vago submetidos à restrição alimentar continuavam exibindo atividade antecipatória ao horário de alimentação. Posteriormente, Davidson & Stephan (1998), utilizando injeções intraperitoneais de capsaicina (uma neurotoxina) em ratos, mostraram que vias aferentes não-vagais parecem também não ser essenciais para a sincronização por alimento. Uma hipótese paralela é a de que a informação a respeito da disponibilidade de alimento poderia ser transmitida ao sistema nervoso central antes e durante a ingestão, através de sinais olfativos, por exemplo. Entretanto, ratos anósmicos ou bulbectomizados continuaram exibindo sincronização ao alimento (Coleman & Hay 1990; Davidson et al. 2001).
Estes achados podem indicar a participação de sinais humorais no processo de sincronização. Sabe-se que a ingestão de alimento é regulada por diversos sinais humorais, incluindo diferentes hormônios (Batterham et al. 2006; Coll et al. 2007; Coppola & Diano, 2007; Cummings 2006; Holst 2007; Wynne & Bloom 2006) e a própria disponibilidade de glicose no organismo (Campfield & Smith 2003; Bady et al. 2006). Tal como estes sinais flutuam ao longo das 24 h do dia, ajustados à alimentação noturna em ratos, evidências mostram que os mesmos se ajustam ao horário de alimentação durante regimes de restrição alimentar temporal (Bodosi et al. 2004; Díaz-Muñoz et al. 2000; Drazen et al., 2006; Martínez-Merlos et al. 2004).
alimentar temporal foram submetidos a um atraso de oito horas no horário de alimentação, sendo que nos dois primeiros dias de atraso, os animais receberam como alimentação óleo vegetal ou mineral, sacarina ou uma mistura de glicose e sacarina. A partir do terceiro dia a alimentação oferecida foi ração. Os animais que receberam glicose mostraram maiores atrasos de fase da atividade antecipatória e conseqüentemente, ressincronizaram ao novo horário de alimentação mais rapidamente. Sabe-se que a glicose é o combustível primário utilizado pelas células neurais, e que a concentração desta molécula influencia a atividade neuronal em diferentes regiões, incluindo aquelas envolvidas com a regulação da ingestão de alimento (Burdakov & González 2009; Burdakov et al. 2005a; Burdakov et al. 2005b).
2. OBJETIVO
2.1. OBJETIVO GERAL
O objetivo deste trabalho é estender o conhecimento a respeito do efeito da glicose sobre os ritmos circadianos, verificando se sua ingestão diária, restrita a algumas horas por um longo tempo, é suficiente para gerar antecipação em ratos, ou seja, verificar se o aumento na concentração plasmática de glicose é um sinal suficiente para ajustar o oscilador circadiano sincronizado por alimento.
Nossa hipótese é a de que a ingestão de glicose em um horário fixo no meio da fase de claro produz antecipação do ritmo comportamental de atividade motora e do ritmo de temperatura central em ratos.
2.2. OBJETIVOS ESPECÍFICOS
2) Avaliar se a restri•€o alimentar temporal utilizando somente glicose na
alimenta•€o, na aus…ncia de pistas f†ticas (ciclo claro-escuro), promove atividade
antecipat†ria (Experimento 3);
3) Avaliar se a restri•€o alimentar temporal utilizando somente glicose na
alimenta•€o promove antecipa•€o do ritmo de temperatura central (Experimento 4).
3. HIPÓTESE E PREDIÇÃO
Considerando o potencial envolvimento de sinais humorais no processo de
sincroniza•€o por alimento, e levando em considera•€o os dados presentes na literatura de que
a glicose age neste processo, nossa hip†tese ‚ a de que a ingest€o de glicose induz ritmos
antecipat†rios em ratos. A predi•€o para esta hip†tese ‚ a de que animais submetidos ƒ
restri•€o de glicose mostram aumento da locomo•€o e da temperatura nas horas que
antecedem a disponibilidade de glicose.
4. METODOLOGIA
4.1. EXPERIMENTO 1 –ESTUDO PILOTO
Foram utilizados 12 ratos Wistar (seis machos e seis f…meas), com idade de 5 a 6
meses e pesando 276,4 • 24,2 g no inˆcio do experimento. Os sujeitos foram alocados
individualmente em gaiolas de polipropileno (40 x 32 x 17 cm) dentro de m†dulos de
isolamento (Fig. 1) com temperatura de 23 • 1 ŽC, com •gua e alimenta•€o (ra•€o para
roedores, Labina, Purina•) ƒ vontade, a n€o ser durante os procedimentos experimentais
(descritos a seguir). A atividade motora foi monitorada continuamente atrav‚s de sensores por
infravermelho, posicionados 15 cm acima das gaiolas (ver Fig. 1). Os dados foram coletados
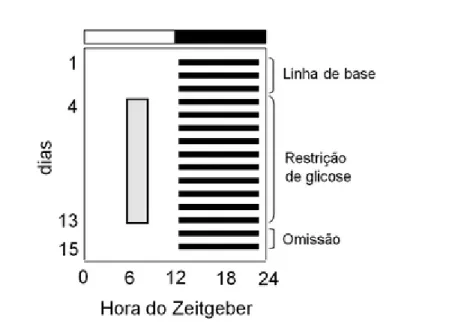
Os animais foram mantidos sob ciclo claro-escuro 12 h: 12 h (100-280 lux na fase de
claro; < 1 lux na fase de escuro) por tr…s dias com •gua e alimenta•€o ƒ vontade – Linha de
base. A alimenta•€o (ra•€o) foi retirada no dia 3 na Hora do Zeitgeber (HZ) 11,5 (HZ 0 e HZ
12 s€o definidas como os momentos em que as luzes acendem e apagam, respectivamente).
Por 10 dias, do dia quatro ao dia 13, entre HZ 06 e HZ 09, os animais tinham disponˆveis para
ingest€o, duas ampolas de glicose de 10 ml de glicose (50%, 2,0 kcal/ml) (Isofarma•,
Industrial Farmac…utica Ltda) – Restrição de glicose (RG). Em seguida, a alimenta•€o
(glicose) foi omitida por dois dias (dias 14 e 15), com o intuito de observar a persist…ncia de
uma possˆvel antecipa•€o ao hor•rio de alimenta•€o – Omissão (Fig. 2) Para permitir ao
animal aprender a ingerir a solu•€o de glicose nas ampolas, uma ampola de glicose foi
disponibilizada a cada dia em HZ 11,5 durante a linha de base. Os animais tinham acesso ƒ
glicose por 24 horas. No dia seguinte, o volume ingerido era medido e uma nova ampola
disponibilizada. As medi•‡es da ingest€o de glicose foram feitas comparando-se visualmente
uma ampola vazia com marca•‡es de volume (precis€o de 0,5 ml) com aquela retirada (Fig.
3).
4.2. EXPERIMENTO 2 –RESTRIÇÃO ALIMENTAR EM CLARO-ESCURO
Foram utilizados 24 machos (oito por grupo) com idade de 2 a 4 meses pesando
257,25 • 6,81 g no inˆcio do experimento. Os animais foram mantidos em condi•‡es id…nticas
Figura 3. Actograma artificial esquematizando o experimento 1 e suas etapas. Os ret‘ngulos verticais em cinza representam a disponibilidade de glicose.
ƒquelas descritas para o experimento 1, exceto pelo fato de que metade dos animais foi
mantida em uma estante (Fig. 4). A atividade motora foi monitorada continuamente, da
mesma maneira descrita no experimento 1.
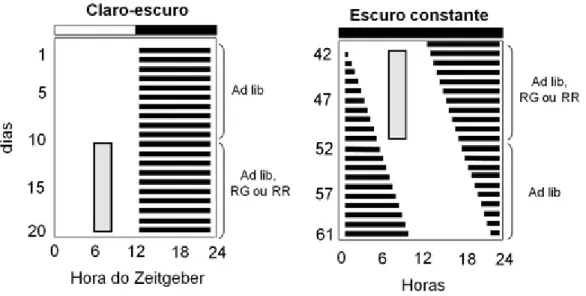
Os animais foram submetidos a 10 dias de claro-escuro (12 h: 12 h) com alimenta•€o
ƒ vontade (Ad lib) – linha de base. Na etapa seguinte, com dura•€o de 10 dias, os animais
foram divididos em tr…s grupos (n = 8 por grupo): 1) Experimental (restri•€o de glicose, RG)
- com alimenta•€o oferecida na forma de solu•€o de glicose (50 %, 2,0 kcal/ml) contida em
ampolas de 10 ml (20 ml/dia/animal) entre HZ 06-09; 2) Controle 1 (Ad lib) - com
alimenta•€o ƒ vontade, tendo, oferecidas ampolas id…nticas ƒquelas oferecidas ao grupo
Experimental entre HZ 06-09, contendo •gua de beber; 3) Controle 2 (restri•€o de ra•€o, RR)
– com ra•€o (3,5 kcal/g) disponˆvel entre HZ 06-09 (Fig. 5).
Para permitir ao animal aprender a ingerir a solu•€o de glicose nas ampolas, uma
ampola de glicose (10 ml) foi disponibilizada em HZ 11,5 nos dias 7, 8 e 9. O grupo Controle
1 foi submetido ao mesmo procedimento, sendo que as ampolas para este grupo continha
•gua. Os animais tinham acesso ƒs ampolas por 24 horas. No dia seguinte, o volume ingerido
era medido e uma nova ampola disponibilizada. Todas as medi•‡es da ingest€o de glicose e
•gua foram feitas comparando-se visualmente uma ampola vazia com marca•‡es de volume
(precis€o de 0,5 ml) com aquela retirada (ver Fig. 2). No dia 10 na fase de HZ 11,5, quando
da retirada das ampolas de glicose e •gua, os animais dos grupos Experimental e Controle 2
tiveram toda a ra•€o retirada de suas gaiolas. Desta forma, ficaram em priva•€o total de
alimento por 18 horas, at‚ o inˆcio da restri•€o alimentar no dia 11 na fase de HZ 06. Para
medir a ingest€o dos animais do grupo Controle 2, a ra•€o a ser disponibilizada para cada
animal era pesada antes da janela de alimenta•€o e a quantidade restante, ao final.
Todos os animais foram pesados no inˆcio do experimento e nos dias 11, 14, 17 e 20
4.3. EXPERIMENTO 3 – RESTRIÇÃO ALIMENTAR EM CLARO-ESCURO E ESCURO
CONSTANTE
Foram utilizadas 12 f…meas com idade de tr…s meses, pesando 183,5 • 3,7 g no inˆcio
do experimento. Os animais foram mantidos em condi•‡es id…nticas ƒquelas descritas para o
Figura 5. Actograma artificial esquematizando o experimento 3 e suas etapas. O ret‘ngulo vertical em cinza representa a disponibilidade de alimento.
Ad lib, alimenta•€o ƒ vontade. RG, restri•€o temporal de glicose. RR, restri•€o temporal de ra•€o.
experimento 1. A atividade motora foi monitorada continuamente, da mesma maneira descrita
no experimento 1.
Os animais foram submetidos a 10 dias de claro-escuro (12 h: 12 h) com alimenta•€o
ƒ vontade (Ad lib) – linha de base. Na etapa seguinte, com dura•€o de 10 dias, os animais
foram divididos em tr…s grupos (n = 4, por grupo): 1) Experimental (restri•€o de glicose, RG)
- com alimenta•€o oferecida na forma de solu•€o de glicose (50 %, 2,0 kcal/ml) contida em
ampolas de 10 ml (20 ml/dia/animal) entre HZ 06-09; 2) Controle 1 (Ad lib) - com
alimenta•€o ƒ vontade, tendo, oferecidas ampolas id…nticas ƒquelas oferecidas ao grupo
Experimental entre HZ 06-09, contendo •gua de beber; 3) Controle 2 (restri•€o de ra•€o, RR)
– com ra•€o (3,5 kcal/g) disponˆvel entre HZ 06-09 (Fig. 6). Para permitir ao animal aprender
a ingerir a solu•€o de glicose nas ampolas, uma ampola de glicose foi disponibilizada em HZ
11,5 nos dias 7, 8 e 9 como descrito anteriormente no experimento 2. No dia 10 na fase de HZ
11,5, quando da retirada das ampolas de glicose e •gua, os animais dos grupos Experimental e
Controle 2 tiveram toda a ra•€o retirada de suas gaiolas. Desta forma, ficaram em priva•€o
total de alimento por 18 horas como descrito para os animais do experimento 2.
A partir do dia 21, os animais foram submetidos ƒ condi•€o de escuro constante, para
a observa•€o do ritmo em condi•‡es de ilumina•€o constante por 21 dias. A seguir, os
animais foram novamente submetidos ao procedimento de restri•€o alimentar temporal (ra•€o
ou glicose) descrito anteriormente, com o objetivo de verificar se a antecipa•€o ocorre
tamb‚m na aus…ncia de pistas f†ticas. Nesta etapa, os animais do grupo Controle 1 em
claro-escuro passaram a compor o grupo Experimental, e o grupo Experimental em claro-claro-escuro
passou a ser o grupo Controle 1. Em escuro constante, a restri•€o teve seu inˆcio por volta da
Hora Circadiana (HC) 06 (HC 0 e HC 12 s€o definidas como o fim e o inˆcio da atividade,
respectivamente). Devido ƒ diferen•a nos perˆodos end†genos a fase circadiana da janela de
Experimental a janela de alimenta•€o foi estabelecida entre 16h00 e 19h00. Para o grupo
Controle 2, a ra•€o estava disponˆvel entre 12h00 e 15h00.
Em escuro constante, com o intuito de permitir ao animal aprender a ingerir a
solu•€o de glicose nas ampolas, 20 ml de glicose foram disponibilizadas para o grupo
Experimental por 48 horas a partir das 09h00 do dia 39. O mesmo procedimento foi realizado
para os animais do grupo Controle 1, sendo que estes receberam ampolas contendo •gua.
Optou-se por disponibilizar o volume de 20 ml por 48 horas seguidas para evitar a entrada na
sala de experimenta•€o e uma possˆvel perturba•€o do ritmo em livre-curso.
Todo o procedimento para medi•€o da ingest€o de glicose e ra•€o foi id…ntico ƒquele
descrito nos experimentos 1 e 2.
4.4. EXPERIMENTO 4 – RITMO DE TEMPERATURA CENTRAL DURANTE RESTRIÇÃO
ALIMENTAR
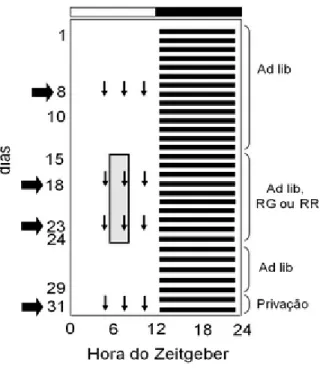
Foram utilizados 12 machos com idade de 3 meses no inˆcio do experimento. Os
animais foram mantidos nas mesmas condi•‡es descritas nos experimentos anteriores e
divididos em três grupos como no experimento 2. A atividade motora foi monitorada continuamente, da mesma maneira descrita no experimento 1.
Os sensores de temperatura ibutton (Maxim Integrated Products, Inc.) foram configurados para registrar a temperatura a cada 30 minutos. Foram implantados 11 sensores intraperitonealmente nos animais, sendo quatro nos grupos Experimental (restrição de glicose) e Controle 1 (alimentação à vontade) e três no Controle 2 (restrição de ração). No procedimento cirúrgico, os animais foram anestesiados com cetamina e xilazina (100 mg/kg, cada). Os sensores foram inseridos na cavidade peritoneal através de uma incisão de aproximadamente 2 cm. Após a implantação, os animais permaneceram pelo menos 14 dias em recuperação, até o início do experimento. Este consistiu de 14 dias de linha de base (alimentação à vontade em claro-escuro 12h:12h, início do claro: 06h00); 10 dias de restrição alimentar (glicose ou ração) entre HZ 06-09, seguidos de cinco dias de alimentação à vontade e 2 dias de privação total de alimento (Fig. 7).
Para permitir ao animal aprender a ingerir a solução de glicose nas ampolas, uma ampola de glicose foi disponibilizada em HZ 11,5 nos dias 11, 12 e 13, como descrito no experimento 2. No dia 14 na fase de HZ 11,5, quando da retirada das ampolas de glicose e água, os animais dos grupos Experimental e Controle 2 tiveram toda a ração retirada de suas gaiolas. Desta forma, ficaram em privação total de alimento por 18 horas como descrito no experimento 2. Todo o procedimento para medição da ingestão de glicose e ração foi idêntico àquele descrito nos experimentos 1 e 2.
µl) para determinar a concentração da referida molécula. As amostras foram coletadas fazendo-se um pequeno furo na ponta da cauda do animal com agulhas esterilizadas com álcool 92 %. O sangue obtido era então colocado em contato com a tira de medição. O aparelho fornecia a concentração de glicose em 12 segundos.
Após o término do experimento os animais foram anestesiados com cetamina e xilazina, os sensores de temperatura foram retirados e, em seguida, os animais foram sacrificados com uma sobre dose do mesmo anestésico.
4.5. ANÁLISE DE DADOS
Os registros de temperatura foram transferidos dos sensores a um computador pessoal através de hardware e software específicos para os mesmos (Maxim Integrated
Products, Inc.). Estes dados assim como os de atividade motora foram trabalhados no
software El temps (A. Dˆez-Noguera, Universitat de Barcelona, 1999), onde actogramas e
termogramas foram confeccionados. Todos os demais gr•ficos foram criados no Microsoft
Excel 2007.
Para an•lise da atividade antecipat†ria (total de atividade durante as duas horas que
antecedem o hor•rio de alimenta•€o), a atividade motora foi transformada em percentagem do
total di•rio (em claro-escuro) ou do total em 24 horas (em escuro constante).
Para os resultados do experimento 1, foi utilizada a an•lise de vari‘ncia (ANOVA)
de medidas repetidas seguida do teste post-hoc de Tukey para compara•€o das m‚dias da
atividade motora entre HZ 04-06 nos tr…s dias de linha de base, nos “ltimos tr…s dias de
restri•€o e do segundo dia de omiss€o. A ingest€o de glicose nos dias 4 e 13 foram
comparadas atrav‚s de teste t para amostras dependentes.
Os resultados obtidos em claro-escuro nos experimentos 2 e 3 foram agrupados numa
“nica an•lise. A atividade antecipat†ria, o peso corporal e a perda de peso (% em rela•€o ao
peso no dia 11 – inˆcio da restri•€o) foram comparados entre os grupos atrav‚s de ANOVA
seguida do teste post-hoc de Tukey. A ingest€o de calorias foi comparada entre os grupos
Experimental (glicose) e Controle 2 (ra•€o) atrav‚s de testes t para amostras independentes.
Na fase de escuro constante do experimento 3, a atividade antecipat†ria foi comparada entre
os grupos atrav‚s de ANOVA seguida do teste post-hoc de Tukey.
No experimento 4, a temperatura foi analisada de forma descritiva. As concentra•‡es
de glicose foram comparadas entre os grupos atrav‚s de ANOVA seguida do teste post-hoc de
Tukey, e dentro dos grupos atrav‚s de ANOVA de medidas repetidas.
Todas as an•lises estatˆsticas foram feitas no software Statistica 7. Todos os resultados
4.6. ‹TICA
O projeto foi aprovado pela comiss€o de ‚tica no uso de animais da Universidade
Federal do Rio Grande do Norte (CEUA-UFRN), sob o protocolo n” 026/2009 (ver anexo 1).
5. RESULTADOS
5.1. EXPERIMENTO 1 –ESTUDO PILOTO
Dos 12 animais utilizados, um n€o ingeriu a glicose disponibilizada em HZ 11,5
durante a linha de base. O registro de atividade de outro animal foi prejudicado pelo mau
funcionamento do sensor. Esses dois animais foram eliminados do experimento.
Os animais aprenderam a ingerir a glicose contida nas ampolas e aumentaram o
volume ingerido ao longo do experimento (Fig. 8). Atrav‚s da inspe•€o visual dos
actogramas, pudemos verificar que os animais exibiram antecipa•€o ao hor•rio de
disponibilidade de glicose (Fig. 9). As figuras 10A e 10B mostram a percentagem de
atividade entre HZ 04 e HZ 06 a cada dia e o total de atividade motora entre HZ 04 e HZ 06
ao longo das etapas do experimento, respectivamente. Pode-se notar o aumento da atividade
nos dias de restri•€o.
5.2. EXPERIMENTOS 2 E 3 –RESTRIÇÃO ALIMENTAR EM CLARO-ESCURO
A figura 11 mostra o ritmo de atividade motora de animais dos tr…s grupos durante os
20 dias em que estiveram em ciclo claro-escuro. A figura 12 mostra o perfil m‚dio de
atividade nos cinco primeiros dias de alimenta•€o ƒ vontade e nos cinco “ltimos de restri•€o
alimentar temporal (glicose ou ra•€o). O aumento da atividade (antecipa•€o) mostrado pelos
grupos Experimental (RG) e Controle 2 (RR) nas horas que antecediam a alimenta•€o foi
muito semelhante (Fig. 11). A fase de restri•€o alimentar foi dividida em dois blocos de cinco
dias. Os animais sob restri•€o temporal de glicose ou ra•€o mostraram maior nˆvel de
atividade nas duas horas que precediam o hor•rio de alimenta•€o, quando comparados com os
animais do grupo Controle 1 (Fig. 13). Os grupos em restri•€o alimentar n€o mostraram
diferen•a entre si quanto ƒ atividade antecipat†ria.
Ambos os grupos Experimental (RG) e Controle 2 (RR) aumentaram a ingest€o ao
longo da fase de restri•€o alimentar (Fig. 14A), sendo que houve diferen•a com rela•€o ƒ
quantidade de calorias ingeridas (Fig. 14B). A figura 15 mostra que, ao final da restri•€o
alimentar, os animais do grupo Experimental perderam significativamente mais peso do que
os animais dos grupos controle. Aqueles, no “ltimo dia de restri•€o haviam perdido, em
Figura 12. Perfil de 24 horas da atividade motora. (A) Média dos dias 1 a 5, etapa de alimentação à vontade para todos os grupos. (B) Média dos dias 16 a 20, restrição alimentar para os grupos Experimental (RG) e Controle 2 (RR). A área com linha tracejada indica a disponibilidade de alimento (glicose ou ração).
5.3. EXPERIMENTO 3 –RESTRIÇÃO ALIMENTAR EM ESCURO CONSTANTE
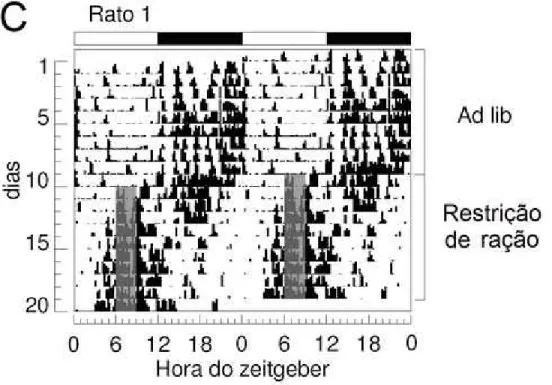
A figura 16 (A-C) mostra actogramas de um animal de cada grupo. Podemos
constatar visualmente que os animais em restri•€o alimentar durante a etapa de escuro
constante mostram atividade antecipat†ria ao hor•rio de alimenta•€o. A figura 16D mostra a
m‚dia de atividade antecipat†ria nos primeiros e “ltimos cinco dias de restri•€o alimentar.
Novamente, o nˆvel de atividade apresentado pelos grupos Experimental e Controle 2 ‚ maior
que aquele apresentado pelo grupo Controle 1. Al‚m disso observamos que o grupo
Experimental apresentou nˆveis mais elevados de atividade antecipat†ria que o grupo Controle
5.4. EXPERIMENTO 4 – RITMO DE TEMPERATURA CENTRAL DURANTE RESTRIÇÃO
ALIMENTAR
Dos tr…s sensores implantados nos animais do grupo Controle 2, um apresentou
problemas com a coleta de dados (animal 10). Por isso, estes dados n€o foram incluˆdos nos
resultados. A figura 17 mostra termogramas de todos os animais ao longo dos 31 dias de
experimento ao passo que a figura 18 mostra a temperatura m‚dia ao longo de 24 horas nas
Figura 16. Actogramas duplos de animais do experimento 3. (A) Animal submetido ƒ restri•€o de glicose na etapa de claro-escuro e com alimenta•€o ƒ vontade na etapa de escuro constante. (B) Animal mantido com alimenta•€o ƒ vontade durante o claro-escuro e submetido ƒ restri•€o de glicose em escuro constante. (C) Animal submetido ƒ restri•€o de ra•€o em claro-escuro e escuro constante. Em claro-escuro, a restri•€o alimentar teve inˆcio no dia 11 e fim no dia 20. Em escuro constante, o inˆcio foi no dia 42 e o fim, no dia 51. (D) Atividade antecipat†ria m‚dia nos primeiros e “ltimos cinco dias de restri•€o alimentar. * p < 0,05, *** p < 0,001, #p = 0,07, teste
post-hocde Tukey ap†s ANOVA de medidas independentes. Na figura A, as •reas em vermelho e verde indicam o perˆodo de 24 h utilizado para o c•lculo da atividade antecipat†ria nos blocos 1 e 2 da restri•€o alimentar, respectivamente (ver figura D). RG, restri•€o de glicose; RR, restri•€o de ra•€o; EE, escuro constante.
diferentes etapas do experimento. Em ambas as figuras, é possível observar o aumento gradual da temperatura central à medida que o horário de alimentação (glicose ou ração) se aproxima. Tal antecipação da temperatura surgiu de forma gradual nos primeiros dias de restrição alimentar (Fig. 18A-G). Após a etapa de restrição, a temperatura ressincroniza gradualmente ao ciclo claro-escuro (Figs. 17 e 18I-M). No segundo dia de privação (dia 31), a temperatura do grupo Experimental foi muito similar àquela do grupo Controle 1 antes de HZ 06 (horário de alimentação durante a etapa de restrição alimentar). No mesmo momento, o grupo Controle 2 mostrou um aumento gradual. Entretanto, isto foi devido aos dados de um animal. Pelo fato de termos apenas dois animais neste grupo, não podemos afirmar que este aumento é uma persistência do ritmo.
Figura 19. Concentração de glicose. * p < 0,05, ** p< 0,01, teste post-hoc de Tukey após ANOVA de medidas independentes (grupos). # p < 0,05, &p < 0,01, teste post-hoc Tukey após ANOVA de medidas repetidas (hora do zeitgeber 05 comparado com hora do zeitgeber 08 e 11)
6. DISCUSSÃO
Nós demonstramos que a ingestão de glicose em horários fixos durante 10 dias é uma pista temporal suficiente para gerar atividade antecipatória em ratos. A persistência da antecipação observada no experimento 1 indica a natureza endógena do comportamento.
realmente em escuro constante. É possível que o ambiente não estivesse completamente isolado da iluminação externa, o que explicaria nossas observações. Esta condição poderia ser denominada de claro-escuro de baixa intensidade. Nesta situação, observamos que os animais sob restrição temporal de glicose mostraram maior atividade antecipatória na média dos últimos cinco dias de restrição do que os animais sob restrição temporal de ração. Além disso, em escuro constante (ou claro-escuro de baixa intensidade), era impossível que o início da janela de alimentação coincidisse exatamente com HC 06 para todos os animais de um grupo, uma vez que os mesmos apresentaram períodos endógenos diferentes. Diante disto, a janela de alimentação estava no dia subjetivo, mas para alguns animais começava antes de HC 06 e para outros, depois. Com base nos períodos endógenos dos animais, a janela de alimentação para o grupo Experimental foi estabelecida entre 16h00 e 19h00 e para o grupo Controle 2, entre 12h00 e 15h00. Uma possível razão para os animais em restrição de glicose apresentar maior nível de antecipação seria o efeito da entrada do experimentador na sala às 15h00 para a retirada da ração do grupo Controle 2. Este era o momento em que os animais do grupo Experimental exibiam atividade antecipatória. O ruído da entrada na sala para a retirada da ração pode ter sido um estímulo que aumentou o estado de alerta dos animais e conseqüentemente, a locomoção.
influenciada pela quantidade de ração oferecida (0, 2, 6 ou 16 g) e pela ingestão nos dois primeiros dias do novo horário de alimentação. Além disso, utilizando o mesmo protocolo, ele confirmou as observações de outros investigadores (Mistlberger & Rusak 1987) de que a quantidade calórica, mas não a distensão gástrica, é determinante no ajuste do oscilador sincronizado por alimento. Com base na quantidade de ração ingerida, Stephan calculou que um mínimo de 22 kcal é necessário para o ajuste do oscilador. Nossos resultados indicam que talvez esse limiar calórico seja um pouco mais baixo. Os animais em restrição de glicose no presente estudo exibiram atividade antecipatória visualmente evidente entre o quarto e o quinto dia de restrição. Nos dias imediatamente anteriores, a ingestão calórica foi por volta de 15 kcal.
supraquiasm•tico (Froy et al. 2008; Mendoza et al. 2008). Neste sentido, o resultado
observado no presente estudo de que alguns animais do grupo experimental (restri•€o de
glicose) n€o exibem apenas atividade antecipat†ria mas mostram aparente sincroniza•€o dos
ritmos de atividade e temperatura de forma “completa” (Figs. 9 e 17) e alguns dias de
transientes ap†s o fim do regime de alimenta•€o na etapa de escuro constante (Fig. 16) indica
um possˆvel efeito na oscila•€o do n“cleo supraquiasm•tico. Efeito este que poderia ser
explicado pela quantidade reduzida de calorias ingeridas pelos animais.
Uma possˆvel via de sincroniza•€o alimentar para o n“cleo supraquiasm•tico poderia
existir atrav‚s do n“cleo arqueado no hipot•lamo. Nesta regi€o, neur—nios produtores de
neuropeptˆdeo Y e horm—nio relacionado ao Agouti (reconhecidos por sua fun•€o na
estimula•€o da ingest€o) s€o alvos da a•€o de v•rios sinais humorais perif‚ricos envolvidos
no controle da ingest€o (Coppola & Diano, 2007) e especificamente, s€o inibidos por altas
concentra•‡es de glicose (Burdakov & Gonz•lez 2009). Conex‡es recˆprocas entre o n“cleo
supraquiasm•tico e o n“cleo arqueado foram descritas recentemente (Yi et al. 2006). Tendo
em vista a fun•€o do n“cleo arqueado na regula•€o da ingest€o de alimento (Coppola &
Diano, 2007), assume-se que tal conex€o deva servir para comunicar informa•€o a respeito do
estado energ‚tico do organismo. A liga•€o entre o n“cleo arqueado e o n“cleo
supraquiasm•tico constituiria ent€o uma via de sincroniza•€o para o “ltimo.
Com rela•€o ao peso corporal, os animais em restri•€o de glicose foram os que
tiveram uma perda de peso consider•vel. Os animais do grupo Controle 1 (Ad lib) ganharam
peso ao longo dos 10 dias da etapa de restri•€o alimentar. Por outro lado, os animais do grupo
Controle 2 tiveram uma ligeira perda de peso durante esta etapa (Fig. 15). Espera-se que
animais em restri•€o alimentar tenham perda de peso, como foi observado no presente estudo.
A perda de peso mais acentuada no grupo Experimental ‚ provavelmente devida ƒ baixa
motora e da temperatura, este último provavelmente devido ao aumento na produção de calor pela atividade.
plasmática de glicose, por exemplo). Na verdade, não se sabem, com precisão, quais são os sinais associados com a ingestão de alimento que são necessários ou indispensáveis para a sincronização dos comportamentos antecipatórios à alimentação.
Recentemente, Waddington Lamont et al. (2007) mostraram que ratos ingerindo sacarose (frutose + glicose) no meio da fase de claro não expressam comportamento antecipatório. Algumas diferenças metodológicas entre o presente estudo e este citado devem ser consideradas. No presente trabalho, nós usamos glicose concentrada a 50 % enquanto Waddington Lamont et al. usaram sacarose a 32 %. Além disso, no estudo citado os animais tinham ração à vontade enquanto no presente estudo os ratos tinham glicose como sua única fonte alimentar. Como discutido acima, evidências mostram que a restrição calórica ou a quantidade expressiva de calorias ingeridas numa refeição são necessárias para a expressão de comportamentos antecipatórios ao alimento (Mistlberger & Rusak 1987; Mistlberger et al. 1990). Assim, a ausência de atividade antecipatória no estudo de Waddington Lamont et al. poderia ser devido à ausência de restrição calórica e/ou à baixa quantidade de calorias representadas pela ingestão de sacarose em comparação ao número de calorias ingeridas através de ração. Neste sentido, o mesmo grupo de pesquisa mostrou, posteriormente, que um alimento altamente palatável não induz atividade antecipatória a menos que o animal esteja num estado metabólico negativo (Verwey et al. 2007).
alimentação (Bodosi et al. 2004; Díaz-Muñoz et al. 2000; Drazen et al., 2006; Martínez-Merlos et al. 2004; Schoeller et al. 1997). Alguns destes sinais têm efeitos na expressão do oscilador sincronizado por alimento ou na variável mais evidente sincronizada pela alimentação, o estado de vigília. Por exemplo, a ausência de funcionalidade do receptor da leptina provoca aumento na amplitude do ritmo antecipatório em ratos (Mistlberger e Marchant 1999), e também parece estar ligada à expressão do ciclo sono-vigília (Laposky et al. 2006); e a grelina, quando administrada em ratos com alimentação à vontade ou mantidos em restrição alimentar, é um potente indutor de atividade motora e de vigília (Szentirmai et al. 2006).
Um trabalho recente sugere um papel para o núcleo ventromedial do hipotálamo na iniciação da atividade antecipatória ao alimento (Ribeiro et al. 2009). Trabalhos anteriores também apontam para a importância da área hipotalâmica lateral na expressão da antecipação ao alimento (Akyiama et al. 2004). Deve-se mencionar, contudo, que existem controvérsias quanto à necessidade da integridade dessas estruturas para a expressão dos ritmos antecipatórios ao alimento (Davidson 2006). Recentemente, um grupo de pesquisa sugeriu que o núcleo dorsomedial do hipotálamo seria essencial para a sincronização por alimento (Gooley et al. 2006; Fuller et al. 2008), o que gerou extensas discussões dentro na área (Gooley & Saper 2007; Landry & Mistlberger 2007; Mistlberger et al. 2009a; Mistlberger et al. 2009b; Fuller et al. 2009). Entretanto, pesquisadores de outros grupos mostraram, independentemente, que esta região não é imprescindível para a sincronização por alimento em ratos e camundongos (Landry et al. 2006, Landry et al. 2007; Moryia et al. 2009).
Os resultados obtidos na maioria dos estudos de lesão realizados até agora parecem indicar que o oscilador sincronizado por alimento, ao invés de ser constituído por uma única área no cérebro, é composto por uma rede de estruturas com funções parcialmente sobrepostas. Nossa hipótese é a de que uma gama de sinais humorais é responsável pela temporização de uma rede de osciladores localizados no cérebro, os quais são responsáveis pela expressão dos ritmos comportamentais antecipatórios ao alimento (Carneiro & Araujo 2009).
se sabe, entretanto, se estas e outras estruturas, como o pâncreas, possuem esta capacidade de rápido ajuste. Se esta característica for comum a outros tecidos periféricos, podemos hipotetizar que os sinais humorais produzidos na periferia em resposta à presença de alimento no sistema digestório e ao conseqüente aumento da glicose plasmática se ajustam rapidamente a um horário de alimentação incomum (meio da fase de claro, p. ex.). Estes sinais periféricos, assim como a glicose plasmática, ajustariam então a fase de osciladores localizados no sistema nervoso central, sincronizando-os ao horário de alimentação. Estas estruturas cerebrais seriam responsáveis pelo ajuste comportamental e da temperatura em antecipação à disponibilidade de alimento (Fig. 21).
7. CONCLUSÃO
REFERÊNCIAS
Akiyama, M., Yuasa, T., Hayasaka, N., Horikawa, K., Sakurai, T. & Shibata, S.2004. Reduced
food anticipatory activity in genetically orexin (hypocretin) neuron-ablated mice. Eur J Neuroci20,
3054-3062.
Andrade, J. P., Pereira, P. A., Silva, S. M., Sá, S. I. & Lukoyanov, N. V. 2004. Timed hypocaloric
food restriction alters the synthesis and expression of vasopressin and vasoactive intestinal peptide
in the suprachiasmatic nucleus. Brain Res. 1022, 226-233.
Bady, I., Marty, N., Dallaporta, M., Emery, M., Gyger, J., Tarussio, D., Foretz, M. & Thorens,
B. 2006. Evidence from glut2-null mice that glucose is a critical physiological regulator of feeding.
Diabetes 55, 988-995.
Batterham, R. L., Heffron, H., Kapoor, S., Chivers, J. E., Chandarana, K., Herzog, H., Le Roux,
C. W., Thomas, E. L., Bell, J. D. & Withers DJ. 2006. Critical role for peptide YY in
protein-mediated satiation and body-weight regulation. Cell Metabolism4, 223-233.
Bodosi, B., Gardi, J., Hajdu, I., Szentirmai, E., Obal Jr, F. & Krueger, J. M.2004. Rhythms of
ghrelin, leptin, and sleep in rats: effects of the normal diurnal cycle, restricted feeding, and sleep
deprivation. Am J Physiol Regul Integr Comp Physiol287, R1071-R1079.
Burdakov, D. & González, J. A.2009. Physiological functions of glucose-inhibited neurons. Acta
Physiol195, 71-78.
Burdakov, D., Gerasimenko, G. & Verkhratsky, A. 2005a. Physiological changes in glucose
differentiatelly modulate the excitability of hypothalamic melanin-concentrating hormone and
orexin neurons in situ. J. Neurosci. 25, 2429-2433.
Burdakov, D., Luckman, S. M. & Verkhratsky, A. 2005b. Glucose-sensing neurons of the
Caldelas, I., Feillet, C. A., Dardente, H., Eclancher, F. Mal€n, A., Gourmelen, S., P•vet, P. &
Challet, E. 2005. Timed hypocaloric feeding and melatonin synchronize the suprachiasmati
clockwork in rats, but with opposite timing of behavioral output. Eur. J. Neurosci. 22, 921-929.
Campfield, L. A. & Smith, F. J. 2003. Blood glucose dynamics and control of meal initiation: A
pattern detection and recognition theory. Physiol. Rev.83, 25-58.
Carneiro, B. T. S. & Araujo, J. F.2009. The food-entrainable oscillator: a network of interconnected
brain structures entrained by humoral signals? Chronobiol Int26, 1273-1289.
Challet, E., Solberg, L. C. & Turek, F. W.1998. Entrainment in calorie-restricted mice: conflicting
zeitgebers and free-running conditions. Am. J. Physiol. Regul. Integr. Comp Physiol. 274,
1751-1761.
Clarke, J. D. & Coleman, G. J. 1986. Persistent meal-associated rhythms in SCN-lesioned rats.
Physiol Behav 36, 105-113.
Coleman, G. J. & Hay, M. 1990. Anticipatory whell-running in behaviorally anosmic rats. Physiol
Behav47, 1145-1151.
Coleman, G. J., Harper, S., Clarke, J. D. & Armstrong, S. 1982. Evidence for a separate
meal-associated oscillator in the rat. Physiol. Behav.29, 107-115
Coll, A. P., Farooqi, I. S., & O’rahilly, S.2007. The hormonal control of food intake. Cell129,
251-262.
Comperatore, C. A. & Stephan, F. K.1987. Entrainment of duodenal activity to periodic feeding. J.
Biol. Rhythms2, 227-242.
Comperatore, C. A. & Stephan, F. K.1990. Effects of vagotomy on entrainment of activity rhythms
to food access. Physiol. Behav.47, 671-678.
Coppola, A. & Diano, S. 2007. Hormonal regulation of the arcuate nucleus melanocortin system.
Front. Biosci.12, 3519-3530.
Cummings, D. E.2006. Ghrelin and the short- and long-term regulation of appetite and body weight.
Davidson, A. J. & Stephan, F. K.1998. Circadian food anticipation persists in capsaicin deafferented
rats. J. Biol. Rhythms13, 422-429.
Davidson, A. J. 2006. Search for the feeding-entrainable circadian oscillator: a complex proposition.
Am J Physiol Regul Integr Comp Physiol 290, R1524-R1526.
Davidson, A. J., Aragona. B. J., Werner, R. M., Schroeder, E., Smith, J. C. & Stephan, F. K.
2001. Food-anticipatory activity persists after olfactory bulb ablation in the rat. Physiol Behav72,
231-235.
Dƒaz-Mu„oz, M., V€zquez-Martƒnez, O., Aguilar-Roblero, R. & Escobar, C. 2000. Anticipatory
changes in liver metabolism and entrainment of insulin, glucagon, and corticosterone in
food-restricted rats. Am J Physiol Regul Integr Comp Physiol 279, R2048-R2056.
Drazen, D. L., Vahl, T. P., D’Alessio, D. A., Seeley, R. J. & Woods, S. C.2006. Effects of a fixed
meal pattern on ghrelin secretion: evidence for a learned response independent of nutrient status.
Endocrinology 147, 23-30.
Dunn-Meynell, A. A., Govek, E. & Levin, B. E. 1997. Intracarotid glucose selectively increases
Fos-like immunoreactivity in paraventricular, ventromedial, and dorsomedial nuclei neurons. Brain Res.
748, 100-106.
Froy, O.,Chapnik, N. & Miskin, R. 2008. The suprachiasmatic nuclei are involved in determining
circadian rhythms during restricted feeding. Neuroscience155, 1152-1159.
Fuller, P. M., Lu, J. & Saper, C. B.2008. Differential rescue of light- and food-entrainable circadian
rhythms. Science 320, 1074-1077.
Fuller, P. M., Lu, J. & Saper, C. B.2009. Standards of evidence in chronobiology: A response. J.
Circadian Rhythms7(9).
Gooley, J. J. & Saper C. B. 2007. Is food-directed behavior an appropriate measure of circadian
entrainment to restricted daytime feeding? J. Biol. Rhythms22, 479-483.
Gooley, J. J., Schomer, A. & Saper, C. B. 2006. The dorsomedial nucleus is critical for the
Hirao, A., Tahara, Y., Kimura, I. & Shibata, S. 2009. A balanced diet is necessary for proper
entrainment signals of the mouse liver clock. Plos One4, e6909.
Holst, J. J.2007. The physiology of glucagon-like peptide 1. Physiol. Rev. 87, 1409-1439.
King, B. M. 2006. The rise, fall and resurrection of the ventromedial hypothalamus in the regulation
of feeding behavior and body weight. Physiol. Behav.87, 221-244.
Krieger, D. T.1974. Food and water restriction shifts corticosterone, temperature, activity and brain
amine periodicity. Endocrinology95, 1195-1201.
Landry, G. J. & Mistlberger R. E.2007. Food entrainment: methodological issues. J. Biol. Rhythms
22, 484-487.
Landry, G. J., Simon, M. M., Webb, I. C. & Mistlberger, R. E. 2006. Persistence of a behavioral
food-anticipatory circadian rhythm following dorsomedial hypothalamic ablation in rats. Am. J.
Physiol. Regul. Integr. Comp. Physiol. 290, R1527-R1534.
Landry, G. J., Yamanaka, G. R., Webb, I. C., Mear, R. J. & Mistlberger, R. E. 2007. The
dorsomedial hypothalamic nucleus is not necessary for the expression of circadian
food-anticipatory activity in rats. J. Biol. Rhythms22, 467-477.
Laposky, A. D. Shelton, J., Bass, J., Dugovic, C., Perrino, N. & Turek, F. W.2006. Altered sleep
regulation in leptin-deficient mice. Am. J. Physiol. Regul. Integr. Comp. Physiol.290, R894-R903.
LeSauter, J., Hoque, N., Weintraub, M., Pfaff, D. W. & Silver, R. 2009. Stomach ghreli-secreting
cells as food-entrainable circadian clocks. Proc. Natl. Acad. Sci. U. S. A.106, 13582-13587.
Marchant, E. & Mistlberger, R. E. 1997. Anticipation and entrainment to feeding time in intact and
SCN-ablated C57BL/6j mice, Brain Res 765, 273-282.
Martínez-Merlos, M. T., Ángeles-Castellanos, M., Díaz-Muñoz, M., Aguilar-Roblero, R.,
Mendoza, J. & Escobar, C.2004. Dissociation between adipose tissue signals, behavior and the
food-entrained oscillator. J. Endocrinol.181, 53-63.
Mendoza, J., Drevet, K., Pévet, P., Challet, E. 2008. Daily meal timing is not necessary for resetting
Mendoza, J., Graff, C., Dardente, H., Pevet, P. & Challet, E. 2005. Feeding cues alter clock gene
oscillations and photic responses in the suprachiasmatic nuclei of mice exposed to a light/dark
cycles. J. Neurosci. 25, 1514-1522.
Mendoza, J., Pévet, P. & Challet, E. 2007. Circadian and photic regulation of clock and
clock-controlled proteins in the suprachiasmatic nuclei of calorie-restricted mice. Eur. J. Neurosci.25,
3691-3701.
Mieda, M., Williams, S. C., Sinton, C. M., Richardson, J. A., Sakurai, T., Yanagisawa, M. 2004.
Orexin neurons function in an efferent pathway of a food- entrainable circadian oscillator in
eliciting food- anticipatory activity and wakefulness. J. Neurosci.24, 10493-10501.
Mistlberger, R. & Rusak B. 1987. Palatable daily meals entrain anticipatory activity rhythms in
free-feeding rats: dependence on meal size and nutrient content. Physiol. Behav.41, 219-226.
Mistlberger, R. E. & Marchant, E. G. 1995. Computational and entrainment models of circadian
food-anticipatory activity: Evidence from non – 24-h feeding schedules. Behav Neurosci109,
790-798.
Mistlberger, R. E. & Marchant, E. G.1999. Enhanced food-anticipatory circadian rhythms in the
genetically obese Zucker rat. Physiol Behav 66, 329-335.
Mistlberger, R. E. & Skene, D. J.2004. Social influences on mammalian circadian rhythms: Animal
and human studies. Biol Rev Camb Philos Soc79, 533-556.
Mistlberger, R. E. 1992. Nonphotic entrainment of circadian activity rhythms in suprachiasmatic
nuclei-ablated hamsters. Behav Neurosci106, 192-202.
Mistlberger, R. E. 1994. Circadian food-anticipatory activity: Formal models and physiological
mechanisms. Neurosci Biobehav Rev18, 171-195.
Mistlberger, R. E., Buijs, R. M., Challet, R., Escobar, C., Landry, G. J., Kalsbeek, A., Pevet, P.
& Shibata, S. 2009a. Standards of evidence in chronobiology: critical review of a report that
restoration of Bmal1expression in the dorsomedial hypothalamus is sufficient to restore circadian
Mistlberger, R. E., Buijs, R. M., Challet, R., Escobar, C., Landry, G. J., Kalsbeek, A., Pevet, P.
& Shibata, S. 2009b. Food anticipation in Bmail1 -/- mice and AAV-Bmal1 rescued mice: a reply
to Fuller et al. J Circadian Rhythms, 7 (11).
Mistlberger, R. E., Houpt, T. A. & Moore-Ede, M. C.1990. Food-anticipatory rhythms under 24-h
schedules of limited access to single macronutrients. J Biol Rhythms5, 35-46.
Mistlberger, R. E., Kent, B. A. & Landry, G. J. 2009c. Phenotyping food entrainment: motion
sensors and telemetry are equivalent. J Biol Rhythms24, 95-98.
Moberg, G. P., Bellinger, L. L. & Mendel, V. E.1975. Effect of meal feeding on daily rhythms of
plasma corticosterone and growth hormone in the rat. Neuroendocrinology19, 160-169.
Moore, R. Y. & Eichler, V. B. 1972. Loss of a circadian adrenal corticosterone rhythm following
suprachiasmatic lesions in the rat. Brain Res42, 201-206.
Moryia, T., Aida, R., Kudo, T., Akiyama, M., Dói, M., Hayasaka, N., Nakahata, N., Mistlberger,
R., Okamura, H. & Shibata, S.2009. The dorsomedial hypothalamic nucleus is not necessary for
food-anticipatory circadian rhythms of behavior, temperature or clock gene expression in mice. Eur
J Neurosci29, 1447-1460.
Ribeiro, A. C., LeSauter, J., Dupré, C. & Pfaff, D. W. 2009. Relationship of arousal to circadian
anticipatory behavior: ventromedial hypothalamus: one node in a hunger-arousal network. Eur J
Neurosci30, 1730-1738.
Roky, R., Kapás, L., Taishi, P., Fang, J. & Krueger, J. M.1999. Food restriction alters the diurnal
distribution of sleep in rats. Physiol. Behav.97, 697-703.
Schoeller, D. A., Cella, L. K., Sinha, M. K. & Caro, J. F.1997. Entrainment of the diurnal rhythm
of plasma leptin to meal timing. J. Clin. Invet. 100, 1882-1887.
Stephan, F. K. & Davidson, A. J. 1998. Glucose, but not fat, phase shifts the feeding-entrained
circadian clock. Physiol. Behav.65, 277-288.
Stephan, F. K. & Zucker, I.1972. Circadian rhythms in drinking behavior and locomotor activity in
Stephan, F. K. , Swann, J. M. & Sisk, C. L. 1979. Anticipation of 24 h feeding schedules in rats with
lesions of the suprachiasmatic nucleus. Behav. Neural Biol. 25, 346-363.
Stephan, F. K.1981. Limits of entrainment to periodic feeding in rats with suprachiasmatic lesions. J.
Comp. Physiol. A Neuroethol. Sens. Neural Behav. Physiol.143, 401-410.
Stephan, F. K. 1984. Phase shifts of circadian rhythms in activity entrained to food access. Physiol
Behav 32, 663-671.
Stephan, F. K.1997. Calories affect zeitgeber properties of the feeding entrained circadian oscillator.
Physiol. Behav.62, 995-1002.
Stephan, F. K. 2002. The “other” circadian system: Food as a zeitgeber. J. Biol. Rhythms17,
284-292.
Stokkan, K., Yamazaki, S., Tei H., Sakaki, Y. & Menaker, M.2001. Entrainment of the circadian
clock in the liver by feeding. Science291, 490-493.
Szentirmai, E., Hajdu, I., Obal Jr., F. & Krueger, J. M.2006. Ghrelin-induced sleep responses in
ad libitum fed and food-restricted rats. Brain Res. 1088, 131-140.
Tkacs, N. C., Pan Y., Sawwhney, G., Mann, G. L. & Morrison, A. R. 2007. Hypoglycemia
activates arousal-related neurons and increases wake time in adult rats. Physiol. Behav. 91,
240-249.
Verwey, M., Khoja, Z., Stewart, J. & Amir, S.2007. Differential regulation of the expression of
Period2 protein in the limbic forebrain and dorsomedial hypothalamus by daily limited access to
highly palatable food in food-deprived and free-fed rats. Neuroscience147, 277-285.
Waddington Lamont, E., Harbour, V. L., Barry-Shaw, J., Renteria Diaz, L., Robinson, B.,
Stewart, J. & Amir S. 2007. Restricted access to food, but not sucrose, saccharine ,or salt,
synchronizes the expression of period2 protein in the limbic forebrain. Neuroscience144, 402-411.
Wu, T., Ni, Y., Kato, H. & Fu Z. 2010. Feeding-induced rapid resetting of the hepatic circadian
clock is associated with acute induction of Per2and Dec1transcription in rats. Chronobiol. Int. 27,
Wynne, K. & Bloom, S. R.2006. The role of oxyntomodulin and peptide tyrosine–tyrosine (PYY) in
appetite control. Nat. Clin. Pract. Endocrinol. Metab.2, 612-620.
Yang, L. Scott, K. A., Hyun, J., Tamashiro, K. L., Tray, N., Moran, T. H. & Bi, S. 2009. Role of
dorsomedial hypothalamic neuropeptide Y in modulating food intake and energy balance. J.
Neurosci.29, 179-190.
Yi, C., van der Vliet, J., Dai, J., Yin, J., Ru, L. & Buijs, R. M. 2006. Ventromedial arcuate nucleus
communicates peripheral metabolic information to the suprachiasmatic nucleus. Endocrinology
147, 283-294.
Yoda, T., Crawshaw, L. I., Yoshida, K., Su, L., Hosono, T., Shido, O., Sakurada, S., Fukuda, Y.
& Kanosue, K. 2000. Effects of food deprivation on daily changes in body temperature and
behavioral thermoregulation in rats.Am J Physiol Regul Integr Comp Physiol 278, , R134-R139.
Zvonic, S., Ptitsyn, A. A., Conrad, S. A., Scott, L. K., Floyd, Z. E., Kilroy, G., Wu, X., Goh, B. C.,
Mynatt, R. L. & Gimble J. M. 2006. Characterization of peripheral circadian clocks in adipose
ANEXOS
PLEASE SCROLL DOWN FOR ARTICLE
This article was downloaded by: [Tercio Santos Carneiro, Breno] On: 13 November 2009
Access details: Access Details: [subscription number 916853405] Publisher Informa Healthcare
Informa Ltd Registered in England and Wales Registered Number: 1072954 Registered office: Mortimer House, 37-41 Mortimer Street, London W1T 3JH, UK
Chronobiology International
Publication details, including instructions for authors and subscription information:
http://www.informaworld.com/smpp/title~content=t713597233
The Food-Entrainable Oscillator: A Network of Interconnected Brain
Structures Entrained by Humoral Signals?
Breno Tercio Santos Carneiro ab; John Fontenele Araujo b
a Centre for Biological Timing and Cognition, University of Toronto, Toronto, Ontario, Canada b
Laboratório de Cronobiologia, Departamento de Fisiologia, Centro de Biociências, Universidade Federal do Rio Grande do Norte, Natal, RN, Brazil
Online publication date: 12 November 2009
To cite this Article Carneiro, Breno Tercio Santos and Araujo, John Fontenele(2009) 'The Food-Entrainable Oscillator: A Network of Interconnected Brain Structures Entrained by Humoral Signals?', Chronobiology International, 26: 7, 1273 — 1289
To link to this Article: DOI: 10.3109/07420520903404480 URL: http://dx.doi.org/10.3109/07420520903404480
Full terms and conditions of use: http://www.informaworld.com/terms-and-conditions-of-access.pdf This article may be used for research, teaching and private study purposes. Any substantial or systematic reproduction, re-distribution, re-selling, loan or sub-licensing, systematic supply or distribution in any form to anyone is expressly forbidden.
The publisher does not give any warranty express or implied or make any representation that the contents will be complete or accurate or up to date. The accuracy of any instructions, formulae and drug doses should be independently verified with primary sources. The publisher shall not be liable for any loss, actions, claims, proceedings, demand or costs or damages whatsoever or howsoever caused arising directly or indirectly in connection with or arising out of the use of this material.
REVIEW ARTICLE
THE FOOD-ENTRAINABLE OSCILLATOR: A NETWORK OF INTERCONNECTED BRAIN STRUCTURES ENTRAINED BY HUMORAL SIGNALS?
Breno Tercio Santos Carneiro1,2and John Fontenele Araujo2
1Centre for Biological Timing and Cognition, University of Toronto, Toronto, Ontario,
Canada
2Laborat´orio de Cronobiologia, Departamento de Fisiologia, Centro de Biociˆencias,
Universidade Federal do Rio Grande do Norte, Natal, RN, Brazil
Food is critical for all animal species. Its temporal availability is a relevant signal for organizing behavioral and physiological parameters. When food is restricted to a few hours per day, rats, mice, and other mammals exhibit anticipatory activity before meal-time (food-anticipatory activity). There is considerable evidence suggesting that this anticipation is mediated by a food-entrainable oscillator (FEO) with circadian proper-ties, but located outside the suprachiasmatic nucleus of the hypothalamus (the light-entrainable oscillator). However, the locus of the FEO as well as the mechanisms by which food entrainment occurs is unclear. In this review, we summarize data about the potential input pathways to the FEO and propose a model for understanding it as a network of interconnected brain structures entrained by fluctuation of different humoral signals. (Author correspondence: brenotercio@cb.ufrn.br).
Keywords Food entrainment, Circadian rhythm, anticipatory activity, Food-entrainable oscillator, Humoral pathway
INTRODUCTION
Circadian rhythms in mammals are entrained primarily by the light-dark (LD) cycle imposed by the earth’s rotation. However, the LD cycle is not their only zeitgeber. Other cues, such as the presence of a conspecific (Mistlberger & Skene, 2004) and food availability (Mistlberger, 1994;
Submitted February 6, 2009, Returned for revision March 10, 2009, Accepted June 8, 2009 Grant sponsors: Conselho Nacional de Desenvolvimento Cient´ıfico e Tecnolo´gico (CNPq), Pro´reitoria de Pesquisa da Universidade Federal do Rio Grande do Norte (PROPESQ-UFRN), Funda-¸ca˜o de Amparo a` Pesquisa do Estado do Rio Grande do Norte (FAPERN) and Graduate Student Exchange Program (GSEP) from the Canadian government.
Address correspondence to Breno Tercio Santos Carneiro, Universidade Federal do Rio Grande do Norte, Departamento de Fisiologia, Centro de Biociˆencias, Campus Universit´ario, Lagoa Nova, Caixa Postal 1506, CEP:59078-970, Natal, RN, Brazil. Tel.: 55 (84) 3215 3409 (Ext 218); Fax: 55 (84) 3211 9206; E-mail: brenotercio@cb.ufrn.br, brenotercio@yahoo.com.br
Chronobiology International, 26(7): 1273–1289, (2009) Copyright#Informa Healthcare USA, Inc. ISSN 0742-0528 print/1525-6073 online DOI: 10.3109/07420520903404480
Stephan, 2002), can influence circadian rhythms of behavior and physi-ology in some species, and consequently are also considered zeitgebers.
The importance of food for animal species is obvious. The energy pro-vided by food is indispensable for metabolism and biological efficiency of the organism, and it is food itself that enables the individual to survive. Because feeding is a basic need, it is not surprising that animals develop strategies to optimize food acquisition and its ingestion.
An interesting behavioral phenomenon was observed by Richter (1922). He was studying the effects of environmental variables on rat loco-motor activity and tested the effect of 25 min of food availability per day. He observed that the animals increased their locomotion 2–3 h before mealtime. This anticipation became known as food-anticipatory activity (FAA) and is observed not only in rats but in many other species (Azzaydi et al., 2007; see Mistlberger, 1994). In rodents, predominantly rats, this phenomenon has been studied through the observation of various behaviors, such as general locomotor activity (as observed by Richter; see Figure 1), wheel-running activity, and food-directed behavior. Other variables that increase before mealtime are temperature, corticos-terone release, and gastrointestinal motility (Comperatore & Stephan, 1987; Krieger, 1974; Moberg et al., 1975). When food is restricted to a few hours during the light phase of an LD cycle, the rats’ sleep distribution
FIGURE 1 An artificial double-plotted actogram of a nocturnal rodent under 12 h:12 h LD cycle. From day one to four, the animal had food ad libitum (Ad lib 1) and concentrated its activity in the dark phase. Starting from day five, food availability was restricted to 2 h (vertical light grey bar) a day until day 14 (RF). In this phase, the animal exhibits an increase in locomotion2–3 h before meal-time, termed food-anticipatory activity (FAA), and a decrease in nocturnal activity. When the restricted feeding schedule is terminated, the animal increases nocturnal activity (Ad lib 2). If after a few days under this condition the animal is food-deprived (dark grey area) (FD), it will exhibit a bout of activity in phase with the previous mealtime, indicating the existence of a self-sustained oscillatory mechanism
B.
1274 T. S. Carneiro and J. F. Araujo