MARINA DOS SANTOS BRITO SILVA FURTADO
PREVALÊNCIA DA INFECÇÃO PELO ERITROVÍRUS B19 E
ASSOCIAÇÕES CLÍNICAS EM CRIANÇAS COM ANEMIA
FALCIFORME PROVENIENTES DA TRIAGEM NEONATAL E ACOMPANHADAS NO HEMOCENTRO DE BELO HORIZONTE (MG)
UNIVERSIDADE FEDERAL DE MINAS GERAIS FACULDADE DE MEDICINA
ii
MARINA DOS SANTOS BRITO SILVA FURTADO
PREVALÊNCIA DA INFECÇÃO PELO ERITROVÍRUS B19 E
ASSOCIAÇÕES CLÍNICAS EM CRIANÇAS COM ANEMIA
FALCIFORME PROVENIENTES DA TRIAGEM NEONATAL E ACOMPANHADAS NO HEMOCENTRO DE BELO HORIZONTE (MG)
Dissertação apresentada ao Curso de Pós-Graduação da Faculdade de Medicina da Universidade Federal de Minas Gerais como requisito parcial para obtenção do título de mestre em Ciências da Saúde – Área de concentração em Saúde da Criança e do Adolescente
Orientador: Prof. Dr. Marcos Borato Viana
Professor Emérito do Departamento de Pediatria da Faculdade de Medicina da Universidade Federal de Minas Gerais
Co-orientadora: Dra. Marina Lobato Martins
iii
iv
UNIVERSIDADE FEDERAL DE MINAS GERAIS
Reitor: Prof. Clélio Campolina Diniz
Pró-reitor de Pós-graduação: Prof. Ricardo Santiago Gomez
Diretor da Faculdade de Medicina: Francisco José Penna
Chefe do Departamento de Pediatria: Profa. Benigna Maria de Oliveira
Coordenadora do Programa de Pós Graduação em Saúde da Criança e do Adolescente: Profa. Ana Cristina Simões e Silva
Colegiado do Programa de Pós-graduação em Medicina – Área de concentração em Saúde da Criança e do Adolescente:
Profa. Ana Cristina Simões e Silva Prof. Cássio da Cunha Ibiapina Prof. Eduardo Araújo de Oliveira Prof. Francisco José Penna Prof. Jorge Andrade Pinto Profa. Ivani Novato Silva
Prof. Marcos José Burle de Aguiar
v
MARINA DOS SANTOS BRITO SILVA FURTADO
PREVALÊNCIA DA INFECÇÃO PELO ERITROVÍRUS B19 E
ASSOCIAÇÕES CLÍNICAS EM CRIANÇAS COM ANEMIA
FALCIFORME PROVENIENTES DA TRIAGEM NEONATAL E ACOMPANHADAS NO HEMOCENTRO DE BELO HORIZONTE (MG)
BANCA EXAMINADORA:
Prof. Marcos Borato Viana Dra. Marina Lobato Martins Prof. Daniel Dias Ribeiro Dr. Svetoslav Nanev Slavov
Suplente:
vi
vii
Agradecimentos
A Deus pela vida e por renovar em mim a dedicação e persistência para que eu pudesse concluir esse trabalho.
Às crianças e aos seus pais ou responsáveis que aceitaram participar desse estudo.
Ao meu orientador Professor Marcos Borato Viana pela oportunidade, incentivo e pelos diversos ensinamentos. Pela solução conjunta de inúmeros problemas e pelas valiosas sugestões dadas.
À co-orientadora Dra. Marina Lobato Martins pela paciência, oportunidade, incentivo, apoio e disponibilidade. Pelas essenciais contribuições no desenvolvimento do trabalho. Pelo exemplo de dedicação e ética na vida profissional.
Às bolsistas de iniciação científica que me acompanharam nas diversas etapas do desenvolvimento do estudo, agradeço pela colaboração à Denise Martins Van Putten Vasconcelos, Raquel Laís Lima Gontijo e Jéssica Silqueira Hickson Rios.
Aos funcionários do Laboratório de Hematologia e Coagulação da Fundação Hemominas pela disponibilização das amostras dos pacientes.
A todos os colegas do serviço de pesquisa da Fundação Hemominas pela convivência e apoio.
viii
À Marcilene Rezende Silva, pela amizade, apoio, companheirismo e por compartilhar tantas dúvidas e angústias.
À funcionária do NUPAD Ivanir pelo fundamental apoio prestado durante a coleta dos termos de consentimento.
Às funcionárias do cadastro do ambulatório da Fundação Hemominas pela presteza na disponibilização dos prontuários consultados.
Às hematologistas Rosangela Figueiredo e Célia Maria Silva pela convivência agradável, pelo estímulo e pela troca de informações preciosas, e principalmente, por serem exemplos de profissionalismo e dedicação.
Ao Centro de Pós Graduação da Faculdade de Medicina da UFMG. À Fundação Hemominas por colaborar no financiamento e por disponibilizar sua estrutura física e organizacional para realização dos experimentos e coleta de dados e pela oportunidade de participar do Programa de capacitação de recursos Humanos da instituição.
Aos membros da banca examinadora Prof. Daniel Dias Ribeiro, Dr. Svetoslav Nanev Slavov e Dr. Ricardo Andrade Carmo por aceitarem o convite e dedicarem atenção à minha dissertação.
Ao meu marido Fabiano pela paciência, carinho, apoio e incentivo. À Ana Luísa, que mesmo com suas limitações de criança, soube ser paciente e incentivadora do meu trabalho.
ix RESUMO
x
xi ABSTRACT
xii
xiii SUMÁRIO
página
Resumo ... viii
Abstract ... x
Lista de abreviaturas e siglas ... xiv
Lista de tabelas ... xvii
Lista de figuras ... xviii
1 – Introdução ... 1
2 – Revisão bibliográfica ... 3
2.1 – Histórico ... 3
2.2 – Classificação do Eritrovírus B19 ... 4
2.3 – Características do Eritrovírus B19 ... 4
2.3.1 – Estrutura viral ... 4
2.3.2 – Genoma viral ... 5
2.4 – Ciclo de replicação viral ... 7
2.5 – Epidemiologia e curso da infecção ... 9
2.6 – Transmissão de B19V por produtos do sangue ... 12
2.7 – Diagnóstico laboratorial ... 14
2.7.1 – Diagnóstico direto ... 15
2.7.2 – Testes moleculares ... 15
2.7.3 – Diagnóstico indireto ... 17
2.8 – Manifestações clínicas ... 18
2.8.1 – Eritema infeccioso ... 18
2.8.2 – Artropatia ... 19
2.8.3 – Crise Aplástica Transitória... 19
2.8.4 – Infecção fetal ... 20
2.8.5 – Infecção em pacientes imunodeficientes ... 21
2.9 – Tratamento e prevenção ... 21
2.10 – Anemia falciforme ... 23
2.11 – Anemia falciforme no Brasil ... 25
2.12 – Patogênese da anemia falciforme ... 27
2.13 – Principais manifestações clínicas na infância ... 27
2.13.1– Vaso-oclusão ... 27
2.13.2 – Crise de dor ... 28
2.13.3 – Sequestro esplênico ... 28
2.13.4 – Síndrome torácica aguda ... 29
2.13.5 – Acidente vascular cerebral ... 30
2.13.6 – Infecções ... 30
2.14 – Anemia falciforme e infecção pelo Eritrovírus B19 .. 32
3 – Objetivos ... 36
xiv
página
3.2 – Objetivos específicos ... 36
4 – Materiais e métodos ... 37
4.1 – Desenho e local do estudo ... 37
4.2 – Carcterização da população de estudo ... 37
4.3 – Avaliação dos dados clínicos e laboratoriais ... 39
4.3.1 – Dados hematológicos ... 39
4.3.2 – Eventos clínicos da anemia falciforme ... 40
4.4 – História transfusional e exames hematológicos basais ... 41
4.5 – Diagnóstico da infecção pelo Eritrovírus B19 ... 41
4.6 – Preparação das amostras ... 42
4.7 – Testes imunoenzimáticos para detecção de anticorpos anti-B19 ... 43
4.8 – Extração do DNA viral ... 43
4.9 – Teste PCR em tempo real ... 46
4.9.1 – Teste PCR em tempo real utilizando SYBR Green ... 46
4.9.2 – PCR em tempo real pelo sistema TaqMan ... 48
4.9.3 – Validação dos testes de PCR em tempo real ... 49
4.9.3.1 – Capacidade de detecção dos genótipos 1, 2 e 3 das PCRs em tempo real utilizando SYBR Green e TaqMan ... 49
4.9.4 – Avaliação do limite de detecção mínima da PCR em tempo real para B19V utilizando SYBR Green ... 52
4.10 – Aspectos éticos ... 56
4.11 – Análise estatística ... 56
5 – Resultados ... 58
5.1 – Características da população de estudo ... 58
5.2 – Análise das amostras clínicas ... 59
5.3 – Análise das características clínicas da população ... 61
5.4 – Análise dos eventos clínicos ... 64
5.5 – Relato de evidência de transmissão intrafamiliar do B19V com agravo clínico ... 66
6 – Discussão ... 69
7 – Conclusões ... 80
8 – Referencias bibliográficas ... 81
9 – Anexos ... 103
9.1 – Termo de Consentimento Livre e esclarecido ... 103
9.2 – Parecer do Departamento de Pediatria ... 106
9.3 – Parecer do Comite de Ética em Pesquisa da UFMG .. 107
xv
xvi
LISTA DE ABREVIATURAS E SIGLAS
µL – microlitros µM – micromolar A – Adenina
AVC – Acidente Vascular Cerebral B19V – Vírus B19
CAT – Crise Aplástica Transitória cm – centímetros
COV – Valor do Cut-off
DF – Doença Falciforme dL – Decilitros
DNA –Deoxyribonucleic acid - ácido desoxirribonucleico
dNTP –Deoxynucleotide triphosphate - Desoxirribonucleotídeo
trisfosfatado
DO – Densidade ótica
EDTA – Ethylenediamine tetracetic acid – ácido etilenodiamino
tetra-acético
EI - Eritema infeccioso
ELISA - enzyme-linked immunosorbent assay - Ensaio imunoenzimático FDA - Food and Drugs Administration
g – grama G –Guanina
Hb – Hemoglobina
xvii Hb S – Hemoglobina S
HbF – Hemoglobina fetal
HPFH – Hereditary persitence of fetal hemoglobin - persitência
hereditária de hemoglobina fetal
HPLC – Cromatografia líquida de alta resolução IgG – Imunoglobulina G
IgM – Imunoglobulina M KDa - Kilodalton
Kg – Kilograma LEU – Leucócitos MG – Minas Gerais mL – mililitro
mM – milimolar
NIBSC – National Insitute for Biological Standards - Instituto Nacional de
Padrões Biológicos nm - nanômetro
NUPAD – Núcleo de Ações e Pesquisa em Apoio Diagnóstico OMS – Organização Mundial de Saúde
pb - pares de base
PCR – Reação em Cadeia da Polimerase
PETN – MG – Programa Estadual de Triagem Neonatal de Minas Gerais pH – Potencial hidrogeniônico
PHHF – Persistência hereditária de hemoglobina fetal PLAQ - Plaquetas
xviii SEA - sequestro esplênico agudo STA – Síndrome Torácica Aguda T – Timina
xix
LISTA DE TABELAS
Página Tabela 1 Iniciadores utilizados na amplificação da região NS1 do B19V através
da PCR em tempo real SYBR Green ... 47 Tabela 2 Sondas TaqMan utilizadas na reação de PCR em tempo real ... 48 Tabela 3 Resultados sorológicos e moleculares para B19 V em amostras de
crianças com doença falciforme ... 59 Tabela 4 Características hematológicas e número de transfusões recebidas em
239 crianças com doença falciforme ... 61 Tabela 5 Número de transfusões recebidas por crianças com doença falciforme
e status da infecção pelo B19V ... 62 Tabela 6 Características das crianças com doença falciforme de acordo com o
status da infecção pelo B19V ... 63 Tabela 7 Associação da freqüência de eventos clínicos e internação hospitalar
xx
LISTA DE FIGURAS
Página Figura 1 Microscopia eletrônica de partícula do eritrovírus B19 ... 5 Figura 2 Representação esquemática do genoma de eritrovírus B19 e regiões de
transcrição (Corcoran & Doyle, 2004) ... 6 Figura 3 Ciclo de replicação do eritrovírus B19 (Kasamatsu & Nakanshi, 1988) ... 8 Figura 4 Pronormoblasto gigante com inclusões citoplasmáticas sugerindo
infecção pelo B19V (Garcia et al, 2009) ... 9
Figura 5 Principais eventos hematológicos e imunológicos e diagnósticos
durante infecção aguda e persisitente pelo B19V (Slavov et al, 2011) .... 12
Figura 6 Mutação gênica responsável pela Hb S ... 23 Figura 7 Frequência do gene βS nas diferentes regiões do Brasil (Cançado e
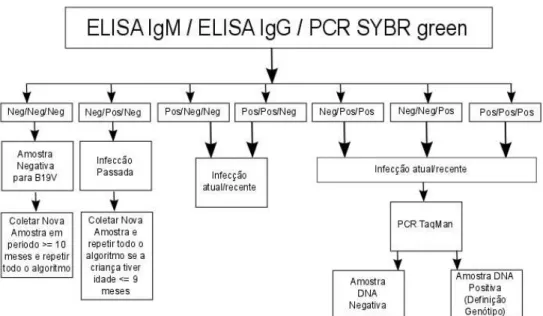
Jesus, 2007) ... 26 Figura 8 Algoritmo de testagem das amostras para testes sorológicos e
moleculares para definição de ausência da infecção pelo B19V ou
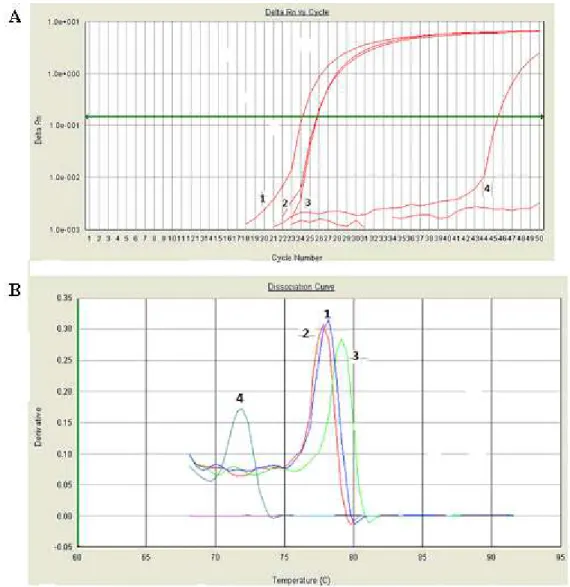
histórico de infecção aguda ou recente ... 42 Figura 9 Amplificação dos genótipos de B19 V do painel de referência da OMS
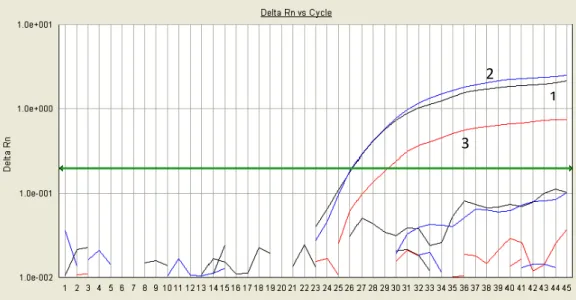
por PCR em tempo real SYBR Green ... 51 Figura 10 Amplificação dos genótipos de B19V do painel de referência da OMS
por PCR em tempo real TaqMan ... 52 Figura 11 PCR em tempo real de diluições seriadas de DNA de B19V utilizando
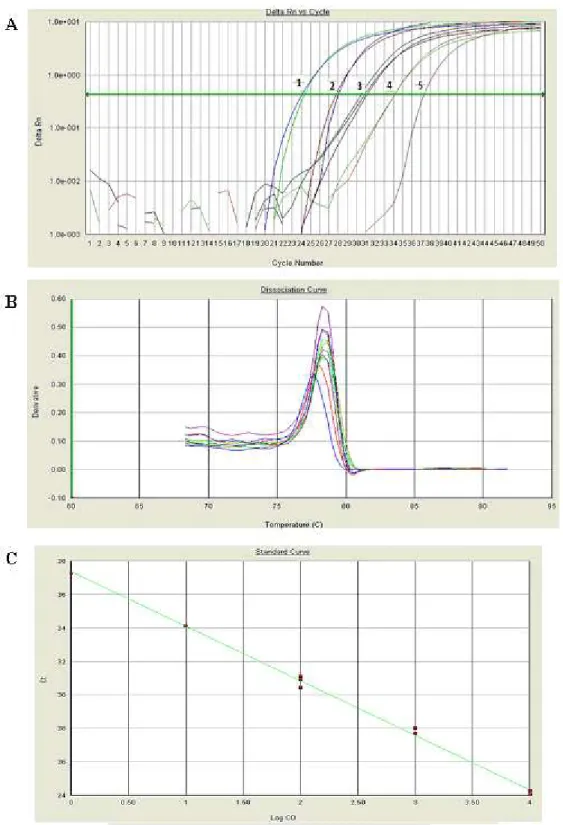
padrão OMS/NIBSC ... 54 Figura 12 PCR em tempo real TaqMan de diluições seriadas de DNA de B19V de
padrões OMS/NIBSC ... 55 Figura 13 Distribuição etária das crianças com anemia falciforme divididas em
quartis ... 58 Figura 14 Reatividade no ELISA para detecção de IgG anti-B19V em amostras de
crianças com doença falciforme ... 60 Figura 15 Curva de sobrevida estimada pelo método de Kaplan-Meier ... 64 Figura 16 Frequência de eventos agudos que levaram a hospitalização no grupo
1 1. INTRODUÇÃO
O eritrovírus B19 (B19V, antes denominado parvovírus B19) é um agente infeccioso comum em humanos e está associado a uma variedade de manifestações clínicas, dependendo do estado hematológico e imunológico do paciente. Em crianças imunocompetentes, a infecção pelo vírus está associada ao eritema infeccioso ou “quinta doença”, geralmente sem gravidade e de cura rápida. No entanto, o vírus pode estar associado a complicações na gravidez, à anemia crônica em indivíduos imunocomprometidos e à crise aplástica transitória em pessoas com doença hemolítica, como a doença falciforme. Nesses casos, a infecção pode levar à queda temporária, porém expressiva, da taxa de hemoglobina, ocasionando quadro de anemia intensa. O eritrovírus B19 tem sido encontrado em até 70% dos casos de crise aplástica. Esta situação geralmente requer transfusões sanguíneas para reverter o quadro de anemia grave. A infecção também pode estar associada a diversas complicações da doença falciforme, como dor, sequestro esplênico agudo, síndrome torácica aguda e acidente vascular cerebral. Considerando que a infecção por B19V é comum na infância, crianças com anemia falciforme constituem população especialmente vulnerável a essa complicação.
Apesar da significativa morbidade causada pela infecção por B19V em crianças com doença falciforme, poucos estudos têm sido realizados nesse grupo etário sobre a epidemiologia dessa infecção e as complicações a ela associadas. Dados de prevalência e incidência da infecção por B19 em pacientes com doença falciforme têm sido documentados por diversos pesquisadores em diferentes países. No Brasil, entretanto, essas taxas ainda são desconhecidas, bem como o grau de morbidade por ela causada.
O diagnóstico sorológico por meio da detecção de anticorpos IgG anti-B19V determina o status de infecção passada, enquanto a presença
2
testes de PCR em tempo real para detecção do DNA viral no soro ou plasma
do paciente vem permitindo identificar casos de infecção atual/recente sem resposta pela IgM, melhorando a sensibilidade do diagnóstico da infecção por B19V. Ao mesmo tempo, permite a identificação dos genótipos virais circulantes.
3 2. REVISÃO BIBLIOGRÁFICA
2.1. Histórico:
O eritrovírus B19 (B19V), antes denominado parvovírus, foi identificado pela primeira vez em 1974, na Inglaterra, por Cossart e colaboradores durante a realização de testes para diagnóstico da infecção pelo vírus da hepatite B. A designação B19, universalmente conhecida, se refere ao rótulo do frasco que continha a amostra de plasma a partir da qual o vírus foi isolado (Anderson, 1987; Young, 1996). Análises por microscopia eletrônica revelaram tratar-se de partículas virais de 23 nm de diâmetro, semelhante aos parvovírus animais (Heegard & Brown, 2002). Posteriormente, estudos de biologia molecular identificaram no vírus a presença de DNA de fita simples, de aproximadamente 5,5 Kb, com sequências palindrômicas características da família parvoviridae(Berns, 1996).
A primeira associação entre o eritrovírus B19 e doença humana foi descrita em 1981, a partir da observação de crise aplástica transitória em pacientes com anemia falciforme. Em seguida, outros relatos foram publicados na literatura mundial relacionando esse mesmo evento clínico ao vírus, principalmente em pacientes portadores de anemia hemolítica crônica (Pattison et al., 1981; Serjeant et al., 1981). Estudos
soro-epidemiológicos realizados por Anderson e colegas em 1983 comprovaram que o B19V é o agente etiológico do eritema infeccioso ou “quinta doença”. Outras consequências clínicas foram relatadas, como associação entre a infecção pelo B19V e hidropsia fetal em gestantes, devido à transmissão intrauterina. Quadros clínicos de artropatia aguda e crônica também foram observados (Reid et al., 1985; White et al.,
4
Estudos recentes publicados na literatura científica mundial mencionam outras doenças eventualmente associadas à infecção pelo eritrovírus B19, pendentes de maior comprovação, envolvendo doenças do miocárdio (Munro et al., 2003), lúpus eritematoso sistêmico (Diaz et al., 2002; Hsu et al., 2001;), púrpura trombocitopênica idiopática
(Martinez-Martinez & Maranon, 2000), doença neurológica, encefalite, meningite (Watanabe et al., 1994; Barah et al., 2001) e insuficiência
hepática fulminante (Diaz & Collazos, 2000).
2.2. Classificação do vírus B19
De acordo com o Comitê Internacional de Taxonomia de Vírus (ICVT), a família Parvoviridae está subdividida em duas subfamílias: Densovirinae e Parvovirinae, que infectam insetos e vertebrados,
respectivamente (Berns,1996). A subfamília Parvovirinae está por sua
vez dividida em cinco gêneros: Amdovirus, Bocavirus, Dependovirus, Erythrovirus e Parvovirus. O B19V é considerado vírus autônomo à
medida em que não requer a presença de vírus auxiliar para que ocorra sua replicação. Assim, estava classificado até recentemente no gênero
Parvovirus. No entanto, considerando seu tropismo por células
precursoras de eritrócitos, passou a ser classificado como membro do gênero Erytrovirus, criado para classificá-lo (Fauquet et al., 2005).
2.3. Características do Eritrovírus B19
2.3.1. Estrutura viral
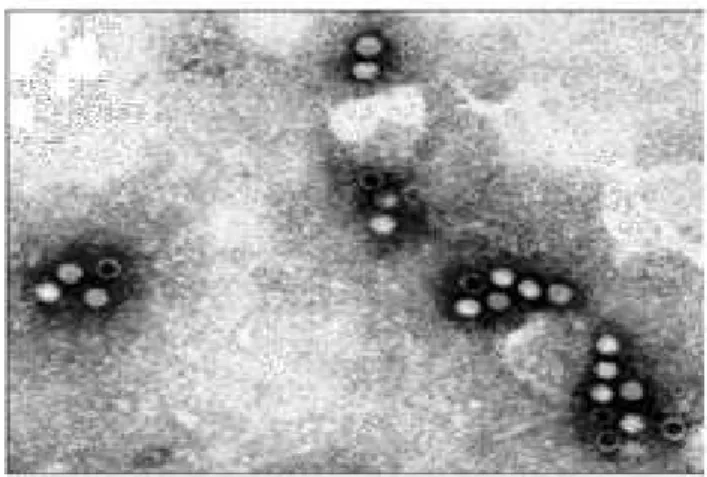
O B19V é um vírus DNA de fita simples não envelopado, com simetria icosaédrica e diâmetro de 20-25 nm (figura 1). A partícula completa ou virion possui peso molecular de 5,5 a 6,2 x 106 daltons
5
O vírus é estável até à temperatura de 56ºC por 60 minutos e resiste também à aplicação de solventes lipídicos. A inativação viral ocorre quando este é submetido à formalina, β-propionolactona e radiação gama (Cohen et al., 1992).
Figura 1 – Microscopia eletrônica de partícula de eritrovírus B19. Fonte: Wadsworth Center, NYS Departament of Health.
2.3.2. Genoma viral
O genoma do B19V é constituído por um filamento de DNA linear de fita simples, de polaridade positiva ou negativa e tamanho de 5,6 kb (Cotmore & Tattersall, 1984).
As sequências terminais são palindrômicas e capazes de formar uma configuração similar a um grampo (hairpin), que serve como
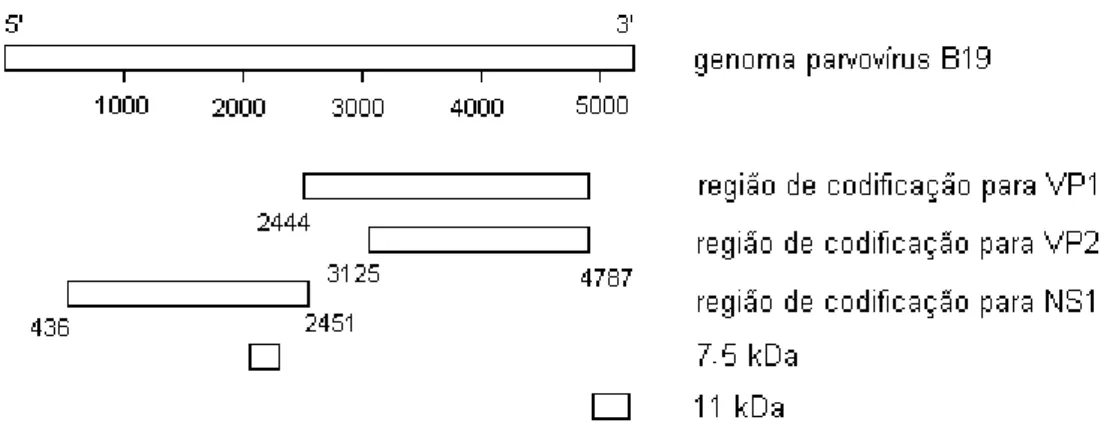
iniciador para síntese da fita complementar. Como na maioria dos parvovírus animais, o genoma do B19V possui duas grandes regiões de leitura (ORF). Uma que codifica para as proteínas estruturais VP1 e VP2, sendo que esta última perfaz aproximadamente 95% do capsídeo, e outra que codifica uma proteína não estrutural NS1 (figura 2).
6
infecção são dirigidos contra epítopos desse domínio, presume-se que VP1u esteja exposta na superfície do vírus (Rosenfeld et al., 1994).
A proteína NS1 se caracteriza como fosfoproteína importante, com funções regulatórias, incluindo controle da transcrição e replicação viral. A citotoxicidade da NS1 está estritamente relacionada à apoptose, resultando na ativação da caspase 3 que, por sua vez, pode alterar e degradar proteínas celulares vitais, como enzimas de reparo de DNA, induzindo à morte celular.
O vírus B19 usa um único promotor, p6, capaz de expressar diferencialmente os genes estruturais e não estruturais. Foi demonstrado que NS1 interage diretamente com o promotor p6 e com fatores de transcrição celulares Sp1/Sp3 para fazer a regulação transcricional. Outros dois polipeptídeos menores são codificados pelo genoma do B19V, um de 7,5 kDa e outro de 11 kDa, mas suas funções não são conhecidas (Berns, 1996; Moffatt et al., 1998; Corcoran & Doyle, 2004).
Figura 2 – Representação esquemática do genoma do eritrovírus B19 e as regiões de transcrição. Modificado de Corcoran & Doyle, 2004.
7
Todos os genótipos do vírus parecem co-circular, no entanto a frequencia de cada um é diferente e sua distribuição espacial e temporal não é uniforme. O genótipo 1 é predominante e está presente em todas as áreas geográficas. A variante genótipo 2 é rara embora possa ser esporadicamente encontrada em regiões diversas, principalmente na Europa. A variante genótipo 3 pode ser detectada em maior freqüência no oeste da áfrica, onde constitui-se como o genótipo mais prevalente, e em menor freqüência em outras regiões.
2.4. Ciclo de replicação viral
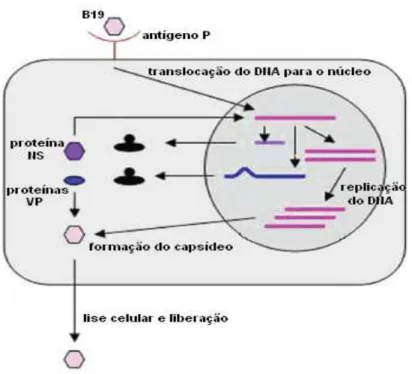
O ciclo de vida do eritrovírus B19 é semelhante ao de outros vírus DNA e inclui a ligação do vírus com a célula hospedeira, internalização, translocação do genoma viral para o núcleo celular, replicação do DNA viral, transcrição do RNA viral, montagem do capsídeo e lise celular com a liberação das partículas virais (figura 3).
O vírus se replica em células humanas progenitoras da linhagem eritroide na medula óssea e sangue, inibindo a eritropoiese (Mortimer et al., 1983). O fator responsável por esse tropismo é o globosídeo, também chamado antígeno P, que atua como o principal receptor para ligação do vírus à célula. O vírus é adsorvido pela célula através da interação entre a proteína VP2 e o antígeno P, presente na superfície dos eritrócitos e seus progenitores, megacariócitos, células endoteliais, células da placenta, células miocárdicas e hepáticas fetais. Evidências sugerem que apenas a presença do antígeno P não é suficiente para garantir a entrada do vírus na célula, sendo importante a participação de β-integrinas como co-receptores (Weigel-Kelley et al., 2001).
8
formação do capsídeo e, finalmente, a lise celular e a liberação das partículas virais(Anderson et al., 1987; Berns,1996; revisado por Slavov et al., 2011).
Figura 3 - Ciclo de replicação viral do eritrovírus B19. Modificado de Kasamatsu & Nakanishi, 1988.
No caso de infecção em células permissivas, tais como precursores de eritrócitos, as proteínas estruturais e não estruturais são produzidas e a infecção é produtiva (Ozawa et al., 1987; Ozawa et al.,
1988; Moffat et al., 1998; Gallinella et al., 2003). A incapacidade de
produção do vírus por algumas linhagens celulares se deve, provavelmente, à ausência de condições para a transcrição, presentes em precursores de eritrócitos (Raab et al., 2001).
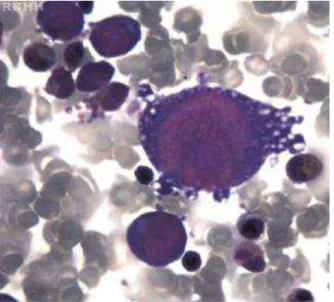
O efeito citopático da infecção pelo B19V em progenitores eritroides se traduz na presença de pronormoblastos gigantes ou “células de lanterna”, tanto in vivo quanto in vitro (figura 4). Os
9
de 25 a 32 μm que apresentam alterações associadas à toxidade do vírus tais como vacuolização citoplasmática com formação de pseudópodes, marginalização da cromatina nuclear e presença dos corpúsculos de inclusão intranucleares eosinofílicos(Koduri et al., 1998).
Figura 4 – Pronormoblasto gigante com inclusões citoplasmáticas sugerindo infecção pelo B19V. Medula óssea, coloração por Leishman, aumento 1000 x. (Garcia et al., 2009).
2.5. Epidemiologia e curso da infecção
A infecção pelo eritrovírus B19 é comum e tem sido descrita em todas as partes do mundo onde foi pesquisada, manifestando-se primariamente como surtos de eritema infeccioso em escolas, creches, hospitais e no ambiente familiar (Anderson et al., 1984; Evans et al.,
1984; Gillespie et al., 1990). A incidência do eritema infeccioso em
10
Estudos epidemiológicos conduzidos na Inglaterra por Anderson e colegas (1987), na vigência de epidemias de eritema infeccioso ou crise aplástica transitória associadas ao B19V, revelaram que 10% dos casos ocorreram na faixa etária abaixo dos cinco anos, 70% em indivíduos entre cinco e 15 anos de idade, e 20% nos pacientes acima desta faixa etária.
A soroprevalência para o B19V aumenta com a idade e pode variar de 2 a 15% em crianças com até cinco anos de idade, 15 a 60% em crianças e adolescentes de seis a 19 anos, entre 30 e 60% em adultos e até 85% na população idosa (Anderson et al.,1986; Cohen et al., 1988; Kelly et al., 2000).
Mulheres em idade fértil apresentam taxa anual de soroconversão para B19V de 1 a 2% (Koch & Adler, 1990), com alta taxa de infecção naquelas que trabalham em atividades de alto risco ocupacional, como contato com crianças em creches e escolas, chegando a até 30% em períodos epidêmicos, enquanto que mulheres que ocupam outros postos de trabalho têm risco reduzido, próximo de 4% (Anderson et al.,1990;
Gillespie et al.,1990; Cartter et al.,1991).
Dois estudos soroepidemiológicos realizados nas áreas urbanas de Belém e Rio de Janeiro encontraram taxas de prevalência global da ordem de 43% e 72%, respectivamente (Freitas et al., 1990; Nascimento et al, 1990). Achados pertinentes às investigações soroepidemiológicas
em comunidades indígenas isoladas da região amazônica mostraram uma frequência de positividade quatro vezes menor (4,7 a 10,7%) que a registrada para a zona urbana de Belém do Pará (Freitas et al., 1990).
A prevalência de cada genótipo do vírus B19 varia de acordo com a região geográfica, população e amostra biológica pesquisada (Servant-Delmas et al., 2010). Estudo recente baseado na análise filogenética do
11
genótipo 3 que, apesar de predominante no continente africano, tem sido encontrado também em países como França, Brasil, Reino Unido, Estados Unidos, Alemanha, Grécia e Bulgária (Servant et al.,2002;
Cohen et al.,2006; Freitas et al., 2008; Hubschen et al., 2009).
A transmissão do vírus B19 ocorre principalmente pelo contato pessoal, por meio de secreções respiratórias, mas pode também ocorrer pela administração de hemocomponentes e hemoderivados contaminados, verticalmente da mãe para o feto, via placenta, e por transplante de órgãos (Heegard & Brown, 2002).
A evolução da doença está bem documentada em um estudo de Anderson e colaboradores em 1985, no qual voluntários saudáveis se expuseram a uma inoculação por via intranasal conforme descrito a seguir:
Após inoculação intranasal do vírus, o mesmo foi detectado 1-7 dias depois em secreções respiratórias e sangue de indivíduos ainda soronegativos até esse momento. Em alguns foi registrada intensa viremia (aproximadamente 1011 cópias do genoma por mL de soro), durante 4-5 dias, coincidindo com a aplasia de medula e desaparecimento de células precursoras de eritrócitos. A seguir, foram relatados sintomas inespecíficos como febre, mal estar, mialgias, náuseas e cefaleia. Em alguns voluntários a infecção apresentou-se de forma assintomática.
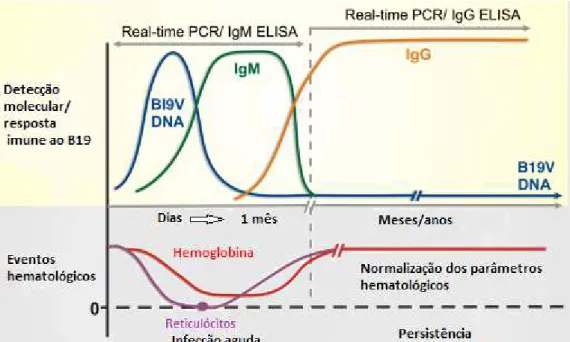
Anticorpos IgM surgem a partir do 10º a 12º dia da infecção, enquanto os anticorpos de IgG só são detectados a partir de duas semanas após a infecção, e provavelmente permanecem por toda a vida (Figura 5), fornecendo imunidade duradoura (Anderson et al., 1985).
12
pico virêmico (Figura 5); a segunda fase é caracterizada pelo aparecimento de sintomas de artralgia e exantema (rash), elevação da
13
Figura 5: Principais eventos hematológicos, imunológicos e diagnósticos durante infecção aguda e persistente por B19V. Modificado de Slavov et al., 2011.
2.6. Transmissão do B19V por produtos do sangue
A transmissão do vírus B19 através de hemocomponentes e hemoderivados tem sido relatada em diversos estudos e está associada a determinadas características virais, como a relativa resistência do vírus a processos de inativação, infecção persistente em indivíduos assintomáticos e ao prolongado período de replicação do vírus após a infecção inicial (Cassinotti et al., 1997; Santagostino et al.,1997; Blumel et al., 2002; Lefrere et al., 2005).
A partir do desenvolvimento de novas metodologias para detecção do B19V tem sido demonstrado que a prevalência dessa infecção entre doadores de sangue é de aproximadamente 1%, e a maioria apresenta carga viral relativamente baixa (<100-1000 UI/mL) (Candotti et al., 2004; Kleimann et al., 2007). No entanto, em períodos
14
neutralizantes que evitem a contaminação do receptor do hemocomponente (Kooistra et al., 2011).
Atualmente não tem sido documentada a transmissão do vírus B19 a partir de produtos obtidos por pool de plasma para os quais tenha
sido quantificada carga viral <103-104 UI/mL (Wu et al., 2005; Parsyan et al., 2007). Estudo conduzido por Kleinmann e colaboradores (2011) em
doadores de sangue demonstrou ser improvável a transmissão do B19V através de componentes do sangue com níveis de carga viral <106 UI/mL. A razão para essa ausência de infectividade não está completamente esclarecida, porém parece estar relacionada à quantidade de partículas virais infundidas na transfusão, o efeito neutralizante de anticorpos contra B19 presentes em unidades de plasma do pool, e fatores do hospedeiro, como infecção prévia e, assim,
o desenvolvimento de imediata imunidade anti-B19V (Parsyan et al.,
2007).
Frente aos possíveis riscos da infecção por B19V a partir de doações de plasma, foi proposto nos Estados Unidos pelo FDA (Food and Drugs Administration) a implementação de testes para determinar a
carga viral do B19V, com o objetivo de garantir que os produtos derivados do plasma apresentem concentração de DNA viral <104 UI/mL (US FDA, 2008). Esse mesmo limite foi determinado pelo Conselho Europeu para preparações de imunoglobulina anti-D e tratamento do plasma visando à inativação viral (European Pharmacopea, 2009).
Enquanto aspectos relativos à transmissão do B19V a partir de
pools de plasma têm resultado no rastreamento do DNA viral para uso
15
hemácias e um por plaquetas) (Yoto et al., 1995; Zanella et al., 1995;
Cohen et al., 1997; Jordan et al., 1998). Além desses, foi também
relatado um caso assintomático descrito a partir de um estudo prospectivo que avaliou infecções virais transmitidas pelo sangue (Yu et al., 2007).
Visando à maior segurança transfusional, é importante que estejam disponíveis testes moleculares sensíveis (limite de detecção a 105 UI/mL) para que seja possível aos diversos serviços a definição de protocolos que determinem o limite da carga viral do B19V nos componentes do sangue, especialmente naqueles utilizados em pacientes com anemia hemolítica, gestantes e pacientes imunocomprometidos, e que, ao mesmo tempo, evitem o descarte desnecessário de hemocomponentes, uma vez que a maior parte deles possui carga viral relativamente baixa (Kleinmann et al., 2009).
2.7. Diagnóstico laboratorial
O diagnóstico laboratorial da infecção pelo B19V pode ser realizado pela demonstração da presença do próprio vírus por meio de identificação direta ao microscópio eletrônico, detecção do DNA viral por hibridização direta ou PCR, ou métodos indiretos de diagnóstico, em que se detecta a presença de anticorpos do indivíduo contra o vírus.
16 2.7.1. Diagnóstico direto
Durante o período virêmico, partículas virais podem ser visualizadas diretamente no soro usando a microscopia eletrônica e/ou imunomicroscopia eletrônica (Caul et al., 1988; Chrystie et al., 1990;
Pilavdzic et al., 1994). Antígenos virais podem ser detectados em
amostras de soro pelos métodos de radioimunoensaio (Anderson et al.,
1982), ensaio imunoenzimático (Anderson et al., 1986; Cubel et al.,
1996) ou através da detecção do genoma viral por métodos de hibridização in situ (Heegaard & Hornsleth, 1995).
2.7.2. Testes moleculares
A introdução de métodos de amplificação do genoma viral fez com que a técnica da reação em cadeia da polimerase (PCR) se tornasse o método diagnóstico mais sensível para detecção do B19V em espécimes clínicos (Clewley et al., 1989; Erdman et al., 1991; Durigon et al., 1993).
Assim, muitos laboratórios atualmente complementam a triagem para anticorpos anti-B19V com diagnóstico por técnicas de PCR, uma vez que já está bem estabelecido que a PCR melhora a sensibilidade na detecção da infecção por B19V (Skjoldebrand-Sparre et al., 2000;
Manaresi et al., 2002).
O primeiro método de PCR para detecção do B19V em soro e tecido fetal surgiu em 1989 (Salimans et al., 1989). Atualmente, há uma
variedade de métodos moleculares comerciais ou desenvolvidos in house para detecção do vírus B19.
17
amplificado (amplicons) ocorra simultaneamente à reação de amplificação, em oposição aos métodos tradicionais de PCR, em que o produto da amplificação é detectado apenas no final da reação, com a utilização de uma segunda técnica, normalmente eletroforese em gel. O monitoramento da presença e acúmulo do amplicon em tempo real é possível pelo uso de sondas ou iniciadores marcados com moléculas fluorogênicas, ou de fluoróforos que se ligam ao próprio produto de PCR (Mackay et al., 2002). A metodologia permite monitorar em tempo real, o
momento da reação em que a fluorescência emitida pelo produto amplificado ultrapassa o limiar de detecção (Ct – Threshold cycle). As PCRs em tempo real mais comuns usam a molécula fluorescente SYBR Green ou sondas hidrolíticas (Taqman®) com diferentes marcações.
O fluoróforo SYBR Green usado na PCR se liga à fita dupla de DNA, e com a excitação da luz emitida pelo sistema óptico do termociclador, emite uma fluorescência verde. A intensidade da fluorescência emitida é proporcional à quantidade de material amplificado na reação, ou seja, do material alvo no início da reação. Nesse método é necessário que após a etapa de amplificação seja feita uma análise da curva de dissociação do produto da PCR. Essa análise consiste na verificação do ponto correspondente à temperatura de dissociação do amplicon (Tm, melting temperature). Assim, a inclusão da
curva de dissociação permite avaliar se houve formação de um único produto através da visualização de um único pico na curva de melting,
indicando que ocorreu amplificação de apenas um alvo, eliminando assim amplificações inespecíficas. A vantagem da PCR usando SYBR Green é que ela é menos onerosa que aquelas usando sondas hidrolíticas.
18
a sequencia alvo estiver presente, a sonda se anela logo após um dos
primers e é clivada através da atividade da nuclease 5` da da Taq DNA
polimerase enquanto o primer é estendido. separando o quencher da
molécula fluorescente após a extensão. A separação do fluoróforo do
quencher resulta em aumento da intensidade da fluorescência. Esse
aumento ocorre apenas quando a sonda é clivada, ou seja, quando a amplificação da sequência-alvo é estabelecida (Heid et al., 1996; Novais & Pires-Alves, 2004). A PCR em tempo real usando sondas TaqMan é bastante sensível e específica, sendo cada vez mais usada no diagnóstico de infecções (Holland et al., 1991).
O desenvolvimento de técnicas de PCR em tempo real aumentou a sensibilidade e especificidade do diagnóstico de B19V. Vários métodos utilizando essa técnica vêm sendo descritos visando a identificação dos genótipos virais e a quantificação da carga viral (Aberham et al., 2001;
Koppelman et al., 2007).
2.7.3. Diagnóstico indireto
A detecção da presença de anticorpos contra o vírus B19 é o método mais utilizado para diagnóstico de pacientes imunocompetentes com alterações clínicas sugestivas da infecção. A detecção de anticorpos IgM indica infecção atual ou recente, dado que estes anticorpos permanecem por até 3 meses na circulação (Schwarz et al.,1997; Heegaard &Brown, 2002).
O aparecimento de anticorpos da classe IgG ocorre a partir de 2 semanas após a infecção e coincide com o declínio de IgM. A reatividade de IgG persiste indefinidamente após a infecção.
Atualmente não existe padrão internacional para detecção de IgM anti-B19V e apenas um teste diagnóstico disponível está autorizado pelo FDA (US Food and Drugs Administration). Trata-se de um
19
para detecção específica de IgM humana no soro ou plasma. Esse imunoensaio possui 89,1% de sensibilidade e 99,4% de especificidade (Corcoran et al., 2004) e está sendo amplamente utilizado no diagnóstico
de infecção recente pelo eritrovírus B19 (Jordan, 2000).
2.8. Manifestações clínicas
Desde sua descoberta em 1975, o eritrovírus humano vem sendo relacionado a uma diversidade de quadros clínicos, que compreendem desde sintomas inespecíficos, como febre, mialgia, fadiga e mal-estar, até quadros clínicos característicos (Anderson & Cohen, 1987).
O aparecimento das diversas manifestações clínicas relacionadas à infecção pelo B19V é influenciado pela condição imunológica e hematológica do hospedeiro. Em crianças e adultos saudáveis, a infecção geralmente evolui de sem sintomas clínicos (Woolf et al., 1989).
2.8.1. Eritema infeccioso
O eritema infeccioso (EI) ou quinta doença da infância é doença exantemática conhecida há mais de um século. A etiologia viral pelo B19V foi descrita por Anderson e colegas (1984), na Inglaterra. O eritema infeccioso é a manifestação clínica mais prevalente em crianças infectadas pelo B19V. Porém, também pode ocorrer em adultos (Pereira
et al., 2001; Hoebe et al., 2002; Figueiredo et al., 2005).
20
Acredita-se que a causa da formação do exantema seja a deposição de complexos formados entre antígenos e anticorpos, já que existe concomitância entre o período de produção de anticorpos e o aparecimento do exantema (Anderson et al., 1985).
2.8.2. Artropatia
A artrite associada ao B19V foi descrita pela primeira vez em 1985 (Reid et al.,1985; White et al., 1985). Artralgia e artrite são os
sintomas mais comuns observados em adultos, acometendo 60% das mulheres e 30% dos homens infectados pelo vírus B19 (Anderson et al.,1985; Woolf et al.,1989). Em contraste, essa manifestação clínica em
crianças tem incidência abaixo ou igual a 10% (Nocton et al., 1993). A
artralgia é geralmente simétrica, com envolvimento principalmente das articulações das mãos e pés, geralmente dura de uma a três semanas, mas pode persistir por meses (Woolf et al., 1989; Freitas et al., 2002).
O diagnóstico diferencial da infecção pelo B19V deve ser considerado em qualquer paciente que apresente artrite reumatoide juvenil. Em contraste com a artrite reumatoide, a infecção pelo B19V não tem sido relacionada à destruição de articulações em prazo mais longo.
2.8.3. Crise aplástica transitória
A Crise Aplástica Transitória (CAT) foi a primeira doença associada ao B19V, sendo originalmente descrita em pacientes portadores de anemia hemolítica crônica, como anemia falciforme, talassemia e esferocitose hereditária (Pattison et al., 1981; Serjeant et al., 1981; Kellerher et al., 1983).
21
ausência de reticulócitos na circulação (Heegaard & Brown, 2002). Geralmente leucócitos e plaquetas não são afetados, no entanto, às vezes estão presentes leve leucopenia e/ou trombocitopenia (Borsato et al., 2000).
2.8.4. Infecção fetal
A infecção pelo eritrovírus B19 durante a gestação pode comprometer o feto, levando à ocorrência de hidropsia fetal, anemia congênita, abortamento ou parto de natimorto (Vallada & Vallada, 2007).
O primeiro relato comprovado registrou a detecção de IgM anti-B19V no sangue de um natimorto e da sua mãe (Knott et al., 1984). Num
segundo relato, Brown e colaboradores (1984), durante um surto de eritema infeccioso, identificaram um caso de hidropsia fetal e detectaram a presença de DNA viral no tecido fetal.
A incidência de infecção primária por B19V durante a gravidez tem sido estimada em 1 a 5% (Kerr et al.,1994; Harger et al., 1998), e a
subsequente transmissão transplacentária situa-se entre 24 e 33% (Enders & Biber, 1990; Yaegashi et al.,1998).
Há maior comprometimento fetal quando a infecção materna acontece até a 20.a semana de gestação. O risco de morte fetal é, em média, de 9%, e de hidropsia fetal varia de 2-9% (Vyse et al., 2007). O
aborto espontâneo e a morte intrauterina são mais frequentes no 1.º e 3.º trimestres da gestação, respectivamente (Nyman et al., 2002).
Entretanto, a infecção no feto pode ser resolvida espontaneamente, resultando em criança normal e sem complicações posteriores (Morey et al., 1991; Xu et al., 2003).
22
o diagnóstico laboratorial é esclarecedor. No entanto, a infecção pelo B19V durante a gravidez passa geralmente despercebida, uma vez que a maioria das gestantes é assintomática ou apresenta manifestações clínicas discretas. Por essa razão, seria importante a realização do diagnóstico sorológico por anti-IgG no pré-natal, e que os profissionais de saúde se mantivessem alertas para a possibilidade dessa infecção nas mães IgG negativas (Cubel, 1996; Wong et al., 2002).
2.8.5. Infecção em pacientes imunodeficientes
Em pacientes imuncomprometidos, devido a doenças inatas ou adquiridas ou em decorrência do uso de drogas imunossupressoras, como em transplantados, a infecção pelo B19V pode levar à anemia crônica. Esses indivíduos não são capazes de produzir anticorpos neutralizantes em títulos protetores, cursando com viremia persistente ou recorrente acompanhado de anemia crônica devido a aplasia de série vermelha (Vallada & Vallada, 2007; Slavov et al., 2011).
Nesses pacientes não é possível a formação de imunocomplexos para eliminar o vírus do organismo. Nesses casos, o diagnóstico laboratorial da infecção pelo B19V só é possível pela detecção do DNA viral (Clewley, 1989; Duringon et al., 1993).
2.9. Tratamento e prevenção
23
concentrado de hemácias, para reverter o quadro de anemia e seus sintomas clínicos, preservando assim a vida do paciente. Gestantes previamente soronegativas devem ter a gravidez monitorada, em caso de soroconversão, por meio de ultrassonografia semanal. Em caso de risco de hidropsia fetal deve-se realizar a cordocentese e transfusão intrauterina de hemácias para diminuir a mortalidade fetal (Bousquet et al., 2000).
Pacientes imunocomprometidos que apresentam infecção crônica pelo B19 e aplasia de células vermelhas devem submeter-se à terapia de infusão endovenosa de gamaglobulina (0.4g/Kg de peso corporal/dia durante 5 dias ou 1g/Kg/dia por 2 ou 3 dias). Esse tratamento pode ser curativo, levando ao aumento nos níveis de reticulócitos e hemoglobina (Heegaard & Brown, 2002).
24 2.10. Anemia falciforme
Os distúrbios das hemoglobinas humanas, ou hemoglobinopatias, constituem grupo heterogêneo de doenças geneticamente determinadas, de ampla distribuição e que apresentam morbidade significativa em todo o mundo (Weatherall & Clegg, 1999). Estima-se que aproximadamente 7% da população mundial seja portadora de doenças desse tipo. Apesar desses distúrbios ocorrerem com maior frequência nas regiões tropicais, eles são encontrados em todo o mundo, devido às migrações (Weatherall & Clegg, 2001; Weatherall, 2008).
As hemoglobinopatias são de importância fundamental na genética médica, pois são as doenças monogênicas mais comuns no mundo, causando morbidade substancial (Thompson & Thompson, 2002). Esses distúrbios constituem um grupo de doenças genéticas caracterizadas por alterações da porção proteica da molécula da hemoglobina. Podem ser classificadas como estruturais e de síntese (Bunn, 1994).
A hemoglobina S (Hb S) é uma variante estrutural decorrente de uma mutação pontual (GAG > GTG) no sexto códon no gene da globina β, levando à substituição do ácido glutâmico pela valina, na sexta posição da cadeia polipeptídica (figura 6) (Steinberg, 1995).
25
As doenças falciformes constituem um conjunto de desordens genéticas autossômicas recessivas, caracterizadas pela presença de, pelo menos, um alelo mutante βS e o fenótipo com a concentração de Hb S superior a 50% (Ashley-Koch et al., 2000; Naoum, 2000; Stuart e
Nagel, 2004). Os genótipos da doença falciforme mais comuns em nosso meio são Hb SS, Hb SC, Hb Sβ+-tal, Hb Sβ0-tal e Hb SDPunjab (Januário, 2002). O traço falciforme caracteriza o portador assintomático, ou heterozigoto falcêmico (Hb AS).
Os indivíduos heterozigotos para a hemoglobina S (AS), portadores do traço falcêmico, possuem hemácias com aproximadamente 20-45% da hemoglobina variante e são assintomáticos; os homozigotos (SS) possuem a anemia falciforme, com hemácias contendo 80% ou mais de Hb S, sendo portadores de anemia hemolítica grave, acompanhada por manifestações clínicas variáveis (Smith et al.,1981; Embury, 1995; Chang et al., 1997; Weatheral &
Provan, 2000). Este genótipo apresenta maior gravidade clínica e hematológica, e maior morbidade e mortalidade que genótipos possuindo Hb S em conjunto com outra Hb variante (Naoum, 2000; Frenette & Atweh, 2007).
26 2.11. Anemia falciforme no Brasil
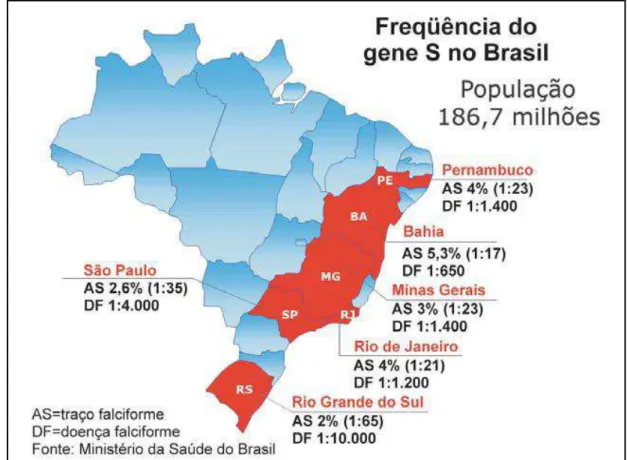
A anemia falciforme é a doença hereditária monogênica mais comum no Brasil, ocorrendo predominantemente, mas não exclusivamente, em afrodescendentes (Di Nuzzo & Fonseca, 2004; Cançado & Jesus, 2007). O Ministério da Saúde estima a prevalência de 25.000 a 30.000 indivíduos com anemia falciforme no país e a incidência de 3.500 novos casos a cada ano (o nascimento de uma criança com anemia falciforme para cada 1.000 recém-nascidos vivos). Com relação ao traço falciforme, estima-se a prevalência de 7.200.000 casos, sendo 2% a 8% na população geral e 6% a 10% entre afrodescendentes. Estima-se a incidência de 200.000 novos portadores do traço falciforme a cada ano (Cançado & Jesus, 2007).
A distribuição do alelo βS no Brasil é bastante heterogênea. A prevalência de heterozigotos (Hb AS) é maior nas regiões norte e nordeste (6% a 10%), enquanto nas regiões sul e sudeste a prevalência é menor (2% a 3%) (Silva & Shimauti, 2006; Cançado & Jesus, 2007).
27
entre heterozigotos e homozigotos (Daudt et al., 2002). Em outro estudo, envolvendo o estado do Rio Grande do Sul como um todo, a prevalência do traço falciforme foi de 1,14% (Sommer et al., 2006). No estado de
São Paulo, na cidade de Campinas, o programa de triagem neonatal encontrou frequência de 1,98% de portadores do traço falciforme e de 0,01% para anemia falciforme (Brandelise et al., 2004). No Estado de
Minas Gerais está estimado o nascimento de uma criança com anemia falciforme para cada 2.500 recém-nascidos vivos (Januário, 2002).
As diferentes prevalências desta hemoglobinopatia nas diferentes regiões brasileiras (figura 7) refletem a diversidade de origens raciais e os variados graus de miscigenação presentes no país (Sommer et al.,
2006).
28 2.12. Patogênese da anemia falciforme
A polimerização da hemoglobina S desoxigenada é o primeiro evento na patogênese molecular da doença falciforme. Ela resulta na distorção da forma da hemácia e na acentuada diminuição da sua deformabilidade (Bunn, 1997).
29
principalmente no baço, medula óssea e placenta (Naoum & Domingos, 1997).
2.13. Principais manifestações clínicas na infância
Os fenômenos vaso-oclusivos e a hemólise crônica são os principais determinantes das manifestações clínicas da anemia falciforme. Apesar da alteração principal estar restrita às hemácias, trata-se de doença sistêmica, cujos efeitos podem incidir sobre qualquer órgão (Reed & Vichinsky, 1998).
2.13.1. Vaso-oclusão
A grande quantidade de Hb S presente nas hemácias do paciente com anemia falciforme leva ao aumento da densidade celular, favorecendo a polimerização intracelular que diminui a maleabilidade da hemácia e leva à obstrução de vasos sanguíneos de médio e pequeno calibre (Wang e Lukens, 1998). Os fenômenos vaso-oclusivos acontecem principalmente em órgãos onde o fluxo sanguíneo é lento e a tensão de oxigênio e o pH são mais baixos, como rim, baço e medula óssea. Vários fatores estão associados a esse evento clínico, como a polimerização da Hb S, desidratação celular, aumento da rigidez do eritrócito e da viscosidade sanguínea, ativação e adesão das células endoteliais e de plaquetas, desequilíbrio do tônus vascular com elevação dos níveis de endotelina e redução do óxido nítrico (Wang & Lukens, 1998; Stuart & Nagel, 2004).
2.13.2. Crises de dor
30
intermitentes da microcirculação, as crises dolorosas são provocadas por danos nos tecidos e geralmente são de início agudo, durando em torno de 3 a 5 dias. A dor atinge mais frequentemente os ossos e as articulações, podendo atingir também o tórax, o abdômen e a região dorsal. Os episódios de dor e edema dos pés e das mãos (dactilite ou síndrome mão-pé) podem ser a primeira manifestação de dor nos lactentes. Esses episódios de dor geralmente são autolimitados e podem desaparecer espontaneamente. Devido à possibilidade de condutas equivocadas, sequelas crônicas ou mesmo risco de vida, merecem atenção especial. Infecções, febre, hipóxia, desidratação e exposição ao frio e níveis mais elevados de Hb são fatores que podem desencadear as crises álgicas (Wang & Lukens, 1998; Gualandro, 2001).
2.13.3. Sequestro esplênico
A crise de sequestro esplênico agudo (SEA) é mais frequente nos dois primeiros anos de vida, sendo caracterizada pelo aumento do baço, diminuição da concentração de hemoglobina (≥ 2g/dL em relação aos níveis basais), sempre acompanhada de reticulocitose, podendo acarretar colapso circulatório que pode levar ao óbito por anemia e choque hipovolêmico (Stuart & Nagel, 2004; Rezende et al, 2009). Essa complicação é resultante da estase (estagnação) aguda das células falciformes nos sinusoides do baço, que aumenta de volume em 2 cm ou mais à palpação.
31
reduzido o número de mortes (Stuart & Nagel, 2004; Cançado & Jesus, 2007).
2.13.4. Síndrome Torácica Aguda
A síndrome torácica aguda (STA) é causa frequente de hospitalizações e a principal causa de morte em jovens adultos com doença falciforme (Platt et al., 1994). É caracterizada por dor torácica, tosse, febre, dispneia, infiltrados pulmonares e declínio no nível basal de hemoglobina. Afeta em torno de 40% dos pacientes com anemia falciforme (Steinberg, 1999).
Em estudo multicêntrico realizado nos EUA do qual 30 centros participaram, as causas específicas dos episódios de STA foram identificadas em 38% dos pacientes. As infecções foram as principais causas (29%), seguidas da embolia gordurosa (9%) (Vichinsky et al., 2000). Os tipos de infecções são igualmente distribuídas entre bacteriana, micoplasma, vírus e infecções por clamídia (Stuart & Nagel, 2004). A infecção pelo eritrovírus B19 causa necrose na medula e uma forma grave de STA (Lowenthal et al., 1996).
Os fatores de risco para STA incluem o genótipo homozigoto (Hb SS), baixas concentrações de Hb F e níveis basais altos de hemoglobina e leucócitos (Castro et al., 1994).
2.13.5. Acidente Vascular Encefálico
32
Os dois principais mecanismos responsáveis pelo AVC em indivíduos com doença falciforme são: 1) arteriopatia oclusiva em que existe proliferação da camada íntima e aumento dos fibroblastos e das células musculares lisas na parede das artérias e, como consequência, estreitamento segmentar progressivo da porção distal da artéria carótida interna e ramos proximais das principais artérias intracranianas (polígono de Willis); 2) agregação das células falciformes e, consequentemente, oclusão do lúmen de pequenos vasos (Hillery & Panepinto, 2004). A terapia transfusional crônica pode reduzir em até 90% a recorrência destes episódios (Figueiredo, 2001). Em adultos, o AVC hemorrágico é o mais comum.
2.13.6. Infecções
As infecções são a maior causa de morbidade e mortalidade de crianças portadoras de anemia falciforme, sendo o Streptococcus pneumoniae o principal agente etiológico. O risco de infecção é maior
nos primeiros anos de vida, especialmente para a meningite bacteriana causada por pneumococos (Costa, 2001; Ohene-Frempong & Steinberg, 2001).
A fisiopatologia que envolve a susceptibilidade elevada à infecção em indivíduos com anemia falciforme está relacionada à asplenia funcional que ocorre progressivamente e dificulta a opsonização de bactérias encapsuladas, favorecendo a infecção por patógenos como S. penumoniae, Haemophilus influenzae, Neisseria meningitidis, Escherichia coli, Enterobacter sp, Klebisiella sp, Salmonella sp e Staphylococcus aureus (Wang & Lukens, 1998; Costa, 2001; Di Nuzzo &
33
2.14. Anemia falciforme e infecção pelo eritrovírus B19
O eritrovírus B19 causa significativa morbidade e mortalidade em crianças com doença falciforme. No entanto, há poucos estudos publicados sobre a epidemiologia e as complicações clínicas associadas a esta infecção em pacientes pediátricos.
Estudos sorológicos em populações gerais, não falcêmicas, na cidade paulista de Caieiras e no Rio de Janeiro, apontam que a infecção pelo eritrovírus B19 ocorre predominantemente durante a infância (Amaku et al., 2009; Nascimento et al, 1990). Estudo realizado na
Jamaica por Serjeant e colaboradores (2001) demonstrou que aos 15 anos de idade 61% das crianças com genótipo SS apresentaram soroconversão para B19V. Esse percentual é similar ao encontrado em outro estudo, realizado no Reino Unido, onde 50% apresentaram soroconversão na faixa etária de 11 a 15 anos (Brown, 1997).
Estudo americano com crianças e adolescentes entre um a 21 anos (média de 7,3 anos) com doença falciforme mostrou prevalência de 30% de B19V e incidência de 11,3 por 100 pacientes-anos (Smith-Whitley, 2004). Em outro estudo realizado na Tunísia com pacientes com doença falciforme (idade média de 9,2 anos) foi identificada infecção passada em 56,5% dos pacientes com anemia falciforme e 39% dos pacientes com β-talassemia. Já a infecção aguda foi detectada em 8,7% das crianças com anemia falciforme por meio da detecção de anticorpos IgM anti-B19V e/ou DNA viral (Regaya et al., 2007). Estudo realizado na
cidade de Ribeirão Preto, São Paulo, avaliou a soroprevalência de anticorpos IgG em uma população de pacientes com doença falciforme e talassemia beta (idade média 19,2 anos) e encontrou taxa de 55,3% Slavov et al., 2011).
34
hematopoiese por aproximadamente uma semana. Isso, entretanto, não leva a anemia sintomática em indivíduos com concentração de hemoglobina dentro dos limites de referência, pois a vida média das hemácias de cerca de 100 dias está preservada. Em pessoas que apresentam anemia hemolítica crônica, ou seja, aquelas com baixas taxas de hemoglobina e hemácias com período de vida curto (aproximadamente 20 dias), a infecção pelo B19V acarreta queda progressiva e relativamente rápida na taxa de hemoglobina, ocasionando anemia intensa, sintomática. Assim, os achados laboratoriais comuns são queda abrupta da hemoglobina, queda dos reticulócitos e redução na medula óssea dos precursores eritroides com inclusões nucleares características nos proeritroblastos (Veríssimo, 2007). Este quadro grave, conhecido como crise aplástica transitória (CAT) é, sem dúvida, umas das principais complicações da anemia falciforme e de outras anemias hereditárias. Nos pacientes com anemia falciforme, a CAT é a condição de maior relevância associada à infecção pelo eritrovírus B19.
Em 1981, foi descrita pela primeira vez a associação entre a infecção pelo eritrovírus B19 e a CAT e desde então estudos têm mostrado que aproximadamente 70% das infecções pelo B19 nessa população resultam em crise aplástica transitória (Serjeant et al., 2001).
Estudo longitudinal realizado por Rao e colaboradores (1992) em Nova Iorque mostrou que 68% dos casos de CAT em pacientes com anemia falciforme foram causados pela infecção por B19V.
O período de incubação viral na crise aplástica pode variar de 9 a 17 dias. Os sintomas prodrômicos possíveis são febre, mal-estar, dores e sintomas gastrointestinais e respiratórios leves. Exantema pode ocorrer em 23% dos pacientes, sendo de difícil visualização nos pacientes melanodérmicos (Cubel et al., 1992; Di Nuzzo & Fonseca,
2004; Smith-Whitley et al., 2004). Os sintomas prodrômicos são
35
reticulopenia acentuada, que duram em média 6 a 8 dias. O curso total da doença, dos sintomas prodrômicos até o reaparecimento dos reticulócitos circulantes é de 10 a 12 dias (Saarinem et al., 1986).
Embora alguns episódios de CAT em crianças com doença falciforme possam ter evolução benigna, muitos deles necessitam transfusão de concentrado de hemácias visando a reduzir o risco de colapso circulatório devido à anemia grave e súbita provocada pela infecção (Goldstein et al., 1987; Serjeant et al., 1993). No estudo
coordenado por Smith–Withley e colegas (2004), a transfusão foi necessária em 72% dos pacientes portadores de doença falciforme, sendo que as crianças com Hb SS necessitaram de transfusão mais frequentemente que as com SC. Um outro estudo em crianças com doença falciforme mostrou que, após a infecção pelo B19V, a imunidade contra outros episódios de CAT parece ser duradoura, não sendo observada recorrência desse evento associada à infecção pelo vírus B19 (Serjeant et al., 2001).
Além da crise aplástica, outras complicações têm sido relacionadas à infecção pelo eritrovírus B19. Eventos cerebrovasculares como acidente vascular cerebral e encefalite foram descritos em dez pacientes com anemia falciforme após confirmação de soroconversão para o vírus (Wierenga et al., 2001). Outros eventos como meningite e
ataxia cerebelar aguda foram observados em indivíduos normais em associação ao B19V (Okumura et al.,1993; Watanabe et al.,1994;
Shimizu et al.,1999). Outro estudo realizado em pacientes com doença
falciforme mostrou a ocorrência de sequestro esplênico (19,1%) e de síndrome torácica (11,8%), como eventos subsequentes à CAT em pacientes infectados pelo B19V (Smith-Whitley et al., 2004). Do mesmo
36
37 3. Objetivos
3.1. Objetivo geral
Estimar a prevalência e incidência da infecção pelo eritrovírus B19 em crianças com doença falciforme atendidas no Hemocentro de Belo Horizonte e avaliar a morbidade da infecção.
3.2. Objetivos específicos
1. Padronizar um teste de PCR em tempo real para detecção dos três genótipos do eritrovírus B19 em amostras de soro ou plasma. 2. Investigar a frequência de infecção passada ou atual/recente pelo
B19V por meio da detecção de anticorpos IgG e IgM anti-B19V, e DNA viral em amostras de soro ou plasma dos indivíduos participantes.
3. Definir o genótipo de B19V mais frequente na população estudada.
38
4. MATERIAIS E MÉTODOS
4.1. Desenho e local de realização do estudo
Trata-se de um estudo transversal aninhado a uma coorte retrospectiva, realizado em crianças com doença falciforme, genótipos SS e Sβ0-talassemia, diagnosticadas pelo Programa Estadual de Triagem Neonatal de Minas Gerais (PETN-MG), nascidas entre 1999 e 2009, acompanhadas no Hemocentro de Belo Horizonte, Fundação Hemominas.
4.2. Caracterização da população de estudo
Inicialmente foi realizada aleatorização estratificada de 385 pacientes, homogeneamente distribuídos em 35 crianças por ano de nascimento, nascidas no período compreendido entre 1999 e 2009, sendo que no ano de 2009 foram incluídas apenas crianças com pelo menos nove meses de idade. Essa amostra de 35 crianças por ano de nascimento representa aproximadamente 50% a 60% do total de crianças com doença falciforme matriculadas anualmente no ambulatório do Hemocentro de Belo Horizonte, todas provenientes do Programa de Triagem Neonatal de Minas Gerais.
39
A diferença de 146 casos entre a aleatorização inicial e os que foram efetivamente estudados (385-239=146) deveu-se à exclusão de crianças nas quais não foi possível a coleta de sangue, por variados motivos, e daquelas para as quais não houve assinatura do termo de consentimento dos responsáveis para participação na pesquisa. Também foram excluídas crianças com idade inferior à 9 meses devido a possível presença de anticorpos maternos anti-B19 circulantes. Três crianças foram excluídas porque, embora tendo o fenótipo FS ao nascimento, eram portadoras do genótipo S-Persistência hereditária de hemoglobina fetal (S-HPFH), provado por testes moleculares.
Os critérios de inclusão utilizados nesta pesquisa foram:
- Crianças triadas pelo PTN-MG, com perfil hemoglobínico compatível com doença falciforme (padrão neonatal FS, ou SS determinado por HPLC e eletroforese com focalização isoelétrica).
- Crianças incluídas pela aleatorização estratificada cujas famílias assinaram o termo de consentimento livre e esclarecido referente à pesquisa e concordaram em realizar coleta de amostra de sangue ou consentiram na utilização de amostra já disponível no Hemocentro de Belo Horizonte.
Os critérios de exclusão foram:
- Crianças com perfil hemoglobínico compatível com outros subtipos de doença falciforme como FSC E FSA (Sβ+-talassemia) e as que apresentaram diagnóstico posterior de PHHF (Persistência Hereditária da Hemoglobina Fetal).
- Crianças que foram ao óbito antes do início do estudo.
- Crianças encaminhadas ao Hemocentro, que compareceram à primeira consulta e não deram seguimento ao acompanhamento clínico.
40
As informações utilizadas na seleção da população de estudo foram retiradas do banco de dados do PETN-MG (NUPAD/Faculdade de Medicina, UFMG).
Foram utilizadas amostras de soro ou plasma coletadas no Hemocentro de Belo Horizonte, no período de junho de 2010 a fevereiro de 2012. A maioria das amostras utilizadas no estudo foi obtida de coletas realizadas para exames de rotina, necessários ao acompanhamento clínico dos pacientes e, desse modo, não foi preciso realizar coleta de sangue exclusivamente para a pesquisa. Nesses casos, aproximadamente 1 a 4 mL de sangue foram coletados em tubo contendo EDTA e o plasma obtido por centrifugação a 3.000 x g por 10 minutos.Naqueles poucos pacientes para os quais não estava prevista coleta de amostras de rotina, o sangue foi colhido por punção venosa em tubo de 5 mL sem anticoagulante, para obtenção de soro.
4.3. Avaliação dos dados clínicos e hematológicos
As informações referentes ao acompanhamento clínico dos pacientes incluídos neste estudo foram retiradas dos prontuários médicos arquivados no ambulatório do Hemocentro de Belo Horizonte e lançadas em planilha Microsoft Excel 2007 que serviu como base de dados para a pesquisa.
4.3.1. Dados hematológicos