PROGRAMA DE PÓS-GRADUAÇÃO EM AGRONOMIA
ELOISA APARECIDA DA SILVA
Engenheira AgronônomaAspergillus niger e Glomus clarum incrementam a
disponibilidade de fósforo em Latossolos sob Urochloa
brizantha
PROGRAMA DE PÓS-GRADUAÇÃO EM AGRONOMIA
ELOISA APARECIDA DA SILVA
OrientadaAspergillus niger e Glomus clarum incrementam a
disponibilidade de fósforo em Latossolos sob Urochloa
brizantha
Profª. Drª. ANA MARIA RODRIGUES CASSIOLATO
Orientadora
Ilha Solteira – SP julho/2012
FICHA CATALOGRÁFICA
Elaborada pela Seção Técnica de Aquisição e Tratamento da Informação Serviço Técnico de Biblioteca e Documentação da UNESP - Ilha Solteira.
Silva, Eloisa Aparecida da.
S586a Aspergillus niger e Glomus clarum incrementam a disponibilidade de fósforo em
Latossolos sob Urochloa brizantha / Eloisa Aparecida da Silva. – Ilha Solteira : [s.n.],
2012
94 f. : il.
Tese (doutorado) - Universidade Estadual Paulista. Faculdade de Engenharia de Ilha Solteira. Especialidade: Sistemas de Produção, 2012
Orientador: Ana Maria Rodrigues Cassiolato Inclui bibliografia
1. Cerrados. 2. Fungos solubilizadores. 3. Micorriza. 4. Biomassa microbiana.
À Deus pela bênção de viver e pela proteção divina.
À Faculdade de Engenharia - UNESP do Campus de Ilha Solteira pela minha formação profissional.
À CAPES, pela concessão da Bolsa de Estudos.
À minha mãe Cleuza e à minha irmã Edicléia pelo apoio nessa jornada.
Ao meu namorado Pedro pelo incentivo e cumplicidade.
À Profª Drª Ana Maria Rodrigues Cassiolato pela orientação e apoio.
À Profª Drª Kátia Luciene Maltoni pela atenção.
À Profª Drª. Elke Jurandi Bran Nogueira Cardoso e ao Profº Drº Ely Nahas pela doação de isolados de Glomus clarum e Aspergillus niger, respectivamente.
Ao Profº Drº Marcelo Andreotti pela doação de sementes de Urochloa brizantha cv Xaraés.
À Engª Agrª MScª Michele Cláudia da Silva pelo auxílio com as análises de água.
que resulta na sua baixa disponibilidade para as plantas. Como o fósforo nas culturas é indispensável, justificam-se estudos relacionados à maximização do aproveitamento do fósforo não lábil do solo por meio de microrganismos solubilizadores de fosfato e fungos micorrízicos arbusculares. O objetivo do presente trabalho foi de averiguar os efeitos de Aspergillus niger Tiegh e de Glomus clarum Nicol. & Schenck em dois latossolos com diferentes teores de óxidos de ferro e alumínio e no crescimento de
Urochloa brizantha (Hochst. ex A. Rich.) Stapf, visando o aproveitamento do fósforo não lábil do solo. O experimento foi conduzido em condições naturais de luz e temperatura, com solo não esterilizado, empregando vasos plásticos com capacidade para 30 dm3 de solo. O delineamento experimental utilizado foi inteiramente casualizado, com 6 repetições e esquemas fatoriais diferenciados. Para as variáveis da caracterização química do solo e as variáveis microbiológicas do solo utilizou-se o fatorial 5x2x7, correspondendo aos tratamentos: épocas, solos e inoculaçãocom 5, 2 e 7 níveis, respectivamente. Os níveis de épocas foram: 0, 90, 180, 270 e 360 dias após o corte de uniformização e os níveis de solo foram LVdA e LVd1. O tratamento inoculação contou com os níveis: controle fosfatado, controle não fosfatado, A. niger 19,A. niger 26, G. clarum, G. clarum + A. niger 19, G. clarum + A. niger 26. Fósforo total, fósforo inorgânico e fósforo orgânico foram avaliados no esquema fatorial 2x2x7 com os mesmos tratamentos do esquema anterior, porém com apenas dois níveis para épocas: 180 e 360 dias. O fósforo disponível total e o fósforo não lábil foram analisados no esquema fatorial 2x7 ao final do experimento com os níveis de solo e inoculação descritos. As variáveis da planta foram analisadas no esquema fatorial 2x7 com os mesmos níveis de tratamentos solo e inoculação, entretanto a massa seca radicular, o fósforo acumulado correspondente, a massa seca total e o fósforo acumulado total foram avaliados apenas ao final do experimento, ao passo que as demais variáveis foram analisadas aos 0, 90, 180, 270 e 360 dias. G. clarum e/ ou A. niger 19 e A. niger 26 promoveram os maiores teores de fósforo disponível total e os menores teores de fósforo não lábil. A quantidade de argila representou maior limitação à disponibilização de fósforo do que o percentual de goethita. A inoculação de G. clarum e /ou A. niger 19 e 26 resultaram em maiores valores de carbono (C-CO2 liberado). A inoculação de G.
apresentaram-se maiores quando inoculados com G. clarum. A. niger 19 e A. niger 26 mostraram-se capazes de solubilizar o fósforo não lábil do solo.
availability to plants. As the phosphor in the cultures is essential, justifies related studies to maximize the use of non-labile soil phosphorus by phosphate solubilizing microorganisms and arbuscular mycorrhizal fungi. The aim of this study was to investigate the effects of Aspergillus niger and Glomus clarum Tiegh Nicol. & Schenck in two soils with different levels of iron and aluminum oxides, and the growth of
Urochloa brizantha (Hochst. ex A. Rich.) Stapf, targeting the use of non-labile soil phosphorus. The experiment was conducted under natural conditions of light and temperature, with non-sterile soil, using plastic pots with a capacity of 30 dm3 of soil.
The experimental design was completely randomized with six replications and differentiated factorial schemes. The variables for the soil chemical and microbiological characterization were analyzed in the 5x2x7factorial scheme, corresponding to the treatments: time, soil and inoculation, with 5, 2 and 7 levels, respectively. The levels of time were 0, 90, 180, 270 and 360 days after the uniformity cut, and the soil were LVdA and LVd1. The inoculation treatment levels included: control phosphate, no phosphate control, A. niger 19, A. niger 26, G. clarum, G. clarum + A. niger 19 and A. niger 26+G. clarum. Total phosphorus, inorganic and organic phosphorus were evaluated in a 2x2x7 factorial, with the same treatments as the previous scheme, but with only two levels for time: 180 to 360 days. The total available phosphorus and the non-labile phosphorus were analyzed in a 2x7 factorial scheme, at the end of the experiment, using the same levels of soil and inoculation as described. The plant variables were analyzed in a 2x7 factorial with the same levels of soils and inoculation treatments in previously described, however the root dry mass, corresponding accumulated phosphorus, the total dry mass and total accumulated phosphorus were assessed only at the end of the experiment, while other variables were analyzed at 0, 90, 180, 270 and 360 days. G.
clarum and / or A. niger 19 and A. niger 26 promoted the highest levels of available phosphorus and the lowest for the total non-labile soil phosphorus. The amount of clay represented major limitation to the phosphorus availability than the percentage of goethite. The inoculation with G. clarum and / or A. niger 19 and 26 resulted in higher values of released C-CO2. The inoculated G. clarum led to higher values of microbial
Figura 1 Médias de potencial de hidrogênio nas diferentes épocas de amostragem 46
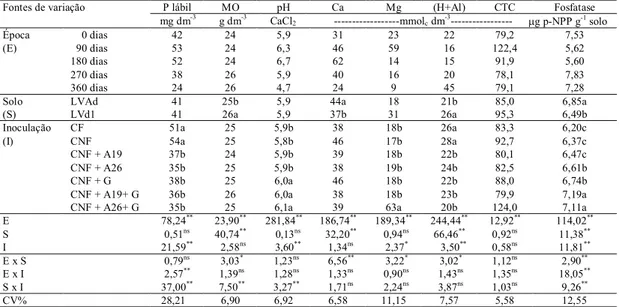
Figura 2 Médias de matéria orgânica (A), cálcio (B), magnésio (C), acidez potencial (D) e atividade da fosfatase ácida do solo (E) para os diferentes solos e épocas de amostragem. (LVAd: LATOSSOLO VERMELHO AMARELO
e LVd1: LATOSSOLO VERMELHO) 47
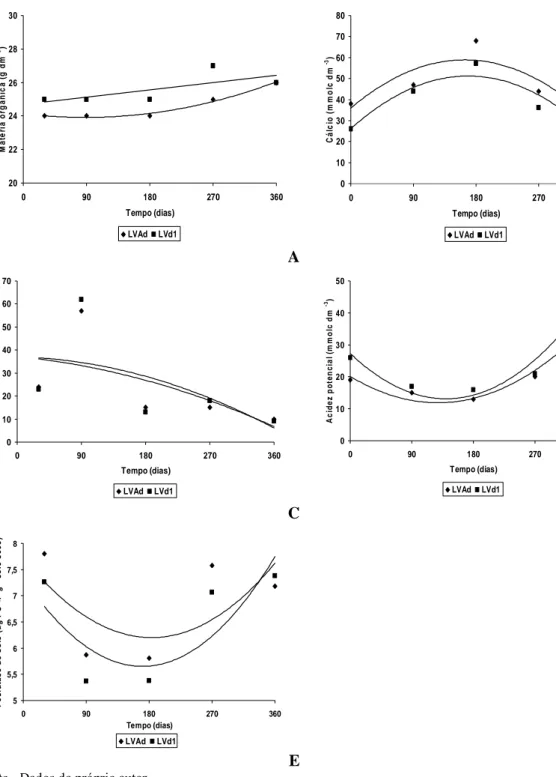
Figura 3 Médias de fósforo lábil (P lábil) (A) e atividade da enzima fosfatase ácida do solo (B) para as diferentes épocas de amostragem e inoculação. Fósforo lábil: teor de fósforo resina/(100 – subestimação %). CF: controle
fosfatado; CNF: controle não fosfatado; A19: Aspergillus niger 19; A26:
Aspergillus niger 26; G: Glomus clarum 49
Figura 4 Médias de carbono liberado (C-CO2 liberado) (A), carbono de biomassa
microbiana (CBM) (B), quociente metabólico (qCO2) (C), quociente
microbiano (qMIC) (D), fósforo da biomassa microbiana (PBM) (E) e
número de esporos (F) nas diferentes épocas em função dos diferentes solos 59
Figura 5 Médias de carbono da biomassa microbiabna (A), quociente metabólico (B), quociente microbiano (C), fósforo da biomassa microbiana (D), colonização micorrízica (E) e número de esporos (F) para as diferentes épocas de amostragem e inoculação. CF: controle fosfatado; CNF: controle
não fosfatado; A19: Aspergillus niger 19; A26: Aspergillus niger 26; G:
Glomus clarum 62
Figura 6 Precipitação pluvial mensal de janeiro de 2010 a setembro de 2011 no
camada de 0-0,20 m na Fazenda de Ensino, Pesquisa e Extensão (FEPE)
da UNESP, localizada município de Selvíria-MS 31
Tabela 2 Caracterização inicial dos dois latossolos coletados para fósforo lábil, matéria orgânica, potencial de hidrogênio, potássio, cálcio, magnésio, acidez potencial, alumínio, soma de bases, capacidade de troca catiônica, saturação por bases, fósforo total (P total), fósforo inorgânico (P inorg.) e
fósforo orgânico (P org) 33
Tabela 3 Médias e valores de F para fósforo lábil (P lábil), matéria orgânica, potencial de hidrogênio, cálcio, magnésio, acidez potencial, capacidade de troca catiônica e atividade da fosfatase ácida do solo, nas diferentes
épocas de amostragem, tipos de solos e inoculação 45
Tabela 4 Desdobramento das interações significativas para matéria orgânica, cálcio, magnésio, acidez potencial e atividade da fosfatase ácida do solo para os diferentes solos e épocas de amostragem e seus pontos de máximo ou
mínimo (P max/min) 48
Tabela 5 Desdobramento das interações significativas para fósforo lábil (P lábil) e atividade da fosfatase ácida do solo, para as diferentes épocas e
inoculação e seus pontos de máximo ou mínimo (P max/min) 50
Tabela 6 Desdobramento das interações significativas para fósforo lábil (P lábil), matéria orgânica, potencial de hidrogênio e fosfatase ácida do solo para
os diferentes solos e inoculação 51
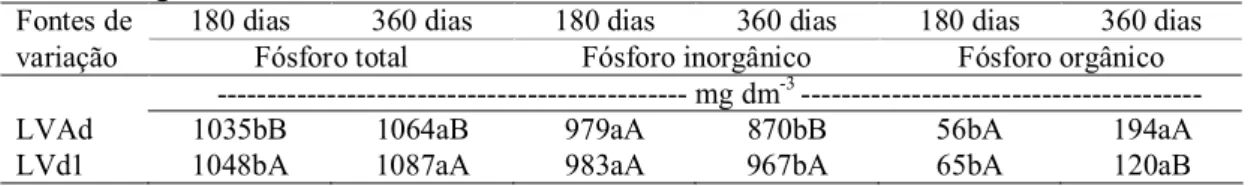
Tabela 7 Médias e valores de F para fósforo total, fósforo inorgânico e fósforo orgânico aos 180 e 360 dias para os diferentes solos e diante da
inoculação 52
Tabela 8 Desdobramento das interações significativas para fósforo total, fósforo
Tabela 10 Desdobramento das interações significativas para fósforo orgânico nos
diferentes solos diante da inoculação 53
Tabela 11 Médias e valores de F para fósforo disponível total do solo e fósforo não
lábil do solo para os diferentes solos e inoculação 54
Tabela 12 Desdobramento das interações significativas para fósforo disponível total (P disponível total) e fósforo não lábil (P não lábil) nos diferentes solos e
inoculação 55
Tabela 13 Médias e valores de F para carbono do CO2 liberado (µg CO2 g-1 solo
seco dia), carbono de biomassa microbiana (CBM - µg C g-1 solo seco),
quociente metabólico (qCO2 - µg CO2/µg C g1 solo seco), quociente
microbiano (qMIC - %), fósforo da biomassa microbiana (PBM - mg P
g-1 solo seco), porcentagem de colonização micorrízica (COL - %) e
número de esporos (100 g solo-1 seco) de fungos micorrízicos
arbusculares, para as diferentes épocas de amostragem, tipos de solos e
inoculação 57
Tabela 14 Desdobramento das interações significativas para carbono liberado
(C-CO2 liberado), carbono de biomassa microbiana (CBM), quociente
metabólico (qCO2) e quociente microbiano (qMIC), fósforo da biomassa
microbiana (PBM) e número de esporos, para os diferentes solos e épocas
de amostragem e seus pontos de máximo ou mínimo (P max/min) 60
Tabela 15 Desdobramento das interações significativas para carbono de biomassa
microbiana (CBM), quociente metabólico (qCO2) e quociente microbiano
(qMIC), fósforo da biomassa microbiana (PBM), porcentagem de
colonização micorrízica e número de esporos para as diferentes épocas e
(qMIC) e fósforo da biomassa microbiana (PBM) para os diferentes
solos e inoculação 64
Tabela 17 Médias e valores de F para massa seca da parte aérea, atividade da fosfatase ácida foliar e fósforo acumulado na parte aérea nos diferentes
tipos de solos e inoculação 0, 90, 180, 270 e 360 dias 66
Tabela 18 Médias e valores de F para massa seca radicular, massa seca total, fósforo radicular (P radicular), e fósforo acumulado total (P acumulado total)
para os diferentes solos e inoculação 67
Tabela 19 Desdobramento das interações significativas para massa seca da parte aérea (0 dias), atividade da enzima fosfatase foliar (0 e 90 dias), fósforo acumulado na parte aérea (90 e 180 dias) e fósforo acumulado total para
os diferentes solos e inoculação 67
Tabela 20 Coeficiente de correlação para fósforo lábil, matéria orgânica, potencial de hidrogênio, cálcio, magnésio, acidez potencial, capacidade de troca catiônica, atividade da enzima fosfatase ácida do solo (fosf solo), fósforo total (P total), fósforo inorgânico (P inorg), fósforo orgânico (P org), fósforo disponível total (P dispt), fósforo não lábil (P não lábil), carbono
do CO2 liberado (C-CO2), carbono de biomassa microbiana (CBM),
quociente metabólico (qCO2), quociente microbiano (qMIC), fósforo da
biomassa microbiana (PBM), colonização micorrízica (COL), número de esporos (esporos), massa seca radicular (MSR), massa seca total, fósforo acumulado radicular (P radicular) e fósforo acumulado total (P
bases, capacidade de troca catiônica, saturação por bases, atividade da enzima fosfatase ácida do solo (fosf solo), fósforo total (P total), fósforo inorgânico (P inorg), fósforo orgânico (P org), fósforo disponível total (P dispt), massa seca da parte aérea (0, 90, 180, 270 e 360 dias), atividade da enzima fosfatase ácida foliar (0, 90, 180, 270 e 360 dias), fósforo acumulado na parte aérea (0, 90, 180, 270 e 360 dias)
84
Tabela 22 Coeficiente de correlação para fósforo não lábil (P não lábil), carbono do
CO2 liberado (C-CO2), carbono de biomassa microbiana (CBM),
quociente metabólico (qCO2), quociente microbiano (qMIC), fósforo da
biomassa microbiana (PBM), colonização micorrízica (COL), número de esporos (esporos), massa seca radicular (MSR), massa seca total, fósforo acumulado radicular (P radicular), fósforo acumulado total (P acumulado total), massa seca da parte aérea (0, 90, 180, 270 e 360 dias), atividade da enzima fosfatase ácida foliar (0, 90, 180, 270 e 360 dias),
fósforo acumulado na parte aérea (0, 90, 180, 270 e 360 dias) 85
Tabela 23 Coeficiente de correlação para massa seca da parte aérea (90, 180, 270 e 360 dias), atividade da enzima fosfatase ácida foliar (0, 90, 180, 270 e
360 dias), fósforo acumulado na parte aérea (0, 90, 180, 270 e 360 dias) 86
Tabela 24 Médias de fósforo lábil, matéria orgânica, potencial de hidrogênio, cálcio, magnésio e acidez potencial para inoculação no latossolo
vermelho amarelo aos 0, 90,180, 270 e 360 dias 87
Tabela 25 Médias de capacidade de troca catiônica, atividade da fosfatase ácida do
solo, carbono liberado (C-CO2 liberado), carbono da biomassa
microbiana, quociente metabólico e quociente microbiano para
fosfatase foliar e fósforo acumulado na parte aérea para inoculação no
latossolo vermelho amarelo aos 0, 90,180, 270 e 360 dias 89
Tabela 27 Médias de fósforo total, fósforo inorgânico e fósforo orgânico aos 180 e 360 dias e médias de fósforo disponível total (P dispt), fósforo não lábil, massa radicular, massa seca total, fósforo radicular e fósforo acumulado total ao final do experimento para inoculação no latossolo vermelho
amarelo 90
Tabela 28 Médias de fósforo lábil, matéria orgânica, potencial de hidrogênio, cálcio, magnésio e acidez potencial para inoculação no latossolo vermelho aos 0,
90,180, 270 e 360 dias 91
Tabela 29 Médias de capacidade de troca catiônica, atividade da fosfatase ácida do
solo, carbono liberado (C-CO2 liberado), carbono da biomassa
microbiana, quociente metabólico e quociente microbiano para
inoculação no latossolo vermelho aos 0, 90,180, 270 e 360 dias 92
Tabela 30 Médias de fósforo da biomassa microbiana, porcentagem de colonização micorrízica, número de esporos, massa seca da parte aérea, atividade da fosfatase foliar e fósforo acumulado na parte aérea para inoculação no
latossolo vermelho aos 0, 90,180, 270 e 360 dias 93
Tabela 31 Médias de fósforo total, fósforo inorgânico e fósforo orgânico aos 180 e 360 dias e médias de fósforo disponível total (P dispt), fósforo não lábil, massa radicular, massa seca total, fósforo radicular e fósforo acumulado
1 INTRODUÇÃO 16
2 REVISÃO DE LITERATURA 18
2.1 Distribuição geográfica e características agronômicas do gênero
Urochloa 18
2.2 O efeito do fósforo sobre as plantas 19
2.3 Formas de fósforo no solo 20
2.4 A mineralogia dos solos tropicais e sua relação com o fósforo 22
2.5 O papel da microbiota na qualidade do solo 24
2.5.1 Bioindicadores de qualidade do solo 25
2.6 Fungos micorrízicos arbusculares 26
2.6.1 Relação entre o fósforo e a micorriza 28
2.7 O potencial de fungos solubilizadores de fósforo 29
3 MATERIAL E MÉTODOS 31
3.1 Local de instalação do experimento e descrição dos solos utilizados 31
3.2 Multiplicação, inoculação dos fungos Glomus clarum e Aspergillus
niger e instalação do experimento 34
3.3 Análises realizadas 35
3.3.1 Análises do solo 36
3.3.1.1 Análise química do solo 36
3.3.1.1.2 Atividade enzimática da fosfatase ácida 36
3.3.1.1.3 Fósforo total 37
3.3.1.1.4 Fósforo orgânico 37
3.3.1.1.5 Fósforo inorgânico 37
3.3.1.1.6 Fósforo disponível total 37
3.3.1.1.7 Fósforo não lábil 38
3.3.1.2 Análises microbiológicas 38
3.3.1.2.1 Carbono do CO2 liberado 38
3.3.1.2.2 Carbono da biomassa microbiana 38
3.3.1.2.3 Determinação do quociente metabólico (qCO2) 39
3.3.1.2.4 Determinação do quociente microbiano (q MIC) 39
3.3.1.2.5 Fósforo da biomassa microbiana 39
3.3.1.2.6 Porcentagem de colonização micorrízica 40
3.3.1.2.7 Contagem de esporos 41
3.3.2.3 Fósforo acumulado na parte aérea 42
3.3.2.4 Massa seca radicular 42
3.3.2.5 Fósforo acumulado radicular 42
3.3.2.6 Massa seca total 42
3.3.2.7 Fósforo acumulado total 42
3.3.3 Análise de água 43
3.3.3.1 Dureza 43
3.3.3.2 Teor de fosfato 43
3.3.4 Delineamento experimental e análise de dados 43
3.4 Dados climaticos 44
4 RESULTADOS E DISCUSSÃO 45
4.1 Atributos do solo 45
4.2 Variáveis microbiológicas 56
4.3 Crescimento das plantas 64
5 CONCLUSÕES 68
REFERÊNCIAS 69
APÊNDICE A – Precipitação pluvial 82
APÊNDICE B - Coeficientes de variação 83
1 INTRODUÇÃO
O fósforo nas plantas é indispensável para o desempenho de diversas funções como fotossíntese, respiração e reprodução; por conta disso, a deficiência desse nutriente compromete o crescimento e desenvolvimento das mesmas tornando necessário o adequado manejo da fertilização com esse nutriente.
Os solos de regiões tropicais, no entanto, são carentes desse elemento, por serem ácidos e apresentarem alta capacidade de fixação do fósforo, processo que envolve sua precipitação na superfície de óxidos de ferro e alumínio, resultando na sua baixa disponibilidade para as plantas, o que pode restringir a produtividade das culturas. Portanto, para suprir esta carência é necessária a aplicação de fertilizantes fosfatados em doses elevadas.
Existem processos naturais, todavia, que podem aumentar a disponibilidade de fósforo, entre os quais, a solubilização microbiana de fosfatos inorgânicos insolúveis. Trata-se de microrganismos do solo hábeis em solubilizar fosfatos orgânicos e inorgânicos, por processos que envolvem excreção de ácidos orgânicos ou inorgânicos, na dependência do metabolismo microbiano em questão.
Numerosos estudos têm sido realizados testando microrganismos solubilizadores de fosfato, na tentativa de criar alternativas para um melhor fornecimento de fósforo para as plantas, sendo que a dinâmica do processo de solubilização pode variar em função do meio e dos microrganismos.
Além da possibilidade de solubilização do fósforo pode-se considerar, ainda, o aporte desse nutriente por meio da inoculação de fungos micorrízicos arbusculares, os quais promovem maior aquisição do nutriente existente no solo por meio de maior exploração do solo pelas hifas e raízes. Esses estimulam o crescimento vegetal como conseqüência do efeito sobre a absorção de elementos pouco móveis no solo, como o fósforo.
proposto com o objetivo de averiguar os efeitos de Aspergillus niger Tiegh e de Glomus
2 REVISÃO DE LITERATURA
2.1 Distribuição geográfica e características agronômicas do gênero Urochloa
O gênero Urochloa contém cerca de 97 espécies, com limites taxonômicos ainda mal definidos, distribuídas por toda a zona tropical do planeta. São encontradas espécies nativas no continente Americano (14), na Austrália (10) e no sudeste Asiático (6), com o restante no continente Africano, onde estão as mais conhecidas e importantes para a pecuária tropical (RENVOIZE; CLAYTON; KABUYE, 1996). Essas espécies crescem dentro de uma grande faixa de variação de habitats, sendo típicas nas savanas, mas também crescem em regiões alagadas ou desérticas, em plena luz ou sombreadas (BUXTON; FALES, 1994).
Embora sejam descritas como plantas daninhas agressivas e de controle custoso em áreas agrícolas, o interesse agronômico do gênero está relacionado ao seu uso como plantas forrageiras em pastagens (VALLE; EUCLIDES; MACEDO, 2000).
Em todo território nacional, existem aproximadamente 180 milhões de hectares de pastagens cultivadas e nativas. Da área cultivada, 70 a 80% são formados por espécies do gênero Urochloa. Dados não oficiais mostram que as braquiárias ocupam cerca de 85 % das pastagens na região dos Cerrados (42,5 milhões de hectares dos 55 milhões de hectares de pastagens cultivadas nessa região e que os Estados do Centro-Oeste possuem aproximadamente 73 milhões de hectares de pastagens, dos quais 51 % são formadas pelo gênero Urochloa, 41 - 42 % formadas por espécies nativas e apenas 7 - 8 % formada com outras espécies forrageiras (MACEDO, 1995; SANO; BARCELLOS; BEZERRA, 1999).
O gênero Urochloa permitiu o aumento do rebanho nacional em número e a melhoria de seus índices zootécnicos. O número de cabeças passou de aproximadamente 158 milhões de cabeças em 1996 para cerca de 207 milhões de cabeças em 2005 (IBGE, 2007). Pesquisadores ressaltam o aumento da taxa de lotação das pastagens, proveniente do uso maior de tecnologia e, recentemente, da integração lavoura-pecuária (ANDRADE, 1994; VALLE; MILES, 1994; VALLE; EUCLIDES; MACEDO, 2001), consideradas ideais para os avanços da pecuária e das lavouras nas regiões Norte, Nordeste e Centro-Oeste.
forragem; tolerância a pragas, em especial às cigarrinhas das pastagens [Zulia entreriana (Berg), Deois flavopicta (Stal) e Deois schach (Fab)]; alta resposta à aplicação de fertilizantes; boa qualidade de forragem e alta produção de raízes e sementes, tornando o gênero o campeão de vendas de sementes no país (SOARES FILHO, 1994).
A substituição das espécies nativas, de baixa produtividade, por gramíneas cultivadas, permitiu o desenvolvimento do setor e ajudou a levar o país ao patamar de maior exportador mundial de carne, detentor do maior rebanho bovino comercial do mundo. De acordo com o último censo agropecuário realizado em 1995/1996, do mapa de utilização de terras no Brasil, ocorreu a diminuição das pastagens nativas, de aproximadamente 100 milhões de hectares em 1970, para 75 milhões em 1996. Em contrapartida houve aumento significativo na área de pastagens plantadas que passou de 27 milhões de hectares em 1970, para 90 milhões em 1996 (IBGE, 2007).
2.2 O efeito do fósforo sobre as plantas
Nas plantas, o fósforo desempenha papel importante na transferência de energia da célula, na respiração e na fotossíntese. As limitações à sua disponibilidade, no início do ciclo vegetativo, podem resultar em restrições ao desenvolvimento, das quais a planta não se recupera posteriormente, mesmo aumentando o suprimento de fósforo a níveis adequados (GRANT et al., 2001).
A baixa disponibilidade de fósforo no solo, para a planta é uma condição comum ao redor do mundo. Embora o fósforo total do solo possa ser alto, grande parte dele é ligado firmemente a componentes orgânicos e inorgânicos do solo e está indisponível para a absorção por meio das raízes. As plantas, porém, desenvolveram estratégias para ganhar acesso ao fósforo fixado. Estas estratégias incluem associação com fungos micorrízicos, que colonizam as raízes das plantas e desenvolvem hifas que se difundem no solo, aumentando a absorção de fósforo (BLEVINS, 1999).
radicular do fósforo. Estas estratégias são de sobrevivência das plantas que ocorrem sob condições de estresse (BLEVINS, 1999).
2.3 Formas de fósforo no solo
Os minerais fosfatados primários são as fontes de fósforo nos sistemas naturais. Como o fósforo é seu constituinte estrutural para ser utilizado pelos organismos vivos, deve haver rompimento da estrutura cristalina para ser liberado. O rompimento desses minerais primários ocorre mediante intemperização, que depende dos fatores e processos de formação do solo durante a pedogênese. O fósforo é, então, liberado para a solução do solo e readsorvido aos colóides, mas parte dele é absorvida pelos organismos e pelas plantas. Neste estágio de formação do solo, ocorre a maior biodisponibilidade de fósforo, já que os colóides inorgânicos são pouco intemperizados e a quantidade de sítios adsorventes é pequena; por isso, ele é retido com baixa energia, facilitando seu retorno à solução do solo. Concomitantemente à utilização de fósforo pelos organismos vivos, seus resíduos são depositados no solo e uma nova forma é acumulada, o fósforo orgânico (GATIBONI, 2003).
Com o avanço do intemperismo, os minerais fosfatados são degradados e sua contribuição no fornecimento de fósforo ao sistema é reduzida. Adicionalmente, os minerais do solo também sofrem intemperismo, aumentando sua cristalinidade e os sítios de adsorção aniônica. Com isso, a fase sólida mineral do solo muda seu caráter frente à disponibilidade de fósforo, passando de fonte a dreno da solução, devido à formação de complexos de alta energia e de difícil reversibilidade, o que diminui a biodisponibilidade do nutriente (GATIBONI, 2003).
Assim, o destino do fósforo dos minerais primários é o próprio solo, pois se estabiliza em compostos inorgânicos e orgânicos de alta energia de ligação, ficando a sua bioutilização depende da interceptação pelas raízes antes da passagem para formas mais estáveis e antes da mineralização do fósforo orgânico. Estima-se que 25% dos solos tropicais e subtropicais, caracterizados pelo alto grau de intemperismo, apresentam deficiência acentuada de fósforo (SANCHEZ; LOGAN, 1992).
solos da Região Sul (pouco intemperizados) e do Planalto Riograndense (mais intemperizados), porém o percentual de fósforo inorgânico baixou de 31% para 12% do fósforo total, respectivamente, indicando que a disponibilidade de fósforo inorgânico diminui em solos intemperizados. A importância relativa do fósforo orgânico na nutrição das plantas aumenta quando há deficiência de fósforo, resultante dos baixos teores totais e, ou, forte adsorção de fósforo pelos oxidróxidos de ferro e alumínio no solo. Nessas condições, a ciclagem de formas orgânicas mais lábeis é acelerada, sendo mais importante em solos tropicais altamente intemperizados (SILVA; MENDONÇA, 2007).
O fósforo inorgânico do solo pode ocorrer em várias formas, com diferentes energias de ligação aos íons e colóides do solo, dependendo do grau de intemperização e uso do solo. Como apenas pequena parte do fósforo do solo é disponibilizada às plantas, a estimativa do fósforo total não informa sobre biodisponibilidade do elemento e se faz necessário o conhecimento das suas formas predominantes. A avaliação da ocorrência destas formas e a sua participação na biodisponibilidade têm envolvido vários pesquisadores nas últimas seis décadas. Neste período, diversas metodologias de extração do fósforo do solo foram desenvolvidas, tendo como base teórica a técnica do fracionamento desenvolvida por Chang; Jackson em 1956, que usa o modo de ação de extratores químicos como agente seletivo para a extração do fósforo ocorrente em diferentes formas e estados de energia (FIXEN; GROVE, 1990).
O fósforo orgânico é extremamente relevante nos solos tropicais, pois atua ativamente na disponibilidade de fósforo às plantas (CROSS; SCHLESINGER, 1995) e deve ser levado em consideração em estudos envolvendo a sua dinâmica e a biodisponibilidade. O fósforo orgânico é originário dos resíduos vegetais adicionados ao solo, do tecido microbiano e dos produtos de sua decomposição. A grande variedade de compostos orgânicos no solo faz com que mais da metade das formas de fósforo orgânico ainda não tenham sido identificadas.
Para o caso do fósforo, não se pode estabelecer uma relação C:P básica nos resíduos que divida os processos de imobilização ou mineralização, porque além da decomposição biológica, pode ocorrer a mineralização bioquímica, que consiste na retirada do fósforo orgânico dos compostos orgânicos sem decomposição da molécula, por intermédio de catálise enzimática provocada por fosfatases produzidas pelos microrganismos e plantas (BISHOP; CHANG; LEE, 1994). Além disso, o carbono pode sair do sistema via liberação de CO2,
2.4 A mineralogia dos solos tropicais e sua relação com o fósforo
Os solos brasileiros, geralmente, são pobres em fósforo disponível e, por conseguinte, a adubação com esse nutriente é uma das práticas que mais elevam a produtividade da agropecuária, desde que outros fatores da produção não se apresentem ainda mais limitantes. Esse macronutriente, segundo Raij (1991), é exigido em menores quantidades pelas plantas, porém é o mais aplicado em adubações no Brasil, devido a sua carência generalizada e, também, porque o elemento tem forte interação com o solo. A baixa disponibilidade de fósforo nos solos tropicais, provavelmente, é decorrente dos seus baixos teores, da baixa solubilidade dos compostos de fósforo, normalmente encontrados nos solos e da sua imobilização, devido as fortes interações que apresenta com os constituintes destes solos (ROLIM NETO; SCHAEFER; COSTA, 2004), sendo estas interações conhecidas como adsorção, sorção ou fixação de fósforo.
A adsorção de fósforo é o fenômeno pelo qual formas solúveis de fósforo, por meio de ligações eletrostáticas ou covalentes, e de precipitação, com formação de compostos insolúveis, tornam-se indisponíveis para as plantas (AQUINO, 2004). A magnitude deste fenômeno depende da natureza e da quantidade de sítios disponíveis na superfície dos minerais. Assim, numerosos trabalhos têm mostrado que os principais fatores que influenciam a adsorção de fósforo no solo são a quantidade e a mineralogia da fração argila, a quantidade de colóides amorfos, o pH, o teor de alumínio trocável e a matéria orgânica (MOREIRA et al., 2006).
Em decorrência do fenômeno da fixação que ocorre no solo, grande quantidade de fósforo é aplicada nas culturas, porém apenas de 5 a 20% é absorvido pelas plantas (RAIJ et al., 1996). Os fertilizantes solúveis, além do alto custo e da grande quantidade requerida, possibilitam uma reação do fósforo solúvel introduzido com componentes do solo, formando compostos de fósforo insolúveis e indesejáveis (VASSILEV et al., 1996).
Os Latossolos são solos em avançado estado de intemperismo, apresentam intensa perda de sílica (dessilicatização), com resultante acúmulo de óxidos insolúveis de ferro e alumínio (UEHARA, 1988), sendo os mais freqüentes a goetita (αFeOOH), a hematita (αFe203) e a gibbsita γAl(OH)3. A primeira confere cor amarela ao solo (2,5Y - 10YR) na
ausência de hematita, enquanto, na segunda, a cor é vermelha (2,5YR - 5R), mesmo quando ela aparece em pequenas quantidades (KÄMPF; RESENDE; CURI, 1988).
elevados teores de óxidos de ferro. Mesmo não sendo a rocha relativamente rica em minerais máficos, os processos de formação do solo nas áreas tropicais promovem a concentração residual de óxidos de ferro e de alumínio. Solos originados de material pobre em minerais máficos tendem a ser mais pobres em óxidos de ferro e de alumínio, fixando menos fósforo (RESENDE et al., 1997).
A gibsita tem alto poder adsorvente, o que pode compensar o efeito dos óxidos de ferro, isto é, pode ser um solo relativamente pobre em óxidos de ferro e rico em gibsita e, portanto, com alta capacidade de adsorção de fósforo. A goethita tende a adsorver mais fósforo do que a hematita (BAHIA FILHO et al., 1983; SOUZA et al., 1991), mas nem sempre isto acontece (CORRÊA, 1984), havendo registro de situação em que a hematita adsorve mais fósforo (GUALBERTO et al., 1987). É fundamental considerar a textura, ao lado do conteúdo de óxidos (de ferro e de alumínio), nesses processos de fixação de fósforo. Em condições comparáveis, os solos mais argilosos apresentam maior fixação de fósforo (RESENDE et al., 1997).
O fenômeno da adsorção de fósforo em solo, apesar de conhecido há mais de um século e de ser um dos temas mais estudados no campo da ciência do solo, ainda mostra vários desdobramentos a serem esclarecidos, o que sugere a necessidade de novos estudos (BAHIA FILHO, 1982). Isso é particularmente válido para o Brasil, em função do grande domínio dos Latossolos, solos estes reconhecidamente grandes fixadores de fósforo (CAMARGO et al.,1988).
O processo de adsorção de fósforo pelos óxidos, hidróxidos e oxiidróxidos de ferro e alumínio é um dos principais fatores envolvidos na insolubilização desse nutriente em solos tropicais (LOPES; COX, 1979). A goethita é considerada a principal responsável pelo fenômeno de adsorção de fósforo nos solos do Brasil Central (BAHIA FILHO et al., 1983). Essa maior capacidade de adsorção de fósforo pelos solos goethíticos foi, também, constatada por Curi e Franzmeier (1984), sendo creditada à facilidade de acesso do fosfato aos grupos OH- de superfície (FROSSARD et al., 1994). Ocorrem, também, reações de adsorção de
Nem sempre o solo com maior teor de argila possui o maior valor de capacidade máxima de adsorção, cuja explicação está na qualidade da argila. Os óxidos de ferro e alumínio são tidos como os constituintes da fração argila mais efetivos na adsorção de fósforo podendo apresentar maior capacidade em adsorvê-lo em relação às argilas silicatadas. Dentre estas argilas, aquelas do tipo 1:1 são as que efetivamente adsorvem fósforo (GAMA, 2002). Embora seja relativamente grande a quantidade de trabalhos na literatura correlacionando a mineralogia com a adsorção de fósforo, muitas dúvidas ainda persistem quanto à natureza específica deste ou daquele mineral em adsorver fósforo. É conhecida, entretanto, a preponderância dos óxidos de ferro nos fenômenos de adsorção de fósforo pelo solo, ainda que com divergência na literatura a respeito de qual realiza maior adsorção (KER et al., 1996).
2.5 O papel da microbiota na qualidade do solo
A base científica que respalda a busca por indicadores de qualidade do solo é a compreensão de que esses indicadores estão direcionados para a avaliação e/ou, o monitoramento das condições do solo que o tornam um corpo vivo (DUMANSKI; PIERI, 2000). De outra forma, indicadores específicos dessa escala devem ter a capacidade e a sensibilidade para medir e avaliar atributos e processos do solo que interfiram na promoção da sua vida. As práticas de manejo que adicionam ou mantêm carbono orgânico no solo parecem estar entre as mais importantes para restabelecer, manter ou melhorar a qualidade do solo (KARLEN et al., 1997).
A regulação da biota sobre a decomposição de resíduos orgânicos, ciclagem de nutrientes, degradação de poluentes químicos e a sua forte influência sobre a estrutura do solo faz com que esses microrganismos e esses processos sejam naturalmente escolhidos como indicadores da saúde ou qualidade do solo (KENNEDY; SMITH, 1995).
Dando uma visão geral do estudo da biota de solo, Papendik e Parra (1992) explicam que ela pode ser estudada ao nível de organismos (pela presença ou ausência de determinadas espécies, ou pela biomassa dessas espécies) ou em nível de comunidade (biomassa e atividade respiratória do solo, grupos funcionais, etc.).
medidas do fósforo da biomassa microbiana, carbono da biomassa microbiana, carbono do CO2 (C-CO2) liberado, quociente metabólico e quociente microbiano do solo, é possível aferir
melhor o comportamento da comunidade microbiana, uma vez que essa atividade auxilia, de modo direto ou indireto, os processos em que o fósforo está envolvido (MOLTOCARO, 2007).
2.5.1 Bioindicadores de qualidade do solo
A quantificação da biomassa microbiana é indispensável, pois esta apresenta papel fundamental dentro dos ciclos geoquímicos dos elementos de interesse para a produtividade agrícola e para a ecologia (FERNANDEZ et al., 1995). Uma das frações importantes de fósforo orgânico do solo é aquela contida na biomassa microbiana (fósforo microbiano) por sua rápida dinâmica. A biomassa microbiana do solo, que compreende cerca de 3% do total de carbono orgânico do solo, é importante fonte de carbono, nitrogênio, fósforo e enxofre, e suas flutuações em tamanho e atividade podem influenciar na disponibilidade destes elementos às plantas (RHEINHEIMER, 2000).
O carbono do CO2 (C-CO2) liberado do solo consiste na medida da produção de CO2
resultante da atividade metabólica no solo de microrganismos, de raízes vivas e de macrorganismos, como minhocas, nematóides e insetos (PARKIN et al., 1996). Sua interpretação deve ser feita com cautela, pois uma alta atividade respiratória pode resultar tanto de uma grande reserva de substratos de carbono lábeis, onde a decomposição da matéria orgânica é intensa, como da rápida decomposição de uma pequena reserva decorrente, por exemplo, de quebra de agregados do solo promovida pela aração (PAUL et al., 1999). Desse modo, altas taxas de respiração podem indicar tanto um distúrbio ecológico (como a incorporação de resíduos) como um alto nível de produtividade do ecossistema (ISLAM; WEIL, 2000).
O metabolismo microbiano é um dos principais processos reguladores da transformação de nutrientes no solo. No entanto, a atividade dos microrganismos está estritamente relacionada com fatores ambientais, como temperatura, umidade, pH, nutrientes e matéria orgânica (ATLAS; BARTHA, 1993). Em particular, o nitrogênio e o fósforo são os principais nutrientes exigidos no metabolismo devido às demandas estruturais e funcionais das células (SYLVIA et al., 1999).
a energia necessária para a síntese da própria biomassa (BARDGETT; SAGGAR, 1994). A razão carbono microbiano e carbono orgânico de um solo indicam a qualidade da matéria orgânica (WARDLE, 1994) e, de acordo com Sparling (1992), pode-se monitorar a dinâmica da matéria orgânica do solo usando-se esta razão, chamada quociente microbiano. Desta forma, este é um índice bastante utilizado para fornecer indicações sobre a dinâmica da matéria orgânica, expressando a eficiência da biomassa microbiana em utilizar o carbono orgânico do solo (ANDERSON; DOMSCH, 1989).
Outra forma de avaliar a dinâmica do fósforo no solo é pela atividade de enzimas que participam do processo de mineralização do fósforo (NAHAS, 1991). As fosfatases são hidrolases que se encontram amplamente distribuídas na natureza, em diversas formas moleculares e utilizam fosfoésteres como substratos. Podem ser classificadas em ácidas, neutras e alcalinas, dependendo do seu pH de atuação. A catálise enzimática, em geral, é caracterizada pela interação entre o substrato e o sítio ativo. A atividade das enzimas depende de uma série de fatores, como a concentração de substrato e da enzima, a composição do meio de reação, temperatura, pH, íons, inibidores, entre outros. As fosfatases podem ser constitutivas ou repressíveis por fosfato. As fosfatases constitutivas são sintetizadas independentemente da composição do meio em que atuam; sendo a repressíveis são sintetizadas apenas na presença de concentrações limitantes de fosfato (ESPOSITO; AZEVEDO, 2004).
A fosfatase ácida do solo tem sua atividade aumentada à medida que a disponibilidade de fósforo para as plantas e para a população de microrganismos do solo é reduzida, mostrando-se um indicador sensível da biodisponibilidade de fósforo às plantas (FERNANDES et al. 2000).De modo semelhante a atividade fosfatase ácida foliar aumenta à medida que a deficiência desse nutriente se eleva (ASCÊNCIO, 1994).
2.6 Fungos micorrízicos arbusculares
Os fungos que formam as micorrizas arbusculares pertencem ao Filo Glomeromycota, sendo identificados, atualmente, cerca de 160 espécies. Esses fungos formam associação simbiótica mutualística com as raízes da maioria das espécies de plantas superiores (SMITH; READ, 1997) e, por serem simbiotróficos obrigatórios, somente completam seu ciclo de vida em simbiose com a planta hospedeira (SIQUEIRA et al., 1985). Desse hospedeiro, o fungo obtém carboidratos e outros fatores essenciais ao seu desenvolvimento e esporulação, enquanto a planta hospedeira recebe, em troca, água e nutrientes inorgânicos absorvidos do solo, além de benefícios como aumento no volume e longevidade de raízes e na resistência à patógenos ou na redução do estresse hídrico (SMITH; READ, 1997).
Seus benefícios para a planta hospedeira dependem das condições de crescimento e da dependência micotrófica da planta, que são controlados por fatores diversos, tais como características do sistema radicular e exigências nutricionais (SIQUEIRA et al., 1994). Dessa forma, a diversidade, a densidade e o potencial de infectividade dos propágulos dos fungos micorrízicos arbusculares no solo estão relacionados indiretamente com as condições ecológicas de cada ecossistema (MAIA; TRUFEM, 1990) e diretamente com a fisiologia do fungo (MORTON, 1993), estando a colonização micorrízica ligada ao genótipo da planta e do fungo, assim como ao ambiente (CARRENHO; TRUFEM; BONOFI, 2002). Do mesmo modo, a perturbação do solo, a destruição física da rede micelial (JASPER; ABBOT; ROLSON, 1992), a retirada da vegetação, a exposição dos propágulos a extremos de umidade e temperatura (MCGONIGLE; MILLER, 1999) e baixos valores de pH (MEHROTRA, 1998) reduzem a densidade e diversidade desses fungos.
Por serem biotróficos obrigatórios, são dependentes da presença de plantas hospedeiras para completarem seu ciclo de vida, apresentando crescimento limitado quando cultivados exenicamente (SIQUEIRA et al., 1998). A propagação desses fungos ocorre por meio de esporos, do micélio e de fragmentos de raízes colonizadas (propágulos infectivos) que, ao infectarem as raízes da planta hospedeira, podem se desenvolver e originar a associação micorrízica (SMITH; READ, 1997).
Os fungos micorrízicos diferem na maneira e na intensidade com que colonizam as raízes, sendo que alteração das condições do solo pode modificar a composição das espécies presentes (ABBOTT; GAZEY, 1994). Essa interação entre comunidade vegetal e comunidade fúngica é relevante para os agroecossistemas, sobretudo aqueles que envolvem rotação de culturas e culturas intercalares (MIRANDA; VILELA; MIRANDA, 2005). Devido à suplementação na capacidade de absorver nutrientes do sistema radicular da planta, os fungos micorrízicos arbusculares são os simbiontes que podem estimular o crescimento das plantas pelo aumento na absorção de nutrientes, maior tolerância à condição de deficiência hídrica, tolerância da planta a metais pesados, em locais contaminados e resistência aos patógenos do solo (SILVEIRA, 1992).
As micorrizas diferem na eficiência para a absorção de fósforo em função das concentrações no solo, pois a contribuição relativa desses fungos foi estimada em 77 e 49% para solos com baixos e altos níveis de fósforo, respectivamente (THINGSTRUP; KAHILUOTO; JADOBSEN, 2000). Pereira et al. (1996), trabalhando com Glomus
etunicatum Nicol & Schenck em espécies arbóreas, observaram que, mesmo com menores teores de fósforo na parte aérea, as plantas se desenvolveram mais, superando o tratamento de 360 mg fósforo kg-1 e que, nas plantas micorrizadas, ocorreu o aumento na concentração de nitrogênio em 2,6 vezes e o de fósforo, em 1,5 vezes.
2.6.1 Relação entre o fósforo e a micorriza
Para avaliar a efetividade de fungos micorrízicos arbusculares, diversas variáveis que dependem do objetivo da pesquisa, podem ser utilizadas, sendo importante o crescimento da planta, a absorção de fósforo, o comprimento e a colonização da raiz (ALLEN, 1991). A colonização pode variar em condições naturais; com algumas raízes apresentando-se mais colonizadas que outras e essas diferenças podem ocorrer entre espécies e cultivares de uma mesma cultura, sendo influenciadas por condições ambientais. Segundo Bagyaraj (1991), a colonização micorrízica é controlada pela quantidade de fósforo absorvida pela planta, porém o papel do fósforo na regulação da simbiose não está bem esclarecido, em parte, devido a resultados experimentais conflitantes (SCHACHTMAN; REID; AYLING, 1998).
Vários estudos relatam que a alta disponibilidade de fósforo no solo promove restrição à infecção micorrízica e redução da porcentagem de raízes colonizadas (MELLONI et al., 2000; NOGUEIRA; CARDOSO, 2000), consequentemente a queda da contribuição da micorriza na absorção desse nutriente. Nas plantas, os efeitos do fósforo são indiretos, de modo que o aumento na disponibilidade do nutriente no solo promove maior absorção e concentração na parte aérea (PEREIRA et al., 1996).
A disponibilidade de fósforo pode determinar o custo metabólico da simbiose, a natureza da relação simbiótica e a magnitude dos benefícios da micorrização (SIQUEIRA; SAGGIN JÚNIOR, 1995). O nível crítico desse elemento no solo que afeta a micorrização depende do endófito (MELLONI et al., 2000; NOGUEIRA; CARDOSO, 2000). Desse modo, fungo eficiente é aquele que, em dadas condições de fertilidade do solo, consegue sobreviver, colonizar as raízes, produzir volume de micélio externo, aumentar a absorção de nutrientes e influenciar o crescimento da planta hospedeira (MOREIRA; SIQUEIRA, 2006).
A avaliação da eficiência simbiótica baseada no crescimento ou no aspecto nutricional é essencial quando se pretende selecionar fungos destinados a programas de inoculação (SAGGIN JÚNIOR; SIQUEIRA, 1995). Algumas características dos fungos micorrízicos arbusculares podem ser usadas para definir um isolado como eficiente, tais como: ter habilidade em absorver nutrientes do solo, principalmente o fósforo e transferi-lo para o hospedeiro; ser capaz de colonizar as raízes rapidamente após a inoculação, entre outras (ABBOTT; ROBSON; GAZEY, 1992).
Quando se pretende explorar as micorrizas arbusculares, a seleção de fungos eficientes deve ser priorizada. Estes fungos selecionados devem ser capazes de promover o crescimento das plantas, serem compatíveis e persistentes com as condições edafoclimáticas e com as práticas de manejo utilizadas no sistema de produção (SAGGIN-JÚNIOR; SIQUEIRA, 1995).
2.7 O potencial de fungos solubilizadores de fósforo
Um crescente interesse tem surgido em relação à importância da diversidade microbiana edáfica, já que os microrganismos desempenham papel fundamental na manutenção da qualidade do solo (GARBEVA; VAN VEM; VAN ELSAS, 2004).
desenvolvimento vegetal (SAHIN; ÇAKMAKÇI; KANTAR, 2004; SOUCHIE et al., 2006). A população de microrganismos solubilizadores de fosfatos existentes nos solos, segundo Silva Filho e Vidor (2000), está entre 104 e 107 g-1 de solo, variando conforme o local e o método de avaliação.
Dentre os microrganismos do solo, os solubilizadores de fosfatos inorgânicos desempenham importante papel no suprimento de fósforo para as plantas (SILVA FILHO; VIDOR, 2001), apresentando potencial de uso na forma de inoculante (SILVA FILHO; NARLOCH; SCHARF, 2002; SOUCHIE et al., 2006). Autores têm relatam que a solubilização de fosfatos é correlacionada com a habilidade de produção de ácidos orgânicos e/ou polissacarídeos extracelulares pelos microrganismos (OMAR, 1998; KIM; JORDAN; MCDONALD, 1997). Por exemplo, Reyes et al. (1999) encontraram correlação positiva entre a solubilização mineral de fosfato por Penicilium rugulosum Thom e a produção de ácido glucônico ou cítrico.
A presença destes microrganismos tem sido constatada na maioria dos solos (JONES et al., 1991; NAHAS; CENTURION; ASSIS, 1994), sendo uma parcela importante desta comunidade microbiana hábil em mineralizar fosfatos orgânicos e solubilizar fosfatos inorgânicos, liberando fósforo assimilável para as plantas (SILVA FILHO; VIDOR 2000), maximizando o desenvolvimento vegetal (SAHIN; ÇAKMAKÇI; KANTAR, 2004). Entre as populações fúngicas com potencial para solubilização destacam-se os gêneros Aspergillus e
Penicillium (SILVA FILHO; NARLOCH; SCHARF, 2002). Investigando alternativas para a obtenção de fósforo solúvel, Nahas, Banzatto e Assis (1990) demonstraram a possibilidade de produção de 1,2 g L-1 de fosfato solúvel pela ação de
Aspergillus niger Tiegh sobre fluoropatita em meio de vinhaça.
As populações de microrganismos solubilizadores e sua capacidade de solubilização fosfato têm mostrado estar intimamente relacionadas ao tipo e ao manejo do solo (NAHAS; CENTURION; ASSIS, 1994), a espécie e a idade da planta (ODUNFA; OSO, 1978), a espécie de microrganismo, os tipos de fosfato e a fonte de carbono (SILVA FILHO; VIDOR, 2001).
3 MATERIAL E MÉTODOS
3.1 Local de instalação do experimento e descrição dos solos utilizados
O experimento foi conduzido em condições naturais de luz e temperatura, junto ao Departamento de Fitossanidade, Engenharia Rural e Solos da Faculdade de Engenharia, UNESP - Universidade Estadual Paulista, Campus de Ilha Solteira, no período de 08/05/2010 a 08/05/2011. Os solos utilizados foram coletados na camada de 0-0,20 m na Fazenda de Ensino, Pesquisa e Extensão da UNESP/Campus de Ilha Solteira, localizada em Selvíria-MS. Os mesmos foram encontrados na região, pertencem ao bioma Cerrado sensu stricto e foram escolhidos por conterem diferentes teores de óxidos de ferro e alumínio, como segue LATOSSOLO VERMELHO AMARELO Distrófico, A moderado, textura argilosa (20º20’13”S, 51º24’36”O) e LATOSSOLO VERMELHO Distrófico, A moderado, textura argilosa (20º20’90”S, 51º24’57”O). Ambos foram coletados em área sob rotação milho-soja-sorgo, em plantio convencional, que não estavam sob cultivo na ocasião da coleta. A caracterização textural (EMBRAPA, 1997) e mineralógica (MALTONI, 1994) dos mesmos estão apresentadas na Tabela 1.
Tabela1 - Caracterização textural e mineralógica dos dois latossolos, coletados na camada de 0-0,20 m na Fazenda de Ensino, Pesquisa e Extensão (FEPE) da UNESP, localizada município de Selvíria-MS.
Classificação do solo Legenda Areia Silte Argila Caulinita* Gibsita* Goethita* Hematita*
--- g kg-1 --- ---%---
LATOSSOLO VERMELHO AMARELO Distrófico, A moderado, textura argilosa
LVAd 478 92 430 74,2 4,8 17,1 3,4
LATOSSOLO VERMELHO Distrófico, A moderado,
textura argilosa LVd1 263 147 590 66,9 3,0 7,5 17,4
Fonte - Dados do próprio autor
*Fonte - Maltoni (1994)
Departamento de Fitossanidade, Engenharia Rural e Solos da Faculdade de Engenharia - UNESP/Campus de Ilha Solteira para a determinação dos teores de fósforo (resina), matéria orgânica, potássio, cálcio, magnésio, acidez potencial, alumínio e potencial de hidrogênio (CaCl2), além dos valores calculados de capacidade de troca catiônica, soma de bases e
saturação, de acordo com metodologia descrita por Raij et al. (2001). Os solos amostrados também foram submetidos às determinações dos teores de fósforo total, fósforo orgânico e ao cálculo do teor de fósforo inorgânico.
Para fósforo extraído pela resina de troca aniônica, acreditava-se não haver influência da capacidade tampão do solo, medida pelo fósforo remanescente. No entanto, trabalhos de Campello (1993) e Fernández Rojas (1995), onde se têm valores de 1ª extração de fósforo pela resina, segundo método de Raij et al. (2001), e valores da soma do teor de fósforo de extrações sucessivas (fósforo lábil), mostram que a relação entre o conteúdo de fósforo da 1ª extração e das extrações sucessivas, varia com o valor de fósforo remanescente dos solos. Essa relação representa o conteúdo de fósforo extraído pelo método da resina trocadora de ânions, que, conseqüentemente, varia com o fósforo remanescente do solo.
Sendo assim, diante dos teores encontrados para fósforo extraído pela resina foram calculados os teores de fósforo remanescente e a porcentagem da subestimação dos teores de fósforo pelo mesmo método para estimar o conteúdo de fósforo lábil do solo.
Quando em uma análise de solo não se dispuser do valor de fósforo remanescente, como no presente trabalho, esse pode ser estimado em função do teor de argila, a partir da equação de regressão obtida por Freire (2001):
P rem = 52,44 – 0,9646*Arg + 0,005*Arg2 R2 = 0,747
Onde:
P rem: fósforo remanescente em mg dm-3. Arg: teor de argila em %.
A porcentagem da subestimação dos teores de fósforo pelo método da resina e o teor de fósforo lábil foram determinados segundo Santos (2002) pelas fórmulas:
Subestimação (%) = 100 - (100*0,419*P resina)0,1281
Teor de fósforo lábil = P resina*100/ (100 – subestimação %)
Onde:
Subestimação (%): porcentagem da subestimação dos teores de fósforo pelo método da resina.
Os resultados da caracterização química inicial dos solos utilizados estão apresentados na Tabela 2.
Tabela 2 - Caracterização inicial dos dois latossolos coletados para fósforo lábil, matéria orgânica, potencial de hidrogênio, potássio, cálcio, magnésio, acidez potencial, alumínio, soma de bases, capacidade de troca catiônica, saturação por bases, fósforo total (P total), fósforo inorgânico (P inorg.) e fósforo orgânico (P org).
Solos P lábil MO pH K Ca Mg (H+Al) Al SB CTC V P total P inorg. P org.
mg dm-3 g dm-3 CaCl
2 ---mmolc dm-3--- % ---mg dm-3---
LVAd 32 24 5,5 2,9 32 21 31 0 55,9 86,9 64 1038 970 68
LVd1 24 23 5,3 3,1 24 19 38 0 46,1 84,1 55 1056 972 84
Fósforo lábil: teor de fósforo resina/(100 – subestimação %); (LVAd: LATOSSOLO VERMELHO AMARELO e LVd1: LATOSSOLO VERMELHO).
*Fonte - Dados do próprio autor
O fósforo total foi determinado segundo Vettori (1969) por meio de ataque sulfúrico. Foram pesados 2 g de terra fina seca ao ar (TFSA) em erlenmeyer de 500 mL, juntou-se 50 mL de H2SO4 de peso específico 1,47 e procedeu-se a fervura por 1 hora. Após o esfriamento
adicionou-se 50 mL de água destilada e filtrou-se em balão de 250 mL completando o volume do filtrado. Colocou-se 5 mL de extrato sulfúrico e 10 mL de solução de bismuto e molibdato em balões de 50 mL, completou-se o volume para cerca de 35 mL e acrescentou-se 30 mg de ácido ascórbico. Agitou-se até completa dissolução do ácido ascórbico e completou-se o volume. Depois de 30 minutos procedeu-se a leitura da absorbância no comprimento de onda de 660 nm. O teor de fósforo total foi calculado com base numa curva padrão determinada com solução de 0,0958 g de KH2PO4, 3 mL de H2SO4 concentrado e 1L de água destilada.
tomou-se 10 mL e completou-se o volume para 100 mL com ácido sulfúrico 0,05 N, obtendo-se 10 μg P mL-1.
O teor de fósforo inorgânico foi determinado subtraindo-se o fósforo orgânico do fósforo total.
Ainda como caracterização inicial dos solos foi realizada a contagem do número de esporos dos fungos micorrízicos arbusculares autóctones. Esta empregou 100 g de solo peneirado por repetição e seguiu uma associação de métodos de decantação e peneiramento úmido (GERDEMANN; NICOLSON, 1963) e de centrifugação e flutuação com sacarose (JENKINS, 1964). Cada amostra foi misturada em 1 L de água em um béquer e agitada vigorosamente. Após decantação por alguns minutos para sedimentação das partículas maiores e/ou mais densas, o sobrenadante foi passado por duas peneiras com aberturas de 710 e 50 μm na seqüência da maior para a menor abertura da malha, e o procedimento foi repetido 4 vezes. Com o auxílio de uma pisseta o material depositado na peneira de 50 μm foi recolhido, transferido para tubos de ensaio e centrifugado por 3 minutos a 1200 rpm.
O sobrenadante foi cuidadosamente descartado e o precipitado ressuspenso em sacarose 50% para novamente ser centrifugado por mais 1 minuto. Os esporos presentes no sobrenadante foram transferidos para a peneira de malha de 50 μm, lavados com água em abundância, para retirar o excesso de sacarose e recolhidos em um béquer. A contagem dos esporos do fungo micorrízico arbuscular foi realizada usando uma placa de acrílico com anéis concêntricos, sob microscópio esteroscópico. Foram encontrados 42 e 56 esporos por 100 g solo-1 seco para LVAd e LVd1, respectivamente.
3.2 Multiplicação, inoculação dos fungos Glomus clarum e Aspergillus niger e instalação do experimento
Após 75 dias da semeadura de U. decumbens, os esporos do solo-inóculo foram quantificados segundo uma associação de métodos de decantação e peneiramento úmido (GERDEMANN; NICOLSON, 1963) e de centrifugação e flutuação com sacarose (JENKINS, 1964) como anteriormente descrito, tendo sido encontrados 200 esporos por 100 g solo-1 seco. A inoculação do experimento consistiu na aplicação de 100 g de solo-inóculo,
distribuído na superfície dos solos nos vasos plásticos, a 3 cm de profundidade.
Os fungos solubilizadores empregados foram A. niger 19 e o A. niger 26, isoladosque fazem parte da coleção do Profº Drº Ely Nahas, UNESP/Campus de Jaboticabal. Esses fungos foram cultivados em placas de Petri contendo meio de batata-dextrose-ágar e multiplicados em arroz parboilizado cru + água destilada (1:1) autoclavados durante 20 minutos a 1 atm (121 oC). Cada vaso recebeu 10 grãos de arroz, distribuídos a 2 cm da superfície do solo.
A planta indicadora utilizada foi a U. brizantha cv. Xaraés. Foram depositadas 10 sementes por vaso e o desbaste foi realizado 18 dias após a semeadura (d.a.s.), deixando 5 plantas por vaso. Estas foram regadas diariamente e 30 d.a.s. ocorreu o corte de uniformização, à 10 cm da superfície do solo, simulando um futuro rebrote do capim para a continuidade da pastagem. Este foi considerado o primeiro corte, marcando o início do experimento e consistindo, portanto, na época zero. Assim, a partir desse primeiro corte foram contados 360 dias de experimento e nesse período experimental existiram cinco épocas de análise: aos 0, 90, 180, 270 e 360 dias, todavia nem todas as análises foram realizadas em todas as cinco épocas.
3.3 Análises realizadas
Diante dos resultados da caracterização química inicial foi realizada a correção básica recomendada para a cultura da U. brizantha, assegurando que o desenvolvimento das plantas não fosse comprometido por possíveis deficiências nutricionais. Os dois solos receberam o equivalente a 60 kg ha-1 de N, 40 kg ha-1 de P2O5 e 20 kg ha-1 de K2O para tanto foram
os solos receberam correção química de nitrogênio e potássio, mas não receberam a adubação fosfatada nem a inoculação dos microrganismos, foram consideradas controle não fosfatado.
O controle fosfatado foi utilizado para comparação entre os resultados da adubação fosfatada e da inoculação com G. clarum e/ ou A. niger 19 e A. niger 26 e o controle não fosfatado foi empregado para comparar os efeitos desses microrganismos com a ausência da adubação fosfatada.
3.3.1 Análises do solo
Realizaram-se análises químicas e microbiológicas do solo e para tanto o mesmo foi coletado em quatro pontos aleatórios dos vasos à 0,10 m de profundidade e peneirado (malha de 2 mm). A análise química do solo e a determinação da atividade da enzima fosfatase ácida do solo foram realizadas aos 0, 90, 180, 270 e 360 dias.
As determinações de fósforo total, fósforo orgânico e fósforo inorgânico foram efetuados aos 180 e 360 dias. As avaliações de fósforo disponível total e fósforo não lábil ocorreram somente aos 360 dias e as microbiológicas aos 0, 90, 180, 270 e 360 dias.
3.3.1.1 Análise química do solo
As amostras de solo foram homogeneizadas, secas ao ar e enviadas para a caracterização química como descrito anteriormente.
3.3.1.1.1 Atividade enzimática da fosfatase ácida
A determinação da atividade da enzima fosfatase ácida foi realizada com base no procedimento de Tabatabai e Bremner (1969). Foi pesado 0,2 g de solo úmido (fresco) em tubos de ensaio. A capacidade de campo foi ajustada para 60%. Adicionaram-se 4 mL de tampão acetato 0,095 mol L-1 pH 5,4 e colocaram-se os tubos em banho-maria, à 37°C, por 5
minutos, para equilibrar a temperatura. Agitando levemente, adicionou-se 1 mL de solução de p-nitrofenil fosfato 0,08 mol L-1. O período de incubação foi por, no máximo, 30 minutos.
Após a incubação, acrescentou-se 1 mL de solução de cloreto de cálcio (CaCl2) 0,66
comprimento de onda correspondente a 405 nm. Para cada amostra, fez-se um controle acrescentando-se a solução de p-nitrofenil fosfato 30 mM, após a adição da solução de cloreto de cálcio 0,66 mol L-1 e da solução de hidróxido de sódio 0,5 mol L-1. Os resultados foram calculados a partir de uma curva padrão com solução de p-nitrofenol.
3.3.1.1.2 Fósforo total
O fósforo total foi determinado segundo Vettori (1969) por meio de ataque sulfúrico, como descrito anteriormente.
3.3.1.1.3 Fósforo orgânico
A determinação do fósforo orgânico ocorreu pelo método proposto por Saunders e Willians (1955), como já descrito.
3.3.1.1.4 Fósforo inorgânico
O teor de fósforo inorgânico foi determinado subtraindo-se o fósforo orgânico do fósforo total.
3.3.1.1.5 Fósforo disponível total
O objetivo desse cálculo foi estimar o teor de fósforo disponibilizado em função dos
tratamentos solo e inoculação ao final do experimento. Determinou-se o teor de fósforo disponível total por meio da seguinte fórmula:
Pdt= Pat + Pbm + P lábil
Onde:
Pdt: teor de fósforo disponível total em mg dm-3.
Pat: teor de fósforo acumulado total em mg dm-3.
Pbm: teor de fósforo da biomassa microbiana aos 360 dias em mg dm-3.
3.3.1.1.6 Fósforo não lábil
O fósforo não lábil do solo foi determinado subtraindo-se o fósforo disponível total do fósforo inorgânico do solo.
3.3.1.2 Análises microbiológicas
3.3.1.2.1 Carbono do CO2 liberado
A quantificação do carbono do CO2 liberado exigiu 100 g do solo de cada unidade
experimental inicialmente peneirado. Amostras foram colocadas em jarros de vidro com tampa de rosca, onde a umidade do solo foi corrigida até 70% da capacidade de retenção, sendo no centro depositado um frasco contendo 10 mL de NaOH 0,1 mol L-1. Os jarros foram
fechados hermeticamente até o final do período de incubação.
O tempo de incubação foi determinado por meio da curva de calibração, resultante de um monitoramento em dias alternados. A titulação do NaOH livre, à qual foi acrescido 1 mL de solução de BaCl2,foi realizada empregando HCl 0,1 mol L-1. O controle foi feito com
jarros de vidro, sem solo, contendo frascos com NaOH. A titulação da base livre permitiu calcular, por subtração, a quantidade de CO2 que combinou com NaOH (ANDERSON;
DOMSCH, 1989).
3.3.1.2.2 Carbono da biomassa microbiana
O conjunto foi submetido a vácuo, por 5 minutos, até o clorofórmio borbulhar. A extração das amostras fumigadas e não fumigadas foi feita transferindo-se o solo para erlenmeyer de 125 mL e adicionando-se 50 mL de solução extratora de sulfato de potássio 0,5 mol L-1. Foram agitados por uma hora em agitador horizontal e a mistura foi filtrada em papel de filtro, sendo o filtrado armazenado em câmara fria (7°C) até o momento da determinação.
Para a determinação, foram pipetados 8 mL do filtrado em erlenmeyer de 125 mL, 2 mL de solução de dicromato de potássio 0,066 mol L-1, 5 mL de ácido fosfórico concentrado e
10 mL de ácido sulfúrico concentrado. A mistura foi submetida à digestão por uma hora a 100ºC. Com água destilada, o volume foi ajustado para 75 mL. Depois que a solução atingiu a temperatura ambiente, foram adicionados 3 gotas de solução de difenilamina 1% e titulou-se com solução de sulfato ferroso amoniacal 0,033 mol L-1 em solução de ácido sulfúrico 0,4 mol L-1, até a mudança da cor azul para verde garrafa. Em cada avaliação foi feito um branco com 8 mL de sulfato de potássio 0,5 mol L-1 em substituição ao extrato de solo.
3.3.1.2.3 Determinação do quociente metabólico (qCO2)
O quociente metabólico (qCO2), que representa a quantidade de C-CO2 liberada por
unidade de CBM, segundo Anderson (1994), foi estimada pela razão C-CO2 liberado / CBM,
ou seja: μg C-CO2 g solo fresco-1 h-1/μg biomassa - C g solo-1.
3.3.1.2.4 Determinação do quociente microbiano (qMIC)
O quociente microbiano (qMIC) foi calculado pela expressão (CBM/Corg do solo)/10, de acordo com Sparling (1992).
3.3.1.2.5 Fósforo da biomassa microbiana
A obtenção do extrato para a determinação do fósforo da biomassa microbiana seguiu método proposto por Brookes, Powlson e Jenkinson (1984). Foram pesados 2,5 g de solo úmido em béquer, utilizando-se sempre três sub-amostras de cada amostra para que a primeira fosse fumigada, a segunda recebesse adição de fosfato de potássio (KH2PO4) e a terceira
Para a fumigação, as amostras foram colocadas em um dessecador previamente forrado com papel de filtro úmido para manter a umidade, contendo um béquer com aproximadamente 30 mL de água destilada e outro com 50 mL de clorofórmio isento de álcool e as pérolas de vidro dispostas no seu interior. Este conjunto foi submetido ao vácuo por aproximadamente 5 minutos, até o clorofórmio borbulhar. Em seguida, o dessecador contendo as respectivas sub-amostras fumigadas assim como as adicionadas de KH2PO4 e o
controle foram mantidos, por 24 horas, em estufa BOD a 25°C.
A extração das três sub-amostras foi feita transferindo-se o solo para erlenmeyer de 125 mL, onde foram adicionados 50 mL de solução extratora de bicarbonato de sódio (NaHCO3) 0,5 mol L-1 pH 8,5. Agitou-se por trinta minutos em agitador horizontal e filtrou-se
a mistura em papel de filtro, o extrato foi armazenado em câmara fria (7°C) até o momento da determinação.
Para a determinação do fósforo da biomassa microbiana foi utilizado o método proposto por Watanabe e Olsen (1965). Foram pipetados 2 mL do filtrado em tubo de ensaio, onde foram adicionados 0,2 mL de solução de ácido sulfúrico 2,48 mol L-1 e 0,8 mL de
reagente B. Todos os tubos foram agitados e submetidos a incubação em banho-maria, a 45°C, por vinte minutos. Após a incubação, foi feita a leitura das amostras no espectrofotômetro em absorbância de 820 nm. O mesmo procedimento foi utilizado para as três sub-amostras. Em cada avaliação foi feito um branco com 2 mL de bicarbonato de sódio (NaHCO3) 0,5 mol L-1 pH 8,5, em substituição ao extrato de solo.
3.3.1.2.6 Porcentagem de colonização micorrízica