UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM FARMACOLOGIA
ESTUDO GENOTÓXICO E CARCINOGÊNICO DA EXPOSIÇÃO AO PÓ DE
CROMO TRIVALENTE EM RATTUS NORVEGICUS
SAMIRA RÊGO MARTINS DE DEUS LEAL
FORTALEZA
i
SAMIRA RÊGO MARTINS DE DEUS LEAL
ESTUDO GENOTÓXICO E CARCINOGÊNICO DA EXPOSIÇÃO AO PÓ DE
CROMO TRIVALENTE EM RATTUS NORVEGICUS
Tese apresentada à Coordenação do Programa de Pós-Graduação em Farmacologia do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará – UFC, como requisito para obtenção do grau de Doutor em Farmacologia.
Orientadora: Profa. Dra. Maria Elisabete Amaral de Moraes
FORTALEZA
ii Dados Internacionais de Catalogação na Publicação
Universidade Federal do Ceará Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
______________________________________________________________________________________________
Lle LEAL, SAMIRA RÊGO MARTINS DE DEUS.
Estudo genotóxico e carcinogênico da exposição ao pó de cromo trivalente em rattus norvegicus / SAMIRA RÊGO MARTINS DE DEUS LEAL. -2017.
105 f. : il. coloro
Tese(doutorado)-Universidade Federal do Ceará, Faculdade de Medicina, Programa de Pós- Graduação em Farmacologia, Fortaleza, 2017.
Orientação: Prof. Dr. MARIA ELISABETE AMARAL DE MORAES.
I. Cr (III), . 2. Ensaio Cometa, , . 3. Testes de Mutagenicidade. 4. Carcinogênese. I. Título.
iii
SAMIRA RÊGO MARTINS DE DEUS LEAL
ESTUDO GENOTÓXICO E CARCINOGÊNICO DA EXPOSIÇÃO AO PÓ DE
CROMO TRIVALENTE EM RATTUS NORVEGICUS
Tese apresentada à Coordenação do Programa de Pós-Graduação em Farmacologia do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará – UFC, como requisito para obtenção do grau de Doutor em Farmacologia.
Orientadora: Profa. Dra. Maria Elisabete Amaral de Moraes Data de apresentação: 22/08/2017
BANCA EXAMINADORA
____________________________________________________ Profa. Dra. Maria Elisabete Amaral de Moraes
Universidade Federal do Ceará – UFC
_____________________________________________________ Prof. Dr. Francisco Vagnaldo Fechine Jamacaru
Universidade Federal do Ceará – UFC
_____________________________________________________ Prof. Dr. Gislei Frota Aragão
Universidade Estadual do Ceará – UECE
_____________________________________________________ Profa. Dra. Helena Serra Azul Monteiro
Universidade Federal do Ceará- UFC
_____________________________________________________ Profa. Dra. Jéssica Pereira Costa
iv
Dedicatória
Dedico este trabalho às pessoas mais presentes em minha vida:
Minha mãe, pelo exemplo de vida que é.
Meu pai, o mais generoso de todos os pais.
Meus irmãos, Agamenon e Priscila, pelo incentivo direto ou indireto.
Meu grande amor, Justijânio Cácio, por estar ao meu lado nos melhores e piores momentos de minha vida.
Cácio Filho, meu maior PRESENTE!
v
AGRADECIMENTOS
A Deus, por me guiar, iluminar e me dar tranquilidade para seguir em frente com os meus objetivos e não desanimar com as dificuldades.
À Prof.ª Dra. Maria Elisabete Amaral de Moraes, que acreditou na
viabilidade do meu projeto de pesquisa. Agradeço a oportunidade de tê-la como minha orientadora de doutorado. Tenho muito orgulho de citá-la como uma das responsáveis pela minha formação profissional. Obrigada pelos conhecimentos repassados!
Em especial, ao meu coorientador, Prof. Dr. Fabrício Pires de Moura do Amaral, por sua dedicação, empenho, competência e paciência para que este estudo
fosse concretizado. A você, o meu muito obrigada, pela dedicação, pelos ensinamentos valiosos, pelas palavras de apoio e incentivo a mim dedicados. Muito obrigada mesmo. Sem você, este projeto não teria existido.
Agradeço ao Laboratório de Biologia Molecular e de Estudo de Injúrias Biológicas (LABMINBIO) da Faculdade de Ciências Médicas (FACIME/UESPI), na pessoa do Prof. Dr. Fabrício Pires de Moura do Amaral, por gentilmente me ceder o
espaço, acolher o meu projeto de pesquisa e oferecer as condições acadêmicas para o seu desenvolvimento. Obrigada de coração!
Estendo meus agradecimentos ao Prof. Dr. Antônio Luís Martins Maia Filho e ao técnico de laboratório Daniel Cabral Leão Ferreira, pela prontidão e pelo indispensável auxílio na realização desta pesquisa.
Não posso deixar de agradecer também à Dra. Tatiana de Souza Vieira
Chaves, pela oportunidade concedida. Tenho muito respeito e admiração pela sua ética,
seu conhecimento, pela maneira simples e humilde com que a senhora se relaciona com as pessoas. À senhora, minha eterna gratidão!
vi Ao meu pequeno Cácio Filho, meu “presentinho” de Deus, razão da minha existência, criança que transborda amor, luz e alegria. Você me inspira a querer ser mais do que fui até hoje.
Aos meus pais, Edivar e Vandira, meu eterno agradecimento pelo amor, incentivo e apoio incondicionais. Obrigada por todo o carinho, pela preocupação constante e, principalmente, por terem me ensinado a ser uma pessoa melhor a cada dia.
É um grande orgulho tê-los como meus pais!
Aos meus irmãos Agamenon e Priscila, que sempre torceram pela minha vitória e por me fazerem acreditar que esse sonho poderia ser concretizado.
À minha amiga do doutorado, Carlene, companheira de todas as horas, com quem dividi minhas angústias e medos. Você será eternamente guardada em minha memória e em meu coração.
Aos membros da banca examinadora, por aceitarem gentilmente a participação e pelas valiosas contribuições científicas.
Aos professores, pela experiência compartilhada, pelos ensinamentos transmitidos, pelo constante incentivo, e pelo exemplo de profissionais a serem seguidos.
Às funcionárias da UNIFAC e do Programa de Pós-Graduação em Farmacologia, especialmente, a Fábia, Maria Teresa e a Célia, pela solicitude,
prontidão e suporte administrativo durante esses anos na pós-graduação.
Ao Conselho Nacional de Pesquisa (CNPq) e ao CAPES pelo incentivo no desenvolvimento da pesquisa.
vii
RESUMO
ESTUDO GENOTÓXICO E CARCINOGÊNICO DA EXPOSIÇÃO DE Rattus
norvegicus AO PÓ DE CROMO TRIVALENTE
Orientadora: Profa. Dra. Maria Elisabete Amaral de Moraes. Tese de Doutorado. Pós-Graduação em Farmacologia. Departamento de Fisiologia e Farmacologia, UFC, 2017.
INTRODUÇÃO: Os metais, a exemplo do cromo, são elementos que ocorrem naturalmente e em face de suas múltiplas aplicações industriais, domésticas, agrícolas, médicas e tecnológicas levaram à sua ampla utilização, suscitando preocupações quanto aos seus potenciais efeitos na saúde humana e no meio ambiente. OBJETIVO: Avaliar os possíveis efeitos genotóxicos e carcinogênicos da exposição de Rattus norvegicus machos ao pó de cromo trivalente atmosférico. METODOLOGIA: Rattus norvegicus machos foram distribuidos em grupos de exposição aguda (250 e 500 µg/m3 por 8h, n=5/grupo) e subcrônica (500 µg/m3, 1h30min/dia durante 45 dias, n=8/grupo) ao pó de cromo trivalente atmosférico. Compuseram o grupo controle negativo, animais tratados com água destilada (exposição aguda) e expostos ao ar filtrado (exposição subcrônica); e como positivo, animais tratados com ciclofosfamida 50 mg/kg, i.p (exposição aguda). Ao final do tratamento agudo foram realizados o ensaio cometa em sangue periférico e testes de micronúcleos e aberrações cromossômicas em medula óssea. Ao final do período de exposição subcrônica foram realizadas análises histopatológicas dos tecidos pulmonar e hepático. RESULTADOS: A exposição aguda ao pó de cromo trivalente (250 e 500 µg/m3) induziu (p<0,05) danos genotóxicos ao DNA de linfócitos de ratos por meio da análise do % de DNA na cauda, comprimento da cauda e TailMoment. Foram também evidenciados efeitos mutagênicos, pela elevação da frequência de micronúcleos em eritrócitos policromáticos, apenas para o grupo exposto à 500 µg/m3, comparado ao controle negativo. Além disso, o tratamento agudo (500 µg/m3) induziu aumento proeminente do número de aberrações cromossômicas, especialmente do tipo cromossomos dicêntricos, anéis cromossômicos e fragmentos de cromossomos, comparado ao grupo não exposto. As análises histopatológicas do grupo exposto de forma subcrônica revelaram no tecido pulmonar metaplasia e descamação epitelial em brônquios e alvéolos, acompanhados de foco de atividade inflamatória em alvéolos e formação de granulomas. No tecido hepático foram evidenciadas lesões discretas ou moderadas em hepatócitos, que exibiram infiltração de leucócitos, degeneração hidrópica e/ou necrose e hepatócitos apoptóticos. CONCLUSÃO: Os dados do presente estudo demonstraram que a exposição ao pó de cromo trivalente atmosférico induz eventos genotóxicos ao DNA celular, que por sua vez suscitam instabilidade genômica, as quais são determinantes para os processos de carcinogênese.
viii
ABSTRACT
GENOTOXIC AND CARCINOGENIC STUDY OF THE EXPOSURE OF Rattus norvegicus TO THE TRIVALENT CHROMIUM POWDER
Advisor: Profa. Dra. Maria Elisabete Amaral de Moraes. Doctoral thesis. Postgraduate Program in Pharmacology. Department of Physiology and Pharmacology, UFC, 2017.
INTRODUCTION: Chromium-like metals are naturally occurring elements and in
view of their multiple industrial, domestic, agricultural, medical and technological applications have led to their widespread distribution, raising concerns about their potential effects on human health and environment. OBJECTIVE: To evaluate the possible genotoxic and carcinogenic effects of exposure of male Rattus norvegicus to atmospheric trivalent chromium powder. METHODS: Male Rattus norvegicus were divided into acute exposure groups (250 and 500 μg/m3 for 8h, n=5/group) and subchronic (500 μg/m3, 1h30min/day for 45 days, n=8/group) to atmospheric trivalent chromium powder. As negative control group, animals were treated with dH2O 10 mL/kg (acute exposure) and exposed to filtered air (subchronic exposure); and as a positive, animals treated with cyclophosphamide 50 mg/kg, i.p. (acute exposure). At the end of the acute treatment, the comet assay was performed in peripheral blood and tests of micronuclei and chromosomal aberrations in bone marrow. At the end of the subchronic exposure period, histopathological analyzes of the pulmonary and hepatic tissues were performed. RESULTS: Acute exposure to trivalent chromium powder (250 and 500 μg/m3) induced (p<0.05) genotoxic damage to rat lymphocyte DNA by analysis of % of DNA in the tail, tail length and TailMoment. Mutagenic effects were also evidenced by the elevation of the micronucleus frequency in polychromatic erythrocytes, only for the group exposed to 500 μg/m3, compared to the negative control. In addition, acute treatment (500 μg/m3) induced a prominent increase in the number of chromosomal aberrations, especially dicentric chromosomes, chromosomal rings and chromosome fragments, compared to the non-exposed group. Histopathological analyzes of the subchronic exposed group revealed in the lung tissue metaplasia and epithelial desquamation in the bronchi and alveoli, accompanied by a focus of inflammatory activity in the alveoli and formation of granulomas. In hepatic tissue, mild or moderate hepatocyte lesions were observed, showing leukocyte infiltration, hydropic degeneration and/or necrosis and apoptotic hepatocytes.
CONCLUSION: The data from the present study prove that exposure to atmospheric
trivalent chromium powder may induce genotoxic events to cellular DNA, which in turn provoke genomic instability, which are determinant for the carcinogenesis processes.
ix
LISTA DE ILUSTRAÇÕES
Figura 1. Esquema geral da carcinogênese de compostos metálicos induzida por espécies reativas de oxigênio.
18
Figura 2. Captação celular e redução de compostos de cromo. 34
Figura 3. Mecanismos carcinogênicos de compostos de cromo. 35
Figura 4. Fotomicrografia do Ensaio cometa com diferentes tipos de dano ao DNA.
39
Figura 5. Fotomicrografia do teste de micronúcleos em eritrócitos de medula óssea de camundongos.
43
Figura 6. Linfócitos de Rattus norvegicus avaliados pelo teste de aberrações cromossômicas.
46
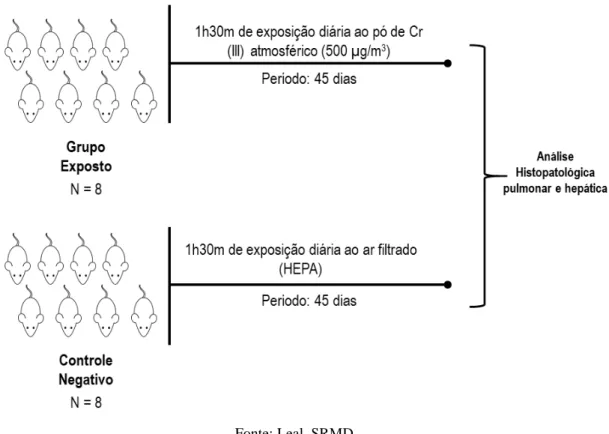
Figura 7. Ilustração do método para avaliar a genotoxicidade aguda do Cr (III) em Rattus norvegicus.
49
Figura 8. Desenho experimental do tratamento subcrônico. 50
Figura 9. Caixa de inalação, simulando o ambiente atmosférico contendo Cr (III).
50
Figura 10. Esquema representativo do procedimento experimental para realização do ensaio cometa alcalino.
52
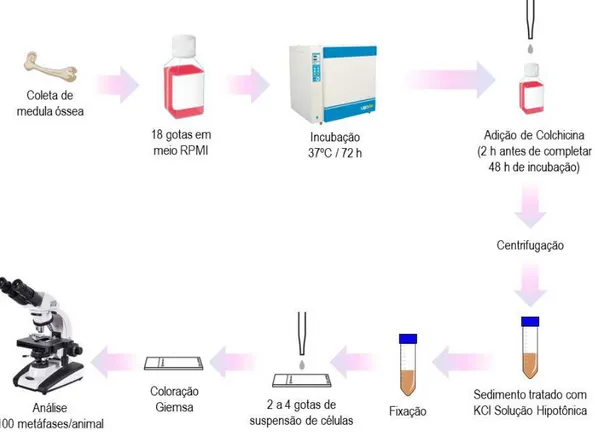
Figura 11. Esquema representativo do procedimento experimental para realização do teste de micronúcleos.
54
Figura 12. Esquema representativo do procedimento experimental para realização do teste de aberrações cromossômicas.
55
Figura 13. Genotoxicidade do pó de Cr (III) 250 µg/m3 atmosférico em linfócitos de Rattus norvegicus.
58
Figura 14. Genotoxicidade do pó de Cr (III) 500 µg/m3 atmosférico em linfócitos de Rattus norvegicus.
59
Figura 15. Perfil fotomicrográfico de cometas analisados após lise, eletroforese e coloração com GelRed.
60
Figura 16. Perfil histoarquitetural pulmonar dos animais controle e expostos ao pó de Cr (III).
70
Figura 17. Perfil histoarquitetural hepático dos animais controle e expostos ao pó de Cr (III).
x
LISTA DE TABELAS
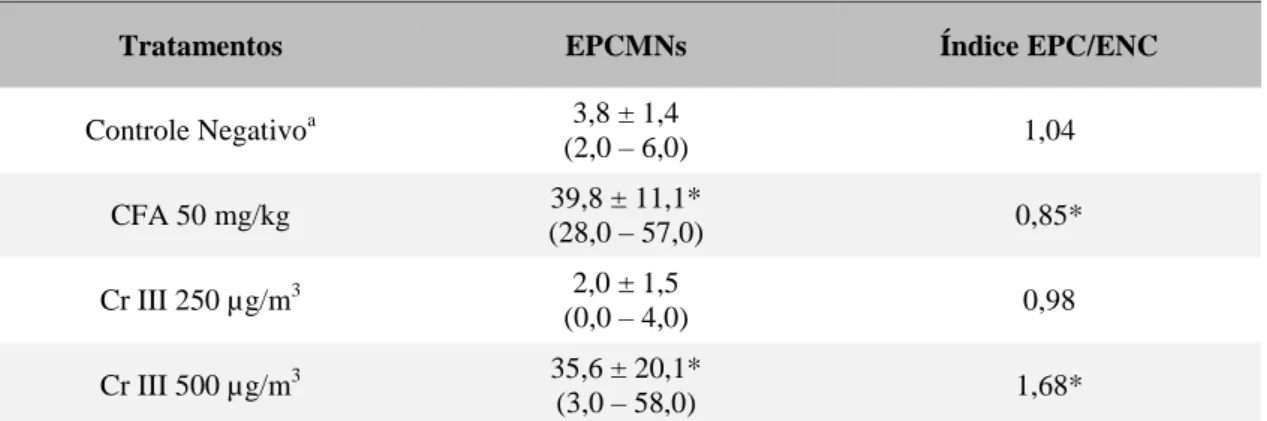
Tabela 1. Alterações do número de EPCMN e índice de EPC/ENC induzido por Cr (III) em medula óssea de Rattus norvegicus 24 h após exposição.
63
Tabela 2. Aberrações cromossômicas em células de medula óssea de ratos após 24 da exposição ao pó de Cr (III) atmosférico.
65
Tabela. 3. Alterações histopatológicas em pulmão de ratos expostos de forma subcrônica ao pó de Cr (III) 500 µg/m3 atmosférico.
69
Tabela 4. Alterações histopatológicas em fígado de ratos expostos de forma subcrônica ao pó de Cr (III) 500 µg/m3 atmosférico.
xi LISTA DE ABREVIATURAS
▪OH Radical hidroxila
AC Aberrações cromossômicas
ATSDR Agency for Toxic Substances & Disease Registry
Cd Cádmio
Cd2+ Íon Cádmio
CHL Chinese hamster lung CHO Chinese hamster ovary
Co Cobalto
Co2+ Íon cobalto
CONCEA Conselho Nacional de Controle de Experimentação Animal CFA Ciclofosfamida
Cr Cromo
Cr (III) Cromo trivalente
Cr (OH)3 Hidróxido de cromo (III) Cr2O3 Óxido de cromo
Cr (VI) Cromo hexavalente Cr2 (SO4)3 Sulfato de cromo (III) Cr-DNA Adutos de Cromo-DNA
Cu Cobre
DBS Quebras de cadeia dupla
DTPA Ácido dietileno triamina pentaacético ENC Eritrócitos normocromáticos
EPAIUS Environmental Protection Agency of United States EPC Eritrócitos policromáticos
EPCMN Eritrócito policromático com micronúcleo EROs Espécies reativas de oxigênio
FD Frequência de danos
FDA Food and Drug Administration
Fe Ferro
FHIT Fragile histidine triad protein FISH Fluorescent In Situ Hybridization G:C Guanina:Citocina
H2O2 Peróxido de hidrogênio H-E Hematoxilina-eosina
HEPA High Efficiency Particulate Arrestance HPA Hidrocarbonetos aromáticos policíclicos
IARC Agência Internacional de Pesquisa sobre o Câncer ICH International Conference on Harmonisation ID Índice de danos
IM Índice metafásico KCl Cloreto de potássio
Mg Magnésio
Mn Manganês
Mo Molibdênio
NaOH Hidróxido de Sódio
Ni Níquel
xii Ni3S2 Subsulfeto de Níquel
NiO Óxido de Níquel NiSO4 Sulfato de Níquel
NTP National Toxicology Program O2- Ânio superóxido
OECD Organisation for Economic Co-operation and Development
Pb Chumbo
REN Reparação por excisão de nucleotídeos RPMI Roswell Park Memorial Institute
Se Selênio
SH Grupo sulfidrila
xiii SUMÁRIO
RESUMO ... vii
ABSTRACT ...viii
LISTA DE ILUSTRAÇÕES ... ix
LISTA DE TABELAS ... x
LISTA DE ABREVIATURAS ... xi
1 INTRODUÇÃO ... 15
1.1 Os metais e os riscos à saúde humana ... 15
1.2 Aspectos físico-químicos e tóxicos dos metais ... 17
1.3 Mecanismos gerais de genotoxicidade e carcinogenicidade de metais ... 18
1.3.1 Indução de estresse oxidativo ... 19
1.3.2 Interferência com os mecanismos de reparo de DNA ... 20
1.3.3 Desregulação da proliferação celular ... 21
1.4 Influência da poluição ambiental com o risco de câncer ... 22
1.4.1 Associação entre exposição a metais e carcinogênese ... 24
1.5 Cromo ... 25
1.5.1 Exposição humana ao cromo ... 29
1.5.2 Cromo e instabilidade genômica ... 31
1.5.3 Cromo trivalente e eventos toxicogenéticos ... 32
1.5.4 Rotas de interação do cromo trivalente com o material genético ... 34
1.6 Biomarcadores de genotoxicidade e mutagenicidade ... 37
1.6.1 Ensaio Cometa ... 39
1.6.2 Teste de Micronúcleos ... 42
1.6.3 Teste de Aberrações Cromossômicas ... 44
2 OBJETIVOS ... 48
2.1 Geral ... 48
2.2 Específicos ... 48
3 MATERIAIS E MÉTODOS ... 49
3.1 Animais experimentais ... 49
3.2 Reagentes químicos ... 49
3.3 Desenho do estudo ... 49
3.4 Ambiente de exposição atmosférica ... 51
3.5 Grupos experimentais ... 52
3.5.1 – Exposição aguda – avaliação genotóxica... 52
3.5.1.1 Ensaio cometa alcalino ... 52
3.5.1.2 Teste de Micronúcleos em medula óssea ... 54
3.5.1.3 Teste de Aberrações Cromossômicas ... 55
3.5.2 – Exposição subcrônica – avaliação histopatológica ... 56
xiv
3.6 Análise estatística ... 57
4 RESULTADOS E DISCUSSÃO... 58
4.1 Genotoxicidade e mutagenicidade da exposição atmosférica ao pó de cromo (III) em Rattus norvegicus ... 58
4.2 Aberrações cromossômicas em ratos expostos de forma aguda ao pó de Cr (III) atmosférico ... 66
4.3 Alterações histopatológicas pulmonares e hepáticas em ratos em exposição subcrônica ao pó de Cr (III) 500 µg/m3 atmosférico ... 69
5 CONCLUSÃO ... 76
REFERÊNCIAS ... 77
ANEXO A – Carta de aprovação da Comissão de Ética de Uso de Animais CEUA/FACID ... 103
ANEXO B – Publicação de artigo relacionado à Tese ... 104
15 1 INTRODUÇÃO
1.1 Os metais e os riscos à saúde humana
Nos últimos anos, a exposição humana aos metais aumentou dramaticamente
como resultado de um incremento exponencial em seu uso em diversas áreas:
industriais, agrícolas, domésticas e tecnológicas (DUFFUS, 2002; FOSTER et al.,
2017). As fontes ambientais destes agentes incluem geogênicas, industriais, agrícolas,
farmacêuticas, efluentes domésticos e fontes atmosféricas (HE; YANG; STOFFELLA,
2005; BOFFETTA, 2006).
Embora os metais sejam elementos que ocorrem naturalmente em toda a crosta
terrestre, a maior parte da contaminação ambiental e exposição humana resultam de
atividades antropogênicas, como operações de mineração e fundição, produção
industrial e uso doméstico e agrícola de metais e compostos contendo metais (SINGH;
RAJU; NAZNEEN, 2015). A contaminação ambiental também pode ocorrer por meio
da corrosão do metal, deposição atmosférica, erosão do solo por íons metálicos e
lixiviação de metais pesados, ressuspensão de sedimentos e evaporação do metal dos
recursos hídricos para o solo e águas subterrâneas (HOLT, 2000; LEWTAS, 2007).
Fenômenos naturais, como intemperismo e erupções vulcânicas também
contribuem significativamente para a poluição por meio de metais no ambiente. Fontes
industriais incluem processamento de metais em refinarias, queima de carvão em usinas
de energia, combustão de petróleo, centrais de energia nuclear e linhas de alta tensão,
plásticos, têxteis, microeletrônica e usinas de processamento de papel (NRIAGU, 1988;
ARRUTI; FERNÁNDEZ-OLMO; IRABIEN, 2010).
Evidências anteriores apontaram que metais como cobalto (Co), cobre (Cu),
cromo (Cr), ferro (Fe), magnésio (Mg), manganês (Mn), molibdênio (Mo), níquel (Ni),
selênio (Se) e zinco (Zn) são nutrientes essenciais e necessários para várias funções
bioquímicas e fisiológicas no ser humano (WHO, 1996). A quantidade insuficiente
destes micronutrientes resulta em uma variedade de doenças ou síndromes relacionadas
à deficiência (WHO, 1996).
Alguns metais são também considerados oligoelementos devido à sua presença
(KABATA-16 PENDIA, 2001). A sua biodisponibilidade é influenciada por fatores físicos tais como
temperatura, associação de fase, adsorção e sequestro. Também é afetado por fatores
químicos que influenciam a especiação no equilíbrio termodinâmico, cinética de
complexação, solubilidade lipídica e coeficientes de partição octanol/água
(HAMELINK et al., 1994). Fatores biológicos, como características de espécies,
interações tróficas e adaptação bioquímica/fisiológica, também desempenham
importante papel (SHARMA; AGRAWAL, 2005).
Em sistemas biológicos, os metais pesados podem afetar componentes e
organelas celulares, como a membrana celular, mitocondrial, lisossomo, retículo
endoplasmático, núcleo e algumas enzimas envolvidas no metabolismo, detoxificação e
reparação de danos (WANG; SHI, 2001; OLANIRAN; BALGOBIND; PILLAY, 2013).
Além disso, íons metálicos interagem com componentes celulares tais como DNA e
proteínas nucleares, causando danos no DNA e alterações conformacionais que podem
levar à modulação do ciclo celular, à carcinogênese ou a morte celular por apoptose
(KOEDRITH et al., 2013; SHARMA; SINGH; SIDDIQI, 2014).
A produção de espécies reativas de oxigênio (EROs) e o estresse oxidativo
desempenham papel chave na toxicidade e carcinogenicidade de metais como o arsênio
(TCHOUNWOU; CENTENO; PATLOLLA, 2004), cádmio (TCHOUNWOU;
ISHAQUE; SCHNEIDER, 2001), cromo (PATLOLLA et al., 2009), chumbo
(YEDJOU; TCHOUNWOU, 2007) e mercúrio (PLETZ; SÁNCHEZ-BAYO;
TENNEKES, 2016). Devido ao seu alto grau de toxicidade, estes cinco elementos estão
entre os metais prioritários e de grande importância para a saúde pública, considerando
sua toxicidade sistêmica e elevada capacidade de induzir danos em vários órgãos,
mesmo em níveis mais baixos de exposição (MARTINEZ-ZAMUDIO; HA, 2011).
De acordo com a Agência Internacional de Pesquisa sobre o Câncer (IARC),
esses metais também são classificados como "conhecidos" ou "prováveis" carcinógenos
humanos, com base em estudos epidemiológicos e experimentais que demonstraram
associação entre a exposição e a incidência de câncer em humanos e animais. A
toxicidade e a carcinogenicidade induzidas por metais envolvem muitos aspectos
mecânicos, alguns dos quais não foram claramente elucidados ou compreendidos
(ROUSSEAU, 2005). No entanto, cada metal possui características únicas e
17 específicos (CHERVONA; ARITA; COSTA, 2012). Estas informações serão discutidas
a seguir.
1.2 Aspectos físico-químicos e tóxicos dos metais
Os metais podem ser carcinogênicos sob a forma de íons livres, complexos ou
partículas de metais e compostos pouco solúveis. A toxicidade dos metais e seus
compostos se dá por suas propriedades físico-químicas (BEYERSMANN, 1995). Em
relação aos íons metálicos, o estado de oxidação, a carga e os raios iônicos são cruciais.
Características como complexos metálicos, o número de coordenação, a geometria e o
tipo de ligante (por exemplo, a sua lipofilicidade) são importantes para as interações
tóxicas (NIEBOER et al., 1999; HARTWIG 2001).
Considerando os metais e seus compostos pouco solúveis, o tamanho da
partícula e a estrutura cristalina são importantes. Não só os cátions metálicos tóxicos
mas também os íons de metais de transição essenciais interagem com ligantes
biológicos de carga oposta como cadeias laterais de aminoácidos em proteínas e grupos
fosfato de nucleótidos e ácidos nucleicos e formam complexos com grupos de oxigênio,
enxofre e nitrogênio em proteínas, ácidos nucleicos e outras biomoléculas relevantes
(COHEN et al., 2010).
Se íons metálicos tóxicos apresentarem propriedades físico-químicas miméticas,
tais como carga e tamanho ideal, eles podem competir pela ligação biológica a regiões
específicas, ocasionando perturbações estruturais em macromoléculas bioquímicas,
resultando em uma função aberrante. Um exemplo proeminente é o efeito dos íons
metálicos carcinogênicos Cd2+, Co2+ e Ni2+ na estrutura e função dos domínios zinco
digitais de vários fatores de transcrição e enzimas (KOPERA et al., 2004).
A toxicidade dos metais e seus compostos, em sua maioria, depende da sua
biodisponibilidade, isto é, dos mecanismos de absorção através das membranas
celulares, distribuição intracelular e ligação a macromoléculas celulares
(JAISHANKAR et al., 2014). Os compostos aniônicos de cromo e vanádio penetram
suavemente nas células por meio de canal aniônico na membrana plasmática. Assim, o
cromo aniônico (VI) é facilmente absorvido dentro das células e, no entanto, logo é
reduzido a cromo (III) por redutores intracelulares. Por fim, o metal fica preso e
18 Vários metais tóxicos que ocorrem como cátions divalentes podem atravessar a
membrana plasmática por transportadores de cátions. Em contraste, acredita-se que
membranas plasmáticas celulares são impermeáveis ao cromo trivalente [Cr (III)]. Em
variância, os compostos de metal moderadamente solúveis podem ser absorvidos por
fagocitose, o que pode conduzir a uma acumulação intracelular considerável destes
metais após a dissolução gradual nos lisossomas (SNOW, 1991).
1.3 Mecanismos gerais de genotoxicidade e carcinogenicidade de metais
Os riscos genotóxicos e carcinogênicos de compostos metálicos para os seres
humanos são alvos constantes de estudos da IARC. Os metais como o cromo (VI),
níquel (II), berílio, cádmio e compostos de arsênico têm sido confirmados como
carcinógenos em humanos (EBINA et al., 1986; ROUSSEAU, 2005). Há ainda
evidências de que danos ao DNA poderiam ser induzidos por compostos metálicos
cancerígenos por meio da geração de estresse oxidativo ocasionado por espécies
reativas de nitrogênio e oxigênio (Figura 1).
Figura 1. Esquema geral da carcinogênese de compostos metálicos induzida por espécies reativas de
oxigênio.
Fonte: Adaptado de Kawanishi et al. (2000).
Os íons metálicos reagem com ânios superóxido (O2-) e peróxido de hidrogênio
19 complexos metal-oxigênio em sistemas biológicos, resultando em danos oxidativos ao
DNA. Além disso, os sistemas de reparo do DNA são alvos muito sensíveis para os
metais cancerígenos (MORALES et al., 2016). Demonstrou-se que vários metais, como
arsênico e cádmio, se ligam ao grupo sulfidrila (SH), resultando na inibição do processo
de reparo do DNA e no aumento da formação de 8-Oxo-2'-deoxiguanosina (HIRANO;
YAMAGUCHI; KASAI, 1997).
Determinados compostos metálicos cancerígenos podem causar danos ao DNA
mediados por espécies reativas de oxigênio (EROs) através de mecanismos indiretos.
Embora o próprio chumbo não tenha causado danos oxidativos ao DNA mesmo na
presença de H2O2, o ácido δ-aminolevulínico, que se acumula no envenenamento por
chumbo induziu danos oxidativos ao DNA e pode indiretamente participar na
carcinogênese do chumbo. Os compostos de níquel (Ni3S2, NiO e NiSO4) induziram
danos indiretos por meio de inflamação e Ni3S2 causou danos oxidativos diretos ao
DNA pela formação de H2O2 (HIRAKU; KAWANISHI, 1997; LEE; O'CONNOR;
PFEIFER, 2002; HIRAKU et al., 2014). Estudos apontam que alguns metais
carcinogênicos, como o Cr, Cd, Pb, Co e Fe, também induzem a produção de EROs
relacionada com a inflamação e a subsequente lesão oxidativa do DNA em sistemas in
vivo. Portanto, alguns metais carcinogênicos podem induzir danos indiretos ao DNA in
vivo, além de danos oxidativos diretos ao DNA (FRENKEL, 1992; KASPRZAK, 1995).
As interações de diversos carcinógenos metálicos com a matéria viva são
bastante complexas e, à primeira vista, parece presunçoso assumir que haja mecanismos
de ação comuns. No entanto, conforme supracitado, aparentemente há três grandes
mecanismos que se aplicam à maioria dos compostos metálicos cancerígenos, além de
algumas reações distintas, nomeadamente estresse oxidativo (considerado proeminente
em relação à carcinogênese), modulação do reparo de DNA e distúrbios de vias de
transdução de sinal envolvidas no controle do ciclo celular (HARTWIG et al., 2002;
CHERVONA; ARITA; COSTA, 2012).
1.3.1 Indução de estresse oxidativo
A indução do estresse oxidativo é uma hipótese majoritária para explicar os
efeitos mutagênicos e carcinogênicos dos metais. Íons metálicos cancerígenos, tais
20 reações redox em sistemas biológicos (VALKO; MORRIS; CRONIN, 2005). Foi
demonstrado que alguns metais induzem a formação de espécies reativas de oxigênio e
nitrogênio in vivo e in vitro em células de mamíferos. Frequentemente, a formação de
radicais hidroxila muito provavelmente pode ser devido a reações do tipo Fenton e
Haber-Weiss. Estes radicais podem causar danos oxidativos ao DNA, lipídeos e
proteínas (XIE; MASON; WISE, 2011).
Além de gerar danos diretamente ao DNA, as espécies reativas de oxigênio, em
baixas concentrações funcionam como sinais mitogênicos e ativam fatores de
transcrição redox-sensível (GENESTRA, 2007). Assim, o estresse oxidativo pode não
apenas iniciar o desenvolvimento de tumores por mutagênese, mas também desregular o
crescimento celular e promover o crescimento tumoral dependente da extensão e do
tempo de interferência (JOMOVA; VALKO, 2011).
Por outro lado, uma grande objeção contra a hipótese do estresse oxidativo
induzido por metais carcinogênicos é a discrepância comparativa entre as doses altas,
frequentemente citotóxicas, de compostos metálicos que são necessários para induzir a
formação de espécies reativas de oxigênio e/ou aumento mensurável dos danos em
macromoléculas celulares e doses muito baixas de metais que induzem tumores. Por
conseguinte, o estresse oxidativo induzido por metal, aparentemente, não é a única
causa da carcinogênese metálica, mas ainda contribui para o desenvolvimento de
malignidade (BAL; PROTAS; KASPRZAK, 2011).
1.3.2 Interferência com os mecanismos de reparo de DNA
Com exceção do Cr (VI), os metais cancerígenos são mutagênicos fracos em
células de mamíferos e frequentemente inativos em ensaio com bactérias.
Considerando que a mutagenicidade em ensaios bacterianos seja um indicador de
reatividade de uma dada substância com o DNA, acredita-se que os metais exerçam
genotoxicidade por mecanismos indiretos (CODINA et al., 1995; BOLOGNESI et al.,
1999; MORALES et al., 2016).
Os compostos metálicos carcinogênicos são frequentemente comutagênicos, isto
é, aumentam a mutagenicidade de outros agentes genotóxicos. Na verdade, muitos
21 reparação de danos no DNA, ocasionados por outros xenobióticos ou por fatores
endógenos (HARTWIG; SCHWERDTLE, 2002).
As quatro principais vias de reparação do DNA, que se sobrepõem e operam em
células de mamíferos são a excisão de base, mismatch, excisão de nucleotídeos e a
reparação por recombinação. Deficiências herdadas ou adquiridas em tais vias podem
contribuir para a carcinogênese. Mecanismos de reparo de DNA são frequentes alvo de
interferência por metais tóxicos. A inibição da reparação e danos persistentes no DNA
resultam em instabilidade genômica, que pode tornar-se especialmente prejudicial em
condições de proliferação celular descontrolada (HENGSTLER et al., 2003).
1.3.3 Desregulação da proliferação celular
O desenvolvimento tumoral é caracterizado por uma desregulação do
crescimento celular e diferenciação. Os compostos metálicos carcinogênicos podem
alterar o crescimento celular por vários mecanismos distintos, seja por aumento da
expressão de fatores estimuladores do crescimento, ou inativando os mecanismos de
controle do crescimento celular (RUITER; MAILÄNDER; KAPPUS, 1985). Em
relação ao primeiro, alguns íons metálicos demonstraram ativar caminhos de sinalização
mitogênica e induzir a expressão de proto-oncogenes celulares. Além disso,
mecanismos epigenéticos, tais como hipo ou hipermetilação do DNA ou distúrbios na
acetilação de histonas podem contribuir para padrões modificados da expressão gênica
(PULIDO; PARRISH, 2003).
As alterações na regulação dos genes são observadas antes da manifestação dos
tumores. Inicialmente, elas não são fixadas por mutação, e o agente promotor deve estar
presente por um longo período de tempo para causar modificações persistentes, que
podem ser geneticamente fixadas durante o desenvolvimento do tumor (HAYES, 1997;
BEYERSMANN, 2002). Finalmente, íons metálicos podem desregular a proliferação
celular inativando processos apoptóticos, resultando na adaptação à citotoxicidade do
metal.
Em relação à interferência com o controle do crescimento celular, verificou-se
que alguns metais carcinogênicos inativam as proteínas supressoras de tumores p53 e/ou
regulam negativamente a expressão dos genes supressores de tumores FHIT, P16, TP53
22 Considerando estes mecanismos, a exposição aos metais tóxicos pode aumentar o risco
de câncer em humanos (WILD; BOURGKARD; PARIS, 2009; TOKAR et al., 2011).
1.4 Influência da poluição ambiental com o risco de câncer
A poluição ambiental tem sido associada a vários tipos de cânceres. Fazem parte
deste espectro a poluição do ar exterior por partículas de carbono associadas a
hidrocarbonetos aromáticos policíclicos (HAP); poluição do ar em ambientes fechados
por tabaco, formaldeído e compostos orgânicos voláteis, tais como benzeno e
1,3-butadieno (que podem afetar particularmente crianças); poluição alimentar por aditivos
alimentares e por contaminantes carcinogênicos, tais como nitratos, pesticidas, dioxinas
e outros organoclorados; metais carcinogênicos e metaloides; medicamentos
farmacêuticos; e cosméticos (BAUDOUIN et al., 2002; JÄRUP, 2003; FARMER et al.,
2003; ROSSNER et al., 2007).
Numerosos poluentes do ar ao ar livre, como os HAP, aumentam o risco de
câncer, especialmente câncer de pulmão. Os HAP podem aderir a finas partículas de
carbono na atmosfera e assim penetrar no corpo humano, principalmente por meio da
respiração (KO; HUI, 2009). A exposição a longo prazo ao ar contendo HAP em
cidades poluídas foi associada com elevado risco de mortes por câncer de pulmão e do
trato digestivo (ARMSTRONG et al., 2004; DIGGS et al., 2011). Além de HAP e
outras partículas finas de carbono, outro poluente ambiental, o óxido nítrico, foi
associado com aumento do risco de câncer de pulmão em uma população europeia de
não-fumantes (HEMMINKI; PERSHAGEN, 1994). Outros estudos mostraram que o
óxido nítrico pode induzir câncer de pulmão e promover a metástase. O aumento do
risco de leucemia infantil associado à exposição a gases de escapamento de veículos
automotores também foi relatado (HECK et al., 2014).
Poluentes atmosféricos internos, como compostos orgânicos voláteis e
pesticidas, aumentam o risco de leucemia e linfoma na infância e crianças e adultos
expostos a pesticidas apresentam elevado risco de tumores cerebrais, tumores de Wilm,
sarcoma de Ewing e tumores de células germinais (BELSON; KINGSLEY; HOLMES,
2007). Exposição a poluentes orgânicos ambientais estão associados com aumento do
23 foi relacionado com o aumento do risco de sarcoma e linfoma (STICKNEY et al., 2003;
KANO et al., 2009).
A inalação de óxidos de arsênio pode causar câncer de pulmão, mas se eles são
engolidos, o câncer pode se desenvolver na bexiga, rim, fígado e pulmão
(SZYMANSKA-CHABOWSKA et al., 2002). Assim, a exposição a óxidos de arsênio
tem sido associada a um amplo espectro de tipos comuns de câncer. Além da exposição
a óxidos de arsênio, o câncer de pulmão também está associado à exposição a muitos
metais, incluindo chumbo, cromo hexavalente e níquel (IARC, 1990).
Além disso, verificou-se que a exposição ao cromo hexavalente ou ao níquel está
associada ao carcinoma nasofaríngeo; a exposição ao chumbo ou ao mercúrio aos
tumores cerebrais; a exposição ao chumbo ou ao cádmio ao câncer de rim; e a exposição
ao cádmio, ao câncer da próstata (HAYES, 1997; COCCO et al., 1999; LANDRIGAN
et al., 2000; NAVAS-ACIEN et al., 2002; WESSELING et al., 2002; WAALKES,
2003).
Os mecanismos de ação de metais e metaloides ainda não estão claros. Podem
atuar como cocarcinógenos ativando procarcinógenos no fígado (HAYES, 1997) ou
aumentando o efeito promotor de estrogênio (GURPIDE et al., 1984). Eles também
poderiam atuar substituindo o metal natural associado à enzima, inativando assim a via
metabólica de enzimas-chave. Metais carcinogênicos e metaloides, tais como arsênio,
cádmio e níquel, e carcinogêneos putativos, incluindo cobalto e chumbo, podem inibir
as proteínas de reparo do DNA (WITKIEWICZ-KUCHARCZYK; BAL, 2006).
Outro detalhe é que alguns metais e metaloides podem também ser mutagênicos
através de outros mecanismos. Na verdade, muitos deles podem interagir com o DNA.
Compostos metálicos tais como Cr (VI) são capturados pelas células como ânios de
cromato e são reduzidos intracelularmente por meio de intermediários reativos a Cr (III)
estável, que pode interagir diretamente com o DNA. Estes intermediários de Cr (III)
podem afetar o DNA impedindo a replicação ou reduzindo a fidelidade de replicação,
desencadeando mutações (SNOW, 1991; SNOW, 1994). O Cr (III) também pode
formar crosslinks de DNA-proteínas, DNA-aminoácidos e glutationa (ZHITKOVICH et
al., 1995; ZHITKOVICH et al., 1996).
Os compostos de platina (cis-diaminodicloroplatina) estão associados com
24 mutações (ZWELLING et al., 1979; DONAHUE et al., 1990). Há evidências de que o
níquel pode atuar por meio de um mecanismo epigenético envolvendo regiões
heterocromáticas do genoma (COSTA, 1991; SALNIKOW et al., 1994). No entanto,
como a contaminação do ambiente por metais e metaloides pode estar relacionada com
a incidência crescente de câncer? No próximo tópico revisamos um pouco a literatura.
1.4.1 Associação entre exposição a metais e carcinogênese
O processo de carcinogênese tem sido classicamente descrito em quatro
estágios: iniciação, promoção, progressão e metástase
(GRZYBOWSKA-SZATKOWSKA, SLASKA, 2012). A iniciação caracteriza-se como o resultado da
genotoxicidade que levará ao acúmulo de mutações no DNA. A iniciação do câncer
pelos metais envolve com mais frequência a produção de radicais livres que podem
potencialmente lesionar o DNA. Este processo pode ocorrer por múltiplos mecanismos,
como o ciclo redox, o metabolismo e a indução de genes que produzem espécies
reativas (HARRIS; SHI, 2003; ARITA; COSTA, 2009; VALKO et al., 2016). Os
produtos de danos oxidativos no DNA são frequentemente lesões de base única, mais
notavelmente as modificações do tipo 7,8-di-hidro-8-Oxo-2'-desoxiguanosina. De todos
os metais, os sais de cromato produzem a maior resposta genotóxica no menor período
de tempo (LEONARD; BOWER; SHI, 2004).
Os sais de cromo também exibem capacidade de formar crosslinks entre DNA e
proteínas. O ferro, similarmente, é altamente reativo e prontamente capaz de doar ou
aceitar elétrons a partir de uma variedade de fontes. É, no entanto, altamente regulado,
de tal modo que é improvável que ocorram efeitos genotóxicos ou formação de adutos,
excetuando-se em circunstâncias onde há sobrecarga do metal (POURAHMAD et al.,
2003; JOMOVA; VALKO, 2011).
A iniciação do câncer, no entanto, não é apenas o resultado de mutações
pontuais. Pode também ser causada por rupturas da cadeia de DNA, que podem resultar
em rearranjos cromossômicos, ou através de alterações na reparação do DNA que
reduzem a capacidade de reparar lesões não associadas com o metal. Mudanças no
controle transcricional de genes específicos, dependente de metais, também podem
desempenhar importante papel na carcinogênese (CHEN; SHI, 2002; SALNIKOW;
25 A expressão de genes alterada, por meio da indução de cascatas de sinais
específicos é mais frequentemente associada à promoção do câncer (SEVER;
BRUGGE, 2015). Os sais de metal podem alterar a regulação de genes a partir de vários
mecanismos, no entanto, mais frequentemente pela ativação de fatores de transcrição ou
por mudanças nos padrões de metilação gênica. De modo semelhante, cascatas de sinais
podem ser modificadas pela interação de metais com qualquer um dos passos na via,
muitas vezes através da ligação direta a receptores ou proteínas intermediárias
(BEYERSMANN, 1994; ADAMS et al., 2002).
A progressão tumoral é semelhante ao ponto em que há predomínio de
aberrações em mecanismos de controle celular, sendo caracterizada por alterações no
fenótipo celular e nos processos metabólicos (QUAIL; JOYCE, 2013). Os metais têm
fortes efeitos nas células, particularmente no que se refere ao estado redox. Tanto o
cromo como o arsênico têm demonstrado alterar o potencial redox em células de
mamífero in vitro (KOEDRITH et al., 2013; KIM; KIM; SEO, 2015). Alterações desta
natureza podem propiciar maior competitividade destes tipos de células em comparação
com as suas contrapartes não neoplásicas, com maior potencial de crescimento
(CHERVONA; ARITA; COSTA, 2012).
A fase final da tumorigênese maligna envolve a migração de células cancerosas
para outras regiões do corpo. Este processo normalmente objetiva a formação de sítios
secundários de colonização por células que apresentam cascatas de sinalização celular
alteradas, características fenotípicas indiferenciadas e capacidade proliferativa (QUAIL;
JOYCE, 2013; KIM; BAE, 2016). O cádmio, aparentemente, é o único que demonstrou
afetar a matriz extracelular de células, interferindo nas caderinas, moléculas
responsáveis pela adesão, impedindo a sua formação e subsequentemente permitindo
que as células se desloquem para outras regiões (TOKAR; BENBRAHIM-TALLAA;
WAALKES, 2011).
As informações toxicológicas sofrem revisões periódicas. Dentre os dados
existentes sobre os metais pesados, o Cr (III) parece necessitar de novas investigações.
Isso se deve à existência de fortes evidências epidemiológicas que põem em dúvida sua
segurança, principalmente, em ambientes de trabalho.
26 O cromo é um metal pesado importante do ponto de vista ambiental e é
comumente utilizado em várias indústrias, incluindo curtumes, têxteis, chapeamento de
cromo, produção de aço e refratários (NRIAGU, 1988). Os riscos devidos à
contaminação ambiental por cromo dependem criticamente do seu estado de oxidação e
solubilidade (SHRIVASTAVA; UPRETI; SETH, 2002). O cromo exibe vários estados
de oxidação, variando de 0 a +6, o que determina sua reatividade química e, portanto,
seu significado ambiental e biológico. Os estados de oxidação mais comuns para o
cromo são +3 e +6 ou equivalentemente cromo trivalente [Cr (III)] e hexavalente [Cr (VI)] (KOTAŚ; STASICKA, 2000).
O Cr (III) é a forma mais estável do elemento devido à sua forte tendência a
formar complexos hexacoordenados cineticamente inertes em água, amônia, ácidos
orgânicos, sulfato, haletos e ureia (APTE et al., 2005); serve como nutriente essencial em plantas (STĘPNIEWSKA; WOLIŃSKA, 2005), e exibe um número significativo de benefícios para a saúde humana e animal (ANDERSON, 2000). O Cr (VI), por outro
lado, é ácido e é o estado do cromo mais importante do ponto de vista ambiental. Nesta
forma, o cromo é altamente solúvel em água e, portanto, móvel, enquanto que a forma
de Cr (III) reduzida é quase insolúvel em água e, portanto, imóvel (BINI; MALECI;
ROMANIN, 2008).
Pesquisas anteriores demonstraram que o Cr (VI) é estável em ambiente
oxidante com pH acima de 6,0 (JAMES et al., 1997). Em condições de pH 3 a 6, os
compostos de Cr (VI) tendem a reduzir para formas mais termodinamicamente estáveis,
como o Cr (OH)3 (MASSCHELEYN et al., 1992). Todos os compostos de Cr (VI) são
agentes oxidantes fortes, corrosivos e considerados tóxicos e potencialmente
cancerígenos (DAS; MISHRA, 2008). A ingestão de grandes quantidades de Cr (VI)
pode causar danos nos rins e no fígado e o contato com a pele pode desenvolver
ulcerações.
Das várias fontes de Cr no ambiente, as indústrias de curtimentos têm lugar de
destaque. Um dos principais problemas emergentes da indústria de curtimento é a
eliminação de lamas contaminadas com cromo (MWINYIHIJA et al., 2006;
MWINYIHIJA, 2010). Os resíduos de curtumes contêm uma mistura complexa de
poluentes orgânicos e inorgânicos resultantes de operações, como a limpeza, o
esmagamento, a divisão, o curtimento e o polimento dos resíduos animais
27 Os compostos de cromo são ubíquos entre os poluentes inorgânicos como
resultado de sua utilização como agentes curtidores, sob a forma de Cr2 (SO4)3 e a falta
de uma estratégia adequada de tratamento de águas residuais (REDA, 2015). A partir do
Cr total utilizado no processo de curtimento, apenas 60 a 70% são utilizados e o
restante, 30 a 40%, são liberados para o ambiente no efluente do curtume (CASSANO
et al., 2007). Este uso ineficiente de cromo resulta em águas residuais contendo até
1500-3000 ppm e 500-1000 ppm de cromo por meio das técnicas de curtimento
convencional e de alta exaustão, respectivamente.
Uma gama de métodos físico-químicos e biológicos ou a combinação de ambos
(REEMTSMA; JEKEL, 1997) foram disponibilizados para remoção de Cr em efluentes,
muito embora, alguns destes não removam completamente os contaminantes
(BOUWER et al., 1994). Os métodos convencionais de tratamento de águas residuais
dependem do fato de os sais de Cr precipitarem com NaOH, seguindo-se a dissolução
de Cr (OH)3 em ácido sulfúrico. No entanto, a qualidade da solução recuperada nem
sempre é ideal, devido à presença do estado tóxico do metal, substâncias lipídicas e
outras impurezas (CASSANO et al., 2001).
Estão disponíveis novas técnicas para melhorar a reciclagem do cromo, a fim de
que se reduza os impactos para o ambiente, mas estas tecnologias estão limitadas aos
países desenvolvidos, considerando o elevado custo operacional e algumas delas
demandarem uma grande gestão (SUNDAR; RAO; MURALIDHARAN, 2002).
Embora o Cr (III) seja a forma mais esperada nos efluentes do curtume, pode ocorrer
um aumento na forma hexavalente como resultado das reações redox que ocorrem na
lama, por exemplo, na água por meio de óxidos de manganês e em solos por meio de
ligandos móveis, tais como ácido cítrico, ácido dietileno triamina pentaacético (DTPA)
e oxidação mediada pelo ácido fúlvico (STEPNIEWSKA; BUCIOR; BENNICELLI,
2004).
A quantidade de cromo em determinado momento depende da intensidade dos
processos industriais, da proximidade das fontes, da quantidade de cromo liberada e de
fatores meteorológicos (BARTLETT; KIMBLE, 1976). O cromo, a partir de fontes que
liberem o elemento em partículas relativamente grandes (diâmetro variando de 0,2-50
mm), é depositado localmente e pode migrar por meio de fatores ambientais individuais
e particulares. A distância percorrida por um metal depositado no ambiente depende de
28 O transporte dentro dos sistemas terrestres e na água é diretamente afetado pela
especiação química: formas químicas de cromo e sua afinidade para transformações
redox químicas e fotoquímicas, precipitação/dissolução e processos de
adsorção/dessorção, por exemplo, ocorrendo em etapas individuais do ciclo biogeoquímico do cromo (KOTAŚ; STASICKA, 2000). Conversão redox do Cr (III) para Cr (VI) pode aumentar o deslocamento do Cr (VI) no solo para os sistemas
aquáticos (HOMA; HAILE; WASHE, 2016).
Compostos de cromo trivalente, com exceção para o acetato, o nitrato e sais de
cloreto hexaidratado são geralmente insolúveis em água. Alguns compostos
hexavalentes, tais como trióxido de crômio, os sais de amônio e de metal alcalino e sais
de ácido crômico são facilmente solúveis em água. O Cr (VI) é reduzido a compostos de
Cr (III) na presença de matéria orgânica oxidável. Por outro lado, em águas naturais,
onde há uma baixa concentração de materiais redutores, os compostos de Cr (VI) são
mais estáveis (O'BRIEN et al., 2005; NICKENS; PATIERNO; CERYAK, 2010).
Nos seres humanos e animais, o Cr (III) é considerado um nutriente essencial
que desempenha importante papel no metabolismo da glicose, gordura e proteínas por
potencializar a ação da insulina (KE; COSTA, 2007). A forma biologicamente ativa de
cromo, denominada cromodulina, é um complexo de oligopeptídeo contendo quatro
íons de cromo. Os seres humanos e os animais são capazes de converter compostos
inorgânicos de Cr (III) inativos para formas fisiologicamente ativas. Apesar do Cr (III)
ter sido reportado como um nutriente essencial, a exposição a níveis elevados por
inalação, ingestão ou contato com a pele podem causar alguns efeitos adversos para a
saúde humana (ATSDR, 2012).
A toxicidade do Cr (III) é menor do que a forma hexavalente [Cr (VI)],
considerando sua alta solubilidade em água e potente efeito oxidativo (SEDMAN et al.,
2006). Diferentes estudos focaram na carcinogenicidade do cromo hexavalente
(HOLMES; WISE; WISE, 2008; NICKENS; PATIERNO; CERYAK, 2010), muito
embora os mecanismos relacionados à induçao de câncer por este composto não estejam
completamente esclarecidos (DE FLORA et al., 2008), evidências sugerem que efeitos
toxicogenéticos estejam envolvidos.
Comparado à forma hexavalente, as influências celulares do cromo trivalente
29 ambiente extracelular, o Cr (III) tem maior dificuldade em atravessar membranas
celulares comparado ao Cr (IV), embora este último, ao ser reduzido à forma trivalente,
produz elevada quantidade de espécies reativas de oxigênio, resultando em peroxidação
lipídica e danos oxidativos ao material genético (SALNIKOW; ZHITKOVICH, 2008;
YAO et al., 2008).
As exposições por longos períodos e em baixas concentrações ao Cr (III) são de
reconhecimento clínico bem mais difícil, principalmente quando há exposição a
múltiplos compostos, situação bastante comum em exposição ocupacional. Há, neste
caso, maior dificuldade para o reconhecimento de uma associação causa/efeito. Alguns
efeitos foram relatados decorrentes da exposição ao cromo, como indução de apoptose
por processos oxidativos em culturas celulares e formação de adutos de cromo ao DNA
(QUIEVRYN et al., 2003; REYNOLDS et al., 2009; THOMPSON et al., 2013).
Nesta perspectiva, estudos citogenéticos com aplicação de biomarcadores podem
ser potencialmente utilizados para identificar possíveis fatores de susceptibilidade à
carcinogênese. Agentes químicos com resultados positivos em testes padrões de
genotoxicidade são geralmente conhecidos por induzir o câncer por mecanismos
relacionados à indução de danos ao DNA, por efeitos clastogênicos/aneugênicos, os
quais são indicativo de riscos para processos neoplásicos (LUZHNA; KATHIRIA;
KOVALCHUK, 2013; NIKITAKI et al., 2015; WOOD et al., 2015).
1.5.1 Exposição humana ao cromo
A produção mundial de Cr está concentrada em algumas regiões, como África
do Sul, Índia, Cazaquistão, Finlândia, Brasil e Turquia, totalizando 16.400.000
toneladas produzidas em todo o mundo, a partir da queima de óleo e carvão, petróleo de
material refratário de ferro cromato, oxidantes de pigmentos, catalisadores, aço de
cromo, fertilizantes, perfuração de poços de petróleo, chapeamento de metais e
curtumes (GHANI, 2011; MOHANTY; KUMAR PATRA, 2013). Estima-se que 33
toneladas de Cr total são liberadas anualmente no meio ambiente, principalmente em
efluentes industriais e fertilizantes (ATSDR, 2000; GUERTIN, 2005; NICKENS;
PATIERNO; CERYAK, 2010), o que representa um alto risco aos seres humanos e
30 O nível seguro de exposição é cerca de 5 μg/m3, para uma média ponderada de 8
horas, mesmo que este nível possa ainda representar um risco carcinogênico (OSHA,
2006). Para a população humana em geral, os níveis atmosféricos variam de 1 a 100
ng/cm3, mas podem exceder este intervalo em áreas de refinaria, metalurgia e curtumes
(SINGH et al., 1999). A exposição não ocupacional ocorre através da ingestão de
alimentos e água contendo cromo, enquanto que a exposição ocupacional ocorre por
inalação (LANGÅRD; VIGANDER, 1983).
As concentrações de cromo variam entre 1 e 3000 mg/kg no solo, 5 a 800 μg/L na água do mar e 26 μg/L para 5,2 mg/L nos rios e lagos. O teor de cromo nos alimentos varia muito e depende do processamento e da preparação. Em geral, a maioria dos
alimentos frescos normalmente contém níveis de cromo que variam de <10 a 1.300 μg/kg. Os trabalhadores em indústrias relacionadas ao cromo podem estar expostos a concentrações duas vezes mais elevada que a população em geral (ATSDR, 2008).
Embora a principal via de exposição humana ocupacional ao cromo seja por
inalação e o pulmão seja o principal órgão-alvo, também foi relatada uma exposição
humana significativa ao cromo através da pele (SHELNUTT; GOAD; BELSITO,
2007). Por exemplo, a incidência generalizada de dermatite observada entre
trabalhadores de construção é atribuída à sua exposição ao cromo presente no cimento
(SHELNUTT; GOAD; BELSITO, 2007). A exposição ocupacional e ambiental a
compostos contendo Cr (VI) está relacionada com toxicidade multiorgânica, tal como
dano renal, alergia e asma, e câncer do trato respiratório em seres humanos (GOYER,
2001).
Respirar elevados níveis de cromo (VI) pode causar irritação no revestimento do
nariz e úlceras no nariz. Os principais problemas de saúde observados nos animais após
a ingestão de compostos de Cr (VI) são irritação e úlceras no estômago e no intestino
delgado, anemia, danos em espermatozóides e danos no sistema reprodutor masculino.
Os compostos de Cr (III) são muito menos tóxicos e não parecem causar estes
problemas. Alguns indivíduos são extremamente sensíveis ao Cr (VI) ou ao Cr (III);
foram observadas reações alérgicas consistindo em vermelhidão grave e inchaço da pele
decorrentes da exposição ao metal. Observou-se um aumento nos tumores de estômago
31 A ingestão acidental ou intencional de doses extremamente elevadas de
compostos de Cr (VI) por humanos resultou em danos respiratórios, cardiovasculares,
gastrointestinais, hematológicos, hepáticos, renais e neurológicos graves, podendo
evoluir para morte (ATSDR, 2000). Embora as evidências de carcinogenicidade do
cromo em humanos e mamíferos terrestres pareçam fortes, o mecanismo pelo qual ele
induz câncer não é completamente compreendido.
1.5.2 Cromo e instabilidade genômica
A instabilidade do genoma é uma característica chave de boa parte das formas de
câncer (CAHILL et al., 1999). Na maioria das neoplasias, a integridade da estrutura e
número cromossômico estão comprometidos. A instabilidade genômica refere-se a uma
grande variedade de alterações genéticas; Anormalidades cromossômicas numéricas e
estruturais são geralmente referidas como instabilidade cromossômica e eventos que
causam erros durante replicação ou reparo de DNA, ocasionando a instabilidade de
microsatélites (FENECH; FERGUSON, 2001; MICHOR et al., 2005).
Os elementos traço alcançaram grande importância na prevenção do câncer e
acredita-se que têm um papel significativo na manutenção do genoma (HARTWIG,
2001). Estes elementos, necessários diariamente, podem ter grandes impactos sobre o
genoma quando presente em excesso ou quando deficiente (LINDER, 2001; CHENG,
2009). O excesso de íons metálicos podem causar estresse oxidativo e contribuir para a
elevação da quantidade de radicais livres; No entanto, muitos deles são necessários em
funções fisiológicas e estabilidade do ambiente celular, incluindo a detoxificação de
radicais. Assim, para a maioria dos metais, é importante estabelecer um equilíbrio para a
manutenção da estabilidade celular e genômica (HARTWIG, 2001).
O cromo tem sido motivo de preocupação, dada a sua carcinogenicidade e sua
ocorrência comum (WISE et al., 2008). A bioquímica completa do cromo é muito
complexa e contribui para a sua reatividade e disponibilidade em sistemas biológicos.
Nesses sistemas, o Cr (VI) é encontrado como o ânion, cromato, que é semelhante ao
sulfato e fosfato e é facilmente transportado através da membrana celular (DE FLORA;
WETTERHAHN, 1989). Alternativamente, o cromo trivalente forma grandes moléculas
volumosas, tais como complexos ternários com aminoácidos e proteínas em sistemas
32 O Cr (VI) é considerado a forma mais potente de cromo no que diz respeito à
toxicidade e carcinogenicidade (HOLMES; WISE; WISE, 2008). Entretanto, o Cr (VI)
não interage diretamente com o DNA, mas é a redução intracelular de Cr (VI) a Cr (III)
que poderá causar os eventos prejudiciais ao DNA, que levam à transformação neoplásica das células e, finalmente, ao câncer (O’BRIEN; CERYAK; PATIERNO, 2003).
1.5.3 Cromo trivalente e eventos toxicogenéticos
A bioquímica básica do Cr (III) já está bem definida. Estudos em diferentes
sistemas caracterizaram o papel do Cr (III) em se ligar ao DNA, levando a uma
diminuição da processividade das DNA polimerases e aumento de erros na replicação, o
que podem elevar a frequência de mutações (SNOW, 1991; SNOW; XU, 1991). Uma
revisão dos efeitos do Cr (III) demonstra resultados positivos para uma variedade de
eventos genotóxicos, incluindo mutagenicidade (EASTMOND; MACGREGOR;
SLESINSKI, 2008).
Embora o Cr (III) tenha capacidade de reagir com o DNA, a sua absorção
através da membrana celular é fraca, e assim, estudos em culturas celulares são difíceis.
A maioria dos experimentos in vitro são conduzidos com sais inorgânicos menos ativos,
que são mal absorvidos e requerem concentrações de tratamento não relevantes. Além
disso, os estudos in vivo com o Cr (III) são amplamente negativos quanto à
genotoxicidade (EASTMOND; MACGREGOR; SLESINSKI, 2008).
Estudos com trabalhadores de curtumes em exposição prolongada ao cromo
inorgânico demonstraram evidências de efeitos genotóxicos, incluindo aberrações
cromossômicas, formação de micronúcleos e quebras das fitas de DNA (SBRANA et
al., 1990; MEDEIROS et al., 2003; MEIBIANA et al., 2008; AMARAL et al., 2015).
Além disso, Mancuso (1997) evidenciou que os trabalhadores expostos ao Cr (III)
inorgânico têm elevado risco de desenvolver câncer. Este estudo sugere que a exposição
a longo prazo seja fundamental para a genotoxicidade induzida por Cr (III).
Outra evidência chama atenção para os efeitos a longo prazo de concentrações
fisiologicamente relevantes de Cr (III) em pacientes com implantes de cromo-cobalto
(FIGGITT et al., 2010). Neste estudo, os fibroblastos foram tratadas com níveis de
33 quanto à estabilidade cromossômica. As células tratadas com Cr (III) apresentaram
elevada instabilidade cromossômica numérica e estrutural. A instabilidade
cromossômica foi proposta como mecanismo para a carcinogênese induzida por metal
(WISE; WISE, 2010; HOLMES; WISE, 2010).
Com o desenvolvimento de formas mais biodisponíveis de Cr (III), como
picolinato de cromo e nicotinato de cromo, amplamente utilizados em aplicações
nutricionais e farmacológicas, o potencial de toxicidade destas formas carece de
avaliação. Estudos com cultura celular mostraram que Cr picolinato é capaz de lesionar
o DNA (BAGCHI et al., 2002; ANDERSSON et al., 2007), causar aberrações
cromossômicas (STEARNS et al., 1995) e induzir mutações (STEARNS et al., 2002;
CORYELL; STEARNS, 2006) em concentrações fisiologicamente relevantes. Por outro
lado, um estudo apresentou dados negativos para indução de danos cromossômicos por
picolinato de Cr (III), não obstante, os tempos de tratamento neste estudo foram
limitados a apenas 4 horas (GUDI et al., 2005). Outra evidência aponta o destino
metabólico de complexos orgânicos de Cr (III), sugerindo que altos níveis de Cr (III)
intracelular podem se acumular (KAREUS et al., 2001), levando à formação de adutos
de Cr-DNA e potencialmente causar efeitos genotóxicos.
Além disso, a partir da especiação química em meios biológicos, evidências
apontam que muitos compostos de Cr (III) podem ser oxidados em fluidos
extracelulares, levando a uma captação celular mais eficiente e, consequentemente,
danos ao DNA (LEVINA; LAY, 2008). O NTP (National Toxicology Program) relatou
carcinogenicidade em um estudo com ratos e camundongos expostos por 2 anos ao
picolinato de Cr, apresentando neoplasias adrenais em ratos machos (STOUT et al.,
2009).
Em contrapartida, outro estudo não relatou danos cromossômicos em medula
óssea de ratos tratados com picolinato de cromo; No entanto, a exposição foi de apenas
24 h para os animais tratados oralmente (KOMOROWSKI; GREENBERG; JUTURU,
2008). Não há estudos a longo prazo de Cr (III) orgânico que sejam comparáveis aos
estudos de trabalhadores de Cr (III) inorgânico; Os estudos em seres humanos com
suplementação de Cr (III) estão focados nos efeitos do metabolismo da glicose e não
avaliam a genotoxicidade. Em geral, as formas mais biodisponíveis de Cr (III) têm
potencial para produzir espécies reativas de oxigênio que podem ter profundas
34 em cromossomos, e consequentemente instabilidade genômica e efeitos potencialmente
carcinogênicos (KE; COSTA, 2007; LEVINA; LAY, 2008).
Embora o campo de pesquisa com Cr (III) seja repleto de controvérsias, tanto no
que se refere à sua essencialidade, quanto à sua toxicidade, não há evidência do papel
do Cr (III) quanto a provável manutenção da estabilidade genômica (FANG et al., 2014;
SUN; BROCATO; COSTA, 2015). Apesar de todos os estudos de Cr (III) serem
fortemente criticados por pontos de vista opostos, dos estudos investigados, o Cr (III)
não desempenha papel na reparação do DNA ou na sua síntese e não auxilia na remoção
de radicais livres, semelhantemente a outros elementos metálicos traços, tais como
zinco e cobre (NICKENS; PATIERNO; CERYAK, 2010). A seguir serão discutido os
prováveis mecanismos de interação do Cr (III) com o material genético, favorecendo a
carcinogênese.
1.5.4 Rotas de interação do cromo trivalente com o material genético
Após captação de cromato (VI) e sua redução intracelular para Cr (III), este
último forma complexos potencialmente genotóxicos com o DNA. Isto implica que Cr
(III) pode ser genotóxico, superando a barreira da membrana plasmática (Figura 2).
Este mecanismo pode ocorrer de várias maneiras. Partículas insolúveis de Cr2O3 podem
ser absorvidas por fagocitose e, posteriormente, serem solubilizados em lisossomos para
libertar íons Cr3+. Estes cátions ligam-se a macromoléculas celulares, incluindo o DNA