Universidade Federal de Ouro Preto Escola de Farmácia
Programa de Pós-Graduação em Ciências Farmacêuticas CIPHARMA
ESTUDO QUÍMICO E AVALIAÇÃO DAS ATIVIDADES
ANTIMICROBIANA E ANTICOLINESTERÁSICA DE
EXTRATOS BRUTOS ACETATO DE ETILA E
METABÓLITOS SECUNDÁRIOS DO FUNGO
Paecilomyces lilacinus
Ana Paula Campos Teles
Universidade Federal de Ouro Preto Escola de Farmácia
Programa de Pós-Graduação em Ciências Farmacêuticas CIPHARMA
ESTUDO QUÍMICO E AVALIAÇÃO DAS ATIVIDADES
ANTIMICROBIANA E ANTICOLINESTERÁSICA DE
EXTRATOS BRUTOS ACETATO DE ETILA E
METABÓLITOS SECUNDÁRIOS DO FUNGO
Paecilomyces lilacinus
Ana Paula Campos Teles
Orientadora: Profa. Drª. Jacqueline Aparecida Takahashi
Ouro Preto - Minas Gerais 2012
Catalogação: www.sisbin.ufop.br
T269e Teles, Ana Paula Campos.
Estudo químico e avaliação das atividades antimicrobiana e
anticolinesterásica de extratos brutos acetato de etila e metabólitos secundários do fungo Paecilomyces lilacinus [manuscrito] / Ana Paula Campos Teles. -2012.
160f.: il.: color; grafs; tabs.
Orientadora: Profa. Dra. Jacqueline Aparecida Takahashi.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Escola de Farmácia. Departamento de Farmácia. Programa de Pós-graduação em Ciências Farmacêuticas.
Área de Concentração: Fármacos e Medicamentos.
1. Alzheimer, Doença de. 2. Análise cromatográfica. 3. Fungos. 4. Antibióticos. I. Takahashi, Jacqueline Aparecida. II. Universidade Federal de Ouro Preto. III. Titulo.
AGRADECIMENTOS
À Deus, pelo dom da vida e por ter me dado oportunidade e sabedoria para a realização deste trabalho;
Aos meus pais Ana e Maurício, pelo constante amor, apoio, compreensão,
incentivo e palavras de estímulo em todos os momentos da minha vida, sendo meus exemplos de vida e perseverança;
À Professora Drª Jacqueline Aparecida Takahashi, pela oportunidade e confiança, pelos ensinamentos, mas principalmente pela amizade e conselhos sempre acolhedores;
Aos meus irmãos Rose e Rogério, fontes de carinho, apoio e amizade. Irmã, muito obrigada por tudo que sempre fez e faz por mim, obrigada por cada conversa, por cada conselho, por não me deixar nunca desistir e por fazer de mim uma pessoa melhor.
Ao Cassio, por todo o carinho, incentivo, apoio e por estar sempre presente na minha vida apesar da distância;
Aos colegas da turma 2010/2012 do Programa de Pós-Graduação em Ciências Farmacêuticas da UFOP;
Às amigas do mestrado Leidiane, Bruna Pitol, Danielle e Juliana, por todo o acolhimento e amizade, por terem compartilhado comigo, de alguma forma, os momentos de conquistas, frustrações e cansaço durante esse período de descobertas e aprendizagem;
Aos amigos do Laboratório de Bioensaios e Biotecnologia do Departamento de Química da UFMG, principalmente à Karine, Ana Sarah, Adriana, Dhionne, Bruna Gomes, Paulo, Mirra, Arthur e Jo pela ajuda no desenvolvimento do trabalho e por me proporcionarem um ambiente sempre agradável para o trabalho e por todas as risadas;
Às amigas Bruna Fernandes, Amanda, Juliana Campos e Larissa, pelo apoio e sincera amizade durante todos esses anos;
Aos Professores e amigos do Programa de Pós-Graduação em Ciências Farmacêuticas da UFOP, em especial, ao Bibo, Dênia e Célia;
À Ivana e ao Ricardo, pela obtenção dos espectros de RMN; À Líliam, pela ajuda na utilização do HPLC;
Ao Programa de Pós-Graduação em Ciências Farmacêuticas da UFOP; À Universidade Federal de Ouro Preto, pela bolsa concedida;
SUMÁRIO
LISTA DE FIGURAS ...i
LISTA DE GRÁFICOS ...iii
LISTA DE TABELAS ...iv
LISTA DE ABREVIATURAS ...vi
RESUMO ...viii
ABSTRACT ...ix
Capítulo 1 1 INTRODUÇÃO 1.1. Produtos naturais como fonte de fármacos ...2
1.2. Os fungos e sua relação com substâncias bioativas ...4
1.3. O fungo Paecilomyces lilacinus ...14
1.4. Antibacterianos ...17
1.5. Anticolinesterásicos ...20
1.6. Técnica OSMAC ...23
Capítulo 2 2 OBJETIVO 2.1. Objetivo geral ...28
2.2. Objetivos específicos ...28
Capítulo 3 3 PARTE EXPERIMENTAL 3.1. Equipamentos ...30
3.2. Reagentes ...31
3.3. Meios de cultura ...32
3.3.1. Meio de cultura BHI ...32
3.3.2. Meio de cultura sólido antibiótico ...32
3.3.3. Meio de cultura caldo batata dextrosado ...32
3.3.4. Meio de cultura ágar batata dextrosado ...32
3.4. Cromatografia líquida de alta eficiência acoplada à detector de arranjo de diodos (CLAE-PDA)...33
3.5. Cromatografia a gás (CG) ...33
3.5.1. Preparo das amostras para análise em CG ...34
3.6. Ressonância Magnética Nuclear (RMN) ...34
3.8. Manutenção dos micro-organismos ...35
3.9. Cultivo dos micro-organismos ...35
3.9.1. Inoculação da bactéria Salmonella tiphymurium ...35
3.9.2. Cultivo do fungo Paecilomyces lilacinus ...36
3.10. Testes de atividade biológica ...39
3.10.1. Avaliação da atividade antimicrobiana - Técnica de difusão em placa utilizando discos de papel (BAUER et al.,1966)...39
3.10.2. Avaliação da atividade antimicrobiana – Técnica de microdiluição em caldo...41
3.10.3. Avaliação da atividade de inibição de acetilcolinesterase em cromatografia em camada delgada (CCD) - Método de Ellmann ...43
3.10.4. Avaliação da atividade de inibição de acetilcolinesterase em microplaca – Método de Ellmann...44
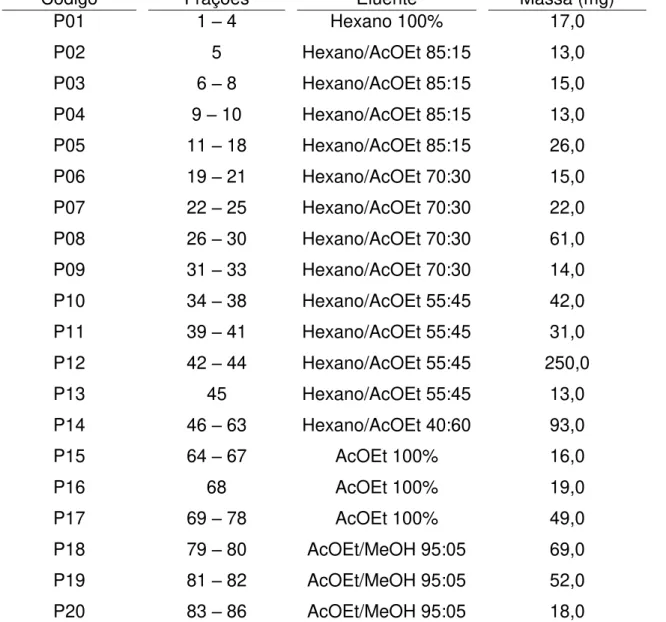
3.11. Fracionamento dos extratos do fungo P. lilacinus ...45
3.11.1. Fracionamento do extrato 5 SA ...45
3.11.2. Fracionamento do extrato 8 SA ...48
Capítulo 4 4 RESULTADOS E DISCUSSÃO 4.1. Análise da influência das condições de cultivo de P. lilacinus na produção de metabólitos secundários, via perfis cromatográficos (CLAE-PDA) ...52
4.2. Cromatografia a gás ...59
4.3. Caracterização de P18 ...72
4.4. Testes de atividade biológica ...77
4.4.1. Avaliação da atividade antimicrobiana - Técnica de difusão em placa utilizando discos de papel (BAUER et al., 1966) ...77
4.4.1.1. Análise Estatística ...81
4.4.2. Avaliação da atividade antimicrobiana – Técnica de microdiluição em caldo ...82
4.4.3. Avaliação da atividade de inibição de acetilcolinesterase em cromatografia em camada delgada (CCD)- Método de Ellmann ...89
4.4.4. Avaliação da atividade de inibição de acetilcolinesterase em microplaca – Método de Ellmann...92
i LISTA DE FIGURAS
Figura 1. Classes de metabólitos secundários fúngicos ...5
Figura 2. Linha de tempo apresentando as classes de antibióticos utilizadas na clínica...9
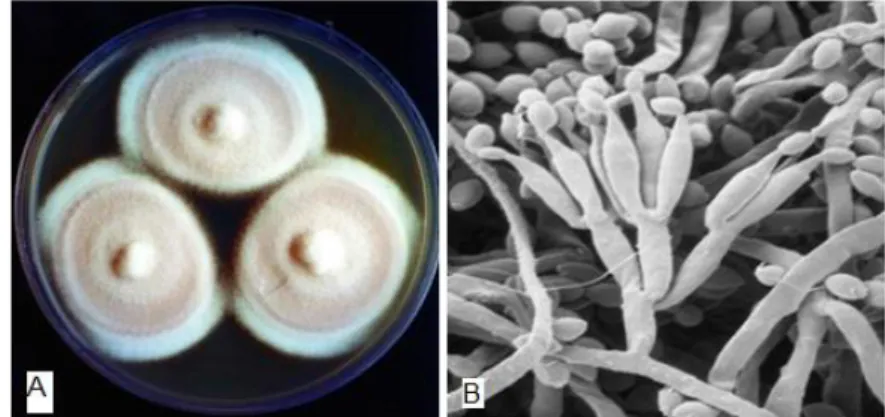
Figura 3. Foto da aparência do fungo P. lilacinus cultivado em meio de cultura ágar batata dextrosado (A) e microfotografia dos conidióforos (B) ...15
Figura 4. Esquema de uma microplaca usada no ensaio antibacteriano e antifúngico com as amostras em uma concentração fixa ...42
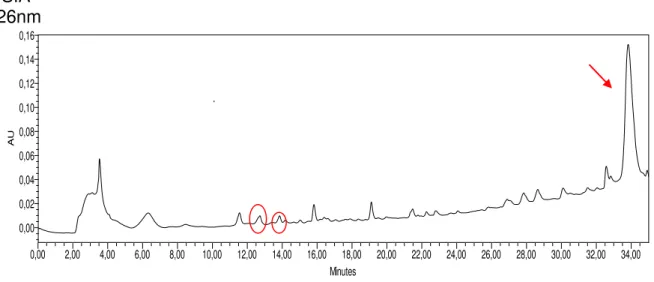
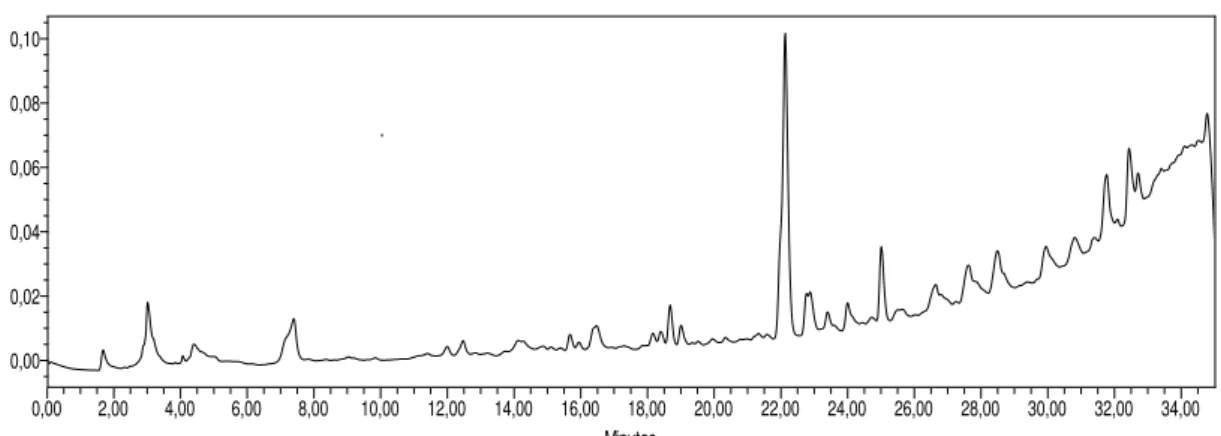
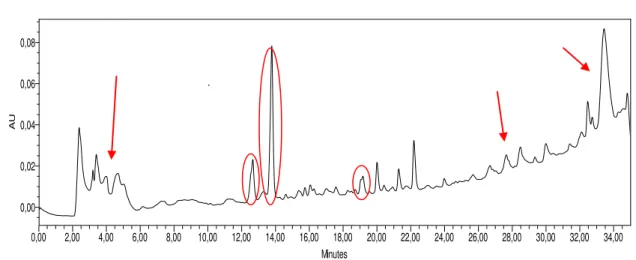
Figura 5. Cromatograma do extrato 1SA (sem agitação) ...53
Figura 6. Cromatograma do extrato 1CA (com agitação) ...53
Figura 7. Cromatograma do extrato 3 SA (sem agitação)...54
Figura 8. Cromatograma do extrato 3 CA (com agitação) ...54
Figura 9. Cromatograma do extrato 5 SA (sem agitação) ...55
Figura 10. Cromatograma do extrato 5 CA (com agitação) ...55
Figura 11. Cromatograma do extrato 9 SA (sem agitação) ...56
Figura 12. Cromatograma do extrato 8 CA (com agitação) ...57
Figura 13. Cromatograma do extrato 10 CA (com agitação) ...57
Figura 14. Cromatograma do extrato 12 SA (sem agitação) ...58
Figura 15. Cromatograma do extrato 13 SA (sem agitação) ...58
Figura 16. Cromatograma do extrato 10 SA (sem agitação) ...59
Figura 17. Cromatograma da fração P01 obtido por CG em comparação com padrões de ésteres de ácidos graxos...62
Figura 18. Cromatograma da fração P02 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...62
Figura 19. Cromatograma da fração P03 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...63
Figura 20. Cromatograma da fração P04 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...63
Figura 21. Cromatograma da fração P05 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...64
ii Figura 23. Cromatograma da fração FH obtido por CG em comparação com padrões de ésteres de ácidos graxos ...65 Figura 24. Cromatograma da fração C01 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...65 Figura 25. Cromatograma da fração C02 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...66 Figura 26. Cromatograma da fração C03 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...66 Figura 27. Cromatograma da fração C04 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...67 Figura 28. Cromatograma da fração C05 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...67 Figura 29. Cromatograma da fração P12 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...69 Figura 30. Cromatograma da fração P13 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...69 Figura 31. Cromatograma da fração P14 obtido por CG em comparação com padrões de ésteres de ácidos graxos ...70 Figura 32. Fragmentos propostos para P18 estabelecidos com base nas correlações 1 H-1H COSY ...73 Figura 33. Correlações espaciais para P18 baseadas no espectro de NOESY ...75 Figura 34 (A) e (B). Correlações espaciais para P18 baseadas no espectro de NOESY...75 Figura 35. Espectro de massas (ESI +) da substância P18 ...76 Figura 36. Reações envolvidas no método de Rhee ...89 Figura 37. (A) Foto da placa do teste de Inibição da AchE em CCD (extratos cultivados sob agitação) e (B) Foto da placa do teste de Inibição da AchE em CCD (extratos cultivados sob condição estática) ...90
iii LISTA DE GRÁFICOS
iv LISTA DE TABELAS
Tabela 1. Principais classes e alvos de antibióticos ...18 Tabela 2. Condições de inoculação do fungo P. lilacinus ...37 Tabela 3. Massas dos extratos do fungo P. lilacinus ...38 Tabela 4. Dados do fracionamento do extrato 5 S.A (1,098 g) do fungo P. lilacinus por cromatografia em coluna de sílica gel...46 Tabela 5. Dados do fracionamento da fração P19 (52,0 mg) por cromatografia em coluna de sílica ―flash‖ ...48
vi LISTA DE ABREVIATURAS E SÍMBOLOS
Ach Acetilcolina
AchE Acetilcolinesterase AcOEt Acetato de etila ACTI Iodeto de acetilcolina BHI Brain Heart Infusion
BuchE Butirilcolinesterase
13C Carbono-13
CCD Cromatografia em camada delgada CCS Cromatografia em coluna de sílica CG Cromatografia a gás
CHCl3 Clorofórmio
CLAE-PDA Cromatografia Líquida de Alta Eficiência- Photo Diode Array Detector
cm Centímetro
COSY Correlation Spectroscopy
DEPT Distortionless Enhancement by Polarization Transfer
DMSO Dimetilsulfóxido
DNA Ácido Desoxirribonucléico
DTNB Ácido 5,5‘-ditiobis-[2- nitrobenzóico]
EM-ESI Espectroscopia de massas por ionização por electrospray FDA Food and Drug Administration
g Grama h Hora
1H Hidrogênio- 1 HCl Ácido clorídrico
HMBC Heteronuclear Multiple Bond Correlation
HMG-Co-AR 3-hidroxi-3-metil-glutaril Co-A redutase HSQC Heteronuclear Single- Quantum Correlation
IAchE Inibidor da acetilcolinesterase iPrOH Isopropanol
L Litro
µL Microlitro
vii
MeOH Metanol
mg Miligrama
MHz Megahertz min Minuto
mL Mililitro
mm Milímetro nm Nanômetro
NOESY Nuclear Overhauser Enhancement Spectroscopy
PDA Ágar batata dextrosado PDB Caldo batata dextrosado ppm Parte por milhão
Pyr Piridina
q.s.p. Quantidade suficiente para Rf Fator de Retenção
RMN Ressonância Magnética Nuclear
RMN de 13C Ressonância Magnética Nuclear de carbono- 13 RMN de1H Ressonância Magnética Nuclear de hidrogênio- 1 RNA Ácido ribonucléico
OSMAC One strain-many active compounds
s Segundo
TMS Tetrametilsilano
UFC Unidades formadoras de colônia UV Ultra-violeta
ºC Graus Celsius
viii RESUMO
A utilização de produtos naturais pela humanidade, em busca por alívio e cura de doenças é prática antiga, principalmente devido à vasta riqueza de espécies vegetais e de micro-organismos pertencentes ao país. Os fungos são importantes organismos utilizados nesta prática, devido aos avanços no campo da biotecnologia e à capacidade destes de produzirem uma variedade de metabólitos secundários. Utilizando-se técnicas como OSMAC (one strain-many active compounds), são obtidos diversos protótipos bioativos, que podem ser utilizados na prevenção e no tratamento de uma gama de enfermidades, entre elas encontram-se as doenças infecciosas e a doença de Alzheimer. Este trabalho teve como objetivo avaliar os diferentes extratos obtidos do cultivo de Paecilomyces lilacinus quanto às ações antibacteriana, antifúngica e inibidores da acetilcolinesterase, enzima representativa no Mal de Alzheimer, além de isolar e identificar os metabólitos secundários. Os resultados dos ensaios biológicos realizados com os extratos brutos e os cromatogramas, estes últimos obtidos por CLAE, mostraram que, variando-se as condições de cultivo, houve variação do perfil químico dos extratos de P. lilacinus. No teste antimicrobiano utilizando o método de difusão em placa, a maioria dos extratos testados mostrou satisfatória atividade para as bactérias Staphylococcus aureus, Listeria
monocytogenes e para a levedura Candida albicans. Utilizando a metodologia de
ix ABSTRACT
The use of natural products by the humanity, searching for relief and cure of diseases is an old practice, mainly due to the vast diversity of plants and micro-organisms belonging to the country. Fungi are important organisms used in this practice, due to the advances in biotechnology and to their ability to produce a variety of secondary metabolites. The use of techniques such as OSMAC (one strain-many active compounds) it is possible to generate diverse bioactive prototypes, which can be used in the prevention and treatment of a range
of diseases, like infectious diseases and Alzheimer‘s diseases. This work aimed to evaluate the different extracts obtained from the cultivation of Paecilomyces lilacinus for antibacterial, antifungal activities and inhibition of acetylcholinestersae, the enzyme in
Alzheimer‘s representative, and to isolate and to identify secondary metabolites. The results of biological assays performed with crude extracts, and their respective chromatograms obtained by HPLC, showed that varying the growth conditions there was variation in the chemical profile of P. lilacinus extracts. In the antimicrobial test using plate diffusion method most of the extracts showed satisfactory activity against Staphylococcus aureus, Listeria monocytogenes and Candida albicans. Using the broth microdilution method, the extracts showed up 100% inhibition of microbial growth. For the qualitative evaluation of AchE enzyme inhibition , from the twenty-eight crude extracts tested, using the method of Ellmann, sixteen showed such activity, and in the quantitative method, the percentage of inhibition varied between 78 an 97%. Three substances were isolated by
chromatographic methods, which one was identified as a δ-lactam. Two substances were isolated bioassayed for the activities above mentioned, with significant results for the test of inhibition of AchE. In the both antimicrobial testing, one substance showed antibacterial activity against Gram-positive S. aureus and L. monocytogenes.
1
2 1. INTRODUÇÃO
1.1. PRODUTOS NATURAIS COMO FONTE DE FÁRMACOS
A utilização de produtos naturais pela humanidade, em busca por alívio e cura de doenças, pela ingestão de ervas e folhas, é prática muito antiga (VIEGAS Jr. et al., 2006). No Brasil, a pesquisa de produtos naturais como fonte de fármacos é crescente, devido a fatores como o alto custo de medicamentos industrializados, a vasta riqueza de espécies vegetais e de micro-organismos pertencentes ao país, visto que, aqui se encontra quase um terço da flora mundial representada por dez biomas com uma biodiversidade exuberante (BÔAS, GADELHA, 2007). NEWMAN e CRAGG (2007) constataram que, entre os anos de 1981 e 2006, mais da metade das novas substâncias químicas encontradas no mercado eram derivadas de produtos naturais ou sintetizadas a partir destes (Gráfico 1), sendo que, diversos fármacos, que se consagraram medicamentos industrializados, foram resultantes de sínteses direcionadas para reproduzir a ação das moléculas encontradas na natureza.
B - Biológico N - Produto Natural
ND - Derivado de Produto Natural S - Fármaco totalmente sintético S* - Sintetizado tendo como
modelo um produto natural V - Vacina
NM – Miméticos de produtos naturais
3 Os extratos obtidos de fontes naturais podem servir como ponto de partida para a obtenção de metabólitos secundários a partir dos quais podem ser preparados derivados sintéticos. Alguns extratos exibem atividade biológica maior ou diferente de seus componentes isolados por apresentarem uma rica diversidade de moléculas químicas como polifenóis, alcalóides, peptídeos e terpenóides, que podem atuar na manutenção e/ou correção das condições fisiológicas de humanos e animais (LAMPÉN, 2009).
Atualmente, o cenário da pesquisa de produtos naturais está sendo modernizado com a utilização de técnicas de química combinatória, a fim de otimizar o estudo da parte ativa da molécula e sua estrutura (NEWMAN, CRAGG, 2007) e se obter o maior número de substâncias bioativas possível (VIEGAS Jr. et al., 2006). Outra perspectiva do ponto de vista de inovação nessa área é a pesquisa utilizando micro-organismos como fontes naturais bioativas, devido ao fato de serem amplamente disseminados no ecossistema e de, nos últimos anos, de vários terem tido seus genomas seqüenciados (NEWMAN, CRAGG, 2007), encorajando esta vertente.
O isolamento de substâncias naturais com atividades biológicas, seja de origem vegetal ou de outras fontes, como micro-organismos, apresenta várias vantagens em relação ao uso de extratos, visto que a substância bioativa pode ser administrada e/ou quantificada de forma reprodutível e em doses exatas, gerando benefícios do ponto de vista experimental e terapêutico (VOLPATO, 2005). Além disto, apresentam alta afinidade por respectivos receptores específicos, que geralmente são proteínas, podendo ativá-los ou inibí-los, e possuem ampla variabilidade química, sendo utilizadas para a prevenção e tratamento de uma gama de enfermidades (COS et al., 2006; MOLINARI, 2009; KINGSTON, 2011).
Os produtos naturais isolados de micro-organismos têm importância no desenvolvimento de agroquímicos menos danosos à saúde humana, mas principalmente, no desenvolvimento de medicamentos, sendo, os fungos, importantes organismos utilizados nesta prática (PINTO et al., 2002). Esse fato advém dos avanços no campo da biotecnologia, aliado ao emprego de técnicas
modernas de fracionamento químico, elucidação estrutural e ―screening‖ na busca
4 micro-organismo submetendo-o a diferentes condições de cultivo, para que assim, possa se obter uma diversidade de metabólitos secundários, candidatos a novas moléculas bioativas, técnica conhecida como OSMAC (one strain, many active compounds).
1.2. OS FUNGOS E SUA RELAÇÃO COM SUBSTÂNCIAS BIOATIVAS
Fungos são classificados como seres eucarióticos, uninucleados, como as leveduras, ou multinucleados, como se observa em fungos filamentosos ou bolores (MARINHO et al., 2007). Os fungos filamentosos possuem hifas e estas podem crescer formando uma massa filamentosa, o micélio (BRIDGE, SPOONER, 2001). São aeróbios, com nutrição heterotrófica por absorção e armazenamento de glicogênio (LACAZ et al., 2002), são encontrados em diversos ambientes, como em água salgada e doce, solo, plantas, animais, alimentos, entre outros. São classificados ainda, de acordo com as características dos esporos sexuais e corpos de frutificação, com os ciclos de vida e com as características morfológicas dos micélios, sendo denominados fungos perfeitos e imperfeitos, que apresentam todos os estágios sexuais e os que não os apresentam, respectivamente (MADINGAN et al., 2004). Estima-se que o ecossistema detenha cerca de 1,5 milhões de espécies fúngicas diferentes, no entanto somente 5% desse total foram descritos, e apenas 16% desse percentual foram estudados (PINTO et al., 2002).
5 Figura 1. Classes de metabólitos secundários fúngicos.
6 Apesar dessa gama de aplicações atribuídas aos produtos naturais originários de fungos, os medicamentos são, sem dúvida, os alvos mais importantes na pesquisa, devido à necessidade de novas farmacoterapias e ao mercado financeiro que os medicamentos movimentam. Um exemplo disto é o fato de que, em pesquisa publicada em 2002, apontou-se que, no mercado mundial, seis dos vinte medicamentos mais vendidos, foram obtidos in natura ou por transformação química de metabólitos provenientes de fungos (PINTO et al,. 2002). Muitas classes de fármacos originárias de metabólitos fúngicos podem ser citadas, como antifúngicos, antitumorais, imunossupressores, inibidores enzimáticos, hipocolesterolêmicos, antiparasitários, anti-inflamatórios, mas principalmente, antibióticos (DEMAIN, SANCHEZ, 2009; KINGSTON, 2011).
A pesquisa por metabólitos secundários de fungos é antiga, porém, o primeiro deles de notória eficácia na indústria farmacêutica foi a penicilina, substância produzida pelo fungo Penicillium chrysogenun (TAKAHASHI, LUCAS, 2008), descoberta acidentalmente pelo pesquisador Fleming em 1928, que impulsionou o interesse em se estudar micro-organismos como fonte de novos antibióticos.
Apesar de descoberta no final da década de 20, somente em 1940 a penicilina G (1) foi introduzida no mercado. Esta substância, isolada como um pó amarelo, foi amplamente utilizada como um potente agente antibacteriano de amplo espectro durante a 2ª guerra mundial, impedindo a morte de muitos soldados (DEMAIN, SANCHEZ, 2009; GUIMARÃES et al., 2010).
O H N N O S OH O 1
Penicilinas são classificadas de várias formas, como, por exemplo, quanto à sua origem, podendo ser naturais, como é o caso da penicilina G (1) ou semi-sintéticas, como a amoxicilina (13) e a oxacilina (14). As penicilinas possuem, em
-7 lactâmico, ao qual se liga uma cadeia lateral sendo, este último, junto com a distorção da geometria planar do sistema bicíclico, essenciais para atividade antibacteriana das penicilinas (MOORE, NYGREN, 2004; MOREIRA, 2009). Além disso, a cadeia lateral é responsável por determinar as características antibacterianas e farmacológicas de cada uma das penicilinas (MOREIRA, 2009). Para a síntese de penicilinas, utilizam-se como precursores, substâncias contendo
anéis β-lactâmicos produzidas microbiologicamente que são subseqüentemente derivatizados. OH NH2 H N N O S O OH N O S O OH H N C
OHC N
O
13 14
São conhecidas seis diferentes tipos de penicilinas de origem natural, das quais duas são usadas como medicamentos antibacterianos, a benzilpenicilina (penicilina G) (1) e a fenoximetilpenicilina (penicilina V) (15) (MOORE, NYGREN, 2004). O O H N N O S OH O 15
Outro antibiótico β-lactâmico produzido por micro-organismos, a cefalosporina C (16), pertence à classe das cefalosporinas, consideradas
antibióticos β-lactâmicos de 2ª geração. A cefalosporina C foi isolada pela primeira vez do fungo Cephalosporium acremonium em 1955 e deu origem a vários outros antibióticos semi-sintéticos. Cefalosporinas também possuem, em sua estrutura,
8 (BRULE, MARCHLAND-BRYNAERT, 2007). As cefalosporinas semi-sintéticas são classificadas em cefalosporinas de primeira geração (ex. cefalotina), de segunda geração (ex. cefaclor), de terceira geração (ex. cefotaxima) e de quarta geração (ex. cefepima) (BRUGUERAS, GARCÍA, 1998), possuindo, todas, a mesma estrutura básica com variações nos substituintes (R1 e R2) (17).
Uma 3ª geração de antibióticos β-lactâmicos são os carbapenemos (18), descobertos na década de 70. Os carbapenemos possuem, igualmente aos outros
antibióticos β-lactâmicos, o anel β-lactâmico, porém este está fundido a um anel carbocíclico de cinco membros. Como fármaco representante dessa classe, pode ser citado o imipenemo (19) (SINGH, BARRETT, 2006).
S N H N O O COOH O O HO O NH2 S N H N R2 COOH O R1 O
16 17
N R
CO2H H O OH H N H3C
COOH O OH H H S HN NH 19 18
9 Figura 2. Linha de tempo apresentando as classes de antibióticos utilizados na clínica. Compostos listados em fonte normal são derivados de produtos naturais e, os listados em itálico são derivados de origem sintética.
FONTE: Adaptado de SINGH e BARRETT, 2006.
Outra classe de substâncias biotivas produzidas por fungos filamentosos são os antifúngicos. A descoberta de antibióticos antifúngicos data de 1939 com o isolamento do primeiro antifúngico, a griseofulvina (20), isolada do fungo
Penicillium griseofulvum. A griseofulvina inibe o crescimento de várias espécies fúngicas, como Epidermophyton, Microsporum e Trichophyton, agindo como fungistático e, dependendo da concentração usada, pode inibir a divisão celular (GUPTE et al., 2002).
20 O O OCH3 O OCH3 Cl H3CO
H3C H
1930 1940 1950 1960 1970 1980 1990 2000 Sulfa 1936 Fenilpropanóides Cloranfenicol 1946 Aminoglicosídeos Estreptomicina 1946-1960 Macrolídeos Eritromicina 1952
2ª geração β-lactâmicos Cefalosporinas 1962 Β-lactâmicos Penicilina 1929-1941 Policetídeos Tetraciclinas 1949 Glicopeptídeos Vancomicina 1956-1975 Quinolonas Ácido nalidíxico
1960-1962 Oxazolidinonas Linezolida
1979-2000
3ª geração β-lactâmicos Carbapenemos
1975-1985
10 Nistatina (21) e anfotericina B (22), também são substâncias com atividade antifúngica, pertencentes ao grupo dos macrolídeos poliênicos, porém, têm o uso clínico restrito, devido à alta toxicidade e baixa especificidade (GUPTE et al., 2002).
21 CH3 O OH O O O CH3 HO
H3C
OH OH OH OH
OH O OH COOH NH2 OH CH3 OH 22
Atualmente, inibidores da síntese de β-D-glucano na parede celular dos fungos estão sendo utilizados no tratamento de aspergilose invasiva em pacientes que apresentam intolerância aos tratamentos convencionais (BOWMAN et al., 2002). Um importante grupo desses inibidores é o das equinodinas, que englobam moléculas que contem, em sua estrutura, um anel hexapeptídico N-acetilado e que se diferenciam entre si pelos substituintes ligados a esse anel (VICENTE et al,. 2003). Um fármaco pertencente a esse grupo é a caspofugina (23), que exibe atividade in vitro contra uma ampla variedade de leveduras, fungos filamentosos e dimórficos clinicamente importantes, inclusive Candida spp. e Aspergillus spp
11
efetiva na melhora ou eliminação dos sinais clínicos e sintomas da candidíase (WAKAI et al., 1998).
HO NH O N HN CH3 HO N H R5 OH R4 HN O N NH R2 O R1 HO OH OH OH R3 O O O
R1 R2 R3 R4 R5
23 H NH2(CH2)2CHOH H NH(CH2)2NH O
24 OHSO3 NH2(CO)CH2CHOH CH3 OH
O
N O
O
Fungos filamentosos também produzem estatinas, substâncias com ação hipocolesterolêmica, ou seja, que agem reduzindo os níveis sanguíneos de colesterol. Em 1975, no Japão, isolou-se, pela primeira vez, do fungo Penicillum
brevicompactum, a mevastatina (25), posteriormente obtida também de Penicilium
12 colesterol, tendo como substrato natural o hidroxi-metil-glutaril-Co-A, levando ao ácido mevalônico ou à mevalo-lactona. Este fármaco representa uma autêntica inovação terapêutica para controle do colesterol plasmático (VIEGAS Jr. et al., 2006). H O O O O HO H O O
H3C
O O HO
H3C
CH3 CH3
H O O O O HO
25 12 26
Outras substâncias com importantes atividades biológicas também isoladas de micro-organismos são os imunossupressores ciclosporina A (3), rapamicina (27) e ácido micofenólico (28), tendo, este último, originado o fármaco semi-sintético micofenolato de mofetila (29) (USUI, et al., 2006).
N N N H N
N N
O O O
O H HO O O N H N N H N N H O O O O O O Me OH OMe OH O O O OMe H OH Me O N O Me
Me OMe Me Me Me
13 O O O OH OH O O O O OH O O N O
28 29
No entanto, alguns fungos produzem também substâncias tóxicas para os seres vivos, denominadas micotoxinas. As micotoxinas são substâncias naturais produzidas pela estrutura micelial dos fungos filamentosos, não tendo significado bioquímico no crescimento e desenvolvimento destes (HUSSEIN, BRASEL, 2001). São encontrados mais de 400 destes compostos e estes são classificados de acordo com suas características químicas e origem biossintética (BENNETT, KLICH, 2003). Entre as micotoxinas mais importantes encontram-se as aflatoxinas, como a aflatoxina B1 (10), ocratoxinas, como a ocratoxina A (30), citreoviridinas, como a citrinina (31), fuminosinas, como a fuminosina B1 (32), patulina (33) e alcalóides do ergot, como a ergotamina (34) (PINTO et al., 2002; BENNETT, KLICH, 2003). Surpreendentemente, algumas micotoxinas, como a di-hidroergotamina (35) e a metilergonovina (36) possuem relevantes propriedades farmacológicas, sendo utilizadas na medicina humana no tratamento da enxaqueca e no controle de hemorragias pós-parto, respectivamente (MOSS, 2002; MOREIRA, 2009). O O O O O OCH3 N H OH O O Cl O H CH3 COOH
14
O OH
HOOC
O
CH3 CH3 CH3
CH3
H3C
O C C
OH OH
CH3
O
CH3 OH
O C OH OH O O O OH O OH NH2
31 32
O O O OH 33 HN N H CH3 H O N H CH3 O N O OH N H
H CH2
O 34 HN N H CH3 H O N H CH3 O N O OH N H
H CH2
O HN H N O NH OH
35 36
1.3. O FUNGO Paecilomyces lilacinus
Paecilomyces lilacinus (Figura 3) é uma espécie de fungo filamentoso que
15 As colônias de espécies deste gênero apresentam inicialmente formas planas e flocosas, mas à medida que amadurecem, desenvolvem textura aveludada ou pulverulenta. A cor das colônias pode ser altamente variada (FISHER, COOK, 2001), sendo que as colônias de Paecilomyces lilacinus
apresentam conidióforo pigmentado, parede rugosa e reverso incolor ou púrpura (LACAZ et al., 2002).
Figura 3. Foto da aparência do fungo P. lilacinus cultivado em meio de cultura ágar batata dextrosado (A) e microfotografia dos conidióforos (B).
FONTES:http://www.biotec.or.th/tncc/dbstore/StrainDetails.asp?Genus=Paecilomyces&Species=lil acinus&id=82&DB=BCC [acessado em: 12/07/11]
http://www.pf.chiba-u.ac.jp/gallery/fungi/p/Paecilomyces_lilacinus_SEM.htm [acessado em 12/07/11]
O gênero Paecilomyces é morfologicamente similar ao gênero Penicillium e, no ano de 1971, já eram descritas 31 espécies diferentes. As espécies mais comuns são P. variotti e P. lilacinus (SAMSON, 1974), podendo esta última, no Brasil, ser encontrada em diferentes tipos de solo, cultivados ou não, em profundidades variáveis de 0-40 cm ou mais (CARNEIRO, 1986) e em estruturas marinhas, como esponjas e outros (ELBANDY et al., 2009).
16 (FIELDS et al., 1996), além de α-pironas (40-41) e ciclo-hexenonas (42-43), isoladas de P. lilaninus, derivados de uma esponja marinha (ELBANDY et al., 2009). Outras substâncias foram isoladas, recentemente, de Paecilomyces sp. SC0924, seis novas lactonas β-resorcíclicas (44-49) denominadas paecilomicinas A-F e outras cinco já conhecidas, na qual, algumas mostraram atividade anti-plasmodial contra Plasmodium falciparum (XU et al., 2010).
H H HO NH HO O O O O O OH OH R
37 38 R = CH3 / 39 R = CH2OH
O O R2 R1 R3 O R3 O R1 OCH3 R2
40 R1 = OH, R2 = CH3, R3 = H 42 R1 = O
O
, R2 = OOH, R3 = OCH3 41 R1 = CH3, R2 = H, R3 = H
43 R1 = OOH, R2 = O
O
, R3 = OCH3
O O OH
OH H3CO
O OH H
OH 44 45
O O
H3CO
OH
O
HO OH
OH
17 O
OH
H3CO
OH OH R2 R1 OH O OH O O OH OH H3CO
R1 R2 OH
46 R1 = H, R2 = OH
47 R1 = OH, R2 = H
48 R1 = H, R2 = OH
49 R1 = OH, R2 = H
P. lilacinus possui distribuição cosmopolita e seus metabólitos secundários são amplamente utilizados no controle biológico de nematóides, sendo, muitas vezes, a produção desses metabólitos induzida pela presença dos nematóides no meio (SANTIAGO et al., 2006). Os metabólitos secundários produzidos por esta espécie são diversos, variando com o meio e as condições às quais estão submetidos os micro-organismos.
1.4. ANTIBACTERIANOS
As doenças infecciosas representam, atualmente, umas das principais causas de morte da população humana, devido ao surgimento de micro-organismos multirresistentes aos antibióticos, ocasionada por diversos fatores, entre eles, o uso constante e irracional de antibióticos (DAFFRE et al., 2001; ANTUNES et al., 2006), o surgimento de organismos oportunistas fatais, associadas à AIDS, quimioterapia anti-neoplásica e transplantes (PENNA et al., 2001). Diante de tal situação, a pesquisa por novos agentes antimicrobianos eficazes é de grande relevância, alargando o campo da pesquisa nesta área.
18 com a retirada de plantas e algas da natureza, além de os fungos, poderem ser cultivados em grande escala em fermentadores (TAKAHASHI, LUCAS, 2008).
Os antibióticos são compostos naturais ou sintéticos que inibem o crescimento ou provocam a morte de bactérias e fungos (GUIMARÃES et al., 2010), sendo, as principais classes, mostradas na Tabela 1.
Tabela 1. Principais classes e alvos de antibióticos
Antibióticos Alvo
β-lactâmicos (penicilinas,
cefalosporinas,carbapeninas, monobactamas) Enzima transpeptidase
β-lactâmicos (oxapeninas, sulfoxapeninas) Enzima β-lactamase Macrolídeos, lincosamidas, estreptograminas
(dalfopristina e quinupristina), cloranfenicol,
oxazolidinonas (linezolida) Subunidade 50S ribossômica
Aminoglicosídeos, tetraciclinas Subunidade 30S ribossômica
Glicopeptídeos (vancomicina, teicoplanina) Dipeptídeo terminal D-Ala-D-Ala do peptideoglicano
Peptídeos não ribossomais (bacitracina,
gramicidina C, polimixina B) Membrana plasmática
Lipodepsipeptídeos (daptomicina) Membrana plasmática
Rifampicina RNA polimerase dependente de DNA
Fluoroquinolonas Enzima DNA girase
Sulfonamidas Enzima di-hidropteroato sintetase
FONTE: Adaptado de GUIMARÃES et al., 2010.
19
N N O
O O N N Cl Cl O
H3C
Cl Cl N N N O O
O N N N
N N O F F OH N N N N N N
no mercado, novos fármacos antifúngicos como as aureobasidinas, que agem inibindo a síntese da membrana plasmática dos fungos (PELÁEZ, OLGA, 2009) e
o posaconazol, um triazólico de segunda geração (TELLES, 2007).
50 51 52
20 Gráfico 2. Distribuição da produção de antibióticos por micro-organismos.
As infecções são causadas por uma variedade de micro-organismos, sendo alguns mais patogênicos que outros. Colombo e Guimarães (2003) mostraram que as leveduras do gênero Candida são responsáveis por cerca de 80% das infecções fúngicas hospitalares, sendo a principal causa de infecção fúngica sistêmica, com taxa de mortalidade geral de fungemias da ordem de 40 a 60%. Quanto às infecções bacterianas, algumas das espécies mais patogênicas compreendem
Pseudomonas aeruginosa, Escherichia coli e Staphylococcus aureus. Diante o exposto, faz-se necessária a descoberta de novas substâncias antibióticas que atuem combatendo as infecções.
1.5. ANTICOLINESTERÁSICOS
A doença de Alzheimer é uma afecção neuro-degenerativa progressiva e irreversível, que acarreta perda da memória e diversos distúrbios cognitivos (SMITH, 1999). Esta patologia acomete cerca de 1,5% da população com idade entre 65-69 anos, 21% entre 85-86 e 39% acima dos 90 anos, sendo presente em aproximadamente 15 milhões de pessoas em todo o mundo (VIEGAS Jr. et al., 2004). Os sinais e sintomas estão relacionados à redução de neurotransmissores cerebrais, como acetilcolina, noradrenalina e serotonina (BRYNE, 1998).
0% 5% 10% 15% 20% 25% 30% 35% 40% 45% 50%
Bactérias Fungos Actinomycetales
21 NH2 O NH Me O N N H Me Me Me
O tratamento da doença de Alzheimer é baseado na tentativa de restauração da função colinérgica. Dessa forma, a elevação do nível da acetilcolina é realizado pela utilização de inibidores da acetilcolinesterase (IAchEs), enzima que atua na degradação desses neurotransmissores na fenda sináptica. Atualmente, há uma diversidade de substâncias sendo pesquisadas para tal fim, o que se tornou possível graças à modernização dos ensaios, que agora permitem a utilização da enzima AchE para avaliação rápida de grandes quantidades de amostras. Este bioensaio sensível é capaz de detectar e selecionar amostras com ação anticolinesterásica (TREVISAN, 2003).
A tacrina (53) foi o primeiro fármaco sintético aprovado pelo FDA para o tratamento da doença de Alzheimer, porém apresenta sérios efeitos colaterais. Outros fármacos, como fisostigmina (54) e rivastigmina (55) também tem sido utilizados. Porém, a galantamina (56), um alcalóide isolado de plantas da família Amaryllidaceae, apresenta ação seletiva, reversível e competitiva para inibir a acetilcolinesterase (TREVISAN et al., 2006), sendo considerada mais efetiva do que a fisostigmina e a tacrina (INGKANINAN et al., 2000; RHEE et al., 2001). A galantamina tem sido utilizada como protótipo para novos fármacos anticolinesterásicos. Outra substância anticolinesterásica é a Huperzina-A (57), isolada de Huperzia serrata. Esta substância mostrou potente atividade IAhE e seu uso sistêmico pode aumentar a liberação de ACh, dopamina e norepinefrina, sendo que o aumento da concentração de ACh pode persistir por até 6 h após a administração do chá desta planta (CHANG , 2000; RAJENDRAN et al., 2002).
A atividade anticolinesterásica de extratos da planta Ginkgo biloba (VIEGAS Jr., et al., 2004), aliada à diversidade estrutural dos IAchEs conhecidos e à possibilidade de se estudar diferenciados modos de ação, estimularam o estudo químico de várias espécies vegetais e de micro-organismos, que pudessem fornecer novas substâncias anticolinesterásicas.
22 O
O N CH3
CH2CH3
H3C
CH3
CH3 O
MeO
H
N
OH
Me
55 56
H2N
H3C
NH O CH3
57
Trevisan e colaboradores (2003) realizaram um estudo com 50 extratos de 38 espécies de variados gêneros vegetais, para identificar, nestes extratos, substâncias inibidoras da enzima AchE. Para a pesquisa, foram utilizados o ensaio bioautográfico de Rhee et al e o ensaio de Ellmann, em microplacas. Os autores observaram que Paullinia cupana (guaraná), Amburana cearensis (cumaru) e
Lippia sidoides (alecrim-pimenta) foram as espécies que demonstraram os
melhores resultados, inibindo de 65-100% da atividade enzimática.
Produtos naturais produzidos por micro-organismos também são candidatos a novas fontes de substâncias anticolinesterásicas, como as quinolactacina A1 (58) e quinolactacina A2 (59) isoladas de uma cultura de Penicillium citrinum 90648 (KIM et al., 2001) . Estudos como estes evidenciam a contribuição e a relevância da pesquisa de metabólitos fúngicos com a finalidade de sua utilização no desenvolvimento de novos fármacos anticolinesterásicos.
N HN
O O
CH3 H3C
CH3 N HN O O CH3 H3C
H3C
23 1.6. TÉCNICA ―OSMAC‖ (One strain-many active compounds)
Como visto anteriormente, produtos naturais produzidos por micro-organismos são alvos de grande interesse de pesquisadores e da indústria farmacêutica, principalmente após a descoberta do antibiótico penicilina, isolado de um fungo. Este fato pode ser atribuído a fatores como a alta diversidade química das moléculas produzidas no metabolismo de micro-organismos e à facilidade de manuseio, pouco tempo e espaço que demandam o cultivo dos mesmos (ELIAS et al., 2006). Além disso, técnicas estão sendo desenvolvidas para otimizar, direcionar e/ou diversificar a produção de metabólitos secundários de micro-organismos, sendo que essas técnicas podem ser divididas em dois tipos: técnicas moleculares e técnicas de cultivo onde parâmetros do mesmo são alterados (GROSS, 2007). Esta última vem sendo utilizada há algum tempo por pesquisadores que trabalham com produtos naturais de micro-organismos e é denominada OSMAC (one
strain-many active compounds).
O método OSMAC baseia-se no cultivo de uma determinada espécie de micro-organismo variando-se alguma (s) condição (ões) de incubação. São vários os parâmetros que podem ser variados, dentre eles, a composição do meio de cultura, aeração do meio, alterando a rota metabólica daquele micro-organismo (SALEEM et al., 2009), período de cultivo, pH, temperatura e a adição de agentes para induzir ou inibir a produção de determinado (s) metabólito (s) (BODE et al., 2002; BUGNI, IRELAND, 2004). Uma importante ferramenta aliada ao OSMAC é a utilização de modelos estatísticos para se delinear experimentos (PIMENTA, et al., 2010), o que pode otimizar o crescimento microbiano, aumentando a produção de metabólitos bioativos e direcionando a pesquisa para a produção de determinada (s) substância (s) (COCKSHOTT, SULLIVAN, 2001; CHAKRAVARTI, SAHAI, 2002; FURTADO et al., 2005; SAYYAD et al., 2007; TULLY et al., 2007).
24
HO
OH
CHO
O OH
Cl Cl
RO
60
Fatos como este demonstram que a produção de substâncias antibióticas pode ser induzida em resposta ao antagonismo microbiano (BURGESS et al., 1999) e que a produção de metabólitos secundários específicos pode ser aumentada 400 vezes quando espécies são cultivadas na presença de um antagonista (SONNENBICHLER et al., 1994). Pestalone mostrou potente atividade antibacteriana contra Staphylococcus aureus resistente à meticilina (MIC = 37 ng/mL) e Enterococcus faecium resistente à vancomicina (MIC = 78 ng/mL).
Wang e colaboradores (2011) realizaram uma pesquisa na qual, utilizando a técnica OSMAC, isolaram três novas citocalasinas (alcalóides fúngicos) (61, 62 e 63) e cinco novos análagos, as aspocalasinas, de uma cultura de Spicaria elegans. A obtenção desses produtos foi decorrente da variação do meio de cultivo e da adição de aminoácidos precursores dessa molécula, pois o tipo de citocalasina produzido depende do aminoácido incorporado à sua estrutura. As moléculas 61, 62 e 63 foram avaliadas quanto à atividade citotóxica, contra linhagens celulares.
HN O
OH O
OH
HO HN O
O O
O OH
O
25 HN
O O O
O
O
OH 63
As substâncias 61 e 62 mostraram grande atividade citotóxica contra a linhagem A-549 com IC50 de 8,2 µM e 20,0 µM, respectivamente.
Em outro estudo, realizado por Bode e colaboradores (2000), induziu-se a mutação do fungo Sphaeropsidales sp. (linhagem F-249707) por exposição à luz UV. Esta espécie de fungo, produtora de espirobisnaftalenos, policetídeos com diferentes atividades biológicas, como por exemplo, a cladospirona bisepóxido (64), após mutação, produziu um novo policetídeo, denominado mutolide (65). A nova substância foi submetida ao teste antibacteriano, contra B. subtilis e E. coli, produzindo halo de inibição de 10 mm na placa.
O O
O
OH OH
O O
O O OH OH
H3C
64 65
26 N
H HO
O OCH3
OCH3 H OH
O
NH
HO
O OCH3
OCH3
H OH
O
66 67
N H HO
O OCH3
OCH3 H OH
O HO
diasteroisômeros 68-69
As aspoquinolonas 66 e 67 exibiram grande atividade citotóxica contra células fibroblásticas L-929 de ratos com IC50 de 10,6 e 11,4 lg mL-1, respectivamente e bom efeito antiproliferativo de células leucêmicas K-562 (IC50 =17,8/21,2 lg mL-1), respectivamente.
27
28 2. OBJETIVO
2.1. OBJETIVO GERAL
Realizar o estudo químico de metabólitos secundários do fungo filamentoso Paecilomyces lilacinus, utilizando-se a técnica OSMAC em seu cultivo, para a obtenção de substância (s) com atividade (s) antibacteriana (s), antifúngica (s) e anticolinesterásica (s).
2.2. OBJETIVOS ESPECÍFICOS
Cultivar o fungo P. lilacinus, em diferentes condições, para a obtenção dos extratos brutos;
Selecionar, por meio de testes biológicos, as condições de cultivo que levarem aos extratos mais ativos;
Produzir os extratos mais ativos em quantidades adequadas ao seu fracionamento;
Submeter os extratos brutos selecionados à técnicas de cromatografia para o isolamento de constituintes químicos;
Elucidar a estrutura das substâncias isoladas utilizando técnicas espectrométricas;
29
30 3. PARTE EXPERIMENTAL
3.1. EQUIPAMENTOS
Agitador de tubos Phoenix, modelo AP 56, série 10359;
Agitador magnético Corning;
Autoclave vertical Fanen, modelo 415/3, série J03610;
Balança analítica Quimis, modelo Q-ILA2104, 210g/0,1 mg;
Balança eletrônica Digimed KN1000C, classe exatidão II, série 04G6;
Banho Büchi waterbath B-480;
Banho de ultra-som UltraCleaner 800ª com aquecimento;
Bomba de pressão Quimis, modelo Q-355B1, série 806377;
Bomba de pressão Millipore WP6111560;
Bomba de vácuo Tecnal TE-0581;
Capela de exaustão em madeira;
Cabine de segurança biológica VECO, modelo JLF 912, série FL 5799;
Câmera fotográfica Sony Cyber-shot 7.2 mega pixels;
Chapa de aquecimento Laboratory Stirrer, modelo PC-320, série 440893;
Cromatógrafo a gás HP5890;
Cromatógrafo líquido Waters Alliance 2695;
Colunas de vidro;
Espectrofotômetro Bioespectro, modelo SP-22;
Espectrômetros BRUKER AVANCE DPX200 e DRX400;
Espectrômetro de massas MicroTOF, Bruker Daltonics;
Estufa de secagem Fanen Ltda, modelo 002 CB;
Estufa para meio de cultura Quimis Q-316.12, série 807.131;
Estufa para placa cromatográfica Quimis G-317 8122;
Incubadora B.O.D. MA 415/ Marconi;
Lâmpada UV 254 nm Mineralight UVG-54;
Leitora de microplaca Thermo Plate, modelo: TP-READER;
Mesa agitadora Tecnal, modelo TE-421;
31
Microondas Máster Cooking CCE M-500;
Micropipeta automática Digipet de 5-50 µL, série 05012635;
Micropipeta automática Finnpipette 4027, Labsystems de 200-1000 µL, série E19971;
Micropipeta automática Kacil de 100 µL, série 0037201;
Micropipeta automática multicanal Digipet de 20-100 µL;
Paquímetro digital 150 mm/0,01mm, Jomarca;
Placas de vidro para CCD;
Ponto de fusão Gehaka, modelo PF 1000, série 0530/06001020;
Purificador de água Millipore- Milli Q;
Refrigerador Consul Pratice 230;
Refrigerador Eletrolux Double D440;
Rotavapor Büchi Waterbath, modelo B-480;
Rotavapor Fisaton, modelo 802, série 531782;
Termômetro Incoterm, série 313675.
3.2. REAGENTES
Ágar batata dextrosado- PDA, Acumedia;
Caldo de batata dextrosado- PDB, Acumedia;
Caldo infusão de cérebro e coração- BHI, Acumedia;
Cloreto de Sódio, Vetec;
Discos com cloranfenicol (30 µg/disco), Sensidisc;
Discos com miconazol (50 µg/disco), Sensifungidisc- CECON;
Iodo sublimado;
Meio de cultura antibiótico, Difco TM ;
Sílica gel para CCS, Vetec;
Sílica gel para CCD, Sigma;
Solventes P.A: acetato de etila, acetona, álcool isopropílico, álcool metílico, clorofórmio, diclorometano, dimetilsulfóxido, éter etílico, hexano, piridina;
32
Kit SIGMA para teste de inibição da enzima aceticolinesterase: Albumina bovina sérica B4287-25G, Ácido 5,5‘-ditiobis- [2-nitrobenzóico] (DTNB) D8130-5G, Tris/HCl 0,1 M pH 8, Iodeto de acetilcolina (ACTI) A5751-D8130-5G, Acetilcolinesterase liofilizada tipo V-S C2888.
3.3. MEIOS DE CULTURA
3.3.1. Meio de cultura BHI
BHI (Brain heart infusion) ... 37,0 g/L Água destilada qsp
3.3.2. Meio de cultura sólido antibiótico
Meio antibiótico ... 30,5 g/L Água destilada qsp
3.3.3. Meio caldo batata dextrosado
Caldo batata dextrosado ... 24,0 g/L Água destilada qsp
3.3.4. Meio ágar batata dextrosado
33 3.4. CROMATOGRAFIA LÍQUIDA DE ALTA EFICIÊNCIA ACOPLADO À DETECTOR DE ARRANJO DE DIODOS (CLAE-PDA)
Os extratos brutos, obtidos a partir do cultivo do fungo P. lilacinus em diferentes condições, foram analisados por CLAE-PDA para a obtenção dos perfis cromatográficos dos mesmos, a fim de se verificar o perfil da produção de metabólitos secundários em função dos parâmetros estudados. As amostras analisadas por CLAE-PDA foram devidamente filtradas com unidades filtrantes MILLEX LCR (0,45µm) PTFE modificadas para solventes orgânicos - Millipore. Os extratos fúngicos foram analisados utilizando-se um cromatógrafo líquido Waters Alliance 2695, equipado com bomba quaternária, auto-injetor, detector de arranjo diodo (PDA) e forno para coluna. As separações foram realizadas em uma coluna de fase reversa C18 Shimadzu ODS (150 x 4,6 mm; 5 µm). O volume de amostra injetado foi de 20,0 µL, na concentração de 1,0 mg/mL. O sistema cromatográfico foi operado utilizando-se o software EMPOWER.
O método empregado na corrida cromatográfica apresentou as seguintes características: a fase móvel consistiu de uma mistura de H2O e metanol e o gradiente linear de eluição usado foi H20-MeOH 90:10 a 0:100 em 30 min. O gradiente foi retornado ao valor inicial e mantido por 5 min, para equilíbrio do sistema, antes da injeção da próxima amostra. A fase móvel utilizada (H20 – MeOH) foi filtrada e desgaseificada por 30 min em banho de ultra-som antes do experimento. O fluxo do eluente foi de 0,8 mL/min.
3.5. CROMATOGRAFIA A GÁS (CG)
34 comparadas com óleo de soja (12,0 mg) hidrolizado, metilado e analisado sob as mesmas condições.
3.5.1. Preparo das amostras para análise em CG
I. Hidrólise de lipídeos
Dissolveram-se, em tubo criogênico de capacidade de 2,0 mL, ~10,0 mg do óleo em 100 µL de uma solução de etanol (95%)/ hidróxido de potássio 1 mol/L (5%). Após agitação em vórtex por 10 s, o óleo foi hidrolisado em um forno de micro-ondas doméstico (Panasonic Piccolo), à potência de 80 W (Potência 2), durante 5 min. Após resfriamento, adicionaram-se 400 L de ácido clorídrico a 20%, uma ponta de espátula de NaCl e 600 L de acetato de etila. Após agitação em vórtex por 10 s e repouso por 5 min, uma alíquota de 300 L da camada orgânica foi retirada, colocada em tubos de microcentrífuga e seco por evaporação, obtendo-se assim os ácidos graxos livres (adaptado de W. W. Christie, Gas Chromatography and Lipids, 1989, Pergamon Press).
II. Metilação dos ácidos graxos
Os ácidos graxos livres foram metilados com 100 µL BF3 / metanol (14%), usando-se aquecimento durante 10 min em banho de água a 80 ºC. Foram, em seguida, analisados por cromatografia a gás.
3.6. RESSONÂNCIA MAGNÉTICA NUCLEAR (RMN)
35 3.7. ESPECTROSCOPIA DE MASSAS POR IONIZAÇÃO POR
ELECTROSPRAY (EM-ESI)
Os espectros de massas foram obtidos em espectrômetro de massas marca Bruker Daltonics, modelo MicroTOF, equipado com fonte de ionização electrospray operando no modo positivo em alguns espectros e no modo negativo em outros, no Laboratório Central Analítica do Instituto de Química da Universidade de São Paulo. Soluções MeOH/água dos compostos foram preparadas e analisadas na faixa de m/z entre 200 e 500 daltons.
3.8. MANUTENÇÃO DOS MICRO-ORGANISMOS
Os micro-organismos utilizados neste trabalho pertencem à coleção microbiológica do Laboratório de Biotecnologia e Bioensaios do Departamento de Química da Universidade Federal de Minas Gerais. Os fungos encontravam-se armazenados na forma de suspensão de esporos em glicerol 12% a -86 ºC. Para a utilização diária, estes se encontravam armazenados em geladeira (a 8 ºC), em tubos de ensaio contendo ágar batata dextrosado.
3.9. CULTIVO DOS MICRO-ORGANISMOS
Todo o procedimento de obtenção do pré-inóculo e inóculo da bactéria e do fungo foi realizado em cabine de segurança biológica sob condições assépticas, próximo à chama do bico de Bunsen. Os materiais e reagentes utilizados foram previamente esterilizados em autoclave a 121 ºC durante 20 min.
3.9.1. Inoculação da bactéria Salmonella typhimurium
36 Preparo do inóculo: o pré-inóculo contendo a bactéria (S. typhimurium) foi transferido para um Erlenmeyer contendo 200 mL de meio de cultura (BHI), em duplicata. Após inoculação da bactéria, os frascos foram incubados em estufa a 37 ºC, durante 24 h.
3.9.2. Cultivo do fungo Paecilomyces lilacinus
Preparo do pré-inóculo I: com o auxílio de uma alça de platina, foi realizada a raspagem do micro-organismo armazenado em um tubo de ensaio, mantido em geladeira (a 8 ºC). O micro-organismo foi, em seguida, inoculado em outro tubo de ensaio contendo meio de cultura ágar batata dextrose (PDA). O fungo foi cultivado durante sete dias, sem agitação, à temperatura ambiente (25 ºC).
Preparo do pré-inóculo II: após o crescimento do fungo, o mesmo foi inoculado em Erlenmeyers contendo 200 mL de meio de cultura líquido caldo batata dextrose (PDB). Em seguida, foi realizada a homogeneização do meio com o micro-organismo. O fungo foi cultivado durante sete dias, sob agitação, à temperatura ambiente (25 ºC). Este procedimento foi realizado para que se obtivesse quantidade suficiente de biomassa, para que pudesse então, ser iniciado o experimento de cultivo do fungo em diferentes condições.
Preparo dos inóculos: após obtenção da biomassa do fungo, o mesmo foi inoculado em Erlenmeyers contendo meio de cultura líquido caldo batata dextrose (PDB). Em seguida, foi realizada a homogeneização do meio com o micro-organismo.
O experimento foi iniciado com o preparo de 28 frascos (14 frascos sob condição estática e 14 frascos sob condição de agitação em agitador orbital). O fungo foi cultivado durante 21 dias, à temperatura ambiente (25 ºC).
37 Tabela 2. Condições de inoculação do fungo P. lilacinus
Frasco Conteúdo
1 PDB + fungo 2 PDB, controle
3 PDB + 1 mL do inóculo bacteriano e fungo 4 PDB + 1 mL do inóculo bacteriano
5 PDB + 1 mL do inóculo bacteriano, adicionou-se o fungo após 7 h; 6 PDB + 1 mL do inóculo bacteriano, após 7 h, autoclavou-se o frasco
e inoculou-se o fungo
7 PDB + 1 mL do inóculo bacteriano, após 7 h autoclavou-se o frasco 8 PDB + fungo, após 8 dias, inoculou-se 1 mL do inóculo bacteriano 9 PDB, após 8 dias, inoculou-se 1 mL do inóculo bacteriano
10 PDB + fungo, após 8 dias, inocularam-se 10 mL do inóculo bacteriano
11 PDB, após 8 dias, inoculou-se 1 mL do inóculo bacteriano
12 PDB + fungo, após 8 dias, inocularam-se 10 mL do inóculo bacteriano autoclavado
13 PDB + fungo, após 8 dias, inocularam-se 10 mL do inóculo bacteriano submetido à irradiação de micro-ondas
14 PDB, após 8 dias, inocularam-se 10 mL do inóculo bacteriano submetido à irradiação de micro-ondas
PDB= caldo de batata dextrosado
Oito dias após o inicio do experimento, os frascos contendo os inóculos da bactéria usados no início do experimento foram utilizados da seguinte forma, o primeiro foi submetido à irradiação de micro-ondas por 2 min e, o segundo, autoclavado a 121 ºC, por 20 min. Estes procedimentos foram realizados a fim de se interromper o crescimento bacteriano, para que se pudesse trabalhar somente com o material genético bacteriano. Em seguida, os inóculos bacterianos tratados foram adicionados nos respectivos frascos.
38 cultura foram filtrados a vácuo com o auxílio de funil e papel de filtro, separando-se o filtrado do micélio. O filtrado foi extraído com acetato de etila utilizando-se funil de separação. O procedimento foi realizado por três vezes. O micélio também foi submetido à extração com acetato de etila, e seu extrato combinado com o filtrado orgânico. Em seguida, os extratos orgânicos obtidos foram concentrados em rotavapor a vácuo e transferidos para frascos limpos e previamente pesados. As massas de extratos obtidas encontram-se listadas na Tabela 3.
Os extratos foram submetidos aos testes biológicos e aqueles que apresentaram a melhor combinação dos resultados (maior atividade e perfil por CCD) foram novamente preparados, em escala ampliada, para as etapas posteriores.
Tabela 3. Massa dos extratos do fungo P. lilacinus
Extrato Código do
extrato cultura (L) Meio de extrato (mg) Massa do
1 1 S.A 1,0 115,0
2 2 S.A 1,0 3,7
3 3 S.A 1,0 327,0
4 4 S.A 1,0 265,0
5 5 S.A 1,0 278,0
6 6 S.A 1,0 238,0
7 7 S.A 1,0 12,0
8 8 S.A 1,0 127,0
9 9 S.A 1,0 213,0
10 10 S.A 1,0 206,0
11 11 S.A 1,0 66,0
12 12 S.A 1,0 109,0
13 13 S.A 1,0 106,0
14 14 S.A 1,0 51,0
15 1 C.A 0,2 18,7
16 2 C.A 0,2 4,1
17 3 C.A 0,2 33,7
39 C.A = com agitação S.A = sem agitação
3.10. TESTES DE ATIVIDADE BIOLÓGICA
3.10.1. Avaliação da atividade antimicrobiana – Técnica de difusão em placa utilizando discos de papel (BAUER et al., 1966)
Para a realização do teste de atividade antimicrobiana foram utilizadas as bactérias Gram-positivas Staphylococcus aureus e Listeria monocytogenes, as bactérias Gram-negativas Escherichia coli e Pseudomonas aeruginosa, e a levedura Candida albicans. Discos de papel contendo 30 µg de cloranfenicol foram utilizados como controle positivo para as bactérias e discos contendo 50 µg de miconazol para o fungo; como controle negativo foram utilizados discos de papel contendo o solvente usado na dissolução das amostras.
CONSIDERAÇÕES:
I. Foram utilizadas placas de Petri previamente esterilizadas; II. O teste foi realizado em duplicata;
III. Os halos de inibição formados foram mensurados utilizando-se um paquímetro digital;
… continuação Tabela 3
18 4 C.A 0,2 17,0
19 5 C.A 0,2 23,1
20 6 C.A 0,2 20,3
21 7 C.A 0,2 48,4
22 8 C.A 0,2 6,0
23 9 C.A 0,2 15,2
24 10 C.A 0,2 5,7
25 11 C.A 0,2 13,2
26 12 C.A 0,2 14,6
27 13 C.A 0,2 6,0
40 IV. Os extratos e as substâncias testadas foram consideradas ativas
quando o halo de inibição apresentou valor igual ou maior que 7,5 mm.
Preparo das amostras: uma quantidade de 2,0 mg de cada amostra foi pesada e solubilizada em 1,0 mL de clorofórmio, e 50,0 µL de cada solução foi quantitativamente aplicada em um disco de papel resultando em uma concentração final de 100,0 µg/disco. O solvente foi removido por ar seco.
Todo o procedimento de obtenção do pré-inóculo e inóculo do fungo e da bactéria foi realizado em cabine de segurança biológica sob condições assépticas, próximo à chama do bico de Bunsen. Os materiais e reagentes utilizados foram previamente autoclavados a 121 ºC durante 20 min.
Preparo do pré-inóculo bacteriano: as bactérias estocadas em tubos de ensaio foram raspadas com o auxílio de uma alça de platina e inoculadas em tubos de ensaios pequenos contendo 3,0 mL de meio de cultura BHI. Em seguida, os tubos foram incubados em estufa a 37 ºC durante 8-18 h.
Preparo do inóculo bacteriano: com o auxílio de uma micropipeta, 500 µL do pré-inóculo bacteriano foram transferidos para tubos de ensaio contendo 4,5 mL de água destilada estéril. Os tubos foram homogeneizados e a concentração ajustada comparando-se com o tubo 0,5 da escala de McFarland de turbidez padrão (108 UFC/mL).
41 diâmetro dos halos de inibição e, após 48 h, foi realizada uma nova leitura para a determinação de cepas resistentes.
3.10.2. Avaliação da atividade antimicrobiana – Técnica de microdiluição em caldo
Para a realização do ensaio da atividade antibacteriana foram utilizadas as bactérias Gram-positivas S. aureus e L. monocytogenes, as bactérias Gram-negativas E. coli e P. aeruginosa, e a levedura C. albicans.
Todo o procedimento de obtenção do pré-inóculo e inóculo do fungo e da bactéria foi realizado em cabine de segurança biológica sob condições assépticas, próximo à chama do bico de Bunsen. Os materiais e reagentes utilizados foram previamente autoclavados a 121 ºC durante 20 min.
CONSIDERAÇÕES:
I. Foram utilizadas microplacas de 96 poços (12 colunas e 8 linhas); II. Foram realizados controles;
III. O teste foi realizado em quintuplicata;
IV. Os extratos brutos foram testados em uma concentração fixa de 1000 μg/mL e as substâncias isoladas em uma concentração de 250 μg/mL;
V. Os resultados do teste foram mensurados por Leitor de microplacas Thermo Plate.
Preparo das amostras: as amostras foram pesadas e solubilizadas em DMSO, resultando em uma concentração de 50 mg/mL e 12,5 mg/mL, para os extratos brutos e substâncias isoladas, respectivamente.
42
Preparo do inóculo bacteriano: com o auxílio de uma micropipeta, 500 µL do pré-inóculo bacteriano foram transferidos para tubos de ensaio contendo 4,5 mL de água destilada estéril. Os tubos foram homogeneizados e a concentração ajustada comparando-se com o tubo 0,5 da escala de McFarland de turbidez padrão (108 UFC/mL). Após, 500 µL do inóculo preparado foram adicionados a 4,5 mL de meio de cultura BHI, obtendo-se assim, os inóculos bacterianos utilizados no teste.
PROCEDIMENTOS:
Placa teste:
I. Em cada placa teste foram testados 12 extratos, ou seja, um em cada coluna, utilizando-se, assim, três placas para teste com cada micro-organismo.
Figura 4. Esquema de uma microplaca usada no ensaio antibacteriano e antifúngico com as amostras em uma concentração fixa.
II. Em cada poço foram adicionados 100 µL da solução de trabalho (40 µL de solução do extrato + 960 µL de meio de cultura BHI) e 100 µL de inóculo do micro-organismo testado.