FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA
ANÁLISE DA RETIRADA E SUBSTITUIÇÃO DO ESÔFAGO
TORÁCICO: ESTUDO EXPERIMENTAL EM CÃES
CARLOS EDUARDO MEIRELLES DOS SANTOS
UNIVERSIDADE ESTADUAL PAULISTA
FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA
ANÁLISE DA RETIRADA E SUBSTITUIÇÃO DO ESÔFAGO
TORÁCICO: ESTUDO EXPERIMENTAL EM CÃES
Carlos Eduardo Meirelles dos Santos
Dissertação apresentada junto ao Programa de Pós-Graduação em Medicina Veterinária, área de Cirurgia Veterinária, para obtenção do título de Mestre.
Orientadora:
FICHA CATALOGRÁFICA ELABORADA PELA SEÇÃO TÉCNICA DE AQUISIÇÃO E TRATAMENTO DA INFORMAÇÃO
DIVISÃO TÉCNICA DE BIBLIOTECA E DOCUMENTAÇÃO - CAMPUS DE BOTUCATU - UNESP BIBLIOTECÁRIA RESPONSÁVEL: Selma Maria de Jesus
Santos, Carlos Eduardo Meirelles dos Santos.
Análise da retirada e substituição do esôfago torácico: estudo experimental em cães / Carlos Eduardo Meirelles dos Santos. – Botucatu : [s.n.], 2008 Dissertação (mestrado) – Universidade Estadual Paulista, Faculdade de Medicina Veterinária e Zootecnia, Botucatu, 2008.
Orientador: Sheila Canevese Rahal Assunto CAPES: 50501070
1. Cão - Doenças - Tratamento - Estudos experimentais 2 Cão - Cirurgia CDD 636.70897
Nome do Autor: Carlos Eduardo Meirelles dos Santos
Título: ANÁLISE DA RETIRADA E SUBSTITUIÇÃO DO ESÔFAGO TORÁCICO: ESTUDO EXPERIMENTAL EM CÃES
COMISSÃO EXAMINADORA
Profa. Dra. Sheila Canevese Rahal Presidente e Orientadora
Departamento de Cirurgia e Anestesiologia Veterinária FMVZ – UNESP – Botucatu
Prof. Ass. Dr. Rogério Saad Hossne Membro
Departamento Cirurgia e Ortopedia FMB – UNESP – Botucatu
Profa. Adjunto Márcia Rita Fernandes Machado Membro
Departamento de Morfologia e Fisiologia Animal FCAV – UNESP – Jaboticabal
À Profa. Dra. Sheila Canevese Rahal. Foi uma honra para mim ter sido aceito como orientando de uma profissional de tão nítido destaque dentro da FMVZ– UNESP – Botucatu.
À minha esposa, Débora Cristina Damasceno Meirelles dos Santos, por muitas vezes também ter sido minha orientadora e por ser a pessoa mais espetacular que eu conheci.
Ao Dr. José Olympio Meirelles dos Santos, a quem eu considero como irmão, por ser o meu mestre e me introduzir no “mundo da endoscopia”.
Ao meu pai, Carlos Olympio Meirelles dos Santos, pela ajuda nos procedimentos cirúrgicos. E por me levar para o seu trabalho de veterinário desde pequenininho.
Aos meus pais, Carlos e Wilma, e meus irmãos, Ricardo e Felipe, por estarem sempre ao meu lado.
À Profa. Dra. Débora Cristina Damasceno, pelas relevantes contribuições para a confecção desta dissertação e para o meu desempenho como aluno de pós-graduação.
Aos profissionais e estagiários do Centro Veterinário de Bauru, particularmente à Dra. Denise Peruca de Melo Moretti, pelo apoio e suporte nos momentos em que estive ausente.
Ao Prof. Ass. Dr. Rogério Saad Hossne, pelos ensinamentos técnicos e científicos em cirurgia esofágica.
Ao Prof. Ricardo Luis Vieira Meirelles dos Santos, jornalista e professor de Letras, e à Profa. Gabriela Vieira de Campos Meirelles, professora de Língua Portuguesa e Redação, pela revisão do texto em português.
À Profa. Ass. Dra. Maria Jaqueline Mamprim, pela análise do projeto.
Ao Prof. Dr. Joffre Guazzelli Filho, Departamento de Anatomia do Instituto de Biociências – UNESP, pela revisão dos termos anatômicos de acordo com a Nômina Anatômica Veterinária.
Ao Prof. Benedicto Vinício Aloise, pelos excelentes desenhos que fazem parte desta dissertação.
Ao Prof. Dr. José Eduardo Corrente, por ensinar e elaborar as análises estatísticas.
À Prefeitura Municipal de Bauru, na figura dos médicos veterinários Dr. Mário Ramos de Paula e Silva, Dr. Luiz Ricardo Paes de Barros Cortez e Dr. José Rodrigues Gonçalves Neto, pela colaboração no experimento.
Às bibliotecárias Luciana Pizzani e Selma Maria de Jesus, por, respectivamente, auxiliar na correção das referências bibliográficas e elaborar a ficha catalográfica.
Ao fotógrafo Daniel Cristian Ornelas de Oliveira, pela realização das fotografias dos procedimentos cirúrgicos.
Aos proprietários dos cães utilizados neste experimento, pelo desprendimento e contribuição à ciência.
Figura 1 - Esofagectomia torácica por invaginação retrógrada: Aplicação de sonda orogástrica e, no detalhe a ponta da sonda. ... 34 Figura 2 - Esofagectomia torácica por invaginação retrógrada: Estômago liberado e mobilizado para exposição do cárdia (seta)... 34 Figura 3 - Esofagectomia torácica por invaginação retrógrada: Pinçamentodo cárdia. ... 35 Figura 4 - Esofagectomia torácica por invaginação retrógrada: Incisão na região esofagogástrica (seta) para tração da sonda gástrica... 35 Figura 5 - Esofagectomia torácica por invaginação retrógrada: Incisão em bisel do esôfago cervical... 36 Figura 6 - Esofagectomia torácica por invaginação retrógrada: Borda caudal do esôfago cervical fixada à extremidade cranial da sonda por pontos simples isolados... 36 Figura 7 - Esofagectomia torácica por invaginação retrógrada: Tração da sonda (seta) para a retirada do esôfago... 37 Figura 8 - Esofagectomia torácica por invaginação retrógrada: Esôfago totalmente invertido, fixado apenas à sua inserção no diafragma (seta)... 37 Figura 9 – Avaliação da rota formada após a remoção do esôfago torácico (vista geral da região torácica): Remoção do esterno para facilitar a visualização da cavidade torácica... 38
Figura 15 - Substituição do esôfago pelo estômago inteiro: Incisão do piloro para realização da técnica de piloroplastia Heineke-Mikulicz... 43
Tabela 1 – Dados de identificação (raça, sexo, peso, idade) e avaliação do canal formado após a esofagectomia torácica por invaginação retrógrada, utilizando-se exames endoscópicos e solução de azul de metileno... 64 Tabela 2 – Dados de identificação (raça, sexo, peso, idade) e medidas
anatômicas (cm) dos cães do grupo 2... 70 Tabela 3 – Medidas das proporcionalidades anatômicas dos cães do grupo 2
... 71 Tabela 4 – Dados de identificação (raça, sexo, peso, idade) e medidas
anatômicas (cm) dos cães do grupo 3... 77 Tabela 5 – Medidas das proporcionalidades anatômicas dos cães do grupo 3
... 78 Tabela 6 – Médias dos excedentes das medidas do estômago ou gastrotubo
Página
RESUMO... 1
ABSTRACT... 2
1 INTRODUÇÃO... 3
2 REVISÃO DA LITERATURA... 6
2.1 Anatomia do esôfago canino... 7
2.2 Anatomia do estômago canino... 9
2.3 Métodos de remoção do esôfago torácico... 13
2.3.1 Estudosem humanos... 13
2.3.2 Estudoem cães... 16
2.4 Substituição do esôfago torácico com emprego do estômago... 17
2.4.1 Técnicas de gastrotubo ... 18
2.4.1.1.. Estudosem humanos 18
2.4.1.2 Estudos em animais 21
2.4.2 Mobilização do estômago inteiro ... 24
2.4.2.1 Estudos em humanos 24
2.4.2.2 Estudos em cães... 25
2.5 Rotas de mobilização dos substitutos esofágicos... 26
3 OBJETIVOS... 28
4 MATERIAL E MÉTODOS... 30
4.1 Animais e grupos experimentais... 31
4.2 Procedimentos cirúrgicos... 31
4.2.1 Grupo 1... 31
4.2.2 Grupo 2... 39
4.2.3 Grupo 3... 49
4.3 Endoscopias... 55
4.4 Avaliação da relação entre medidas anatômicas e tensão da anastomose... 56
4.5 Análise estatística... 57
5 RESULTADOS... 58
5.1.1 Técnica cirúrgica e transcirúrgico... 59
5.1.2 Avaliação endoscópica... 59
5.1.3 Avaliação com solução aquosa de azul de metileno... 60
5.2 Grupo 2 ... 65
5.2.1 Técnica cirúrgica e transcirúrgico ... 65
5.2.2 Endoscopia ... 66
5.3 Grupo 3 ... 73
5.3.1 Técnica cirúrgica e transcirúrgico ... 73
5.3.2 Endoscopia ... 74
5.4 Comparação entre o grupo 2 e o grupo 3 ... 81
6 DISCUSSÃO... 82
7 CONCLUSÕES... 89
8 REFERÊNCIAS... 91
9 TRABALHO CIENTÍFICO ... 98
Procedimentos cirúrgicos de remoção e substituição do esôfago torácico em cães ... 99
10 APÊNDICE... 124
...10.1 Normas para publicação na revista Pesquisa Veterinária Brasileira... 125
Santos, C.E.M. Substituição do esôfago torácico: Estudo experimental em cães. Botucatu, 2008. 126p. Dissertação (Mestrado em Medicina Veterinária – Cirurgia) – Faculdade de Medicina Veterinária e Zootecnia, Campus de Botucatu, Universidade Estadual Paulista.
RESUMO
Embora a esofagectomia com substituição gástrica total ou por gastrotubo seja procedimento comum em pacientes humanos, há poucos relatos de sua utilização em casos clínicos na medicina veterinária, especialmente quando envolve grandes extensões que incluam o esôfago torácico. O presente trabalho avaliou, em cadáveres de cães, uma técnica para remoção do esôfago torácico sem toracotomia e dois métodos de substituição do esôfago torácico, visando o tratamento de afecções pertinentes a essa espécie. Foram utilizados 27 cadáveres de cães que vieram a óbito por causas não relacionadas ao experimento. Estes foram aleatoriamente divididos em três grupos de nove animais, em que se estudou: G1 – esofagectomia torácica total pelo método de invaginação retrógrada; G2 – esofagectomia torácica total com substituição esofágica pelo estômago inteiro; G3 – esofagectomia torácica total com substituição esofágica por um gastrotubo confeccionado de acordo com a técnica de Büchler de gastroplastia por rotação do fundo. Também foi realizada, nos grupos 2 e 3, uma piloroplastia pela técnica de Heineke-Mikulicz. Após a ressecção esofágica no grupo 1, a integridade da rota intratorácica foi avaliada por endoscopia e solução de azul de metileno a 1%. A ruptura da pleura visceral ocorreu em todos os animais, especialmente no terço caudal. Entretanto, a rota transtorácica mediastinal permitiu a elevação de ambos os substitutos esofágicos (G2 e G3) para a realização da anastomose com a extremidade caudal do esôfago cervical. A substituição por estômago inteiro apresentou menor tensão na anastomose, maior facilidade e rapidez comparada à técnica de gastroplastia por rotação do fundo. Os resultados em cadáveres suportam a realização de estudos clínicos para validação da técnica.
Santos, C.E.M. Thoracic esophageal replacement: Experimental study in dogs. Botucatu, 2008. 126p. Dissertação (Mestrado em Medicina Veterinária – Cirurgia) – Faculdade de Medicina Veterinária e Zootecnia, Campus de
Botucatu, Universidade Estadual Paulista.
ABSTRACT
Use of whole stomach or gastric tubes as substitutes for the esophagus are common procedures in human patients, but there are few clinical reports of their use in small animals, especially involving large extension of the intrathoracic esophagus. The present study evaluated in dogs, ex vivo, one technique to remove the thoracic esophagus without thoracotomy and two methods of thoracic esophageal replacement aiming for the treatment of diseases associated with this specie. Twenty-seven dogs which died or were euthanatized for reasons unrelated to this study were used. The dogs were randomly divided into three groups of nine animals each to evaluate: G1 – total thoracic esophagectomy by everting stripping method; G2 – total thoracic esophagectomy and esophageal substitution using whole stomach; G3 – total thoracic esophagectomy and esophageal substitution using fundus rotation gastroplasty according to the method of Büchler. Heineke-Mikulicz pyloroplasty was performed in both G2 and G3. After esophageal resection in G1, the integrity of the intrathoracic route was evaluated by endoscopy and test with 1% methylene blue solution. Visceral pleura rupture was observed in all animals, especially in the caudal third portion. However, this mediastinal intrathoracic route allowed that both substitutes for esophagus (G2 and G3) could be brought up to be anastomosed to the cut end of the cervical esophagus. Thoracic esophageal substitution using whole stomach showed less anastomotic tension and was less technically demanding than fundus rotation gastroplasty method. The results ex vivo support future studies to validate the techniques in clinical cases.
1 INTRODUÇÃO
As afecções que afetam o esôfago de cães são consideradas, muitas vezes, um desafio terapêutico (JONES et al., 1989). As lesões de pequena extensão são tratadas por manejo clínico e avaliações endoscópicas periódicas, dilatações ou procedimentos cirúrgicos, tais como esofagomiotomia, anastomoses ou esofagoplastias, com recuperação satisfatória (ZIMMER, 1984; PARKER e CAYWOOD, 1987; DARGENT et al., 1998). No entanto, quando áreas maiores são acometidas por tumores, divertículos, estenoses não tratáveis pelo método de dilatação, perfurações severas, necrose extensa devido à presença de corpos estranhos, nódulos de Spirocerca lupi não manejáveis por tratamento com parasiticidas, e em casos de megaesôfago idiopático ou congênito em que o manejo alimentar e medicamentoso seja insuficiente para a manutenção da sobrevida do paciente, procedimentos cirúrgicos mais complexos são necessários para reparar, ressecar ou substituir a área acometida (COLGROVE, 1971; WILSON, 1977; HILL et al., 1979; PARKER e CAYWOOD, 1987; STRAW et al., 1987; FINGEROTH, 1993; LIAPIS, 1996; PIGATTO et al., 1997; RANEN et al., 2004).
com suas vantagens e desvantagens (ZWISCHENBERGER et al., 2002; GUPTA e GUPTA, 2004). Para o procedimento de anastomose com a extremidade proximal seccionada, esses órgãos são trazidos por meio de várias rotas, tais como pré-esternal, retroesternal, intratorácica, via mediastino posterior ou endoesofágica (HIEBERT e BREDENBERG, 1995).
O substituto esofágico ideal deve ser similar em tamanho e função ao esôfago, em particular com relação à atividade peristáltica, não deve ocupar muito espaço no tórax, e a técnica cirúrgica deve ser relativamente fácil de executar e ter baixa taxa de complicação, o paciente deve ser capaz de deglutir normalmente e não deve apresentar refluxo (AIKO et al., 1993; HIEBERT e BREDENBERG, 1995; SPITZ et al., 2004). Além disso, em pacientes jovens o substituto deve funcionar sem deterioração com a evolução temporal (ANDERSON e RANDOLPH, 1978; SPITZ et al., 2004).
Em cães, a substituição do esôfago torácico pelo intestino delgado ou cólon é dificultada pela mobilidade limitada do pedículo vascular (PARKER e CAYWOOD, 1987; BRIGHT, 1990; KYLES, 2003). O uso de auto-enxerto livre de cólon por meio de técnica microvascular, além de ser tecnicamente complexo e requerer equipamento especializado, apresentou experimentalmente resultados insatisfatórios (KUZMA et al., 1989; HOLMBERG et al., 1991). Dessa forma, utilizar o estômago inteiro ou tubos construídos a partir dele parece ser a opção mais viável (KYLES, 2003).
2 REVISÃO DA LITERATURA
2.1 Anatomia do esôfago canino
O esôfago conecta a faringe ao estômago e possui três porções: cervical, torácica e abdominal (LEIB, 1983; DYCE et al., 1997a). A porção cervical inicia-se na prega anular da faringe laríngea dorsalmente à traquéia, e continua até a entrada do tórax (LEIB, 1983), mantendo-se à esquerda da traquéia (WILSON, 1977). O esôfago torácico começa na entrada do tórax, à esquerda da linha média e da traquéia, para então ocupar uma posição dorsal à traquéia e à direita da aorta; entre a região caudal à bifurcação traqueal e o hiato esofágico, ele está na linha média (WILSON, 1977; EVANS, 1993; PASQUINI et al., 2003). Na região torácica média, o esôfago fica dentro do mediastino, muito próximo ao plano mediano, entre as cavidades pleurais direita e esquerda (ADAMS, 2004). Após atravessar o diafragma torácico, via hiato esofágico, apenas um curto segmento do esôfago é situado dentro da cavidade abdominal (DYCE et al., 1997a; ADAMS, 2004). Essa porção abdominal tem formato de cunha; dorsalmente une-se ao estômago e ventralmente encaixa-se na borda dorsal do lobo caudado do fígado (EVANS, 1993). No hiato esofágico, uma camada delgada de pleura, peritônio e tecido conjuntivo frouxo fixa o esôfago ao músculo do diafragma (EVANS e deLAHUNTA, 2001a).
O esôfago não é uniforme em espessura de parede ou diâmetro do lúmen, sendo a porção abdominal a que possui a parede mais espessa (EVANS, 1993). Todo o órgão é capaz de grande dilatação, porém, é menos distensível nas extremidades e quando passa através da entrada do tórax (EVANS, 1993; GRANDAGE, 2003).
com fibras do músculo cricofaríngeo e fibras musculares circulares da parede proximal do esôfago – e outro na junção gastroesofagiana denominado esfíncter esofágico inferior, com função fisiológica, mas sem estruturas musculares distintas (ROSIN, 1975; JONES et al., 1989). Algumas características anatômicas contribuem para manter a capacidade do esfíncter esofágico inferior, tais como: presença de pregas rugosas, sustentação muscular pelo pilar diafragmático direito, inserção oblíqua junto ao estômago e pressão positiva intra-abdominal (JONES et al., 1989). O fechamento do esfíncter esofágico inferior previne o refluxo de conteúdo gástrico dentro do esôfago, pela manutenção na maior parte do tempo de uma zona de alta pressão (STROMBECK, 1978; JONES et al., 1989). Na deglutição, o esfíncter relaxa, em geral, cinco segundos antes da chegada do bolo alimentar e resulta em queda da pressão (STROMBECK, 1978).
O esôfago tem quatro camadas: mucosa, submucosa, muscular e adventícia (JONES et al., 1989; EVANS, 1993). Durante o seu curso, a camada adventícia do esôfago fixa-se à fáscia própria dos órgãos e às estruturas adjacentes (WILSON, 1977). De acordo com Evans (1993), na região cervical a fixação ocorre com a fáscia cervical profunda, dorsal e à esquerda, e com a fáscia que forma a bainha carotídea, à direita. Nas porções torácica e abdominal, o esôfago fixa-se, respectivamente, às fáscias endotorácica e transversal. Além disso, o esôfago é coberto pela pleura no tórax e pelo peritônio no abdome. Segundo Grandage (2003), dentro do tórax a delicada pleura mediastinal adere diretamente à adventícia. No lado direito do esôfago, exatamente cranial ao diafragma, há uma bolsa fechada de pleura, conhecida como bursa infracardíaca.
fase esofágica da deglutição (STROMBECK, 1978). As fibras motoras eferentes que partem desse núcleo não são parassimpáticas, apesar de estarem no nervo vago (STROMBECK, 1978; LEIB, 1983). A musculatura lisa, por outro lado, é inervada pelas fibras simpáticas e parassimpáticas localizadas no núcleo do vago e contribuem muito pouco na peristalse esofágica do cão (STROMBECK, 1978).
Conforme Grandage (2003), a inervação do músculo estriado do esôfago inicia-se com o nervo faringoesofágico, seguindo pelo nervo laríngeo recorrente e concluindo com os troncos vagais ventral e dorsal no tórax caudal. Dessa forma, supõe- se que o vago e seus ramos cervical e torácico são a fonte de inervação motora e sensorial, ao passo que as porções cervical e torácica do tronco simpático contribuem para o plexo nervoso da parede do esôfago (WILSON, 1977).
Strombeck (1978) afirmou que, se ambos os vagos forem seccionados na região cervical do esôfago, a parte distal dilata, retém comida e apresenta contrações repetitivas simultâneas após a deglutição. Resultados similares são verificados após a vagotomia na região hilar ou a secção de alguns ramos esofagianos múltiplos. A vagotomia reduz pouco a pressão do esfíncter esofágico caudal no descanso, mas reduz muito a incidência de relaxamento e as contrações associadas à deglutição (LEIB, 1983).
A porção cervical do esôfago é irrigada por ramos das artérias tireóideas cranial e caudal, os dois-terços craniais da porção torácica pela artéria broncoesofágica, e o segmento terminal, pelos ramos da aorta em conjunto com os ramos esofágicos da gástrica esquerda (ROSIN, 1975; GRANDAGE, 2003). Essas artérias têm veias-satélites que se ligam às veias jugular e ázigos (WILSON, 1977; EVANS, 1993). A drenagem linfática ocorre pelos nódulos linfáticos cervical, mediastinal anterior, bronquial e celíaco (WILSON, 1977).
2.2 Anatomia do estômago canino
plano mediano, cranial ao arco costal e agudamente curvado (EVANS e deLAHUNTA, 2001b).
O estômago é dividido em quatro partes: cárdia, fundo, corpo e parte pilórica (ADAMS, 2004). O cárdia é a menor delas e se localiza perto do esôfago; o fundo é um divertículo em formato de cúpula localizado à esquerda e dorsal ao cárdia; o corpo é a grande porção média entre o fundo e o piloro; e a parte pilórica é separada do corpo pela incisura angular e une-se ao duodeno (EVANS, 1993; ADAMS, 2004). A porção cardíaca e o piloro regulam a passagem de ingestas (ADAMS, 2004). No cárdia, há o esfíncter cardíaco, formado por uma camada circular de músculo liso, e o óstio cardíaco, que consiste na abertura do esôfago através do esfíncter cardíaco (PASQUINI et al., 2003; ADAMS, 2004). A parte pilórica é tubular e divide-se em antro pilórico e canal pilórico, que são distinguidos pela espessura muscular (EVANS, 2003a; PASQUINI et al., 2003). O esfíncter muscular na entrada do duodeno é o piloro e seu lúmen, o óstio pilórico (EVANS, 1993; GRANDAGE, 2003). O cárdia é mantido relativamente imóvel pelo esôfago, enquanto o piloro e o duodeno são fixados ao fígado, de forma que o estômago é frouxamente ancorado à linha média (GRANDAGE, 2003).
Além disso, o estômago possui curvaturas maior e menor e superfícies visceral e parietal (EVANS, 1993; ADAMS, 2004). Nos cães, a curvatura maior apresenta-se ventralmente, caudalmente e à esquerda, ficando acima e à esquerda do intestino delgado (EVANS e deLAHUNTA, 2001b). Essa curvatura tem formato convexo e confere fixação ao omento maior, cuja parte denominada ligamento gastresplênico promove a ligação do baço com o estômago (EVANS, 1993; DYCE et al., 1997b). Já a curvatura menor, localiza-se craniodorsalmente e à direita, é pequena e côncava e une-localiza-se ao fígado pelo omento menor (DYCE et al., 1997b; PASQUINI et al., 2003). A superfície visceral está em contato com o lobo esquerdo do pâncreas e separada da massa intestinal e do rim esquerdo pela folha dorsal do omento maior (EVANS, 1993). Com o estômago contraído, a superfície parietal posiciona-se em contato com o fígado, no qual produz uma impressão gástrica (EVANS, 1993; ADAMS, 2004).
reveste todo o órgão, exceto ao longo das curvaturas, onde se reflete e continua nos omentos; os locais sem serosa são os mais susceptíveis ao rompimento (DYCE et al., 1997a). A camada muscular consiste em fibras musculares lisas com uma porção mais externa, longitudinal, e uma mais interna, circular, além de fibras oblíquas sobre o corpo do estômago (EVANS, 1993). A camada submucosa consiste em uma forte, mas fina camada elástica de tecido areolar, unida mais firmemente à mucosa que a muscular, e contém ramos finos dos vasos gástricos e nervos (EVANS, 1993; GRANDAGE, 2003). A camada mucosa está dividida em epitélio, lâmina própria glandular e muscular da mucosa (EVANS, 1993). As pregas longitudinais presentes na superfície interna do estômago são denominadas pregas gástricas (GRANDAGE, 2003; ADAMS, 2004).
As artérias do estômago são derivadas dos três principais ramos da artéria celíaca (artéria hepática, artéria gástrica esquerda e artéria esplênica) e cursam ao longo ou próximo das uniões do omento (DYCE et al., 1997b; EVANS e deLAHUNTA, 2001b; GRANDAGE, 2003). As principais artérias que irrigam o estômago são: as artérias gástricas direita e esquerda, que correm ao longo da curvatura menor; as artérias gastroepiplóicas direita e esquerda, posicionadas ao longo da curvatura maior; e as artérias gástricas curtas, ramos da artéria esplênica, responsáveis por suprir o fundo (EVANS, 1993; GRANDAGE, 2003; ADAMS, 2004). A artéria gástrica esquerda anastomosa com a gástrica direita no início do antro pilórico, e os vasos gastroepiplóicos se anastomosam na curvatura maior do corpo (EVANS, 1993).
Em geral, as artérias são acompanhadas por veias-satélites (GRANDAGE, 2003). As veias gástrica esquerda e gastroepiplóica esquerda são tributárias da veia esplênica, e as veias gástrica direita e gastroepiplóica direita são tributárias da veia gastroduodenal (EVANS, 1993). Desta forma, o sangue vindo do estômago entra no fígado por meio da veia porta (EVANS, 1993; DYCE et al., 1997b).
curvatura menor, ao passo que o tronco vagal dorsal emite ramos para a curvatura menor e a parede ventral (EVANS, 1993). A secção dos nervos vagais, sejam os troncos principais ou os ramos selecionados, reduz a atividade e a secreção gástrica, sendo um tipo de tratamento de úlceras gástricas em pacientes humanos (DYCE et al., 1997a).
Yamato et al. (1979) realizaram um estudo anatômico em pacientes humanos, por meio de arteriografia e angiograma celíaco, para avaliar as comunicações entre as artérias gastroepiplóicas direita e esquerda. Os resultados mostraram que, 34,4% dos indivíduos apresentavam uma comunicação extramural distinta entre as artérias ao longo da curvatura maior (tipo I), 15,3% não mostravam evidência de anastomose extramural e alguns tinham anastomose intramural de ambas as artérias (tipo II), 44,5% não possuíam anastomose intramural ou extramural entre as artérias (tipo III), e em 5,8% havia uma anastomose indireta entre as artérias pelo trajeto da artéria epiplóica esquerda. Os autores afirmaram que o conhecimento da circulação gástrica e das suas variações é importante para a construção de um gastrotubo viável.
2.3 Métodos de remoção do esôfago torácico
Vários fatores podem influenciar a escolha do acesso para remoção do esôfago, desde a preferência do cirurgião até a localização da lesão (PINOTTI, 1977; MATHISEN, 1995). Na medicina humana, especialmente para esofagectomia de tumores localizados no terço inferior do esôfago e no cárdia, é freqüentemente utilizado o acesso torácico pelo lado esquerdo, em geral com ressecção subperióstica da sétima costela ou por uma incisão no sétimo espaço intercostal (WILKINS, 1995; ZWISCHENBERGER et al., 2002).
Uma outra opção é a esofagectomia por acesso torácico pelo lado direito, denominada procedimento Ivor Lewis, indicada para pacientes humanos com tumores no terço médio do esôfago, displasia em esôfago de Barrett, destruição do esôfago distal por ingestão de substância cáustica ou com falha no procedimento de miotomia para acalasia (MATHISEN, 1995). Em virtude de o procedimento de Ivor Lewis necessitar de uma laparotomia em separado ede os acessos torácicos apresentarem complicações como insuficiência respiratória, atelectasia e pneumonia (PINTO et al., 2007), o emprego da esofagectomia transhiatal tem sido defendida (MATHISEN, 1995; ORRINGER, 1995; ZWISCHENBERGER et al., 2002). Por sua vez, esta última tem sido associada com incidência de paresia ou paralisia do nervo laríngeo recorrente e outros problemas, como quilotórax, lesão da traquéia e perda sangüínea (MORENO et al, 1992; GUPTA e GUPTA, 2004; CELIKER et al., 2005; GOCKEL et al., 2005; LAGARDE et al., 2005; PINOTTI et al., 1997).
2.3.1 Estudosem humanos
removidos. Os nervos laríngeos recorrentes foram preservados. O esôfago torácico proximal foi seccionado e temporariamente fechado por sutura. Após a construção do tubo gástrico, o esôfago torácico com o tumor foi tracionado através do hiato esofágico para dentro do abdome.
A esofagogastroplastia e a esofagocoloplastia transmediastinal posterior sem toracotomia foram efetuadas, por Ferreira (1974), em pacientes humanos com megaesôfago avançado. Após celiotomia mediana, foram realizadas dissecação da transição esofagogástrica, ampliação do hiato esofágico e dissecação romba do esôfago através do hiato. Procedeu-se, então, a cervicotomia ântero-lateral esquerda, com exposição, isolamento e dissecação romba do esôfago torácico até o arco aórtico. A junção esofagogástrica foi seccionada e a incisão gástrica, suturada. Aplicou-se um extrator através do esôfago terminal seccionado, que foi exteriorizado no nível da porção cervical. O esôfago foi removido mediante tração contínua do extrator, e durante o processo sua parede tornava-se evertida.
Pinotti et al. (1980) efetuaram a esofagectomia subtotal por via cervicoabdominal, sem toracotomia e com abertura do diafragma, em pacientes humanos com megaesôfago avançado. Após laparotomia mediana, a musculatura do anel hiatal foi seccionada até a região esternal e o esôfago foi isolado por dissecação dirigida com hemostasia direta. O esôfago foi então liberado na porção cervical, para depois ser removido pela via abdominal. De acordo com os autores, o método é vantajoso porque evita os inconvenientes da toracotomia direita, técnica usualmente utilizada para remoção do esôfago, especialmente em enfermos desnutridos e com problemas pulmonares como os que têm megaesôfago.
próximo ao cárdia. A porção proximal foi então invertida e puxada através de um túnel criado atrás do esôfago, na direção da cavidade abdominal, adquirindo a aparência de um V invertido. As porções proximal e distal foram tracionadas, para proceder-se à sutura final dos vasos do terço médio no nível da bifurcação bronquial. De acordo com os autores, a esofagectomia sem toracotomia é um procedimento fácil. Além disso, a abertura do diafragma não apenas permite a dissecação do esôfago sob visão direta, mas a injúria à parede torácica é também evitada e a dinâmica do diafragma não é afetada.
Gupta e Gupta (2004) efetuaram, em 51 pacientes humanos, a ressecção do esôfago comprometido por injúria corrosiva pela via transhiatal, já que esta não requer toracotomia, permite redução do trauma cirúrgico e minimiza a necessidade de ventilação pós-operatória. Segundo os autores, a dissecação do mediastino deve começar posteriormente e depois seguir lateralmente e anteriormente. Paralisia transitória do nervo laríngeo recorrente foi verificada em quatro pacientes, provavelmente associada à tração do nervo durante o afastamento medial.
Ao realizarem estudo retrospectivo em 470 pacientes humanos submetidos à esofagectomia, Gockel et al. (2007) observaram menores taxas de complicação e mortalidade e maiores taxas de sobrevivência no acesso transhiatal quando comparado ao transtorácico. Contudo, segundo Gockel et al. (2005), o acesso transtorácico deve ser utilizado em pacientes com tumores infiltrados e que necessitem da remoção da cadeia de linfonodos, visto a dissecação “cega” do acesso transhiatal tornar difícil a contenção de grandes hemorragias e diminuir a constatação da margem livre na dissecação da neoplasia.
Apesar de não ser prática freqüente na medicina veterinária, a esofagectomia videolaparoscópica tem sido cada vez mais utilizada na medicina humana. Segundo Domene et al. (1998), as esofagectomias podem ser realizadas por videocirurgia de distintas maneiras: videoassistidas, por toracoscopia e laparotomia, por toracoscopia e laparoscopia e por laparoscopia e dissecção transdiafragmática.
digital e posicionamento manual do gastrotubo. Com esse método, observaram-se menor perda de sangue e menor tempo de internação. Entretanto, os tempos cirúrgicos foram similares com ambas as técnicas, e a dissecação laparoscópica só foi possível em pacientes com tumores em início de infiltração.
Crema et al. (2005) realizaram esofagectomia laparoscópica em 34 pacientes com megaesôfago. O laparoscópio foi introduzido por uma abertura no diafragma e utilizado para a dissecação do esôfago abdominal e torácico, permitindo inclusive a hemostasia com eletrocautério. Segundo os autores, embora a taxa de disfonia (23,3%) e pneumotórax (20%) seja maior nas cirurgias laparoscópicas assistidas, as taxas de complicação e mortalidade foram consideradas menores.
Ao utilizarem a via laparoscópica na fase abdominal da esofagectomia, mantendo os acessos padrões para cervicotomia e toracotomia, Garcia et al. (2005) verificaram diminuição na perda sangüínea, de 600 ml para 300 ml, e redução do tempo médio de internação de 16 para 11 dias. O tempo cirúrgico médio de 4 horas e 50 minutos foi maior do que na cirurgia convencional, mas, segundo os autores, provavelmente melhore com o aumento da curva de aprendizado. Adicionalmente, o método não deve ser aplicado em pacientes com cirurgia abdominal prévia. Narumiya et al. (2005) relataram menor tempo de internação e menor dor trans e pós-operatórias com o método laparoscópico, porém, sem diminuição da perda sangüínea.
2.3.2 Estudoem cães
cabeçote; tração contínua como em fleboextração, removendo o esôfago com mucosa evertida. Após 48 horas, os animais foram submetidos a toracotomia direita para avaliação do mediastino e do leito esofágico, tendo sido observado hematoma inexpressivo, sem lesão de tecidos nem de órgãos contíguos.
2.4 Substituição do esôfago torácico com emprego do estômago
Não há ainda um consenso sobre o tipo e o tamanho da porção do estômago a ser utilizada para substituir o esôfago excisado (BEMELMAN et al., 1995). Basicamente, o estômago pode ser aplicado na forma tubular, semitubular ou inteira (sacular), cada uma com vantagens e desvantagens (BEMELMAN et al., 1995; ZWISCHENBERGER et al., 2002). No entanto, o esvaziamento gástrico está diretamente relacionado ao tipo do remanescente gástrico (BEMELMAN et al., 1995).
Domene et al. (1998), operando dez pacientes entre 1995 e 1997, utilizaram preferencialmente o estômago inteiro como substituto, optando pelo gastrotubo em pacientes com o estômago curto ou em casos de neoplasia. O estômago total ou o tubo gástrico permaneceram irrigados pelas artérias gástrica direita e gastroepiplóica direita.
Segundo Hiebert e Bredenberg (1995), o tubo gástrico mais comum em pacientes humanos é o da curvatura maior, que é formado pela excisão de dois terços da curvatura menor, e sua principal vascularização é a artéria gastroepiplóica direita. As desvantagens desse método são poucas, uma vez que a possibilidade de deiscência de suturas tem diminuído com o emprego de uma sutura cuidadosa ou com o uso de grampeadores.
com a artéria gastroepiplóica direita. O baço pode ser facilmente injuriado e há citações de formação de fístulas e constrições anastomóticas.
Segundo Hiebert e Bredenberg (1995), o tubo gástrico não-reverso é um tubo isoperistáltico construído com a curvatura maior com intuito de criar um desvio do trânsito esofágico. O suprimento é dependente da artéria gastroepiplóica direita e, como os nervos vagos não são lesados, não há necessidade de uma piloroplastia.
2.4.1 Técnicas de gastrotubo
2.4.1.1 Estudos em humanos
Akiyama et al. (1976) efetuaram a ressecção e a reconstrução do esôfago torácico com emprego de gastrotubo em 40 pacientes humanos com carcinoma. O omento maior foi dividido ao longo da curvatura maior do estômago, preservando a artéria gastroepiplóica direita. A artéria gastroepiplóica esquerda e as artérias gástricas curtas foram seccionadas, e a curvatura maior do estômago foi livrada em direção ao hiato esofágico. Adicionalmente, a veia e a artéria gástricas esquerdas foram seccionadas e ligadas em suas origens. Em seguida, o esôfago torácico com o tumor ou a extremidade seccionada do esôfago foi tracionada através do hiato esofágico, para dentro do abdome. A porção proximal do estômago, incluindo os linfonodos na região do cárdia, e a parte superior da curvatura menor foram excisadas junto com o esôfago. O restante do estômago foi mobilizado por via retroesternal e anastomosado com duas camadas ao esôfago cervical. Além disso, realizou-se a piloroplastia. A ingestão oral de comida foi retomada no 9º dia após a cirurgia, e, posteriormente, todos os indivíduos foram capazes de ingerir uma dieta normal. As complicações pós-operatórias mais importantes foram diarréia e retardo no esvaziamento do estômago, que desapareceram após alguns meses. Segundo os autores, mesmo com excisão de uma porção, o formato do estômago residual é adequado para mobilização e preserva a peristalse normal.
baço foi mantido. O tubo finalizado foi rotacionado cranialmente e posicionado através de túnel retroesternal ou colocado em posição retrohilar no tórax esquerdo. Este foi suturado ao estoma do esôfago cervical imediatamente ou em uma segunda fase. O tubo funcionou satisfatoriamente em todos os pacientes e, diferentemente do cólon, que freqüentemente dilata e torna-se redundante, houve retenção do formato tubular. Como o tubo não possui peristalse intrínseca, não há esvaziamento em posição horizontal, sendo necessária em infantes a permanência em pé por 1 a 2 horas. Constrição da anastomose cervical ocorreu em um terço dos pacientes, e vazamento da anastomose cervical se desenvolveu em cinco, porém apenas um requereu fechamento cirúrgico.
Yamato et al. (1979) substituíram o esôfago torácico de pacientes humanos por meio de tubo gástrico, procedimento que foi desenvolvido da seguinte maneira: excisou-se o omento maior, preservando a artéria gastroepiplóica direita; fez-se uma incisão curvilínea paralela à curvatura maior, para obter um retalho gástrico longo, e manteve-se o pedículo do retalho unido ao antro gástrico; desenvolveu-se um tubo gástrico longo e estreito e removeu-se o remanescente da parede do estômago; efetuou-removeu-se uma piloroplastia de Heinecke-Mickulicz para prevenir estase gástrica. O tubo foi trazido pela rota retroesternal e anastomosado com o coto do esôfago cervical, à esquerda da fossa supraclavicular. Pela arteriografia, foi observado que, algumas vezes, a gastroepiplóica esquerda foi inadequadapara perfundir a extremidade antral do tubo, por causa da comunicação insuficiente com a gastroepiplóica direita. Como o método usado é dependente do suprimento da gastroepiplóica direita, o achado representou uma vantagem em relação ao tubo gástrico reverso, porque este é perfundido pela gastroepiplóica esquerda. O fato foi confirmado, já que, de 50 pacientes, houve deiscência da anastomose com esôfago cervical em apenas três.
executada por secção do estômago com grampeador linear, iniciando na curvatura menor, distal à junção gastroesofagiana, ao longo da curvatura maior e para a região fundo-corpo, e então redirecionada para a curvatura menor. A área de estômago removida media em torno de 6 a 10 cm2, deixando íntegras todas as tributárias maiores das artérias gástricas direita e esquerda. Sendo assim, a curvatura maior formou o neo-esôfago torácico e o corpo gástrico compôs o neo-estômago. Segundo os autores, as vantagens em relação às técnicas convencionais seriam: formação de tubo gástrico de comprimento superior; maior fluxo sangüíneo na extremidade do tubo gástrico, local onde se aplica a anastomose com o esôfago cervical; e aumento do reservatório gástrico.
De acordo com Aiko et al. (1993), a ligação vascular para a construção de tubo gástrico causa enfraquecimento da microcirculação, em especial na parte superior do tubo, com conseqüente ruptura anastomótica no pós-operatório imediato e desenvolvimento de úlcera em períodos tardios. As úlceras pépticas desenvolvem-se a despeito da redução da secreção ácida após vagotomia e podem promover sangramento e perfuração. Em 65 pacientes de origem japonesa que foram submetidos à ressecção de câncer esofágico seguida de reconstrução com tubo gástrico, Mori et al. (2007) verificaram esofagite por refluxo. Segundo os autores, esta foi determinada pela presença da bactéria H. pylori, e não pela ausência de um esfíncter gastroesofágico.
2.4.1.2 Estudos em animais
estômago e à extremidade pilórica foi anastomosado à extremidade proximal do esôfago. Como dois cães desenvolveram isquemia do tubo gástrico, foi recomendada a ligação dos vasos esplênicos no hilo durante a esplenectomia, dada a inconstância da origem da artéria gastroepiplóica esquerda. De 16 animais que sobreviveram por 14 dias ou mais, oito desenvolveram hérnia diafragmática. Quando o nervo frênico foi esmagado, isso foi evitado. Os animais com gastrotubo antiperistáltico tiveram a habilidade de deglutir comprometida; para amenizar esse problema, a esofagogastrostomia antiperistáltica não deve conter musculatura pilórica. O tempo mais longo de sobrevivência foi seis meses.
Henderson et al. (1974) removeram em 10 cães, por meio de toracotomia esquerda e liberação circunferencial do diafragma, 25% do esôfago inferior junto com a junção gastresofagiana. Esse trecho do esôfago foi substituído por tubo gástrico construído com a curvatura maior do estômago (desenvolvido com 16,6 mm diâmetro interno) e vascularizado pelos vasos gástricos curtos. O baço foi removido para facilitar a mobilização total do tubo, e foram realizadas vagotomia e piloroplastia. No grupo 1 (n=3) o tubo gástrico foi mantido 6 cm abaixo do diafragma, e o fundo do estômago foi envolvido ao redor do tubo para criar uma válvula; no grupo 2 (n=4) o tubo foi apenas colocado 6 cm abaixo do diafragma; no grupo 3 (n=3) o tubo foi posicionado inteiro dentro do tórax e unido ao estômago no nível do diafragma. Os autores concluíram que, se um segmento de 2,5 a 6 cm for mantido abaixo do diafragma, se prevenirá o refluxo. Por sua vez, a miotomia do tubo subdiafragmático permite o refluxo de conteúdo gástrico.
Di Benedetto e Dessanti (1998) substituíram, em quatro porquinhos, uma porção do esôfago torácico (média de 8 cm) por tubo gástrico pedunculado. Após identificação da porção do corpo do estômago a ser utilizada para construção do tubo, os vasos gastroepiplóicos direitos foram dissecados até a origem próxima aos vasos gastroduodenais, e posteriormente separados da parede do estômago, abaixo da área do tubo. Os vasos gastroepiplóicos esquerdos foram ligados e seccionados acima da área do tubo. O tubo gástrico foi então desenvolvido com grampeador cirúrgico, auxiliado por um tubo com 4,62 a 5,94 mm de diâmetro interno, o que permitiu manter diâmetro similar ao do esôfago. Na seqüência, o tubo gástrico e seu pedículo vascular foram introduzidos na cavidade torácica, passando através do omento menor e pelo diafragma à direita do hiato. A anastomose com o esôfago remanescente foi realizada via toracotomia no 5º e 7º espaço intercostais. De acordo com os autores, o método teria como principais vantagens a preservação do cárdia, fácil realização, a manutenção da peristalse, o excelente suprimento sangüíneo e a preservação do vago.
Uribe et al. (1995) analisaram, em 11 cães, a perfusão residual durante a gastroplastia tubular de Akiyama com ligação dos vasos gástricos esquerdos, das artérias e veias gastroepiplóica esquerda e gástricas curtas e preservação das artérias gástrica e gastroepiplóica direitas. A metade proximal da curvatura menor do estômago foi ressecada e suturada com grampeador cirúrgico. Após a gastroplastia, a fotopletismografia e a superfície de pO2 e pCO2 foram aferidas no nível correspondente ao fundo e à região média do estômago, mostrando severa isquemia na região do fundo. Dessa forma, os autores sugeriram que a anastomose deve ser construída não mais que 3-4 cm acima da extremidade do arco gastroepiplóico e citaram a necessidade de preservar a artéria gastroepiplóica esquerda, dada a importância na vascularização residual do fundo.
oxigênio, e o emprego de drogas anti-radicais livres pode ser uma opção para o tratamento de úlceras recalcitrantes.
2.4.2 Mobilização do estômago inteiro
2.4.2.1 Estudos em humanos
Pinotti et al. (1980) restabeleceram o trânsito esofágico, após esofagectomia subtotal por via cervicoabdominal em pacientes humanos com megaesôfago avançado, empregando o estômago inteiro. O estômago foi liberado mantendo-se a arcada da curvatura maior à custa do pedículo dos vasos gastroepiplóicos direitos e da pequena curvatura dos vasos gástricos direitos. Em seguida, o órgão foi mobilizado através do túnel mediastinal até a região cervical, onde foi anastomosado ao esôfago. Além disso, foram realizadas duas jejunostomias, uma para aspiração de secreção gástrica e outra para alimentação enteral. O diafragma foi fechado até o hiato, mantendo-se diâmetro adequado para a passagem do estômago. As complicações imediatas foram efusão pleural (dois casos), disfonia transitória devido ao trauma ao nervo laríngeo recorrente (dois casos) e fístula na anastomose cérvico-torácica (um caso).
Além disso, diarréia e retardo no esvaziamento ocorreram como resultado da vagotomia e da piloromiotomia. Os sintomas e complicações tardios foram tratados por medidas clínicas e avaliação endoscópica periódica.
Bemelman et al. (1995) avaliaram o atraso do esvaziamento gástrico em 155 pacientes humanos submetidos a substituição do esôfago pelo estômago, que foi utilizado inteiro, com dois terços ou tubulizado. A piloroplastia foi executada em alguns casos. O atraso foi mais evidente com o emprego do estômago inteiro, e a sua ocorrência não foi prevenida pela piloroplastia. Segundo os autores, o esvaziamento é dependente da força da gravidade e da formação de pressão gástrica intraluminal. Para prevenir o atraso, o remanescente gástrico precisa ser pequeno e ter baixa complacência, por isso recomendam a técnica de estômago tubulizado sem piloroplastia.
Spitz et al. (2004) analisaram, retrospectivamente, o êxito da transposição gástrica efetuada em 173 crianças devido a atresia esofágica ou, em menor ocorrência, a constrições e outras causas. Em quase todos os pacientes aplicou-se um tubo nasogástrico intratorácico para proporcionar descompressão gástrica pós-operatória. O método foi considerado aceitável e provavelmente uma das melhores opções no momento. Houve 5% de mortalidade, 12% de vazamento na anastomose, e 19,6% dos pacientes necessitaram de dilatação anastomótica por causa de constrição. Não foi demonstrado se a metaplasia de Barret no esôfago proximal pode constituir um problema em longo prazo, porém, como o estômago foi vagotomizado, a quantidade de ácido pode ser insuficiente para induzi-la.
2.4.2.2 Estudos em cães
casos de total remoção do esôfago torácico, foi utilizada uma incisão na parede torácica esquerda inferior ou no abdome superior. Na primeira, o esôfago inferior foi dividido entre ligaduras e inverteu-se a extremidade inferior com uma sutura em bolsa de tabaco, e na segunda foi efetuada uma tunelização. Em ambos os casos, o esôfago foi trazido através de incisão cervical. A alimentação foi dada via tubo de gastrostomia. Os autores observaram que a remoção de até 10 cm do esôfago torácico com gastroesofagostomia pode ser efetuada com sucesso em uma alta porcentagem de casos. A excisão de todo esôfago torácico ou de parte dele, sem estabelecimento de continuidade do trato alimentar, não foi bem tolerada: houve alta taxa de mortalidade. Ressecções altas foram mais viáveis que as baixas por causa da menor ação peristáltica do coto esofágico.
Um cão com osteofibrossarcoma localizado no terço caudal do esôfago foi tratado por Colgrove (1971) por meio de excisão da porção afetada. As extremidades remanescentes do esôfago foram aproximadas e cerca de um terço do estômago foi trazido para dentro da cavidade torácica. O diafragma foi unido ao estômago com suturas interrompidas simples. Na sexta semana de pós-operatório, o cão veio a óbito devido a timpanismo gástrico e herniação do estômago dentro do tórax.
2.5 Rotas de mobilização dos substitutos esofágicos
Para a realização de um túnel retroesternal para passagem de um tubo gástrico em pacientes humanos, Akiyama et al. (1976) utilizaram um retrator intestinal maleável com um orifício em um lado. Uma fita foi amarrada através do orifício e ao estômago, que foi então trazido ao pescoço pela tração da fita através do túnel retroesternal. A rota foi considerada simples de ser realizada, mais curta que a pré-esternal e com melhor aparência cosmética.
carotídea. No caso do posicionamento retrohilar no tórax esquerdo, pode ser realizada uma toracotomia posterolateral no sexto espaço intercostal para orientar o tubo enquanto ele passa através do diafragma e atrás da raiz do pulmão para emergir na entrada do tórax.
Yamato et al. (1979) utilizaram um túnel retroesternal para passagem de gastrotubo obtido da curvatura maior do estômago em pacientes humanos. Segundo os autores, o tubo deve apresentar diâmetro estreito para evitar a compressão dos órgãos adjacentes pela repleção de conteúdo alimentar. Além disso, eles afirmaram que evitam o túnel subcutâneo antesternal, porque o tubo gástrico pode ser comprimido pela pele e a circulação local pode ficar comprometida, em especial no local da esofagogastrotomia, levando a insuficiência anastomótica.
Em 51 pacientes humanos portadores de injúrias corrosivas do esôfago, Gupta e Gupta (2004) aplicaram os substitutos esofágicos no mediastino posterior. A opção foi justificada por ser a rota mais curta, a posição ortotópica facilitar a avaliação endoscópica pós-operatória, além de evitar a compressão do pulmão e minimizar a dissecação operatória. O esôfago foi reconstituído por tubo gástrico em 78,4% dos casos; o cólon foi usado apenas quando não havia disponibilidade do emprego do estômago. Constrição anastomótica pós-operatória tratável por dilatação ocorreu em 58,8% dos pacientes, sem diferenças entre os condutos colônico e gástrico.
3 OBJETIVOS
Este trabalho teve por objetivos avaliar, por meio de estudos em cadáveres de cães:
1 a remoção do esôfago torácico sem toracotomia, por meio de incisão cervicoabdominal e inversão do órgão;
2 a integridade da rota intratorácica, formada após a esofagectomia torácica, por meio de exame endoscópico e teste com solução de azul de metileno 1%;
4 MATERIAL E MÉTODOS
4.1 Animais e grupos experimentais
A metodologia adotada durante o desenvolvimento do presente trabalho foi aprovada pela Câmara de Ética em Experimentação Animal da Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista (Unesp) - Botucatu, protocolo nº 140/2005 (Apêndice).
Foram utilizados 27 cadáveres de cães, 12 machos e 15 fêmeas, com idade variando de 2 meses a 10 anos (mediana de 3 anos e 2 meses) e peso entre 2 kg e 20 kg (mediana de 6 kg), que vieram a óbito ou foram submetidos a eutanásia por motivos humanitários. Incluíram-se no estudo apenas aqueles cujo exame físico descartou quaisquer alterações que pudessem influenciar os resultados. O tempo entre o óbito e a realização do experimento não excedeu 24 horas e, quando necessário, o cadáver foi mantido sob refrigeração. Os cães foram classificados de acordo com a raça e divididos aleatoriamente em grupos, de acordo com a técnica cirúrgica a ser testada: G1 (n=9) – esofagectomia torácica pelo método de invaginação retrógrada, G2 (n=9) – esofagectomia torácica e substituição do esôfago pelo estômago inteiro, G3 (n=9) – esofagectomia torácica e substituição do esôfago por um gastrotubo, confeccionado pela técnica de gastroplastia por rotação do fundo.
4.2 Procedimentos cirúrgicos
4.2.1 Grupo 1
membros torácicos imobilizados cranialmente. Efetuaram-se tricotomia no aspecto ventral da região caudal da mandíbula até o limite cranial da pélvis e anti-sepsia da área cirúrgica com álcool iodado. Em seguida, foram dispostos os panos de campo operatório.
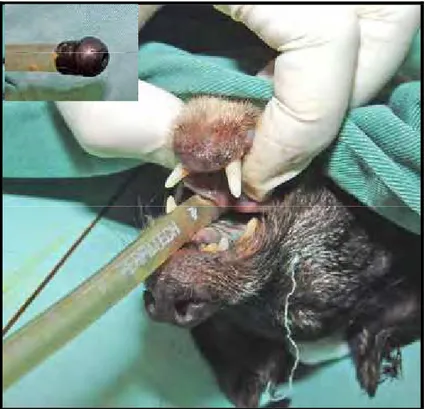
Aplicou-se sonda orogástrica com comprimento de no mínimo 20 cm a mais que a distância entre a sínfise mandibular e a 13ª costela, e diâmetro de aproximadamente 2/3 do diâmetro do esôfago sem conteúdo (Figura 1). A Sonda foi confeccionada com tubo de látex semi-rígido, com proteção de borracha em uma das extremidades, de forma a minimizar as lesões nos tecidos moles quando fosse introduzida nos cães (Figura 1). Após a colocação de abre-boca auto-estático, a sonda foi introduzida da cavidade oral até o início do estômago, posição determinada pela distância entre a sínfise mandibular e a 13ª costela. O procedimento foi, em seguida, dividido em quatro etapas.
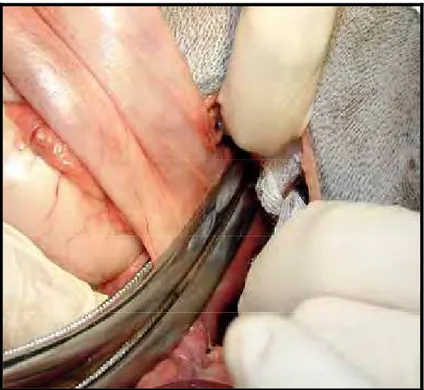
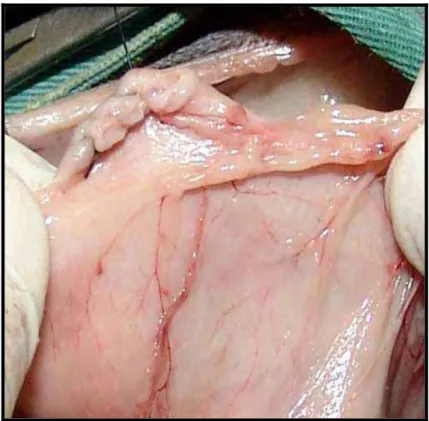
Na primeira, realizou-se a celiotomia pela linha média ventral. O ligamento falciforme foi excisado e, após a colocação de afastador auto-estático, os lobos medial e lateral esquerdo do fígado foram retraídos para a direita, com o auxílio de compressa para expor o hiato esofágico. Para a liberação do estômago foram ligados e incisados os ramos dos vasos gástricos direitos, os ramos dos vasos gastroepiplóicos direito e esquerdo e os vasos gástricos esquerdos. O estômago foi tracionado caudalmente (Figura 2) e os ramos ventral e dorsal do vago foram identificados. A transição entre o cárdia e o esôfago foi isolada por divulsão romba, e ao seu redor foi colocado um dreno de Penrose para posterior mobilização e tração.
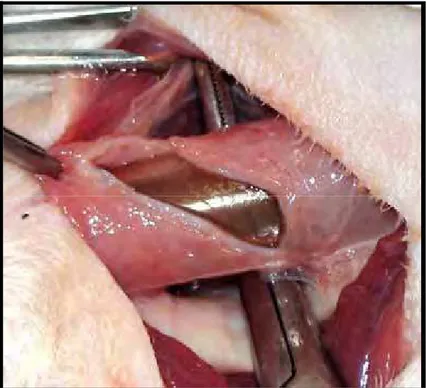
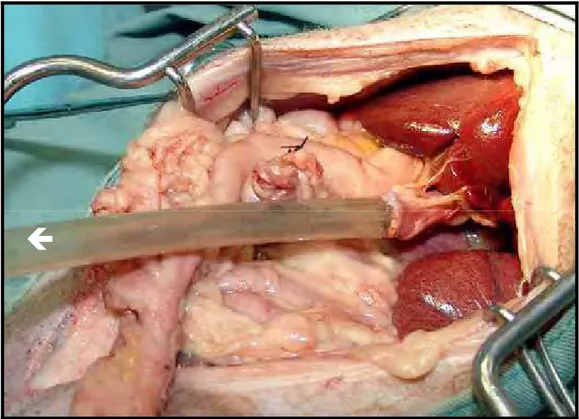
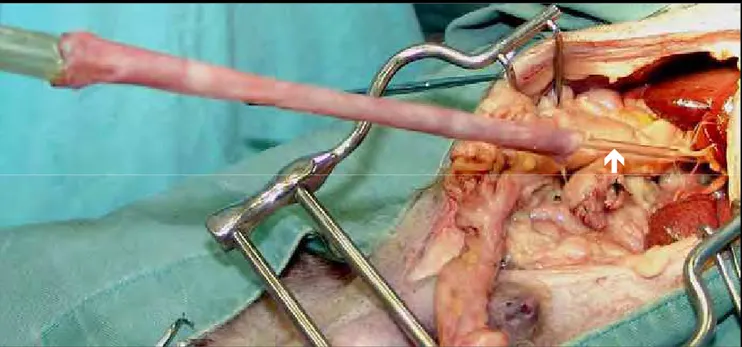
Na terceira etapa, a sonda orogástrica foi retraída cranialmente, o suficiente para a aplicação de duas pinças de Doyen na região esofagogástrica, o mais próximo possível do diafragma (Figura 3). Incisou-se o tecido entre as pinças, a pinça cranial foi removida e a sonda orogástrica, tracionada caudalmente (Figura 4). Nesse momento, o auxiliar do cirurgião informou quando a sonda ultrapassou a área do esôfago cervical a ser seccionada, a aproximadamente 2 cm da entrada do tórax. O esôfago cervical foi transeccionado em forma de bisel (Figura 5), e sua borda caudal foi fixada à extremidade cranial da sonda, por meio de 4 pontos simples eqüidistantes com fio de náilon monofilamento 2-0. Estes transfixaram toda a espessura da sonda e todas as camadas do esôfago (Figura 6). A porção caudal da sonda, localizada na região abdominal, foi então tracionada caudalmente, de forma vagarosa e delicada, permitindo a inversão do esôfago dentro de sua própria luz e a separação da pleura que o revestia (Figura 7 e 8). O esôfago totalmente invertido permaneceu fixado somente à sua inserção no diafragma.
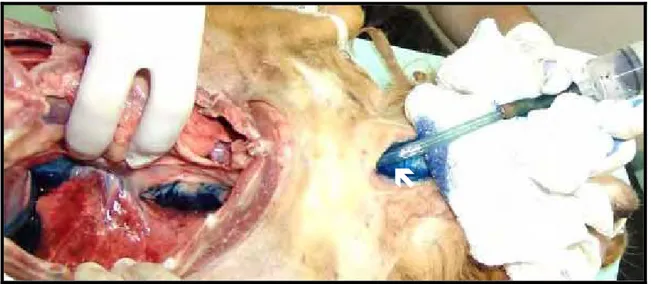
A quarta etapa avaliou a rota formada após a remoção do esôfago torácico por meio de gastroscópio pediátrico, inserido via oral. A complementação do exame foi efetuada com aplicação, na entrada do canal, de solução aquosa de azul de metileno a 1%, por meio de sonda acoplada a uma seringa de 60 ml (Figura 10). Para evitar extravasamento da solução, a mesa cirúrgica foi elevada em 15 graus na porção cranial e o local de secção da junção esofagogástrica mais próximo ao diafragma foi ocluído com pinça de Doyen. No intuito de facilitar a visualização da presença de líquido azulado na cavidade torácica, indicativo de ruptura na pleura visceral, o esterno foi
b
Figura 1 - Esofagectomia torácica por invaginação retrógrada: Aplicação de sonda orogástrica e, no detalhe a ponta da sonda.
Figura 2 - Esofagectomia torácica por invaginação retrógrada: Estômago liberado e mobilizado para exposição do cárdia (seta).
Figura 3 - Esofagectomia torácica por invaginação retrógrada: Pinçamentodo cárdia.
Ò
b
Figura 5 - Esofagectomia torácica por invaginação retrógrada: Incisão em bisel do esôfago cervical.
Figura 7 - Esofagectomia torácica por invaginação retrógrada: Tração da sonda (seta) para a retirada do esôfago.
a Figura 8 - Esofagectomia torácica por invaginação retrógrada: Esôfago totalmente invertido, fixado apenas à sua inserção no diafragma (seta).
Í
Figura 10 – Avaliação da rota formada após a remoção do esôfago torácico: Aplicação da solução de azul de metileno a 1% na entrada do canal (seta).
Ñ
4.2.2 Grupo 2
O posicionamento do cão e o acesso à cavidade abdominal foram realizados como descrito no grupo 1. Para a mobilização da curvatura maior e de parte do fundo do estômago, foram ligados e incisados os ramos dos vasos gastroepiplóicos direitos e esquerdo e os vasos gástricos curtos localizados junto ao omento maior (Figura 11, Figuras 12 e 13). Para a mobilização da curvatura menor, foram ligados e incisados os ramos dos vasos gástricos direitos junto ao omento menor. As duas arcadas vasculares paralelas às curvaturas gástricas foram preservadas. Em seguida, foram clampeados, incisados e ligados os gástricos esquerdos (Figura 11 e Figura 14). Ato contínuo efetuou-se a piloroplastia, segundo técnica de Heineke-Mikulicz (Figura 15).
A exposição e a transecção do esôfago cervical ocorreram de acordo com o relatado no grupo 1. A junção gastroesofagiana foi seccionada e a porção gástrica foi ocluída por meio de sutura contínua simples, atingindo todas as camadas, seguida de sutura de Cushing na camada seromuscular (Figura 16). O esôfago foi removido pela técnica de invaginação retrógrada, similar à do grupo 1 (Figuras 17 e 18). Contudo, além da sonda orogástrica, foi utilizada uma outra de menor calibre para posterior tração do estômago (Figura 17). Esta última foi suturada no fundo do estômago, no local onde se obteve a maior distância até o piloro com o estômago estendido, o que correspondia à mobilização gástrica de maior comprimento (Figura 19a e Figura 20). Para tanto, foram aplicados quatro pontos simples de náilon 2-0, incluindo apenas a camada seromuscular (Figura 20).
A sonda fixada ao estômago foi tracionada vagarosamente pelo auxiliar de cirurgião, posicionado na área cervical (Figura 19b). A tração da sonda via cervical permitiu o deslocamento do estômago para a área torácica (Figura 19c). Quando a porção do estômago suturada à sonda surgiu na área cervical (Figura 21), esta foi liberada para o procedimento de sutura do estômago com o esôfago cervical remanescente.
maior que a luz esofágica, para posterior anastomose gastresofágica terminoterminal (Figura 22). Foram colocados três pontos eqüidistantes e, entre os mesmos, realizou-se sutura contínua simples atingindo todas as camadas (Figura 23). O fio utilizado foi o náilon monofilamento 2-0 ou 3-0. Os músculos esternoióideos e esternocefálicos foram aproximados por meio de sutura contínua simples, bem como o tecido subcutâneo. Para a sutura da pele foram aplicados pontos isolados simples com fio de náilon 2-0.
Com a finalidade de evitar a herniação de outras vísceras para dentro da cavidade torácica ou deslocamento do posicionamento do estômago, foram aplicados dois pontos simples com náilon 2-0 entre o hiato diafragmático e o estômago mobilizado. A celiorrafia foi efetuada de maneira rotineira.
GD
Æ
GE
Ê
GCÆ
GED
Ä
Ç GEE
Figura 13 – Foto para preparação vascular na substituição do esôfago pelo estômago inteiro: Localização, para posterior pinçamento, dos vasos gastroepiplóicos esquerdos (seta).
Ç
Î
a
Figura 15 - Substituição do esôfago pelo estômago inteiro: Incisão do piloro para realização da técnica de piloroplastia Heineke-Mikulicz.
a
Ï
Figura 17 - Substituição do esôfago pelo estômago inteiro: Sutura da sonda principal e da sonda acessória no esôfago.
c
b a
Figura 18 - Substituição do esôfago pelo estômago inteiro: Retirada do esôfago com passagem da sonda acessória (seta).
a b
c
a b
Figura 21 - Substituição do esôfago pelo estômago inteiro: Exposição da porção do estômago suturada à sonda na área cervical.
Figura 20 - Substituição do esôfago pelo estômago inteiro: Determinação do ponto gástrico de maior distância até o piloro (seta) e sutura da sonda acessória no referido ponto.
Î
Cranial Æ
b
Figura 23 - Substituição do esôfago pelo estômago inteiro: Aplicação de pontos eqüidistantes para anastomose gastroesofagiana terminoterminal.
4.2.3 Grupo 3
O posicionamento do cão e o acesso à cavidade abdominal foram efetuados como descrito nos grupos 1 e 2. Os procedimentos de oclusão da circulação do estômago para posterior mobilização, o método de piloroplastia, assim como a exposição e transecção do esôfago cervical, foram realizados de forma similar ao empregado no grupo 2.
A junção gastroesofagiana foi seccionada e a porção gástrica ocluída com pinça atraumática de Doyen. A incisão no estômago, sempre seguindo uma sutura prévia de referência (Figura 24 e Figura 25), foi iniciada na curvatura menor aproximadamente 3 cm abaixo do cárdia e prosseguiu de forma transversa em direção à curvatura maior. Nesse momento, a incisão foi prolongada ao longo da curvatura maior até a altura da região do corpo, a 3 cm do piloro, quando foi redirecionada para a pequena curvatura (Figuras 24, 26 e 27). As paredes gástricas incisadas foram aproximadas com sutura contínua simples, incorporando todas as camadas, seguida de sutura de Cushing, que atingiu a porção seromuscular do órgão, de forma a constituir com a região do fundo e corpo um tubo gástrico de aproximadamente 3 cm de diâmetro, e com as regiões do corpo e antro um neo-estômago com 3 cm de diâmetro (Figura 28).
monofilamento 2-0 ou 3-0. A síntese da região cervical, a fixação do estômago no diafragma e a celiorrafia foram realizadas conforme descrito no grupo 2.
Figura 26 - Substituição do esôfago por um gastrotubo: Incisão gástrica adjacente à linha de sutura.
Figura 25 - Substituição do esôfago por um gastrotubo: Sutura prévia de referência para determinação do formato do gastrotubo (setas).
Ç
Figura 27 - Substituição do esôfago por um gastrotubo: Completada a incisão nas paredes gástricas.
a
Figura 30 - Substituição do esôfago por um gastrotubo: Posicionamento dos cotos gástrico e esofágico para a realização da anastomose.
4.3 Endoscopias
Para realização do presente experimento foi utilizado um videogastroscópio pediátrico (9 mm de diâmetro e 100 cm de comprimento de trabalho).
4.3.1 Grupo 1
O endoscópio foi introduzido via oral, com sua progressão foi observada a porção remanescente do esôfago cervical e o seu ponto de secção, avaliando-se as características da mucosa, luz do órgão e condições da área de secção. Em seguida o aparelho foi introduzido no túnel mediastinal formado na região cervical e na rota intratorácica até a altura do coração. O gastroscópio não avançou a partir desse ponto, uma vez que a pleura mediastinal poderia ser traumatizada. Na avaliação da rota mediastinal atentou-se para as condições e dimensões da luz; para as características da pleura, com relação a rupturas, pontos de hemorragia e demais alterações do tecido.
4.3.2 Grupos 2 e 3
4.4 Avaliação da relação entre medidas anatômicas e tensão da anastomose
Para verificar a existência de tensão na anastomose entre o esôfago cervical remanescente e o estômago ou tubo gástrico mobilizados, bem como uma possível relação entre a tensão na anastomose e as medidas anatômicas dos cães, foram aferidas (em cm) as seguintes distâncias durante os procedimentos cirúrgicos dos grupos G2 e G3:
1 Laringe até a borda cranial do púbis;
2 Laringe até a borda caudal da cartilagem xifóide;
3 Início do gastrotubo ou estômago preparado para a mobilização até o piloro;
4 Anastomose gastroesofagiana até o hiato diafragmático;
5 Anastomose gastroesofagiana até a laringe;
6 Distância que o estômago (já mobilizado e sem ser submetido à tensão) foi capaz de ultrapassar a região da anastomose gastroesofagiana;
7 Distância que o gastrotubo foi capaz de ultrapassar a região da anastomose gastroesofagiana, com o neo-estômago dentro da cavidade abdominal (já mobilizado e sem ser submetido à tensão);
8 Distância que o gastrotubo foi capaz de ultrapassar a região da anastomose gastroesofagiana, com o neo-estômago dentro da cavidade torácica (já mobilizado e sem ser submetido à tensão).
As proporcionalidades anatômicas foram calculadas da seguinte forma:
I. Proporção entre as medidas 1 e 2; II. Proporção entre as medidas 3 e 4; III. Proporção entre as medidas 3 e 2; IV. Proporção entre as medidas 5 e 1;
4.5 Análise estatística
Na comparação entre as medidas quantitativas da Proporção V e as demais Proporções, foram utilizadas correlações de Pearson. O nível de significância estabelecido foi de 5% de probabilidade. Foram ajustados modelos de regressão para as variáveis correlacionadas significativamente e apresentados os diagramas de dispersão com as respectivas retas ajustadas e as bandas de confiança com coeficiente de confiança de 95%.
5
RESULTADOS
5.1 Grupo 1
5.1.1 Técnica cirúrgica e transcirúrgico
Notou-se maior dificuldade de divulsão na região de transição entre o cárdia e o esôfago no cão 5 (raça dachshund), no cão 7 (sem raça definida), em virtude da presença de conteúdo líquido no estômago, que necessitou aspiração, e no cão 8 (raça cocker). Este desenvolveu lesões traumáticas na parede hepática (em torno 0,5 cm), em virtude da maior manipulação durante o afastamento do órgão.
O método de retirada do esôfago por invaginação retrógrada mostrou-se de fácil execução em todos os animais, visto que com leve tração da sonda foi possível a liberação do esôfago dos tecidos circundantes.
5.1.2 Avaliação Endoscópica
Em três cães (5, 6 e 7) foram verificados pequenos pontos de sangramento distribuídos nos terços médio (n=3) e caudal (n=1) do canal pleural formado após a retirada do esôfago (Figura 31). A ruptura da pleura nas porções mediais ou craniais (Figura 32) foi detectada endoscopicamente em dois cães (1 e 4). O cão 8 foi o único animal em que a ruptura na porção caudal do canal pleural torácico foi detectada endoscopicamente (Tabela 1).
5.1.3 Avaliação com solução aquosa de azul de metileno
Figura 32 – Esofagectomia torácica por invaginação retrógrada. Visão endoscópica da rota intratorácica após a retirada do esôfago: Ruptura da pleura (seta).
Figura 31 – Esofagectomia torácica por invaginação retrógrada. Visão endoscópica da rota intratorácica após a retirada do esôfago: Área de hemorragia (seta).