Universidade de Trás-os-Montes e Alto Douro
Aplicação de Espetroscopia de Infravermelhos na Predição da
Deterioração de Carne de Bovino Maronês Tratada com Óleos
Essenciais
Dissertação de Mestrado
Mestrado em Segurança Alimentar
Joana Isabel Teixeira Ramiro Vilela
Orientador: Professor Doutor José Manuel Marques Martins de Almeida Co-orientadora: Professora Doutora Cristina Maria Teixeira Saraiva
Vila Real, 2016
Aplicação de Espetroscopia de Infravermelhos na Predição da
Deterioração de Carne de Bovino Maronês Tratada com Óleos
Essenciais
Dissertação de Mestrado
Mestrado em Segurança Alimentar
Joana Isabel Teixeira Ramiro Vilela
O Orientador
__________________________________
(Professor Doutor José Manuel Marques Martins de Almeida)
O Coorientador
__________________________________ (Professora Doutora Cristina Maria Teixeira Saraiva)
O Arguente
__________________________________
(Professora Doutora Maria da Conceição Medeiros de Castro Fontes)
A Direção de Mestrado
__________________________________ (Professor Doutor José António de Oliveira e Silva)
Este trabalho foi elaborado com vista à realização da unidade curricular de Dissertação do 2ºano do Mestrado em Segurança Alimentar da Universidade de Trás-os-Montes e Alto Douro.
Agradecimentos
Agradeço em primeiro lugar aos meus pais e irmão, que me deram esta oportunidade apoiando-me sempre em todo o apoiando-meu percurso.
Ao Professor Doutor José Manuel Marques Martins de Almeida e à Professora Doutora Cristina Saraiva, não só pela orientação neste trabalho mas também pela paciência, prontidão, sugestões e ensinamentos que me foram transmitindo ao longo da sua realização.
Ao Doutor Alfredo Aires pelo apoio e incentivo. Ao Professor Doutor Luís Patarata, ao Professor Doutor António Silva, ao Doutor Gerardo González Aguilar e ao investigador Filipe Monteiro Silva pela disponibilidade demonstrada.
À D. Ana Leite, à D. Fátima Silva e ao Sr. Carlos pela colaboração, apoio, ensinamentos e encorajamento.
Ao painel de provadores constituído pela Professora Doutora Maria da Conceição Fontes, Professora Doutora Cristina Saraiva, D. Ana Leite, Rita Sousa e pelo Professor Doutor José António Silva.
Às colegas de laboratório e amigas Dirce Martins, Rita Sousa e Vanessa Silva por todo o apoio, pelas horas de diversão, pela partilha de bons momentos e pela força.
À colega Patrícia Pires e aos estagiários Mara Carvalhais e Diogo Pereira pela colaboração, dedicação e pelos bons momentos.
Ao Alexandre Oliveira pela paciência, ânimo e apoio constantes.
Às minhas amigas Rita Balça, Margarida Magalhães, Angela Liquito, Cristiana Ferro, Susana Catalão e Catarina Miranda pela amizade, apoio, interesse e motivação.
Índice Geral
Índice de Tabelas ... i
Índice de Figuras ... v
Lista de Abreviaturas ... viii
Resumo ... x
Abstract ... xi
CAPÍTULO I - Introdução 1. Enquadramento temático ... 1
2. Métodos tradicionais para avaliar a qualidade de alimentos ... 1
2.1 Espetroscopia de infravermelho na avaliação da segurança e qualidade alimentar ... 2
2.1.1 Reflexão Total Atenuada ... 4
2.2 Análise multivariada ... 5
2.2.1 Análise em componentes principais (PCA) ... 6
2.2.2 Análise discriminante (DA) ... 6
2.3 Regressão multivariada ... 6
3. Óleos essenciais ... 7
3.1 Composição química dos óleos essenciais ... 8
3.2 Extração dos óleos essenciais ... 9
3.3 Óleo essencial de murta - Myrtus communis L. ... 10
3.4 Óleo essencial de alecrim - Rosmarinus officinallis L. ... 10
4. Deterioração da carne fresca ... 11
4.1 Deterioração microbiana ... 12
4.2 Deterioração química – Oxidação Lipídica ... 17
5. Estratégias para aumento de vida útil de carnes frescas ... 19
5.1 Utilização de embalagens em alimentos frescos ... 20
5.2 Atividade antimicrobiana dos óleos essenciais ... 22
5.3 Atividade antioxidante dos óleos essenciais ... 24
6. Coloração da carne fresca ... 25
6.1 Medição da cor da carne ... 27
CAPÍTULO II - Material e Métodos
1. Extração dos Óleos Essenciais ... 30
1.1 Análise dos óleos por cromatografia gasosa ... 30
2. Determinação da mínima concentração inibitória (MIC)... 31
3. Preparação, embalagem e armazenamento das amostras... 33
4. Análise microbiológica ... 34
4.1 Preparação das diluições e sementeira ... 34
4.2 Normas de enumeração microbiológica ... 34
5. Análise Sensorial ... 36
6. Análises físico-químicas ... 37
6.1 pH... 37
6.2 Coordenadas de cor L*a*b* ... 37
6.3 Avaliação da capacidade antioxidante (TEAC) ... 37
6.4 Oxidação lipídica (TBARs) ... 38
6.5 Obtenção dos espetros FTIR e pré-tratamento dos dados ... 39
7. Tratamento estatístico dos dados ... 39
CAPÍTULO III - Resultados e Discussão 1. Rendimento dos óleos essenciais ... 42
1.1 Composição volátil dos OE’s ... 42
2. Concentração mínima inibitória (MIC) ... 45
3. Análises microbiológicas ... 46
3.1 Microrganismos mesófilos totais ... 46
3.2 Microrganismos psicrotróficos totais ... 51
3.3 Enterobacteriaceae ... 55 3.4 Pseudomonas spp. ... 59 3.5 BAL ... 62 3.6 Fungos ... 66 4. Análise sensorial ... 71 5. Análises físico-químicas ... 75 5.1 pH ... 75
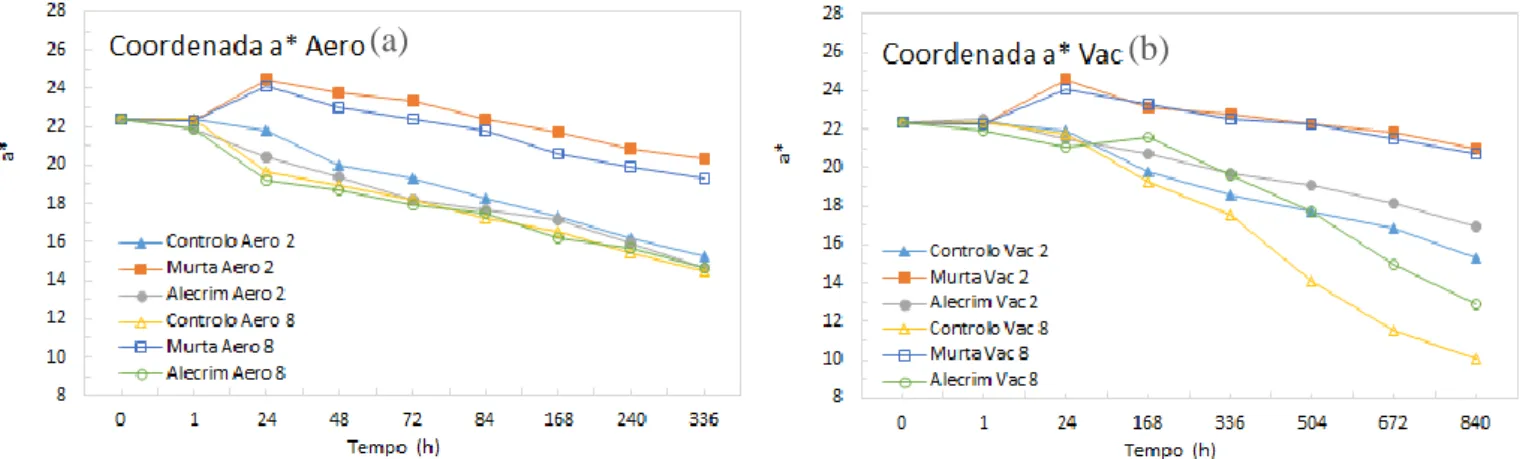
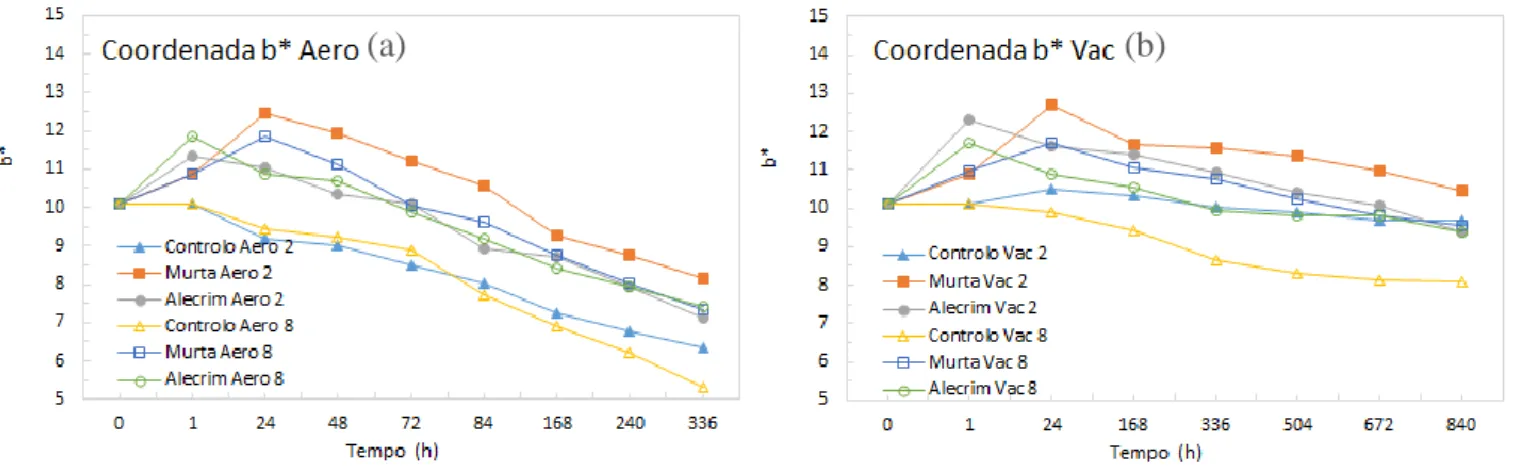
5.2 Coordenadas de cor L*a*b* ... 78
5.2.1 Coordenada L* ... 78
5.2.3 Coordenada b* ... 84
5.3 Avaliação da capacidade antioxidante (TEAC) ... 87
5.4 Oxidação lipídica (TBAR’s) ... 87
5.5 Espetros FTIR das amostras ... 91
5.6 Correlações de Pearson ... 92
6. Análise Multivariada ... 93
6.1 Análise de componentes principais para variáveis microbiológicas ... 93
6.1.1 Análise de componentes principais para variáveis espetrais ... 95
6.1.2 Análise discriminante com dados espetrais ... 96
7. Regressões multivariadas PCR e PLS-R ... 101
7.1 Microrganismos mesófilos totais ... 102
7.2 Microrganismos psicrotróficos totais ... 106
7.3 Enterobacteriaceae ... 110
7.4 Pseudomonas spp. ... 114
7.5 BAL ... 118
7.6 Fungos ... 122
7.7 pH ... 126
7.8 Oxidação lipídica (TBAR’s) ... 130
CAPÍTULO IV - Conclusão e Considerações Finais Conclusão e Considerações Finais ... 136
Referências Bibliográficas ... 137
ANEXOS
Anexo I - Ficha de análise sensorial.
i
Índice de Tabelas
Tabela 1 - Valores de absorção de diferentes grupos funcionais no infravermelho, adaptado de
Stuart (2004). 3
Tabela 2 - Quantidade (µL) de OE de Murta e Alecrim adicionada a cada grupo de amostras. 33 Tabela 3 - Rendimento da extração dos OE´s por hidrodestilação com aparelho de Clevenger.
42 Tabela 4 - Compostos voláteis detetados por GC-MS e sua percentagem nos OE’s de Myrtus
communis L. e Rosmarinus officinalis L., de acordo com o índice de Kovats. 43
Tabela 5 - Concentração mínima inibitória (MIC) dos OE's para os microrganismos estudados. 46 Tabela 6 – Contagens de microrganismos mesófilos totais (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura
e OE, embalados em aerobiose. 49
Tabela 7 - Contagens de microrganismos mesófilos totais (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura
e OE, embalados em vácuo. 50
Tabela 8 - Contagens de microrganismos psicrotróficos totais (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura
e OE, embalados em aerobiose. 53
Tabela 9 - Contagens de microrganismos psicrotróficos totais (média e desvio padrão) em hamburgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura
e OE, embalados em vácuo. 54
Tabela 10 - Contagens de Enterobacteriaceae (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados
em aerobiose. 57
Tabela 11 - Contagens de Enterobacteriaceae (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados
em vácuo. 58
Tabela 12 - Contagens de Pseudomonas spp. (média e desvio padrão) em hambúrgeres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados
ii Tabela 13 - Contagens de Pseudomonas spp. (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados
em vácuo. 62
Tabela 14 - Contagens de BAL (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em aerobiose.
64 Tabela 15 - Contagens de BAL (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em vácuo. 65 Tabela 16 - Contagens de fungos (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em aerobiose.
68 Tabela 17 - Contagens de fungos (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em vácuo. 69 Tabela 18 – Valores (cm) da avaliação global de frescura (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura
e OE, embalados de aerobiose. 73
Tabela 19 - Valores (cm) da avaliação global de frescura (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura
e óleo essencial, embalados em vácuo. 74
Tabela 20 – Valores de pH (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em aerobiose. 76 Tabela 21 - Valores de pH (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em vácuo. 77 Tabela 22 – Valores da coordenada L* (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em
aerobiose. 79
Tabela 23 - Valores da coordenada L* (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em vácuo.
80 Tabela 24 - Valores da coordenada a* (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em
iii Tabela 25 - Valores da coordenada a* (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em vácuo.
83 Tabela 26 - Valores da coordenada b* (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em
aerobiose. 85
Tabela 27 - Valores da coordenada b* (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em vácuo.
86 Tabela 28 - Valores de capacidade antioxidante para os OE's de alecrim e murta. 87 Tabela 29 - Valores de TBARs (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em aerobiose.
89 Tabela 30 - Valores de TBARs (média e desvio padrão) em hambúrgueres de bovino ao longo do período de armazenamento, de acordo com a temperatura e OE, embalados em vácuo. 90 Tabela 31 - Correlações de Pearson para as amostras sem e com OE’s embaladas em aerobiose
e vácuo e armazenadas a 2 e 8ºC. 92
Tabela 32 -Fatores de determinação da PCA e KMO em função das variáveis microbiológicas 95 Tabela 33 - Fatores de determinação da PCA e KMO em função das variáveis espetroscópicas.
96 Tabela 34 - Matriz de confusão de calibração com base nas observações dos dados espetrais
para AGF no conjunto de amostras de controlo. 98
Tabela 35 - Matriz de confusão de validação cruzada com base nas observações dos dados
espetrais para AGF no conjunto de amostras de controlo. 98
Tabela 36 - Matriz de confusão de calibração com base nas observações dos dados espetrais
para AGF no conjunto de amostras com OE de murta. 99
Tabela 37 - Matriz de confusão de validação cruzada com base nas observações dos dados espetrais para AGF no conjunto de amostras com OE de murta. 99 Tabela 38 - Matriz de confusão de calibração com base nas observações dos dados espetrais
para AGF no conjunto de amostras com OE de alecrim. 100
Tabela 39 - Matriz de confusão de validação cruzada com base nas observações dos dados espetrais para AGF no conjunto de amostras com OE de alecrim. 100
iv Tabela 40 - Calibração e Validação de PCR e PLS-R para os valores de contagens de microrganismos mesófilos totais nas amostras de controlo. 103 Tabela 41 - Características das regressões PCR e PLS-R para os valores de contagens de microrganismos mesófilos totais nas amostras com OE de murta. 105 Tabela 42 - Calibração e Validação de PCR e PLS-R para os valores de contagens de microrganismos psicrotróficos totais nas amostras de controlo. 107 Tabela 43 - Calibração e Validação de PCR e PLS-R para os valores de contagens de microrganismos psicrotróficos totais nas amostras com OE de murta. 109 Tabela 44 - Calibração e Validação de PCR e PLS-R para os valores de contagens de
Enterobacteriaceae nas amostras controlo. 111
Tabela 45 - Calibração e Validação de PCR e PLS-R para os valores de contagens de
Enterobacteriaceae nas amostras com OE de murta. 113
Tabela 46 - Calibração e Validação de PCR e PLS-R para os valores de contagens de
Pseudomonas spp nas amostras de controlo. 115
Tabela 47 - Calibração e Validação de PCR e PLS-R para os valores de contagens de
Pseudomonas spp. nas amostras com OE de murta. 117
Tabela 48 - Calibração e Validação de PCR e PLS-R para os valores de contagens de BAL nas
amostras controlo. 119
Tabela 49 - Calibração e Validação de PCR e PLS-R para os valores de contagens de BAL nas
amostras com OE de murta. 121
Tabela 50 - Calibração e Validação de PCR e PLS-R para os valores de contagens de Fungos
nas amostras de controlo. 123
Tabela 51 - Calibração e Validação de PCR e PLS-R para os valores de contagens de Fungos
nas amostras com OE de murta. 125
Tabela 52 - Calibração e Validação de PCR e PLS-R para os valores de pH das amostras de
controlo. 127
Tabela 53 - Calibração e Validação de PCR e PLS-R para o valor de pH das amostras com OE
de murta. 129
Tabela 54 - Calibração e Validação de PCR e PLS-R para o valor de TBAR's das amostras de
controlo. 131
Tabela 55 - Calibração e Validação de PCR e PLS-R para o valor de TBAR’s das amostras com
v
Índice de Figuras
Figura 1 - Esquema de uma célula ATR típica, adaptado de Stuart (2004). 5
Figura 2- Arbusto de Murta- Bagas e folhas. 10
Figura 3 - Arbusto de Alecrim. 11
Figura 4 - Estrutura de alguns compostos presentes nos OE's que exercem atividade
antimicrobiana, (Tassou and Nychas, 1995). 24
Figura 5- Diferentes formas redox da Mioglobina na carne fresca (Mancini and Hunt, 2005). 26
Figura 6 - CIELAB color space (adaptado de CIE, 2015). 28
Figura 7 - Extração de 30
Figura 8 – Exemplo de uma placa para cálculo da de MIC. 32
Figura 9 - Tubos de ensaio com soluções para estabelecer a curva padrão. 38 Figura 10 - Amostra sobre o cristal ATR no equipamento FTIR. 39 Figura 11 - Gráficos de evolução das contagens de microrganismos mesófilos totais para as amostras controlo e as tratadas com OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b).
46 Figura 12- Gráficos de evolução das contagens de microrganismos psicrotróficos totais para as amostras controlo e as amostras tratadas com OEs armazenadas a 2 e 8ºC em aerobiose (a) e
vácuo (b). 51
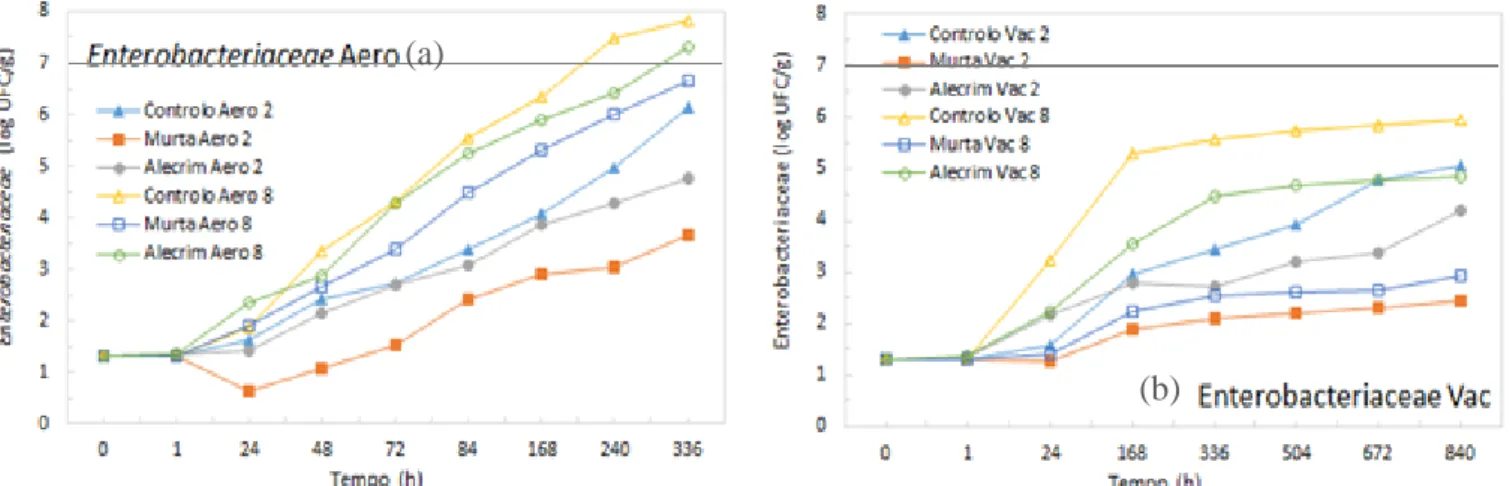
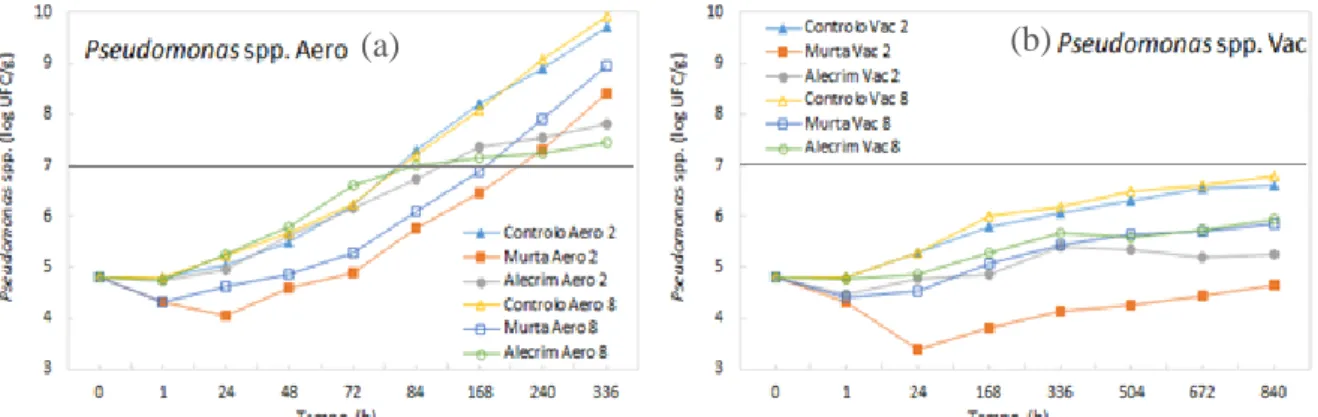
Figura 13 - Gráficos de evolução das contagens de Enterobacteriaceae totais para as amostras tratadas com e sem OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 55 Figura 14 - Gráficos de evolução das contagens de Pseudomonas spp. para as amostras tratadas com e sem OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 59 Figura 15 - Gráficos de evolução das contagens de BAL para as amostras tratadas com e sem
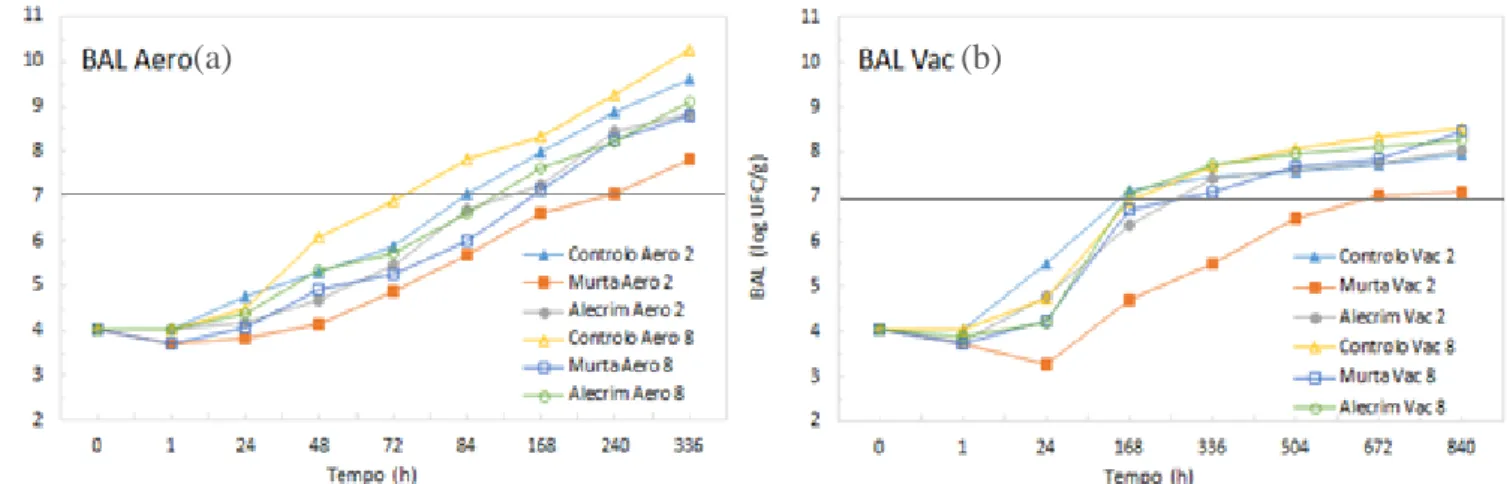
OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 62
Figura 16 - Gráficos de evolução das contagens de fungos (bolores e leveduras) para as amostras tratadas com e sem OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 66 Figura 17 - Gráficos de evolução dos valores (cm) de AGF para as amostras tratadas com e sem
OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 71
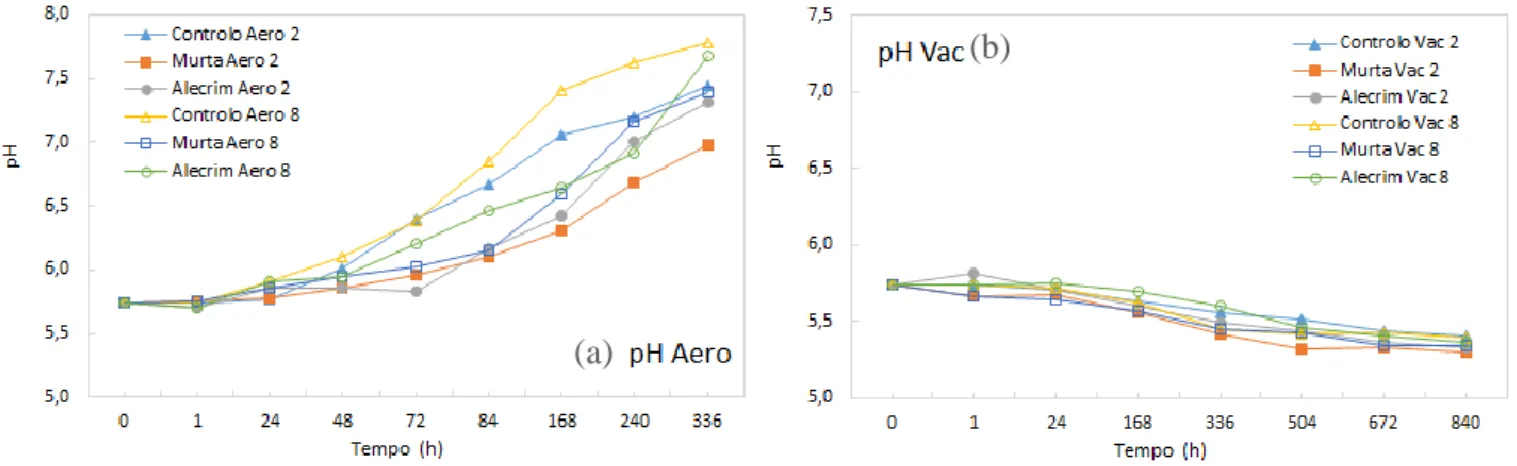
Figura 18 - Gráficos de evolução dos valores de pH para as amostras tratadas com e sem OEs
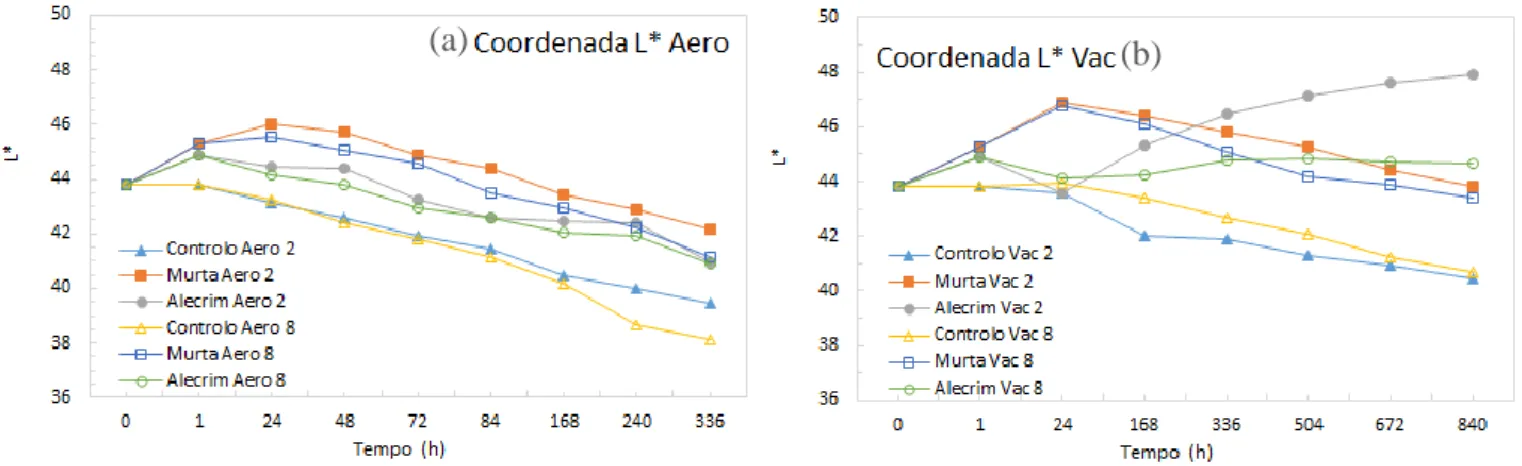
vi Figura 19 - Gráficos de evolução dos valores da coordenada L* para as amostras tratadas com e sem OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 78 Figura 20 - Gráficos de evolução dos valores da coordenada a* para as amostras tratadas com e sem OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 81 Figura 21 - Gráficos de evolução dos valores da coordenada b* para as amostras tratadas com e sem OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 84 Figura 22 - Gráficos de evolução dos valores de TBARs para as amostras tratadas com e sem
OEs armazenadas a 2 e 8ºC em aerobiose (a) e vácuo (b). 88
Figura 23 - Espetros FTIR das amostras com OE’s de murta e alecrim, embaladas e, aerobiose e sob vácuo e armazenadas a 2 e 8ºC, nos tempos 0h e 336 h. 91 Figura 24 - Gráficos PCA para as amostras de controlo (a), com OE de murta (b) e OE de alecrim (c), armazenadas a 2 e 8ºC, embaladas em aerobiose. 93 Figura 25 - Gráficos PCA para as amostras de controlo (a), com OE de murta (b) e OE de
alecrim (c), armazenadas a 2 e 8ºC, embaladas sob vácuo. 94
Figura 26 - Gráfico das observações obtido por PCA utilizando variáveis espetrais. 96 Figura 27 - Gráfico das observações obtido por DA para as amostras de controlo em função da
AGF, utilizando variáveis espetrais. 97
Figura 28 - Gráfico das observações obtido por PCA para as amostras com OE de murta em
função da AGF, utilizando variáveis espetrais. 98
Figura 29 - Gráfico das observações obtido por PCA para as amostras com OE de alecrim em
função da AGF, utilizando variáveis espetrais. 100
Figura 30 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de microrganismos mesófilos totais nas amostras de controlo. 102 Figura 31 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de microrganismos mesófilos totais nas amostras com OE de
murta. 104
Figura 32 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de microrganismos psicrotróficos totais nas amostras de
controlo. 106
Figura 33 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de microrganismos psicrotróficos totais nas amostras com OE
vii Figura 34 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens Enterobacteriaceae nas amostras de controlo. 110 Figura 35 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de Enterobacteriaceae nas amostras com OE de murta. 112 Figura 36 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de Pseudomonas spp. nas amostras de controlo. 114 Figura 37 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de Pseudomonas spp. nas amostras com OE de murta. 116 Figura 38 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de BAL nas amostras de controlo. 118 Figura 39 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de BAL nas amostras com OE de murta. 120 Figura 40 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de Fungos nas amostras de controlo. 122 Figura 41 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de contagens de Fungos nas amostras com OE de murta. 124 Figura 42 - Correlação entre os valores observados e os estimados pelo modelo obtido por
PLS-R para os valores de pH das amostras de controlo. 126
Figura 43 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de pH das amostras de com OE de murta. 128 Figura 44 - Correlação entre os valores observados e os estimados pelo modelo obtido por
PLS-R para os valores de TBAPLS-R’s das amostras de controlo. 130
Figura 45 - Correlação entre os valores observados e os estimados pelo modelo obtido por PLS-R para os valores de TBAPLS-R’s das amostras com OE de murta. 132
viii
Lista de Abreviaturas
µL- Microlitroabs.- Absorvância
ABTS - 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid) ác.- Ácido
AGF – Apreciação Global de Frescura
AM – Atmosfera Modificada
ATCC – Coleção Norte Americana de microorganismos (American Type Culture Collection) ATR - Reflexão Total Atenuada (Attenuated Total Reflectance)
aw - Atividade de água
BAL - Bactérias do Ácido Láctico BHI – Brain Heart Infusion CE- Comissão Europeia
CIE – Comissão internacional para a iluminação (International Commission on Illumination) COMb – Carboximioglobina
DA – Análise discriminate (Discriminant Analysis) DesoxiMb – Desoximioglobina
DGGE – Eletroforese em gel de gradiente desnaturante (Denaturing Gradient Gel Electrophoresis) DOP – Denominação de Origem Protegida
Eh – Potencial redox
FAO- Organização da alimentação e agricultura (Food and Agriculture Organization) FDA- Administração de alimentos e medicamentos (Food and Drug Administration)
FTIR -Espetroscopia de infravermelho com transformada de fourier (Fourier Transform Infrared Spectroscopy) g- Grama
GC – Cromatografia gasosa (Gas chromatography)
GC-MS – Cromatografia gasosa com espetroscopia de massa (Gas Chromatography-Mass Spectrometry) GC-TCD – Cromatografia gasosa com detetor de condutividade térmica (Gas Chromatography-Thermal
Conductivity Detector)
GRAS – Substâncias geralmente reconhecidas como seguras (Substances Generally Recognized As Safe) IR - Infravermelhos (Infra-red)
ISO- Organização internacional para a padronização (International Organization for Standardization) kg- Quilograma
L- Litro
LOO - método de validação cruzada "Leave-One-Out” MetaMb - Metamioglobina
Mb – Mioglobina
MBC – Concentração mínima bactericida (Minimum Bactericidal Concentration) MDA - Malonaldeído
ix
MIC – Concentração mínima inibitória (Minimum Inhibitory Concentration) mL- Mililitro
MLR - Regressão linear múltipla MT- Mesófilos totais
NCTC – Coleção nacional de culturas de bactérias (National Collection of Type Cultures for bactéria - UK) nm- Nanómetro
OE - Óleo essencial OxiMb- Oximioglobina
PCA – Análise em componentes principais (Principal Component Analysis) PCA – Plate Count Agar
PT – Psicrotróficos totais
PCR – Reação em cadeia da polimerase (Polymerase Chain Reaction)
PCR - Regressão por componentes principais (Principal Component Regression) PLS-R - Regressão por mínimos quadrados parciais (Partial Least Squares Regression) R – Fator de correlação
R2 - Coeficiente de determinação múltiplo ou coeficiente de regressão
RMSEC – Erro quadrático de calibração (Root Mean Square of Calibration)
RMSECV - Erro quadrático da validação cruzada (Root Mean Square Error of Cross Validation) RR - Regressão de Ridg
RT-PCR - Reação em cadeia da polimerase por transcrição reversa (Reverse Transcription Polymerase Chain
Reaction)
T – Temperatura
TBA – Teste do ácido tiobarbúrico (Thiobarbituric acid test) UE- União Europeia
UFC- Unidades Formadoras de Colónias vol.- Volume
WHO- Organização mundial de saúde (World Health Organization) wn-1- Número de onda (wave number)
x
Resumo
O objetivo deste estudo consistiu em avaliar a aplicação de espetroscopia – FTIR como forma de predição da deterioração de carne de bovino Maronês (DOP) tratada com óleos essenciais (OE’s) de Myrtus communis L. e Rosmarinus officinalis L., embalada sob diferentes condições (aerobiose e vácuo) e armazenada a duas temperaturas (2 e 8ºC). Pretendeu-se também verificar se este método permite estimar os valores de pH das substâncias reativas ao ácido tiobarbitúrico (TBARs) e das contagens de microrganismos presentes nas amostras ao longo do tempo de armazenamento, assim como distinguir com clareza as amostras tratadas com e sem OE’s. Em paralelo realizaram-se análises microbiológicas, físico-químicas e sensoriais das amostras.
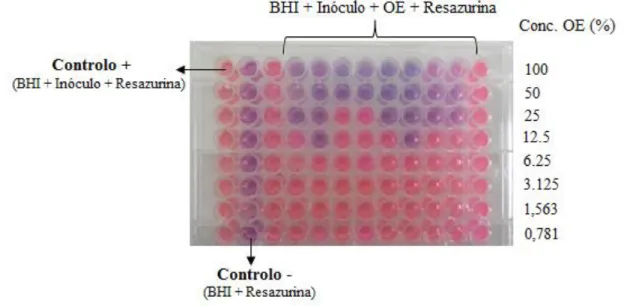
De modo a obter OE’s recolheram-se folhas de murta (Myrtus communis L.) e de alecrim (Rosmarinus officinalis L.) no jardim botânico da UTAD. As folhas, após secagem, foram submetidas a hidrodestilação com aparelho de Clevenger. A composição química dos OE’s foi determinada por análise de GC-MS e os principais componentes obtidos foram acetato de mirtenilo (15,45%), β-linalol (12,30%) e 1.8 cineol (9,86%) para o OE de murta e 1.8 cineol (14,8%), L-verbeneno (9,1%) e endo-borneol (8,7%) para o OE de alecrim.
Para determinar a concentração mínima inibitória (MIC) foi utilizado o método de microdiluição, sendo a maior diluição sem multiplicação microbiana visível considerada a MIC. O OE de alecrim apresentou MIC de 18,75% para E. coli, Pseudomonas spp. e L. monocytogenes; 4,69% para Enterobacteriaceae e E.coli O157:H7 e 2,34% para BAL. O OE de murta apresentou MIC de 25% para todos os microrganismos, exceto para Pseudomonas spp. cuja MIC foi de 50%.
Para realização deste trabalho foi utilizada carne fresca (M. semitendinosus and M. semimembranosus) de bovino de raça Maronesa (machos; n = 3) obtida no mercado local. Depois de cortada e picada, amostras de 40g foram formatadas tipo hambúrguer e embaladas individualmente em duplicado em duas condições diferentes: aerobiose e vácuo, com e sem um dos OE’s. As amostras foram armazenadas e analisadas imediatamente e até ao14º dia para aerobiose e até ao 35º dia para vácuo, relativamente a parâmetros microbiológicos, à cor (L * a * b *), pH, TBARS e a características sensoriais. O painel de provadores avaliou cada amostra ao fim de cada dia de armazenamento em relação à cor e ao odor. Os microrganismos analisados foram mesófilos totais, psicrotróficos totais, Enterobacteriaceae, Pseudomonas spp., BAL e Fungos (bolores e leveduras).
O OE de murta foi o que apresentou melhores resultados globais para a generalidade das variáveis. A temperatura de 2ºC resultou em menores teores de microrganismos, menor oxidação lipídica e maior preservação de cor vermelha, sendo a mais adequada para o armazenamento de carnes frescas.
Relativamente à espetroscopia, verificou-se que a técnica FTIR-ATR em combinação com a análise multivariada permitiu prever, quantitativamente, valores de contagens de microrganismos, pH, oxidação lipídica (TBAR’s), dando assim uma indicação do grau de deterioração da carne fresca. O modelo PLS-R foi o que apresentou melhores resultados variáveis em estudo.
Palavras-chave: FTIR-ATR, Óleos essenciais, Microrganismos deteriorativos, Atividade antimicrobiana,
xi
Abstract
The aim of this study was to evaluate the possibility of applying spectroscopy - FTIR as a way of predicting the deterioration of beef Moronês (POD) treated with essential oils (EO’s) from Myrtus communis L. and Rosmarinus officinalis L., packed under different conditions (aerobiosys and vacuum) and stored at two temperatures (2 and 8 ° C). It was also intended to verify if this method allows to estimate the values of pH, TBARS and microorganisms counts present in the samples during the storage time and to clearly distinguish the samples treated with and without EO's. In parallel microbiological, physical-chemical and sensory analisys were carried out on the same samples.
To produce EOs, leaves of true myrtle (Myrtus communis L.) and rosemary (Rosmarinus officinallis L.) were obtained from the botanical garden of UTAD. The dried leaves were submitted to hydrodistillation using a Clevenger-type apparatus. Chemical composition of EO’s was determined by gas chromatography (GC) analysis. The major components were: myrtenil acetate (15,45%), β-linalool (12,30%) e 1.8 cineol (9,86%), for myrtle’s EO and 1.8 cineole (14,8%), L-verbenene (9,1%) e endo-borneole (8,7%), for rosemary’s EO.
To determine minimum inhibitory concentration (MIC) successive dilutions of the EOs were performed using the microdilution plate method. The highest dilution with no visible multiplication was considered the MIC. Rosemary’s EO presented a MIC of 18,75% for E. coli, Pseudomonas spp. and L. monocytogenes; 4,69% for Enterobacteriaceae and E.coli O157:H7 and 2,34% for BAL. Myrtle’s EO presented a MIC of 25% for all microrganismos with exception of Pseudomonas spp, wich MIC was 50%.
Fresh beef (M. semitendinosus and M. semimembranosus) of Maronesa breed (males; n=3) was obtained from local market. After cut and minced, 40 g samples were individually packed in duplicate in two different conditions: aerobiose and vácuo with and without each EO. Samples were stored at 2 and 8°C and analyzed immediately, 14 days for aerobiosys and 35 days, for vacuum for microbiological, color (L*a*b*), pH, TBARs and sensory analysis. Sensory panelists evaluated each sample after 60min at each storage end time for color and spoiled odor. The microorganisms analyzed were total mesophilic (TM) and psicrothrophic, Enterobacteriaceae, Pseudomonas spp., lactic acid bacteria (LAB) and Fungi.
Myrtle’s EO presented better overall results, for most of variables. The 2°C temperature also resulted in lower microorganism counts, lower lipid oxidation, and better preservation of color, being more suitable for the storage of fresh meat.
Regarding spectroscopy, FTIR-ATR technique in combination with multivariate analysis showed viability to determine quantitatively microorganism counts, pH, lipid oxidation (TBAR's), thus giving an indication of the deterioration of fresh meat. The PLS-R model showed the best results for the variables in study.
Keywords: Infrared spectroscopy, Essential oils, Spoilage microorganisms, Antimicrobial activity, Antioxidant
1
1. Enquadramento temático
A carne constitui a principal fonte de proteína de alto valor biológico (Lund et al., 2011), como tal, é importante garantir a qualidade e segurança no seu consumo. Por ser uma fonte de proteínas e outros nutrientes importantes, é também o substrato ideal para o desenvolvimento de microrganismos deteriorativos e patogénicos (Kodogiannis, Pachidis et al., 2014).
A carne picada tem uma validade reduzida quando comparada com a carne inteira, uma vez que se aumenta a área de superfície exposta ao ambiente externo (Limbo et al., 2010). Assim, para aumentar a sua segurança alimentar e o tempo de prateleira, é necessário adotar estratégias para minimizar a contaminação e retardar ou inibir a multiplicação de microrganismos patogénicos e deteriorativos (Sallam e Samejima, 2004).
Recentemente tem-se vindo a assistir ao aumento de interesse na procura de produtos de origem natural com propriedades antimicrobianas e antioxidantes, por forma a substituir os aditivos químicos/ sintéticos atualmente utilizados na indústria alimentar (Wang et al., 2008). No entanto, é necessário ter em atenção que, de acordo com o Regulamento nº 853 da Comissão Europeia (2004), relativo às regras de higiene específicas para alimentos de origem animal, a adição destes compostos conduz à alteração da denominação deste produto de “carne fresca” para “preparado de carne”.
Os métodos tradicionais para a avaliação da qualidade dos alimentos são normalmente demorados, dispendiosos, necessitam de reagentes, são destrutivos e produzem resíduos. A espetroscopia de infravermelhos é, por outro lado, uma técnica rápida, objetiva e não destrutiva que não requer a utilização de reagentes e a preparação da amostra é mínima.
Os objetivos deste trabalho foram avaliar a aplicação de espetroscopia IR na predição da deterioração de carne bovina Maronesa (Denominação de Origem Protegida - DOP) tratada com óleos essenciais extraídos de plantas e, por consequência, avaliar o efeito antimicrobiano e antioxidante desses óleos essenciais sobre a vida útil de carne picada fresca.
2. Métodos tradicionais para avaliar a qualidade de alimentos
Existem vários métodos organoléticos, microbiológicos e físico-químicos para deteção da contaminação ou deterioração da carne. Contudo, na sua maioria constituem técnicas invasivas, demoradas e minuciosas, com a necessidade de técnicos especializados (Argyri et
2 Atualmente, segundo o Regulamento nº 2073 da Comissão Europeia (2005), as análises microbiológica e sensorial são as mais usadas para avaliar a frescura, deterioração ou segurança da carne e produtos cárneos. Embora, segundo este regulamento, a análise sensorial seja a mais apropriada, esta requer um painel de provadores treinado, sendo um processo demorado e dispendioso, o que o torna inviável para análises de rotina (Nychas et al., 2008).
Segundo Nychas et al. (2007), a análise microbiológica, seja por métodos de contagens ou moleculares (PCR, RT-PCR, DGGE) é mais indicada para medir a microbiota responsável pela deterioração do que a qualidade da carne fresca em si. Este tipo de análise é geralmente demorada e destrutiva (Nychas et al., 2008).
Nas últimas décadas foram desenvolvidas e aperfeiçoadas novas tecnologias não-invasivas baseadas em alterações bioquímicas que ocorrem no músculo como produtos do metabolismo microbiano que constituem índices de deterioração química e podem ser identificados recorrendo-se por exemplo a métodos espetroscópicos (Nychas et al., 2008; Papadopoulou et al., 2011).
2.1 Espetroscopia de infravermelho na avaliação da segurança e qualidade alimentar A espetroscopia de infravermelhos tem vindo a substituir os métodos tradicionais na análise de alimentos e a sua grande aceitação deve-se principalmente à rapidez com que as amostras podem ser caracterizadas, quase sem manipulação, bem como à flexibilidade do equipamento (Blanco e Villarroya, 2002). Além disso, pode ser estudada qualquer amostra em qualquer estado físico (Stuart, 2004).
Este método, rápido e não invasivo, baseia-se na observação das vibrações de moléculas que são excitadas por um feixe de radiação eletromagnética na zona do infravermelho médio (Cordella et al., 2002). Os fotões de radiação na zona do infravermelho (IR) são transmitidos através da amostra e excitam as moléculas para estados vibracionais ou rotacionais de maior energia. Assim, radiação eletromagnética com determinados comprimentos de onda é absorvida. É a estrutura molecular da amostra que determina a radiação que é transmitida ou absorvida (Beasley et al., 2014). Portanto, o espetro de absorvância do IR é um identificador característico de cada substância. Duas substâncias com espetros no infravermelho idênticos representam, quase de certeza, o mesmo composto (Cordella et al., 2002).
A radiação de infravermelho divide-se em três regiões:
Infravermelho próximo (12800-4000cm-1) (ou 780-2500 nm);
3 Infravermelho longínquo (400-10cm-1) (ou 25-1000 µm).
A zona dos infravermelhos médio e próximo são os mais utilizados na análise de alimentos (Cordella et al., 2002). Neste trabalho recorreu-se á zona infravermelho médio.
As moléculas apenas absorvem a radiação infravermelha quando esta é da mesma frequência que um dos seus modos fundamentais de vibração, deste modo, o movimento vibracional de uma pequena parte da molécula é acentuado, enquanto o resto da molécula não é afetado. Quanto maior for a simetria da molécula, menor será o número de bandas observado no seu espetro de infravermelho uma vez que algumas ligações absorvem à mesma frequência (Stuart, 2004). Quando há alteração no momento dipolar das moléculas durante a vibração estas absorvem energia na região do infravermelho, a presença de picos em determinada frequência/número de onda é característica de determinados grupos funcionais, ou seja, pela observação dos picos a determinado número de onda temos uma indicação dos possiveis compostos presentes na amostra. Na Tabela 1 observam-se os números de onda a que determinados grupos funcionais absorvem a radiação no infravermelho (Stuart, 2004).
Assim, com recurso à espetroscopia é possível determinar o grau de deterioração uma vez que estes métodos ao provocar a vibração de moléculas específicas são capazes de quantificar os metabolitos resultantes do desenvolvimento dos microrganismos na carne (Argyri et al., 2010). A quantificação desses metabolitos fornece informação acerca do tipo e do grau de deterioração da amostra (Nychas et al., 2008; Papadopoulou et al., 2011).Com a espetroscopia de infravermelhos é também possível medir as quatro formas redox da mioglobina (Mb) na zona média uma vez que estas têm espetros de absorção suficientemente diferentes para serem diferenciados (entre os 600 e os 500nm) (Suman et al., 2006).
Tabela 1 - Valores de absorção de diferentes grupos funcionais no infravermelho, adaptado de Stuart (2004).
Número de Onda (cm-1) Grupo Funcional
3640 - 3610 O-H (livre)
3500 – 3070 N-H
2960 - 2850 C-H alifáticos
1750 - 1740 CO de ésteres (gordura)
1740 - 1720 CO de aldeídos
1720 - 1700 CO de cetonas
1675 - 1645 CC
1650 Amida I
4
1550 Amida II
1470 - 1430 CH2
1390 - 1370 CH3
1420 e 1300 - 1200 C-O de ácidos carboxílicos
1300 - 1020 C-O de ésteres
1200 - 1050 C-O de álcoois fenóis
1155 - 1150 C-O de hidratos de carbono
1024 - 998 C-OH de hidratos de carbono
2.1.1 Reflexão Total Atenuada
A espetroscopia de infravermelhoscom transformada de Fourier (FTIR) é uma forma de espetroscopia vibracional que se baseia na absorvância da radiação infravermelha. Neste método a luz é absorvida pela amostra em diferentes frequências que correspondem às frequências vibracionais das ligações presentes (Wartewig, 2003). “Fourier Transform” consiste num algoritmo matemático que tem a função de converter os dados de número de onda recolhidos pelo detetor em espetros. Assim, os espetros são o produto das vibrações das ligações da molécula que são produzidas pela passagem da radiação infravermelha pela amostra (Beasley et al., 2014).
Por outro lado a reflexão total atenuada (ATR) é uma técnica mais rápida que quase não requer processamento da amostra (Castellano et al., 2004). As vantagens desta técnica em relação à anterior são o mínimo processamento da amostra, a variação do espetro devido à preparação da amostra é mínima e o impacto da diferença do tamanho das partículas nos resultados é reduzido (Beasley et al., 2014).
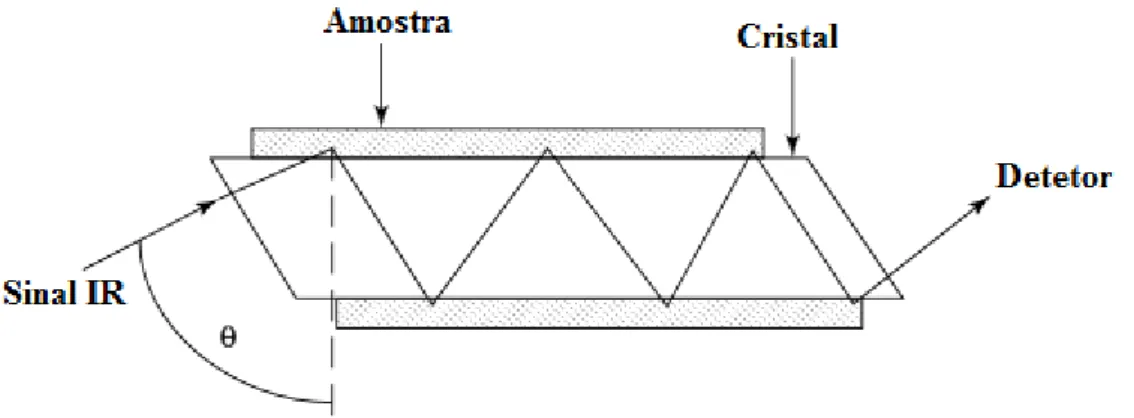
Na técnica ATR, tal como se pode verificar na Figura 1, o feixe de radiação que penetra no cristal, normalmente de seleneto de zinco (ZnSe), sofre reflexão interna total quando o ângulo de incidência na interface entre a amostra e o cristal for superior ao ângulo crítico, sendo este uma função dos índices de refração de duas superfícies (Stuart, 2004). Quando a amostra é colocada em contacto com o cristal, a onda evanescente resultante é atenuada na região do espetro IR em que a amostra absorve energia (Beasley et al., 2014).
5 Figura 1 - Esquema de uma célula ATR típica, adaptado de Stuart (2004).
Os métodos espetroscópicos juntamente com a aplicação de modelos matemáticos estão cada vez mais a ser aplicados na avaliação da qualidade da carne (Aït-Kaddour et al., 2011). Estas técnicas podem fornecer informação rápida relativa à contribuição dos microrganismos deteriorativos ou à categorização da carne em termos de tipo de carne (espécie animal) e estado de conservação (Mataragas et al., 2007).
2.2 Análise multivariada
A análise multivariada consiste em qualquer abordagem analítica que considere o comportamento de duas ou mais variáveis simultaneamente. Esta envolve uma grande multiplicidade de conceitos estatísticos e matemáticos (Pereira, 1999).
A análise de amostras por métodos espetroscópicos resulta numa grande quantidade de dados. A quimiometria é a área que reúne a informação relevante desses dados, reduzindo e organizando os dados obtidos de forma a manter apenas os necessários para obter informação relevante, permitindo assim a interpretação tanto qualitativa como quantitativa (Wold, 1995).
Podem salientar-se algumas técnicas:
Análise em componentes principais (PCA) Análise discriminante de Fisher (DA) Análise fatorial de correspondência Análise canónica de correlação Métodos de seleção de variáveis Regressão multivariada
o Regressão em componentes principais (PCR) o Regressão por mínimos quadrados parciais (PLS)
6 o Regressão linear múltipla (MLR)
o Regressão de Ridg (RR).
Os métodos de regressão multivariada mais usados na espetroscopia são a regressão por componentes principais (PCR) e a regressão por mínimos quadrados parciais (PLS) (Blanco e Villarroya, 2002).
2.2.1 Análise em componentes principais (PCA)
A PCA é uma análise não supervisionada que faz uma aproximação qualitativa. O objetivo desta técnica é criar um conjunto de variáveis – componentes principais – cuja dimensão é a mesma que o conjunto de dados originais. Cada componente principal constitui uma combinação linear de todas as variáveis originais e são, no seu conjunto, independentes entre si. Os componentes principais são estimados com o intuito de diminuir o número de variáveis retendo, no entanto, o máximo de informação contida nos dados originais. Antes de se submeter os dados à PCA é necessário que estes se encontrem normalizados, de forma a realçar as correlações entre as variáveis, a reduzir a não linearidade e a eliminar o efeito das unidades (Martinez et al., 2009).
2.2.2 Análise discriminante (DA)
A DA, pelo contrário, é uma análise multivariada supervisionada que faz uso da informação dos grupos associados a cada amostra para extrair linearmente as características mais discriminantes com o objetivo de estudar as diferenças entre os diferentes grupos baseados nas características relevantes dos seus elementos. Esta análise pode ser utilizada para fazer uma discriminação entre grupos (intergrupos) ou dentro dos grupos (intragrupos) (Khanmohammadi
et al., 2013).
2.3 Regressão multivariada
Designam-se por regressão as técnicas matemáticas numéricas que permitem determinar uma relação entre dois conjuntos de variáveis. Neste trabalho aplicaram-se dois tipos de regressão, a regressão por componentes principais (PCR) e a regressão por mínimos quadrados parciais (PLS-R).
Na PCR, os dados originais -matriz X- são decompostos em Componentes Principais de forma semelhante ao PCA e faz-se uma regressão múltipla inversa relacionando as componentes desta matriz com as variáveis dependentes (matriz Y).
7 Este método compreende duas fases: uma primeira em que apenas se usa a matriz X para determinar a combinação linear das variáveis (Componentes Principais) e uma segunda fase em que a matriz X é representada por uma matriz de componentes T.
Após isto, pode relacionar-se a matriz X com a matriz Y. O resultado é um modelo de calibração que permite prever o posicionamento de novas amostras a partir dos espetros registados (Kawano et al., 2015).
O método PCR usa apenas a informação espetral (matriz X) enquanto no PLS são considerados os dados espetrais, mas também as variáveis dependentes (matriz Y). A Regressão por Mínimos Quadrados Parciais apresenta, geralmente, um poder de previsão melhor que o PCR. Neste método, recorre-se à informação presente em ambas as matrizes de dados X e Y (ao contrário do anterior que apenas considerava a matriz X) dando origem a novas variáveis designadas por variáveis latentes.
O método PLS envolve três fases:
1. Organização da matriz de dados X a partir dos dados espetrais e da matriz Y a partir das variáveis dependentes;
2. Eliminação de informação não relevante através de combinações lineares das colunas da matriz X (obtida por PCA);
3. O estabelecimento de uma relação entre as matrizes reduzidas X e Y.
Assim sendo, os métodos PCR e PLS fazem uma decomposição dos dados originais espetrais em componentes para construir o modelo de calibração. O método PCR usa apenas a informação espetral (matriz X) enquanto no PLS são considerados os dados espetrais, mas também as variáveis dependentes (matriz Y). Tendo o modelo de calibração, este vai permitir que se faça a estimativa da posição para novas amostras (Argyri et al., 2013).
3. Óleos essenciais
Os óleos essenciais são líquidos oleosos aromáticos obtidos de vários órgãos de plantas como flores, folhas, sementes, raízes e frutos (Korifi et al., 2013). Estes são sintetizados pelas plantas aromáticas como metabolitos secundários como forma de proteção da planta relativamente a bactérias, vírus, fungos, insetos e animais herbívoros em geral. Por outro lado, podem atrair alguns insetos para promover a dispersão de pólen e sementes (Burt, 2004). São caracterizados por terem um odor forte e agradável e alguns apresentam um sabor distinto, sendo muito utilizados nas indústrias de perfumes e aromatizantes (Bakkali et al., 2008).
8 Os OE’s são extraídos de plantas aromáticas geralmente provenientes de países temperados a quentes como no Mediterrâneo e países tropicais (Calo et al., 2015). Estes são líquidos, voláteis, límpidos e raramente coloridos. Não são estritamente óleos embora sejam maioritariamente lipossolúveis, pouco solúveis em água e solúveis em solventes orgânicos (Bakkali et al., 2008).
Desde os tempos mais antigos que as especiarias e ervas aromáticas são usadas não só para fins medicinais, mas também para melhorar as características organoléticas dos alimentos (Calo et al., 2015).
Atualmente são conhecidos cerca de 3000 óleos essenciais dos quais 300 são comercialmente importantes nas indústrias agronómica, alimentar e sanitária, para além das indústrias de cosmética, perfumes e farmacêutica (Bakkali et al., 2008; Bozin et al., 2007).
As atividades antibacteriana, antiviral, antiparasitária, antimicótica e antitoxicogénica e propriedades inseticidas dos componentes de alguns OE são desde há muito conhecidas, o que justifica a sua aplicabilidade na alimentação (Burt, 2004). Devido a estas propriedades os OE são usados como analgésicos, sedativos, anti-inflamatórios e anestésicos locais desde a antiguidade. Mais recentemente, tem sido estudado o seu uso na preservação de alimentos, uma vez que já se conhece melhor o seu mecanismo de ação, particularmente ao nível antimicrobiano (Burt, 2004).
3.1 Composição química dos óleos essenciais
A qualidade, quantidade e composição química dos OE pode variar de acordo com a temperatura e composição do solo (clima), órgão da planta de onde é extraído, idade e fase do ciclo vegetativo (Bakkali et al., 2008). Assim, de modo a obter OE de composição constante, as plantas devem ser colhidas sob as mesmas condições. Os OE para serem comercializados têm de ser analisados por cromatografia em fase gasosa e espetrometria de massa (GC-MS) para que a sua composição seja comparada com monografias analíticas publicadas (Farmacopeia Europeia, ISO, OMS, Conselho da Europa) de forma a garantir a sua qualidade (Angioni et al., 2006).
Os óleos essenciais são uma mistura complexa que pode conter 20-60 componentes em concentrações variáveis. Um OE é caracterizado pelos dois ou três compostos principais que se encontram em maior concentração (20-30%), sendo estes os compostos que determinam as suas propriedades biológicas (Bakkali et al., 2008).
9 Os compostos presentes nos OE pertencem essencialmente a dois grupos bio-sintéticos: terpenos/ terpenóides e aromáticos/ alifáticos, ambos caracterizados por um reduzido peso molecular (Bajpai et al., 2012).
O grupo dos terpenos e terpenóides é o maior. Os terpenos podem ser hemiterpenos (C5), monoterpenos (C10), sesquiterpenos (C15), diterpenos (C20), triterpenos (C30) ou tetraterpenos (C40). Os mais frequentemente encontrados (presentes em maior concentração) são os monoterpenos (C10) e os sesquiterpenos (C15) (Bakkali, et al., 2008).
Os terpenóides são terpenos que contém moléculas de oxigénio. Os monoterpenos contêm duas unidades isoprénicas e são as moléculas mais representativas dos OE, constituindo cerca de 90% destes e podem encontrar-se em várias estruturas desempenhando diversas funções. Estes compostos encontram-se na forma de carboneto, álcool, aldeído, cetona, éster, éter e peróxido de fenóis. Os sesquiterpenos contêm três unidades isoprénicas e desempenham funções semelhantes aos monoterpenos (Bajpai et al., 2012).
O grupo dos compostos aromáticos deriva do fenilpropano, podendo ser aldeídos, álcoois ou fenóis na natureza (Bakkali et al., 2008). Alguns compostos azotados e sulfurosos também podem estar presentes nos OE’s (Bajpai et al., 2012).
Estudos físico-químicos in vitro caracterizam a maioria dos compostos presentes nos OE’s como antioxidantes. Dependendo da sua concentração, os OE’s podem ter efeito citotóxico, mas geralmente não são genotóxicos (Bakkali et al., 2008).
3.2 Extração dos óleos essenciais
Para a extração de OE’s é necessário que se seque a parte da planta a ser utilizada (folhas, caules, flores, etc). O OE é obtido pelo calor e pela pressão, a cor varia entre amarelo pálido a forte, dependendo da planta e da parte usada (Aleksic e Knezevic, 2014).
São vários os métodos usados para a extração de OE’s: destilação a vapor, hidrodestilação, maceração, extração com solventes orgânicos, extração supercrítica em CO2 e
microondas. As duas primeiras são as mais comuns para extração de OE’s comerciais. O tipo de extração vai influenciar o perfil químico dos OE não só na quantidade de moléculas extraídas, mas também no seu arranjo estereoquímico (Bakkali et al., 2008).
O tipo de extração é escolhido de acordo com o objetivo da utilização. Enquanto que na indústria dos perfumes a extração é feita com solventes lipofílicos, por vezes, potenciada com dióxido de carbono supercrítico, na indústria alimentar recorre-se mais frequentemente à destilação a vapor e a hidrodestilação (Bakkali et al., 2008).
10 3.3 Óleo essencial de murta - Myrtus communis L.
A murta (Myrtus communis L.) pertence à família Myrtaceae que contém cerca de 145 géneros e mais de 5500 espécies. O género
Myrtus é composto por aproximadamente 16
espécies de plantas com flor encontradas em partes do Médio Oriente, da Europa e Ásia (Burt, 2004).
De facto, a murta é abundante em regiões com
clima mediterrânico, sendo nativa do sul da Europa, Norte de África e do oeste da Ásia embora também possa ser encontrada na América do Sul, Himalaias e Austrália. Na região da India a murta é cultivada devido à fragrância das suas flores (Nassar et al., 2010).
A murta é uma das espécies aromáticas e medicinais mais importantes da sua família. Consiste num arbusto ou pequena árvore (1,8-2,4m de altura) perene com folhagem pequena e bagas ovais fissuradas (Aleksic e Knezevic, 2014). Esta espécie é muito aromática devido ao alto teor de óleo essencial nas folhas, flores e bagas (Figura 5). As folhas desta planta contêm taninos, flavonóides e óleos voláteis (Mendes et al., 2001).
Algumas partes da planta são usadas na indústria alimentar para aromatizar carnes e molhos e tanto as bagas como as folhas são usadas para preparação de licores com propriedades digestivas (Aleksic e Knezevic, 2014). Na medicina tradicional, as folhas e as bagas são utilizadas como agente antissético, antibacteriano, analgésico e anti-inflamatório (Chalchat et
al., 1998).
Esta planta é usada como especiaria apenas nos países de origem (como Itália) uma vez que tem um sabor amargo e muito intenso apesar do odor agradável (Chidouh et al., 2014). 3.4 Óleo essencial de alecrim - Rosmarinus officinallis L.
O alecrim (Rosmarinus officinalis L.), pertencente à família Lamiaceae, é um arbusto que cresce naturalmente em todos os países mediterrânicos. São conhecidas diferentes espécies de alecrim (R. officinalis, R. eriocalyx, R. laxiflorus e R. lavandulaceus), destas apenas a R.
officinalis cresce naturalmente no mediterrâneo (Angioni et al., 2004; Tassou e Nychas, 1995).
Além de ser usado há muitos séculos como aromatizante alimentar, também é muito importante na medicina tradicional sendo o seu óleo usado para combater cólicas e atenuar os
11 sintomas das doenças do sistema nervoso
(Miresmailli et al., 2006; Wang et al., 2008). Outra utilização frequente do alecrim é como repelente de insetos, apresentando também efeito ovicida e larvicida (Wang et al., 2008).
R. officinalis L. é uma das especiarias com
maior poder antioxidante (Bozin et al., 2007), sendo a única planta cujo óleo é comercializado como antioxidante na Europa e nos Estados Unidos da
América. É comercializado em solução de óleo, em pó e disperso em compostos imiscíveis em água (Miresmailli et al., 2006). O seu óleo essencial é classificado como substância geralmente reconhecida como segura (GRAS), pela FDA (2015) e também de acordo com as Diretivas da Comissão Europeia 2010/67/EU e 2010/69/EU.
Atribui-se a sua capacidade antioxidante a compostos fenólicos como o carnosol, ácido carnósico, rosmanol, rosmadial, epirosmanol, rosmadiferol e ácido reosmarínico. Segundo Peng et al., (2005), o carnosol e o ácido carnósico são diterpenos fenólicos que são responsáveis por 90% da capacidade antioxidante dos óleos comerciais de alecrim. Estes promovem a formação e manutenção dos tecidos do sistema nervoso (Offord, 1997). Em diversos estudos foi demonstrado que o ácido carnósico tem propriedades anticancerígenas, inibindo a proliferação de células anormais (Kosaka e Yokoi, 2003). Além dos efeitos referidos anteriormente, o óleo e o extrato de alecrim também possuem propriedades anti-inflamatórias (Steiner et al., 2001).
Vários estudos referem que o óleo essencial de alecrim é eficaz no controlo de vários microrganismos tanto patogénicos como deteriorativos (Sumbul et al., 2011).
4. Deterioração da carne fresca
Segundo o Regulamento (CE) nº 853/2004, define-se por carne as partes comestíveis dos animais, incluindo o sangue. O termo carne fresca refere-se a carne de animais, incluindo a embalada sob vácuo ou atmosfera modificada, que não tenha sofrido qualquer tipo de tratamento além da refrigeração, congelação ou ultracongelação.
Um alimento diz-se deteriorado quando as suas características sensoriais são consideradas inaceitáveis pelo consumidor (Zhou et al., 2010), sendo comum considerar-se
12 como principais critérios para rejeição os seguintes: descoloração, off-odors e off-flavors fortes e o aparecimento de viscosidade superficial (Ellis et al., 2002).
São vários os fatores que influenciam a vida útil da carne: temperatura, oxigénio atmosférico, atividade da água (aw), luz, enzimas endógenas e desenvolvimento microbiano.
Todos estes fatores, isolados ou combinados provocam alterações de cor, odor, sabor e textura. Embora a deterioração da carne possa ocorrer na ausência de microrganismos, como é o caso da proteólise, da lipólise e da oxidação, o desenvolvimento microbiano é o fator mais importante em relação à deterioração da carne fresca (Nychas et al., 2007).
Assim, a deterioração resulta de fatores intrínsecos e extrínsecos que provocam alterações físicas e/ou químicas. A atividade enzimática endógena post mortem do tecido muscular também contribui para as alterações durante o armazenamento (Zhou et al., 2010).
A temperatura (fator extrínseco) e o pH (fator intrínseco) são fatores importantes para o controlo do desenvolvimento de microrganismos na carne (Nychas et al., 2008).
As alterações do valor de pH são determinantes para o desenvolvimento da microbiota da carne. Antes do abate, parte do glicogénio existente no músculo é convertido em ácido lático, o que reduz o pH da carne que, após o rigor mortis baixa de 7,4 para 5,4-5,5 (Jay et al., 2005 e Nychas et al., 2008). A maioria dos microrganismos tem uma taxa de multiplicação ótima a um valor de pH por volta de 6,6-7,5, no entanto, alguns microrganismos desenvolvem-se a valores de pH abaixo de 4,0 (Jay, 2000).
A temperatura exerce também uma influência importante, sendo, segundo Nychas et al., (2008), o principal fator que influencia a segurança alimentar da carne. Na UE, o Regulamento (CE) Nº 853 (2004) estabelece a temperatura máxima de armazenamento de 7ºC para carnes frescas, 3ºC para miudezas e, para carnes picadas, a temperatura máxima indicada é de 2ºC.
Por fim, o grau de deterioração vai depender não só da composição da carne, mas também das práticas de higiene durante o processamento, embalamento e das condições de armazenamento (Ellis et al., 2002).
4.1 Deterioração microbiana
Considera-se que a atividade microbiana é o principal fator responsável pelo aparecimento de metabolitos considerados indicadores de deterioração nas carnes (Ercolini et
al., 2006; Limbo et al., 2010).
Como já se pôde compreender, as características intrínsecas da carne são favoráveis ao desenvolvimento de diversos microrganismos. As alterações organoléticas variam de acordo
13 com a microbiota presente na carne e com as condições sob as quais esta é armazenada (Nychas
et al., 2007). Estas estão relacionadas com o consumo de nutrientes como açúcares e
aminoácidos livres por parte dos microrganismos que resulta na formação de metabolitos voláteis indesejáveis (Mohareb et al., 2015).
Cargas microbianas a partir de 107 CFU cm−2 estão associadas à ocorrência de off-odors como por exemplo, odor amanteigado; estes podem evoluir para odores frutados quando as contagens aumentam e odores pútridos como resultado do consumo de aminoácidos em cargas superiores a 109 CFU cm−2. Quando a glucose presente na fase aquosa é utilizada, outros substratos são sequencialmente consumidos até que odores de compostos azotados, como amónia e dimetilsulfito, são libertados (Ercolini et al., 2006).
Existem muitas espécies e estirpes de bactérias deteriorativas que podem colonizar a superfície da carne através de diferentes etapas que envolvem a adsorção à sua superfície e ligação por formação de glicocálice. O desenvolvimento destas fases depende dos fatores intrínsecos e extrínsecos como pH, morfologia da superfície da carne, disponibilidade de O2,
temperatura e presença de bactérias (Ercolini et al., 2006).
As bactérias aeróbias e anaeróbias facultativas, Gram-negativas são o grupo com maior potencial deteriorativo. Muitos membros da família Enterobacteriaceae contribuem para a deterioração da carne, no entanto, em carnes armazenadas em refrigeração em condições de aerobiose, os géneros Pseudomonas, Acinetobacter, Psychrobacter e Moraxella apresentam elevadas taxas de multiplicação (Ercolini et al., 2006). O género Pseudomonas é geralmente o dominante por contribuir ativamente para a deterioração devido à sua capacidade de degradar a glucose e os aminoácidos a temperaturas de refrigeração (Mohareb et al., 2015). Embora
Acinetobacter pudesse competir com Pseudomonas spp. por aminoácidos e ácido lático, têm
pouca afinidade pelo oxigénio, o que favorece Pseudomonas spp. (Ercolini et al., 2006). Como já foi referido, a microbiota deteriorativa dominante na carne fresca é geralmente Gram-negativa, no entanto, a população inicial pode incluir géneros Gram-positivos como Bactérias do Ácido Lático (BAL) e Brochothrix thermosphacta (Mohareb et al., 2015). As BAL desempenham um papel importante na deterioração de carne fresca refrigerada e são reconhecidas como importantes competidores com outros grupos de microrganismos deteriorativos. Brochothrix thermosphacta é um microrganismo que pode desenvolver-se na carne sob aerobiose e também anaerobiose provocando off-odors (Ellis et al., 2002).
Todos os produtos alimentares têm uma microbiota específica associada. O potencial de deterioração de um microrganismo é a capacidade que a sua cultura pura tem de produzir
14 metabolitos que vão desencadear os fenómenos associados à deterioração desse alimento (Ercolini et al., 2006). Na carne, como já se referiu, a microbiota específica que contribui para o desenvolvimento da deterioração pertence ao grupo das Enterobacteriaceae, Bactérias do Ácido Lático (BAL), Brochothrix thermosphacta e Pseudomonas spp. (Gram et al., 2002).
a) Microrganismos mesófilos totais
Designam-se por mesófilos todos os microrganismos que se multiplicam a temperaturas de 20ºC a 45ºC, sendo a temperatura ótima entre 30ºC - 40ºC (Jay, 2000).
A contagem de microrganismos mesófilos totais é um indicador microbiológico muito importante, funcionando como índice de qualidade sanitária e segurança alimentar (Gram et al., 2002).
b) Microrganismos psicrotróficos totais
As bactérias que têm a capacidade de se desenvolver a temperaturas de refrigeração (0-7ºC) são designadas por psicrotróficas (Jay, 2000). Estas podem pertencer a géneros Gram-positivos como BAL ou Gram-negativos como Pseudomonas spp. e Enterobacteriaceae (Kodogiannis et al., 2014), sendo no entanto estas condições mais favoráveis aos microrganismos Gram-negativos (Jay, 2000).
c) Enterobacteriaceae
Enterobacteriaceae é uma família de bactérias constituída por bacilos Gram-negativos,
oxidase-negativos, anaeróbios facultativos com metabolismo do tipo fermentativo e que não formam esporos. Esta família de bactérias é ubiquitária, encontrando-se naturalmente presente em resíduos fecais, pode ser também encontrada no solo, água, etc. Alguns membros encontram-se frequentemente em alimentos frescos e congelados como carnes de bovino, suíno e outras (Castellano et al., 2004).
Algumas espécies de Enterobacteriaceae são mesófilas, no entanto as psicrotróficas são as principais responsáveis pela deterioração (Jay, 2000).
Esta família contém alguns géneros patogénicos relevantes como são exemplo
Salmonella e E.coli O157:H7 e géneros deteriorativos como Serratia, Enterobacter, Pantoea, Proteus e Hafnia (Doulgeraki et al., 2011).
d) Pseudomonas spp.
O género Pseudomonas, constituído por 223 espécies e 18 subspécies, é um grupo de bacilos Gram-negativos, móveis, não formadores de esporos e maioritariamente aeróbios. São
15 bacilos aeróbios, oxidase e catalase positiva, apresentam flagelos (são móveis), e têm um pH ótimo inferior a 4,5 e aw inferior a 0,97 (Jay, 2000).
A sua classificação sofreu alterações desde a divisão feita por Palleroni em 1973, na qual este género era subdividido em 5 grupos de acordo com as semelhanças de rRNA de acordo com estudos de hibridização de DNA–DNA (Huis in't Veld, 1996).
Apesar das alterações taxonómicas, as espécies mais relevantes envolvidas na deterioração da carne encontram-se no Grupo I que inclui Pseudomonas aeruginosa,
Pseudomonas fragi, Pseudomonas lundinensis, Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas chlororaphis, Pseudomonas cichorii, Pseudomonas viridiflava e Pseudomonas syringae. Destas espécies, P. fragi é considerada a mais presente em carnes
deterioradas (incidência entre 56,7% e 79,0%), seguida pela P. lundinensis (Jay, 2000).
Pseudomonas spp. constituem o género de bactérias mais encontrado em alimentos
frescos. Estas bactérias são típicas do solo e da água, sendo o grupo de bactérias mais importante no caso da deterioração de alimentos frescos refrigerados uma vez que muitas espécies são psicrotróficas (Jay, 2000). São predominantes em carnes ou produtos à base de carne armazenados em aerobiose em refrigeração (Molina et al., 2013).
Embora estejam normalmente associadas a alimentos deteriorados, a maior parte das espécies de Pseudomonas não são patogénicas (Jay, 2000).
No decorrer da sua ação deteriorativa, estas bactérias começam a usar os aminoácidos, o que resulta num aumento de pH e produção de amónia (Ercolini et al., 2009).
e) Bactérias do ácido lático (BAL)
BAL é um grupo de bactérias em bastonete ou cocos, Gram-positivo, que não formam esporos, catalase e oxidase negativo, anaeróbias facultativas, com pH ótimo entre 4.0 – 4.5. Estas fermentam hidratos de carbono produzindo como principal metabolito o ácido lático (Ercolini et al., 2010).
Os géneros que fazem parte do grupo das BAL são: Lactobacillus, Lactococcus,
Leuconostoc, Pediococcus e Streptococcus. Estas bactérias são frequentemente a microbiota
dominante em alimentos à base de carne embalados em atmosfera modificada em fim de validade (Jay, 2000).
As espécies do género Lactobacillus (Lactobacillus sakei, Lactobacillus curvatus,
Lactobacillus algidus, Lactobacillus fuchuensis, Lactobacillus oligofermentans) estão