Christiane Yumi Muramoto Nicolau
Associação das variantes no
ADIPOQ
e concentrações
séricas de adiponectina com alterações metabólicas em
crianças e adolescentes obesos
Tese apresentada à Faculdade de Medicina da Universidade de São Paulo para obtenção do título de Doutor em Ciências
Área de concentração: Endocrinologia
Orientadora: Profa. Dra. Sandra Mara Ferreira Villares
São Paulo
Este estudo foi desenvovido no Laboratório de Nutrição Humana e Doenças Metabólicas – LIM/25, Faculdade de Medicina da Universidade de São Paulo e no Ambulatório de Obesidade Infantil da Disciplina de Endocrinologia e Metabologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
Apoio: Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) Auxílio pesquisa processo no. 2004/14272-3
Ao meu marido Cassio e ao bebê Lucas
que me acompanharam intensamente nesta
jornada...
Aos meu pai Wilian, à minha mãe Ester, à
minha tia Emiko e à minha irmã Aninha que me
Dra Sandra, agradeço primeiramente a oportunidade da realização
desse estudo. Agradeço ainda a companhia, as dicas e ensinamentos
nesse cinco anos de convivência. Agradeço pelas manhãs corridas
seguidas de um dia cheio no ambulatório... São nesses dias intensos
que mais aprendemos como é bom tratar um paciente com carinho,
respeito e firmeza. Muito obrigada por ser essa pessoa íntegra e
generosa.
Eli, minha madrinha querida! Quem convive com a Eliana sabe o
quanto essa pessoa se preocupa com tudo e todos ao mesmo tempo,
deixando muitas vezes de pensar em si mesma... Como a Dra Sandra
diz... “quem entra no laboratório é mais um filho da Eli!” Muito
obrigada pela sua colaboração nesse estudo, lógico, mas agradeço
principalmente a sua companhia, as conversas, as risadas, as
caronas... ah e também, como não poderia deixar de ser...a sua
insistência em usar o “wave” para a realização do trabalho... isso sim
foi bom!
Bel, sempre companheira e disposta a ajudar, organizaaaaaada, a
única do laboratório... sem ela não teria conseguido encaminhar
nenhuma prestação de contas, nem me organizar com as crianças sem
obesidade... e o ambulatório então? Fica uma bagunça sem a Bel! Bel,
agradeço muito pela paciência ajuda, apoio e incentivo. Muito
obrigada pelas conversas, caminhadas e almoços divertidos pela
laboratórios, máquinas de calcular... Obrigada pelo carinho e
compreensão, pelos cafés de sábado, pelas tardes no consultório,
pelas oportunidades que me oferece sempre e por possibilitar meus
estudos na Faculdade de Medicina de Botucatu e na Faculdade de
Medicina da USP.
Mamãe, muito obrigada pelo apoio, carinho, preocupação e pelos
peixinhos de 5ª, coquinhas e pãezinhos sempre!! Agradeço pelo
cuidado com o bebê Lucas e com isso possibilitar que eu pudesse ficar
mais tempo no Ambulatório e me dedicar mais à elaboração dessa
tese!
Ani, minha irmãzinha linda!!! Muito obrigada por existir e fazer a
minha vida mais flamenca e feliz! Muito obrigada por também cuidar
do bebê Lucas e por me apoiar e dividir angústias da vida!!!
Tia Emiko, muito obrigada por participar de todas as fases da minha
vida, sempre me apoiando, incentivando e me ajudando com muito
cuidado e carinho para que eu pudesse me tornar uma pessoa melhor
a cada dia.
Cassio (More), nem sei o que dizer... muito obrigada por me ajudar e
ensinar. Obrigada pela paciência, compreensão, amor a cada dia e
Lucas (bebê), você ajudou muito a mamãe sendo ese bebê lindo,
tranquilo e esperto. Muito obrigada!
Jane, muito obrigada pela ajuda e cuidados com o bebê Lucas.
Agradeço também por sempre trazer sua alegria para nossa casa!
Cadico, adoro sua frase e saiba que a recíproca é verdadeira!
Liege, agradeço muito sua ajuda com o bebê principalmente nos
primeiros meses! Ela foi fundamental para que eu pudesse continuar a
realização desse estudo!
Sophie, amiga chique, cheia de experiências, histórias, conselhos e
vida! Agradeço todos os bons momentos, as histórias e experiências
trocadas. Obrigada pela ajuda e disponibilidade constantes.
Mari, sempre amiga, divertida e engraçada, com suas histórias
malucas que vão e vem, vem e vão... Muito obrigada por todos esses
bons momentos de convivência nesses anos!
Rafa, Xande, Thais, Simone, Melissa, Danilo, obrigada pela
companhia, pelos bons momentos, pela ajuda e por compartilhar todas
obrigada por estarem ao meu lado há tantos anos. Salve...
Apsaras, agradeço as danças, as risadas, os sábados de ensaio, a
convivência divertida que com certeza me ajudaram a chegar até aqui!
Agradeço às minhas professoras da saudosa Faculdade de Medicina
de Botucatu, Dra Gláucia, Dra Célia, Dra Walkyria, Dra Ana Valéria
e Adriana e aos meus colegas e amigos Fernando, Eliane, Bibiana,
Felipe, Flávio e Juliana que muito colaboraram para o meu
aprendizado e formação médica.
Agradeço à todos do LIM/25 em especial à Angela pelas pipetas, ao
Ricardo pela ajuda no sequenciamento, à Ileana pelas dicas e
sabedoria, à Noriza por sempre resolver as questões burocráticas e
às meninas da tiróide pela animação e companhia.
Agradeço a todos do grupo de obesidade pelas oportunidades
oferecidas, por compartilhar os bons momentos e principalmente pelo
apoio nos momentos difíceis!
Agradeço aos estudantes de medicina, às estudantes de nutrição e
aos residentes que atenderam no ambulatório e contribuíram pra esse
aprendizado fosse mais rico a cada dia.
Ai, cansei!
Eu vou sentar e relaxar as costas no chão
Olhar para o céu e ver as nuvens passando...
devagar respirar...
Esta tese está de acordo com as seguintes normas, em vigor no momento desta publicação:
Referências : adaptado de International Commitee of Medical Journals Editors (Vancouver)
Universidade de São Paulo. Faculdade de Medicina. Serviço de Biblioteca e Ducumentação. Guia de apresentação de dissertações, teses e monografias. Elaborado por Annelise Carneiro da Cunha, Maria Júlia de A. L. Freddi, Maria F. Crestana, Marinalva de Souza Aragão, Suely Campos Cardoso, Valéria Vilhena. 2ª Ed. São Paulo: Serviço de Biblioteca e Documentação, 2005
Summary
1. Introdução 1
1.1. Obesidade na infância e adolescência 1 1.2. Alterações metabólicas relacionadas à obesidade 1
1.3. Tecido adiposo como órgão endócrino 3
1.4. Adiponectina 4
1.4.1. Identificação e características 4
1.4.2. Ação da adiponectina 9
1.4.2.1. Adiponectina e sensibilidade à insulina 9
1.4.2.2. Adiponectina e aterosclerose 10
1.4.2.3. Outras ações da adiponectina 11
1.4.3. Observações clínicas 11
1.4.3.1. Adiponectina e componentes da síndrome metabólica 11 1.4.3.2. Adiponectina em crianças e adolescentes 12 1.4.5. Fatores de aumento das concentrações de adiponectina 14
1.4.6. O paradoxo da adiponectina 15
1.4.7. Estudo molecular da adiponectina 16 1.4.7.1. Variantes do gene da adiponectina 17
2. Objetivos 22
2.1. Objetivos primários 22
2.2. Objetivos secundários 22
3.1.2. Critérios de exclusão 25
3.2. Métodos 25
3.2.1. Avaliação corporal 25
3.2.2. Avaliação da pressão arterial 27
3.2.3. Exames laboratoriais 27
3.2.4. Índices de avaliação de resistência e secreção de insulina 31 3.2.5. Critérios de síndrome metabólica em crianças e adolescentes 31 3.2.6. Critérios utilizados na divisão dos grupos estudados 32
3.2.7. Extração de DNA 33
3.2.8. Reação de Polimerase em Cadeia (PCR) da região promotora, exon 2, ínton 2 e exon 3 do gene da adiponectina 34 3.2.9. Análise por dHPLC (Cromatografia liquida de alta performance
denaturante) 38
3.2.10. Método PCR-RFLP (Polimorfismo do Comprimento de Fragmentos
de Restrição) 40
3.2.11. Sequenciamento dos produtos de PCR da região promotora, exon 2, íntron 2 e exon 3 do gene da adiponectina 41
3.2.12. Análise estatística 42
4. Resultados 44
4.1. Avaliação clínica e metabólica 44
4.2. Avaliação das concentrações séricas de adiponectina 50 4.3. Avaliação do gene da adiponectina 61
4.3.1. SNP-11377C>G 62
4.3.2. SNP+45T>G 64
4.3.3. SNP+349A>G 65
4.3.4. G90S 65
4.3.5. Haplótipos 66
5. Discussão 70
5.1. Avaliação clínica e metabólica 70 5.2. Avaliação das concentrações séricas de leptina 76 5.3. Avaliação das concentrações séricas de adiponectina 76
5.4. Avaliação do gene da adiponectina 82
5.4.1. SNP-11377C>G 82
5.4.2. SNP+45T>G 84
5.4.3. SNP+349A>G 85
5.4.4. Exon 3 85
5.4.5. Haplótipos 87
5.5 Considerações finais 89
6. Conclusões 91
7. Anexos 92
8. Referências 125
ADIPO1 Grupo com menores concentrações séricas de adiponectina
ADIPO2 Grupo com concentrações séricas intermediárias de adiponectina
ADIPO3 Grupo com maiores concentrações séricas de adiponectina
ADIPOob1 Grupo com menores concentrações séricas de adiponectina em obesos
ADIPOob2 Grupo com concentrações séricas intermediárias de adiponectina em obesos
ADIPOob3 Grupo com maiores concentrações séricas de adiponectina em obesos
AMPK Proteína cinase ativada por adeninamonofosfato
AUCins/AUCgli Razão da área sob a curva de insulina e área sob a curva de glicose
apM1 Adiponectina
apo Apolipoproteína
ATPIII Adult treatment pannel III
C Cisteína
CA Circunferência abdominal
CT Colesterol total
db/db Camundongos com resistência à leptina
dHPLC Cromatografia liquida de alta performance denaturante DM2 Diabetes mellitus do tipo 2
DNA Ácido desoxirribonucléico EDTA Ácido etilenodiamiotetracético ELISA Ensaio imunoadsorvente ligado à enzima eNOS Óxido nítrico sintase endotelial
F Fenilalanina
G Glicina
GBP28 Adiponectina
G1 Grupo controle
G2 Grupo não obeso / metabólico
G3 Grupo obeso
G4 Grupo obeso mórbido
H Histidina
HAS Hipertensão arterial sistêmica HDLC Lipoproteína de alta densidade HMW Alto peso molecular
HOMA-IR Homeostasis model assessment para avaliação de resistência à insulina
HOMA%ß Homeostasis model assessment para avaliação de sensibilidade à insulina
HOMA%S Homeostasis model assessment para avaliação de secreção de insulina
I Isoleucina
IBGE Instituto Brasileiro de Geografia e Estatística IDF International Diabetes Federation
IMC Índice de massa corpórea
L Lisina
LDLC Lipoproteína de baixa densidade LMW Baixo peso molecular MG% Percentual de massa gorda
ob/ob Camundongos deficientes em leptina
OR Razão de chances – Odds ratio
P Prolina
PAD Pressão arterial diastólica PAI-1 Inibidor do ativador do plasminogênio PAS Pressão arterial sistólica
PCR Reação de polimerase em cadeia
PCR-RFLP Polimorfismo do comprimento de fragmentos de restrição
PP Pré-púbere
RIE Radioimunoensaio
S Serina
SM Síndrome metabólica
SmaI Endonuclease de restrição SNP Polimorfismo em um único nucleotídeo SREBP Sterol regulatory element binding protein
T Treonina
TNF-α Fator de necrose tumoral alfa TTGo Teste oral de tolerância à glicose
TZD Tiazolidinedionas
VLDL lipoproteína de muito baixa densidade VR Valor de referência
X Qualquer aminoácido
Y Tirosina
Z Desvio padrão
adolescentes obesos [tese]. São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2008
no intron 2, Y111H (rs17366743) e a mutação G90S no exon 3. O SNP-11391G>A estava em desequilíbrio de ligação de Hardy-Weinberg. As variantes Y111H e G90S estavam em forte desequilíbrio de ligação com SNP-11377C>G e G90S com SNP+45T>G. Foi observada associação do alelo G do SNP-11377 a maior adiposidade central e menores níveis séricos de glicose. Após construção dos haplótipos com os SNPs -11377C>G, +45T>G e +349A>G observou-se que a presença do alelo G do SNP-11377T>G associou-se a maior obesidade (GTA vs CTA) , enquanto que a presença dos alelos recessivos dos outros SNPs diminuiu essa associação (GTA vs GGG). Na presença do alelo G do SNP+349A>G (CTG vs CTA), foi observada maior freqüência de indivíduos hipertensos, entretanto a associação dos alelos recessivos dos SNPs -11377C>G e +45T>G (CTG vs GGG) diminuiu a freqüência de hipertensão. Os resultados do presente estudo demonstram que níveis de adiponectina diferem em crianças e adolescentes dependendo do grau de adiposidade e puberdade e que níveis mais baixos estão associados às alterações metabólicas de maior risco cardiovascular na obesidade. Variantes no gene da adiponectina podem estar em desequilíbrio de ligação com um SNP funcional ou um pool gênico responsável por maior risco de obesidade e desenvolvimento de alterações metabólicas relacionadas ao aumento da adiposidade.
“Faculdade de Medicina, Universidade de São Paulo” SP (Brazil); 2008
adiposity and lower glucose levels. Haplotypes were constructed using the SNPs -11377C>G, +45T>G and +349A>G, and the results showed an association between -11377SNP G allele presence and higher adiposity (GTA vs CTA), whereas the presence of the recessive alleles of SNPs +45T>G and +349A>G was associated to a lower adiposity (GTA vs GGG). Hypertension was more frequent in the presence of +349A>G G allele (CTG vs CTA), whereas the presence of the recessive alleles of SNPs -11377 and +45T>G (CTG vs GGG) was not associated to hypertension. This study suggests that adiponectin levels, in Brazilian children and adolescents, depends on degree of adiposity and pubertal stage and that lower adiponectin concentrations are associated to altered metabolic features and higher cardiovascular risk. Variants in the adiponectin encoding gene can be in linkage disequilibrium with susceptibility regions responsible to higher risk of obesity and metabolic related features.
1. INTRODUÇÃO
1.1. Obesidade na infância e adolescência
Obesidade é uma doença crônica, resultante do excesso de tecido
adiposo branco, cuja prevalência vem aumentando em países desenvolvidos
e em desenvolvimento em proporções epidêmicas 1 2. Concomitante ao
aumento global de obesidade, a prevalência de obesidade na infância e
adolescência vem aumentando em todo o mundo3 4. No Brasil, dados do
Instituto Brasileiro de Geografia e Estatística (IBGE) para adolescentes de
10 a 19 anos, mostram que a freqüência de excesso de peso aumentou de
3,9% para 17,9% em meninos e de 7,5% para 15,4% em meninas em 28
anos. A evolução da obesidade mimetizou, com freqüências menores, a
evolução do excesso de peso observada ao longo do mesmo período em
meninos (de 0,1% para 1,8%) e em meninas (de 0,7 para 2,9%)5.
1.2. Alterações metabólicas relacionadas à obesidade
Estudos longitudinais têm demonstrado que principalmente o índice
de massa corpórea (IMC), mas também concentrações séricas de insulina
na infância predizem a presença de fatores metabólicos na idade adulta6 7.
Além disso, as complicações metabólicas da obesidade já estão presentes
no grupo pediátrico e a prevalência de diabetes mellitus do tipo 2 (DM2)
também vêm aumentando, chegando a 4 % em adolescentes americanos8 9.
Condições como dislipidemia, hipertensão arterial (HAS), resistência à
cardiovascular em adultos10. Embora seja ainda controversa a existência de uma síndrome que reúna essas doenças, a coexistência dessas desordens
metabólicas foi chamada de síndrome X, síndrome de resistência à insulina
e, mais recentemente, síndrome metabólica (SM) 11 12 13 14 15 16.
1.3. Tecido adiposo como órgão endócrino
O tecido adiposo branco era tradicionalmente visto como um tecido
inerte com um determinado número de adipócitos 17, que respondia a sinais
neuro-hormonais finais e cuja função seria somente de depósito passivo
para estocagem de lipídios. Consistente com esta hipótese, receptores para
insulina, hormônio corticotrófico e adrenalina são expressos em abundância
nas células adiposas18. Entretanto, a descoberta de que o tecido adiposo
produzia leptina indicou que este também funcionava como um órgão
endócrino. Atualmente é aceito que o tecido adiposo serve de local para
estoque de triglicerídeos e liberação de ácidos graxos livres em resposta às
necessidades energéticas corporais 19. Além disso, o tecido adiposo secreta
grande número de citocinas biologicamente ativas como PAI-1, TNF-α e
leptina, bem como moléculas não peptídicas biologicamente ativas como
ácidos graxos livres20 21 22 23. Dessa forma, o tecido adiposo controla o
metabolismo energético pela secreção de moléculas que sinalizam e
regulam as funções do próprio tecido adiposo, de outros tecidos e órgãos
Dentre elas a adiponectina destacou-se pela sua atuação protetora no
desenvolvimento de resistência à insulina e doenças metabólicas
relacionadas à obesidade.
1.4. Adiponectina
1.4.1. Identificação e características
A adiponectina foi primeiramente identificada entre 1995 e 1996 por
quatro diferentes grupos: Scherer et al., 1995 clonaram o cDNA da
adiponectina em adipócitos murinos 3T3-L1 e denominaram a proteína de
adipocyte complement-related protein of 30kD (Acrp30) 27. Independentemente, Hu et al. em 1996 descreveram a clonagem da AdipoQ
em fibroblastos não-adipogênicos 3T3-C2, pré-adipócitos indiferenciados
3T3-F442A e adipócitos diferenciados 3T3-F442A28. O cDNA homólogo
humano da Acrp30 foi originalmente identificado como a proteína mais
transcrita encontrada em tecido adiposo humano de mulheres, sendo assim
denominada adipose most abundant gene transcript 1 (apM1) por Maeda et
al. em 199629. Nakano et al., 1996 purificaram a proteína Acrp30
diretamente do plasma humano ao avaliar proteínas séricas similares às
proteínas ligadoras do colágeno e a chamaram de GBP2830.
Adiponectina é uma proteína secretóriade 244 aminoácidos e massa
molecular de aproximadamente 30kDa, abundante no plasma,
representando cerca de 0,01% das proteínas séricas totais27 28 29 31. Suas
de 1,7 μg/mLno dia32 33. A secreção de adiponectina parece seguir o ritmo do cortisol e está relacionada ao tônus adrenérgico que leva a um efeito
inibitório direto na expressão e secreção da adiponectina in vitro e in vivo 34
35
. Concentrações séricas de adiponectina não foram correlacionadas com
concentrações séricas de leptina, com a ingestão alimentar, ou com teste de
tolerância à glicose o que sugere que a insulina in vivo não influencie a
secreção de adiponectina33 36.
A análise com Northern blot mostrou que a adiponectina é
principalmente expressa em tecido adiposo 27 29. Além disso, foi
demonstrada sua expressão em linhagem celular de osteoblastos em
cultura, em cardiomiócitos de ratos e em células de musculatura esquelética
em humanos37 38 39.
A adiponectina é uma proteína bastante conservada nas diferentes
espécies sendo que a adiponectina de camundongos apresenta 85% de
homologia com a humana27. A estrutura primária da adiponectina é formada
por uma seqüência sinalizadora amino-terminal, um trecho variável de 27
aminoácidos sem homologia a qualquer proteína em variadas espécies,
seguida de uma região com 22 repetições colágenas40. O domínio
carboxi-terminal globular de 134 aminoácidos mostra-se homólogo aos domínios
globulares dos colágenos tipo VIII e X e às subunidades do fator
complemento C1q com identidade de aproximadamente 31% 27 28 29. Apesar
desta similaridade existem diferenças como a ausência, na adiponectina, de
resíduos cisteína que são responsáveis por formar pontes dissulfido no C1q
o que sugeriu que a adiponectina devesse ter propriedades estruturais e
funcionais distintas da C1q 28.
H N -2 - COOH
aa 1 17 42 110 244
Figura 1. Estrutura da adiponectina e alinhamento da seqüência de seus aminoácidos aa: aminoácidos; SS: Seqüência sinalizadora, RV: Região
variável
A análise da porção globular da adiponectina (aminoácidos 111-244),
determinada por Shapiro L e Scherer PE em 1998, revelou uma estrutura
homotrimérica com centro hidrofóbico formado pela interface de três
monômeros individuais. Dois desses três monômeros têm 10 fitas
gelatinosas enroladas e um monômero tem uma das fitas fazendo uma volta
41
. O achado mais surpreendente foi que, embora a homologia seqüencial
primária seja pequena, a adiponectina é estruturalmente homóloga às
citocinas triméricas da família do TNF-α, e não obstante, o alinhamento
seqüencial dos membros da família TNF-α e da adiponectina revelaram
quatro resíduos conservados (Y161, G159, F237 e L242) importantes para a
formação do centro hidrofóbico do homotrímero e que são cruciais em
manter a arquitetura da proteína 41.
A adiponectina está presente no plasma em estruturas com diferentes
pesos moleculares que variam desde somente a porção globular, trímeros e
até multímeros de peso molecular acima de 300kDa27 30 42 43. A formação
dos trímeros e multímeros se dá pela ligação de pontes dissulfido formadas
SS RV Repetições colágenas Domínio globular
H N -2 - COOH
aa 1 17 42 110 244
entre os resíduos cisteína amino-terminais na posição 39 da proteína que
são essenciais para a formação de multímeros44. Além disso, após a
tradução da proteína, a hidroxilação e glicosilação de resíduos lisina (68, 71,
80, 104) no domínio colágeno são necessárias para que ocorra a
bioatividade plena da adiponectina. Esses eventos pós-traducionais
supõe-se supõe-serem críticos para a estabilidade da estrutura tridimensional da
adiponectina45.
so molecular; HMW: alto peso
olecular
Figura 2. Diferentes estruturas circulantes de adiponectina. LMW:
baixo peso molecular; MMW: Médio pe
A distribuição relativa de multímeros de adiponectina parece ser
diferente na célula adiposa e no plasma, sendo as HMW dominantes na
circulação46. Na literatura encontramos resultados contraditórios em relação
ao benefício do uso das concentrações séricas de adiponectina de alto peso
molecular em detrimento das concentrações séricas de adiponectina total
para associação com parâmetros metabólicos. Estudos demonstram que
concentrações séricas de adiponectina de alto peso molecular associam-se
melhor às alterações metabólicas e sensibilidade à insulina do que
concentrações séricas totais de adiponectina, apesar de também haver
associação das concentrações séricas totais de adiponectina com os
parâmetros estudados 47 48. Outro estudo que avalia concentrações séricas
de adiponectina de alto peso molecular e total em relação a parâmetros
metabólicos demonstra não haver diferenças 49. Em crianças pré-púberes
não existem diferenças nos concentrações séricas de adiponectina HMW ou
LMW entre os sexos, porém em adolescentes e adultos as concentrações
séricas dos multímeros de adiponectina são mais elevadas em mulheres 44
50 51
. Algumas mutações descritas e relacionadas à hipoadiponectinemia
impossibilitam a formação de multímeros da adiponectina, permitindo
somente a formação de trímeros; outras mutações que cursam sem
1.4.2. Ação da adiponectina
A adiponectina exerce sua ação pela ligação a dois tipos de
receptores: AdipoR1 e AdipoR2. Esses receptores de superfície contêm sete
domínios transmembrana, porém são estruturalmente e funcionalmente
distintos dos receptores ligados à proteína G52. O AdipoR1 é expresso
abundantemente no músculo esquelético e endotélio, enquanto que o
AdipoR2 é predominantemente expresso no fígado. Os receptores mediam o
efeito sensibilizador da insulina por ativação da AMPK e PPAR-α 42 53 54
1.4.2.1. Adiponectina e sensibilidade à insulina
Os estudos de Waki et al. e Yamauchi et al.em 2003 demonstraram
que no hepatócito somente a adiponectina completa (composta pelas
porções colágena e globular) age levando a fosforilação do AMPK, e
conseqüente inibição da produção de glicose e a redução de triglicérides
intracelular44 52. Já em miócitos tanto a adiponectina completa quanto sua
fração globular agem estimulando a captação de glicose e diminuindo
triglicérides intracelulares 44 45. A incapacidade da fração globular em agir
nos hepatócitos sugere que a formação de multímeros seja importante para
o efeito estimulatório da adiponectina neste tipo celular44. Esses estudos
demonstram os efeitos metabólicos anti-diabéticos da adiponectina ao
melhorar a sensibilidade à insulina inibindo a produção de glicose, e
estimulando a captação de glicose e oxidação de ácidos graxos. O estudo
de Yamauchi T et al., 2001 demonstra a reversão da insulino-resistência em
administração de adiponectina recombinante confirmando o efeito direto da
adiponectina na sensibilização à ação da insulina 54.
1.4.2.2. Adiponectina e aterosclerose
Em estágios precoces da aterosclerose a ativação de células
endoteliais por estímulos inflamatórios aumenta a aderência de monócitos
mediada pela expressão de moléculas de adesão. Esta adesão de
monócitos ao endotélio da artéria é considerada crucial para o
desenvolvimento de doenças vasculares55.
Estudos demonstraram que concentrações fisiológicas de
adiponectina inibem os efeitos inflamatórios do TNF-α de forma dose
dependente em cultura de células endoteliais humanas por um efeito
pós-receptor no qual a via final é de inibição da indução da expressão de
moléculas de adesão de células inflamatórias32 56. Além disso, foi
demonstrado que a porção globular da adiponectina inibe a proliferação de
células endoteliais induzida por LDLC oxidado por suprimir a geração de
superóxido e aumenta a produção de eNOS nos vasos57. Em modelos
animais, a deficiência de adiponectina aumenta o espessamento da
neoíntima da parede vascular, enquanto que a suplementação de
adiponectina atenua esse espessamento, provavelmente por efeito
supressivo da adiponectina na proliferação e migração das células da
musculatura lisa dos vasos58. Esses estudos demonstram o importante
1.4.2.3. Outras ações da adiponectina
Recentemente foi demonstrado que a adiponectina poderia induzir a
apoptose celular com conseqüente efeito antitumoral, poderia amenizar a
inflamação hepática relacionada a esteatose hepática não alcoólica e ainda
poderia estimular a secreção de insulina ou, também regular a homeostase
energética 59 60 61.
1.4.3. Observações clínicas
1.4.3.1. Adiponectina e componentes da síndrome metabólica
A adiponectina tem sua expressão reduzida em tecido adiposo de
camundongos deficientes em leptina em 70-90% e em tecido adiposo de
humanos obesos em 50 a 80%28.
As concentrações séricas de adiponectina são maiores em mulheres
do que em homens e se correlacionam negativamente com o IMC em
indivíduos de diferentes etnias31 62. Indivíduos obesos e diabéticos têm
concentrações séricas de adiponectina mais suprimidas em comparação
aqueles indivíduos que apresentam somente obesidade e em modelos
animais, a progressão para obesidade e insulino-resistência é acompanhada
de diminuição das concentrações séricas de adiponectina, antes mesmo da
instalação da hiperglicemia, tolerância à glicose diminuída e grau máximo de
obesidade 63 64.
Estudos demonstraram que a adiponectina correlaciona-se
triglicérides e glicemia plasmática pós prandial 62 63. A associação negativa mais importante ocorreu entre as concentrações séricas de adiponectina e
insulino-resistência em índios Pima e caucasianos obesos com
normoglicemia, tolerância à glicose diminuída e DM2 65.
Indivíduos com doença coronariana apresentam concentrações
séricas de adiponectina reduzidas acompanhadas de maior glicemia de
jejum, hemoglobina glicada, triglicérides e menores concentrações de HDLC
sérico e pressão arterial diastólica (PAD) em relação aos controles 24 65 66 67.
Ouchi et al. em 1999 demonstraram que concentrações fisiológicas de
adiponectina inibem a expressão de moléculas de adesão induzidas por
TNF-α in vitro, sugerindo que a adiponectina modulasse a função das
células endoteliais por reduzir reações inflamatórias24. Estes estudos
sugerem que concentrações séricas de adiponectina poderiam estar
relacionadas ao desenvolvimento de aterosclerose e doença arterial
coronariana.
Os estudos em relação à pressão arterial e sua correlação com
concentrações séricas de adiponectina são divergentes68 69 70 71.
Especula-se que Especula-seja difícil correlacionar a adiponectina plasmática com níveis
pressóricos devido às alterações metabólicas múltiplas apresentadas por
estes grupos de indivíduos.
1.4.3.2 Adiponectina em crianças e adolescentes
Em crianças, diferentemente dos adultos, não há diferença nas
as concentrações séricas totais de adiponectina, bem como as
concentrações séricas de adiponectina de alto peso molecular, diminuem em
meninos conforme a progressão da puberdade de modo inverso ao aumento
das concentrações séricas de testosterona 64 74 75.
Em crianças e adolescentes, de forma semelhante ao observado em
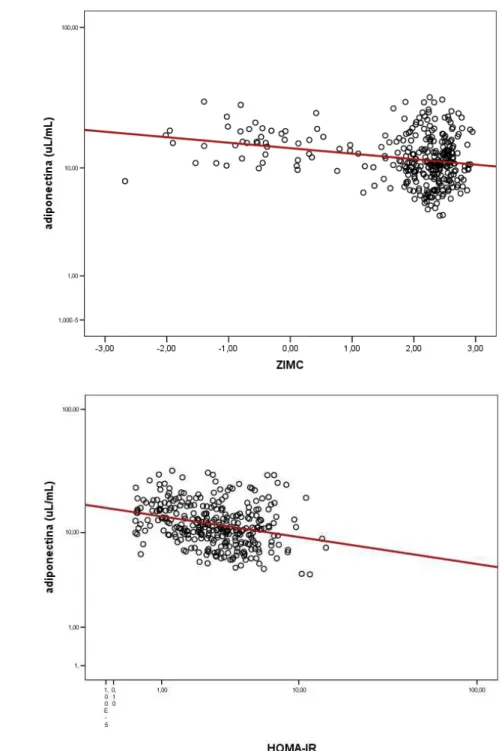
adultos, a adiponectina correlaciona-se inversamente com a obesidade e
aumenta com o emagrecimento de crianças (quando este é maior que 0,5
pontos no desvio padrão do IMC) e de adolescentes que diminuem mais de
19% do peso corpóreo 76 77 78 79. Além disso, as concentrações de
adiponectina plasmática foram inversamente proporcionais à porcentagem
de gordura corporal total e ao conteúdo de gordura intramiocelular em
indivíduos obesos, sugerindo a ação da adiponectina no músculo
esquelético em aumentar a oxidação de ácidos graxos e desse modo
diminuir o conteúdo de triglicérides muscular, como já demonstrado em
modelos animais 50 80.
A Tabela 1, Anexo apresenta as concentrações de adiponectina em
diversos estudos realizados em crianças e adolescentes com e sem
obesidade 76 78 80 81 82 83 84 85.
A adiponectina foi inversamente associada a parâmetros bioquímicos
que se mostraram alterados na obesidade como ácido úrico, triglicérides,
HDLC, insulina, marcadores inflamatórios como Proteína C Reativa e
parâmetros bioquímicos aterogênicos (relação colesterol total/HDLC e apo
B/apo A1), o que sugere que a hipoadiponectinemia possa ser um
de lesões vasculares causadas pela SM no grupo pediátrico79 86. Além disso, Beauloye V et al. demonstraram que a adiponectina foi fator
independente relacionado ao espessamento da camada íntima da carótida
de crianças obesas mostrando que esta pode estar associada ao
desenvolvimento precoce de aterosclerose em jovens87. Observou-se que
somente níveis de PAS correlacionam-se negativamente de forma
independente a adiponectina 88 89.
Concentrações séricas de adiponectina em crianças e adolescentes
correlacionam-se negativamente às doenças metabólicas relacionadas à
obesidade e resistência à insulina.
1.4.5. Fatores de aumento das concentrações de adiponectina
Em contraste com a situação de obesidade e resistência a insulina, as
concentrações de adiponectina elevam-se com a perda de peso, restrição
calórica, exposição ao frio e pelo do tratamento com tiazolidinedionas (TZD),
levando a restauração da sensibilidade à insulina37 42 55 56 90. O tratamento
de camundongos db/db com TZD aumentou dramaticamente as
concentrações de adiponectina plasmática e amenizou a gravidade da
hiperglicemia e insulino-resistência 54 67. De forma similar, o tratamento com
TZD em humanos insulino-resistentes, aumentou as concentrações séricas
de adiponectina90. Esses estudos sugerem que o aumento da sensibilidade
à insulina decorrente do tratamento com TZD pode, em parte, ser mediado
Estudos demonstraram que a administração aguda de adiponectina a
camundongos diminuiu as concentrações de ácidos graxos livres, após
alimentação destes animais com refeição rica em gordura inferindo que a
reposição de adiponectina poderia restabelecer a sensibilidade à insulina e
levar a perda de peso sustentada em camundongos, independente da
ingestão alimentar 42 54 . Um estudo recente in vivo demonstrou que em
camundongos ob/ob, o aumento em 2 a 3 vezes das concentrações séricas
de adiponectina de alto peso molecular melhorou a glicemia, insulinemia e
trigliceridemia, acompanhada de aumento da massa gorda 91, inferindo que
o aumento nas concentrações séricas de adiponectina melhorariam os
fatores relacionados à resistência à insulina independente da adiposidade.
Estes dados demonstram a importância da adiponectina no controle
das doenças metabólicas e sugerem seu possível uso na melhora da
resistência à insulina.
1.4.6. O paradoxo da adiponectina
Sendo o tecido adiposo um tecido endócrino, ou seja, produtor de
citocinas inflamatórias, hormônios e ácidos graxos livres, ao ocorrer sua
expansão, como na situação de obesidade, a produção dessas substâncias
aumenta com exceção das concentrações séricas de adiponectina que
diminuem24.
A expansão do tecido adiposo ou adipogênese, na situação de
composto por hipertrofia das células adiposas, seguida de hiperplasia com
conseqüente estocagem dos ácidos graxos livres na forma de triglicérides92.
Concomitante à expansão do tecido adiposo, são recrutados
macrófagos levando então a um estado pró-inflamatório no tecido adiposo
que culmina com maior secreção de fatores inflamatórios como, por
exemplo, o TNF-α e dessa forma instalando um processo inflamatório
crônico no tecido adiposo 92. A superprodução de TNF-α age na gota de
lipídeo aumentando a liberação de ácidos graxos livres e inibe a transcrição,
bem como as ações do PPAR- , diminuindo a síntese e estocagem de
triglicérides92. Estudos têm demonstrado que o TNF-α inibe a transcrição e
a secreção de adiponectina in vitro, sendo, portanto um dos responsáveis
pela resistência à insulina e hipoadiponectinemia93 94.
1.4.7. Estudo molecular da adiponectina
A localização precisa do gene da adiponectina foi determinada por
Gene Bridge 4 Radiation Hybrid Panel, utilizando primers específicos
desenhados para amplificar a seqüência contendo a região do exon 295. O
gene está localizado no cromossomo 3 (3q27), que é tido como um locus de
susceptibilidade para diabetes tipo 2 e síndromes metabólicas
relacionadas96 97.
O ácido desoxirribonucléico (DNA) genômico apresenta 16kb,
consiste em 3 exons e 2 introns, com um primeiro intron lembrando a
estrutura gênica do colágeno X humano 95. Todas as transições intron-exon
aminoácidos amino-terminais são codificados pelo exon 2 . O estudo da
região promotora revelou a presença de um box clássico CCAAT em -136 e
várias regiões para ligação de fatores transcricionais. Foram achados locais
de ligação para C/EBP, que sabidamente regulam a diferenciação dos
adipócitos99.
Figura 3. Gene da adiponectina humana
1.4.7.1. Variantes do gene da adiponectina
Em indivíduos japoneses foram descritos 10 polimorfismos de um
único nucleotídeo (SNPs), cinco mutações no exon 3, em local
correspondente ao domínio globular da adiponectina e uma no exon 2. Os
SNPs detectados foram SNP -11414, -11379, -11365, -4034, -3964, +45,
+276, +349, +712, +2019, sendo que os SNPs -4034 e -3964 associaram-se
positivamente com a resistência à insulina100. Das cinco mutações
detectadas no exon 3: G84R, R112C, I164T, R221S, H241P, a I164T foi
encontrada em indivíduos diabéticos e intolerantes a glicose e foi associada
a uma menor concentração de adiponectina plasmática; indivíduos com
adiponectina, não sendo esta, porém, mais freqüente em diabéticos neste
estudo 95 101.
Vasseur F et al. em 2002 avaliaram indivíduos franceses DM2 e não
diabéticos e encontraram as 10 SNPs descritas em indivíduos japoneses e
mais duas: SNP -11156 insCA e SNP –11043 C>T 102. Além disso,
encontraram quatro mutações raras no exon 3: G84R, G90S, R92X, Y111H.
Entre as 10 SNPs genotipadas nas populações japonesa e francesa,
somente a SNP -11377C>G não diferiu em freqüência alélica. De todas as
mutações pontuais no exon 3 descritas na literatura somente a G48R foi
comum nas populações japonesa e francesa. Nenhum dos estudos reportou
mutações que poderia afetar o splicing. Na população francesa não foram
detectados R112C, I164T, R221S e H241P e os grupos japoneses não
descreveram G90S e Y111H, o que indica que mesmo as mutações pontuais
são específicas para cada população ou seriam extremamente raras nestas
populações em que não foram encontradas102.
Existem indicações de que as concentrações de adiponectina sejam
moduladas por algumas variantes do seu gene, incluindo SNPs -11391G>A
e -11377C>G, localizadas na região promotora proximal, e as mutações
G90S e Y111H, no exon 3102. O SNP -11391G>A relaciona-se a maiores
concentrações séricas de adiponectina em adultos e em crianças com e sem
obesidadee o SNP -11377C>G a menor HOMA-IR em crianças obesas e a
maior risco de obesidade e IMC 103 104. O estudo de Bouatia-Naji et al.
demonstrou que nessa região não existem locais de ligação de fatores de
fatores repressores da transcrição da proteína103. Além disso, foi demonstrado em estudo funcional, que na região promotora a partir da base
-676 é crucial para a transcrição do gene da adiponectina, provavelmente
por esta ser um região onde existem domínios de ligação para fatores de
transcrição como SREBP e C/EBP105.
Somente mutações que afetam o domínio colágeno (G48R, G90S), a
dobra entre os domínios colágeno e globular (Y111H, R112C) ou a parte
proximal do domínio globular (I164T) têm efeito nos concentrações séricas
de adiponectina38. Nestas regiões, altamente conservada nas espécies
(murinos, camundongos e humanos), são encontrados resíduos lisina que
são hidroxilados e glicosilados levando a seis isoformas de diferentes pesos
moleculares45 78. A glicação dos resíduos lisina é essencial para formação
de multímeros e modulação da sensibilidade à insulina45 106. Além disso,
mutações das glicinas nas posições 84 e 90 poderiam reduzir o número de
repetições colágenas, alterando a estrutura da adiponectina38. Estas
mutações pontuais interferem com modificações pós-translacionais e/ou
organização espacial. Mutações nas posições 111 e 112 podem impedir a
organização espacial da proteína com alteração na sua função ou secreção.
A mutação G90S cursa com deficiência de multímeros de alto peso
molecular e se associa a menores níveis de adiponectina, porém não à
resistência à insulina, enquanto que a variante Y111H está associada ao
risco de DM2 mas não à obesidade38 102 107. Mutações na parte C-terminal
da proteína (R221S, H241P) parecem não ter efeito nas concentrações de
A Tabela 2, Anexo apresenta estudos de associação dos
SNP-11391G>A, -11377C>G, +45T>G, +276G>T e +349A>G 85 102 103 108 109 110
111
.
Visto que mutações no gene da adiponectina podem estar associadas
a hipoadiponectinemia e doenças como obesidade, resistência à insulina,
dislipidemia e aterosclerose, pretendemos, neste estudo, avaliar quais são
as mutações no gene da adiponectina existentes em um grupo de crianças e
2. OBJETIVOS
2.1. Objetivos primários
• Avaliar as concentrações séricas de adiponectina em crianças e
adolescentes obesos e não obesos.
• Pesquisar mutações e polimorfismos do gene da adiponectina em
crianças e adolescentes obesos e não obesos
2.2. Objetivos secundários
• Correlacionar concentrações séricas de adiponectina com os
parâmetros antropométricos e metabólicos
• Associar as mutações e polimorfismos encontrados com as
concentrações séricas de adiponectina
• Associar as mutações e polimorfismos encontrados com os
3. CASUÍSTICA E MÉTODOS
A pesquisa foi desenvolvida no Ambulatório de Obesidade Infantil do
Grupo de Obesidade da Disciplina de Endocrinologia e Metabologia do
Hospital das Clínicas da Faculdade de Medicina da Universidade de São
Paulo e no Laboratório de Investigação Médica/25 da Faculdade de
Medicina da Universidade de São Paulo.
O estudo foi aprovado pela Comissão de Ética da Instituição
(Cappesq). Os pais ou responsável assinaram o termo de consentimento
após esclarecimento verbal e por escrito da pesquisa. As crianças e
adolescentes consentiram verbalmente sua participação no estudo.
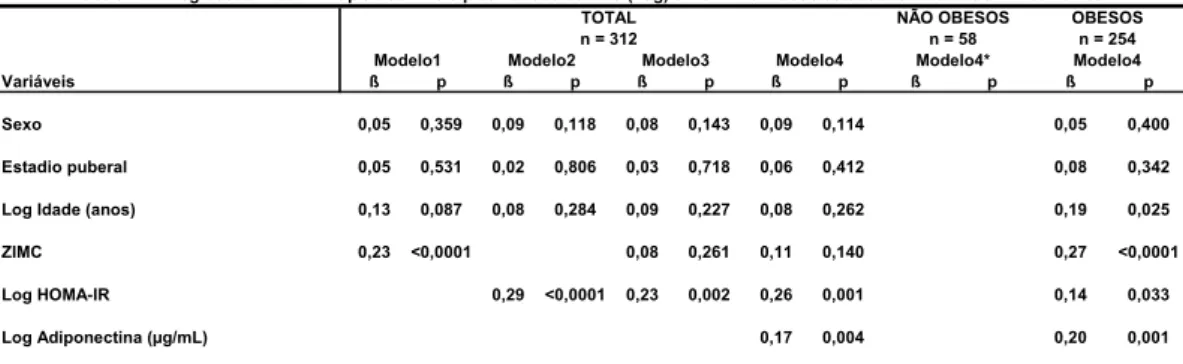
3.1. População do estudo
Avaliamos clinica e laboratorialmente 312 crianças e adolescentes,
254 obesos do Ambulatório de Obesidade Infantil e 58 não obesos, 191
(61%) do sexo feminino (F) e 121 (39%) do sexo masculino (M); 162 (52%)
pré-púberes (PP) e 151 (48%) púberes (PUB), avaliados pelos critérios de
TANNER; 160 (51%) brancos, 83 (27%) mulatos e 37 (12%) negros, 32 sem
informação (10%), avaliados pelo fenótipo.
3.1.1. Critérios de inclusão
O grupo obeso foi composto por crianças e adolescentes de ambos os
sexos, de 7 a 14 anos, que procuraram por tratamento para obesidade no
clínicos necessários para a avaliação e soro disponível para a dosagem de
adiponectina.
O grupo não obeso foi composto por crianças e adolescentes de
ambos os sexos, de 6 a 14 anos, trazidas pelos pais que se interessaram
pela possibilidade de avaliação médica, nutricional e laboratorial oferecida
pelo grupo do Ambulatório de Obesidade Infantil. As crianças foram
provenientes da escola EMEF Professor Olavo Pezotti e do próprio serviço,
filhos de funcionários do Hospital das Clínicas e da Faculdade de Medicina
da USP.
3.1.2. Critérios de exclusão
Indivíduos aparentados, com uso crônico de medicação, com
descendência oriental ou portadores de síndromes genéticas relacionadas à
obesidade.
3.2. Métodos
3.2.1. Avaliação corporal
Peso (kg): Aferido duas vezes, considerado peso médio. Foi utilizada
balança digital Filizola®, com capacidade máxima de 150kg com graduações
de 100 em 100 gramas, estando os participantes da pesquisa descalços e
com roupas leves.
Desvio padrão do peso (Zpeso): Cálculo matemático que ajusta o peso
aferido para idade e sexo: Zpeso = (peso aferido- peso esperado)/ desvio
Estatura (cm): Aferida três vezes, considerada estatura média. Utilizado
estadiômetro, graduado em centímetro e com barra de madeira vertical e
fixa, com esquadro móvel, para posicionamento sobre a cabeça do
indivíduo, estando o mesmo descalço, com os pés unidos, em posição ereta,
olhando para frente.
Desvio padrão da altura (Zaltura): Cálculo matemático que ajusta a
estatura aferida para idade e sexo: Zaltura = (estatura aferida - estatura
esperada)/ desvio padrão da estatura.
Índice de massa corpórea (IMC) (kg/m2): Cálculo matemático:
peso(kg)/altura(m)2. O indivíduo foi considerado eutrófico quando IMC < p85
para idade e sexo, sobrepeso quando IMC ≥ p85 e < p95e obeso quando
IMC ≥ p95 nas curvas de IMC do cdc112.
Desvio padrão do IMC (ZIMC): Cálculo matemático – método LMS102: Z escore = 1/S loge(Q/M), no qual Q = IMC; S = coeficiente de variação
individual para sexo e idade; M = mediana. Em estudo realizado no nosso
grupo, dividimos o ZIMC em tercis e demonstramos que crianças e
adolescentes com ZIMC > 2,45, apresentam menor HDLC, maior resistência
à insulina e maior ocorrência de SM, o que confere maior risco
cardiovascular113. De forma semelhante, Weiss propõe em seu estudo que
indivíduos com ZIMC ≥ 2,50 seriam obesos mórbidos114. Portanto a
obesidade será classificada em leve ou moderada se IMC ≥ p 95 para idade
e sexo e ZIMC < 2,50, e grave se IMC ≥ p 95 e ZIMC ≥ 2,50.
Circunferência abdominal (CA) (cm): Fita plástica não-elástica com 0,7 cm
quando estivesse acima de p90 para idade e sexo de acordo com as
Tabelas de Fernandez JR et al., 2004115.
Bioimpedanciometria: O aparelho de bioimpedância elétrica utilizado para
a avaliação da composição corporal foi o Body Composition Analyser
(BiaQuantum RJL Systems, Inc, MI, EUA). A bioimpedância foi realizada
com os indivíduos adequadamente hidratados em decúbito dorsal, sobre
uma superfície não condutora, com os membros separados. O relatório da
composição corporal discriminando o percentual de massa gorda (MG%) e
massa magra foram obtidos a partir das medidas de reactância e resistência,
e dados referentes a sexo, idade, altura e peso.
3.2.2. Avaliação da pressão arterial
A pressão foi aferida pelo método auscultatório, com manguito apropriado
para a circunferência do braço. Para se avaliar a hipertensão arterial
sistêmica (HAS), as concentrações de pressão sistólica (PAS) e diastólica
(PAD) foram comparados aos percentis das Tabelas do National High Blood
Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents116, para sexo, idade e percentil da altura. A pressão arterial foi considerada alterada quando se encontrasse acima do
p90.
3.2.3. Exames laboratoriais
A coleta de sangue venoso periférico foi realizada após 8 a 12 horas de
Glicose (mg/dL): A determinação da glicose plasmática foi realizada no
Laboratório Central do Hospital das Clínicas da Faculdade de Medicina da
Universidade de São Paulo. A concentração plasmática de glicose foi
determinada pelo método enzimático colorimétrico automatizado utilizando a
hexoquinase. Valor de referência (VR): 10 – 100 mg/dL. Segundo as
recomendações da Associação Americana de Diabetes, consideramos
glicemia de jejum alterada quando a glicose em jejum encontrava-se entre
100mg/dL e 125mg/dL; tolerância à glicose diminuída quando a glicemia 120
minutos após 75g de glicose encontrava-se entre 140mg/dL e 199 mg/dL; e
diabetes mellitus do tipo 2 quando a glicemia de jejum encontrava-se ≥
126mg/dL em duas medidas ou, também, glicemia 120 minutos após 75g de
glicose ≥ 200mg/dL117.
Insulina (mU/L): A concentração sérica de insulina foi determinada no
Laboratório de Hormônios do Hospital das Clínicas Faculdade de Medicina
da Universidade de São Paulo utilizando-se o kit B080-101 AutoDELFIA,
PerkinElmer do Brasil. VR: < 25 mU/L. Indivíduos pré púberes foram
considerados hiperinsulinêmicos quando concentrações séricas de insulina
em jejum estavam ≥ 15mU/L, já para os púberes, o nível de corte utilizado foi
de 20mU/L, já que na puberdade existe aumento das concentrações séricas
de insulina basal 118 119.
Ácido úrico (mg/dL): A concentração sérica de ácido úrico foi determinada
no Laboratório Central do Hospital das Clínicas da Faculdade de Medicina
automatizado. VR: 2,4 – 5,7 mg/dL para mulheres; 3,4 – 7,0 mg/dL para
homens.
Colesterol total (CT) (mg/dL): A concentração plasmática de CT foi
determinada no Laboratório Central do Hospital das Clínicas da Faculdade
de Medicina da Universidade de São Paulo por sistema automatizado
modular, utilizando kits enzimáticos comerciais da Roche (Mannhein,
Alemanha). VR: < 200mg/dL.
Lipoproteína de baixa densidade (LDLC) (mg/dL): A concentração
plasmática de LDLC foi determinada pelo cálculo matemático pela equação
de Friedwald, no qual LDLC = CT - (HDLC + VLDLC)120. VR: < 130 mg/dL.
Lipoproteína de alta densidade (HDLC) (mg/dL): A concentração
plasmática de HDLC foi determinada no Laboratório Central do Hospital das
Clínicas da Faculdade de Medicina da Universidade de São Paulo por
sistema automatizado modular, utilizando kits enzimáticos comerciais da
Roche (Mannhein, Alemanha). VR: > 45 mg/dL. Adotamos o nível de corte
de 40 mg/dL para diagnosticar baixo HDLC121.
Triglicérides (mg/dL): A concentração plasmática de triglicérides foi
determinada no Laboratório Central do Hospital das Clínicas da Faculdade
de Medicina da Universidade de São Paulo por sistema automatizado
modular, utilizando kits enzimáticos comerciais da Roche (Mannhein,
Alemanha). VR: <150mg/dL. Consideramos hipertrigliceridemia quando
níveis de triglicérides estiveram acima de 110 mg/dL 121
Adiponectina (µg/mL): A concentração sérica de adiponectina foi
Faculdade de Medicina da Universidade de São Paulo – LIM/25.
Inicialmente a dosagem das concentrações séricas de adiponectina foi
realizada por radioimunoensaio (RIE), porém as dosagens eram repetidas,
os valores não eram reprodutíveis (r = 0,30, p = 0,009). Por este motivo foi
realizada a dosagem da adiponectina por ELISA em duplicata com o kit
EZHADP-61K, marca Linco Research, Inc. St Charles, Missouri – USA. A
correlação entre as duas dosagens (RIE e ELISA) foi regular (r = 0,42, p <
0,0001), porém diferente da correlação mostrada pela empresa que
comercializa os kits. VR: não padronizado. As concentrações séricas de
adiponectina foram divididas em tercis tanto no grupo total quanto no grupo
obeso. No grupo total foram criados três grupos com 104 indivíduos com os
seguintes níveis de adiponectina: ADIPO1: 4,2 – 9,9 μg/mL, ADIPO2: 9,9 –
13,6 μg/mL, ADIPO3: 13,7 – 32,5 μg/mL. No grupo obeso foram criados três
grupos com 84 ou 85 indivíduos com os seguintes níveis de adiponectina:
ADIPOob1: 4,2 – 7,7 μg/mL, ADIPOob2: 9,5 – 12,9 μg/mL, ADIPOob3: 13,0
– 32,5 μg/mL.
Leptina (ng/mL): A concentração sérica de leptina foi determinada no
Laboratório de Nutrição Humana e Doenças Metabólicas da Faculdade de
Medicina da Universidade de São Paulo – LIM/25 pelo kit EZHL-80SK
(ELISA), marca Linco Research, Inc. St Charles, Missouri – USA. VR: 3,7 –
11,1 ng/mL para mulheres; 2,0 – 5,6 ng/mL para homens. As análises foram
3.2.4. Índices de avaliação de resistência e secreção de insulina
Razão da área sob a curva de insulina e glicose (AUCins/AUCgli): Este
índice, que avalia a secreção de insulina em relação à glicose, foi calculado
com base nos concentrações séricas de glicose e insulina nos tempos (T) 0,
30, 60, 90, 120 minutos após ingestão de 1,75 gramas de glicose anidra ou
equivalente por kg de peso até o máximo de 75 gramas do teste oral de
tolerância à glicose (TTGo). O TTGo foi realizado somente nos obesos.
HOMA-IR: calculado pela fórmula matemática: insulina T0 (μU/mL) x glicose
T0 (mmol/L)/22,5122. Para que pudessemos comparar valores de HOMA-IR
relacionados à obesidade ou às alterações metabólicas dividimos seus
valores em tercis: HOMA-IR1: 0,4 – 2,2; HOMA-IR2: 2,2 – 3,8; HOMA-IR3:
3,8 – 14,4. Dessa forma, indivíduos no tercil 1 de HOMA-IR são mais
sensíveis à insulina, enquanto que aqueles no tercil 3 são mais resistentes à
ação da insulina.
HOMA%S: Cálculo matemático que infere a sensibilidade à insulina,
realizado em um programa de computador fornecido pela Universidade de
Oxford123.
HOMA%ß: Cálculo matemático que infere a função da célula beta
pancreática no basal, realizado em um programa de computador fornecido
pela Universidade de Oxford 123.
3.2.5. Critérios de síndrome metabólica em crianças e adolescentes
Considerando-se que não existe consenso em relação à definição de
ATPIII adaptado para o grupo pediátrico124. Portanto, a SM será
diagnosticada quando existirem três ou mais dos seguintes fatores: CA ≥
p90, glicose em jejum ≥ 100 mg/dL, triglicérides ≥ 110 mg/dL, HDLC < 40
mg/dL, PAS ou PAD ≥ p90.
3.2.6. Critérios utilizados na divisão dos grupos estudados
Inicialmente comparamos o grupo não obeso com o grupo obeso,
entretanto percebemos que os dois grupos eram muito heterogêneos, em
relação à presença de alterações metabólicas e grau de adiposidade.
Portanto, dividimos os indivíduos não obesos em dois grupos: um grupo
controle formado por crianças eutróficas e sem alterações metabólicas (G1)
e um grupo com crianças sobrepeso e crianças sem alteração da
adiposidade, mas com pelo menos uma das seguintes alterações
metabólicas: glicemia de jejum ≥ 100 mg/dL, HDLC < 40 mg/dL, TG ≥ 110
mg/dL, PAS ou PAD ≥ p90 (G2). Da mesma forma, na tentativa de diminuir a
heterogeneidade da amostra, dividimos o grupo obeso em obesos (G3) e
obesos mórbidos (G4), já que em estudo prévio realizado em nosso grupo
constatamos que crianças e adolescentes com ZIMC > 2,45, apresentaram
menor HDLC, maior resistência à insulina e maior ocorrência de SM113.
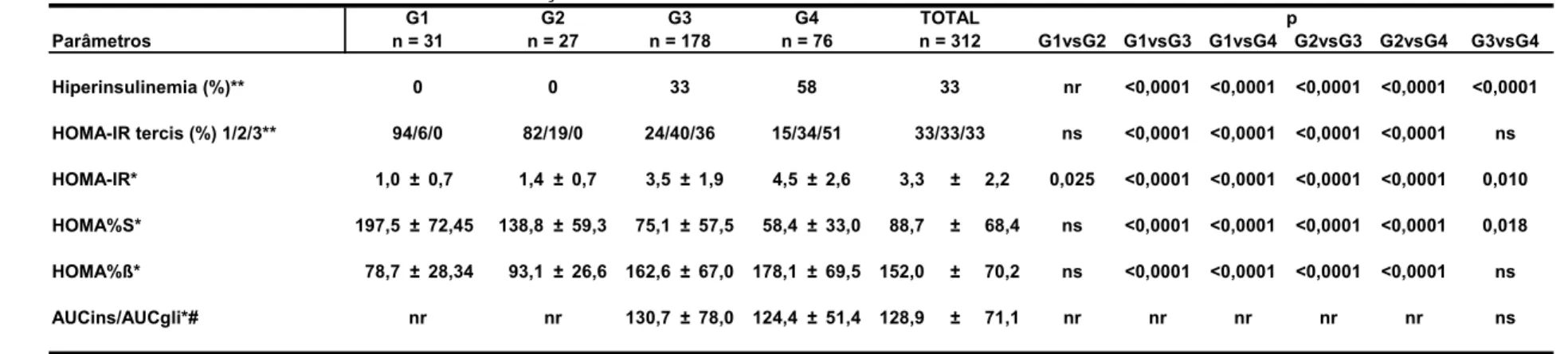
Conforme os critérios descritos acima, os 312 indivíduos foram
divididos em quatro grupos:
• G1 – grupo controle: 31 (10%) (IMC < p 85 e sem nenhuma
• G2 – grupo não obeso/metabólico: 27 (9%) (IMC < p 95 ou, também, com pelo menos uma alteração metabólica)
• G3 – grupo obeso: 178 (57%) (IMC ≥ p95 e ZIMC < 2,5);
• G4 – grupo obeso mórbido: 76 (24%) (IMC ≥ p95 e ZIMC ≥ 2,5)
3.2.7. Extração de DNA - procedimento com sal (Salting Out)125.
Esse procedimento segue o protocolo de Miller, Dykes e Polesky.
Foi coletado 10 mL de sangue venoso em tubos contendo ácido
etilenodiamiotetracético (EDTA 25mM).O pellet leucocitário foi obtido a partir
da lise do glóbulos vermelhos utilizando solução de lise de hemácias (1mM
NH4HCO3, 114mM NH4Cl), com incubação a 4oC por 30 minutos, seguida
de centrifugação do material a 3000rpm, a 4ºC por 15 minutos
desprezando-se o sobrenadante.Esdesprezando-se procedimento foi repetido mais uma vez. O botão
de glóbulos brancos foi então suspenso em 6 mL de solução de glóbulos
brancos (TEN buffer), 120uL de SDS 10% e proteinase K 80 uL (100 ug/mL)
e incubadadurante 18 horas à 37ºC. Foi adicoinado 2,4mL de cloreto de
sódio saturado. Agitou-se vigorosamente a solução por 15 segundos e o
material foi centrifugado por 15 minutos, a 3000 rpm. O sobrenadante
contendo DNA desproteinizado foi transferido para um tubo limpo no qual foi
adicionado dois volumes de etanol absoluto gelado e homogeneizado
cuidadosamente por inversão. O DNA precipitado foi retirado do tubo lavado
duas vezes com etanol gelado a 70% e posteriormente com etanol absoluto.
Em seguida foi centrifugado à vácuo durante 5 minutos e ressuspenso em
A concentração do DNA foi estimada a partir da leitura da densidade
óptica por espectrofotometria com luz ultravioleta (Gene Quant pro
RNA/DNA calculator, Pharmacia Biotech, Cambridge, England). O grau de pureza foi avaliado pela relação de absorbância de 260 e 280nm, e a
integridade do material verificada após eletroforese em gel de agarose a 1%.
As amostras foram armazenadas até sua utilização.
3.2.8. Reação de Polimerase em Cadeia (PCR) da região promotora,
exon 2, íntron 2 e exon 3 do gene da adiponectina
Realizamos as reações de PCR em um volume final de 26 μL de
reação, utilizando aproximadamente 250 ng de DNA como template. Os
primers utilizados estão na Tabela 3 (Anexo).
A região promotora foi avaliada com dois pares de primers devido a sua
extensão. As reações de PCR continham: PCR buffer (INVITROGEN Life
Technologies) 1X concentração final, 50 mM MgCl2 (INVITROGEN Life
Technologies), 100 mM desoxinucleotídeos (dNTP) (GIBCO Life
Technologies), 20 pmol de cada primer (Tabela 3, Anexo) e 1,25 U de
Platinum Taq DNA Polymerase (INVITROGEN Life Technologies). Incubamos as amostras durante 1 minuto a 95º C para a denaturação das dupla- fitas de
DNA em termociclador (Gene Amp PCR System 9600, Perkin-Elmer, EUA ). A
seguir, submetemos as mesmas a 35 ciclos (1min a 94º C; 1min a 60º C; e
1min a 72° C) e, após o último ciclo, realizamos a etapa de extensão final por
Para o exon 2 as reações de PCR continham: PCR buffer
(INVITROGEN Life Technologies) 1X concentração final, 50 mM cloreto de
magnésio (MgCl2) (INVITROGEN Life Technologies), 100 mM dNTP Mix
(GIBCO Life Technologies), 20 pmol de cada primer (Tabela 3, Anexo) e 1,25
U de Platinum Taq DNA Polymerase (INVITROGEN Life Technologies).
Incubamos as amostras durante 5 minutos a 95º C para a denaturação das
dupla- fitas de DNA em termociclador (Gene Amp PCR System 9600,
Perkin-Elmer, EUA). A seguir, submetemos as mesmas a 40 ciclos (30 seg a 95º C;
30 seg a 60º C; e 1min 15 seg a 72° C) e, após o último ciclo, realizamos a
etapa de extensão final por 10 minutos a 72° C.
Para o íntron 2 as reações de PCR continham: PCR buffer
(INVITROGEN Life Technologies) 1X concentração final, 50 mM cloreto de
magnésio (MgCl2) (INVITROGEN Life Technologies), 100 mM dNTP Mix
(GIBCO Life Technologies), 20 pmol de cada primer (Tabela 3, Anexo) e 1,5
U de Taq DNA Polymerase (INVITROGEN Life Technologies). Incubamos as
amostras durante 4 minutos a 94º C para a denaturação das dupla- fitas de
DNA em termociclador (Gene Amp PCR System 9600, Perkin-Elmer, EUA). A
seguir, submetemos as mesmas a 30 ciclos (1 min a 94º C; 1 min a 56º C; e 1
min a 72° C) e, após o último ciclo, realizamos a etapa de extensão final por
10 minutos a 72° C.
Para o exon 3 as reações de PCR continham: PCR buffer
(INVITROGEN Life Technologies) 1X concentração final, 50 mM MgCl2
(INVITROGEN Life Technologies), 100 mM dNTP Mix (GIBCO Life
Anexo) e 1,25 U de Platinum Taq DNA Polymerase (INVITROGEN Life Technologies). Incubamos as amostras durante 5 minutos a 95º C para a
denaturação das dupla- fitas de DNA em termociclador (Gene Amp PCR
System 9600, Perkin-Elmer, EUA ). A seguir, submetemos as mesmas a 40
ciclos (30 seg a 95º C; 30 seg a 54º C; e 1 min 15 seg a 72° C) e, após o
último ciclo, realizamos a etapa de extensão final por 10 minutos a 72° C.
Os géis de agarose a 2% demonstrando os produtos da reação de PCR
para região promotora, exon 2, íntron 2 e exon 3 são demonstrados nas
Figuras 4, 5, 6 e 7.
1kb 1F/1R NEG 2f/2R NEG
516
394
344
298
534pb
508pb
pb
1kb 1F/1R NEG 2f/2R NEG
516
394
344
298
534pb
508pb
pb
Figura 4. Gel de agarose demonstrativo dos produtos da reação de PCR da
região promotora. prom1: região promotora 1; prom2: região promotora 2;
400pb
400pb
Figura 5. Gel de agarose demonstrativo dos produtos da reação de PCR do
exon 2.
504pb
504pb
Figura 6. Gel de agarose demonstrativo dos produtos da reação de PCR do
672pb
672pb
Figura 7. Gel de agarose demonstrativo dos produtos da reação de PCR do
exon 3.
3.2.9. Análise por dHPLC (Cromatografia liquida de alta performance
denaturante)
A pesquisa de mutações e polimorfismos pelo método de dHPLC
consiste em submeter os produtos de PCR à cromatografia líquida de fase
reversa íon-pareada em coluna contendo partículas alquiladas não-porosas.
Em condições de denaturação parcial ao calor, juntamente com gradiente
linear de acetonitrila, os heteroduplexes formados nas amostras de PCR,
que têm variação na seqüência interna, possuem um tempo de retenção
menor em comparação aos homoduplexes. Portanto, o perfil das curvas de
eluição para os heteroduplexes será distinto daqueles com seqüência
homozigota, o que possibilita a identificação de amostras com polimorfismos
ou mutações (Figura 6). Utilizamos o software WAVEMAKERTM,
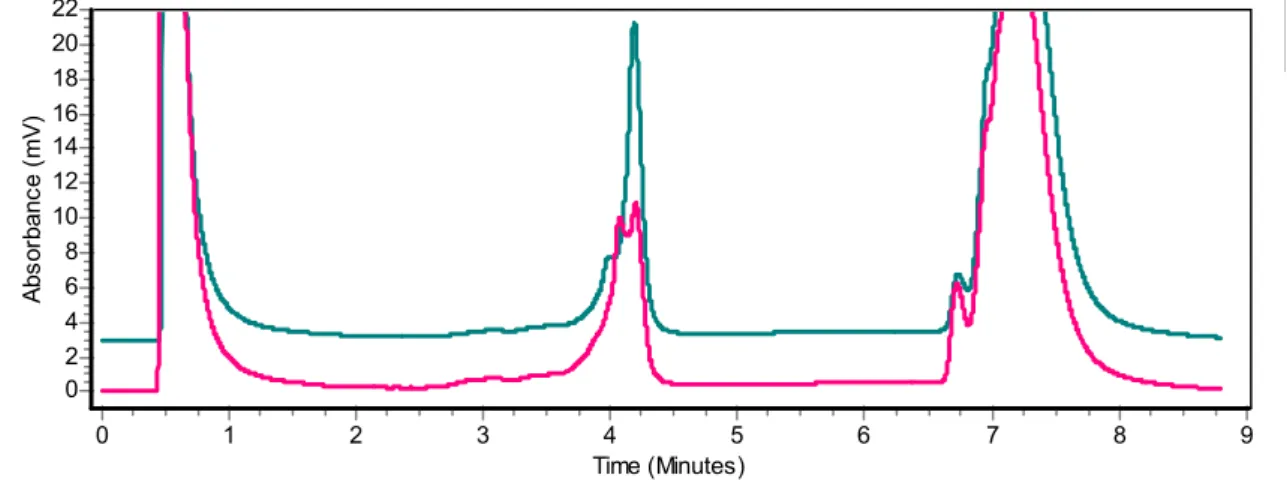
Transgenomic, Inc. Omaha para otimização da temperatura de denaturação
Time (Minutes) 9 8 7 6 5 4 3 2 1 0 A bs or banc e ( m V ) 22 20 18 16 14 12 10 8 6 4 2 0
Figura 8. Cromatograma ilustrativo de curvas obtidas no rastreamento do
exon 2 e exon 3 do gene da adiponectina. Curva superior: homoduplex;
curva inferior: heteroduplex
Denaturamos 26 μL de produto de PCR por 5 minutos à 95ºC e os
reanelamos gradualmente, com a temperatura baixando gradualmente 0,1º
C a cada 4 segundos, até 25º C em aproximadamente 45minutos.
Colocamos os produtos de PCR no aparelho WAVE® System,
Transgenomic, Inc. Omaha, para avaliação de homo e heteroduplexes. A
Tabela 4, Anexo apresenta as condições de rastreamento de variantes no
exon 2 e 3 do gene da adiponectina
Não continuamos a metodologia acima devido a impossibilidade
técnica. Optamos, então para a utilização do método PCR-RFLP para
determinação da freqüência alélica do SNP na posição 45, no exon 2 e
3.2.10. Método PCR-RFLP (Polimorfismo do Comprimento de
Fragmentos de Restrição)
O produto de PCR de 405 pb foi digerido a 30oC por 2 horas com 3 U
de enzima de restrição SmaI. O produto de digestão foi introduzido em gel a
2% (50% agarose ultrapura e 50% Nusieve) com tampão TBE (89mM
Tris-Borato, 2 mMEDTS) e visualizado em sistema de documentação de imagens
GelDoc System 1000 (Bio Rad, Califórnia, EUA) após coloração com
brometo de etídio. Os fragmentos de produtos de digestão apresentaram
bandas de 405pb nos homozigotos dominantes, 128pb, 277pb e 405pb nos
heterozigotos e 128pb, 277pb nos homozigotos recessivos. Figura 9.
405pb
277pb
128pb
TT TG GG
405pb
277pb
128pb 405pb
277pb
128pb
TT TG GG
Figura 9. Géis de agarose demonstrativos da digestão ocorrida na reação de
PCR-RFLP para SNP+45 do exon 2 do gene da adiponectina. A: Gel com 5
3.2.11. Sequenciamento dos produtos de PCR da região promotora,
exon 2, íntron 2 e exon 3 do gene da adiponectina
O sequenciamento foi realizado no LIM/25 em seqüenciador
automático ABI PRISM 3130 XL Genetic Analyser, Applied Biosystems
Foster City,USA.
G/C
C/T
G/C
C/T
A
B
C
G/C
C/T
G/C
C/T
A
B
C
Figura 10. Esferograma ilustrativo do seqüenciamento da região promotora,
evidenciando os SNPs -11391G>A e -11377C>G. A: hetrerozigose, B:
3.2.12. Análise estatística
Realizamos a análise estatística no programa SPSS versão 14
(Statistical Package for Social Science Inc., Chicago, Illinois, USA).
Avaliamos as variáveis quantitativas utilizando o teste t de Student e análise
de variância (ANOVA) de um caminho com análise Post Roc de Tukey, após
normalização das amostras pelo log10. Comparamos as variáveis
qualitativas pelo teste qui-quadrado (χ2). Estimamos o risco relativo com o
cálculo do Odds Ratio (OR). Utilizamos a correlação de Pearson para
análise de relações bivariadas. Avaliamos a influência das variáveis
estudadas pela análise de regressão múltipla e para a avaliação dos
haplótipos utilizamos a regressão logística multinomial. Consideramos o
resultado significante quando p < 0,05.
Utilizamos o programa Helix TreeTM para calcular o Equilíbrio de
Hardy-Weinberg e o desequilíbrio de ligação entre os SNPs, e para