Universidade de Trás-os-Montes e Alto Douro
Mestrado Integrado em Medicina Veterinária
Análise citológica vs histopatológica no diagnóstico de
tumores de canídeos
Sónia Vilar Gomes de Sá
Orientador:
Professora Doutora Adelina Maria Gaspar Gama Quaresma
Co-orientador:
Dr. Hugo Corte Real Vilhena
Universidade de Trás-os-Montes e Alto Douro
Mestrado Integrado em Medicina Veterinária
Análise citológica vs histopatológica no diagnóstico de
tumores de canídeos
Sónia Vilar Gomes de Sá
Orientador:
Professora Doutora Adelina Maria Gaspar Gama Quaresma
Co-orientador:
Dr. Hugo Corte Real Vilhena
i
Resumo
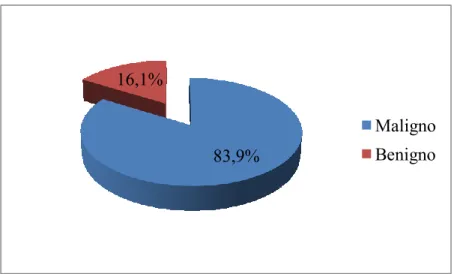
O estudo das neoplasias mamárias tem um elevado interesse clínico e científico, constituindo uma das neoplasias mais frequentes na cadela e que apresentam elevadas semelhanças com as da mulher. Devido à sua diversidade morfológica constituem um desafio em termos de diagnóstico. Neste estudo foram acompanhados 16 canídeos do sexo feminino que se apresentaram no Hospital Veterinário do Baixo Vouga num período de seis meses, com presença de neoformações mamárias, nas quais foram realizadas a avaliação citológica e posterior análise histopatológica. O estudo pretendeu comparar a fiabilidade da citologia obtida através de punção aspirativa por agulha fina relativamente à histopatologia, considerada como meio de diagnóstico “padrão”. As cadelas apresentaram frequentemente lesões múltiplas, predominantemente nas glândulas mamárias abdominais, sendo a maioria dos animais incluídos no estudo de raça indeterminada, com idade média de 11 anos. Dos 31 casos analisados por citologia, 16,1% (n=5) foram considerados benignos, 58,1% (n=18) malignos e em 25,8% (n=8) das amostras não foi possível emitir diagnostico, verificando-se uma não concordância com a histopatologia em apenas um caso. Considerando os resultados válidos, a análise estatística efetuada revelou uma especificidade de 100% e sensibilidade de 94,74%. Por outro lado, o VPP e o VPN foram 100% e 80%, respetivamente, sendo a acurácia diagnóstica de 95,65%. Apesar do número de amostras ser reduzido, este estudo confirma a fiabilidade da citologia como meio de diagnóstico em neoplasias mamárias caninas. No entanto, esta técnica não deve ser encarada como único meio de diagnóstico, devendo ser efetuada a análise histopatológica para obtenção do diagnóstico definitivo.
ii
Abstract
The study of canine mammary tumours has a high scientific and clinical interest, constituting one of the most common neoplasia in female dogs and presenting clinicopathological features similar to those of human breast cancer. Its high morphological diversity is a challenge in terms of diagnosis. In this study, 16 female dogs were observed in Baixo Vouga Veterinary Hospital in a six-month period presenting mammary nodular lesions which were analysed both by cytology and histopathology. The present study aimed to compare the reliability of cytology obtained by fine needle aspiration biopsy in relation to histopathology, considered as the “gold standard” diagnostic method in canine mammary neoplasms. Most dogs were mixed-breed, an average age of 11 years and presented multiple lesions (especially at abdominal glands). From the 31 cases analysed by cytology, 16.1% (n=5) were considered benign lesions, 58.1% (n=18) malignant and 25,8% (n=8) cases were considered inadequate for diagnosis. There was an agreement in most cases, only one case was discordant. Considering the valid cytological diagnoses, statistical analysis showed a specificity of 100% and a sensitivity of 94.74%, VPP of 100%, VPN of 80% and a diagnostic accuracy of 95.65%. Despite the reduced sample number, this study confirms the reliability of cytological analysis in canine mammary cancer diagnosis. Yet, this technique does not replace histology, which must be performed in order to obtain the final diagnosis.
iii
Índice Geral
1. Neoplasias mamárias caninas ... 1
1.1. Introdução ... 1
1.2. A Glândula Mamária... 2
1.3. Etiologia das neoplasias mamárias caninas ... 4
1.3.1 Factores hormonais ... 5
1.3.2 Factores genéticos ... 6
1.3.3 Outros factores ... 7
1.4 Classificação das neoplasias mamárias caninas ... 8
1.5 Tratamento ... 9 1.5.1 Cirurgia... 11 1.5.2 Quimioterapia ... 12 1.5.3 Radioterapia ... 12 1.5.4 Hormonoterapia ... 13 1.5.5 Imunoterapia... 13 1.5.6 Terapias adjuvantes ... 14 1.6 Citologia e Histopatologia ... 14 1.6.1 Citologia ... 14 1.6.2 Histopatologia ... 17
1.6.3 Comparação entre a citologia e a histopatologia ... 18
1.6.4 Estudos realizados ... 19 2. Objetivos ... 22 3. Material e métodos ... 23 3.1 Material ... 23 3.2 Metodologia ... 23 3.3 Análise estatística... 25 4. Resultados ... 26
4.1 Caracterização clínica da amostra ... 26
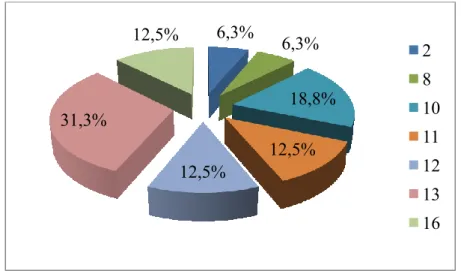
4.1.1 Raça ... 26
4.1.2. Idade ... 26
iv
4.1.4. Tamanho ... 29
4.2. Caracterização citológica das lesões ... 29
4.3. Caracterização histológica das lesões ... 30
4.4. Análise comparativa entre a citologia e a histopatologia ... 33
5. Discussão ... 36
6. Conclusão ... 41
v
Índice de Figuras
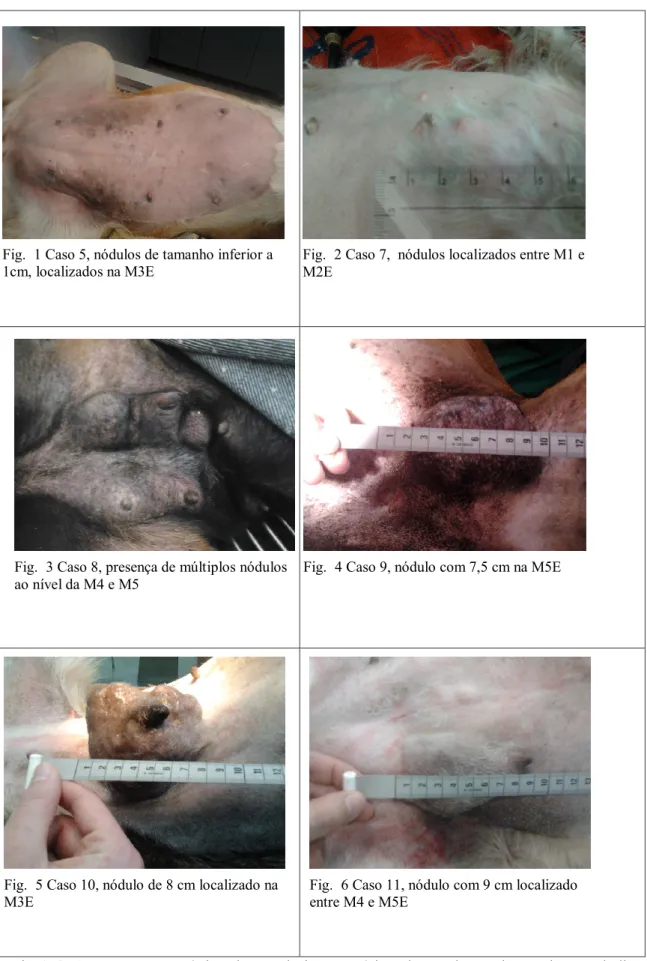
Fig. 1 Caso 5, nódulos de tamanho inferior a 1cm, localizados na M3E ... 27
Fig. 2 Caso 7, nódulos localizados entre M1 e M2E ... 27
Fig. 3 Caso 8, presença de múltiplos nódulos ao nível da M4 e M5 ... 27
Fig. 4 Caso 9, nódulo com 7,5 cm na M5E ... 27
Fig. 5 Caso 10, nódulo de 8 cm localizado na M3E ... 27
Fig. 6 Caso 11, nódulo com 9 cm localizado entre M4 e M5E ... 27
Fig. 7 Representação gráfica da distribuição das cadelas por raça ... 28
Fig. 8 Representação gráfica da distribuição das idades na população em estudo ... 28
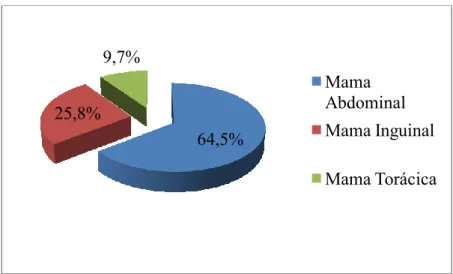
Fig. 9 Representação gráfica da distribuição da localização das lesões ... 29
Fig. 10 Representação gráfica da distribuição das neoplasias mamárias quanto ao comportamento biológico ... 30
Fig. 11 Caso 3, Adenoma complexo... 34
Fig. 12 Caso 3, Adenoma complexo... 34
Fig. 13 Caso 7, Carcinoma complexo... 34
Fig. 14 Caso 7, Carcinoma complexo... 34
Fig. 15 Caso 8, Carcinoma tubulopapilar ... 34
vi
Índice de Quadros
Quadro 1 Classificação histológica das neoplasias mamárias malignas caninas e breve descrição (adaptado de Misdorp 2002; Lana et al.,2009; Marconato et al.,2009;
Goldschmidt et al., 2011). ... 10 Quadro 2 Classificação histológica das neoplasias mamárias benignas caninas e breve descrição (adaptado de Misdorp 2002; Goldschmidt et al., 2011). ... 11 Quadro 3 Estudos sobre o exame citológico como meio de diagnóstico (adaptado de Sontas et al, 2012) ... 21 Quadro 4 Método de cálculo dos testes de validação diagnóstica (adaptado de Varallo, 2013). ... 25 Quadro 5 Características clinicopatológicas observadas para cada um dos casos
analisados simultaneamente para citologia e histologia ... 31 Quadro 6 Comparação dos resultados obtidos por citologia e histopatologia em
neoplasias mamárias caninas ... 35 Quadro 7 Comparação dos resultados obtidos por citologia e histopatologia em
neoplasias mamárias caninas, encontrando-se discriminados os tipos histológicos
vii
Lista de Siglas e Abreviaturas
AC: acurácia CDK: Quinase ciclina-dependente COX 1: Ciclooxigenase 1 COX 2: Ciclooxigenase 2 Cm: centímetros E: especificidade FN: Falso negativo FP: Falso positivo G: Gauje GH: Hormona de crescimento M1: glândula mamaria 1 M2: glândula mamaria 2 M3: glândula mamaria 3 M4: glândula mamaria 4 M5: glândula mamaria 5 MGG: May Grünwald Giemsa OVH: ováriohisterectomiaOMS: Organização Mundial da Saúde mL: mililitros
PAAF: Punção aspirativa com agulha fina PG: Prostaglandina
PGs: Prostaglandinas PRL: Prolactina S: sensibilidade
TMN: tumor, linfonodo e metástase
UTAD: Universidade de Trás-os-Montes e Alto Douro VN: Verdadeiro negativo
VP: Verdadeiro positivo VPN: valor preditivo negativo VPP: valor preditivo positivo
viii
Agradecimentos
Aos meus avós; à Dona Rosa e ao Paulo pela dedicação, apoio, incentivo, pela força, amor, por sempre acreditarem, por TUDO.
À minha orientadora, Professora Doutora Adelina Maria Gaspar Gama Quaresma pela paciência, oportunidade, responsabilidade, apoio e amizade ao longo deste percurso.
Ao meu Co-orientador, Dr. Hugo Corte Real Vilhena pela ajuda, ensinamentos, paciência e oportunidades de aprender oferecidas durante esse período.
Ao Prof. Dr. António Silvestre, pela ajuda preciosa na análise estatística dos resultados.
A toda à equipa do Hospital Veterinário do Baixo pela confiança, amizade, conhecimento que me transmitiram e acima de tudo por me terem recebido tão bem. Aos estagiários pelo carinho e companheirismo, tornaram tudo muito especial.
À Professora Doutora Alexandra Esteves por todo o apoio, pela força, por me ter recebido tão bem, e acima de tudo por não me ter deixado desistir.
À Dona Elvira por todo o carinho, protecção. Jamais esquecerei o seu sorriso e olhar maternal.
À Cathy, Ana, Lipinha e Vânia, companheiras de todas as horas, pela amizade, cumplicidade, incentivo, apoio incondicional, por todos os momentos de camaradagem e pelas voltas animadas que demos na “burra”.
Aos meus amigos, Rafa, Lita, Bomboca, Leonor, Joh, Zé Diogo; Natacha, Ricardo, Breno, João Agostinho, João Martins, Sara Vasconcelos, Dany, Cláudia, Isa, Aniana, Maria João Garcia (a nossa “salvadora”)
1
Revisão Bibliográfica
1. Neoplasias mamárias caninas
1.1. Introdução
O termo neoplasia refere-se a uma proliferação descontrolada e persistente de células de qualquer tecido do organismo, que não respondem aos mecanismos normais de controlo de crescimento celular associando-se, por norma, a uma alteração genética (Cotran et al., 2004). As designações de neoplasia e de tumor são frequentemente utilizadas indistintamente para indicar uma proliferação benigna ou maligna; no entanto estes termos são erradamente utilizados como sinónimos, sendo a designação de tumor mais ambígua, referindo-se unicamente a um aumento anormal do volume de uma parte ou da totalidade de um tecido, o qual também pode ser devido a uma acumulação de líquido ou uma reacção inflamatória (Cotran et al., 2004).
A importância do estudo das neoplasias mamárias na cadela tem vindo a aumentar nos últimos anos por ser muito frequente na rotina clínica dos animais de companhia (Fonseca e Daleck, 2000). Os tumores mamários são uma das neoplasias mais comuns nas cadelas, com uma incidência três vezes superior quando comparado com os tumores de mama nos humanos (Cassali et al 2007). Por outro lado, devido às semelhanças em alguns aspectos com as neoplasias da mama da mulher, são importantes aliados na compreensão dos mesmos (Cassali et al 2007). Muitos estudos baseiam-se na cadela como modelos para a mulher (MacEwen, 1990; Zappulli, 2005), uma vez que as neoplasias mamárias da espécie canina e humana partilham várias características epidemiológicas, morfológicas, clinico-patológicas e bioquímicas (Kumaraguruparan et al., 2006).
As neoplasias da mama são as mais frequentes na cadela, representando cerca de 52% dos processos neoplásicos, sendo que destes, 41 a 53% correspondem a neoplasias malignas (Andrade et al., 2010). No caso dos machos, afecta apenas um por cada noventa e nove fêmeas (Misdorp, 2002; Rutteman et al., 2003; Guim et al., 2007; Lana, et al., 2007). A incidência aumenta em cadelas submetidas a tratamento com progestagénios inibidores do estro e diminui com a prática da ovariohisterectomia
2
(OVH) (Simon et al 2009; Varello, 2013). O risco de desenvolvimento de neoplasias malignas em cadelas esterilizadas antes do primeiro cio é de 0,05%, aumentando para 8% se for esterilizada depois do primeiro cio e para 26% depois do segundo cio, a partir daí não se verificam alterações em termos de riscos em realizar a castração (Lana et al., 2009). Afecta principalmente fêmeas geriátricas, com idade média de aparecimento entre os 8 e os 10 anos, podendo contudo, surgir em animais com menos de 5 anos (Millanta et al., 2005). Não existe uma predisposição racial evidente, embora as raças de caça sejam apontadas por alguns autores como tendo uma maior predisposição para esta doença (Millanta et al., 2005). Na génese destas neoplasias estão envolvidos factores de natureza genética, ambiental e hormonal. A quantificação da incidência de neoplasias malignas é condicionada pelo facto de os animais com nódulos mamários indolentes e de pequenas dimensões (tipicamente benignos) serem poucas vezes levados à consulta e/ou raramente sujeitos a extirpação cirúrgica, aumentando, desse modo, a proporção de neoplasias malignas que chegam ao laboratório de histopatologia (Misdorp, 2002; Rutteman et al., 2003).
1.2. A Glândula Mamária
Na cadela, as glândulas mamárias estão dispostas em duas cadeias bilaterais simétricas que se estendem desde o tórax ventral até à região inguinal, localizadas de um e de outro lado da linha branca. As cadelas têm geralmente cinco pares de glândulas mamárias. Do sentido cranial para o caudal tomam a seguinte designação: primeiras ou craniais torácicas, segundas ou caudais torácicas, terceiras ou craniais abdominais, quartas ou caudais abdominais e quintas ou inguinais (Peleteiro, 1994; Patsikas et al., 2006).
A drenagem linfática da glândula mamária canina é complexa. Geralmente, a drenagem da linfa proveniente das glândulas craniais (torácicas e abdominal cranial) está a cargo dos linfonodos axilar, axilar acessório e esternal ipsilaterais. No caso das glândulas caudais (abdominal caudal e inguinal), são os linfonodos inguinais superficiais ipsilaterais os mais frequentemente envolvidos. A glândula abdominal cranial drena simultaneamente para o linfonodo axilar e para o linfonodo inguinal superficial, podendo em certos casos drenar para a glândula torácica caudal (Luiz et al., 2002; Pereira, 2003). No entanto, têm sido descritos vários padrões de drenagem (Sleeckx et al., 2011)
3
A irrigação sanguínea das glândulas mamárias origina-se principalmente nas artérias torácica interna, torácica lateral e pudenda externa. As três glândulas craniais são supridas craniolateralmente pela artéria torácica lateral, e profundamente pela artéria epigástrica superficial cranial e ramos perfurantes das artérias intercostais (com origem na torácica interna). Os dois pares caudais são supridos pela artéria epigástrica superficial caudal (origem na artéria pudenda externa) e profundamente pelos ramos das artérias abdominal cranial e ilíaca circunflexa profunda. As artérias e veias formam anastomoses, originando os plexos arteriais e venosos (Luiz et al., 2002; Pereira, 2003). Em termos histológicos, as glândulas mamárias são glândulas compostas tubuloalveolares apócrinas (Banks, 1993; Junqueira e Carneiro, 2004; Fossum, 2007), sendo consideradas glândulas sudoríparas modificadas (Banks, 1993). Cada glândula mamária é formada por lóbulos, separados entre si por septos de tecido conjuntivo denso e tecido adiposo. A secreção proveniente de cada lóbulo drena para o ducto interlobular e depois para o ducto galactóforo (Junqueira e Carneiro, 2004) ou lactífero (Peleteiro, 1994). Os ductos lactíferos podem confluir e formar uma dilatação ampolar designada por seio lactífero ainda antes de atingirem o mamilo. Cada um destes últimos ductos abre directa e independentemente no mamilo, em número variável (Peleteiro, 1994; Junqueira e Carneiro, 2004). Na cadela, cada mamilo pode ter até 20 aberturas distintas, cada uma relacionada com um sistema de ductos e glândulas (Tyler, 2002). O revestimento dos ductos galactóforos é formado por uma dupla camada de células epiteliais cúbicas ou cilíndricas baixas (Banks, 1993; Peleteiro, 1994; Weigelt et al., 2005; Solano-Gallego, 2010). Os ductos intralobulares são revestidos por um epitélio cúbico simples, embora as porções iniciais apresentem um epitélio cilíndrico simples (Banks, 1993; Peleteiro, 1994). As células que constituem o epitélio de revestimento dos ductos são denominadas de células epiteliais luminais (Misdorp et al., 1999). Os ductos interlobulares, por seu lado, são revestidos por um epitélio simples cúbico que assenta numa membrana basal (Weigelt et al., 2005). Os ductos maiores e os menores são rodeados por fibras elásticas e músculo liso e por tecido conjuntivo reticular, respectivamente (Solano-Gallego, 2010).
A organização estrutural da mama varia consoante a maturidade sexual da fêmea, sendo diferente na fêmea impúbere e púbere, sofrendo também alterações durante a gravidez e lactação (Banks, 1993; Peleteiro, 1994; Junqueira e Caneiro, 2004) e durante as diferentes fases do ciclo éstrico (Rehm et al., 2007).
4
Na fase pré-púbere, a glândula mamária sofre pouco desenvolvimento estando a sua velocidade de crescimento de acordo com a velocidade do crescimento corporal (crescimento isométrico), mantendo-se deste modo até ao início da actividade ovárica que precede a puberdade. Na puberdade, antes do primeiro ciclo éstrico, o parênquima mamário começa a crescer a uma taxa mais rápida do que o crescimento corporal (crescimento alométrico) (De Los Monteros et al., 2004).
Aquando da puberdade, o aumento do nível de estrogénios provoca, a nível mamário, um maior crescimento e ramificação dos ductos lactíferos, para além duma acumulação de tecido adiposo e conjuntivo (Peleteiro, 1994; Junqueira e Caneiro, 2004), embora esta suceda de forma pouco marcada na cadela comparativamente ao que ocorre na mulher. Assim sendo, o volume externo das glândulas mamárias da espécie canina aumenta apenas ligeiramente e sobretudo as mamas abdominais caudais e inguinais (Peleteiro, 1994). Após a fecundação e no decorrer da primeira gestação, ocorre a maturação das glândulas mamárias permitindo que estas atinjam a sua capacidade funcional completa. O crescimento é rápido e é feito durante a gestação devendo-se à secreção aumentada e sincronizada das hormonas esteróides como o estrogénio e a progesterona (Weigelt et al., 2005). A acção da progesterona desencadeia a proliferação das células epiteliais da porção terminal dos ductos intralobulares, formando assim os alvéolos secretores (Peleteiro, 1994; Junqueira e Carneiro, 2004), que são revestidos por um epitélio cilíndrico simples. O componente secretor é assim formado pelo epitélio alveolar e por parte das células epiteliais dos ductos intralobulares (Banks, 1993). Na fêmea lactante, os ductos e alvéolos estão bastante distendidos e desenvolvidos, porém no fim da lactação a maioria dos alvéolos é reabsorvida e a mama diminui de volume. As hormonas directamente envolvidas na lactogénese são a prolactina, a somatomamotropina placentária e os glucocorticóides, e indirectamente estão envolvidos os estrogénios, a progesterona e a somatotropina. A oxitocina actua directamente sobre as células mioepiteliais (Peleteiro, 1994). Por sua vez, no final da lactação, os septos interlobulares constituídos por tecido conjuntivo, aumentam de espessura (Cavalcanti et al., 2006).
1.3. Etiologia das neoplasias mamárias caninas
A etiologia das neoplasias mamárias é multifactorial. São referidos de seguida alguns desses factores.
5 1.3.1 Factores hormonais
Os factores hormonais são os mais amplamente estudados e têm um papel fundamental na carcinogénese mamária na cadela (Pérez-Alenza et al., 2000). O desenvolvimento destes tumores é hormono-dependente; por essa razão observam-se diferenças significativas entre cadelas castradas e não castradas, relativamente ao risco de ocorrência de tumores mamários (Lana et al., 2009). Os factores hormonais implicados na génese tumoral são os estrogénios, a progesterona, os androgénios, a prolactina e a hormona de crescimento (Da Silva et al., 2004).
A progesterona e os estrogénios desempenham um papel importante no controlo do crescimento e evolução das glândulas mamárias, daí serem importantes no desenvolvimento de neoplasias mamárias. A exposição prolongada a progesterona estimula a proliferação do epitélio mamário (Thuróczy et al., 2007). Uma das funções desempenhadas pelos estrogénios, que contribui para o crescimento das neoplasias mamárias, baseia-se no estímulo à produção do factor de crescimento do endotélio vascular (Dabrosin et al., 2003; Illera et al., 2006).
A influência destas hormonas na carcinogénese explica porque os tumores mamários ocorrem quase exclusivamente em fêmeas e porque se detectam nos machos neoplasias testiculares dependentes da produção de estrogénios (sertolinomas) (Misdorp, 2002). O tecido mamário normal contém receptores para estrogénio e progesterona em concentrações relativamente altas. Alguns estudos demonstraram que as neoplasias benignas mantêm elevados níveis de receptores para estrogénios, ao passo que as malignas exibem uma diminuição significativa (Lana et al., 2007; Rutteman et al., 2003). Também os receptores para progesterona aparecem diminuídos nas neoplasias malignas (Lana et al., 2007). Os carcinomas mamários com maior diferenciação revelaram níveis mais elevados de receptores hormonais que os carcinomas mais indiferenciados, de pior prognóstico (Misdorp, 2002). Verifica-se uma perda da dependência em estrogénio e progesterona nas neoplasias mamárias malignas, tornando-se estas mais agressivas e menos diferenciadas (Lana et al., 2007).
Relativamente aos androgénios, estes contribuem também para o crescimento neoplásico, podendo ser produzidos nas glândulas mamárias normais e neoplásicas, tal como os estrogénios. Por isso, alguns autores consideram o tecido mamário como um tecido endócrino (Illera et al., 2006).
O envolvimento da glândula hipofisária na tumorigénese tem sido objecto de estudo, pelo facto de controlar a secreção de prolactina (PRL) e da hormona de crescimento
6
(GH), fundamentais ao normal desenvolvimento e funcionamento da glândula mamária. A PRL tem um papel crucial na actividade secretora, facilitando a acção mitótica do estrogénio, originando um aumento do número de receptores de estrogénio (Fonseca e Daleck, 2000). Os níveis de PRL sanguíneos e tecidulares encontram-se mais elevados em glândulas com neoplasias malignas, do que em glândulas mamárias normais (Lana et al., 2009). Ao nível dos tecidos tumorais mamários, parece existir uma correlação positiva e forte entre os níveis da PRL e os das hormonas esteróides. Os diferentes estudos sugerem que a maior parte da PRL detectada não é de origem hipofisária. É possível que esta hormona seja então produzida localmente pelas células que sofreram transformação neoplásica, actuando de forma autócrina e parácrina (Queiroga et al., 2005). O tamanho e a taxa de crescimento neoplásico encontram-se relacionados com os níveis tecidulares de prolactina e das hormonas esteróides, permitindo concluir que estes compostos estimulam a proliferação celular, principalmente no que diz respeito aos tumores mamários malignos (Queiroga et al., 2005).
1.3.2 Factores genéticos
As neoplasias desenvolvem-se como consequência de alterações no ADN das células, levando a um aumento, diminuição ou ausência de expressão de proteínas normais ou até à produção de proteínas anormais. Determinadas proteínas supressoras tumorais, como o caso da codificada pelo gene p53, ou são expressas numa forma inactiva ou simplesmente não são expressas. Os tumores encontram-se associados a uma acumulação progressiva de anomalias genéticas e epigenéticas, que levam a alterações no crescimento, na apoptose e diferenciação celulares, nos mecanismos de reparação do ADN e noutras vias celulares importantes. À medida que as neoplasias evoluem, verifica-se uma diminuição da capacidade de reparação do ADN e aumento da instabilidade genómica. Tal conduz à acumulação de alterações genéticas nas células neoplásicas (Kusewitt e Rush, 2007).
Os principais alvos das alterações genéticas são proto-oncogenes, genes supressores tumorais e os genes que controlam a apoptose (Da Silva et al., 2004). Os proto-oncogenes são promotores do crescimento celular, que controlam a divisão mitótica. O descontrolo da expressão genética (pela mutação, translocação ou rearranjo dos genes) pode transformar os proto-oncogenes em oncogenes. Os oncogenes e os seus produtos podem aumentar a expressão dos genes das ciclinas e das quinases ciclina-dependentes
7
(CDK) responsáveis pela progressão ordenada das células nas diferentes fases do ciclo celular. As mutações nos genes que codificam estas proteínas favorecem a proliferação celular descontrolada (Da Silva et al., 2004). A expressão do oncogene HER-2, responsável pela codificação de receptores para factores de crescimento, aparece aumentada em neoplasias malignas, no entanto, nas benignas tal não foi observado (Lana et al., 2009).
Níveis anormais de expressão de genes mediadores da apoptose, de genes reparadores do ADN, de proto-oncogenes e de genes supressores tumorais, entre outros, estão envolvidos na génese tumoral mamária, constituindo estes genes e as respetivas proteínas codificadas possíveis alvos terapêuticos. No entanto, é necessário aprofundar a investigação nesta área (Klopfleisch et al., 2011).
1.3.3 Outros factores
Os factores responsáveis pelo impacto da obesidade na génese tumoral são o estrogénio, a leptina e a adiponectina. O estrogénio desempenha um papel importante no desenvolvimento e manutenção da mama normal e também na indução e manutenção das neoplasias mamárias, sendo um importante elo de ligação entre a gordura corporal e a indução tumoral. A conversão de androgénios em estrogénios por parte do tecido adiposo aumenta a exposição da glândula a estas hormonas (Kendall et al., 2007; Cleary et al., 2010). A leptina é produzida pelo tecido adiposo e os seus receptores estão situados em células normais e tumorais de todo o organismo. Esta hormona possui capacidade indutora de proliferação celular e de inibição da apoptose (Cleary et al., 2010). O aumento dos níveis séricos da leptina e dos seus receptores no tecido mamário está associado à presença de metástases à distância (Ishikawa et al., 2004).
A adiponectina (também produzida nos adipócitos) tem a capacidade de reduzir a proliferação celular e promover a apoptose, actuando de forma inversa à leptina (Dieudonne et al., 2006; Arditi et al., 2007). Os níveis sanguíneos de adiponectina diminuem com o aumento da massa corporal gorda (Cleary et al., 2010).
A prostaglandina H2 sintase, também conhecida como ciclooxigenase (COX), é uma glicoproteína da membrana celular, responsável pela formação de mediadores biológicos tais como: prostaglandinas, prostaciclina e o tromboxano (Harris et al., 2006).
8
Nas células dos mamíferos existem duas isoenzimas referentes à ciclooxigenase: a COX-1 e a COX-2. A COX-1 é responsável pela produção de prostaglandinas (PGs) que controlam as funções fisiológicas, estando presente na maioria dos tecidos. A COX-2 é induzida por citoquinas, factores de crescimento, oncogenes e por promotores tumorais. Esta isoenzima não é detectada na maioria dos tecidos normais mas nos processos inflamatórios e tecidos neoplásicos contribui para a síntese de PG. Um estudo realizado em cadelas revelou a ausência de expressão da COX-2 em tecidos mamários normais, observando-se um aumento da sua expressão em tumores mamários benignos e em maior percentagem ainda em malignos (Lana et al., 2007). Estudos sugerem um envolvimento das COX-2 na proliferação e no desenvolvimento das neoplasias, contribuindo para a sua progressão (Selmi et al., 2007). A COX-2 encontra-se em vasos neoformados no interior das neoplasias mamárias, como também na vasculatura pré-existente ao redor destes tumores. Acredita-se que exista uma relação entre a alfa-V beta-3 integrina e a COX-2 porque a inibição da COX-2 por anti-inflamatórios não esteróides (AINEs) inibe essa integrina e consequentemente as proteínas da família das GTPases envolvidas na angiogénese (Cdc42/Rac) (Tan et al., 2004).
1.4 Classificação das neoplasias mamárias caninas
As neoplasias mamárias mais comuns da cadela são os carcinomas (tumores de origem epitelial) (Lana et al., 2007). Os carcinomas complexos distinguem-se dos simples por possuírem um componente epitelial e mioepitelial (Misdorp et al., 1999). Os carcinomas de tipo especial são menos frequentes que os simples e os sarcomas mamários representam uma proporção baixa (Lana et al., 2007; Rutteman e Kirpensteijn, 2003). Os fibrossarcomas e os osteossarcomas são as neoplasias mamárias mais comuns dentro do grupo dos sarcomas (Misdorp et al., 1999). Os carcinossarcomas são tumores malignos mistos, que apresentam uma componente epitelial (carcinomatosa) e uma de tecido conjuntivo (sarcomatosa) (Lana et al., 2007). Os carcinomas ou sarcomas em tumores benignos são encontrados casualmente e é difícil saber se o componente maligno teve origem no seio do benigno ou se o invadiu. Os adenomas simples, basalóides e os papilomas ductais são neoplasias benignas raras (Misdorp et al., 1999). Já os tumores mistos benignos são frequentes e são constituídos por tecido epitelial, mioepitelial e mesenquimatoso. O tecido mesenquimatoso é formado por um ou mais dos seguintes componentes: cartilagem, osso e/ou gordura com provável origem em células estaminais pluripotentes (Lana et al., 2007). O Carcinoma
9
Inflamatório é considerado o mais agressivo do grupo das neoplasias malignas. Apresenta-se como uma doença de evolução rápida e elevada mortalidade (Marconato et al.,2009). Este carcinoma pode afectar uma, parte ou até mesmo as duas cadeias mamárias. Verifica-se um crescimento rápido das massas mamárias, envolvendo várias glândulas e a sua pele. Exprime-se por calor, eritema, espessamento, dor e edema dos membros próximos às lesões, devido à obstrução dos vasos linfáticos. Histologicamente, possui características de carcinoma com escassa diferenciação assim como infiltração de leucócitos e neutrófilos (Lana et al.,2009).
Os diferentes tipos histológicos encontram-se discriminados nos quadros 1 e 2. Relativamente às lesões não neoplásicas (hiperplasias/displasias), agrupam-se em hiperplasia ductal; hiperplasia lobular que se subdivide em hiperplasia epitelial e adenose; quistos; ectasia ductal; fibrose focal e ginecomastia (Misdorp et al., 1999).
1.5 Tratamento
As opções de tratamento dependem do estádio em que se encontra a neoplasia. Entre elas citam-se a excisão cirúrgica, a quimioterapia, a radioterapia, a hormonoterapia, a imunoterapia ou combinações destas. A cirurgia é o tratamento de eleição para todos os tumores mamários caninos, excepto para o carcinoma inflamatório. A excisão cirúrgica permite o exame histopatológico do tumor, podendo ser curativa e ainda melhorar a qualidade de vida do doente (Queiroga e Lopes, 2002). Em medicina veterinária, a radioterapia é muito utilizada nos países em que está disponível por ser um método não invasivo podendo ser usado como tratamento único ou paliativo nos casos onde a cirurgia é impossibilitada (Cirillo, 2008). A imunoterapia consiste no tratamento dos tumores mamários pelo uso de anticorpos. As células possuem antigénios específicos na superfície e os anticorpos correspondentes ligam-se a essas moléculas e, dessa forma, inibem o crescimento do tumor. O mecanismo que se torna efetivo é um sinal destrutivo enviado por anticorpos para dentro da célula neoplásica iniciando a sua destruição (Cirillo, 2008).
10
Quadro 1 Classificação histológica das neoplasias mamárias malignas caninas e breve descrição (adaptado de Misdorp 2002; Lana et al.,2009; Marconato et al.,2009; Goldschmidt et al., 2011).
Neoplasias malignas Descrição
Carcinoma não infiltrativo (in
situ) Proliferação epitelial intraductal que não invade a membrana basal.
Carcinoma complexo
Carcinoma constituído por dois componentes: epitelial luminal e mioepitelial. As células epiteliais luminais organizam-se num padrão tubulopapilar ou sólido. As células mioepiteliais dispõem-se num padrão estrelado/reticulado. A invasão vascular não é frequente.
Carcinoma simples
Carcinoma
tubulopapilar Carcinoma caracterizado por proliferações tubulopapilares epiteliais. Quando não apresenta componente papilar é chamado de carcinoma tubular. Os que não possuem elementos tubulares são designados de carcinomas papilares.
Carcinoma sólido
Carcinoma caracterizado por proliferação de células epiteliais organizadas em padrão sólido. É uma neoplasia comum na cadela. Carcinoma
anaplásico Carcinoma muito infiltrativo, formado por células epiteliais de grandes dimensões, organizadas isoladamente ou em grupo, pleomórficas, por vezes multinucleadas. Por apresentarem alta tendência para recidivar e metastizar, o prognóstico é mau. É considerado um dos carcinomas mais agressivos da glândula mamária canina.
Carcinomas de tipos especiais Carcinoma de células fusiformes
Tumor maligno formado por células fusiformes, organizadas num padrão sólido epitelial. Este tipo de carcinoma é raro no cão e pode ter origem mioepitelial.
Carcinoma de células escamosas
Carcinoma caracterizado pela presença de áreas de diferenciação epidermóide, verificando-se a existência de lâminas de queratina. É uma neoplasia infiltrativa que pode invadir a circulação linfática. Carcinoma
mucinoso Carcinoma caracterizado pela presença de grande quantidade de mucina que é produzida pelas células neoplásicas. É uma neoplasia rara na cadela.
Carcinoma
rico em lípidos Carcinoma formado por células arredondadas de citoplasma abundante e vacúolos possuindo grande quantidade de lípidos neutros. Este tipo de carcinoma é muito raro na cadela.
Sarcoma
Fibrossarcoma Sarcoma constituído por células fusiformes e fibras de reticulina e colagénio. Este tipo de tumor ocorre raramente na cadela.
Osteossarcoma Sarcoma no qual as células neoplásicas produzem substância osteóide ou mesmo osso, na forma de trabéculas relativamente regulares. Podem encontrar-se osteossarcomas puros ou formados por tecido ósseo, cartilaginoso ou outro tecido conjuntivo. É o tumor mesenquimatoso mais comum da cadela, metastizando por via hematógena para os pulmões.
Outros Sarcomas
A ocorrência de lipossarcomas e condrossarcomas são muito pouco frequentes.
Carcinossarcoma
Neoplasia maligna mista formada por células morfologicamente semelhantes às células epiteliais malignas (mioepitelial e/ou luminal) e tecido conjuntivo. As metástases podem ser do tipo sarcomatoso, carcinomatoso ou misto.
Carcinoma ou Sarcoma em tumor benigno
Neoplasia benigna, caracterizada pela presença de áreas de proliferação celular maligna. É difícil determinar se a componente maligna surgiu associada ao tumor benigno ou se o invadiu posteriormente.
Carcinoma Inflamatório
Carcinoma mais agressivo do grupo das neoplasias malignas. Apresenta-se como uma doença de evolução rápida e de elevada mortalidade. Verifica-se um crescimento neoplásico rápido, envolvendo frequentemente várias glândulas e pele, associado a calor, eritema, dor e edema dos membros próximos à lesão, devido à obstrução dos vasos linfáticos. Histologicamente, possui características de carcinoma indiferenciado.
11
Quadro 2 Classificação histológica das neoplasias mamárias benignas caninas e breve descrição (adaptado de Misdorp 2002; Goldschmidt et al., 2011).
Neoplasias benignas Descrição
Adenoma
Adenoma simples
Adenoma composto por células mioepiteliais ou epiteliais luminais. Quando é formado por células epiteliais luminais, o tumor é do tipo tubular e pode apresentar secreção. Os mioepiteliomas apresentam crescimento de células fusiformes dispostas segundo um padrão sólido. São muito raros na cadela.
Adenoma complexo Adenoma constituído por células epiteliais luminais e mioepiteliais. Adenoma basalóide
Adenoma constituído por células epiteliais monomórficas que podem apresentar focos de diferenciação epidermóide.
Fibroadenoma
Fibroadenoma de alta celularidade
Apresenta uma proliferação de células epiteliais luminais e do estroma, podendo estar associada a células mioepiteliais. Caracteriza-se também por possuir grande quantidade de células em fase mitótica.
Fibroadenoma de baixa celularidade
Apresenta uma mistura de células epiteliais luminais e estroma, podendo estar associadas a células mioepiteliais.
Tumor benigno misto
Tumor que tem origem na proliferação de células epiteliais luminais/mioepiteliais e por células mesenquimatosas. Observam-se focos de cartilagem, e/ou osso e por vezes tecido adiposo. Papiloma Ductal Neoplasia papilomatosa intraductal constituída por células epiteliais e/ou mioepiteliais. Esta lesão é
rara na cadela.
A hormonoterapia é um termo genérico utilizado para um tratamento que engloba todos os medicamentos que têm ação relacionada com as hormonas reprodutivas do animal, e não é necessariamente uma terapia feita por hormonas propriamente ditas. Este tratamento é indicado para casos de tumores mamários que manifestem receptores de estrogénio e/ou progesterona, independentemente da associação com outros tratamentos (quimioterapia ou radioterapia) (Shahi et al., 2008).
1.5.1 Cirurgia
A excisão cirúrgica é a abordagem terapêutica de referência para os tumores mamários em canídeos, exceptuando os casos de neoplasias inoperáveis, tais como os carcinomas inflamatórios, nódulos de grandes dimensões ou nas situações em que são detectadas metástases à distância (Lana et al., 2007; Misdorp, 2002). As vantagens da excisão tumoral prendem-se com os factos, de poder ser curativa, poder melhorar a qualidade de vida do animal, evitar a progressão da doença e de permitir o exame histológico (Hedlund, 2008). A selecção da técnica cirúrgica depende do número de lesões e da sua localização na cadeia mamária, das características clínicas do tumor (tamanho,
12
aderência, ulceração), do estado clínico do doente, avaliação dos linfonodos regionais e da experiência do cirurgião (Fossum et al., 2002; Misdorp, 2002).
O objectivo da cirurgia oncológica mamária canina é a extirpação completa da neoplasia com margens livres de tecido neoplásico através da técnica mais simples, não esquecendo uma possível extensão da neoplasia pelo sistema linfático local (Lana et al., 2009).
1.5.2 Quimioterapia
Todos os animais que possuírem um risco elevado de desenvolver carcinomas ou sarcomas metastáticos, devido à presença de factores que agravam o prognóstico, devem receber uma terapêutica adjuvante com quimioterápicos, devendo os prós- e os contras ser discutidos com os seus proprietários (Bergman, 2007).
Não há estudos clínicos que demonstrem qual o melhor quimioterápico ou o melhor protocolo terapêutico para os tumores mamários caninos e a grande heterogeneidade verificada nestes tumores dificulta a caracterização da quimiossensibilidade dos diferentes tipos histológicos. A dificuldade na utilização destes fármacos é acrescida pelo facto de nem sempre as metástases à distância terem as mesmas características do tumor primário, nem reagirem da mesma forma à quimioterapia (Queiroga e Lopes, 2002). Os principais quimioterápicos utilizados em neoplasias mamárias são a ciclofosfamida, a doxorrubicina e o 5-Fluouracil (Simon et al., 2006). Para além destes, existem outros menos utilizados, como a vincristina, que pode ser associada à doxorrubicina e ciclofosfamida; a mitoxantrona, em substituição da doxorrubicina, devido à cardiotoxicidade e o metotrexato, associado à ciclofosfamida e ao 5- Fluouracil (Cirillo, 2008).
1.5.3 Radioterapia
A radioterapia é um método capaz de destruir células tumorais pelo uso de feixes de radiações ionizantes. Uma dose pré-calculada de radiação aplicada durante um determinado período de tempo na neoplasia promove a destruição das células neoplásicas, evitando alterações nas células vizinhas normais (Morris e Dobson, 2001). No caso de tratamentos em animais, há pouca informação disponível relativamente à utilização de radiação. No entanto, a radioterapia tem-se mostrado interessante na redução do tamanho, permitindo a sua posterior remoção cirúrgica. A radioterapia não
13
desempenha um papel relevante no caso de tumores malignos que são totalmente excisados (Lana et al., 2009).
1.5.4 Hormonoterapia
Os benefícios da realização de ovariohisterectomia (OVH) em fêmeas jovens, para prevenção do aparecimento destes tumores estão já aceites e documentados (Lana et al., 2009). A realização da OVH em pacientes com tumores mamários só parece ser relevante nos animais jovens (com menos de dois anos de idade), com o objectivo de inibir o reaparecimento de neoplasias mamárias benignas ou com o pretexto de promover uma quebra na estimulação hormonal do tecido mamário, conduzindo à sua regressão, de modo a facilitar o reconhecimento de novas lesões neoplásicas (Rutteman e Kirpensteijn, 2003). A supressão do estímulo hormonal na idade adulta, através da OVH, não apresenta qualquer efeito benéfico a nível mamário, mesmo associado à excisão tumoral (Fonseca e Daleck, 2000).
1.5.5 Imunoterapia
A imunoterapia é muitas vezes descrita como uma terapia biológica, bioterapia ou modificação da resposta biológica, surgindo com base na compreensão dos processos imunológicos antitumorais. A certeza de que os linfócitos T citotóxicos, os linfócitos T auxiliares e as células B podem actuar sinergicamente para a rejeição imunológica das neoplasias tem contribuído para o desenvolvimento da imunoterapia (Gentschev et al., 2009). Foi desenvolvido um estudo para testar a utilização do vírus vacinal oncolítico (GLV- 1h68) no tratamento de tumores mamários caninos, verificando-se que infectou e destruiu com êxito linhas celulares de adenoma mamário canino in vitro e inibiu a proliferação tumoral em xenotransplantes (Gentschev et al., 2009).
As células dendríticas que apresentam antigénios tumorais na sua superfície possibilitam ao sistema imunitário responder adequadamente e desenvolver uma imunidade antitumoral específica pela produção de células efectoras que podem agredir e provocar a lise das células tumorais (Gyorffy et al., 2005). As células “Natural Killer” (NK) e as células T citotóxicas (activadas pelas citocinas) evidenciaram ter um potencial terapêutico no tratamento de diferentes neoplasias em canídeos (Funk et al., 2005). Comprovou-se ainda que os anticorpos IgG caninos demonstraram capacidade de reconhecer antigénios de células tumorais em cultura (Bird et al., 2011).
14 1.5.6 Terapias adjuvantes
Outros medicamentos utilizados como terapia adjuvante incluem o uso de inibidores da COX-2 (AINEs). Estes contribuem não só para a diminuição da dor, como apresentam efeito anti-tumoral, uma vez que aproximadamente 50% destas neoplasias apresentam sobre-expressão de cicloxigenases (Rassnick, 2005; Lorimier, 2007). Demonstrou-se ainda que estes fármacos têm a capacidade de sensibilizar os tecidos mamários neoplásicos aumentando o efeito da radioterapia (Clifford, 2005). O inibidor das COX-2 mais estudado em medicina veterinária oncológica é o piroxicam (Morrison, 2007), aconselhado em neoplasias mais agressivas como o carcinoma inflamatório (Queiroga e Lopes, 2002). Alguns autores defendem a administração de desmopressina (um derivado sintético da hormona anti-diurética com propriedades hemostáticas) no período pós-cirúrgico, uma vez que parece diminuir a recorrência local e reduz a disseminação e sobrevivência de células tumorais residuais, aumentando o período livre de doença e o período de sobrevivência total (Hermo et al., 2008). A suplementação de aminoácidos (glutamina, cisteína, arginina) ajuda na eficácia dos agentes citostáticos, aumenta a resposta imunitária anti-tumoral e favorece a cicatrização dos tecidos (Ogilvie, 2006). A utilização de ácidos gordos polinsaturados de cadeia longa aumenta a qualidade de vida dos canídeos mastectomizados e estimula a sensibilidade à quimioterapia e radioterapia (Ogilvie, 2006).
1.6 Citologia e Histopatologia
A citologia e a histopatologia são dois meios de diagnóstico fundamentais para se estabelecer um diagnóstico definitivo de neoplasia mamária na cadela (Misdorp et al., 1999; Lana et al., 2007).
1.6.1 Citologia
A citologia aspirativa não é uma técnica recente de diagnóstico, contudo a aplicação em Medicina Veterinária de forma rotineira só se observou nos últimos vinte anos (Cassali et al., 2007). A punção aspirativa teve inicialmente uma boa adesão mas devido ao facto de se acreditar que a punção neoplásica poderia levar à disseminação de células neoplásicas pelos tecidos, acabou por cair um pouco em desuso (Meyer, 1996).
A citopatologia estuda as alterações relacionadas com as células enquanto entidades integradoras de processos patológicos. Os objectivos da citologia baseiam-se na
15
distinção entre processos inflamatórios, hiperplásicos e neoplásicos; e identificação de locais de metástase, de forma a actuar rapidamente em relação ao tratamento e monitorização de possíveis recidivas locais (Magalhães et al., 2001). Uma das finalidades do exame citológico é a classificação das lesões, ajudando no diagnóstico, prognóstico e tratamento (Raskin, 2003).
As imagens que a citologia nos apresenta são a duas dimensões: observam-se os limites celulares, o núcleo e o nucléolo são evidentes, e as junções celulares encontram-se bem marcadas (Peleteiro et al., 2006). Antes de iniciar uma colheita para exame citológico, devem-se obter informações sobre a história clínica do animal e evolução da lesão (sobretudo em relação à velocidade de crescimento). A lesão deve ser caracterizada relativamente à localização, dimensão, consistência, sensibilidade dolorosa, presença de líquido no aspirado, características do aspirado e facilidade na obtenção de material para execução do esfregaço (Meyer, 1996). Os achados clínicos identificados no exame clínico ou história pregressa que indicam malignidade de uma neoplasia são: o tamanho, crescimento rápido e recente, infiltração dos tecidos vizinhos, presença de eritema e edema (Allen et al., 1986).
Como o nome indica, a citologia aspirativa é um método que permite aspirar uma pequena porção de tecido por intermédio duma agulha, cujo fino calibre possibilita intervir com um traumatismo mínimo para o animal. A técnica consiste em dispersar o material da colheita numa fina camada sobre uma lâmina, com o objectivo de obter uma monocamada de células (Peleteiro et al., 2006). Depois de depositar o material na extremidade de uma lâmina limpa, faz-se uma compressão suave e deslizamento de outra lâmina sobre o material para se obter uma monocamada de forma a facilitar a observação ao microscópio óptico (Meyer, 2003).
Para se obter uma boa amostra citológica é importante obter um elevado número de células, preservar a sua arquitectura, utilizando métodos não traumáticos na recolha e execução do esfregaço (Masserdotti, 2006).
As lâminas a enviar para o laboratório devem ser bem acondicionadas num porta-lâminas e mantidas distantes de recipientes que contenham formol, uma vez que os seus vapores alteram a integridade da amostra. Nesse caso, as células nucleadas podem surgir com uma aparência azulada, com pouco detalhe celular, e os eritrócitos azul-esverdeados (Meyer, 1996).
A recolha do material deve ser feita em várias áreas da mesma lesão e a partir de diferentes lesões no mesmo animal, quando existentes, devido à heterogeneidade
16
tecidular característica das lesões mamárias. O melhor local para obter amostras mais representativas é na periferia da lesão, porque a zona central é constituída na sua maioria por material necrosado, podendo dificultar o diagnóstico. Devem evitar-se também as áreas flutuantes da lesão, porque do material recolhido pode apenas resultar um líquido de baixa celularidade (Solano-Gallego, 2010).
Na citologia veterinária podem ser usadas diferentes colorações. Diferem umas das outras relativamente aos tempos de realização e estruturas celulares que evidenciam. Os corantes mais utilizados são os provenientes do método de Romanowsky (Diff-Quick, Wright, Giemsa, May-Grünwald-Giemsa e Leishman) (Meyer, 2003). A utilização da técnica de coloração de Romanowsky é muito utilizada porque os procedimentos são rápidos e de fácil execução. Estes corantes coram bem as células, evidenciando o núcleo, nucléolo e o citoplasma (Magalhães et al., 2001).
A citologia tem sido, de uma forma geral, uma valiosa ferramenta de diagnóstico (Peleteiro et al., 2009). Apresenta-se como uma técnica pouco dolorosa, de fácil repetibilidade, não requerendo material sofisticado, anestesia ou sutura, evitando assim os riscos anestésicos e pós-cirúrgicos, assim como as complicações tardias associadas (Magalhães et al., 2001; Peleteiro e Rodrigues, 1991; Sangha et al., 2011). Em medicina veterinária, a maior parte dos patologistas utiliza-a preferencialmente por ser considerada uma técnica simples, barata, inócua e rápida (Peleteiro, 1994). Uma outra vantagem da citologia é o facto do processamento do material obtido não ser necessário, uma vez que é de imediato espalhado sobre uma lâmina (Peleteiro e Rodrigues, 1991). O exame citológico de aspirados oriundos da glândula mamária é muito vantajoso relativamente à diferenciação entre lesões não neoplásicas (hiperplasias, quistos), neoplásicas e inflamatórias (mastites) (Barton, 1983).
Através de uma avaliação citológica cuidadosa e conhecimento do comportamento tumoral podem ser obtidas informações valiosas no que diz respeito à origem do tumor e o seu potencial de malignidade (Alleman, 2003). Possibilita ainda um diagnóstico rápido em que os resultados são considerados bastante fiáveis permitindo um diagnóstico de elevada precisão (Mills e Griffiths, 1984). O exame citológico por punção aspirativa com agulha fina (PAAF), pré- ou em pleno acto cirúrgico, é um bom meio de diagnóstico prático, pela sua rapidez e facilidade de execução (Eich et al., 2000), permitindo definir a técnica cirúrgica mais apropriada, ou o estabelecimento de margens cirúrgicas mais amplas (Meyer, 1996; Magalhães et al., 2001; Simeonov e
17
Stoikov, 2006). É também considerada uma técnica muito útil na identificação dos linfonodos suspeitos de metástases (Zuccari et al., 2001).
A aplicação clínica do exame citológico por PAAF é muito útil em várias situações. No caso de uma neoplasia inoperável, o diagnóstico citológico pode evitar a necessidade de realizar uma biópsia confirmativa (Allen et al., 1986). Em pacientes com vários nódulos mamários, sabendo quais são benignos e malignos, a citologia pode fornecer informações úteis de como deve ser feita a cirurgia (Allen et al., 1986). A citologia permite ainda, um diagnóstico fiável no caso de recorrência de tumores malignos, extirpados, evitando a necessidade de uma nova intervenção cirúrgica para obter um diagnóstico (Allen et al., 1986).
Contudo, a citologia tem as suas limitações: a observação da arquitectura global da lesão neoplásica, assim como informação acerca da capacidade invasiva da lesão em relação aos tecidos vizinhos, não é possível. Uma das principais limitações da citopatologia relaciona-se com a descrição das neoplasias, que não é específica, sendo as lesões reconhecidas apenas como carcinoma ou sarcoma (Magalhães et al., 2001). Alguns autores não consideram a PAAF a técnica de diagnóstico mais indicada, porque a maioria dos tumores da cadela são mistos, sendo necessária a obtenção de amostras de vários pontos de aspiração (Peleteiro, 1994; Zuccari et al., 2001). De qualquer forma, a diferenciação do material benigno em relação ao maligno não provocaria alterações no procedimento cirúrgico (Zuccari et al., 2001).
1.6.2 Histopatologia
A análise histopatológica é a técnica de eleição no diagnóstico, devendo ser realizada em todas as circunstâncias, porque determina o prognóstico com elevada precisão (Peleteiro et al., 2009). De um modo geral, a histopatologia é realizada sobre a totalidade do tumor, visto que em medicina veterinária a excisão cirúrgica é o tratamento de eleição (Peleteiro, 1994).
Para além da sua importância na classificação das lesões, o exame histopatológico permite avaliar a arquitectura tecidular, a infiltração dos tecidos adjacentes, vasos linfáticos e sanguíneos, por parte das células neoplásicas. Fornece informação pormenorizada sobre o grau de diferenciação, presença ou ausência de pleomorfismo, índice mitótico e presença ou ausência de necrose. Permite ainda avaliar se as margens cirúrgicas de segurança foram adequadas (Cassali, 2009).
18
Para um correcto exame histopatológico é necessário analisar amostras provenientes de vários pontos do tumor, devendo abranger não só tecido tumoral, como também zonas de transição entre as lesões e os tecidos aparentemente sãos. Assim é possível avaliar o grau de invasão local e da reacção inflamatória envolvente, e analisar lesões de displasia mamária, que frequentemente acompanham os tumores (Peleteiro, 1994).
Os tumores são classificados da seguinte forma: bem diferenciados (Grau I), moderadamente diferenciados (Grau II) e fracamente diferenciados (Grau III) com base na formação de túbulos, atipia nuclear e índice mitótico (Cassali, 2009).
1.6.3 Comparação entre a citologia e a histopatologia
Na maioria dos casos, os critérios citológicos de malignidade fazem uma previsão fiável do comportamento biológico do tumor (Alleman e Bain, 2000). No entanto, a localização de alguns tumores assim como o tipo específico devem ser ponderados ao usar-se a citologia para determinar o potencial comportamento maligno (Alleman e Bain, 2000).
Em determinadas situações, o diagnóstico citopatológico é mais fácil do que o exame histopatológico, principalmente no caso dos mastocitomas, em lesões linfoproliferativas ou em melanomas. De acordo com alguns autores, nos sarcomas e linfomas, o exame citopatológico por meio de PAAF possui melhor eficácia para o diagnóstico do que a histopatologia (Magalhães et al., 2001). No caso dos tumores mesenquimatosos e neoplasias que apresentam um componente conjuntivo abundante, este dificulta a esfoliação e a colheita de material (Henson, 2003).
Existem situações em que a aparência citológica pode não prever com exactidão determinados comportamentos: a inflamação pode causar alterações reactivas nas células epiteliais ou mesenquimatosas (hiperplasia reactiva) que mimetizam a malignidade (Alleman e Bain, 2000). Os critérios de malignidade devem por isso ser aplicados cuidadosamente numa lesão com população celular mista; isto é, quando existem células inflamatórias (neutrófilos, eosinófilos, linfócitos, macrófagos) e não inflamatórias (células epiteliais e mesenquimatosas) (Alleman e Bain, 2000). Nestes casos a avaliação histológica de uma lesão é necessária para determinar a presença de um processo neoplásico.
Os arranjos celulares são muito importantes na avaliação histológica; no entanto, as amostras citológicas não determinam com rigor esses parâmetros. Raramente, uma
19
descrição citológica realça com rigor a arquitectura da lesão, para além da aparência do núcleo e do citoplasma (Alleman, 2003; Masserdotti, 2006). É importante referir que a arquitectura das células em citologia pode, ou não, manter a arquitectura que originalmente tinha nos tecidos, quando são colhidas e preparadas apropriadamente (Masserdoti, 2006).Pode afirmar-se que a utilidade da citopatologia e da histopatologia dentro da clínica médica é igualmente importante, uma vez que se complementam (Magalhães et al., 2001).
1.6.4 Estudos realizados
Num estudo realizado por Zuccari et al. (2001) em 35 tumores mamários de cadelas, verificou-se que a PAAF é um procedimento pouco sensível (73%). Assim, propunham que a técnica deveria ser utilizada juntamente com o diagnóstico histopatológico e não isoladamente. No mesmo estudo, a citologia aspirativa apresentou ainda uma boa especificidade (83%), próxima da considerada adequada. No entanto, Sangha et al. (2011) registaram, relativamente à citologia, valores bastante elevados de sensibilidade e especificidade, na ordem dos 87.5% e 85.7%, respectivamente. A correlação entre a citologia e a histopatologia, no diagnóstico de neoplasias malignas, era de cerca de 90%; no entanto, a detecção de tumores benignos rondava apenas os 66%. Queiroga e Lopes (2002) afirmam que o exame citológico só é conclusivo se indicar malignidade. A maioria dos autores considera que a PAAF não é o método de diagnóstico mais indicado, visto que a distinção entre neoplasias benignas e malignas não iria alterar a abordagem terapêutica, sendo a maior parte das vezes recomendada a excisão cirúrgica (Zuccari et al., 2001; Rutteman et al., 2001). Para além disso, a maioria dos tumores de cadela apresenta uma composição celular mista, havendo necessidade de obter amostras em vários pontos das lesões (Ruteman et al., 2001).
Allen et al. (1986) defendem que a PAAF pode dar indicações de como deve ser realizada a cirurgia, em caso de múltiplos nódulos mamários benignos e malignos. Nas neoplasias benignas, a cirurgia pode ser adiada ou antecipada com segurança, se o animal tiver também outros problemas clínicos mais graves. No entanto, sempre que existirem dúvidas quanto a uma lesão neoplásica, em que não há nódulos individualizados, em casos de recorrência ou em casos de hipertrofia dos linfonodos, a citologia deve ser sempre realizada (Peleteiro et al., 2009).
20
Alguns autores referem que a citologia tem grande interesse, porque ajuda a identificar a natureza da lesão: neoplásica, inflamatória ou hiperplásica, afastando possíveis diagnósticos diferenciais como mastite, lipoma e mastocitoma (Queiroga e Lopes, 2002; Lana et al., 2009; Sangha et al., 2011). Por outro lado, também é importante na avaliação dos linfonodos regionais e de órgãos que são sede de metástases à distância (Solano-Gallego, 2010). A maioria dos estudos considera o exame citológico bastante fiável relativamente à capacidade para emitir um diagnóstico de malignidade (Allen et al. 1986; Hellmén e Lindgren, 1989; Peleteiro, 1994; Zuccari et al, 2001; Sangha et al., 2011; Sontas et al, 2012). No quadro 1. estão sumariados vários estudos onde se observam os valores em percentagem da sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acurácia sobre o exame citológico como meio de diagnótico em tumores mamários de cadelas. No entanto, o mesmo não se verifica relativamente a uma lesão benigna, pelo facto da citologia aspirativa obtida ser pobre em células, podendo apresentar vários elementos típicos duma mama normal, nomeadamente adipócitos, sangue e algumas células de revestimento ductal. A emissão de um diagnóstico de neoplasia maligna por vezes também pode ser difícil, quando se obtém um número reduzido de células na recolha. Neste caso, o tumor maligno pode até assumir a aparência duma neoplasia benigna (Peleteiro, 1994).
21
Quadro 3 Estudos sobre o exame citológico como meio de diagnóstico (adaptado de Sontas et al, 2012)
Ref. Nº cães Nº tumores Tamanho seringa (ml) Diâmetro agulha (G) Coloração Nº biópsias por tumor Amostras inadequadas (%) SP (%) SN (%) PPV (%) NPV (%) DA (%) Allen et al. 1986 37 91 3 22 Modified Sano Trichrome 1 17,6 55,5 21 95 67 25 Hellmen and Lindgren 1989* 76 84 Nd Nd MGG Nd 11 94 65 Nd Nd 79 Cassali et al. 2007 73 77 10 23 MGG/ Papanicolau 1 24,7 100 88,6 100 84 92,9 Simon et al.2009 50 50 Nd 22 MGG >4 14 97 83 94 91 93 Hazıroglu et al. 2010 20 31 10 Nd MGG Nd 10,4 Nd Nd Nd Nd 88,5 Sontas et al. 2012 55 90 5 22 MGG 3 27,7 100 96,2 100 66,7 96,5
22
2. Objetivos
As neoplasias mamárias caninas constituem um desafio tanto para o oncologista como para o patologista veterinário, nomeadamente no que diz respeito ao diagnóstico. No sentido de comprovar a citologia como um meio de diagnóstico válido em oncologia mamária canina, o presente estudo pretende comparar a fiabilidade da citologia obtida através de punção aspirativa por agulha fina (PAAF) relativamente à histopatologia, considerada como meio de diagnóstico “padrão” (“gold standard”) em neoplasias mamárias caninas.
23
3. Material e métodos
3.1 Material
Neste estudo foram acompanhados 16 canídeos do sexo feminino que se apresentaram no Hospital Veterinário do Baixo Vouga entre o período de 1 de Setembro de 2013 a 28 de Fevereiro de 2014. Nos 16 canídeos foram identificadas clinicamente 31 neoformações de localização mamária variada, nas quais foi realizada a avaliação citológica e histopatológica.
O material colhido foi enviado para o Laboratório de Histologia e Anatomia Patológica da Universidade de Trás-os-Montes e Alto Douro onde foi posteriormente analisado. De cada animal foi recolhida informação relativamente à sua identificação (nome, idade, raça); localização e tamanho das lesões mamárias, a qual foi registada em fichas individuais.
Na maioria dos casos as lesões foram identificadas previamente pelos proprietários; noutros casos, foi o médico veterinário a detectá-las, através do exame físico com palpação durante a consulta. Após a identificação da lesão, o procedimento a seguir foi alertar o proprietário para a necessidade do diagnóstico, assim como para as possibilidades terapêuticas. O tratamento sugerido em todos os casos foi a remoção cirúrgica da lesão com amplas margens de segurança.
3.2 Metodologia
A execução da punção aspirativa foi realizada após a exérese cirúrgica. Esta técnica foi realizada através da introdução de uma agulha de 22 G no interior da lesão, utilizando uma seringa de 5 ml em posição de repouso. O êmbolo foi retraído 3 a 4 vezes provocando pressão negativa. Para evitar a entrada do material puncionado para o interior da seringa, recolocou-se o êmbolo da mesma novamente na posição inicial ou de repouso. Para transferir o material para a lâmina, a agulha (contendo a colheita) foi retirada da seringa. Esta foi preenchida com ar tracionando caudalmente o êmbolo. A agulha foi novamente colocada no canhão da seringa e o êmbolo empurrado para a frente, fazendo com que o material aspirado fosse depositado na superfície de uma lâmina de vidro. Esta encontrava-se limpa e desengordurada, sendo manipulada sempre pelos bordos de forma a evitar contaminação da amostra. De acordo com as dimensões
24
da massa, realizaram-se duas ou mais punções; para cada lesão, foram enviadas para análise 3 a 4 preparações, consoante a quantidade de material que fosse possível recolher.
Todas as lâminas foram identificadas com o nome do animal e da localização da lesão. Após secagem ao ar, procedeu-se à fixação para preservação imediata da estrutura celular e conservação dos detalhes citopatológicos, utilizando a coloração de Romanowsky - Diff-Quick. Este é composto por 3 soluções: metanol (fixador), eosina (corante ácido/aniónico) que cora as proteínas com carga positiva/básicas de vermelho e tiazina (frequentemente o azul de metileno) que cora o ADN de azul. As lâminas foram mergulhadas sequencialmente em cada uma destas soluções, durante cerca de 16 segundos, pela ordem anteriormente referida. Retirou-se o excesso de corante numa rápida passagem por água destilada ou corrente. Após secagem, as lâminas foram acondicionadas num porta-lâminas de forma a garantir condições de conservação ideais até à sua chegada ao laboratório.
Todas as preparações citológicas foram examinadas e classificadas por um patologista veterinário em microscópio de luz, sem conhecimento do resultado histopatológico correspondente. O diagnóstico citológico teve em consideração as diversas preparações disponíveis de cada lesão, tendo sido verificada a qualidade da preparação e as características morfológicas citológicas. As amostras foram classificadas em três grupos: neoplasia benigna, neoplasia maligna e amostra inadequada/insuficiente (amostra com representação de número inferior a 5 aglomerados de células, cada um com 5 a 10 células) (Allen et al., 1986; Colodel et al., 2012). Uma lesão foi classificada como maligna quando a maioria das células apresentava pleomorfismo marcado e mais de 20% apresentavam no mínimo três critérios de malignidade nucleares, como anisocariose, aumento da relação núcleo:citoplasma, angulação e variação no número de nucléolos. (Simon et al., 2009). Não constituiu objetivo deste trabalho a diferenciação citológica entre lesões neoplásicas simples vs. complexas vs. mistas.
Relativamente à histopatologia, a peça de mastectomia ou nodulectomia foi geralmente enviada na íntegra para análise histopatológica, fixada em formol tamponado a 10%; quando tal não foi possível, foi enviado material representativo da lesão/lesões, tendo sido evitadas regiões com necrose/hemorragia. O material foi processado segundo o processamento de rotina para microscopia de luz, procedendo-se ao diagnóstico das lesões neoplásicas mamárias de acordo com a classificação proposta pela OMS para neoplasias de mama de cadela (Misdorp et al., 1999).
25
3.3 Análise estatística
A análise citológica foi testada em relação ao teste padrão (histopatologia), no sentido de analisar o seu valor na deteção de neoplasias malignas mamárias (sendo o diagnóstico de neoplasia maligna considerado positivo e o diagnóstico de neoplasia maligna considerado negativo). Assumindo que o teste-padrão é válido, o resultado do teste em análise (citologia) pode estar correto (concordância entre testes) [verdadeiro-positivo (VP) e verdadeiro-negativo (VN)] ou incorreto (não concordância entre testes) [falso-positivo (FP) e falso-negativo (FN)]. A validade do teste foi medida pelas taxas de VP entre os tumores malignos (sensibilidade) e VN entre os benignos (especificidade) (Zuccari et al., 2001). Foi determinado o valor preditivo positivo (VPP) e negativo (VPN) e a acurácia (exatidão) diagnóstica da análise citológica. O VPP calculou-se com base na probabilidade da lesão ser maligna na avaliação histológica quando o resultado citológico foi maligno; o VPN calculou-se tendo em conta a probabilidade da lesão ser benigna na avaliação histológica quando o resultado citológico foi benigno. A acurácia (exatidão) diagnóstica corresponde à proporção dos casos corretamente diagnosticados por citologia (Varallo, 2013) (Quadro 2).
Quadro 4 Método de cálculo dos testes de validação diagnóstica (adaptado de Varallo, 2013).
Histopatologia
Citologia Positiva Negativa
Positiva a b
Negativa c d
Sensibilidade=a/(a+c); especificidade=d/(b+d); VPP=a/(a+b); VPN=d/(c+d); acurácia=(a+d)/(a+b+c+d)