Je tiens à remercier sincèrement Jaime Angulo-Mora de m'avoir accueilli au Laboratoire de Génétique de Radiosensibilité. Ce travail de thèse a porté sur l'étude du rôle de la voie des micro-ARN dans la biologie des cellules tumorales.
L A VOIE MICRO -ARN
L’interférence ARN
- Origines et découverte de l’interférence ARN
- Identification des siRNAs, intermédiaires de l’interférence ARN
- La voie siRNA
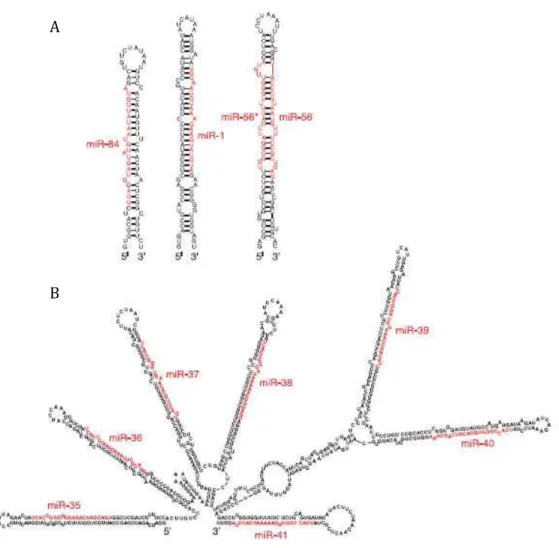
- Découverte des micro-ARNs
- Origine et évolution des micro-ARNs
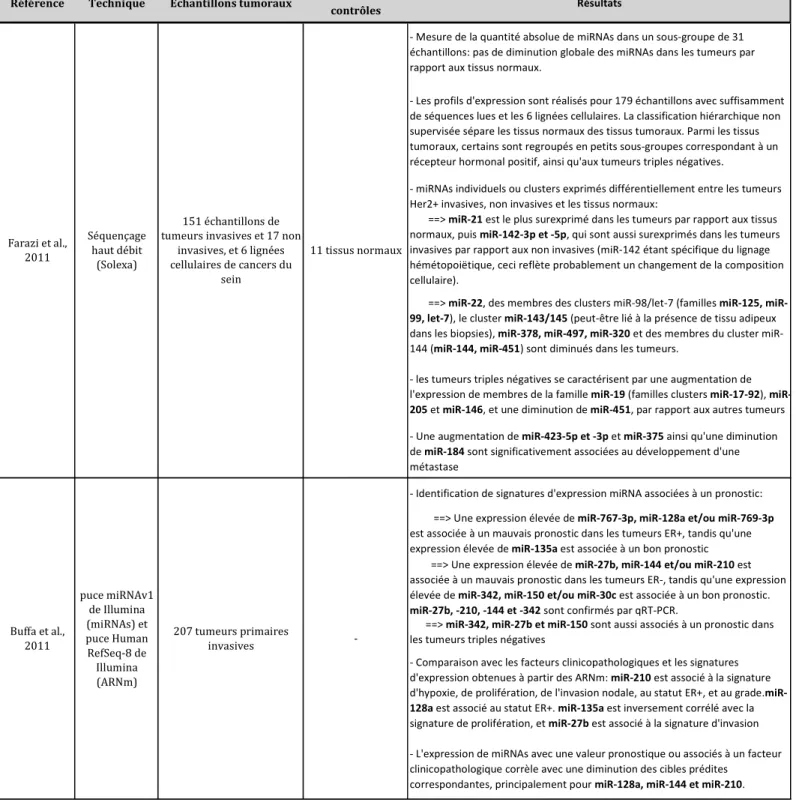
Chez les mammifères, toutes les protéines de la sous-catégorie AGO sont capables de se lier aux siARN, mais seul AGO2 possède l'activité catalytique nécessaire pour cliver l'ARNm cible (Liu et al., 2004b ; Meister et al., 2004) (Figure 1) . Il s'agit de let-7, chargé d'inhiber l'expression de la protéine lin-41, qui permet cette fois le passage du stade larvaire L4 à l'âge adulte (Reinhart et al., 2000).
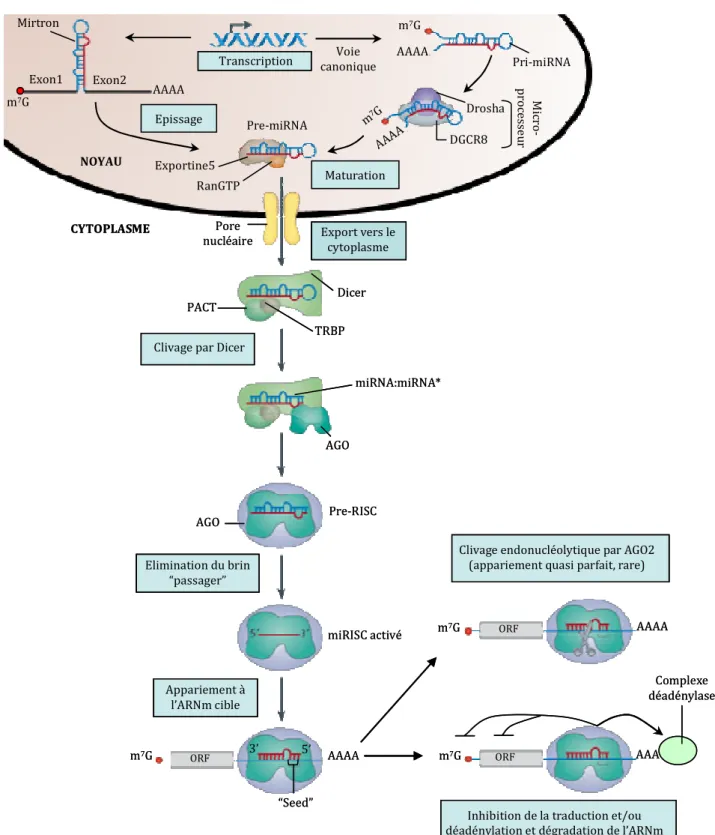
Biogenèse des micro-ARNs
- Organisation génomique et transcription
- Organisation génomique
- Transcription
- Maturation dans le noyau et export dans le cytosplasme
- Voie canonique : clivage du pri-miRNA par le microprocesseur
- Régulation de l’activité du microprocesseur
- Auto-régulation croisée entre Drosha et DGCR8
- Un processus co-transcriptionnel
- Mirtrons
- Export dans le cytoplasme
- Maturation du pre-miRNA et formation du complexe RISC
- Maturation du pre-miRNA
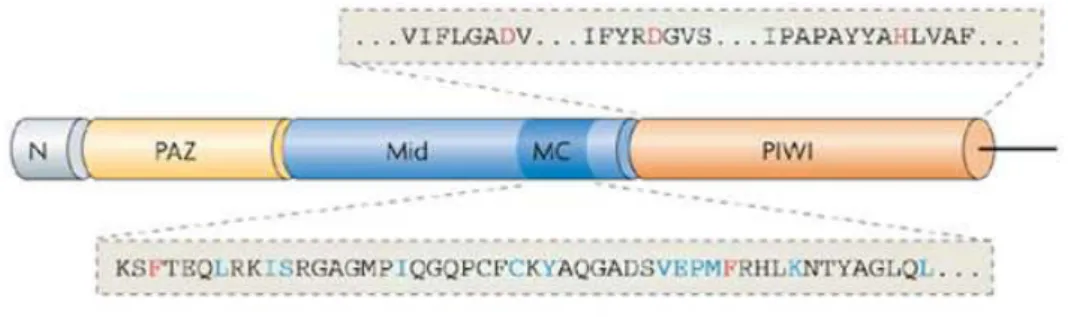
- Le(s) complexe(s) RISC
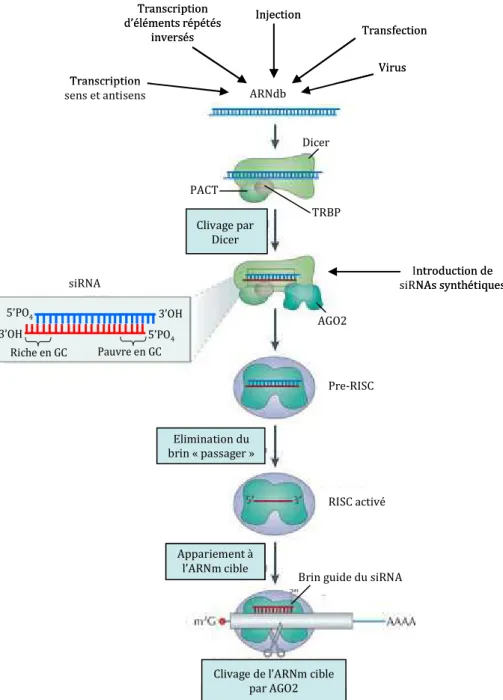
En revanche, la région N-terminale de DGCR8 est requise pour sa localisation nucléaire ( Yeom et al., 2006 ). Dans d'autres cas, au contraire, cela peut favoriser la maturation par Drosha (Kawahara et al., 2008).
Modes d’actions
- Appariement à l’ARNm cible
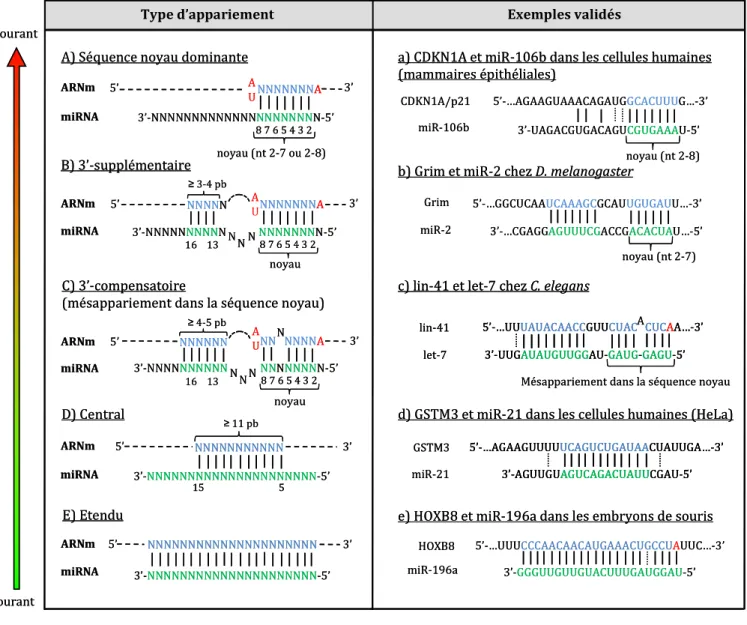
- Règles classiques d’appariement
- Discussion des règles d’appariement
- Conséquences
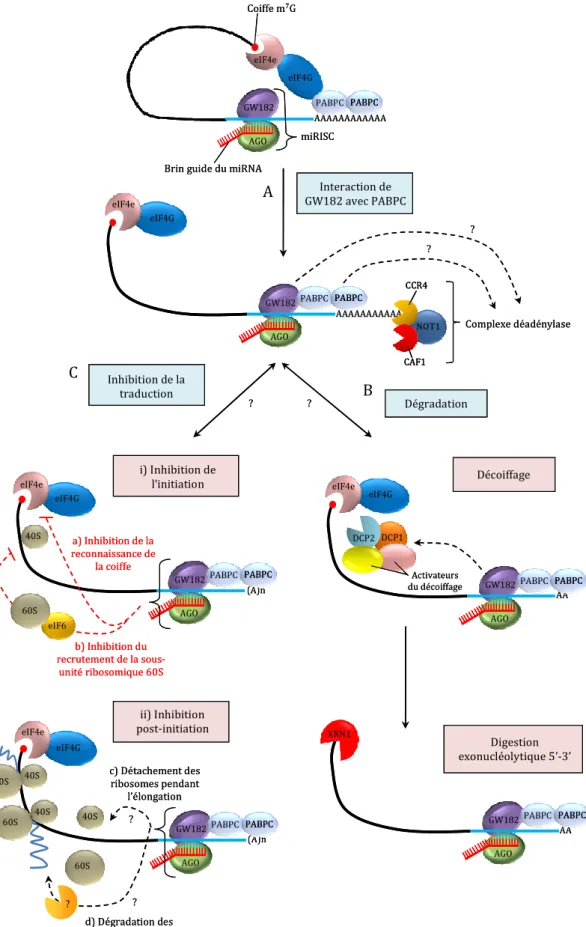
- Modes de régulation de l’expression de la cible
- GW182 et les « corps-P »
- Inhibition de la traduction
- Déadénylation et dégradation de l’ARNm
- Plusieurs mécanismes ?
- Cas particulier : l’activation de la traduction
Cependant, ces résultats ne sont pas reproduits par la déplétion de eIF6 dans les cellules de drosophile ( Eulalio et al., 2008 ). Cette activation de la traduction se produit au stade d'initiation, en stimulant l'association de la petite sous-unité ribosomale avec l'ARN du VHC (Henke et al., 2008).
Rôles biologiques
- Expression mutuellement exclusive : induction de transitions, sauvegarde et
- Co-expression : affinage du niveau d’expression de la cible
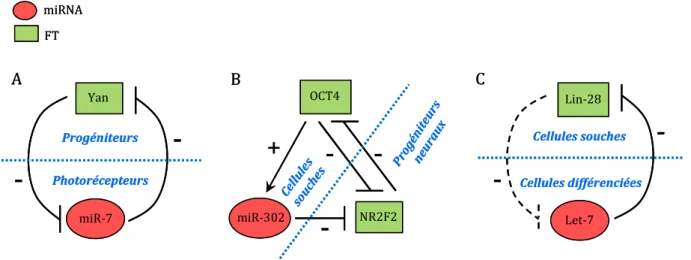
- Maintien des états cellulaires spatio-temporels
De même, l'étude du profil d'expression des miARN dans les lymphocytes T montre que seuls 7 miARN représentent 60 % des miARN exprimés (Wu et al., 2007). Cependant, l'expression de miR-302b (ou miR-372) en complément des facteurs de pluripotence couramment utilisés (Takahashi et Yamanaka, 2006), permet d'augmenter l'efficacité de la reprogrammation des fibroblastes humains en cellules souches pluripotentes induites (iPSC). = « cellules souches pluripotentes induites ») (Subramanyam et al., 2011).
M ICRO -ARN S ET CANCER
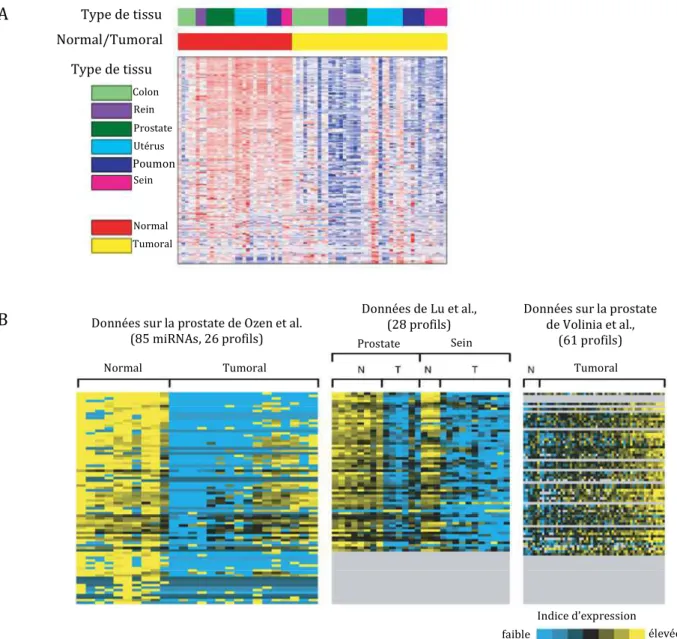
Profils d’expression des micro-ARNs dans les cancers
- Profils et signatures d’expression
- Applications en clinique
Notons enfin que l'étude de Farazi et al., basée sur le séquençage à haut débit, indique qu'aucune réduction globale de l'expression des miARN n'a été constatée dans les tumeurs du sein étudiées par rapport aux tissus normaux. Par exemple, l'analyse de l'expression globale des miARN dans les tissus tumoraux menée par Lu et al.
Perturbation globale de la voie micro-ARN dans les cancers
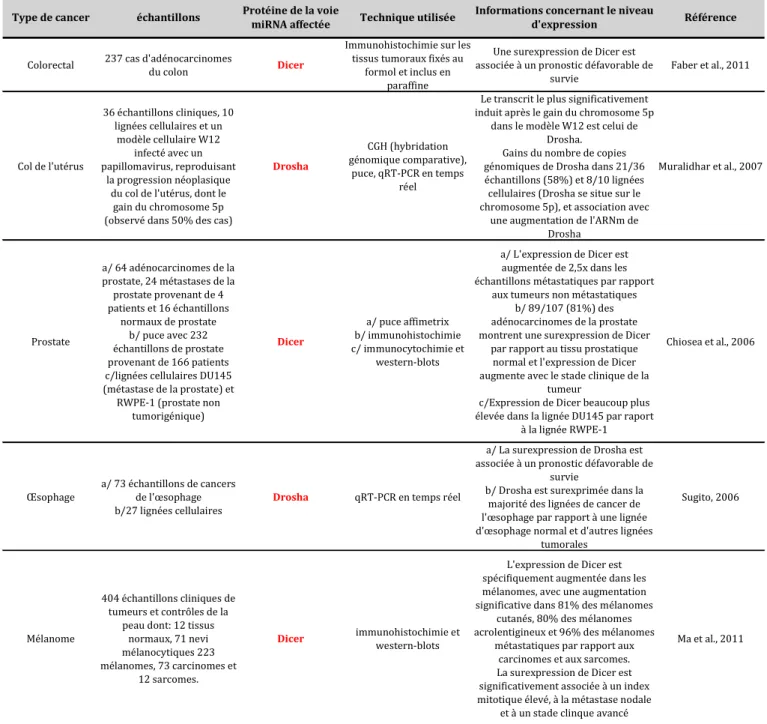
- Diminution de la majorité des micro-ARNs
- Anomalies d’expression d’acteurs de la voie de biogenèse des micro-ARNs
- Conséquences fonctionnelles sur la tumorigenèse et la progression tumorale
Outre la régulation de l’étape de maturation par le microprocesseur, la régulation négative de l’expression de certains miARN dans les cancers se produit directement par répression transcriptionnelle. Les auteurs montrent que la suppression hétérozygote de Dicer conduit effectivement à une réduction globale de l’expression des miARN par rapport aux rétines Dicer+/+. Une étude montre une association entre l'inhibition de l'expression de Dicer par les miARN de la famille miR-103/107 et les métastases dans le cancer du sein (Martello et al., 2010).
Enfin, il convient de noter que ni les mutations ni les modifications de l'expression de DGCR8 n'ont été décrites dans le cancer.
Micro-ARNs suppresseurs de tumeurs et oncogènes
- Suppresseurs de tumeurs
- miR-15a~16-1
- let-7
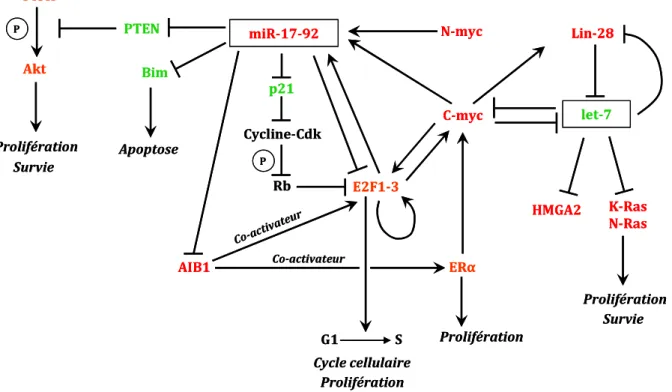
- Oncogènes (oncomiRs)
- miR-17-92
- miR-155
- miR-21
- miR-372~373
Dans la lignée de cancer du sein métastatique MDA-MB-231, l'inhibition de miR-21 n'affecte pas la prolifération cellulaire (Zhu et al., 2008). Une autre étude montre que l'inhibition de miR-21 réduit la capacité invasive, intravasation et métastatique d'une lignée de carcinome du côlon (Asangani et al., 2008). Dans les lignées de carcinome hépatocellulaire, l'inhibition de miR-21 réduit la prolifération, la migration et l'invasion cellulaires (Meng et al., 2006).
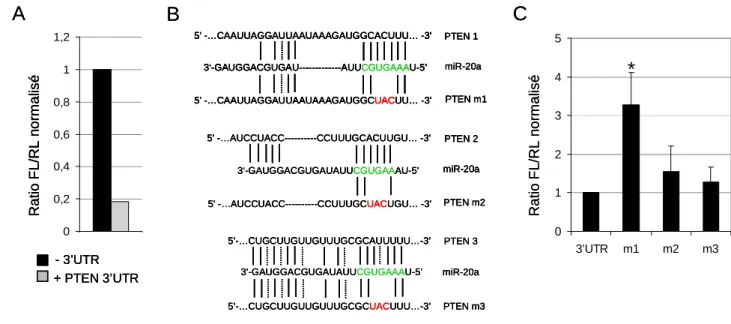
Le suppresseur de tumeur PTEN a également été identifié comme cible de miR-21 dans les lignées de cancer hépatocellulaire (Meng et al., 2006).
O BJECTIFS DU PROJET
Cette régulation négative est au moins partiellement due à une altération du fonctionnement du microprocesseur (Thomson et al., 2006). Nous avons donc développé un système inductible pour inhiber Drosha à l'aide de vecteurs lentiviraux permettant l'expression de shDro sous le contrôle d'un promoteur dépendant de la tétracycline (Wiederschain et al., 2009). Récemment, une étude a décrit l'effet de l'inhibition de la voie des miARN sur le potentiel invasif des lignées de cancer du sein (Noh et al., 2011).
Ils ont montré que l'expression de p21 était induite dans les cellules DGCR8−/− ES et inhibée par l'expression des miARN de la famille miR-290 et miR-302 dans ces cellules ( Wang et al., 2008d ).
S TRATEGIE EXPERIMENTALE
Présentation globale de la stratégie utilisée
Afin d'identifier des miARN d'intérêt dans la prolifération ou la survie des cellules cancéreuses identifiées, le principe de notre approche expérimentale est d'identifier des miARN individuels capables de compléter le(s) phénotype(s) observé(s). Une fois identifiés les miARN capables de compléter le(s) phénotype(s) induits par l'inhibition globale, nous avons cherché à identifier les voies contrôlées par ces miARN qui permettent aux cellules cancéreuses identifiées de survivre ou de proliférer. En effet, il est émis l’hypothèse qu’après une inhibition globale, la dé-répression d’une ou plusieurs cibles de ces miARN serait impliquée dans le phénotype.
L'implication de ces cibles est testée en regardant si leur inhibition directe par les ARNi permet de compléter le phénotype induit par l'inhibition du microprocesseur (Figure 16).
Utilisation de vecteurs épisomaux dérivés du plasmide EBV
- Présentation
- Validation du système expérimental pour l’inhibition de Drosha
- Obtention de populations cellulaires homogènes avec le vecteur épisomal
- L’inhibition de Drosha n’affecte pas la maturation des ARN ribosomaux
De plus, la xénogreffe de ces cellules chez des souris immunodéficientes nous a permis de montrer que l'inhibition de la MP dans les cellules HCT116 entraînait une augmentation de la tumorigenèse in vivo (Figure 1c), conformément au modèle publié (Kumar et al., 2007). Dans une étude précédente, son équipe avait montré que l’inhibition de la voie des miARN par inactivation du gène DGCR8 entraînait un défaut de différenciation et un ralentissement de la prolifération des cellules ES (Wang et al., 2007). L'équipe de Blelloch a ensuite développé un criblage pour identifier des miARN individuels capables de compléter le défaut de prolifération des cellules ES déficientes pour l'expression de DGCR8 (DGCR8-/-) (Wang et al., 2008d).
Par exemple, une expression et une action coordonnée de miR-9 et miR-9* ont été démontrées dans les cellules souches du cancer du glioblastome (Schraivogel et al., 2011).
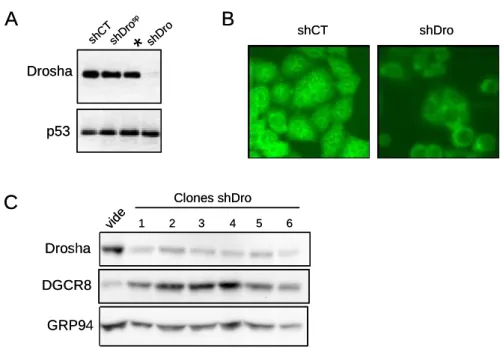
I DENTIFICATION DE CELLULES CANCEREUSES DEPENDANTES DU MICROPROCESSEUR ET
Article I
In transformed cells, this profile was sufficiently conserved to indicate the developmental origin of the tumor tissue (Luet al., 2005). In an elegant approach, Wanget al., (2008) proceeded by complementing this growth defect with individual microRNAs. This result confirmed the already identified cross-regulation between these two proteins (Han et al., 2009).
The tumor suppressor PTEN, a key inhibitory regulator of the PI3K/AKT proliferation signaling pathway (Carracedo and Pandolfi, 2008), is also a shared target of miR-19 (Lewiset al., 2003) and miR-20 (Poliseno et al., 2010 ).
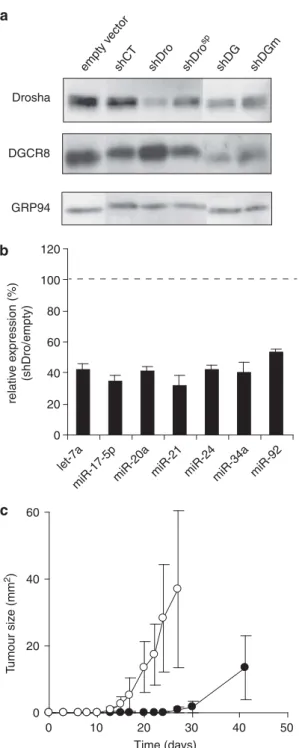
Résultats additionnels
- L’inhibition du microprocesseur n’est pas améliorée par l’inhibition
- PTEN est une cible de la famille miR-20
Nous avons identifié 3 sites miARN prédits de la famille miR-20 dans la région 3'UTR de PTEN. La figure 23B montre qu'après induction de l'inhibition de Drosha dans 2 lignées, nous avons mesuré une diminution de l'expression de la plupart des miARN matures après 7 jours. Cette approche nous a permis d'identifier les cellules tumorales dans lesquelles l'inhibition de la voie des miARN conduit à l'arrêt de la prolifération.
Cependant, il est possible qu’une meilleure inhibition de la voie des miARN se produise dans les cellules arrêtées.
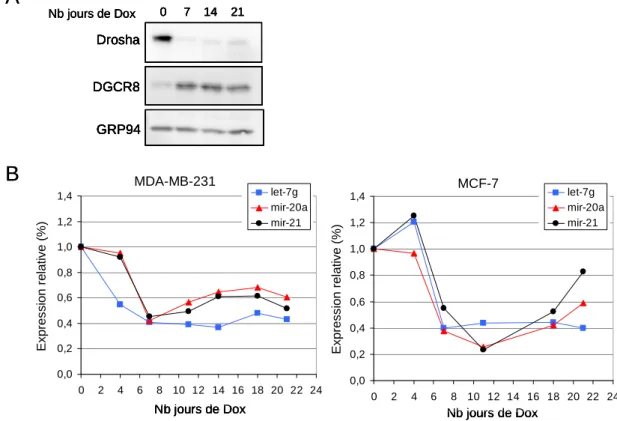
M ISE EN PLACE D ’ UN SYSTEME INDUCTIBLE POUR L ’ INHIBITION DE D ROSHA
Intérêt
Une des limites du système expérimental basé sur les vecteurs épisomaux est qu'il nécessite de travailler après une sélection à moyen terme des cellules transfectées, ce qui ne permet pas d'étudier les premières étapes du phénotype d'arrêt de la prolifération. De plus, après sélection, les cellules dépendantes du microprocesseur sont complètement arrêtées par l'inhibition de Drosha ou de DGCR8 avec des vecteurs épisomaux, limitant la possibilité d'étudier ce phénotype d'arrêt de la prolifération des colonies. La possibilité d'inhiber Drosha en l'absence d'effets liés à la sélection des antibiotiques et sur des durées cinétiques choisies permettrait de tester les propriétés moléculaires (niveau d'expression de Drosha et des miARN, niveau d'expression de PTEN et autres cibles). et cellulaire (cycle cellulaire, apoptose, prolifération) des différentes étapes de l'arrêt de la prolifération.
Matériel et méthodes
- Plasmides et production des particules lentivirales
- Transduction cellulaire et établissement de lignées stables
Résultats préliminaires
- Validation de la fonctionnalité du système inductible
- Effets de l’inhibition de Drosha sur la capacité des cellules dépendantes du
De même, l’inhibition de ces miARN individuels par les anti-miR dans les cellules ES de type sauvage n’a montré qu’un effet très subtil sur la prolifération, confirmant la redondance de la famille de miARN identifiée. Dans ces cellules, l'inhibition du microprocesseur entraîne un arrêt de la prolifération des colonies, que nous avons nommé CoGAM (« Arrêt de la croissance des colonies induite par l'inhibition du microprocesseur »). Le fait que l'inhibition du microprocesseur provoque un arrêt de la prolifération dans les cellules tumorales n’ont jamais été décrites jusqu’à présent.
Nous avons montré que l'inhibition de la voie p53/p21 n'avait aucun effet sur l'établissement du phénotype CoGAM. En effet, il est possible que l’inhibition globale des miARN conduise à une augmentation générale de la traduction. Il est intéressant de noter que ces miARN oncogènes ont également été identifiés par l'équipe de Blelloch dans le criblage de complémentation de la prolifération de cellules ES de souris DGCR8-/- (Wang et al., 2008d) (Figure 25).
M ODIFICATIONS PROTEOMIQUES INDUITES PAR L ’ INHIBITION DU MICROPROCESSEUR
A PPROCHE DE GENETIQUE MOLECULAIRE DE LA VOIE MICRO -ARN
R EPONSE A L ’ INHIBITION DU MICROPROCESSEUR DEPENDANTE DU CONTEXTE CELLULAIRE
La réponse à l’inhibition du microprocesseur dépend du contexte
L’approche réciproque, qui consiste en l’inhibition globale de la voie des miARN et qui a conduit à une augmentation de la tumorigenèse dans certains modèles de tumeurs, implique probablement l’inhibition des miARN suppresseurs de tumeurs dans les modèles utilisés. Étant donné que nous avons déterminé l'implication de PTEN dans la lignée MCF-7, il n'est pas exclu que, dans les cellules ZR-75-1, le phénotype CoGAM se produise également par inhibition de la voie PI3K/Akt indépendante de PTEN. De plus, il convient de noter qu'un rôle du PTEN indépendant de son activité lipidique phosphatase (nécessaire à l'activation de la voie PI3K/Akt) mais dépendant de son activité protéine phosphatase a été décrit dans l'arrêt du cycle cellulaire induit dans les cellules MCF-7 (Hlobilkova et al., 2000 ; Weng et al., 2001).
Ainsi, si l'activation de la voie PI3K/Akt semble être l'hypothèse la plus probable dans la complémentation du CoGAM obtenue par inhibition du PTEN dans MCF-7, on ne peut exclure des effets dépendants du PTEN mais indépendants de cette manière.
Potentielle implication d’une composante quantitative dans la réponse à
En effet, avec le système inductif d'inhibition de Drosha que nous avons mis en place, nos résultats préliminaires suggèrent qu'il est nécessaire de passer par une dilution clonale des cellules pour visualiser une réduction de la capacité des cellules à former des colonies. Il est concevable que dans cette étude, une partie de la différence quantitative observée dans l’expression des miARN provienne également d’une accélération de la dégradation dans les cellules non confluentes. Le système inductif que nous avons développé serait un bon outil pour suivre l’élimination des miARN après blocage de la maturation par Drosha.
De plus, cet outil d'inhibition inductible de Drosha nous permettrait d'examiner l'effet de la dilution ou de la perte de contact cellulaire sur la sécrétion de miARN et de déterminer si ce phénomène peut jouer un rôle dans le phénotype d'arrêt de la prolifération des colonies.
Autres composantes pouvant intervenir dans le phénotype CoGAM
Il est donc possible que dans certaines cellules l'inhibition globale de la voie des miARN conduise à un stress, en l'occurrence une augmentation de la traduction que la cellule ne peut pas gérer, responsable de l'écart de taille observé et éventuellement aussi de l'arrêt du cycle cellulaire. . Cependant, si un miARN suffisait à compléter ce stress, indirectement lié à l’inhibition de la voie des miARN, cela devrait se produire indépendamment de la séquence. Cependant, si l'induction principale de la traduction est responsable du stress en question, on ne peut exclure que seule l'expression de certains miARN fonctionnels dans des cellules dépendantes du microprocesseur conduise à l'inhibition de la traduction de nombreuses cibles, et donc à une réduction de la traduction. . , est indirectement suffisant pour évacuer le stress et permettre aux cellules de proliférer.
Cette dimension ajoute de la complexité au réseau de connexions entre les miARN et leurs cibles.
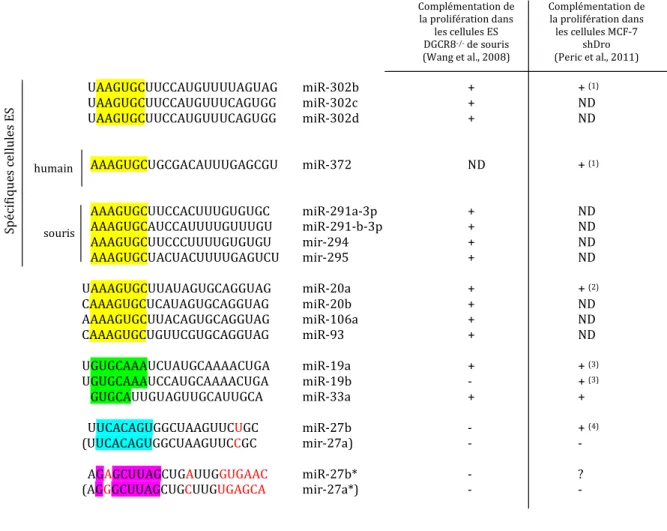
I DENTIFICATION DE MICRO -ARN S SOUTENANT INDIVIDUELLEMENT LA PROLIFERATION
Résumé et comparaison des miARN identifiés dans notre criblage de complémentation pour le phénotype CoGAM dans les cellules MCF-7 shDro (Peric et al., 2011) avec ceux identifiés par l'équipe de Robert Blelloch dans un criblage de complémentation pour le défaut de prolifération des cellules ES DGCR8-/- ( Wang et al., 2008d). L'équipe de Blelloch a proposé que la dé-répression des cibles inhibitrices de la transition G1-S, notamment p21, soit responsable du ralentissement de la prolifération des cellules ES. Dans les cellules dépendantes du microprocesseur, nous avons montré que l'inhibition de p21 n'était pas suffisante pour restaurer la prolifération des colonies.
En conclusion, malgré l’étude indiquant que p53 serait une cible de miR-33, l’inhibition de p53 dans les cellules MCF-7 n’a pas augmenté la prolifération des cellules inhibées pour Drosha.
C ONCLUSION
Downregulation of the miRNA master regulators Drosha and Dicer is associated with specific subgroups of breast cancer. Programmed cell death 4 (PDCD4) is an important functional target of the microRNA miR-21 in breast cancer cells. DOOI-box RNA helicase subunits of the Drosha complex are required for the processing of rRNA and a subset of microRNAs.
A cellular function for the RNA interference enzyme Dicer in maturation of the let-7 small temporal RNA.