Pascale, la protéomique serait bien triste sans toi Nicole P. merci pour l'aide que tu as apporté à la culture des monstres et surtout merci d'avoir trouvé des mots de réconfort à un moment où j'allais mal, je n'ai pas oublié. Caroline, je n'ai pas été beaucoup disponible mais je ne t'ai pas oubliée, merci pour ton soutien constant et pour ta gentillesse, merci pour les sorties parisiennes rafraîchissantes.
Développement de la graine
Acquisition de la tolérance à la dessiccation
La tolérance au dessèchement s'acquiert environ à mi-développement des graines lors de la phase de remplissage. Chez les haricots, la tolérance à la dessiccation s'acquiert lorsque le poids de matière sèche se stabilise (entre 31 et 38 DAP) (Sanhewe et Ellis, 1996).
Longévité des graines
L'acquisition de la tolérance au dessèchement dépendra également de la vitesse de séchage de la graine. En plus de l’établissement d’une tolérance à la dessiccation, d’autres changements physiologiques importants se produiront au cours des derniers stades de maturation.

La dormance
L'établissement de la dormance secondaire semble également dépendre des niveaux d'ABA. Chez M truncatula, la dormance primaire est initiée pendant la maturation à la fin de la phase de remplissage, puis augmente dans les phases tardives lors de la dessiccation des graines.
La tolérance à la dessiccation
Généralités
Après avoir redéfini les principales caractéristiques du développement de la graine orthodoxe, nous allons maintenant décrire les mécanismes qui vont lui permettre de tolérer la dessiccation. Mais généralement, chez les plantes angiospermes, la tolérance à la dessiccation ne se retrouve que dans certaines parties de la plante, à savoir les graines et le pollen.
Impact de la dessiccation sur la cellule
- Impact sur les membranes
- Impact sur les protéines
- Impact sur le métabolisme, et augmentation du stress oxydant
- Impact sur l’ADN
Concernant la conformation de la chromatine, (Leprince et al., 1995) ont montré que chez les racines de maïs sensibles à la dessiccation, la déshydratation in vivo entraînait une condensation irréversible de la chromatine. De même, différents types de dommages à l'ADN (cassures, etc.) ont été rapportés dans des graines sensibles au dessèchement ou ayant subi un stockage prolongé au-delà de la viabilité des lots (Walters et al., 2006).

Mécanismes impliqués dans la tolérance à la dessiccation
- Les systèmes antioxydant
- Les sucres non réducteurs
- L’hypothèse de remplacement de l’eau
- Formation de l’état vitreux
- Les protéines HSP (Heat Shock Protein)
Leur représentation diminue ensuite rapidement au cours de l'ingestion, en association avec la perte de tolérance à la dessiccation (Wehmeyer et al., 1996). De plus, (Alamillo et al., 1995) ont montré que certains sHSP sont absents des cals de la plante en régénération C.
Les protéines LEA (Late Embryogenesis Abundant)
Origine des protéines LEA
Prieto-Dapena et al., 2006), ce qui semble conforter l'importance de leur rôle dans la graine. La mise en place de multiples systèmes et l’interaction entre ces différents systèmes sont nécessaires pour que la graine supporte efficacement la dessiccation.

Caractéristiques et classification des protéines LEA
Le groupe 4 contient des protéines qui n'ont pas de motifs répétés mais qui possèdent un domaine N-terminal plus ou moins conservé. Il convient de noter que (Wise et Tunnacliffe, 2003) considèrent que ce groupe très hétérogène regroupe en fait toutes les protéines qui ne peuvent être classées dans aucun des autres groupes.
Le groupe 5
- Descriptions des membres du groupe 5
- Particularités du groupe 5
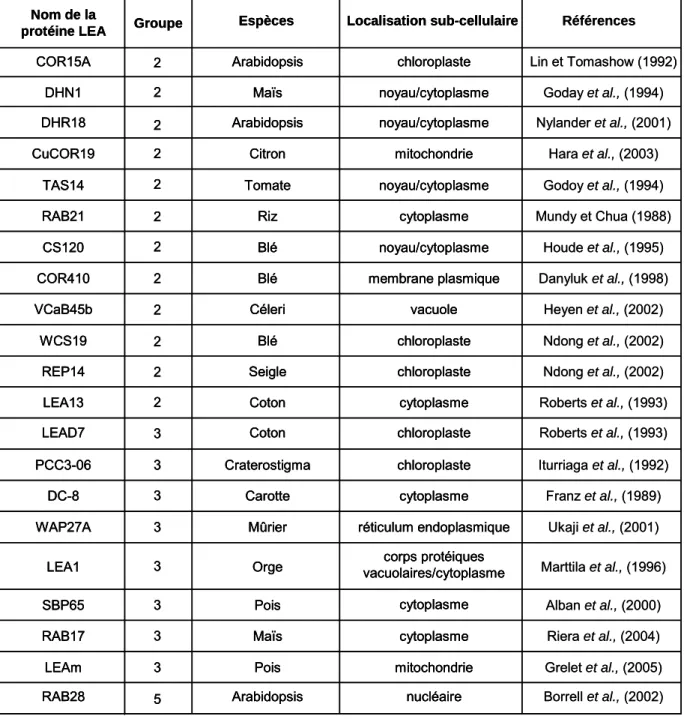
La ligne indique la limite empirique entre les protéines désordonnées à gauche et celles structurées à droite (Uverski et al., 2000). En effet, des hybridations par immunocytochimie ont montré que les protéines AtRAB28 et RAB28 sont localisées dans le noyau de la cellule (Niogret et al., 1996 ; Borrell et al., 2002).

Caractéristiques physico-chimiques des protéines LEA
Il a été démontré que Medicago truncatula est majoritairement (60 % de la protéine) structuré en forme de spirale, mais dans ce cas quelle que soit la vitesse de séchage (Boudet et al., 2006). D'autres études menées sur le dichroïsme circulaire sur LEAM, une protéine mitochondriale du pois, ont également montré une majorité de structuration en hélice lors du séchage ( Tolleter et al., 2007 ).
Localisation cellulaire des protéines LEA
Cette augmentation de la structure hélicoïdale induite par le séchage a également été observée dans les protéines LEA d'autres règnes, comme c'est le cas pour Aav-LEA-1 du nématode Aphelanchus avenae (Goyal et al., 2003). De manière assez remarquable, l'étude menée par (Tolleter et al., 2007) a également pu montrer que cette structuration était réversible, et que le LEAM reprenait une structuration majoritairement désordonnée lors de la réhydratation.
Régulation transcriptionnelle des protéines LEA
Implications des protéines LEA dans la tolérance aux stress abiotiques
- Rôle fonctionnel des protéines LEA : approches de génétique inverse
- Rôle fonctionnel des protéines LEA : approches in vitro
- Protection des protéines
- Protection membranaire
- Séquestration d’ions
- Implication des protéines LEA dans la formation des états vitreux
Ainsi, les protéines LEA pourraient jouer un rôle important dans les propriétés de l’état vitreux des graines sèches (Shih et al., 2004). Dans notre laboratoire (Boudet et al., 2006) ont mis en évidence des protéines LEA liées à la tolérance au dessèchement et spécifiques de la graine de Medicago truncatula.
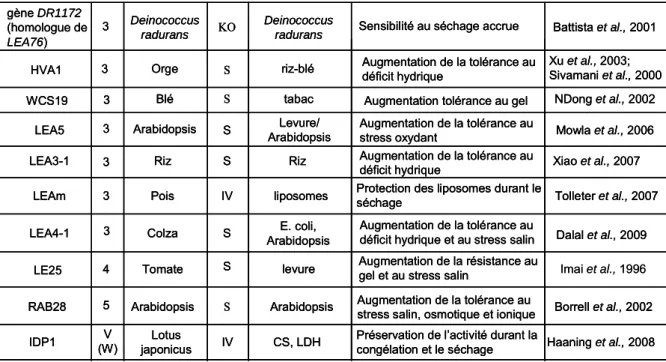
Medicago truncatula, un bon modèle d’étude de la physiologie des légumineuses
En B : Apparition des PM25 dans les graines lors de la maturation en Western blot en parallèle de l'acquisition de la tolérance au dessiccation (DT) indiquée par la barre verte. En D, disparition des PM25 dans les racines lors de la germination et en E, disparition des PM25 dans les cotylédons lors de la germination, parallèlement à la perte de tolérance au dessèchement, indiquée par la barre verte et suivie par le western blot.

PM25 et origine de ce travail
L'expression relative des PM25 (± écart type, sur trois répétitions techniques) est surveillée pendant la germination par RT-qPCR. La stratégie choisie a été d'étudier l'impact de l'absence de PM25 sur la biologie de la graine M. L'expression relative des homologues de PM25 (± écart type, sur trois répétitions techniques) lors de la germination est suivie par RT-qPCR dans les radicules.

PM25, une LEA atypique, spécifique de la graine et
PM25, une protéine hydrophobe largement désordonnée à l’état natif et stable à
- Détermination de l’hydrophobicité de PM25
- PM25, une protéine majoritairement non structurée en solution
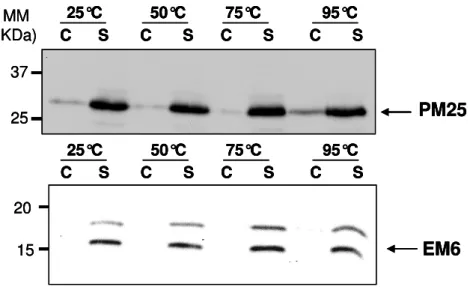
- PM25 est stable à la chaleur dans une solution complexe de protéines
Les spectres obtenus par spectroscopie FTIR de (Boudet et al., 2006) ont été obtenus en diluant la forme recombinante purifiée de PM25 dans du D2O. Nous avons ainsi pu estimer la contribution de chaque structure en solution et en présence de 1% de SDS et comparer nos résultats avec les données obtenues en spectroscopie FTIR par (Boudet et al., 2006). L'analyse de la présence de PM25 dans le surnageant et le culot est réalisée après migration dans un gel SDS-PAGE unidimensionnel suivie d'une révélation de la protéine par Western blot à l'aide d'un anticorps dirigé contre les PM25 (Boudet et al., 2006).

Etude de l’expression de PM25 au cours de la germination et de la croissance
- Expression de PM25 au cours de l’imbibition
- Expression de PM25 en conditions osmotiques pénalisantes
En A, courbes de germination de 80 graines de M. truncatula à l'obscurité à 20°C dans de l'eau (•) ou en présence d'une solution de PEG (○) équivalent à un potentiel hydrique de - 0,3 MPa. En B, analyse RT-qPCR de l'expression relative (± écart-type) des PM25 dans des graines trempées dans l'eau ou en présence de PEG pendant 6 h à l'obscurité. En B, analyse RT-qPCR de l'expression relative (± écart-type) de MtPM25 sur des graines trempées dans l'eau pendant 6 h ou en présence de NaCl.

Localisation cellulaire et tissulaire de PM25
- Localisation cellulaire de PM25
- Localisation tissulaire de PM25
Nous avons également testé les effets de l’ajout de protéines lors de la réhydratation après séchage. De la même manière qu'avec CS, nous avons essayé de vérifier les effets de l'ajout de PM25 après un stress (Figure 2.19). L’effet de la fluridone est donc assez similaire à celui observé avec les graines PM25+.

Caractérisation fonctionnelle de PM25
Effet de PM25 sur la protection de l’ADN et la survie bactérienne lors de stress
- Effet de PM25 sur la conformation de l’ADN
- Protection contre les UV
- Protection contre la dessiccation
Il ne semble donc pas y avoir d’effet spécifique des PM25 sur la conformation de l’ADN. L'expression de PM25 est réprimée en présence de glucose (R), faiblement induite (fI) en l'absence d'inducteur ou de répresseur, ou fortement (I) en présence de L-arabinose dans E.Coli. En présence de PM25, la tolérance à la dessiccation des bactéries n'est pas améliorée, le taux de survie étant similaire à celui observé en l'absence de protéine.
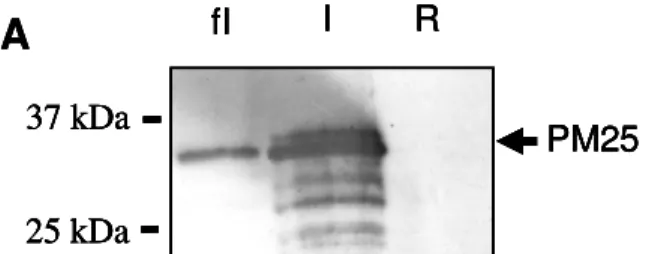
Effet de PM25 sur la protection enzymatique
- Tests de protection de la citrate synthase
- Effet de PM25 sur la protection de la citrate synthase pendant le
- Effet de PM25 sur la protection de la citrate synthase pendant le séchage
- Tests de protection de la lactate déshydrogénase
- Effet de PM25 sur la protection de la lactate déshydrogénase pendant la
Les pourcentages d'activité sont calculés par rapport aux témoins avant chauffage en présence/absence de glycérol. L'évolution du pourcentage d'activité enzymatique est mesurée par rapport aux témoins non séchés respectifs. De même, l'activité résiduelle après congélation en présence d'EM6 est d'environ 60% pour un rapport massique de 10:1.

Effet de PM25 sur la prévention de l’agrégation protéique
- Effet de PM25 sur l’agrégation engendrée par la congélation
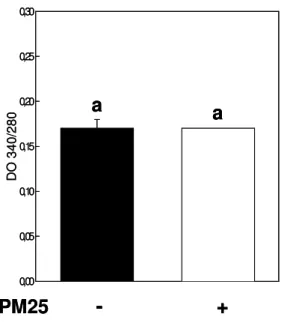
L’agrégation des protéines solubles des racines de M. truncatula a été surveillée après 2 ou 8 cycles de gel/dégel en présence ou en l’absence d’un rapport massique PM25 de 1 : 1 ou 2 : 1 PM25 : protéine soluble. Lorsque l’échantillon est congelé en présence de PM25 à des ratios de masse PM25 : protéines solubles de 1 : 1 et 2 : 1, les protéines sont préservées de l’agrégation quel que soit le nombre de cycles de congélation. Dans A, l'agrégation des protéines est surveillée en mesurant la DO à 340/280 avant ou après l'ajout de quantités croissantes de PM25 après congélation à un rapport massique PM25 : protéine soluble.
Effet de PM25 sur la dissolution des agrégats
- Effet de PM25 sur la dissolution des agrégats après congélation
- Effet de PM25 sur la dissolution d’agrégats après des cycles de congélation
- Effet de PM25 sur l’agrégation engendrée par le séchage
- Effet de PM25 sur l’agrégation engendrée par une dialyse à différents pH
- Effet de PM25 sur la protection de la citrate synthase après le chauffage
- Effet de PM25 sur la protection de la lactate déshydrogénase après la congélation
Accumulation de protéines solubles par les radicules de M. truncatula suivie à différents pH dans un tampon citrate en présence ou en absence d'un rapport massique PM25:protéine soluble de 2:1. Nous avons donc dialysé des échantillons de protéines solubles provenant de racines de M. truncatula à différents pH dans un tampon citrate et observé si l'agrégation générée à un pH acide pouvait être inversée par l'ajout de PM25. En B, mesure de l'agrégation nanométrique de l'échantillon, en absence de PM25 (symbole fermé), ou en présence de protéine (symbole ouvert).

Mesure et visualisation des agrégats
La dormance sera progressivement levée au cours de la post-affinage. Pour les graines déficientes en PM25, les courbes de germination montrent qu'elles répondent au stress osmotique de la même manière que les graines sauvages. Au cours de la maturation, en ce qui concerne les profils d'accumulation de transcription dans les graines mutantes à 28 JAP, seul le gène D-34c est surexprimé (Figure 3.18).

Analyses physiologiques de mutants d’insertion tnt1 de
Vérification des mutations et sélection de lignées homozygotes
Nous avons d’abord sélectionné les graines pour lesquelles les PM25 n’étaient plus présentes. Pour vérifier que l'absence de PM25 était bien associée à l'insertion de Tnt1 dans le gène PM25, nous avons réalisé des PCR couvrant la séquence génomique et le transposon. Entre-temps, nous avons décidé de commencer les caractérisations physiologiques et biochimiques des mutants présentant encore des insertions redondantes.
Phénotypage physiologique des mutants pm25
- Effet de PM25 sur la tolérance à la dessiccation
- Effet de PM25 sur la dormance
- Impact de PM25 au cours du vieillissement accéléré
- Implication de PM25 dans la tolérance aux stress osmotique et salins
- Impact de l’absence de PM25 sur la masse des graines
Par conséquent, nous avons testé si les graines déficientes en PM25 présentaient une susceptibilité accrue à la sénescence. Cependant, les graines déficientes en PM25 présentent la même diminution de leur taux de germination final et ne semblent donc pas plus sensibles. Nous avons pu constater dans la première partie de cette thèse que ce traitement ne modifie pas le taux de germination final, qui reste de 100 % pour les graines sauvages.

Phénotypage biochimique
- Mesure des teneurs en eau
- Teneur en protéines de réserves
- Teneur en sucres solubles
La figure 3.9A montre que les graines matures des mutants pm25 semblent plus petites que les graines de type sauvage. Nous avons donc comparé la teneur en légumineuses et en vicilines, les principales protéines de stockage des graines de légumineuses (Müntz et al., 1985). Concernant l'évolution de la teneur en sucres solubles des graines sèches (Figure 3.15), dans les graines sauvages on constate que la majorité du sucre est devenue du stachyose (environ 60 µg/mg MS), dont le taux a été multiplié par 3 par rapport à graines 28 DAP.

Etude de l’expression des homologues de PM25 au cours de la maturation et de
- Expression des homologues de PM25 au cours de la maturation
- Expression des homologues de PM25 au cours de la germination
- Expression des homologues de PM25 au cours de stress osmotique et salins
Dans ce cas, l’expression de ces gènes semble diminuer au cours de la maturation et du séchage des graines. Par ailleurs, nous avons mis en évidence 2 profils d'accumulation de transcrits homologues PM25 lors de la fin de maturation, soit entre 28 DAP et les graines matures. Fait intéressant, le gène D-34c présente le même profil d’expression que le PM25 lors de la maturation dans les graines de type sauvage, mais dans les graines mutantes, il présente l’autre type de profil.