0 José Rodolfo Lopes de Paiva Cavalcanti
OS NÚCLEOS DOPAMINÉRGICOS DO MESENCÉFALO DO MOCÓ
(Kerodon rupestris): CARACTERIZAÇÃO CITOARQUITETÔNICA E
POR IMUNOISTOQUÍMICA PARA TIROSINA-HIDROXILASE
Dissertação apresentada à Universidade Federal do Rio Grande do Norte, como pré-requisito para obtenção do título de Mestre em Psicobiologia.
NATAL-RN
1 José Rodolfo Lopes de Paiva Cavalcanti
OS NÚCLEOS DOPAMINÉRGICOS DO MESENCÉFALO DO MOCÓ
(Kerodon rupestris): CARACTERIZAÇÃO CITOARQUITETÔNICA E
POR IMUNOISTOQUÍMICA PARA TIROSINA-HIDROXILASE
Dissertação apresentada à Universidade Federal do Rio Grande do Norte, como pré-requisito para obtenção do título de Mestre em Psicobiologia.
Orientadora: Profª Drª Miriam Stela Maris de Oliveira Costa
NATAL-RN
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Cavalcanti, José Rodolfo Lopes de Paiva
Os núcleos dopaminérgicos do mesencéfalo do mocó (kerodon rupestris): caracterização citoarquitetônica e por imunoistoquímica para
tirosina-hidroxilase / José Rodolfo Lopes de Paiva Cavalcanti. – Natal, RN, 2011.
64 f. : Il.
Orientadora: Profa. Dra. Miriam Stela Maris de Oliveira Costa.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Psicobiologia.
1. Roedores – Dissertação 2. Núcleos Dopaminérgicos do Mesencéfalo – Dissertação. 3. Tirosina-hidroxilases – Dissertação. I. Costa, Miriam Stela Maris de Oliveira. II. Universidade Federal do Rio Grande do Norte. IV. Título.
2 TÍTULO: OS NÚCLEOS DOPAMINÉRGICOS DO MESENCÉFALO DO MOCÓ (Kerodon rupestris): CARACTERIZAÇÃO CITOARQUITETÔNICA E POR
IMUNOISTOQUÍMICA PARA TIROSINA-HIDROXILASE.
AUTOR: José Rodolfo Lopes de Paiva Cavalcanti
DATA DA DEFESA: ____/____/______
BANCA EXAMINADORA:
Profª Drª Miriam Stela Maris de Oliveira Costa – Orientadora Universidade Federal do Rio Grande do Norte
Profª Drª Belmira Lara da Silveira Andrade da Costa Universidade Federal de Pernambuco
3 AGRADECIMENTOS
A satisfação de vencer mais essa batalha e de chegar até aqui é inenarrável. Neste processo de maturidade intelectual/pessoal, convivi com pessoas que de alguma maneira marcaram esta caminhada. Sendo assim, não poderia deixar de expressar os meus sinceros agradecimentos:
A Deus, sobretudo por garantir as circunstâncias favoráveis ao longo dessa caminhada, mesmo tendo em troca as minhas frequentes negligências espirituais.
À minha esposa e amiga Dayane Pessoa. Nem que eu tivesse todo o restante das páginas desta dissertação, eu seria capaz discorrer sobre o que representas para mim. Quem diria que um namoro ingênuo, mergulhado no mais impressionante devaneio da inocência e sustentado pelos imprescindíveis veículos de comunicação à distância, vingaria? Somos a prova de que o amor vence barreiras e transcende o convencional. Por isso, costumo dizer que na sua ausência eu sou apenas uma metade. Amo-te.
À minha família pelo amor e respeito fornecidos, em especial aos meus pais Gonçalo Cavalcanti e Fátima Cavalcanti pelo exemplo de integridade e lisura, além de assegurarem uma ótima criação aos seus filhos, priorizando sempre a educação, o respeito para com o próximo e a valorização do “ser” em detrimento ao “ter”.
Ao meu irmão, Diogo Manuel, pela constante união e partilha de conhecimentos. Às minhas tias, Socorro Medeiros e Luzia Cecília, assim como à minha prima
Juliêta Fernandes, pela garantia aqui em Natal-RN da extensão do meu lar. Certamente, na ausência de vocês essa caminhada teria sido bem mais adversa.
À professora/orientadora Miriam Stela, por todo o ensinamento, pela paciência, pela dedicação e, acima de tudo, pelo voto de confiança depositado em mim quando decidiu aceitar-me como orientando, mesmo se conhecer meus princípios, meus propósitos, minha história.
4
À turma do LabNeuro: André, pelo companheirismo e hospitalidade que foram cruciais ao bom andamento das coisas aqui e, acima de tudo, pelo exemplo de determinação frente às vicissitudes da vida. Joacil e Leandro, pelos momentos de descontração, sempre sem perder de vista o cumprimento das responsabilidades, assim como pela constante disposição em colaborar. Gilberto, um exemplo de serenidade e dedicação aos trabalhos.
Janaína, Rovena e Twyla pelas dúvidas esclarecidas, pelas caronas ofertadas e pela elevação significativa nas taxas de colesterol e triglicerídeos em função das dietas nada saudáveis.
Kátia e Rayane, embora nossos contatos tenham sido poucos, cada uma demonstrou ao seu modo o comprometimento indispensável ao bom profissional. Alane, que também é colega de formação (Enfermagem), permanecerá com você a missão de mostrar aos demais enfermeiros que a psicobiologia também pode ser um espaço nosso. Aos alunos e iniciação científica
Nayra, Kayo, Paulo e Melquisedec por todas as ajudas nos experimentos e pela manutenção de um ambiente descontraído no laboratório.
Aos professores Expedito, Jeferson, Judney e Ruthnaldo pelas dúvidas esclarecidas, pelas dicas e pela disponibilidade.
Ao Departamento de Morfologia – DMOR/UFRN pela garantia da infraestrutura necessária a plena execução deste trabalho.
À Regina, pelo preparo das soluções, pela garantia da ordem do laboratório no tocante à execução dos experimentos e pela relação amigável.
A todos os meus colegas do mestrado pela breve, mas significativa convivência. Aos professores da Universidade do Estado do Rio Grande do Norte – UERN e da Faculdade de Enfermagem Nova Esperança de Mossoró – FACENE/RN pelo incentivo a concluir o mestrado e compreensão quando me fiz ausente.
5 LISTA DE FIGURAS
Figura 1: Esquema da síntese da noradrenalina;
Figura 2: Síntese da dopamina e seu armazenamento nas vesículas sinápticas;
Figura 3: Os núcleos dopaminérgicos no encéfalo do rato;
Figura 4: Corte coronal de mesencéfalo do rato, evidenciando os núcleos dopaminérgicos;
Figura 5: Famílias de receptores de dopamina;
Figura 6: O mocó em ambiente natural;
Figura 7: O mocó posicionado em aparelho estereotáxico e com alinhamento dorsoventral do bregma e lambda;
Figura 8: O mocó posicionado em aparelho estereotáxico, após remoção da calota craniana;
Figura 9: Encéfalo do mocó em vistas dorsal e ventral;
Figura 10: Reconstrução esquemática das secções coronais do encéfalo do mocó;
Figura 11: Corte coronal do encéfalo do mocó (2,34mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
Figura 12: Corte coronal do encéfalo do mocó (2,70mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
Figura 13: Corte coronal do encéfalo do mocó (3,24mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
Figura 14: Corte coronal do encéfalo do mocó (3,42mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
Figura 15: Corte coronal do encéfalo do mocó (3,96mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
6
Figura 17: Corte coronal do encéfalo do mocó (4,68mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
Figura 18: Corte coronal do encéfalo do mocó (5,04mm p.b.) – N Coloração pela técnica de issl e imunorreatividade contra TH;
Figura 19: Corte coronal do encéfalo do mocó (5,22mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
Figura 20: Corte coronal do encéfalo do mocó (5,76mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
Figura 21: Corte coronal do encéfalo do mocó (6,12mm p.b.) – Coloração pela técnica de Nissl e imunorreatividade contra TH;
7 LISTA DE ABREVIATURAS
3-hidroxitiramina/dopamina – DA
Aqueduto cerebral - Aq
Área tegmental ventral – VTA/A10
Área tegmental ventral central – VTAc
Área tegmental ventral dorsal - VTAd
Área tegmental ventral dorsal caudal – VTAdc
Comissura do colículo superior - CSC
Comissura posterior - pc
Fascículo retroflexo – fr
Imunoistoquímica – IH
Lemnisco medial – ml
Núcleo das habênulas - Hb
Núcleo interpeduncular – IP
Núcleo linear caudal da rafe - Cli
Núcleo mamilar – Mn
Núcleo do n. oculomotor – 3N
Núcleo pontino - PN
Núcleo pré-comissural – Prc
Núcleo rubro - RN
Núcleo subtalâmico - STh
8
Pedúnculo cerebral – cp
Projeções nigro-estriatais –ns
Susbstância cinzenta periaquedutal - PAG
Substância negra pars compacta – SNc/A9
Substância negra compacta dorsal – SNcd
Substância negra lateral – SNl
Substância negra medial – SNm
Substância negra reticulada - SNr
Susbtância negra ventral – SNv
Substância negra (cauda) – cSN
Terceito ventrículo – 3V
Tirosina-hidroxilase – TH
Trato rubroespinal - rs
Zona incerta - ZI
9 SUMÁRIO
Conteúdo Página
RESUMO... 10
ABSTRACT... 11
1. INTRODUÇÃO... 12
2. JUSTIFICATIVA... 23
3. OBJETIVOS... 24
4. METODOLOGIA... 25
4.1Sujeitos... 25
4.2 Anestesia... 26
4.3 Perfusão... 26
4.4 Remoção dos encéfalos... 26
4.5 Microtomia... 28
4.6 Método de Nissl... 28
4.7 Imunoistoquímica... 29
4.8 Obtenção das Imagens... 30
5. RESULTADOS... 31
6. DISCUSSÃO... 50
7. CONCLUSÕES... 55
8. PERSPECTIVAS... 56 REFERÊNCIAS
10 RESUMO
A 3-hidroxitiramina/dopamina (DA) é uma monoamina do grupo das catecolaminas e consiste na substância precursora da síntese de noradrenalina e adrenalina, tendo a enzima tirosina-hidroxilase (TH) como reguladora deste processo. Os núcleos do mesencéfalo que expressam DA são a zona retrorubral (RRF, grupo A8), a substância negra pars compacta (SNc, grupo
A9) e a área tegmental ventral (VTA, grupo A10). Tais núcleos estão envolvidos em três complexas circuitarias, chamadas mesostriatal, mesolímbica e mesocortical, as quais estão relacionadas diretamente com diversas manifestações comportamentais como controle da motricidade, sinalização de recompensa na aprendizagem comportamental, motivação e nas manifestações patológicas da Doença de Parkinson e esquizofrenia. O objetivo deste estudo foi descrever a morfologia dos núcleos dopaminérgicos do mesencéfalo (A8, A9 e A10) do mocó (Kerodon rupestris), um roedor pertencente à família Caviidae típico da região
Nordeste do Brasil, que está sendo adotado como modelo para estudos neuroanatômicos no
Laboratório de Neuroanatomia da Universidade Federal do Rio Grande do Norte. Secções coronais do encéfalo do mocó foram submetidas à coloração pelo método de Nissl e imunoistoquímica contra tirosina-hidroxilase. A organização nuclear do sistema dopaminérgico do mesencéfalo do mocó é muito semelhante ao que foi encontrado em outros animais da ordem Rodentia, exceto na presença da cauda da substância negra, que foi encontrada apenas na espécie em questão. Concluímos que os núcleos dopaminérgicos do mesencéfalo são filogeneticamente estáveis entre as espécies, porém percebemos a necessidade de se ampliar os estudos acerca da particularidade encontrada no mocó, seja investigando a sua ocorrência em outras espécies de roedores, seja investigando a sua relevância funcional.
11 ABSTRACT
The 3-hydroxytyramine/dopamine (DA) is a monoamine of catecholamineric group and consists in the progenitor substantia of synthesis of noradrenaline and adrenaline, having the enzyme tyrosine hydroxylase as a regulator of this process. Nuclei of midbrain expressing DA are the retrorubral field (RRF, A8 group), the substantia nigra pars compacta (SNc, A9 group) and the ventral tegmental area (VTA, A10 group). These nuclei are involved in three complex circuitry called mesostriatal, mesocortical and mesolimbic, which are related directly with various behavioral manifestations such as motor control, reward signaling in behavioural learning, motivation and pathological manifestations of Parkinson’s disease and schizophrenia. The aim of this study was describe the morphology of midbrain dopaminergic neurons (A8, A9 and A10) of the rock cavy (Kerodon rupestris), a rodent belonging to the
family Caviidae typical of the Brazilian Northeast, which is being adopted as a model for neuroanatomical studies in laboratory of neuroanatomy of the Federal University of Rio Grande do Norte. Coronal sections of brains of the rock cavies were submitted to staining by Nissl’s method and immunohistochemistry against tyrosine hydroxylase. The nuclear organization of the midbrain dopaminergic nuclei of the rock cavy is very similar to that found in other animals of the order Rodentia, except by the presence of the tail of substantia nigra, which was found only in the studied species. We concluded that the midbrain dopaminergic nuclei are phylogenetically stable among species, but we think to be it necessary to expand the studies about the particularity found the rock cavy, investigating its occurrence in other species of rodents or investigating its functional relevance.
Keywords: Midbrain; Dopamine; Tyrosine Hydroxylase; Midbrain Dopaminergic Nuclei; Rock Cavy; Rodents.
12 1. INTRODUÇÃO
1.1 CONSIDERAÇÕES GERAIS ACERCA DA DOPAMINA ENQUANTO NEUROTRANSMISSOR
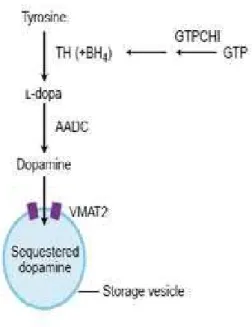
A 3-hidroxitiramina/dopamina (DA) é uma substância resultante da ação da enzima DOPA-descarboxilase (ou aminoácido aromático descarboxilase, AADC) sobre a di-hidroxi-fenilalanina (DOPA), a qual deriva da tirosina por ação da tirosina-hidroxilase (TH) (Marín et al., 2005; Chen et al., 2008). O desempenho eficaz da TH só ocorre na presença de um co-fator chamado 6-tetrahidrobiopterina (BH4), cuja síntese é modulada pela enzima
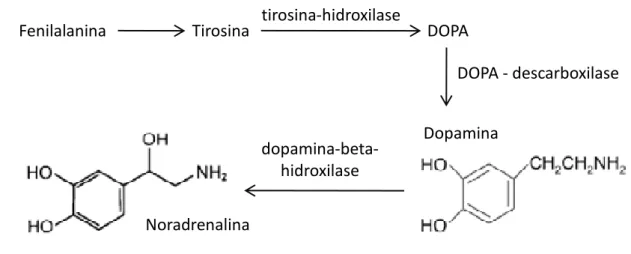
GTP-ciclohidrolase I (GTPCHI) (Nagatsu e Ichinose, 1999). Por sua vez, a dopamina é precursora da noradrenalina, sob ação da enzima dopamina-beta-hidroxilase (Nagatsu et al.,1964) (Fig. 1).
Figura 1. Esquema de síntese da noradrenalina.
Somente em 1958, depois de uma série de estudos, Arvid Carlsson e seus colaboradores constataram que a DA, além de ser precursora da noradrenalina e da adrenalina, possuía a capacidade de atuar como neurotransmissor no sistema nervoso central (Björklund e Dunnett, 2007a). Como tal, a DA é uma monoamina que se encontra no grupo das catecolaminas, juntamente com a noradrenalina e adrenalina, e é um dos principais neurotransmissores na modulação da função cerebral, tendo portanto desempenhado um papel crucial na adaptação do comportamento animal ao longo da evolução (Jones e Pilowski, 2002; Yamamoto e Vernier, 2011).
Fe ilala i a Tirosi a tirosi a-hidroxilase DOPA
DOPA - des ar oxilase
Dopa i a
dopa i a- eta
-hidroxilase
13
Depois de sintetizada, a DA é armazenada nas vesículas sinápticas pela ação da monoamina vesicular transportadora 2 (VMAT2) (Lowlor e During, 2004) (Fig. 2). Finalizada
a sua atuação nos receptores pós-sinápticos, cerca de 30% da DA é metabolizada na própria fenda pela ação das enzimas catecol-O-metiltransferase (COMT) (Goole e Amighi, 2009), enquanto a maioria, cerca de 70%, é recaptada na fenda por meio da ação do transportador dopaminérgico (DAT), uma glicoproteína cuja ação depende diretamente da atividade elétrica relacionada ao Na+ e Cl-, podendo então ser metabolizada por intermédio da mono-amino-oxidase (MAO) ou mesmo rearmazenada em vesículas pela VMAT2 para utilização posterior (Jaber et al, 1997; Ben-Jonathan e Hnasko, 2001; Marshall e Grosset, 2003; Shih et al, 2006).
Figura 2. Síntese da dopamina e seu armazenamento nas vesículas sinápticas (Modificado de Lowlor e During, 2004)
É importante considerar que, embora inespecífica, nos últimos anos, a expressão de TH em amostras encefálicas tem sido amplamente utilizada como marcador molecular de DA neuronal (Prakash e Wurst, 2006).
14
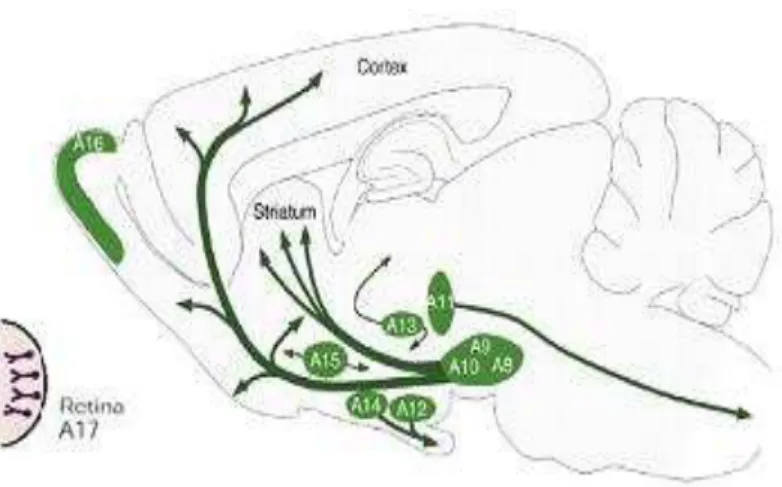
Núcleos específicos no encéfalo produzem DA e a utilizam como neurotransmissor. Estudos anteriores identificaram dez núcleos encefálicos que foram codificados de A8-A17, sendo: A8 – Zona retrorrubral; A9 – Substância negra pars compacta; A10 – Área tegmental
ventral; A11 ao A14 – Grupos hipotalâmicos; A15 – Hipotálamo ventral e lateral/Área retroquiasmática; A16 – Células periglomerulares do bulbo olfatório; A17 – Células interplexiformes da retina (Dahlström e Fuxe, 1964; Kandel et al., 2000; Márin et al., 2005) (Fig. 3).
Figura 3. Esquema evidenciando os núcleos dopaminérgicos no encéfalo do rato (Modificado de Kandel et al., 2000; Björklund e Dunnett, 2007b).
Os núcleos mesencefálicos A8-A10, serão mais bem estudados no decorrer deste trabalho. Porém, é importante comentar mesmo que resumidamente acerca das demais regiões dopaminérgicas do encéfalo, uma vez que estas também são importantes para o estabelecimento de alguns padrões comportamentais.
15
O núcleo arqueado (A12) se projeta tanto para a zona externa da eminência mediana (próximo aos capilares primários do plexo portal hipofisário), formando o trato infundibular, quanto para a neurohipófise e lobo intermediário formando o trato túbero-hipofisário. Além disso, o núcleo peri/paraventricular (A14) também se projeta para o lobo intermediário da hipófise, originando o trato periventricular-hipofisário. Ambos os núcleos, com suas respectivas projeções, estão diretamente voltados para o controle da secreção de prolactina (Freeman et al., 2000).
O grupo A15 ocupa as áreas ventral e lateral do hipotálamo (Ben-Jonathan e Hnasko, 2001), embora alguns autores refiram que tal grupo ocupa a área retroquiasmática (Tillet et al., 2000; Goodman et al., 2010) ou até mesmo o tubérculo olfatório (Kandel et al., 2000). Apesar das divergências quanto à disposição anatômica, estudos têm demonstrado que o A15 possui uma complexa circuitaria, prova disso é a série de aferências que este núcleo possui com destaque para os núcleos septal lateral, da estria terminal, paraventricular do tálamo, entre outras (Tillet et al., 2000). No que se refere à sua fisiologia, acredita-se que o mesmo esteja envolvido em diversas atividades como no controle do metabolismo da pineal (Cipolla-Neto et al, 1999) e no comportamento reprodutivo (Goodman, 1996; Goodman et al., 2010).
Por fim, o grupo das células periglomerulares do bulbo olfatório (A16), assim como o grupo das células interplexiformes (amácrinas) da retina (A17), consistem em grupos de interneurônios dopaminérgicos (Prakash e Wurst, 2006). Quanto à fisiologia desses núcleos, o A16 está envolvido no processamento primário e refinamento sensorial no epitélio olfativo (Baltanás et al, 2011). Já o A17 participa da regulação do RNA mensageiro que controla a síntese de melanopsina (fotopigmento produzido pelas células ganglionares intrinsecamente fotossensíveis), assim como adaptação à luz, sensibilidade ao contraste e acuidade visual (Besharse et al., 1988; Djamgoz et al., 1997; Iuvone et al., 2005).
1.3 OS NÚCLEOS DOPAMINÉRGICOS DO MESENCÉFALO
16
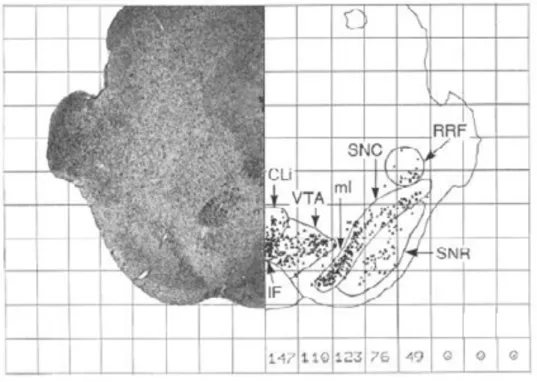
substância negra pars compacta (SNc) e área tegmental ventral (VTA) (A8, A9 e A10,
respectivamente) (Dahlström e Fuxe, 1964; German e Manaye, 1993; François et al., 1999; Smith e Kieval, 2000; Björklund e Dunnett, 2007b) (Fig. 4), os quais constituem objeto do presente estudo.
Figura 4. Corte coronal em nível de mesencéfalo caudal, com imunoistoquímica para TH, evidenciando os três núcleos dopaminérgicos mesencefálicos do rato (Modificado de German e Manaye, 1993).
17
especificamente em primatas que recebe projeções dos três núcleos dopaminérgicos (Bentivoglio e Morelli, 2005; Cho e Fudge, 2010).
A via mesostriatal está envolvida no controle dos movimentos e sua degeneração pode levar a doenças como a de Parkinson (Stochi, 2009). A via mesocortical, que inerva diversas regiões do córtex frontal, incluindo córtex pré-frontal e córtex cingulado anterior, parece estar envolvida em aspectos da memória e aprendizagem (Chinta e Andersen, 2005; Walton et al., 2005; Pritchard et al., 2009). Muitos estudos têm demonstrado que alterações na via mesocortical estão diretamente relacionadas às manifestações clínicas expressas na esquizofrenia (Sesack e Carr, 2002; Fallon et al., 2003).
Já a via mesolímbica projeta-se para o estriado ventral (núcleo accumbens), o tubérculo olfatório e outras partes do sistema límbico como amígdala, hipocampo, área septal e córtex pré-frontal medial. Esta via foi implicada no comportamento motivacional (Pierce e Kumaresan, 2006; Chen et al., 2009). Convém ressaltar que estudos hodológicos demonstram que há certa sobreposição entre as vias mesocortical e mesolímbica, o que permite alguns pesquisadores aglutiná-las em uma via única chamada de mesocorticolímbica (Wise, 2004).
No intuito de compreender melhor os aspectos morfofuncionais desses núcleos, estudos de caráter citoarquitetônico e neuroquímico vem sendo conduzidos ao longo dos anos e em diversas espécies, seja de roedores ou mesmo primatas (Liang et al., 1996; McRitchie et al., 1998; Nemoto et al., 1999).
1.4 OS RECEPTORES DOPAMINÉRGICOS E SUA RELAÇÃO COM ALGUMAS RESPOSTAS COMPORTAMENTAIS
Com relação aos receptores específicos onde a DA poderá realizar ligação, vale destacar que são cinco subtipos e os mesmos estão agrupados, por critérios bioquímicos, farmacológicos e fisiológicos, em dois grupos: D1 e D2 (Kebabian e Calne, 1979). O grupo de receptores D1 é composto pelos subtipos D1 e D5, já o grupo D2 é constituído pelos subtipos D2, D3 e D4 (De La Mora et al., 2009). Essa classificação se baseia no mecanismo de transdução. O grupo D1 estimula a adenilato-ciclase, aumentando os níveis intracelulares de AMP cíclico, enquanto o grupo D2 inibe essa enzima levando a redução intracelular do AMP cíclico (Fig. 5) (Seeman e Vantol, 1994; Jaber et al., 1996; Missale et al., 1998; Silva,
18
Figura 5. Famílias de receptores de dopamina. Modificado de Golan, 2009.
Os receptores dopaminérgicos dos tipos D1, D2 e D5 estão localizados principalmente no striatum, sistema límbico e bulbo olfatório, bem como nos córtices pré-frontal, pré-motor, cingulado e entorrinal, sendo o D5 o de menor expressão nas áreas já citadas. Já os subtipos D3 e D4 restringem-se à área límbica (Cave e Baker, 2009). Entretanto, outro estudo, que aponta a participação direta desses receptores D4 na circuitaria dos núcleos da base, concluiu que a dopamina tem duas ações sobre a liberação de GABA na substância negra pars reticulada (SNr): estimulando a liberação de GABA quando ativados os receptores
D1 (terminações da via estriatonigral) e inibindo a liberação de GABA quando ativados os receptores D4 (terminações palidonigrais) (Acosta-García et al., 2009).
19
D4. Os receptores D5 encontram-se em baixos níveis, principalmente no hipocampo e tubérculo olfatório (Sokoloff e Schwartz, 1995; Hardman et al., 2007).
Retomando a discussão, evoca-se uma das maiores relevâncias atinentes aos receptores dopaminérgicos que se trata do envolvimento dos subtipos D1 e D2 na circuitaria neuronal dos núcleos da base, cuja função reside na modulação da motricidade (Deongaokar e Subramanian, 2005).
Neste caso, os efeitos da DA nos núcleos da base ocorrem mediante a interação com os receptores D1 e D2. Os receptores D1 modulam principalmente os neurônios da via direta, enquanto os D2 estão localizados nos neurônios estriato-palidais da via indireta. Deste modo, a ativação de D1 ativa a via excitatória e a ativação de D2 inibe a via inibitória, o que favorece a realização do movimento (Gerfen, 2003; Siegel, 2006).
Na doença de Parkinson, por exemplo, a degeneração dos neurônios dopaminérgicos da SNc acarreta alteração da capacidade de elaborar movimentos automáticos, semi-automáticos, tônus postural e habilidade de movimentos, evidenciando sinais clínicos como tremor, bradicinesia, rigidez e instabilidade postural (Doyon, 2008).
1.5 O MODELO EXPERIMENTAL
O mocó (Kerodon rupestris) é um roedor nativo da região semi-árida, podendo ser
encontrado em vários estados do Nordeste e norte de Minas Gerais, habitando preferencialmente a caatinga do semi-árido do Nordeste Brasileiro (Cabrera, 1961; Lacher Jr., 1981).
Taxonomicamente é classificado como representante do filo Chordata, subfilo Vertebrata, superclasse Gnathostomata, classe Mammalia, subclasse Theria (mamíferos avançados), infraclasse Eutheria (mamíferos placentários), superordem Glires, ordem Rodentia, (Storer e Usinger, 1971), subordem Hystricognathi, infraordem Caviomorpha, superfamília Cavioidea (Carleton, 1984), família Caviidae, subfamília Caviinae, gênero Kerodon (mocós) (Moojen, 1952).
20
animais costumam ser herbívoros. Além disso, possuem três dedos nos membros pélvicos e cauda completamente atrofiada (Moojen, 1952).
A subfamilia Caviinae é composta por quatro gêneros: Kerodon, Galea, Cavia e Microcavia. A este grupo pertencem pequenos animais já reconhecidamente domésticos,
como porquinho da índia (Cavia porcellus). Geralmente vivem em pequenas colônias feitas
em buracos na terra ou usam cavidades nas bordas das rochas. Possuem hábitos gregários e diurnos (Crandall, 1964).
Estudos morfológicos (Silva Neto, 2000) e de biologia molecular (Rowe e Honeycutt, 2002) firmaram o gênero Kerodon irmanado com a família Hydrochaeridae, à qual
também pertence a capivara (Hydrochaeris) e estreitamente alinhado com a subfamília
Dolichotinae.
O mocó é um animal facilmente adaptado às condições ecológicas locais como o calor, a escassez de água e de alimentos, principalmente nos períodos das grandes secas nas regiões do semi-árido nordestino. Habitam locais rochosos com inúmeras fendas onde se abrigam dos predadores e passam boa parte de seu tempo. Além disso, são excelentes saltadores e conseguem escalar rochas e galhos de árvores, de onde extraem a sua alimentação, composta principalmente de cascas de árvores, ou na falta destas, gramíneas em geral, sendo as árvores mais procuradas o mufumbo (Cobretum leprosum), faveleira
(Cnidoscolus phyllacanthus) e a parreira brava (Cissampelos pareira), ao contrário de outros
caviinaes que possuem hábitos terrestres e comem relva (Carvalho, 1969; Lacher, 1981; Mendes, 1985; 1987). Já em cativeiro, aceitam bem frutas (maçã, banana, melão, melancia, manga) e raízes.
Sua coloração é cinza clara com pelos pretos e amarelos ou esbranquiçados na região dorsal, castanho-ferruginoso na região caudal e um pouco acastanhada nas patas e branco na região cervical. As patas são dotadas de coxins calosos pouco excedidos pelas unhas rígidas que lhes dão habilidades de escalar e saltar (Moojen, 1952). Tem olfato e audição muito aguçados, podendo detectar seu predador a uma longa distância (Carvalho, 1969). Atingem a fase adulta aos 200 dias, podendo atingir até 50 cm de comprimento e 1 quilo de peso corporal (Moojen, 1952; Carvalho, 1969; Roberts et al., 1984).
Espécies do gênero Kerodon diferem quanto ao padrão reprodutivo observado em
outros gêneros próximos relacionados. Na história de vida dos cavinnaes, Kerodon tem a
21
mais baixo peso de filhotes e o mais longo tempo para a maturidade sexual (Roberts et al., 1984). Além disso, apresenta o peso médio da matriz pós-parto em torno de 724,73 ± 13,08 g e 6,89% de abortos (Pinheiro et al., 1985). A reprodução ocorre durante todo o ano, não apresentando sazonalidade, com exceção do período que vai de abril a junho. As fêmeas apresentam um cio pós-parto, podendo acasalar poucas horas após o parto. Apesar das poucas crias por parto, o curto período gestacional garante uma elevada produção de crias durante o ano (Lacher, 1981).
Quanto ao padrão de atividade locomotora, tem sido relatado que nos dias mais escuros o mocó sai para se alimentar pela manhã e à tarde, enquanto que nos dias mais claros sua atividade se concentra no período noturno, podendo também durar o dia inteiro na ocorrência de chuvas (Carvalho, 1969). Outras observações dão conta de que o mocó sai para forragear ao longo do dia e da noite (Lacher, 1981). Contudo, estudos conduzidos por Sousa e Menezes (2006), mostraram que, embora o mocó apresente atividade ao longo de 24 horas, esta se concentra nos períodos de transição de fases claro-escuro, sugerindo um comportamento predominantemente crepuscular.
Figura 6. O mocó (Kerodon rupestris) em ambiente natural. Fonte: LabNeuro.
22
Rodentia. Por essas características, o mocó está sendo adotado como modelo para estudos neuroanatômicos no Laboratório de Neuroanatomia da Universidade Federal do Rio Grande do Norte – UFRN, já tendo gerado alguns produtos.
23 2. JUSTIFICATIVA
As pesquisas supracitadas evidenciam a necessidade de melhor se explorar vários outros componentes do sistema nervoso deste animal e a relevância do presente estudo justifica-se, também, pelo incontestável papel dos núcleos dopaminérgicos do mesencéfalo em diversas modalidades comportamentais.
24 3. OBJETIVOS
3.1 Geral
Caracterizar morfológica e imunoistoquimicamente os núcleos dopaminérgicos (grupamentos A8, A9 e A10) do mesencéfalo do mocó (Kerodon rupestris).
3.2 Específicos
Identificar, mediante imunoistoquímica para TH, os núcleos dopaminérgicos do mesencéfalo do mocó;
Descrever a configuração desses núcleos, baseado nas descrições para o rato;
25 4. METODOLOGIA
Trata-se de um trabalho vinculado ao Programa de Pós-Graduação em Psicobiologia, cujos procedimentos foram realizados, em sua totalidade, no laboratório de Neuroanatomia, vinculado ao Departamento de Morfologia – DMOR/UFRN.
4.1 Sujeitos
Quatro animais adultos jovens, sendo dois machos e duas fêmeas, foram utilizados no experimento. Em virtude da desativação temporária do criadouro científico desta espécie que é o Centro de Multiplicação de Animais Silvestres (CEMAS), localizado na Universidade Federal Rural do Semi-árido (UFERSA) em Mossoró-RN, assim como dos criadouros comerciais existentes ainda não disporem da geração F2, os animais foram obtidos por meio de captura no município de Serra Negra do Norte, RN, mediante a devida autorização do Instituto Brasileiro do Meio Ambiente e Recursos Naturais Renováveis – IBAMA (licença SISBIO nº 22403-1). O processo de captura deu-se por meio de armadilhas e/ou contenção química (ketamina + xilazina), para minimizar o estresse causado ao animal.
Depois de capturados, os animais foram acomodados no Centro de Biociências da UFRN em um ambiente construído de alvenaria e telas em arame cujas dimensões são de 3,0 x 2,0 x 2,6 m, submetidos à temperatura, luminosidade e umidade naturais e comida/água ad libitum. Somente no dia anterior ao experimento os animais foram transferidos para gaiolas,
medindo 0,90 x 0,60 x 0,75m. Os mesmos foram utilizados gradativamente, conforme as necessidades de execução dos experimentos da pesquisa.
Convém ressaltar que os animais utilizados nesse projeto foram os mesmos de outro projeto em andamento no laboratório, previamente aprovado pelo Comitê de Ética no Uso de Animais (CEUA), voltado para a caracterização anatômica e neuroquímica da retina do mocó e sua relação direta com o STC. Por tal motivo, este trabalho foi aprovado pelo CEUA como uma extensão do Protocolo 015/2009.
Todos os cuidados foram tomados no sentido de evitar dor e sofrimento aos animais durante os procedimentos experimentais, seguindo estritamente as normas estabelecidas pela National Research Council of the National Academy publicadas no livro “Guidelines for the Care and Use of Mammals in Neuroscience and Behavioral Research”. Visitando o site da
Sociedade Brasileira de Neurociência e Comportamento – SBNeC
26 4.2 Procedimentos
4.2.1 Anestesia
Foram administrados por via intramuscular, os medicamentos cloridrato de tramadol e xilazina, ambos na dose de 5 (cinco) mg/Kg, como medida pré-anestésica. O tramadol é um opióide necessário para potencializar o efeito da analgesia adequada ao procedimento e a xilazina é um relaxante muscular. Decorridos 10 minutos da conduta pré-anestésica, o animal é induzido e mantido em anestesia inalatória com isoflurano e oxigênio 100% administrado através de máscara, até que o animal atinja o plano anestésico, ou seja, 3º. plano do 3º. estágio de Guedel (Massone, 2008).
4.2.2 Perfusão
Atingido o plano anestésico, cada animal foi submetido à perfusão transcardíaca, que compreende os seguintes passos:
1. Posicionamento do animal em decúbito dorsal sobre tela de arame e sob ponto de água. 2. Toracotomia, com incisão de pele, músculos e arco costal, sendo estes removidos em bloco, para exposição do coração.
3. Cardiopunção no ventrículo esquerdo, utilizando uma agulha de dimensões 17mm x 1,5 mm, a qual é direcionada para o cone arterioso, seguindo-se uma incisão no átrio direito. A agulha foi conectada a uma bomba peristáltica (Cole-Parmer), passando-se 300 ml de solução salina a 0,9% em tampão fostato 0,1M, pH 7,4 com heparina (Parinex, Hipolabor, 2ml/1000 ml de solução salina) durante um tempo estimado de seis minutos. Em seguida, foram infundidos 700 ml de solução fixadora composta por paraformaldeido 4%, glutaraldeído 0,05% e ácido pícrico 0,2% em tampão fosfato 0,1 M, pH 7,4 (Zamboni e Di Martino, 1967), passando-se metade desta solução a um fluxo de 6,0 ml por minuto e a outra metade a 3,0 ml por minuto, durando todo procedimento em torno de três horas.
4.2.3 Remoção dos Encéfalos
27
lambda, os quais ficaram nivelados na mesma altura dorsoventral, ajustando-se a barra dos incisivos, padronizando assim o plano de corte coronal para todos os animais (Fig. 7). Após anotação das coordenadas do bregma e do lambda, o osso da calota craniana foi removido com o uso de broca e trocater, expondo-se o encéfalo. Ainda no aparelho estereotáxico, o encéfalo foi seccionado em três blocos através de duas secções coronais: uma no nível do bregma e a outra no nível do lambda (Fig. 8).
Figura 7. Mocó posicionado em aparelho estereotáxico e com alinhamento dorsoventral do bregma e lambda.
28
Os encéfalos foram retirados delicadamente para evitar danos, preservando os olhos e nervos ópticos (uma vez que estes animais foram também utilizados em outra pesquisa) e em seguida medidos (da extremidade anterior do bulbo olfatório ao limite bulbo-espinal) e fotografados. Logo após esta etapa, os três blocos foram armazenados, por um período entre 24 e 48 horas, em uma solução de contendo sacarose a 30% em tampão fosfato 0,1M, pH 7,4, a 4 ºC, para então serem submetidos à microtomia (cortes coronais).
4.2.4 Microtomia
Os encéfalos foram submetidos à microtomia cuja espessura dos cortes foi padronizada em 30 µm.
Os encéfalos foram congelados por gelo seco e seccionados em micrótomo de deslizamento, obtendo-se secções coronais. Estas foram coletadas em um meio líquido de tampão fostato 0,1M, pH 7,4, distribuídas seqüencialmente em seis compartimentos, de maneira cíclica e seqüenciada, de modo a manter a distância entre uma secção e a outra imediatamente seguinte de um mesmo compartimento de aproximadamente 180 µm.
Os cortes de um compartimento foram imediatamente montados em lâminas de vidro gelatinizadas e submetidas à coloração pelo método de Nissl para permitir uma melhor demarcação das estruturas. Os cortes dos demais compartimentos foram transferidos para solução anticongelante e conservados a -20 ºC para utilização posterior em procedimentos de imunoistoquímica.
4.2.5 Método de Nissl
29
e ácido acético a 1%, por 3 segundos. Os cortes foram deslipidificados em xilol em dois recipientes (2 e 4 minutos, respectivamente) e finalmente cobertos com lamínula utilizando como meio demontagem o DPX.
4.2.6 Imunoistoquímica
Devido a grande concentração de aldeídos contidos no fixador (Zamboni e De Martino, 1967) utilizado na perfusão do animal, precedendo a técnica de imunoistoquímica, os cortes foram submetidos a um pré-tratamento para recuperação da antigenicidade, sendo colocados em solução de boridreto de sódio a 1% em tampão fosfato 0,1M, pH 7,4, durante 15 minutos, a qual tem a propriedade de retirar o excesso de aldeídos dos tecidos. O pré-tratamento também incluiu uma etapa de incubação em peróxido de hidrogênio (H2O2) a 0,3%
em tampão fosfato 0,1M, pH 7,4 por cinco minutos, com a finalidade de abolir artefatos causados pela liberação de peroxidases endógenas. No início, entre as soluções e ao final desta fase, os cortes foram submetidos a seis lavagens de cinco minutos cada em tampão fosfato 0,1 M, pH 7,4.
O próximo passo consistiu na incubação dos cortes em anticorpo primário, isto é, uma solução formada pelo anticorpo anti-TH obtido em camundongo (Sigma) em diluição de 1:10.000, acrescido de soro normal de asno a 2% em Triton X-100 a 0,4% permanecendo em incubação por 12 a 72 horas em rotor com rotação lenta.
Ao fim deste período, os cortes passaram por seis lavagens em tampão fosfato 0,1 M pH 7,4, em agitador orbital e em seguida colocados em contato com o anticorpo secundário anti-camundongo obtido em asno (Jackson) diluído a 1:1000 no mesmo veículo anterior, por 120 minutos à temperatura ambiente, sob agitação lenta, em rotor.
Em seguida, os cortes passaram por seis lavagens em tampão fosfato 0,1 M em agitador orbital e depois colocados na solução do complexo avidina-biotina-HRP (Protocolo ABC, Kit elite da Vector), numa diluição de 1:100 em Triton X-100 a 0,4%, contendo NaCl , por 120 minutos à temperatura ambiente, sob agitação lenta, em rotor. Terminada esta fase, as secções foram novamente submetidas a seis lavagens em tampão fosfato 0,1 M em agitador orbital.
30
A H2O2 foi oferecida indiretamente, colocando-se na solução glicose oxidase e D-glicose,
provocando uma reação em que a primeira agindo sobre a segunda libera H2O2 (Itoh et al.,
1979). Esta reação dura em torno de 15 minutos e após esta, os cortes foram submetidos a mais seis lavagens em tampão fosfato 0,1 M em agitador orbital.
Os cortes foram então montados em lâminas gelatinizadas, que após secas foram imersas em solução de tetróxido de ósmio a 0,05% com o intuito de intensificar a reação. Após as etapas de desidratação, em baterias de álcool de graduação crescente até o álcool absoluto, e diafanização em xilol, as lamínulas foram montadas sobre os cortes com o uso de DPX.
Como controle, algumas secções foram submetidas ao protocolo específico de imunoistoquímica, com a omissão do anticorpo primário.
4.2.7 Obtenção das imagens
31 5. RESULTADOS
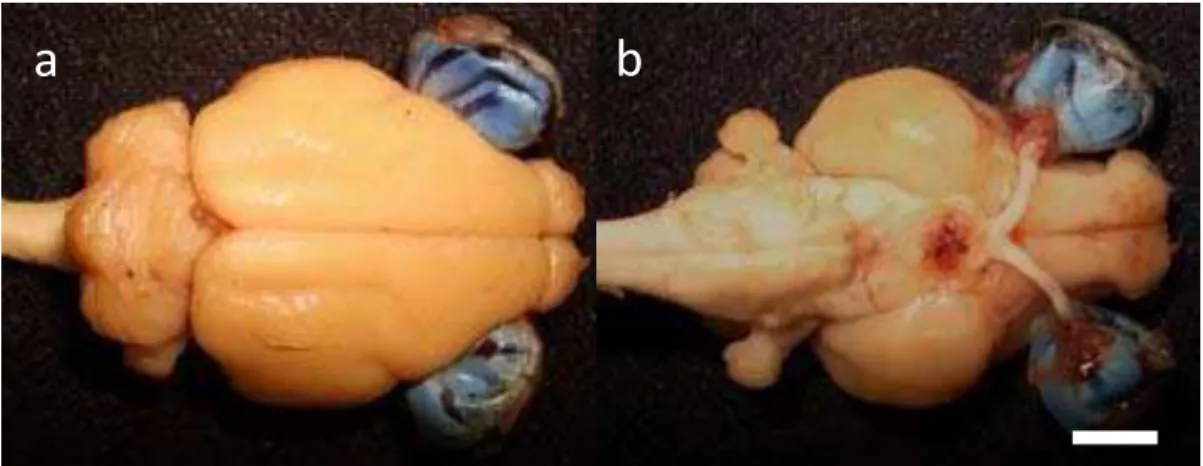
O comprimento rostro-caudal do encéfalo, da extremidade anterior do bulbo olfatório ao limite bulbo-espinal, foi em média 3,63 cm (Fig. 9).
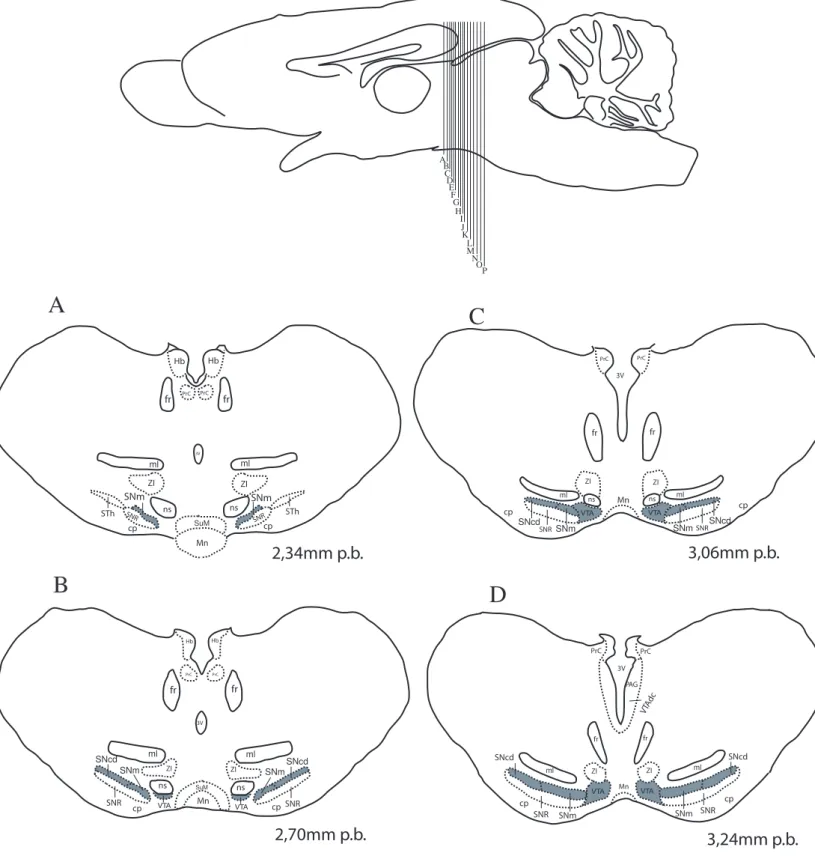
Com base na imunoistoquímica para TH, aliada à técnica de Nissl, foi possível estabelecer os limites anatômicos, assim como a citoarquitetura e possíveis subdivisões, dos três núcleos dopaminérgicos do mesencéfalo. Para facilitar a compreensão, foram feitos esquemas ilustrativos que demonstram as estruturas encefálicas sequenciadamente (Fig. 10).
Figura 9. Encéfalo do mocó em vistas dorsal (a) e ventral (b). Barra: 0,54 cm.
No sentido rostro-caudal, os primeiros neurônios dopaminérgicos a aparecerem fazem parte da SNc e estão no nível da transição die-mesencefálica, coincidindo com estruturas do hipotálamo posterior, a aproximadamente 2,34 mm pós-bregma (p.b.) e se estendem até o nível 6,48 mm p.b., coincidindo com estruturas dos níveis rostrais e médios do mesencéfalo, pertencendo à RRF e a uma das subdivisões da VTA (VTA dorsal caudal).
5.1 Substância Negra pars compacta (SNc/A9):
Com base na densidade de distribuição dos seus neurônios, ao longo da maior extensão da SNc é possível identificar subunidades neste núcleo. Assim, a SNc foi então dividida em substância negra compacta dorsal (SNcd ou A9d), substância negra lateral (SNl ou A9l), substância negra medial (SNm ou A9m), cauda da substância negra (cSN) e substância negra ventral (SNv ou A9v).
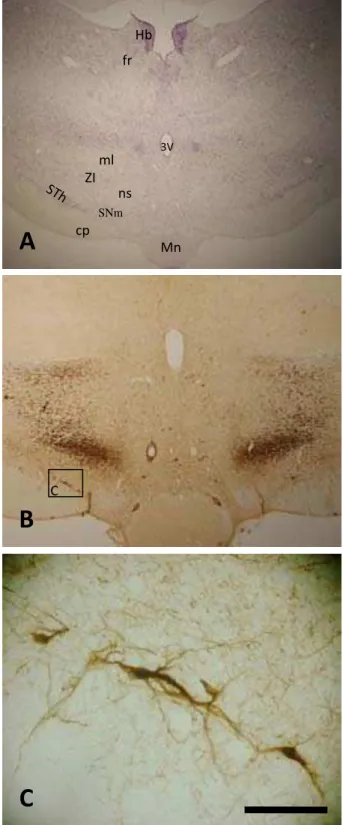
Como mencionado, os primeiros neurônios dopaminérgicos nigrais surgem na porção ventrolateral do tegmento mesencefálico no nível 2,34 mm p.b. e são pertencentes à SNm,
32
localizando-se lateralmente aos núcleos mamilares (Mn) e supramamilar (SuM), medialmente ao núcleo subtalâmico (STh), ventralmente ao lemnisco medial, zona incerta (ZI) e às projeções nigro-estriatais TH+ e dorsalmente ao pedúnculo cerebral e à substância negra reticulada (SNr) (Figs. 10A e 11A-C). Os neurônios atribuídos à constituição da SNm foram encontrados até o nível 5,22 mm p.b. (Fig. 10M). Foi visto que estes neurônios são bipolares e multipolares, apresentando formato ovóide e, com menor freqüência, triangular. Com relação à orientação dendrítica, os neurônios rostrais apresentavam uma organização dendrítica paralela às bordas do pedúnculo cerebral e SNr (Fig. 11C). Porém, nos níveis mais caudais, esse padrão foi sendo substituído por uma arborização aleatória (Figs. 12D e 13D).
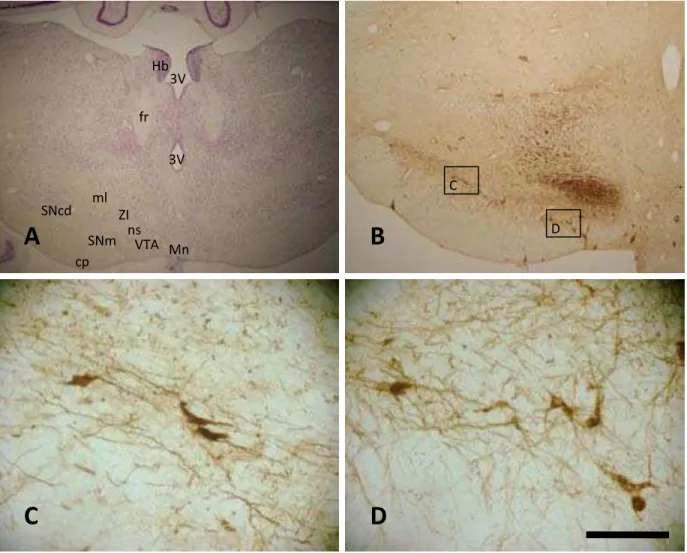
No nível de aproximadamente 2,70 mm p.b. (Fig. 10B), lateralmente à SNm, aparecem os primeiros neurônios TH+ referentes à SNcd. Basicamente, em toda a sua extensão a SNcd encontra-se ventralmente ao lemnisco medial e dorsalmente à SNr, sendo seu limite caudal identificado em cortes nos níveis de 6,12 mm p.b. (Fig. 10O). Assim como na SNm, na SNcd constatou-se a presença de neurônios TH+ bipolares e multipolares com corpo celular em formatos ovóide e triangular. No tocante à arborização dendrítica, foi possível constatar a predominância de uma orientação em sentido medial-lateral (paralelo ao lemnisco medial) e, em menor expressão, em sentido dorso-ventral (na área correspondente à SNr) (Figs. 12C e 13C).
Em 3,42 mm p.b. (Fig. 10E), lateralmente à SNcd, foi possível visualizar neurônios referentes à SNl. Este grupamento de baixa densidade neuronal foi identificado nas porções mais laterais do tegmento mesencefálico, estando dorsalmente à SNr. Seus limites caudais se encontram no nível 5,76 mm p.b., onde a SNl se encontra ventralmente à RRF (Fig. 10N). Os neurônios pertencentes a esta subunidade nigral são multipolares e, em menor expressão, bipolares. Além disso, apresentam formato ovóide e, frequentemente, piriforme. Com relação à organização dendrítica, não há um padrão específico (Figs. 14C e 15C).
33
No nível 4,32 mm p.b. (Fig. 10I), foram identificados neurônios TH+ bilateralmente em uma região ventral às porções intermediárias da SNcd e dorsal ao pedúnculo cerebral, inseridos na SNr. Estes grupamentos recebem o nome de SNv ou A9v e seus neurônios coexistem com as demais porções da SNc até o nível 6,12mm p.b. (Fig. 10O). Trata-se de um subgrupo de baixa densidade neuronal, formado por neurônios ovóides e multipolares com orientação dendrítica dorso-ventral (Figs. 17D e 18C).
5.2 Área Tegmental Ventral (VTA/A10):
Assim como a SNc, foi possível subdividir o complexo da VTA em sub-regiões: VTA propriamente dita, VTA central (VTAc ou A10c), VTA dorsal (VTAd ou A10d) e VTA dorsal caudal (VTAdc ou A10dc).
Os primeiros neurônios TH+ referentes à VTA começaram a aparecer no nível 2,70 mm p.b., na região mais medial do tegmento mesencefálico. Neste ponto, localiza-se lateralmente aos núcleos mamilares e supramamilar, medialmente à SNm e SNr e ventralmente aos lemnisco medial, ZI e às projeções nigro-estriatais (Fig. 10B). Analisando níveis mais caudais, foi possível identificar mais relações entre a VTA e outras estruturas mesencefálicas, como por exemplo o núcleo interpeduncular e o fascículo retroflexo, que se encontram em uma posição ventromedial em relação à VTA (Figs. 10H e 10M). De um modo geral, os neurônios da VTA são multipolares arredondados e, em menor quantidade, triangulares. Além disso, não apresentam um padrão de organização dendrítica (Figs. 14D e 16C). Nas amostras estudadas, os últimos neurônios da VTA são identificados no nível 6,12mm p.b. (Fig. 10O).
No nível 3,96 mm p.b. (Fig. 10G) foi possível identificar com clareza a formação neuronal TH+ que recebe o nome VTAc. Neste nível ela se encontra medialmente à VTA e dorsalmente ao fascículo retroflexo. Já, em níveis mais caudais, a VTAc se encontra dorsalmente ao núcleo interpeduncular (Fig. 10L). Trata-se de um núcleo pouco denso constituído de neurônios multipolares, com formato arredondado e sem um padrão específico de organização dendrítica (Figs. 14E e 19E). Seus limites caudais se dão no nível 5,76 mm p.b. (Fig. 10N) onde este núcleo se entrelaça com o linear caudal da rafe (Cli).
34
(descrita a seguir) e ventralmente à substância cinzenta periaquedutal (PAG) e, nos níveis mais caudais, ao núcleo do nervo oculomotor (3N). Trata-se de um grupo neuronal que esboça um padrão de organização dendrítica dorsoventral (Fig. 15C e 19D).
A VTAdc, contém neurônios TH+ em baixa densidade, presentes desde os níveis mais rostrais (3,24 mm p.b. – Fig. 10D), até os níveis em que não mais existem neurônios da VTA no tegmento mesencefálico (6,48 mm p.b. – Fig. 10P). Trata-se de um grupo existente na PAG, especificamente na metade ventral do aqueduto cerebral (Aq). Seus neurônios basicamente são ovóides, bipolares e, em menor freqüência, multipolares com orientação dendrítica paralela às bordas do aqueduto cerebral (Figs. 14E e 22C).
5.3 Zona Retrorubral (RRF/A8):
Os neurônios TH+ retrorubrais surgem no nível 5,76 mm p.b. (Fig. 10N) em uma área ventral às porções mais caudais do núcleo rubro (RN) e dorsal ao lemnisco medial. Neste nível, é possível ainda se perceber a coexistência da SNcd e SNl que se encontram ventrolateralmente e a VTA que está ventromedialmente à RRF.
2,34mm p.b. Hb Hb fr fr 3V ml ml ZI ZI ns ns Mn SuM SNR PrC PrC 2,70mm p.b. Mn SuM ZI ZI ml ml ns ns SNR SNR PrC PrC Hb Hb fr fr 3V VTA 3,06mm p.b. Mn 3V PrC PrC fr fr ml ml ZI ZI VTA SNR ns ns 3,24mm p.b. PrC PrC 3V fr fr ZI ZI VTA ml ml SNR SNR Mn PAG VTAdc
A
B
C
D
Figura 10. Reconstrução esquemática das secções coronais do encéfalo do mocó, ilustrando a morfologia dos núcleos dopaminégicos do mesencéfalo. Representação do nível mais rostral em (A) e do nível mais caudal em (P). Barra 1mm. Ver lista de abreviações.
3,96mm p.b. pc Aq PAG RN RN ml ml MT MT
SNR fr fr SNR
VTAdc VTAd 4,14mm p.b. pc Aq PAG RN RN
VTA VTA SNR
SNR fr fr ml ml MT MT cSN cSN VTAdc VTAd 4,32mm p.b. pc Aq PAG RN RN VTA VTA SNR SNR fr fr ml ml cSN cSN VTAdc VTAd 4,50mm p.b. SNR SNR ml ml RN RN VTA VTA PAG Aq csc cSN cSN SNv SNv VT Adc VTAd
G
H
I
J
3,42mm p.b. ml ml VTA VTA SNR SNR fr fr PAG Aq pc VTAdc VTAd VTAc 3,60mm p.b. pc Aq PAG fr fr VTA SNR SNR ml ml RN RN MT VTAdc VTAdE
F
Figura 10. Continuação.
SNlSNcd SNl
5,22mm p.b. csc 3N 3N PAG Aq RN RN VTA VT A ml ml
SNR IP SNR
VTAdc cSN cSN SNv SNv VTAd Cli 5,76mm p.b. csc Aq PAG 3N 3N RN RN VTA VTA IP ml ml SNR SNR RRF RRF Cli VTAd VTAdc 4,68mm p.b. csc Aq PAG RN RN ml ml VTA VTA SNR SNR VTAdc VTAd cSN cSN SNv SNv 5,04mm p.b. csc PAG Aq RN RN VTA VTA ml ml SNR SNR 3N 3N IP VT Adc cSN cSN VTAd SNv SNv
K
L
M
N
6,12mm p.b. csc Aq PAG 3N 3N VTA VTA IP ml ml SNR SNR RRF RRF rs rs VT Adc VTAdO
6,48mm p.b. csc Aq PAG 3N 3N RRF RRF IP PN VT AdcP
Figura 10. Continuação. SNl SNcd SNm SNm cp cp SNcd SNl VTAc cp cp SNl SNl SNcd SNcd SNm SNm VT Ac VTAc
SNl SNcd SNl
SNcd
SNm SNm
cp cp
SNlSNcd SNcdSNl
A
C
B
C
Figura 11. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 2,34 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente à SNm. Barra: 2 mm em A, 1 mm em B, 100 µm em C.
Hb fr
3V
ml
Mn ns ZI
cp
SNm
A
C
D
B
C
D
Figura 12. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 2,70 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente à SNcd; (D) Ampliação da caixa homônima em B, em área correspondente a SNm. Barra: 2 mm em A, 1 mm em B, 100 µm em C e D.
Hb 3V
3V fr
Mn ml
ns VTA cp
ZI SNcd
SNm
A
C
D
C
D
E
B
E
Figura 13. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 3,24 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente à SNcd; (D) Ampliação da caixa homônima em B, em área correspondente a SNm; (E) Ampliação da caixa homônima em B, em área correspondente a VTAdc. Barra: 2 mm em A, 1 mm em B, 100 µm em C, D e E.
3V PrC
Mn fr
ZI
VTA cp
SNcd SNm
PAG
D
B
A
E
C
Figura 14. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 3,42 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente à SNl; (D) Ampliação da caixa homônima em B, em área correspondente a VTA; (E) Ampliação da caixa homônima em B, em área correspondente a VTAc. Barra: 2 mm em A, 1 mm em B, 100 µm em C, D e E.
C
D
E pc
Aq PAG
cp
fr VTAc VTA SNm SNcd SNl
A
D
C
B
C
D
Figura 15. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 3,96 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente à VTAd; (D) Ampliação da caixa homônima em B, em área correspondente a SNl. Barra: 2 mm em A, 1 mm em B, 100 µm em C e D.
pc Aq PAG
RN
cp
VTAd
VTAc VTA fr SNm SNcd SNl
D
C D
B
A
C
Figura 16. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 4,14 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente à VTA; (D) Ampliação da caixa homônima em B, em área correspondente a cSN. Barra: 2 mm em A, 1 mm em B, 100 µm em C e D .
pc Aq PAG
RN VTAd
fr cp
VTAc VTA SNm SNcd SNl
cSN
C
D
B
A
C
D
Figura 17. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 4,68 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente a cSN; (D) Ampliação da caixa homônima em B, em área correspondente a SNv. Barra: 2 mm em A, 1 mm em B, 100 µm em C e D .
CSC Aq
PAG
RN
VTA VTAc VTAd
cp SNv SNm
SNcd SNl
cSN
C
B
A
C
Figura 18. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 5,04 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente a cSN; (D) Ampliação da caixa homônima em B, em área correspondente a SNv. Barra: 2 mm em A, 1 mm em B, 100 µm em C .
CSC
Aq PAG
3N RN
IP SNv
cp cSN
SNcd
Figura 19. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 5,22 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente a VTAdc; (D) Ampliação da caixa homônima em B, em área correspondente a VTAd; (E) Ampliação da caixa homônima em B, em área correspondente a VTAc. Barra: 2 mm em A, 1 mm em B, 100 µm em C, D e E .
C
D
E
A
C
D
E
B
CSC3N
RN VTAd
VTAc IP cp
Aq
C
D
C D
B
A
Figura 20. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 5,76 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente a VTAdc; (D) e (E) Ampliações das caixas homônimas em B, em áreas correspondentes a RRF. Barra: 2 mm em A, 1 mm em B, 100 µm em C e D.
CSC
PAG
3N RN RRF
Aq
IP cp
SNcd
C
D
C D
B
A
Figura 21. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 6,12 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) e (D) Ampliações das caixas homônimas em B, em áreas correspondentes a RRF. Barra: 2 mm em A, 1 mm em B, 100 µm em C e D .
Aq
PN IP VTAd 3N PAG
RRF rs
SNcd
C
D
C
D
B
A
Figura 22. Fotomicrografias em campo claro de secções coronais do encéfalo do mocó, ao nível de aproximadamente 6,48 mm p.b. submetidas a (A) Coloração pela técnica de Nissl; (B) Imunoistoquímica para TH; (C) Ampliação da caixa homônima em B, em área correspondente a VTAdc e (D) Ampliação da caixa homônima em B, em área correspondentes a RRF. Barra: 2 mm em A, 1 mm em B, 100 µm em C e D.
Aq PAG
3N
PN IP RRF
50 6. DISCUSSÃO
6.1 Considerações técnicas
Como mencionado anteriormente, a TH é uma enzima comum à síntese de todas as catecolaminas, podendo a sua expressão imunoistoquímica evidenciar tanto neurônios dopaminérgicos, como noradrenérgicos ou adrenérgicos. Entretanto, evidências provenientes de estudos com ferramentas fisiológicas, farmacológicas, hodológicas, clínicas e de biologia molecular, permitem assegurar que os grupamentos neuronais imunorreativos a TH no mesencéfalo, diencéfalo, telencéfalo e retina são constituídos por neurônios produtores de dopamina e, portanto, a imunorreatividade a TH pode ser considerada um marcador molecular confiável para identificação de grupamentos dopaminérgicos no mesencéfalo (Grimm et al., 2004; Prakash e Hurst, 2006; Margolis et al., 2010).
Portanto, a imunoistoquímica para TH, aliada à técnica de Nissl, permitiu-nos delimitar os grupamentos dopaminérgicos do mesencéfalo do mocó, bem como caracterizar a morfologia dos neurônios.
No mesencéfalo do mocó foram identificados os núcleos A8, A9 e A10, semelhantemente aos que foram encontrados anteriormente no rato (Rattus norvegicus)
(German e Manaye, 1993), hamster (Mesocricettus auratus) (Vincent, 1988), gerbil (Tatera brantsii) (Moon et.al., 2007), rato-cão (Thryonomys swinderianus) (Dwarika et al., 2008),
porco-espinho do Cabo (Hystrix africaeaustralis) (Limacher et al., 2008) entre outros
roedores.
Convém ressaltar que resultados semelhantes foram obtidos em estudos de caracterização morfológica desses núcleos em animais de diferentes ordens, como por exemplo, o babuíno Chacma (Papio ursinus) (McRitchie et.al., 1998), damão-do-cabo
(Procavia capensis) (Gravett et al., 2009), rock musaranho elefante (Elephantulus myurus)
(Pieters et al., 2010), girafa (Giraffa camelopardalis) (Bux et al., 2010), morcegos das
subordens Microchiropteria e Megachiropteria (Dell et al., 2010; Kruger et al., 2010) entre outros.
51 6.2 Zona retrorubral (A8)
Em estudo com duas espécies de roedores, o highveld mole-rat (Cryptomys hottentotus pretoriaie) e o Cape dune mole-rat (Bathyergus suillus), demonstrou-se que os
neurônios que formam a RRF são do tipo ovóide, bipolar e/ou multipolar e não apresentam uma orientação dendrítica (Bhagwandin et al., 2008). No highveld gerbil (Tatera brantsii),
evidenciou-se que, além dos neurônios ovóides, encontram-se neurônios fusiformes, podendo ambos os tipos apresentarem um padrão de organização dendrítica nos sentidos ventrolateral e dorsolateral (Moon et al., 2007). No presente estudo no mocó, não foi identificada a presença de neurônios bipolares nesta região. Porém, constatou-se a existência de neurônios com formato ovóide e, em menor freqüência, fusiforme cujos dendritos não apresentam padrão organizacional específico.
6.3 Substância Negra pars compacta (A9)
As propriedades eletrofisiológicas dos neurônios dopaminérgicos do mesencéfalo foram primeiramente caracterizadas na SNc, onde cerca de 90% dos neurônios são imunorreativos a TH (Margolis et.al., 2006). Com relação a esta área, todos os estudos propõem a sua subdivisão em: SNcd, SCl, SNm e SNv. Contudo, apenas um estudo evidenciou a existência da cSN como sendo um dos componentes dos núcleos dopaminérgicos (Nielsen et al., 2009). De acordo com o atlas do rato (Paxinos e Watson, 2007), a área referente à cSN seria pertencente à RRF. Todavia, a análise microscópica das secções do mocópermitiu sugerir que se trata de áreas distintas, uma vez que os neurônios da cSN são basicamente fusiformes e com padrão de organização dendrítica dorso-ventral o que, de certo modo, diverge dos neurônios relativos à RRF.
Certamente, surge a necessidade de se ampliar os estudos acerca da existência dessa subunidade nigral, incluindo a análise de outras amostras do próprio mocó, assim como
estudos em outros animais da ordem Rodentia e, principalmente, da família Caviidae. Afinal, os estudos anteriores trataram de roedores de outras famílias e, sobretudo, discrepantes em termos de fenótipo, hábitos de vida, dimensões encefálicas, entre outros aspectos.
52
organização dendrítica paralela ao pedúnculo cerebral, como no highveld gerbil (Moon et.al., 2007). Na SNm do mocó foram encontrados neurônios bipolares e multipolares, apresentando um formato ovóide e, com menor freqüência, triangular. Com relação à orientação dendrítica, os primeiros neurônios apresentavam uma organização paralela às bordas do pedúnculo cerebral e SNr. Porém, nos cortes mais caudais, esse padrão foi sendo substituído por uma arborização aleatória.
No mocó a SNcd é formada por neurônios bipolares e multipolares com corpo celular em dois aspectos, ovóide e triangular, e a arborização dendrítica apresenta a predominância de uma orientação em sentido medial-lateral (paralelo ao lemnisco medial) e, em menor expressão, em sentido dorso-ventral (na área correspondente à SNr). De fato, esta subunidade nigral não apresenta divergências significativas quando comparadas com outros estudos (Bux et al., 2010; Limacher et al., 2008).
Já a SNv, no highveld gerbil (Tatera branstsii) é formada por neurônios triangulares,
multipolares e não apresentam orientação dendrítica (Moon et al., 2007). No caso do highveld mole-rat (Cryptomys hottentotus pretoriaie) e do Cape dune mole-rat (Bathyergus suillus),
esses neurônios são ovóides, bipolares e não apresentam orientação dendrítica (Bhagwandin et.al, 2008). No mocó apresenta-se como um grupo de baixa densidade neuronal, formado por neurônios ovóides e multipolares com orientação dendrítica dorso-ventral.
No tocante à SNl, ficou constatado que esta é formada por uma baixa densidade neuronal e se encontra nas porções mais laterais do tegmento mesencefálico. Seus neurônios são multipolares e, em menor expressão, bipolares. Além disso, apresentam formato ovóide e, frequentemente, piriforme. Com relação à organização dendrítica, não há um padrão específico. Em outros estudos, foram encontrados neurônios poligonais e, frequentemente, triangulares no rock hyrax (Gravett et al., 2009) e no rock elephant shrew (Pieters et.al., 2010).
6.4 Área Tegmental Ventral (A10)
Com relação à morfologia do complexo da VTA, vários estudos destacaram a sua divisão em: VTA, VTAc, VTAd e VTAdc (Smeets e González, 2000).
53
foram identificadas no mocó, no qual os neurônios são multipolares, arredondados e, em menor quantidade, triangulares. Além disso, não apresentam um padrão de organização dendrítica.
A VTAc, uma região pouco densa, foi delimitada e seus neurônios classificados em multipolares, com formato arredondado e sem um padrão específico de organização dendrítica. Já no caso de outro roedor estudado, o cape porcupine (Hystrix africaeaustralis),
contatou-se a presença de neurônios ovóides, bipolares e com orientação dorsolateral dos dendrítos(Limacher et al., 2008).
No mocó, a localização da VTAd, na linha média encefálica, dorsalmente à VTAc, bem como a citoarquitetura constituída por um aglomerado de neurônios ovóides, bipolares e, em menor freqüência, multipolares, com organização dendrítica dorsoventral, está de acordo com o padrão encontrado nas diversas espécies estudadas previamente.
O último componente do complexo VTA é a VTAdc. No mocótrata-se de um grupo situado na substância cinzenta periaqueduta, com neurônios ovóides, bipolares e, em menor freqüência, multipolares com orientação dendrítica paralela às bordas do aqueduto mesencefálico. Este padrão foi encontrado nas diversas espécies estudadas. Todavia, em estudo com morcegos (Schreiber’s long-fingered bat, Miniopterus schreibersii) estes
neurônios não foram identificados (Maseko e Manger, 2007).
6.5 Considerações evolutivas
Com base nos estudos realizados em outros animais, principalmente reportando-se aos diversos da ordem Rodentia, foi possível deduzir que, embora se perceba diferenças fenotípicas acentuadas, a complexidade nuclear dos centros dopaminérgicos no mesencéfalo parece ser capaz de mudar entre as diferentes ordens, mas não dentro dela mesma (Maseko et al, 2007). Deste modo, autores sugeriram que para a ordem Rodentia as variações fenotípicas, de hábitos de vida e características evolutivas não conduzem à variação dos núcleos dopaminérgicos (Manger, 2005; Da Silva et al., 2006; Bhagwandin et al, 2008).
54
apenas em uma espécie não Rodentia, o gottingen minipig (Sus scrofa domesticus), um
55 7.CONCLUSÕES
A partir dos resultados deste trabalho, com relação aos núcleos dopaminérgicos do mesencéfalo do mocó, é possível concluir que:
1. A imunoistoquímica para TH, juntamente com a técnica de Nissl, são eficientes no que se refere à delimitação dos neurônios dopaminérgicos presentes no mesencéfalo, assim como na delimitação dos núcleos e na caracterização citoarquitetônica;
2. Os núcleos dopaminérgicos do mesencéfalo são: zona retrorubral (RRF/A8), substância negra pars compacta (SNc/A9) e área tegmental ventral (VTA/A10); 3. A SNc foi dividida em: SNm, SNcd, SNl, SNv e cSN. Já a VTA se divide em:
VTA, VTAc, VTAd e VTAdc;