Pró-Reitoria de Pós-Graduação e Pesquisa
Programa de Pós-Graduação
Stricto Sensu
em Ciências
Genômicas e Biotecnologia
PEPTÍDEOS ANTIMICROBIANOS POTENCIAIS PARA
TERAPIA ENDODÔNTICA: ANÁLISE ANTIMICROBIANA,
IMUNOLÓGICA E OSTEOCLASTOGÊNICA
IN VITRO
Brasília - DF
Autora: Stella Maris de Freitas Lima
Orientadora: Prof.
aDr.
aTaia Maria Berto Rezende
STELLA MARIS DE FREITAS LIMA
PEPTÍDEOS ANTIMICROBIANOS POTENCIAIS PARA TERAPIA ENDODÔNTICA:
ANÁLISE ANTIMICROBIANA, IMUNOLÓGICA E OSTEOCLASTOGÊNICA IN
VITRO
Dissertação apresentada ao Programa de
Pós-Graduação Stricto Sensu em
Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito parcial para obtenção do Título de Mestre em Ciências Genômicas e Biotecnologia.
Orientadora: Prof.a Dr.a Taia Maria Berto
Rezende
Coorientador: Prof. Dr. Octávio Luiz Franco
7,5cm
Ficha elaborada pela Biblioteca Pós-Graduação da UCB
L732p Lima, Stella Maris de Freitas.
Peptídeos antimicrobianos potenciais para terapia endodôntica: análise antimicrobiana, imunológica e osteoclastogênica in vitro. / Stella Maris de Freitas Lima – 2014.
177 f.; il : 30 cm
Dissertação (mestrado) – Universidade Católica de Brasília, 2014. Orientação: Profa. Dra. Taia Maria Berto Rezende
Coorientação: Prof. Dr. Octávio Luiz Franco
1. Biotecnologia. 2. Peptídeos. 3. Endodontia. 4. Medicamentos – microbiologia. I. Rezende, Maria Berto, orient. II. Franco, Octávio Luiz, coorient. III. Título.
À família linda que Deus me deu e aos
meus amigos, inesquecíveis e
AGRADECIMENTOS
Ao Programa de Pós-Graduação Stricto Sensu em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília e ao Centro de Análises Proteômicas e Bioquímicas, pelo acolhimento e estrutura.
Ao Corpo Docente da Universidade Católica de Brasília, pela competência e pela transmissão de conhecimento.
À orientadora, Prof.a Dr.a Taia Maria Berto Rezende, que tanto acredita no meu potencial e na minha capacidade, por se dedicar ao propósito de uma orientação baseada no companheirismo e na confiança. Você é um grande exemplo para mim.
Ao coorientador, Prof. Dr. Octávio Luiz Franco, um chefe com uma mente brilhante e um coração humilde, que enxerga tanto a pesquisa quanto as pessoas. Obrigada pela confiança.
Aos membros da banca avaliadora, Prof. Dr. Jacy Ribeiro de Carvalho Junior, por valiosas críticas e sugestões, e Prof.a Dr.a Simoni Campos Dias, que também contribuiu com o meu crescimento pessoal e profissional, me ensinando a “fazer pesquisa”.
À Prof.a Dr.a Beatriz Simas Magalhães, por colaborar na etapa de purificação e análise dos peptídeos deste estudo.
Aos alunos de iniciação científica e amigos, Maurício de Sousa, você é meu braço direito; Ana Paula Cantuária, que nunca deixou de me ajudar; e Thaís Silva, pela coragem e confiança.
Ao doutorando Jeeser Almeida, que colaborou na árdua análise estatística dos dados deste trabalho, pela paciência, companheirismo e piadas sem graça.
Ao doutorando Daniel Amaro e à mestranda Flávia Dutra, grandes amigos, que colaboraram na purificação dos peptídeos e em tantas outras etapas deste estudo.
Ao pós doutorando Ludovico Migliolo, por colaborar na etapa de liofilização e análise da pureza dos peptídeos, pelas discussões valiosas e pelas risadas.
Às doutorandas Camila Guimarães e Suzana Meira, pela colaboração nos experimentos de curva de crescimento microbiano.
À técnica Kênia Chaves, por me aguentar, rir das minhas piadas e por tanto me ajudar.
Aos amigos, Júnior (gordo), Pâmela, Bernardo, Thata, Betty e Marlon, pelo companheirismo, risadas e comilanças.
Aos funcionários da Universidade Católica de Brasília, pela dedicação.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Univesidade Católica de Brasília (UCB) e Fundação de Apoio a Pesquisa do Distrito Federal (FAPDF), pelo auxílio financeiro.
“...e quando estiver bem cansado, ainda exista amor pra recomeçar.”
RESUMO
LIMA, Stella Maris de Freitas. Peptídeos antimicrobianos potenciais para terapia endodôntica: análise antimicrobiana, imunológica e osteoclastogênica in vitro. 177 f.
Dissertação (Mestrado em Ciências Genômicas e Biotecnologia) – Universidade Católica de Brasília, Brasília, 2014.
O insucesso nos tratamentos endodônticos pode ser motivado por resistência microbiana aos processos de desinfecção do sistema de canais radiculares. Peptídeos antimicrobianos (PAMs) podem apresentar potencial no desenvolvimento de novas terapias endodônticas. O presente estudo objetivou avaliar as capacidades antimicrobianas, citotóxicas, imunomodulatórias e inibitória na osteoclastogênese dos PAMs clavaninas A e X e LL-37, em comparação a medicação intracanal Ca(OH)2. Os PAMs e o Ca(OH)2 foram avaliados a partir de: (1) ensaios
antimicrobianos contra Candida albicans e Enterococcus faecalis; (2) ensaios de
citotoxicidade e dosagem de citocinas (ELISA) e NO em células RAW 264.7 incubadas com ou sem heat killed (HK)-C. albicans ou HK-E. faecalis combinados ou
não com interferon-γ, determinando a produção de fator de necrose tumoral (TNF)-α,
proteína quimioatrativa de monócitos (MCP)-1, interleucina (IL)-1α, IL-6, IL-10, IL-12
e óxido nítrico (NO); e (3) ensaio de osteoclastogênese mediada pelo receptor ativador do fator nuclear kappa B ligante. Resultados demonstraram as concentrações inibitórias mínimas (CIM) para C. albicans (Ca(OH)2, 1728 µM) e E.
faecalis (Ca(OH)2, 13820 µM e LL-37, 57 µM). A partir da concentração de 128
µg.mL-1 dos PAMs e do Ca(OH)2, somente a clavanina X foi considerada
potencialmente citotóxica. O Ca(OH)2 foi capaz de estimular a produção de MCP-1,
TNF-α, IL-12 e IL-6 e reduzir IL-1α, IL-10 e NO. As clavaninas estimularam o
aumento de TNF-α, a redução de IL-10 e demonstraram efeito duplo na produção de
NO. A LL-37 demonstrou duplo efeito na produção de TNF-α, aumentou IL-6 e
reduziu IL-10 e NO. Em adição, todos os PAMs e o Ca(OH)2 foram capazes de inibir
o processo de osteoclastogênese. O Ca(OH)2 e a LL-37 demonstraram melhor
potencial antimicrobiano. No entanto, o Ca(OH)2 demonstrou um perfil pró
osteoclastogênese. A atuação destas biomoléculas pode favorecer a saúde dos tecidos perirradiculares na endodontia. No entanto, testes in vivo são necessários
para a confirmação de tal atividade promissora como medicação intracanal.
ABSTRACT
The failure in endodontic treatment may be motivated by microbial resistance to disinfection processes of the root canal system. Antimicrobial peptides (AMPs) may have potential in the development of new endodontic therapies. The present study aimed to evaluate the antimicrobial, cytotoxic, immunomodulatory and inhibitory capacity of AMPs in osteoclastogenesis of the AMPs clavanins A and X and LL-37, compared to intracanal medication Ca(OH)2. AMPs and Ca(OH)2 were evaluated by
the following procedures: (1) antimicrobial assays against Candida albicans and
Enterococcus faecalis; (2) cytotoxicity assays and cytokine (ELISA) and NO
production in RAW 264.7 cells incubated with or without heat killed (HK)-C. albicans
or HK-E. faecalis combined or not with interferon-γ, determining the production of
tumor necrosis factor (TNF)-α, monocyte chemoattractant protein (MCP)-1,
interleukin (IL)- 1α, IL-6, IL-10, IL-12, and nitric oxide (NO), and (3)
osteoclastogenesis assay mediated by receptor activator of nuclear factor kappa B ligand. The minimum inhibitory concentrations (MICs) were established to C. albicans
(Ca(OH)2, 1728 µM) and E. faecalis (Ca(OH)2, 13820 and LL-37, 57 µM). From the
concentration of 128 g.mL-1 of AMPs and Ca(OH)2, only clavanin X was considered
potentially cytotoxic. The Ca(OH)2 was capable to up-stimulate the production of
MCP-1, TNF-α, IL-12 and IL-6 and to down-regulate IL-1α, IL-10 and NO. Clavanins
up-regulate the TNF-α, down-regulate the IL-10 and demonstrated a double effect on
NO production. The LL-37 demonstrated a dual effect on the TNF-α production,
up-regulation in IL-6 and down-up-regulation in IL-10 and NO. In addition, all AMPs and Ca(OH)2 were able to inhibit osteoclastogenesis process. The Ca(OH)2 and LL-37
demonstated better antimicrobial potential. However, Ca(OH)2 demonstrated a
pro-inflammatory response profile, while the AMPs were able to modulate the inflammatory response from the non-interference with the active cytokines in osteoclastogenesis process. The performance of these biomolecules can promote the health of periradicular tissues in endodontics. However, in vivo tests are needed
to confirm this promising activity as an intracanal dressing.
LISTA DE ILUSTRAÇÕES
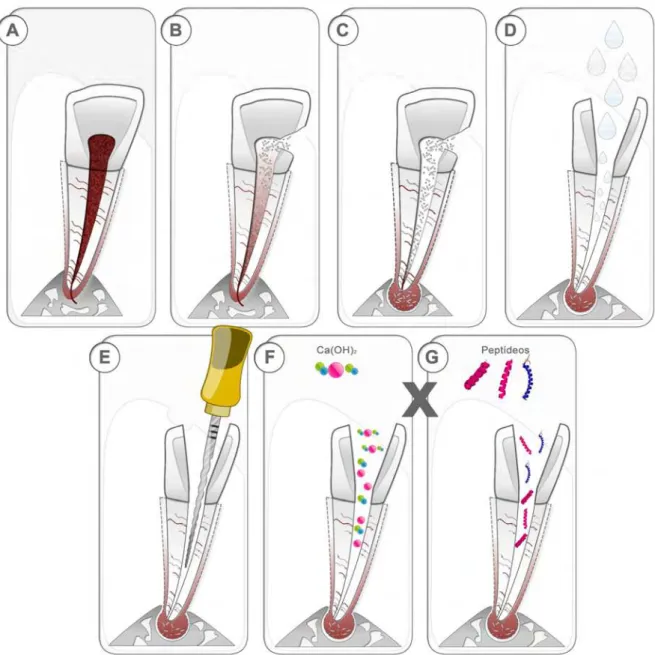
Figura 1. Etiologia da lesão perirradicular e princípios do tratamento endodôntico. O dente hígido apresenta tecido pulpar imunocompetente e o osso perirradicular intacto (A). A lesão cariosa progride e os microrganismos proliferam em direção apical até alcançarem a polpa (B). Quando superadas as defesas pulpares, estes microrganismos colonizam o SCR e suas ramificações de forma seletiva, causam necrose pulpar seguida de reabsorção óssea perirradicular (C). A terapia endodôntica ocorre por uma desinfecção química (D) (soluções irrigadoras e medicação intracanal) e mecânica (E), constituindo estas duas etapas iniciais de instrumentação e irrigação. Tal processo de desinfecção é completado pela etapa da medicação intracanal (F). Frente a índices de insucesso na terapia endodôntica devido à resistência microbiana à diversas medicações intracanais, tem-se a proposta de inserir os peptídeos antimicrobianos como uma nova medicação intracanal, na intenção de eliminar microrganismos persistentes e auxiliar no reestabelecimento da saúde no ambiente intra e perirradicular (G)...22
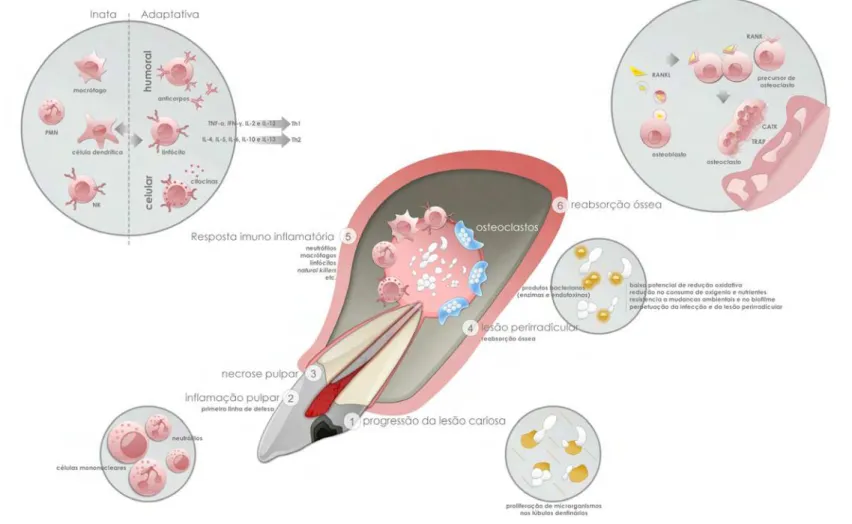
Figura 2. Desenvolvimento da patologia pulpar e perirradicular. A lesão cariosa progride em direção a polpa (A) que reage a partir de uma linha de defesa primária (B). A progressão da cárie dá início ao processo de necrose (C) com consequente formação de lesão perirradicular (D). A resposta do hospedeiro (E) e a presença de microrganismos na área perirradicular dá início ao processo de reabsorção óssea (F)...31
Figura 3. Osteoclastogênese mediada por RANKL. Moléculas de RANKL e OPG são produzidas e liberadas por osteoblastos. A ligação RANK-RANKL na superfície de pré osteoclastos ativa a osteoclastogênese. A ligação OPG-RANKL impede a ligação do RANKL ao RANK, inibindo o processo de osteoclastogênese mediado por tais moléculas...34
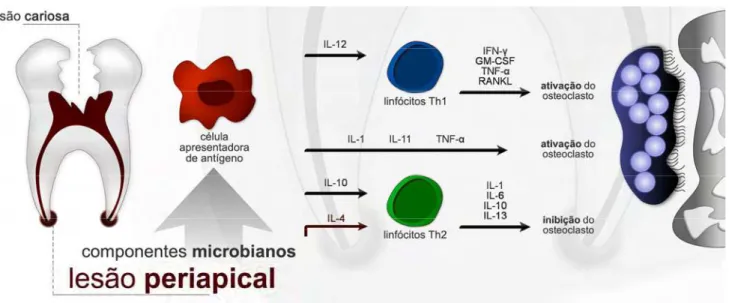
Figura 4. Osteoclastogênese mediada por estímulo microbiano. O processo de reabsorção óssea é ativado e/ou inibido por citocinas produzidas mediante a presença de infecção...35
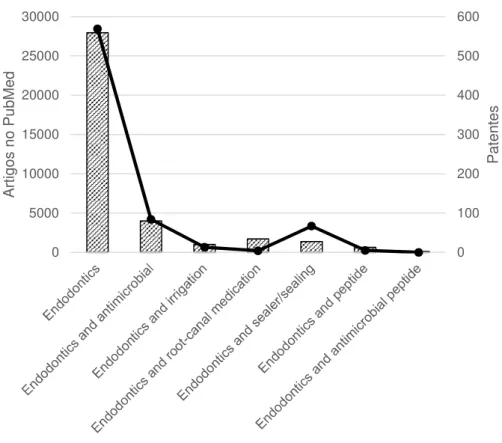
Figura 5. Relação entre a busca por artigos e patentes na área da endodontia...66
Figura 6. Fluxograma das etapas que caracterizaram o estudo...76
Figura 7. Avaliação da citotoxicidade dos peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e do Ca(OH)2 a 128 µg.mL-1, em células RAW 264.7, após 6 h de incubação, pelo teste de MTT. A
viabilidade celular foi representada em média e desvio padrão da absorbância a 595 nm, a partir de triplicata biológica e técnica. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço de HK-C. albicans ou HK-E. faecalis, combinados ou
não, tendo como controle, 105 células por poço em meio de cultura. (A) representa as culturas na presença dos peptídeos e Ca(OH)2. (B) representa as culturas na presença dos peptídeos
estimuladas com rIFN-γ. (C) e (D) representam as culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam as culturas estimuladas com
rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os
grupos assinalado, em cada condição testada, pelo teste ANOVA One way e pós teste de Bonferroni...93
Figura 8. Avaliação da citotoxicidade dos peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e do Ca(OH)2 a 128 µg.mL-1, em células RAW 264.7, após 72 h de incubação, pelo teste de MTT. A
viabilidade celular foi representada em média e desvio padrão da absorbância a 595 nm, a partir de triplicata biológica e técnica. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células por poço em meio de cultura. (A) representa as culturas na presença dos peptídeos e Ca(OH)2. (B) representa as culturas na presença dos peptídeos
estimuladas com rIFN-γ. (C) e (D) representam as culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam as culturas estimuladas com
rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os
Figura 9. Produção de MCP-1 em células RAW 264.7, na presença de peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 6 h de incubação. A produção de MCP-1
foi representada em média e desvio padrão, de três réplicas biológicas e técnicas. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células por poço
em meio de cultura. (A) representa a produção de MCP-1 de culturas na presença dos peptídeos e Ca(OH)2. (B) representa a produção de MCP-1 de culturas na presença dos peptídeos e Ca(OH)2
estimuladas com rIFN-γ. (C) e (D) representam a produção de MCP-1 de culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam a
produção de MCP-1 de culturas estimuladas com rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada,
pelo teste ANOVA One way e pós teste de Bonferroni...97
Figura 10. Produção de TNF-α em células RAW 264.7, na presença de peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 24 h de incubação. A produção de TNF-α
foi representada em média e desvio padrão, de três réplicas biológicas e técnicas. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço
de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células por poço
em meio de cultura. (A) representa a produção de TNF-α de culturas na presença dos peptídeos e Ca(OH)2. (B) representa a produção de TNF-α de culturas na presença dos peptídeos e Ca(OH)2
estimuladas com rIFN-γ. (C) e (D) representam a produção de TNF-α de culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam a
produção de TNF-α de culturas estimuladas com rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada,
pelo teste ANOVA One way e pós teste de Bonferroni...99
Figura 11. Produção de IL-12 em células RAW 264.7, na presença de peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 24 h de incubação. A produção de IL-12 foi
representada em média e desvio padrão, de três réplicas biológicas e técnicas. De acordo com as amostras testadas, as –culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células por poço em meio de cultura. (A) representa a produção de IL-12 de culturas na presença dos peptídeos e Ca(OH)2. (B) representa a produção de IL-12 de culturas na presença dos peptídeos e Ca(OH)2
estimuladas com rIFN-γ. (C) e (D) representam a produção de IL-12 de culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam a
produção de IL-12 de culturas estimuladas com rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada,
pelo teste ANOVA One way e pós teste de Bonferroni...101
Figura 12. Produção de IL-6 em células RAW 264.7, na presença de peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 24 h de incubação. A produção de IL-6 foi
representada em média e desvio padrão, de três réplicas biológicas e técnicas. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células por poço em meio de cultura. (A) representa a produção de IL-6 de culturas na presença dos peptídeos e Ca(OH)2. (B) representa a produção de IL-6 de culturas na presença dos peptídeos e Ca(OH)2
estimuladas com rIFN-γ. (C) e (D) representam a produção de IL-6 de culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam a
produção de IL-6 de culturas estimuladas com rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada,
pelo teste ANOVA One way e pós teste de Bonferroni...103
Figura 13. Produção de IL-1α em células RAW 264.7, na presença de peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 24 h de incubação. A produção de IL-1α foi
representada em média e desvio padrão, de três réplicas biológicas e técnicas. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células por poço em meio de cultura. (A) representa a produção de IL-1α de culturas na presença dos peptídeos e Ca(OH)2. (B) representa a produção de IL-1α de culturas na presença dos peptídeos e Ca(OH)2
HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam a
produção de IL-1α de culturas estimuladas com rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada,
pelo teste ANOVA One way e pós teste de Bonferroni...105
Figura 14. Produção de IL-10 em células RAW 264.7, na presença de peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 72 h de incubação. A produção de IL-10 foi
representada em média e desvio padrão, de três réplicas biológicas e técnicas. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço
de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células por poço
em meio de cultura. (A) representa a produção de IL-10 de culturas na presença dos peptídeos e Ca(OH)2. (B) representa a produção de IL-10 de culturas na presença dos peptídeos e Ca(OH)2
estimuladas com rIFN-γ. (C) e (D) representam a produção de IL-10 de culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam a
produção de IL-10 de culturas estimuladas com rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada,
pelo teste ANOVA One way e pós teste de Bonferroni...107
Figura 15. Produção de óxido nítrico em células RAW 264.7, na presença de peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e do Ca(OH)2 a 128 µg.mL-1,após 72 h de incubação. A produção
de nitrito foi representada em média e desvio padrão, de três réplicas biológicas e técnicas. De acordo com as amostras testadas, as culturas foram estimuladas com 10U por poço de rIFN-γ e 107 UFC por poço de HK-C. albicans ou HK-E. faecalis, combinados ou não, tendo como controle, 105 células.mL-1 em meio de cultura. (A) representa a produção de nitrito de culturas na presença dos
peptídeos. (B) representa a produção de nitrito de culturas na presença dos peptídeos estimuladas com rIFN-γ. (C) e (D) representam a produção de nitrito de culturas estimuladas com HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. (E) e (F) representam a produção de nitrito
de culturas estimuladas com rIFN-γ e HK-C. albicans ou HK-E. faecalis, na presença dos peptídeos e Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada, pelo teste ANOVA One
way e pós teste de Bonferroni...109
Figura 16. Viabilidade celular de células RAW 264.7 na presença dos peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 7 dias de incubação, pelo teste de MTT, a
partir de uma réplica biológica e três réplicas técnicas. A viabilidade celular foi representada em média e desvio padrão da absorbância a 595 nm, a partir de uma réplica biológica e três réplicas técnica. (A) representa as culturas estimuladas com peptídeos e Ca(OH)2, tendo como controle
2,5x103 células por poço em meio de cultura. (B) representa culturas estimuladas com 100 ng.mL-1 de
rRANKL, na presença dos peptídeos e do Ca(OH)2. *p<0,05 entre os grupos assinalados, em cada condição testada, pelo teste ANOVA One way e pós teste de Bonferroni. (C) representa o percentual de viabilidade celular dos grupos acima mencionados. A viabilidade celular foi representada em percentual calculado a partir do controle (células RAW em meio de cultura), representando 100% de viabilidade celular. a p<0,05 em relação ao controle, pelo teste ANOVA One way e pós teste de
Bonferroni...111
Figura 17. Número de osteoclastos diferenciados na presença dos peptídeos clavanina A (Cla A), clavanina X (Cla X), LL-37 e Ca(OH)2 a 128 µg.mL-1, após 7 dias de incubação e coloração de TRAP.
O número de osteoclastos foi representado em média e desvio padrão, a partir duas réplica biológica e três réplicas técnicas. (A) representa as culturas estimuladas com peptídeos e Ca(OH)2, tendo
como controle 2,5x103 células por poço em meio de cultura. (B) representa culturas estimuladas com
100 ng.mL-1 de rRANKL, na presença dos peptídeos e do Ca(OH)2. *p<0,05 entre os grupos
assinalados, em cada condição testada, pelo teste ANOVA One way e pós teste de Bonferroni...112
Figura 18. Proposta biotecnológica para a terapia endodôntica, com a inserção de peptídeos antimicrobianos como medicação intracanal...145
Figura 19. Espectro obtido por MALDI-ToF da massa referente ao peptídeo clavanina A (2667.10 Da), com pureza superior a 95%...169
Figura 21. Espectro obtido por MALDI-ToF referente ao peptídeo LL-37 (4493.33 Da), com dupla (2246.52 Da) e tripla (1494.37 Da) carga, com pureza superior a 95%...171
Figura 22. Curvas representativa de crescimento do fungo C. albicans de três réplicas biológicas para determinação de fase logarítmica. (A) representa a determinação do número de células totais, a partir da relação D. O. versus tempo de incubação em horas. (B) representa a linha de tendência com equação e R2 e a determinação do número de células viáveis a partir da relação D. O. versus UFC.mL-1...172
Figura 23. Curvas representativa de crescimento da bactéria E. faecalis de três réplicas biológicas para determinação de fase logarítmica. (A) representa a determinação do número de células totais a partir da relação D. O. versus tempo de incubação em horas. (B) representa a linha de tendência com equação e R2 e a determinação do número de células viáveis a partir da relação D. O. versus
LISTA DE TABELAS
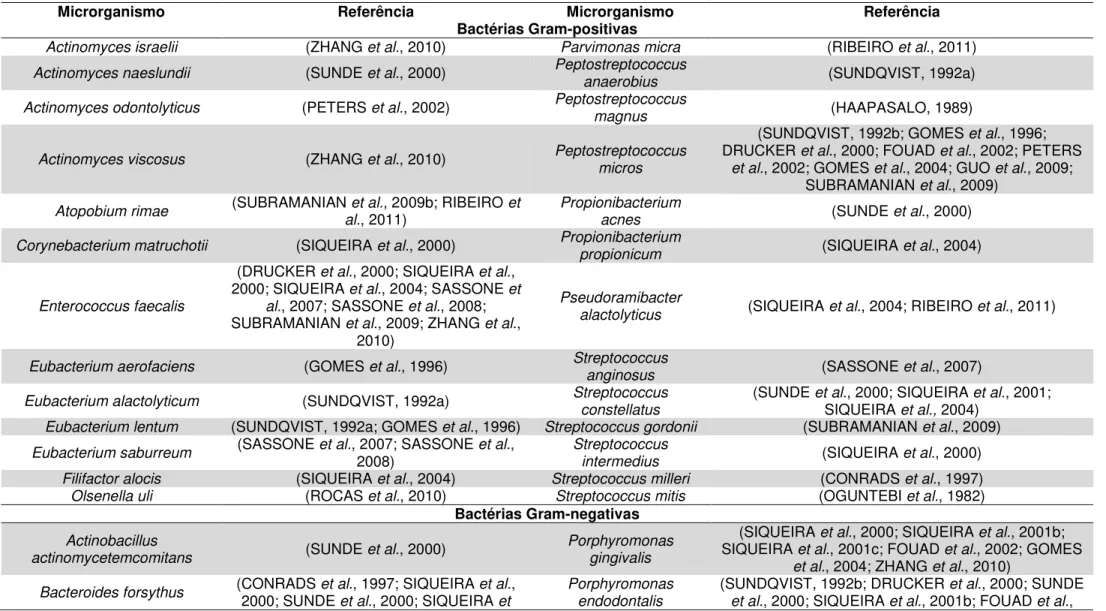
Tabela 1. Relação das bactérias Gram-positivas mais frequentemente isoladas de canais radiculares que apresentam lesão perirradicular mediante levantamento de estudos...26
Tabela 2. Grupos experimentais para análise citotóxica e imunomodulatória dos peptídeos e do Ca(OH)2...83
Tabela 3. Grupos experimentais para o modelo de osteoclastogênese in vitro...87
Tabela 4. Sequência e massa molecular dos peptídeos clavanina A (Cla A), clavanina X (Cla X) e LL-37, utilizados no presente estudo...89
Tabela 5. Resumo do comportamento dos peptídeos e do Ca(OH)2 em análise antimicrobiana,
citotóxica, imunomodulatória e capacidade de inibição da osteoclastogênese, de acordo com a concentração de 128 µg.mL-1. As setas indicam aumento ( ) e redução ( ) na produção das citocinas...114
Tabela 6. Concentração inibitória mínima de diferentes medicações intracanais contra microrganismos participantes de patologias endodônticas...128
LISTA DE ABREVIATURAS
ATCC – American type culture collection
Ca(OH)2 – hidróxido de cálcio
CATK – catepsina K
CIM – concentração inibitória mínima
DMEM – Dulbecco’s Modified Eagle’s Medium
DMSO – dimetilsufóxido
EDTA – ácido etilenodiamino tetra-acético EGF - fator de crescimento epidérmico
ELISA – Enzyme-Liked Immunoabsorbent Assay
FBS – soro bovino fetal
GM-CSF – fator estimulador de colônias de macrófagos e granulócitos HK - heat killed
IFN-γ – interferon gama
IL – interleucina
iNOS – óxido nítrico sintetase indutível
KC – citocina induzidas por quimioatração de neutrófilo LPS – lipopolissacarídeo
LTA – ácido lipoteicóico
MALDI-ToF – Matrix Assisted Laser Desorption Ionization – Time of Flight
MAPK – proteína quinase ativada por mitógeno MCP – proteína quimiotática de monócitos
M-CSF – fator estimulador de colônias de macrófagos MIP-2 – proteína inflamatória dos macrófagos
MTT – 3-(4,5-dimetiltiazol-2yl)-2,5-difenil brometo de tetrazolina NaOCl – hipoclorito de sódio
NCCLS - National Committee for Clinical Laboratory Standards
NF-κB – fator nuclear kappa B
NK – célula natural killer
NO – óxido nítrico
OPG – osteoprotegerina
PBS – tampão fosfato salino
PMCC – paramonoclorofenol canforado
RANK – receptor de ativação do fator nuclear kappa B
RANKL – ligante do receptor de ativação do fator nuclear kappa B
RAW – linhagem celular de monócitos/macrófagos de tumor induzido da leucemia murina de Abelson
RT-HPLC – cromatografia líquida de alta eficiência em fase reversa SCR – sistema de canais radiculares
TGF – fator de transformação do crescimento Th1 – linfócitos T helper tipo 1
Th2 – linfócitos T helper tipo 2
TLR – toll like receptor
TNF-α – fator de necrose tumoral alfa
TRAP – fosfatase ácida tartarato resistente Treg – célula T regulatória
UFC – unidade formadora de colônia
SUMÁRIO
1. INTRODUÇÃO...19
2. REVISÃO DE LITERATURA...20
2.1. Ambiente pulpar e perirradicular...20
2.2. Microbiota de lesões perirradiculares...24
2.3. Resposta imuno inflamatória pulpar e perirradicular...29
2.3.1. Proteína quimiotática de monócitos (MCP-1)...36
2.3.2. Fator de necrose tumoral (TNF-α)...37
2.3.3. Interleucina (IL)-12...38
2.3.4. Interleucina (IL)-6...39
2.3.5. Interleucina (IL)-1α...40
2.3.6. Interleucina (IL)-10...43
2.3.7. Óxido nítrico (NO)...44
2.4. Tratamento endodôntico convencional...44
2.4.1. Medicação intracanal...47
2.4.1.1. Hidróxido de cálcio (Ca(OH)2)...48
2.4.1.2. Outras medicações intracanais...51
2.4.2. Insucesso na terapia endodôntica...54
2.5. Peptídeos antimicrobianos...59
2.5.1. Clavaninas...66
2.5.2. LL-37...69
3. JUSTIFICATIVA...73
4. OBJETIVOS...74
4.1. Objetivo geral...74
4.2. Objetivos específicos...74
5. MATERIAIS E MÉTODOS...76
5.1. Caracterização do estudo...76
5.2. Obtenção e preparo dos peptídeos (clavanina A, clavanina X e LL-37)...77
5.3. Obtenção e preparo do Ca(OH)2...78
5.4. Avaliação da atividade antimicrobiana dos peptídeos e Ca(OH)2...78
5.4.1. Bioensaios antifúngicos...78
5.4.2. Bioensaios antibacterianos...80
5.5. Avaliação citotóxica e imunomodulatória dos peptídeos e do Ca(OH)2...81
5.5.1. Cultura das células RAW 264.7 e grupos experimentais...81
5.5.2. Preparo e teste dos antígenos microbianos mortos pelo calor...83
5.5.3. Avaliação da citotoxicidade dos peptídeos e do Ca(OH)2...84
5.5.4. Avaliação da atividade imunomodulatória dos peptídeos e do Ca(OH)2...85
5.5.4.1. Dosagem de citocinas por Enzyme-Liked Immunoabsorbent Assay (ELISA)...85
5.5.4.2. Dosagem de óxido nítrico (NO)...85
5.5.5. Avaliação da capacidade inibitória dos peptídeos e do Ca(OH)2 na osteoclastogênese in vitro...86
5.5.5.2. Coloração de tartarato fosfatase ácido resistente
(TRAP)...87
5.6. Análises estatísticas...88
6. RESULTADOS...89
6.1. Avaliação da pureza dos peptídeos e do Ca(OH)2...89
6.2. Avaliação da atividade antimicrobiana dos peptídeos e Ca(OH)2...89
6.2.1. Bioensaios antifúngicos...90
6.2.2. Bioensaios antibacterianos...91
6.3. Avaliação citotóxica e imunomodulatória dos peptídeos e do Ca(OH)2...91
6.3.1. Avaliação da citotoxicidade dos peptídeos e do Ca(OH)2...92
6.3.2. Avaliação da atividade imunomodulatória dos peptídeos e do Ca(OH)2...96
6.3.2.1. Dosagem de citocinas por Enzyme-Liked Immunoabsorbent Assay (ELISA)...96
6.3.2.1.1. MCP-1...96
6.3.2.1.2. TNF-α...98
6.3.2.1.3. IL-12...100
6.3.2.1.4. IL-6...102
6.3.2.1.5. IL-1α...104
6.3.2.1.6. IL-10...106
6.3.2.2. Dosagem de óxido nítrico (NO)...108
6.4. Avaliação da capacidade inibitória dos peptídeos e do Ca(OH)2 na osteoclastogênese in vitro...110
7. DISCUSSÃO...116
7.1. Avaliação antimicrobiana...117
7.2. Avaliação citotóxica e imunomodulatória...118
7.3. Avaliação da capacidade inibitória na osteoclastogênese in vitro...123
7.4. Hidróxido de cálcio (Ca(OH)2)...124
7.5. Peptídeos antimicrobianos...132
7.5.1. Clavaninas A e X...136
7.5.2. LL-37...139
8. CONCLUSÕES...146
9. REFERÊNCIAS BIBLIOGRÁFICAS...147
10. ANEXOS...169
10.1. Anexo A – Espectro de massa dos peptídeos antimicrobianos...169
10.2. Anexo B – Curvas de crescimento para determinação de fase logarítmica de C. albicans e E. faecalis...172
1. INTRODUÇÃO
Evidências indicam que o insucesso dos tratamentos endodônticos pode estar relacionado a persistência de infecção intrarradicular e extrarradicular, principalmente na porção apical do sistema de canais radiculares (SCR). A existência de índices de insucesso na endodontia pode acontecer pela iniciação ou manutenção do processo de reabsorção óssea, oriunda da interação entre microrganismos e resposta imuno inflamatória do hospedeiro (FIGDOR, 2004). Neste contexto, as medicações existentes não apresentam todas as propriedades necessárias para eliminar microrganismos resistentes e favorecer o reparo tecidual em ambiente perirradicular.
Microrganismos resistentes possuem capacidade adaptativa e podem se infiltrar em túbulos dentinários inacessíveis ao preparo químico-mecânico (FIGDOR
et al., 2003). A bactéria Enterococcus faecalis e o fungo Candida albicans são
exemplos de microrganismos prevalentes em infecções persistentes (HAAPASALO, 1989; TURNER et al., 2004), apresentados como alguns dos alvos de novas formas
terapêuticas na endodontia. Uma vez que a endodontia visa combater uma infecção mista e promover o reparo dos tecidos perirradiculares, os peptídeos antimicrobianos (PAMs) apresentam-se como potencial produto a ser aplicado nas etapas do tratamento endodôntico. Os PAMs são biomoléculas que atuam precocemente em resposta à infecções (GORR et al., 2011), com capacidade
antimicrobiana, imunomodulatória e de reparo tecidual (LUCCHESE et al., 2012), de
suma importância para a saúde perirradicular, a exemplo da LL-37. Outros peptídeos, como as clavaninas, também possuem atividade antimicrobiana contra diversos microrganismos prevalentes em infecções perirradiculares (LEE et al.,
1997a). A baixa concentração necessária para sua atividade e os baixos índices de resistência potencializam a utilização de PAMs como novos fármacos em terapias antimicrobianas (SILVA et al., 2012).
2. REVISÃO DE LITERATURA
2.1. Ambiente pulpar e perirradicular
A polpa dentária é constituída de tecido conjuntivo com abundantes vasos sanguíneos e linfáticos, nervos mielínicos e amielínicos, além de células mesenquimais indiferenciadas. Semelhante aos demais tecidos conjuntivos do organismo humano, a polpa reage à infecção bacteriana e a outros estímulos (físicos ou químicos), mediante resposta inflamatória. Embora a reação imuno inflamatória instalada tenha como objetivo a proteção da polpa contra a agregação microbiana, por exemplo, esta também pode causar danos teciduais em uma situação de resposta exacerbada (COLIC et al., 2009).
Anatomicamente, além dos canais principais que comportam a polpa em sua luz, existem canais acessórios e bifurcações com ramificações pulpares. O número de canais acessórios aumenta do incisivo ao molar (MAGEEAN, 1972). Estas ramificações laterais e apicais podem formar-se a partir de fragmentação do tecido radicular e contribuem pouco para a função pulpar, quando não localizados apicalmente, devido ao seu calibe reduzido. A comunicação de tecidos internos (polpa) e externos do dente (ligamento periodontal), por meio de túbulos dentinários, pode viabilizar as chances de uma contaminação cruzada (MAGEEAN, 1972).
As variações anatômicas de canais radiculares dificultam os estudos morfológicos e a prática clínica, mas são de alta relevância para alcançar o sucesso da terapia endodôntica. Estudo com 2400 dentes permanentes demonstrou a presença de canais laterais com frequência superior a 24% em todos os dentes da maxila e superior a 18%, em dentes da mandíbula. A frequência de ramificações ao longo do dente varia de 73% no terço apical, 11% no terço médio e 15% no terço coronário (VERTUCCI, 1984).
Em condições de normalidade, o tecido pulpar pode ser considerado imunocompetente, com capacidade de responder aos estímulos nocivos (TORABINEJAD et al., 1985; STASHENKO et al., 1998) (Figura 1A) e reestabelecer
um quadro de saúde, quando removido o agente agressor (ZERO et al., 2011). As
infecções pulpares, na maioria dos casos, são oriundas de contaminação oral, como via direta de lesão cariosa (ZERO et al., 2011). Fatores como virulência e
infeccioso com consequente sintomatologia (SIQUEIRA et al., 2008). A partir da
instalação e perpetuação da infecção, em condições onde as defesas pulpares são vencidas, pode ocorrer a necrose pulpar seguida de rápida colonização bacteriana no interior do SCR e região perirradicular (Figura 1B). A presença destes microrganismos pode desencadear uma série de alterações perirradiculares mediadas, por reações inflamatórias não específicas e/ou respostas imunes específicas, além de destruição óssea (TORABINEJAD et al., 1985; STASHENKO et al., 1998) (Figura 1C).
Determinadas características anatômicas da polpa, porém, tendem a modificar a natureza e o curso da resposta imunológica. Uma vez que o tecido pulpar confina-se entre paredes mineralizadas de dentina, inextensíveis, estas impedem a instalação do edema inflamatório. Nesse órgão, a circulação colateral pode ser comprometida, pois, tanto a circulação sanguínea aferente, quanto a eferente penetram e saem do dente através de forames apicais minúsculos. Tal comprometimento vascular isola a polpa necrótica das respostas do organismo, impedindo o processo de cura e viabilizando a perpetuação da infecção (BAUMGARTNER et al., 1991).
O periodonto de sustentação ou inserção é formado pelo ligamento periodontal, osso alveolar e cemento, tecidos que compõem o ambiente perirradicular. Dessa forma, as lesões perirradiculares são doenças infecciosas (SIQUEIRA et al., 2008) e não se caracterizam como um fenômeno estritamente
local (SOMMA et al., 2011). A infecção perirradicular pode ser circundada pelas
Da relevância de tal assunto, pesquisas epidemiológicas demonstraram, em população adulta japonesa, que 40% de 15232 dentes examinados apresentavam radioluscência perirradicular (TSUNEISHI et al., 2005). Dentre adultos brasileiros,
uma amostra total de 29467 dentes incluíram 6313 dentes (21%) endodonticamente tratados (HOLLANDA et al., 2008). Em adição, uma revisão sistemática de
populações com alto índice de desenvolvimento, revelou que 5% dos dentes avaliados apresentavam radioluscência perirradicular e 10% apresentavam-se com tratamento endodôntico realizado (destes, 36% com radioluscência perirradicular) (PAK et al., 2012).
Portanto, uma vez associadas infecções bucais e doenças sistêmicas, evidências sugerem que microrganismos podem ter acesso ao SCR de dentes não vitais por meio da circulação sistêmica ou de vasos linfáticos e da vascularização periodontal (SOMMA et al., 2011). Dessa maneira, qualquer microrganismo da
cavidade bucal pode colonizar o SCR (MACIEL et al., 2012). Em adição, os
patógenos da polpa podem se mover pelos espaços anatômicos do elemento dentário (SOMMA et al., 2011).
A bactéria Streptococcus viridans, clássica bactéria oportunista, pode ser
isolada de lesões perirradiculares, além de estar presente em diversas doenças sistêmicas como pneumonia, endocardite, meningite, sinusite, epidemia pleural, mediastinite, pericardite, tromboflebite séptica, conjuntivite, otite média, osteomielite, celulite, infecções de próteses articulares e abscessos de fígado, pulmão, baço e cérebro (SOMMA et al., 2011). Portanto, inflamações locais podem prejudicar a
saúde sistêmica, a exemplo da interferência de inflamação no processo do controle glicêmico do Diabetes Mellitus, com consequente elevação de níveis circulantes de glicose (IWAMA et al., 2006), assim como altos níveis de glicose também podem
contribuir para a progressão de lesões perirradiculares (LIMA et al., 2013). Desta
2.2. Microbiota de lesões perirradiculares
A ligação direta entre o aparecimento, a progressão, a manutenção da resposta inflamatória e a presença bacteriana foi relatada em estudo que constatou a existência do processo de necrose pulpar e inflamação perirradicular após a exposição pulpar de dentes de camundongos convencionais. Neste estudo, também foi relatada a formação de dentina reparadora em dentes de camundongos isentos de germes, demonstrando a capacidade da polpa em se auto-reparar na ausência de infecção (KAKEHASHI et al., 1965).
Posteriormente, confirmou-se o relacionamento de causa e efeito entre a infecção pulpar e o desenvolvimento de lesão perirradicular. Bactérias de canais radiculares de dentes sem cárie e com lesões endo-periodontais foram contabilizadas via exsudato e variaram de 3 x 105 a 8,4 x 107 unidades formadoras de colônias (UFC).mL-1. Comparado ao perfil de bactérias de bolsas periodontais, os canais radiculares analisados demonstraram menor variedade de espécies, sendo as mais abundantes as bactérias com morfologia de cocos e bastões (KURIHARA et al., 1995). Apesar de qualquer microrganismo colonizador da cavidade bucal,
nasofaringe ou trato gastrointestinal ter a capacidade de participar da infecção endodôntica (SUNDQVIST, 1992a), os patógenos associados às lesões perirradiculares prosperam em processo seletivo e, sendo específicos, constituem um número restrito de microrganismos, que também são associados as doenças periodontais (FOUAD et al., 2002).
A existência de biofilmes microbianos no interior do SCR está diretamente ligada com os princípios da patogênese e do tratamento endodôntico. Tais biofilmes são compostos de diversos microrganismos em matriz de polissacarídeo e proteínas, ligados a determinada superfície (dentina). Em sua formação, após adesão e colonização de microrganismos planctônicos em matriz polimérica, tem-se a coadesão de outros microrganismos. A determinação das interações em um biofilme para sobrevivência depende do envolvimento de produtos químicos, nutrientes, temperatura, pH, hidrofobicidade de superfície e oxigênio, em conjunto com as propriedades fenotípicas dos microrganismos. Subsequentemente, as adaptações ao ambiente são mediadas por sinalização célula a célula, com múltiplas vias para o amadurecimento do biofilme, incluindo a atuação de DNA extracelular (O'TOOLE et
A presença de biofilme que pode interferir em uma abordagem endodôntica pode estar localizada intra e extrarradicular. O biofilme bacteriano se forma em colônias densas nas paredes dos canais, dentro e entre os túbulos dentinários. Foi demonstrada a formação e biofilme de E. faecalis inoculado com hidróxido de cálcio
(Ca(OH)2) em paredes de canais radiculares. Adicionalmente, fungos formam
colônias separadas densas ao longo das paredes dos canais (SEN et al., 1995;
DISTEL et al., 2002; MOHAMMADI et al., 2013).
Em relação ao perfil de microrganismos, em infecções perirradiculares primárias, bactérias Gram-negativas são predominantes (SIQUEIRA et al., 2004), de
acordo com o tipo de microbiota de cada indivíduo, capacidade de defesa (KURIHARA et al., 1995), quantidade de espécies microbiana (presença de outras
infecções, hábitos de higiene) e tipo de doença perirradicular (crônica, aguda ou abscesso perirradicular agudo) (SIQUEIRA et al., 2009). Os critérios de seleção
microbiana envolvem disponibilidade de nutrientes, interações bacterianas (sinergismo/antagonismo), temperatura, pH, defesas do hospedeiro e presença de agentes antimicrobianos (MACIEL et al., 2012).
Mediante resultados de diversas pesquisas e, considerando as variáveis de metodologia, bactérias isoladas de lesões perirradiculares foram dispostas na Tabela 1. A prevalência de fungos foi relatada a C. albicans (SIQUEIRA et al., 2004;
Tabela 1. Relação das bactérias Gram-positivas mais frequentemente isoladas de canais radiculares que apresentam lesão perirradicular mediante levantamento de estudos.
Microrganismo Referência Microrganismo Referência
Bactérias Gram-positivas
Actinomyces israelii (ZHANG et al., 2010) Parvimonas micra (RIBEIRO et al., 2011)
Actinomyces naeslundii (SUNDE et al., 2000) Peptostreptococcus anaerobius (SUNDQVIST, 1992a)
Actinomyces odontolyticus (PETERS et al., 2002) Peptostreptococcus magnus (HAAPASALO, 1989)
Actinomyces viscosus (ZHANG et al., 2010) Peptostreptococcus micros
(SUNDQVIST, 1992b; GOMES et al., 1996; DRUCKER et al., 2000; FOUAD et al., 2002; PETERS
et al., 2002; GOMES et al., 2004; GUO et al., 2009; SUBRAMANIAN et al., 2009)
Atopobium rimae (SUBRAMANIAN et al., 2009b; RIBEIRO et al., 2011) Propionibacterium acnes (SUNDE et al., 2000)
Corynebacterium matruchotii (SIQUEIRA et al., 2000) Propionibacterium propionicum (SIQUEIRA et al., 2004)
Enterococcus faecalis
(DRUCKER et al., 2000; SIQUEIRA et al., 2000; SIQUEIRA et al., 2004; SASSONE et
al., 2007; SASSONE et al., 2008; SUBRAMANIAN et al., 2009; ZHANG et al.,
2010)
Pseudoramibacter
alactolyticus (SIQUEIRA et al., 2004; RIBEIRO et al., 2011)
Eubacterium aerofaciens (GOMES et al., 1996) Streptococcus anginosus (SASSONE et al., 2007)
Eubacterium alactolyticum (SUNDQVIST, 1992a) Streptococcus constellatus (SUNDE et al., 2000; SIQUEIRA et al., 2001; SIQUEIRA et al., 2004) Eubacterium lentum (SUNDQVIST, 1992a; GOMES et al., 1996) Streptococcus gordonii (SUBRAMANIAN et al., 2009) Eubacterium saburreum (SASSONE et al., 2007; SASSONE et al., 2008) Streptococcus intermedius (SIQUEIRA et al., 2000)
Filifactor alocis (SIQUEIRA et al., 2004) Streptococcus milleri (CONRADS et al., 1997)
Olsenella uli (ROCAS et al., 2010) Streptococcus mitis (OGUNTEBI et al., 1982)
Bactérias Gram-negativas
Actinobacillus
actinomycetemcomitans (SUNDE et al., 2000) Porphyromonas gingivalis
(SIQUEIRA et al., 2000; SIQUEIRA et al., 2001b; SIQUEIRA et al., 2001c; FOUAD et al., 2002; GOMES
et al., 2004; ZHANG et al., 2010)
al., 2001; FOUAD et al., 2002; SIQUEIRA
et al., 2003) ROCAS et al., 2006; SIQUEIRA et al., 2009c; ROCAS 2002; GOMES et al., 2004; SIQUEIRA et al., 2005; et al., 2010; ZHANG et al., 2010)
Bacteroides melaninogenicus (HAAPASALO, 1989) Prevotella baroniae (ROCAS et al., 2010)
Burkholderia cepacia (SUBRAMANIAN et al., 2009) Prevotella buccae (GOMES et al., 1996)
Campylobacter gracilis (SUNDE et al., 2000; SASSONE et al., 2007; SASSONE et al., 2008;
SUBRAMANIAN et al., 2009) Prevotella intermedia
(SUNDQVIST, 1992a; GOMES et al., 1996; SUNDE et al., 2000; SIQUEIRA et al., 2001b; SIQUEIRA et al.,
2001c; FOUAD et al., 2002; PETERS et al., 2002; GOMES et al., 2004; FOSCHI et al., 2006) Capnocytophaga gingivalis (SIQUEIRA et al., 2000; SUNDE et al., 2000) melaninogenica Prevotella (GOMES et al., 1996; DRUCKER et al., 2000; SASSONE et al., 2007)
Dialister invisus (ROCAS et al., 2006; RIBEIRO et al., 2011) Prevotella nigrescens (DRUCKER et al., 2000; XIA et al., 2000; SIQUEIRA et al., 2001b; SIQUEIRA et al., 2001c; FOUAD et al., 2002; GOMES et al., 2004; FOSCHI et al., 2006) Dialister pneumosintes (SIQUEIRA et al., 2003a; 2004; SIQUEIRA et al., 2005; ROCAS et al., 2006) Prevotella oralis (GOMES et al., 1996; RIBEIRO et al., 2011)
Eikenella corrodens (SIQUEIRA et al., 2001c) Prevotella tannerae (SIQUEIRA et al., 2003a) Fusobacterium necrophorum (GOMES et al., 2004) Selenomonas sputigena (SUNDQVIST, 1992b)
Fusobacterium nucleatum (SUNDQVIST, 1992a) Tannerella forsythia (SUNDQVIST, 1992a)
Fusobacterium periodonticum (SIQUEIRA et al., 2001c) Treponema denticola
(SIQUEIRA et al., 2000; SUNDE et al., 2000; FOUAD et al., 2002; SIQUEIRA et al., 2002; SIQUEIRA et al., 2003a; SIQUEIRA et al., 2005; FOSCHI et al., 2006;
ROCAS et al., 2006) Haemophilus aphrophilus (SIQUEIRA et al., 2000) Treponema maltophilum (SIQUEIRA et al., 2005)
Leptotrichia buccalis (SASSONE et al., 2007) Treponema socranskii (SASSONE et al., 2008)
Mitsuokella dentalis (DRUCKER et al., 2000) Veillonella parvula (SASSONE et al., 2007; SASSONE et al., 2008)
O perfil de microrganismos do canal radicular infectado tende ao anaerobismo (SIQUEIRA et al., 2000; FOUAD et al., 2002), característica
geralmente pertencente à microrganismos de infecções secundária (FARBER
et al., 1988). Isso se deve às situações de baixo potencial de redução oxidativa,
bem como reduzido consumo de oxigênio, disponibilidade de nutrientes via fluido tecidual, além de degradação de células e presença de produtos bacterianos (FOUAD et al., 2002). Este perfil pode colonizar o canal durante ou
após intervenção endodôntica profissional ineficiente (SIQUEIRA et al., 2009) e
causar a persistência de dor, uma vez que prejudica a sensibilidade de antibióticos, possibilita inibição na quimiotaxia de neutrófilos e fagócitos e produz enzimas e endotoxinas. Portanto, infecções anaeróbias são precedidas por aeróbias ou por comprometimento de suprimento sanguíneo (FARBER et
al., 1988).
Microrganismos resistentes tem a capacidade de sobrevivência a períodos de escassez de oxigênio e nutrientes, a partir de características de estado dormente ou de reduzida atividade metabólica. Em adição, estes resistem à mudanças no ambiente e no biofilme, atingem número suficiente para causar danos ao hospedeiro, acessam os tecidos perirradiculares e possuem atribuições virulentas para manter a lesão perirradicular, a partir da superação das defesas do hospedeiro (SIQUEIRA et al., 2008). Amostras de
pacientes com necessidade de retratamento endodôntico revelaram, pela técnica de PCR, a prevalência das espécies E. faecalis, P. alactolyticus, P.
propionicum, F. alocis e D. pneumosintes (SIQUEIRA et al., 2004). Estudo fez
um levantamento de trabalhos envolvendo técnicas de cultura e técnicas moleculares, que caracterizaram as seguintes espécies prevalentes: C.
albicans, E. faecalis, P. acnes, P. propionicum, A. naeslundii, A. odontolyticus, F. nucleatum, P. intermedia, Anaerococcus prevotii, Eggerthela lenta, Gemella morbillorum, P. micra, P. alactolyticus, S. anginosus e S. mitis (SIQUEIRA et al., 2009). Outro estudo relatou que o insucesso de tratamentos endodônticos
muitas vezes tem sido motivado pela presença das espécies Enterococcus e
Streptococcus (GOMES et al., 2004).
dificuldade de crescimento de espécies colonizadoras do ambiente bucal em condições artificiais (SIQUEIRA et al., 2009). A opção de técnicas moleculares
tem sido promissora na elucidação do perfil microbiológico e da patogênese de diferentes doenças e na endodontia, almejando a criação de uma terapia efetiva com protocolos preventivos e terapêuticos. Essa metodologia pode redefinir e refinar os resultados de técnicas baseadas em cultura (SIQUEIRA et
al., 2009).
Evidências indicam que o insucesso de tratamentos endodônticos pode ser motivado pela presença/persistência de tais microrganismos patogênicos resistentes à procedimentos de desinfecção do SCR (GAJAN et al., 2009).
Desta forma, são necessárias inovações na terapia endodôntica que possibilitem a diminuição dos índices de lesões refratárias e operem, em todos os passos, a desinfecção do SCR de forma efetiva.
2.3. Resposta imuno inflamatória pulpar e perirradicular
O tecido pulpar, em sua capacidade protetora frente a estímulos nocivos, compreende um sistema de defesa que começa a atuar anteriormente à progressão da infecção, em direção à câmara pulpar (STASHENKO et al.,
1998). A inflamação pulpar se inicia antes do contato direto entre patógenos e polpa (ZERO et al., 2011) (Figura 2A). As células inflamatórias, pertencentes às
defesas pulpares, reagem prontamente ao estágio inicial da cárie, a partir de inflamação crônica, na área subodontoblástica. Concomitante com as mudanças nesta região, inicia-se o processo de formação de dentina reacional (KIM, 1985).
A primeira linha de defesa da polpa pode ser conferida pelas células mononucleares, principalmente linfócitos (ZERO et al., 2011). Os produtos
Estes liberam enzimas lisossomais que auxiliam na digestão de bactérias, mas também participam da destruição tecidual, uma vez que não distinguem componentes do hospedeiro e componentes do agressor. Este quadro crônico pode desencadear em abscesso e potencializar os sintomas clínicos (ZERO et
al., 2011).
A progressão de uma lesão cariosa pelos túbulos dentinários até alcançar a polpa tem seu início com o processo de necrose gradual, mas os tecidos perirradiculares podem permanecer sem alterações patológicas, neste primeiro estágio. Posteriormente, o contato das bactérias com a polpa promove exsudação, edema e aumento de pressão intrarradicular, causando estagnação do fluxo sanguíneo pela compressão de vasos (KIM, 1985). A não remoção de resíduos pela circulação e a presença de produtos de células polimorfonucleadas (PMNs) e bactérias podem causar a degradação tecidual em torno da infecção (RICUCCI et al., 2010). O quadro de pulpite irreversível
pode ser sintomático ou assintomático (podendo apresentar necrose). A necrose migra apicalmente, de forma gradual, até atingir totalmente a polpa (RICUCCI et al., 2010) (Figura 2C). A progressão da doença pelo canal
radicular pode alcançar ou não as ramificações que se comunicam com o ligamento periodontal. Estas ramificações podem apresentar tecido necrosado ou somente inflamado (RICUCCI et al., 2010). Portanto, infecções pulpares, ao
superarem o sistema de defesa, tendem a necrosar a polpa e desenvolver uma lesão, seguida da destruição do osso alveolar perirradicular (Figura 2D).
Os microrganismos localizados no SCR estão protegidos das defesas do hospedeiro, em uma situação de necrose total da polpa. Quando estes migram para o tecido perirradicular, são delineados por tecido inflamado, neutrófilos polimorfonucleados ou plug epitelial, como uma resposta imuno inflamatória
contra a evolução do processo infeccioso. Comumente presente em lesões perirradiculares, o exsudato inflamatório apresenta um grande número de células imunocompetentes (macrófagos; linfócitos CD4+, CD8+ e CD30+; células do plasma, gigantes e natural killer (NK); mastócitos e eosinófilos),
A partir do quadro de lesão perirradicular, o exame de percussão causa desconforto e a extensão da lesão é determinada pela patogenicidade dos agentes agressores, duração da doença e a resposta do hospedeiro (ZERO et
al., 2011). Os sinais clínicos associados à patologias perirradiculares variam de
fase aguda (sintomática) e crônica (com granuloma ou cisto radicular, podendo ser assintomática) (PENARROCHA et al., 2011).
A periodontite apical aguda pode ser definida por uma inflamação aguda das fibras do ligamento periodontal em dentes vitais ou não vitais (GUTMANN
et al., 2009). A presença de exsudato purulento pode ser relatada e citocinas
derivadas de polimorfonucleados, oxidantes e as metaloproteinases possuem um papel importante na resposta inflamatória perirradicular, como a formação de edema com presença de mediadores inflamatórios e reações imunológicas no ligamento periodontal. Nestes casos, a sintomatologia pode englobar dor à mastigação e à percussão (GUTMANN et al., 2009).
O quadro de periodontite apical crônica pode ser assintomático com necrose pulpar e radioluscência perirradicular. Testes de palpação e percussão podem ser negativos ou com respostas não exacerbadas. Histologicamente, tem-se a presença de linfócitos, células do plasma e macrófagos (GUTMANN
et al., 2009).
O abscesso perirradicular se dá pelo acúmulo de células inflamatórias no ápice de dentes não vitais. Quando crônico, é geralmente assintomático, com polpa necrosada, radioluscência perirradicular, podendo apresentar fístula. Quando agudo, é geralmente sintomático (percussão e palpação positivos), com necrose pulpar e presença de fístula na área mucogengival ou planos faciais. O quadro agudo também pode apresentar lesão radiolúcida, espaçamento do ligamento periodontal e mobilidade dentária, além de sintomas sistêmicos como febre e/ou linfoadenopatia (GUTMANN et al., 2009).
O granuloma perirradicular consiste em um tecido de granulação com inflamação crônica no ápice radicular de dentes não vitais. Pode ser oriundo de um abscesso perirradicular e pode progredir para cisto perirradicular (GUTMANN et al., 2009). Os granulomas são geralmente assintomáticos e não
Os cistos apicais podem produzir sintomatologia dolorosa em fase aguda, com percussão horizontal e vertical positivas. Em adição, podem apresentar sinais como mobilidade dentária e presença de fístula (PENARROCHA et al., 2011). Este constitui de epitélio estimulado no ápice
radicular de dentes não vitais com lúmen preenchido com fluido e detritos (MORSE et al., 1977; GUTMANN et al., 2009).
Em consequência de diversas patologias endodônticas citadas, o processo de reabsorção óssea compreende duas fases: a osteoclastogênese e a atividade do osteoclasto. Na primeira fase, o precursor do osteoclasto, o monócito/macrófago se diferencia em osteoclasto multinucleado pela ação do ligante do receptor de ativação do fator nuclear kappa B (RANKL), proteína produzida por osteoblastos, células do estroma ósseo e linfócitos B e T ativados. A regulação da expressão de tal proteína mediadora pode ser diretamente proporcional à expansão da lesão (FUKADA et al., 2009).
Receptora do RANKL, a proteína RANK encontra-se na superfície celular de precursores de osteoclastos e, quando ativada por seu ligante, promove ativação do fator nuclear kappa B (NF-κB), necessário para a diferenciaçãoe
maturação do osteoclasto (WITTRANT et al., 2008) (Figura 2F).
A osteoprotegerina (OPG), proteína produzida por osteoblastos, trata-se de outro receptor para RANKL que inibe sua ligação ao RANK, inviabilizando o processo de maturação do osteoclasto (WANG et al., 2006). Desta forma,
RANKL e OPG regulam fisiológica e patologicamente a ostecolastogênese e a ativação de osteoclastos (WANG et al., 2006) (Figura 3). Níveis instáveis de
Figura 3. Osteoclastogênese mediada por RANKL. Moléculas de RANKL e OPG são produzidas e liberadas por osteoblastos. A ligação RANK-RANKL na superfície de pré osteoclastos ativa a osteoclastogênese. A ligação OPG-RANKL impede a ligação do RANKL ao RANK, inibindo o processo de osteoclastogênese mediado por tais moléculas.
Por consequência, o processo de reabsorção óssea tem seu início mediante ação das citocinas fator estimulador de colônias de macrófagos (M-CSF) e RANKL, aos quais recrutam células multinucleadas que se aderem ao osso e se diferenciam em osteoclastos maduros, induzindo-os a secretarem prótons e enzimas líticas no vacúolo de reabsorção entre a superfície óssea e superfície basal do osteoclasto. As enzimas catepsina K (CATK) e fosfatase ácida tartarato resistente (TRAP), responsáveis pela degradação das matrizes de colágeno e degradação de osso mineral, são ativadas mediante efeito de acidificação pela secreção de prótons (TAUBMAN, 2001) e a ação da reabsorção óssea perirradicular que se processa (Figura 2F).
Evidências sugerem possível indução de destruição óssea por meio da ativação da função de osteoclastos por citocinas produzidas por células imunocompetentes em lesões perirradiculares. Neste processo, as citocinas fator de necrose tumoral (TNF)-α, interferon (IFN)-γ, interleucina (IL)-2 e IL-12,
produzidas pelos linfócitos T helper tipo 1 (Th1), são ativadoras da reabsorção
(TEIXEIRA-SALUM et al., 2010) (Figura 4). Entretanto, sugere-se uma ação protetora pela
ação de IFN-γ e IL-4, produzido por ambas as células Th1 e Th2, mediante
inibição indireta da osteoclastogênese (SATO et al., 2006).
Figura 4. Osteoclastogênese mediada por estímulo microbiano. O processo de reabsorção óssea é ativado e/ou inibido por citocinas produzidas mediante a presença de infecção.
Outra citocina relevante, a IL-17, produzida por células T ativadas de memória, nomeadas Th17, foi analisada em estudos com ratos aos quais resultados demonstraram sua indução em lesões perirradiculares geradas por infecção bacteriana. Em comparação, neste estudo, TNF-α e IFN-γ não
apresentaram um estímulo significante para a reabsorção óssea (OSEKO et al.,
2009). As células Th17, classificadas como único subgrupo de células T CD4+ osteoclastogênico, podem estar relacionadas a efeitos inflamatórios autoimunes e foram reportadas como fator estimulador para a formação de células TRAP positivas, na presença de RANKL e M-CSF. A proliferação de Th17 se dá via estímulo da IL-23 e estas células produzem IL-17, que pode agir diretamente nas células de suporte da osteoclastogênese (como osteoblastos), induzindo a produção de RANKL (SATO et al., 2006).
citocinas de interesse do presente trabalho: MCP-1, TNF-α, IL-12, IL-6, IL-1α e
IL-10, além do NO. Estas citocinas foram escolhidas por estarem envolvidos no recrutamento de células de defesa (MCP-1); na resposta antimicrobiana e ativação da reabsorção óssea (TNF-α); na iniciação e regulação da resposta
imune (IL-12), na resposta antimicrobiana (IL-6); na ativação da reabsorção óssea (IL-1α); na regulação do processo inflamatório (IL-10) e na resposta
antimicrobiana (NO).
2.3.1. Proteína quimiotática de monócitos (MCP-1)
A MCP-1 é um potente fator quimiotático para macrófagos. O receptor desta citocina, CCR2 possui isoformas CCR2A, expresso predominantemente em células mononucleares e células vasculares do músculo liso, e CCR2B, expresso em monócitos e células NK e envolvendo o fluxo de Ca2+ (CHO et al.,
2007).
A MCP-1 é produzida por células constitutivas ou após indução de estresse oxidativo, citocinas ou fatores de crescimento. Células endoteliais, epiteliais, do músculo liso, mesangiais, astrocitárias, monocíticas, microgliais e fibroblastos são capazes de produzir MCP-1, sendo macrófagos/monócitos os maiores produtores (BARNA et al., 1994; DESHMANE et al., 2009). Esta
citocina está envolvida na migração e infiltração de linfócitos T de memória, células NK e monócitos para o sítio de inflamação. Esta citocina pode ter ações pró inflamatória (envolvendo células apresentadoras de antígeno e células T) e anti inflamatórias (envolvendo células T regulatórias) (DESHMANE et al.,
2009). A MCP-1 não recruta neutrófilos. Desta forma, a quimioatração envolve a ativação de moléculas de adesão, diapedese e migração de leucócitos. Quando atraídos, fagócitos mononucleares podem exercer também uma atividade destrutiva frente a uma infecção. A expressão de MCP-1 foi relatada em infecções bacterianas com inflamação óssea, relacionadas a infecções gengivais e lesões perirradiculares (RAHIMI et al., 1995). Portanto, bactérias
podem estimular a expressão de MCP-1 de maneira dose dependente, de acordo com estudo em células mononucleares do sangue periférico (JIANG et
al., 1998). Ainda assim, foi demonstrado que a inibição gênica de MCP-1 foi
2011). No entanto, foi demonstrada a expressão de altos níveis de MCP-1 em cistos e granulomas perirradiculares e em lesões endodônticas refratárias (HENRIQUES et al., 2011), demonstrando uma atuação em diferentes etapas
da resposta imune.
Em relação ao relacionamento de MCP-1 com outros mediadores inflamatórios, esta citocina está envolvida na indução de resposta de Th2 e secreção de IL-4 que, por sua vez, inibe o desenvolvimento de células secretoras de IFN-γ (DESHMANE et al., 2009). Em adição, a produção de
MCP-1 pode ser modulada pelo NO, estando condicionada a uma maior expressão em ratos que não produzem NO (SILVA et al., 2011). Em suma,
evidências indicam a participação de MCP-1 na patogênese de tais doenças inflamatórias (lesões e granulomas perirradiculares) com consequente reabsorção óssea.
2.3.2. Fator de necrose tumoral (TNF-α)
A citocina pró inflamatória TNF-α é produzida por macrófagos, linfócitos
T, células estromais, fibroblastos e osteoblastos (SILVA et al., 2005), em
resposta a infecções. O TNF-α atua em fagócitos nucleares e na ativação do
processo de reabsorção óssea. Esta citocina recruta osteoclastos, além de induzir a proliferação de células sinoviais, a produção de citocinas e o aumento da permeabilidade vascular endotelial. Ao tempo que esta citocina induz diferenciação e ativação de osteoclastos, o TNF-α inibe a diferenciação e a
apoptose de osteoblastos (LU et al., 2006; KITAURA et al., 2013).
A citocina TNF-α potencializa a diferenciação de osteoclastos mediada
por RANKL. No entanto, a partir da formação de células precursoras por M-CSF na presença de fator de transformação do crescimento (TGF)-β, o TNF-α
é capaz de induzir a diferenciação de osteoclastos em camundongos que não produzem RANKL (KIM et al., 2005). Dessa forma, evidências indicam que o
TNF pode estimular a expressão de RANK em macrófagos e de RANKL em células estromais. Em adição, o TNF-α foi capaz de aumentar a expressão de
IL-1 e RANKL em células da medula óssea (KITAURA et al., 2013). Em adição,