U
NIVERSIDADE DET
RÁS-
OS-M
ONTES EA
LTOD
OUROO
ZONOTERAPIA EM
S
INOVITES
S
ÉPTICAS DE
EQUINOS
:
UMA ALTERNATIVA
DE TRATAMENTO
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
Gonçalo Varajão Coelho
ORIENTADOR: Professor Doutor Mário Pedro Gonçalves Cotovio
U
NIVERSIDADE DET
RÁS-
OS-M
ONTES EA
LTOD
OUROO
ZONOTERAPIA EM
S
INOVITES
S
ÉPTICAS DE
E
QUINOS
:
UMA ALTERNATIVA
DE TRATAMENTO
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIAGonçalo Varajão Coelho
“As doutrinas apresentadas neste trabalho são da exclusiva responsabilidade do autor”
A
GRADECIMENTOS
Em primeiro lugar, uma palavra de agradecimento à Universidade de Trás-os-Montes e Alto Douro, a todos os docentes do Mestrado Integrado em Medicina Veterinária, assim como a todos os profissionais do Hospital Veterinário da UTAD.
Um obrigado ao Professor Doutor Mário Cotovio, pela ajuda, paciência, apoio e enorme disponibilidade demostrada desde o início até ao final deste trabalho de dissertação.
Ao Dr. Manuel Lamas pelos excelentes meses de estágio que me proporcionou, por todos os conhecimentos que me transmitiu e por se ter tornado num exemplo profissional a seguir. A toda a equipa do Hospital de Referência La Equina, um obrigado pela forma como me receberam e integraram ao longo do estágio, e ainda, pela aprendizagem que me proporcionaram durante o mesmo.
À cidade de Vila Real e à magnífica academia da Universidade de Trás-os-Montes e Alto Douro. Para sempre vos recordarei com saudade. Um especial obrigado a todos aqueles que me acompanharam durante esta longa jornada, onde, cada um contribuiu de forma única para tornar esta cidade, na minha segunda casa. Sem vós era possível, mas muito mais difícil, e sem dúvida, muito menos gratificante. Um obrigado especial à minha grande companheira de todos estes anos, pela amizade, apoio incondicional e por estar sempre comigo, tornando qualquer etapa, num passeio no parque.
A todos os meus amigos de Monção que me viram crescer, como Homem e estudante, e estiveram sempre presentes, para o bem e para o mal. Espero ter-vos sempre comigo.
Aos meus pais e avós, porque sem a vossa educação e valores herdados e transmitidos, era apenas um corpo desprovido de conteúdo. Não só por isso, mas também pelo apoio incondicional, a vós vos devo e agradeço esta vitória e todas as outras que conseguir ao longo da minha vida.
R
ESUMO
As sinovites sépticas ocorrem quando existe infeção de algum compartimento sinovial, como as articulações, bainhas tendinosas ou bursas. É uma doença grave, e bastante comum em equinos, que pode causar claudicação grave, implicar o término da carreira desportiva do cavalo, e até colocar em risco a vida do animal. O estabelecimento da infeção microbiana leva rapidamente a inflamação e, posteriormente, a alterações degenerativas nos compartimentos sinoviais, resultando na perda de função normal da estrutura. O tratamento visa o retorno, do normal ambiente sinovial, e por isso, a antibioterapia local e sistémica desempenham um papel fulcral. O exponencial aumento de bactérias multirresistentes, assim como, a afirmação cada vez maior da patogenicidade, severidade e resposta da infeção ao tratamento, como o principal influenciador do prognóstico, levam a que seja urgente para a comunidade médica veterinária encontrar soluções para este problema.
Apesar da molécula de ozono ser já vista como um desinfetante extremamente eficaz, e da evolução empírica e sucesso terapêutico existente nos últimos anos, a utilização terapêutica desta molécula continua bastante controversa. A sua alta reatividade e poder oxidativo conferem-lhe a capacidade de estimular o sistema imunológico, induzir efeito analgésico, e ainda, de inativação de microrganismos. Quando o microrganismo é exposto ao ozono, ocorre a oxidação dos compostos do seu envelope celular e consequente rutura do mesmo, provocando lise celular. Além disso, a modulação do sistema imunitário induzida pela ozonoterapia modula a produção de citocinas inflamatórias deletérias.
O objetivo desta dissertação foi apresentar, de forma detalhada, as alterações desencadeadas pelas sinovites sépticas, as opções atuais para as evitar, e principalmente, as características da molécula de ozono que permitem à ozonoterapia destacar-se no seu tratamento.
Para o conseguir, o presente trabalho contém uma revisão bibliográfica sobres os referidos temas, um relato de atividade e casuística observada, e uma descrição de 4 casos clínicos de sinovites sépticas, de entre os quais, 3 realizaram ozonoterapia intrassinovial. Foi acompanhada a evolução e resultados clínicos de todos os casos, sendo a mesma posteriormente discutida e comparada com a bibliografia existente.
Concluindo, a ozonoterapia assume-se como uma alternativa ao tratamento de sinovites sépticas em equinos sendo, no entanto, necessários mais estudos acerca desta promissora terapêutica na medicina de equinos.
A
BSTRACT
Septic synovitis occurs when there is infection of any synovial compartment, such as joints, tendon sheaths or bursae. It is a serious disease, very common in horses, that can cause severe lameness, end of the horse's sports career and even threaten the animal´s life. The establishment of microbial infection quickly leads to inflammation and, subsequently, to degenerative changes in synovial compartments, resulting in the loss of normal structure function. The treatment main goal is the return of a normal synovial environment and therefore local and systemic antibiotic therapy plays a pivotal role. The exponential increase in multidrug-resistant bacteria, ally to an increasing statement of pathogenicity, severity, and treatment response as the main predictor of prognosis, makes it urgent for the veterinary community to find solutions to this problem.
Although the ozone molecule is already seen as an extremely effective disinfectant, and the empirical and successful therapeutic evolution seen in recent years, the therapeutic use of this molecule remains quite controversial. Its high reactivity and oxidative power gives it the ability to stimulate the immune system, induce analgesic effect, and yet inactivate microorganisms. When the microorganism is exposed to ozone, oxidation of compounds from its cell envelope occurs and, consequent, its rupture, causing cell lysis. In addition, ozone therapy-induced modulation of the immune system modulates the production of deleterious inflammatory cytokines.
The purpose of this dissertation was to exhibit in detail the changes triggered by septic synovitis, current options to avoid it, and mainly, the characteristics of the ozone molecule that makes it an excellent treatment option.
To achieve that, the present work contains a bibliographic review on the subjects, a report of observed clinical cases and activities, and a description of 4 clinical cases of septic synovitis, among which 3 perform intrasynovial ozone therapy. It was accompanied by the evolution and clinical results of all cases, which was later discussed and compared with the existing bibliography.
In conclusion, ozone therapy assumes as an alternative to the treatment of septic synovitis in horses, however, further studies on this promising therapy in equine medicine.
Í
NDICE
Agradecimentos ... iii Resumo ... v Abstract... vii Índice de tabelas ... xi Índice de figuras ... xiÍndice de Abreviaturas, Siglas e Acrónimos ... xiii
1. Revisão Bibliográfica ... 1
1.1. Introdução ... 1
1.2. Ozonoterapia ... 2
1.2.1. Mecanismos de ação ... 3
1.2.2. Vias de administração ... 5
1.3. Anatomia das estruturas sinoviais do cavalo ... 6
1.3.1. Articulações ... 6
1.3.2. Bainhas Tendinosas ... 9
1.4. Fisiopatologia ...10
1.5. Etiologia...16
1.6. Diagnóstico ...18
1.6.1. Sinais clínicos / Exame físico ...18
1.6.2. Radiografia ...19
1.6.3. Ecografia ...20
1.6.4. Análise do líquido sinovial ...22
1.6.5. Cintigrafia Nuclear, Ressonância Magnética e Tomografia Computorizada ...26
1.7. Tratamento ...27
1.7.1. Tratamento Antibiótico ...27
1.7.1.1. Prevalência bacteriana e Suscetibilidade antibiótica ...28
1.7.1.2. Vias de administração ...31
1.7.1.4 Poder bactericida da Ozonoterapia ...33
1.7.3. Tratamento cirúrgico ...35
1.7.2. Tratamento adjuvante e de suporte ...37
1.8. Prognóstico ...40
2. Objetivos ...42
3. Casuística ...43
3.1. Clínica do Almargem - Setúbal ...43
3.2. Hospital de Referência La Equina - Manilva, Espanha ...44
3.3. Tabela resumo de casos clínicos ...45
4. Descrição de casos clínicos ...48
4.1. Caso Clínico número 1 ...48
4.2. Caso Clínico número 2 ...53
4.3. Caso Clínico número 3 ...56
4.4. Caso clínico número 4 ...60
5. Discussão ...64
6. Conclusões ...73
Í
NDICE DE TABELAS
Tabela 1. Mediadores e Inibidores da inflamação articular………12 Tabela 2. Principais agentes bacterianos presentes em sinovites sépticas equinas e sua
sensibilidade antibiótica in vitro……….28
Í
NDICE DE FIGURAS
Figura 1. Reação e compostos formados após contacto do ozono com os fluídos biológicos...4 Figura 2. Cadeia de reação ao stress oxidativo causado pelo ozono………..4 Figura 3. Representação esquemática de uma articulação………7 Figura 4. Representação esquemática da composição da cartilagem articular sobre o osso
subcondral e trabecular……….8
Figura 5. Avaliação da comunicação entre ferida e compartimento sinovial recorrendo a
radiografia de contraste positivo………20
Figura 6. A- Imagem ecográfica transversal sem utilização de "standoff pad" do aspeto palmar
do metatarso distal de cavalo com sinovite séptica da bainha do tendão flexor digital; B- Imagem ecográfica transversal com utilização de "standoff pad" do aspeto palmar do metatarso distal de cavalo com sinovite séptica da bainha do tendão flexor digital; C- Imagem ecográfica longitudinal do aspeto dorso-medial da articulação tarsocrural com artrite séptica………...21
Figura 7. Fluido sinovial séptico. Aparência serosanguinolenta, opaca e túrbida………22 Figura 8. A- Inflamação séptica por Streptococcus zooepidemicus; B- Artrite inflamatória.
Presença de macrófago a realizar fagocitose e de macrófago reativo………24
Figura 9. Fotografia lateral do aspeto dorsoproximal do carpo esquerdo onde se observa a
ferida transversal e a tumefação difusa dos tecidos moles adjacentes………..49
Figura 10. Imagem ecográfica transversal da face dorsal do aspeto distal do rádio
esquerdo………...50 Figura 11. Estudo radiográfico do carpo esquerdo………..51
Figura 12. Estudo radiográfico, com 4 projeções diferentes, sem alterações dignas de registo
ao nível articular e ósseo………54
Figura 13. Imagem ecográfica transversal do tendão flexor digital superficial, tendão flexor
digital profundo e bainha digital flexora………57
Figura 14. Imagens ecográficas transversais do tendão flexor digital profundo, tendão flexor
digital superficial e bainha digital flexora………..59
Figura 16. Imagem de uma projeção radiográfica dorsopalmar da zona do carpo do membro
anterior direito………..61
Figura 17. Realização de lavagem articular com soro ozonizado………..63 Figura 18. Exame radiográfico de revisão, 1 ano após hospitalização do animal………64
Í
NDICE DE
A
BREVIATURAS
,
S
IGLAS E
A
CRÓNIMOS
%- Percentagem; µL- Microlitro;
AAEP- American Association of Equine Practitioners AH- Ácido hialurónico;
AINES- Anti-inflamatórios não esteroides; AS- Artrites sépticas;
ATP- Adenosina trifosfato;
bFGF- Fator de crescimento de fibroblastos básico; CPCAs- Células progenitoras da cartilagem articular; COX- Cicloxigenase;
dL- Decilitro;
DMSO- Dimetilsulfóxido;
EDTA- Ácido etilenodiaminotetracético; h- Horas;
HClO- Hipoclorito de hidrogénio; HO-1- Heme oxigenase 1;
HSP- Proteínas de choque térmico; H2O2- Peróxido de hidrogénio; IFN- Interferão;
g- grama;
IGF-1- Fator de crescimento semelhante à insulina 1; IL- Interleucina;
IM- Intramuscular; IV- Intravenosa; L- Litros;
LOPs- Produtos de oxidação lipídica; MDA- Malondialdeido;
MEC- Matriz extracelular; mg- miligrama;
mL- Mililitro;
MMP- Metaloproteinase da matriz; NO- Monóxido de nitrogénio;
NrF2- Fator nuclear eritroide 2 relacionado ao fator 2; O2- - Radical superóxido;
PAI- inibidor do ativador de plasminogénio; PGs- Proteoglicanos;
PMMA- Polimetilmetacrilato;
PMNs- Células polimorfonucleadas;
PSGAG- Glicosaminoglicano polissulfatado; ROS- Espécies reativas de oxigénio;
RM- Ressonância magnética; SAA- “Serum amyloid A”;
SARM- Staphylococcus aureus resistente à metilpenicilina; SC- Subcutânea;
TC- Tomografia computorizada;
TGF-β- Fator de crescimento tumoral β;
TIMPs- Inibidores teciduais das metaloproteinases da matriz; TNF- Fator de necrose tumoral;
1.
R
EVISÃO
B
IBLIOGRÁFICA
1.1.
I
NTRODUÇÃOAs infeções dos compartimentos sinoviais (articulações e bainhas dos tendões) podem causar claudicação grave, implicar o término da carreira desportiva do cavalo, e até colocar em risco a vida do animal (Lugo, 2015; Lugo & Gaughan, 2006). A grande exposição da porção distal dos membros dos equinos torna esta doença bastante comum. O desenvolvimento microbiano leva rapidamente a inflamação e dor severa que comprometem o normal funcionamento da articulação ou tendão, designando-se por artrite ou tenossinovite, respetivamente (Ludwig & van Harreveld, 2018; Schneider et al., 1992). Por conseguinte, o tempo é um fator chave para o desenvolvimento da afeção sendo que um diagnóstico precoce e uma terapia agressiva são fundamentais para o tratamento da mesma. Um diagnóstico e início de tratamento tardio levam a alterações degenerativas nas articulações e à formação de tecido fibroso nos tendões e cápsulas articulares o que leva a perda de função normal da estrutura (Lugo & Gaughan, 2006; Schneider et al., 1992).
As artrites sépticas (AS) e tenossinovites sépticas (TS) são patologias muito similares em termos de etiologia, agentes microbianos envolvidos, sinais clínicos, diagnóstico e tratamento, sendo, por isso, estudadas em conjunto (Joyce, 2007; Schneider et al., 1992).
As principais causas de sinovites sépticas no cavalo adulto, envolvem contaminação sinovial de origem exógena. De entre as várias causas possíveis, as feridas são a mais comum ocorrendo principalmente nas articulações metacarpo/metatarso-falangeana (boleto), do carpo, tarsocrural, interfalangeana proximal, interfalangeana distal e do joelho. As bainhas tendinosas afetadas com maior frequência são a digital e tarsal. A bursa do navicular e a bursa calcânea são outras das estruturas que podem estar afetadas (Bertone, 1995; Joyce, 2007; Ludwig & van Harreveld, 2018; Lugo, 2015; Lugo & Gaughan, 2006; Schneider et al., 1992). Nos equinos jovens é mais comum o estabelecimento de artrites sépticas por disseminação bacteriana hematogénica (Lugo & Gaughan, 2006).
O tratamento de AS e TS tem como objetivo o retorno, o mais rápido possível, do normal ambiente sinovial. Para o conseguir são realizadas lavagens, desbridamento e drenagem do compartimento sinovial de modo a remover o conteúdo bacteriano e os detritos inflamatórios. Para uma ação mais eficaz contra os microrganismos patogénicos administram-se fármacos antimicrobianos no local da infeção. A antibioterapia tem como finalidade a eliminação da carga bacteriana, necessitando de obter a Concentração Mínima Inibitória nos tecidos lesados através da combinação de antibióticos sistémicos e locais. É recomendado
também o uso de terapia anti-inflamatória para diminuir o processo inflamatório, minimizar os danos articulares e promover analgesia mantendo o conforto e incentivando ao apoio do membro (Bertone, 1995; Joyce, 2007; Ludwig & van Harreveld, 2018; Lugo, 2015; Lugo & Gaughan, 2006).
O ozono (O3) é uma molécula altamente instável e reativa formada por três átomos de
oxigénio, que é usada como método de desinfeção e, em medicina humana, no tratamento de diversas patologias como condições inflamatórias crónicas, osteonecrose, doença periodontal e cáries, entre outras. Esta variedade de aplicações deve-se ao seu amplo espetro de potenciais como o efeito antimicrobiano, a estimulação do sistema imunitário e a indução de regeneração de feridas (Borges et al., 2017). Na medicina de equinos, o ozono assume-se cada vez mais como uma alternativa na terapia das mais variadas lesões com especial destaque para a sua eficácia no tratamento de artrites e tenossinovites sépticas recorrentes e na descontaminação e cicatrização de feridas (Bhatt et al., 2016; Orsini, 2017).
As artrites e tenossinovites podem ser divididas em dois grandes grupos, sépticas e não sépticas. Devido ao forte poder antimicrobiano do ozono e à sua utilização para combater os desafios relacionados com sinovites sépticas persistentes foi decidido não abordar, neste trabalho, a vertente das artrites e tenossinovites não sépticas.
1.2.
O
ZONOTERAPIAA utilização terapêutica do ozono, apesar da evolução empírica e do sucesso terapêutico existente nos últimos anos, continua bastante controversa. No entanto, é já muito utilizado na desinfeção de água, esterilização de material e na odontologia, sendo visto como um desinfetante extremamente eficaz (Beck et al., 1998; Bocci, 2006; Smith et al., 2017). Ainda assim, a falta de regulação e desinteresse pelas autoridades de saúde, a existência de pessoal não qualificado a utilizar a técnica, a falta de suporte financeiro e o ceticismo e desinformação de vários cientistas são ainda aspetos por resolver. A Ozonoterapia tem-se mostrado extremamente eficaz em várias afeções infeciosas causadas por bactérias multirresistentes, vírus e fungos, assim como, no tratamento da osteomielite e de feridas cutâneas (Bocci, 2006).
A molécula de ozono é constituída por 3 átomos de oxigénio arranjados de forma diédrica, apresenta grande instabilidade reagindo com diversos compostos como o carbono e o óxido nítrico. A sua capacidade oxidante encontra-se entre as 3 mais potentes de todas as moléculas estudadas. O seu armazenamento no estado gasoso é impossível devido ao baixo tempo de semivida. A sua alta reatividade e poder oxidativo conferem-lhe a capacidade de estimular o sistema imunológico, induzir efeito analgésico, e ainda, de inativação de
microrganismos. De salientar, a importância da utilização deste gás dentro da sua janela terapêutica com vista a evitar toxicidade e danos tecidulares (Bhatt et al., 2016). Adicionalmente, o poder antioxidante e a resposta de hormese por parte do sistema biológico que interage com a molécula, são também muito importantes (Zanardi et al., 2016).
1.2.1.
M
ECANISMOS DE AÇÃOA Ozonoterapia baseia-se em princípios bioquímicos, fisiológicos e farmacológicos (Bocci, 2006). Apresenta efeitos diretos em vários componentes biológicos como lipoproteínas, fosfolípidos, cápsulas virais e envelopes celulares bacterianos, mas também, efeitos indiretos formando substratos ativos e ativando cascatas endógenas de resposta celular (Smith et al., 2017). Infelizmente muitos profissionais desconhecem os seus mecanismos de ação e benefícios terapêuticos. Nas últimas duas décadas existiram enormes avanços científicos na compreensão dos mecanismos desta molécula (Bhatt et al., 2016).
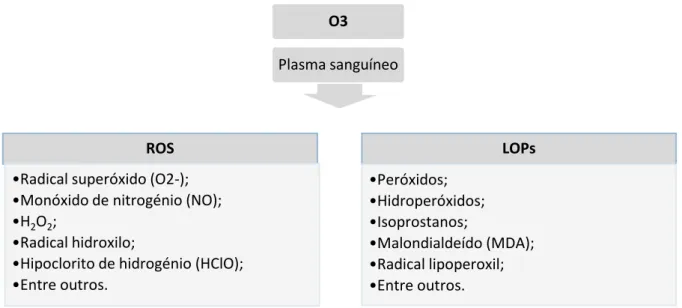
Quando os fluídos biológicos contactam com o ozono ocorrem diversas reações que assentam em dois processos fundamentais (Figura 1). Em primeiro lugar, uma reação inicial gera espécies reativas de oxigénio (ROS), como o peróxido de hidrogénio (H2O2),
responsáveis pela ativação de diversas cadeias bioquímicas. As ROS são altamente citotóxicas, mas apresentam curto tempo de semivida e são neutralizadas entre 0,5 a 1 minuto após a sua formação pelo sistema antioxidante das células sempre que utilizados em doses que não sobreponham esse poder. Em segundo lugar, ocorre uma perioxidação lipídica, em especial dos ácidos gordos polinsaturados, que resulta na formação de produtos de oxidação lipídica (LOPs). Estes compostos apresentam maior tempo de semivida e provocam efeitos tardios (Bocci, 2005).
As ROS e os LOPs funcionam como os mensageiros do ozono no organismo e são os responsáveis pelos efeitos terapêuticos. De entre as ROS, o H2O2 apresenta especial
importância devido à sua rápida difusão para os eritrócitos, leucócitos e plaquetas, e ainda, pela sua capacidade de ativação da tirosina cinase que leva ao aumento da síntese de diversas proteínas que atuam em células mononucleadas, eritrócitos e plaquetas. Os LOPs apresentam um largo espetro de ação chegando a praticamente todos os órgãos. Atuam preferencialmente na medula óssea e, quando em doses submicromolares (em doses de 1 micromolar são citotóxicos), estimulam a proliferação celular e atividades bioquímicas. Promovem ainda uma adaptação celular ao stress oxidativo agudo através do aumento da libertação de células mãe, da produção de proteínas de stress oxidativo e da regulação positiva das enzimas antioxidantes (Bocci, 2005).
Quando os fluidos biológicos são submetidos ao ozono é induzido um stress oxidativo moderado e transiente. Este fenómeno, quando repetido diversas vezes, promove o reequilíbrio do sistema redox do organismo responsável pelas respostas terapêuticas obtidas com a terapia com O3. A capacidade antioxidante é um dos benefícios terapêuticos da
Ozonoterapia conseguido através de uma cascata de acontecimentos iniciada com o aumento da ativação do fator nuclear eritroide 2 relacionado ao fator 2 (NrF2) resumida na Figura 2 (Smith et al., 2017).
ROS
•Radical superóxido (O2-); •Monóxido de nitrogénio (NO); •H2O2;
•Radical hidroxilo;
•Hipoclorito de hidrogénio (HClO); •Entre outros. LOPs •Peróxidos; •Hidroperóxidos; •Isoprostanos; •Malondialdeído (MDA); •Radical lipoperoxil; •Entre outros. Stress oxidativo induzido pelo O3 Aumento da ativação do NrF2 Ativação da transcrição dos elementos de resposta antioxidante
Aumento da produção de enzimas antioxidantes como a superóxido dismutase, glutationa peroxidase, glutationa S-transferase, catalase, heme oxigenase-1 (HO-1) e proteínas
de choque térmico (HSP)
Figura 1. Cadeia de reação ao stress oxidativo causado pelo ozono (adaptado de Smith et al., 2017).
O3
Plasma sanguíneo
Figura 1. Reação e compostos formados após contacto do ozono com os fluídos biológicos (adaptado de Bocci, 2005 e Smith et al., 2017).
Este tipo de resposta, de hormese, é um potente mecanismo de defesa endógeno contra a isquemia letal e insultos oxidativos a múltiplos órgãos. Várias formas da enzima heme oxigenase (HO) incluindo a HO-1 funcionam como sensores dinâmicos do stress oxidativo celular regulando desta forma a homeostase redox sendo, consequentemente, de enorme importância na resposta de hormese do sistema antioxidante. Na resposta antioxidante devem salientar-se as proteínas de choque térmico que providenciam um estado citoprotetor durante, por exemplo, a inflamação (Smith et al., 2017).
Para além da resposta antioxidante, a molécula de O3 provoca uma modulação
vascular e hematológica responsável pelo aumento de eficiência da cadeia respiratória mitocondrial, do nível de oxigénio intracelular e do fluxo transmembranar de oxigénio. Para o conseguir, o ozono provoca um aumento da fosfofrutocinase que leva ao aumento da taxa de glicólise e, por conseguinte, ao aumento da produção de adenosina trifosfato (ATP). Adicionalmente, ocorre um aumento da prostaciclina, que apresenta grande capacidade vasodilatadora, uma estimulação da diferenciação eritroblástica, aumentando o seu número e resiliência, e uma estimulação da eritrogénese pelos LOPs. Tudo isto, em conjunto com o efeito de Bohr, permite um aumento do fluxo sanguíneo e uma oxigenação maior e mais eficiente aos tecidos isquémicos (Smith et al., 2017).
1.2.2.
V
IAS DE ADMINISTRAÇÃOExiste uma enorme variedade de técnicas de administração de ozono descritas como a intramuscular (IM), intravenosa (IV), subcutânea (SC), intra-articular, peri-articular, extracorporal, retal, intradiscal, intraperitoneal entre outras. Atente-se que a via endovenosa não deve ser utilizada para administrar O3 no estado gasoso devido ao risco de embolismo. É
recomendado em praticamente todas as técnicas a administração inicial de baixas concentrações e a subida gradual e ligeira das mesmas. De salientar, entre todas as técnicas, a auto-hemoterapia maior, auto-hemoterapia menor, insuflação retal, aplicação tópica e injeção intra-articular (Bocci, 2006).
A auto-hemoterapia maior figura-se como a técnica mais estudada e fiável. Consiste na recolha, ozonização (durante 5-10 minutos) e administração IV de uma quantidade considerável (200-270 ml) de sangue do animal. Está indicada para diversos distúrbios circulatórios, doenças virais e doentes imunodeficientes, entre outras (Beck et al., 1998; Bocci, 2006). Com um procedimento semelhante ao anterior, a auto-hemoterapia menor realiza-se com menor quantidade de sangue, menor tempo de ozonização e a administração é feita IM.
As suas principais indicações são como adjuvante no tratamento de neoplasias, para imunoativação e no tratamento de alergias. Em ambas as auto-hemoterapias, a janela terapêutica varia entre 10 µg/ml e 80 µg/ml existindo a possibilidade de hemólise com a utilização de concentrações superiores a 90 µg/ml (Beck et al., 1998; Bocci, 2006).
A insuflação retal é uma das formas mais antigas de administração de O3 e atua
provocando um aumento da pressão parcial de oxigénio na parede intestinal, vasos sanguíneos mesentéricos, veia porta e parênquima hepático. Está indicada, entre outras, para a colite ulcerativa e imunomodulação (Beck et al., 1998).
Quando se trata de infeções e lesões tópicas, podemos utilizar a Ozonoterapia de forma tópica. A sua aplicação direta em forma de gás, creme, água ozonizada ou óleos tem sido muito utilizada. Adicionalmente, para infeções mais profundas e lesões mais graves, o encerramento da zona afetada numa bolsa contendo uma mistura gasosa de oxigénio e ozono em altas concentrações, é o método de eleição. Esta técnica proporciona um aumento da reparação tecidular e a eliminação dos microrganismos presentes (Beck et al., 1998).
Por último, a injeção articular apresenta especial destaque no tratamento de sinovites sépticas como vai ser adiante explorado. A injeção do gás realiza-se em concentrações subatmosféricas em afeções articulares crónicas ou agudas. Está indicada para doenças e lesões articulares degenerativas, causadoras de limitações ao movimento, e com uma componente dolorosa limitante, entre outras. Tem sido muito utilizada no tratamento de lesões pós-traumáticas, degenerativas e inflamatórias, assim como, no período pós-cirúrgico (Beck et al., 1998).
1.3.
A
NATOMIA DAS ESTRUTURAS SINOVIAIS DO CAVALO1.3.1.
A
RTICULAÇÕESAs articulações são formadas pela associação de dois ou mais ossos com o intuito de conferir mobilidade ao esqueleto do animal. Para o conseguir contam com a ajuda de outras estruturas como músculos, ligamentos e cápsulas articulares e possuem características fundamentais como: robustez para suportar as forças geradas na locomoção e atividade atlética; lubrificação para conferir, aos ossos por ela formados, um movimento suave e sem fricção; e por último, devem conseguir diminuir as vibrações causadas pelo impacto do casco com o solo (Alves et al., 2018; van Weeren, 2016).
Em termos de classificação podemos dividir, de forma simplificada, as articulações segundo o tipo de tecido que compõe a junção interóssea e segundo a sua função/mobilidade. Quanto ao tecido estrutural a divisão é feita em três grandes grupos: articulações fibrosas, cartilagíneas e sinoviais. Ao contrário das outras, nas articulações sinoviais, não existe
conexão estrutural entre os constituintes ósseos, mas sim o líquido sinovial, a cartilagem hialina que os reveste e a cápsula articular envolvente. A classificação quanto ao grau de movimento permitido pela articulação divide-as em sinartroses, anfiartroses e diartroses (van Weeren, 2016). As diartroses correspondem a todas as articulações do esqueleto apendicular do cavalo e são as que por larga maioria sofrem algum tipo de afeção, e por isso, o estudo anatómico e fisiológico desenvolvido neste trabalho será apenas sobre esta.
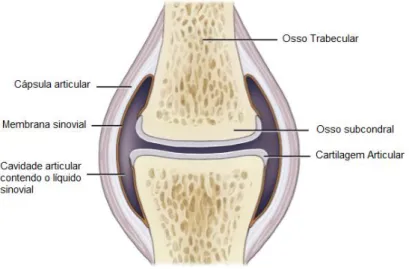
As articulações sinoviais são constituídas por: cartilagem articular, osso subcondral, osso trabecular, líquido sinovial, membrana sinovial e cápsula articular ou outra estrutura que restrinja o líquido sinovial (Figura 3) (Alves et al., 2018; van Weeren, 2016).
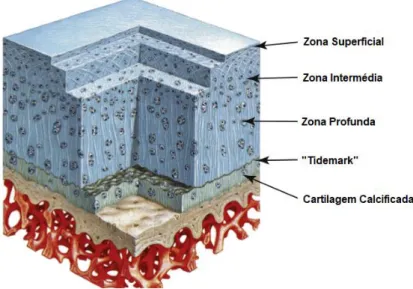
A cartilagem articular recobre a parte terminal do osso e é responsável por formar uma superfície articular resiliente, suave e lubrificada, absorver e transferir impactos compressivos (Alves et al., 2018; Milner et al., 2012; Morris et al., 2002). É uma superfície avascular composta maioritariamente por matriz extracelular (MEC), entre 88% e 99%, e componente celular, 1% a 12%. A MEC apresenta 70% a 80% de água para além de colagénio, sendo mais comum o colagénio tipo 2, e proteoglicanos (PGs), entre outros constituintes minoritários como lípidos, glicoproteínas e minerais. O ácido hialurónico é responsável pela manutenção da coesão de todos estes componentes. A componente celular é composta por condrócitos e uma pequena porção de células progenitoras da cartilagem articular (CPCAs), descobertas recentemente (van Weeren, 2016). Os condrócitos são células maduras, metabolicamente ativas que produzem e mantem a MEC. A cartilagem articular desde a superfície até ao osso subcondral divide-se em quatro zonas distintas, com transições graduais entre as mesmas. As zonas superficial, intermédia e profunda formam a cartilagem hialina que é separada do osso subcondral pela cartilagem calcificada, a última zona (figura 4) (Johnston, 1997; van
Figura 3. Representação esquemática de uma articulação diartroidal (adaptado de van Weeren, 2016).
Weeren, 2016). Na zona superficial os PGs são compostos em grande parte por cadeias laterais de sulfato de condroitina que atuam como uma barreira não seletiva para a entrada de oxigénio e água, e seletiva para a entrada de nutrientes e hormonas. Nas zonas intermédia e profunda a maior concentração de PGs confere grande resistência à aplicação de carga excessiva, existindo ainda, na última zona um tipo de proteoglicano composto por grande quantidade de cadeias laterais de sulfato de queratina, ao contrário da zona superficial, que aumentam a sua permeabilidade, podendo ser importante para permitir a difusão de nutrientes para as camadas mais profundas da cartilagem (Milner et al., 2012). Estudos indicam que a composição da cartilagem articular varia ao longo da vida do animal com especial atenção dada a alterações de celularidade nos primeiros dois anos de vida (MacDonald et al., 2002).
Profundamente à cartilagem calcificada encontramos o osso subcondral, uma camada rígida adjacente ao osso trabecular, cuja espessura varia com a sua localização anatómica e carga que suporta. A rigidez do osso subcondral conciliada com o osso trabecular mais elástico conferem grande adaptabilidade no suporte de carga por parte da articulação. A matriz óssea, ao contrário da cartilagínea, é extremamente vascularizada e enervada permitindo a esta camada reagir, extensivamente, tanto a estímulos patológicos como fisiológicos (Brama et al., 2009; Van Wereen, 2016).
O líquido sinovial é uma substância aquosa secretada pela membrana sinovial, cuja base é o plasma sanguíneo, encontra-se no espaço articular e garante a lubrificação do
Figura 4. Representação esquemática da composição da cartilagem articular sobre o osso subcondral e trabecular (adaptado de van Weeren, 2016).
mesmo, permite a estabilidade e a distribuição das cargas nas superfícies, reduzindo as tensões de contacto (Alves et al., 2018). A membrana sinovial é a responsável por permitir a entrada de eletrólitos e moléculas de pequena dimensão, como glucose e oxigénio, e impedir a entrada de grandes moléculas como as proteínas (Johnston, 1997). Macroscopicamente tem uma coloração amarelada e apresenta grande viscosidade devido ao alto teor em ácido hialurónico. Microscopicamente apresenta baixa celularidade (<500 células/mm3) com
predominância de linfócitos, células mononucleadas e alguns macrófagos. As diferenças de pressão osmótica e hidrostática permitem o processo de filtragem e são influenciadas pela normal locomoção do animal (van Weeren, 2016).
Por fim, a cápsula articular é o revestimento fibroso da cavidade articular que fornece estabilidade à articulação, mantendo a estrutura óssea segura. Esta função é assegurada pela camada fibrosa da cápsula. A outra camada, a membrana sinovial, é constituída pela íntima e sub-íntima. Esta última apresenta-se como extremamente vascularizada e enervada sendo essencial para fazer passar constituintes do plasma, pela muito fina e porosa membrana sinovial até ao interior da articulação e formar o líquido sinovial. Para além desta vertente, a membrana sinovial é composta por sinoviócitos A e B responsáveis pela fagocitose e excreção de proteínas, ácido hialurónico, glicosaminoglicanos, entre outras. Existe também um tipo C que pode diferenciar-se em qualquer um dos outros tipos sendo que todos eles podem produzir citocinas, fatores de crescimento e mediadores inflamatórios (Alves et al., 2018; van Weeren, 2016).
1.3.2.
B
AINHAST
ENDINOSASAs bainhas tendinosas situam-se sobre a superfície de articulações com grande amplitude de movimentos como as bainhas digitais na zona do boleto, as bainhas carpais da zona extensora e flexora do carpo e ainda as bainhas tarsais da zona flexora e extensora do curvilhão. Servem para formar uma superfície lubrificada e proteger o tendão de pressões restritivas e fricções derivadas do movimento articular. De origem mesenquimal, as bainhas tendinosas, tal como as cápsulas articulares são formadas por duas camadas: uma camada fibrosa exterior e uma membrana sinovial interior. Ambas tem uma composição e intervenção na formação do líquido sinovial, que se encontra no interior da bainha, idêntica à cápsula articular como está supramencionado. Além disso, o líquido sinovial é também muito semelhante em ambas as estruturas (Bertone, 1995).
1.4.
F
ISIOPATOLOGIAO correto funcionamento dos compartimentos sinoviais e o cumprimento das suas funções está intimamente ligado à homeostase articular (van Weeren, 2016). Como anteriormente referido, a rotatividade metabólica necessária para a manutenção da homeostase articular é assegurada pela circulação articular e pelas trocas entre o plasma e o fluido sinovial, sendo esta rotatividade dependente da idade do animal, da carga sobre o compartimento sinovial e do seu ambiente (Boere, 2017). No entanto, esta dinâmica é afetada por influências externas que excedam os limites fisiológicos de resposta ou por influências internas que diminuam a capacidade de resposta dos mesmos (de Grauw, 2011). Agressões como traumatismos, inflamação ou infeção levam ao desequilíbrio nos tecidos que levará, por conseguinte, ao desarranjo de todo o ambiente articular (Boere, 2017). Neste momento, ocorre perda de integridade dos tecidos e com isto perda de capacidade biomecânica num ciclo vicioso que leva ao aparecimento de patologias crónicas (van Weeren, 2016). Este mecanismo fisiopatológico é muito semelhante em artrites e tenossinovites sépticas, culminando em danos irreversíveis na cartilagem articular e em formação de fibrose e adesões na bainha tendinosa, respetivamente (Chan & Munroe, 1997).
Em condições normais as propriedades fagocíticas dos sinoviócitos tipo A conjuntamente com a secreção de mediadores inflamatórios e citocinas por parte dos sinoviócitos tipo B impedem a invasão e propagação microbiana. O dano sinovial, a virulência e a patogenicidade do microrganismo e o número de microrganismos inoculados contribuem para a possível superação dos mecanismos de defesa do tecido sinovial. Ocorre então uma resposta inflamatória aguda por parte dos sinoviócitos tipo B que produzem mediadores inflamatórios, enzimas e radicais livres promovendo o aumento da permeabilidade vascular, e consequente, passagem de fibrina, macrófagos e neutrófilos para o compartimento articular. Para além da fagocitose, os neutrófilos libertam diversas substâncias como os radicais livres, a catepsina G, a colagenase, a elastase, a lisozima e a gelatinase. Os proteoglicanos, o ácido hialurónico e o colagénio são clivados pelos radicais livres, ao passo que, as interleucinas (IL) 1 e 6 e o fator de necrose tumoral (TNF) α são produzidos por condrócitos e sinoviócitos ativados pelos mediadores inflamatórios. Para concluir a cadeia, a IL-1 e o TNF-α desencadeiam a produção de metaloproteinases da matriz (MMP) por parte dos condrócitos, sinoviócitos, macrófagos, fibroblastos, osteoblastos e células endoteliais (Ludwig & van Harreveld, 2018).
A cadeia inflamatória, em cima resumida, é uma rede complexa, não específica e bem orquestrada de respostas e reações desencadeadas por qualquer tipo de agressão, como por exemplo a bacteriana. Esta, inicia-se na membrana sinovial onde ocorre uma mudança nas
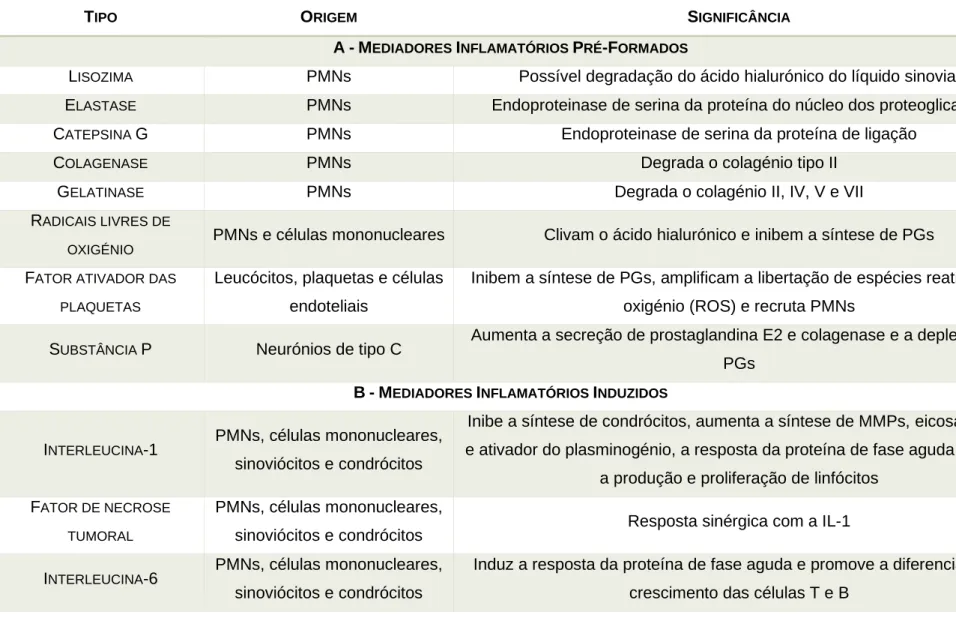
proporções de sinoviócitos, com aumento do tipo B, acompanhada por uma disrupção da barreira espaço sinovial/ sangue, que leva ao aumento da produção e secreção de polipéptidos no espaço articular assim como de mediadores inflamatórios inespecíficos. A permeabilidade e diâmetro da microvasculatura sinovial sofrem alterações devido a alguns destes mediadores, como as prostaglandinas e bradicinina, que levam ao rápido aumento de celularidade do líquido sinovial pelo aumento abrupto de monócitos, e sobretudo, neutrófilos que passam a ser as células predominantes do mesmo (de Grauw, 2011; Palmer & Bertone, 1994). Seguidamente, os produtos derivados dos leucócitos estimulam os macrófagos, condrócitos e sinoviócitos a produzir mais mediadores inflamatórios numa cascata de sobrerregulação cujos efeitos nocivos para a articulação dependem da concentração e atividade de inibidores de destruição da MEC como a macroglobulina α-2, produzida pelo fígado, e dos inibidores tecidulares das MMPs (Inibidores teciduais das metaloproteinases da matriz-TIMPs) que bloqueiam a ação de enzimas ativadas e ainda previnem a ativação das proenzimas. Entre estes dois inibidores os TIMPs apresentam especial importância pois o elevado tamanho da molécula de macroglobulina α-2 restringe a sua atividade na densa matriz cartilagínea (Palmer & Bertone, 1994). Para repor a homeostase o organismo produz proteínas da fase aguda, como a SeroAmiloide A (SAA) equina, que serão abordadas na secção de diagnóstico (Jacobsen & Andersen, 2010). Os mediadores inflamatórios podem dividir-se em dois grupos, pré-formados e induzidos, como se apresenta resumido na tabela 1. Os mediadores inflamatórios pré-formados são libertados pelos grânulos dos leucócitos, sobretudo células polimorfonucleadas (PMNs). Resultante da sua interação com o endotélio, com a membrana sinovial e com a cartilagem articular resulta a libertação de enzimas e mediadores inflamatórios pelos grânulos primários e secundários (ver tabela1). Devido ao seu elevado tamanho estas moléculas não conseguem penetrar na cartilagem articular, degradando apenas a superfície da mesma. Por conseguinte, este grupo de mediadores, apresenta o seu maior efeito ao nível do fluído sinovial com a degradação do ácido hialurónico pela clivagem dos proteoglicanos. Esta acontece por ação da lisozima e pela inibição da síntese de proteoglicanos e inativação dos inibidores das protéases de serina (macroglobulina α-2 e antiprotease alfa-1). A referida inativação é efetuada pelos radicais livres de oxigénio formados nas membranas das PMNs e monócitos (Palmer & Bertone, 1994).
Tabela 1 - Mediadores e Inibidores da inflamação articular (adaptado de Palmer e Bertone, 1994).
TIPO ORIGEM SIGNIFICÂNCIA
A-MEDIADORES INFLAMATÓRIOS PRÉ-FORMADOS
LISOZIMA PMNs Possível degradação do ácido hialurónico do líquido sinovial
ELASTASE PMNs Endoproteinase de serina da proteína do núcleo dos proteoglicanos
CATEPSINA G PMNs Endoproteinase de serina da proteína de ligação
COLAGENASE PMNs Degrada o colagénio tipo II
GELATINASE PMNs Degrada o colagénio II, IV, V e VII
RADICAIS LIVRES DE
OXIGÉNIO PMNs e células mononucleares Clivam o ácido hialurónico e inibem a síntese de PGs FATOR ATIVADOR DAS
PLAQUETAS
Leucócitos, plaquetas e células endoteliais
Inibem a síntese de PGs, amplificam a libertação de espécies reativas de oxigénio (ROS) e recruta PMNs
SUBSTÂNCIA P Neurónios de tipo C Aumenta a secreção de prostaglandina E2 e colagenase e a depleção de PGs
B-MEDIADORES INFLAMATÓRIOS INDUZIDOS
INTERLEUCINA-1 PMNs, células mononucleares, sinoviócitos e condrócitos
Inibe a síntese de condrócitos, aumenta a síntese de MMPs, eicosanoides e ativador do plasminogénio, a resposta da proteína de fase aguda e ainda
a produção e proliferação de linfócitos FATOR DE NECROSE
TUMORAL
PMNs, células mononucleares,
sinoviócitos e condrócitos Resposta sinérgica com a IL-1
INTERLEUCINA-6 PMNs, células mononucleares, sinoviócitos e condrócitos
Induz a resposta da proteína de fase aguda e promove a diferenciação e crescimento das células T e B
FATOR DE CRESCIMENTO FIBROBLÁSTICO
PMNs, células mononucleares, sinoviócitos e condrócitos
Estimula a proliferação dos fibroblastos e promove a síntese de MMPs e TIMP-1
FATOR DE CRESCIMENTO TRANSFORMADOR
PMNs, células mononucleares, sinoviócitos e condrócitos
Contraria o efeito de IL-1, aumenta a fibrogénese e atrai PMNs e fibroblastos
FATOR DE CRESCIMENTO SEMELHANTE À INSULINA
PMNs, células mononucleares,
sinoviócitos e condrócitos Aumenta a síntese da matriz e diminui a degradação dos PGs INTERFERÃO γ e α PMNs, células mononucleares,
sinoviócitos e condrócitos Modula o efeito de diversas citocinas PROSTAGLANDINA E2 PMNs, células mononucleares,
sinoviócitos e condrócitos
Inibe a síntese de condrócitos, aumenta a permeabilidade vascular e a vasodilatação
MMP-3 Condrócitos Ativa a colagénese e cliva agregados de PGs
MMP-1 Condrócitos Cliva colagénio tipo I, II e III
MMP-2 Condrócitos Cliva colagénio tipo IV
PUMP-1 Condrócitos Cliva PGs e a antiprotease-α1
C-INIBIDORES INFLAMATÓRIOS
MACROGLOBULINA- α2 Plasma Inibidor de proteinases de serina
ANTIPROTEASE- α1 Plasma Inibidor de proteinases de serina
TIMP-1 E TIMP-2 Osso, cartilagem, macrófagos e
fibroblastos Inibidor de MMPs INIBIDOR DO ATIVADOR DE PLASMINOGÉNIO (PAI)-1 E PAI-2 Macrófagos, fibroblastos e células endoteliais
Inibidor do ativador de uroplasminogénio e do ativador do plasminogénio de tecido
Por outro lado, os mediadores inflamatórios induzidos são os principais responsáveis pelas alterações na cartilagem articular (Palmer & Bertone, 1994). Em condições normais o equilíbrio da MEC é mantido pelas ações, opostas, das MMPs e TIMPs. Deste modo, as MMPs são responsáveis por clivar o colagénio, especialmente o de tipo II (MMP-1,8 e sobretudo MMP-13) e os PGs (MMP3,2 e 9) e a sua ação é regulada pela transcrição da sua produção, por certas citocinas que impedem a sua ativação e pelos TIMPs que formam agregados com estas, desativando-as (van Weeren, 2016). Além disso, as citocinas catabólicas, especialmente a IL-1, aumenta a produção de MMPs e são contrapostas por fatores de crescimento com ação anabólica como o fator de crescimento transformador beta (TGF-β). Resumidamente, o TGF-β estimula a síntese de proteoglicanos e a expressão do colagénio, além de inibir a produção de enzimas degradadoras da MEC contrariando assim o efeito da IL-1 (Palmer & Bertone, 1994; van Weeren, 2016). Deste modo, aquando duma agressão, a resposta inflamatória aguda e o infiltrado celular e mediadores inflamatórios dela resultante estimulam a produção de citocinas por parte dos sinoviócitos, macrófagos ativados, condrócitos articulares e células do tecido de conexão, agravando a inflamação e desregulando o equilíbrio metabólico da MEC. A citocina mais estudada é a IL-1 conhecida por causar alterações metabólicas nos condrócitos, sinoviócitos, fibroblastos e osteoblastos; induzir a síntese de MMPs neutras, eicosanóides, ativadores de plasminogénio e proteínas de fase aguda; inibir a produção de colagénio, macromoléculas da MEC e PGs; e ainda de ativar e aumentar a proliferação de linfócitos. Todo este ambiente de estimulação celular gerado leva ao aparecimento de outros mediadores inflamatórios (tabela 1), como o TNF-α, que levam à rutura do equilíbrio entre MMPs e TIMPs. O TNF-α, a IL-1 e as MMPs formam uma importante cadeia inflamatória prejudicial para a cartilagem. Inicialmente o TNF-α, por via do aumento da afinidade das células endoteliais vasculares para os leucócitos, atrai para a cavidade sinovial monócitos e neutrófilos, aumenta as concentrações de IL-1 e outras citocinas, e ainda aumenta a produção de MMPs por parte de condrócitos e células sinoviais. A principal fonte de TNF-α intra-articular parecem ser os sinoviócitos tipo A e outras células da membrana sinovial, ao contrário dos monócitos e PMNs. Seguidamente acontece o aumento de IL-1 e com ele o aumento de MMPs, como supracitado, num ciclo interminável e de elevada destruição cartilagínea que aumenta a fragilidade da mesma e altera os mecanismos reparativos dos condrócitos, especialmente em casos de sinovites recorrentes (Billinghurst et al, 1995; deGrauw, 2011; Jouglin et al, 2000; Palmer & Bertone, 1994; Palmer et al, 1996; van Weeren, 2016).
Como já foi referido anteriormente, o ozono, quando em contacto com os fluidos biológicos desencadeia uma série de cascatas de resposta afetando vários sistemas, como o imunológico. A ativação da proteína de choque térmico 70 é responsável pelo estímulo de
várias respostas por parte do sistema imunitário, entre elas o aumento de linfócitos e macrófagos. Para além disto, o H2O2 e outros compostos de peroxidação, difundem-se nas
células imunes e agem como reguladores na transdução de sinais promovendo alterações em várias citocinas inflamatórias. Assim, as alterações na produção de citocinas inflamatórias, juntamente com o reequilíbrio do sistema redox (já abordado anteriormente) desempenham um papel fulcral no controlo inflamatório, e consequente dano articular causado pela inflamação do componente sinovial (Smith et al., 2017; Vaillant et al., 2013; Vendruscolo et al., 2018).
Teoricamente, as ROS e os LOPs são responsáveis, em particular, por duas reações sobre o líquido sinovial. Para começar, ao nível do reequilíbrio redox, ocorre ainda, um aumento das enzimas antioxidantes, da enzima HO-1, de citocinas inibitórias como a IL-4 e IL-10, de TGF-β (por ação do H2O2, segundo Smith et al., 2017), assim como, uma regulação
da produção de NO, que estimula a formação de citocinas inflamatórias. Em consequência ocorre uma importante promoção da reparação articular através da estimulação da produção de condrócitos, fibroblastos, proteoglicanos, glicosaminoglicanos e colagénio (Vaillant et al., 2013; Vendruscolo et al., 2018). Seguidamente, através da depleção da fosfolipase A2, da
cicloxigenase 1 e 2 e da bradicinina, verifica-se uma redução dos níveis de prostaglandinas e outras citocinas inflamatórias. Do mesmo modo, advém a queda da produção de MMPs e serotonina. Estas respostas contribuem para a inibição da inflamação e prevenção da degradação da cartilagem articular. Vários estudos comprovam, após tratamento com administração de O3 intra-articular a diminuição, na análise ao fluído sinovial, de diversas
citocinas pró-inflamatórias como o TNF-α, a IL-1β e a IL-6. Assim como, do recetor 2 para o TNF-α que contrariamente ao recetor 1 não se encontra em todas as células, mas apenas nas imunológicas. Note-se que, os níveis séricos das mesmas moléculas permanecem em níveis normais revelando a segurança da ozonoterapia quanto a possíveis efeitos sistémicos indesejados. Pensa-se que um dos mecanismos por detrás do efeito modulador da inflamação da molécula de O3, seja uma interação imunológica específica nos sinoviócitos que impede a
1.5.
E
TIOLOGIAO desenvolvimento de qualquer sinovite séptica envolve a contaminação por agentes patogénicos que podem invadir o compartimento sinovial através de feridas penetrantes adjacentes ou comunicantes com o mesmo, contaminação derivada de procedimentos cirúrgicos, falha na assepsia em injeções intra-articulares, e ainda, por disseminação bacteriana hematogénica principalmente em equinos jovens com menos de seis meses de idade, afetando na maior parte das vezes múltiplas articulações (Lugo, 2015; Schneider et al., 1992; Tremaine, 2000). Relativamente aos indivíduos jovens os microrganismos mais comumente encontrados são as enterobactérias, especialmente a Escherichia coli, sendo os locais típicos de infeção primária os pulmões e os tecidos umbilicais remanescentes. Podem também ser encontrados outros agentes como Salmonella spp, Klebsiella spp, Streptococcus spp, Staphylococcus spp e Rhodococcus equi (Lugo, 2015; Lugo & Gaughan, 2006). Apesar da sua componente multiarticular, as articulações mais comummente afetadas são a tarsocrural seguindo-se pelo boleto, carpo, femuropatelar e interfalangeana proximal. As infeções de bainhas tendinosas são menos comuns em neonatos (Tremaine, 2000).
Por outro lado, quando se trata de equinos adultos esta afeção afeta maioritariamente apenas uma estrutura sinovial, principalmente as articulações do boleto, carpo, tarsocrural e femuropatelar, assim como, as bainhas digitais, do carpo e do tarso (Tremaine, 2000). De um modo geral as infeções sinoviais são provocadas mais frequentemente por espécies Gram-positivas, em especial do género Staphylococcus spp. e Streptococcus spp., seguindo-se as espécies Gram-negativas, sendo a Escherichia coli e outras enterobactérias as mais comuns, e por último as bactérias do género Pseudomonas spp. (Gilbertie et al., 2018; Robinson et al., 2016). Existem certos fatores de risco que aumentam a probabilidade de contaminação como contaminação fecal, especialmente na zona mais distal dos membros, ambiental como poeiras ou detritos vegetais, e biológica como por exemplo por insetos (Orsini, 2017). As feridas sobre os compartimentos sinoviais originam normalmente infeções bacterianas mistas (apesar de um dos microrganismos poder estar em maior número) constituídas principalmente por agentes, comensais da pele do animal e do ambiente, anaeróbios, como as enterobactérias, Pseudomonas spp, Staphylococcus aureus e outros Staphylococcus spp, mas também por outras bactérias gram-negativas e gram-positivas como Streptococcus spp, Escherichia coli, Salmonella spp e Corynebacterium pseudotuberculosis. As infeções fúngicas podem existir, mas são raras. As estruturas sinoviais mais afetadas por infeções derivadas de feridas são, por ordem decrescente de incidência, o boleto, as bainhas tendinosas, o tarso, a articulação interfalangeana distal, a bursa do navicular, o carpo, a articulação femuropatelar e a articulação interfalangeana proximal (Ludwig & van Harreveld, 2018; Lugo, 2015).
Do mesmo modo, pode ocorrer infeção após injeção intra-articular de corticosteroides, ácido hialurónico, anestésicos locais, entre outros. Neste tipo de contaminação os agentes mais comuns são os estafilococos especialmente o Staphylococcus aureus (Bertone, 1999; Tremaine, 2000). As cirurgias endoscópicas como a tenoscopia e artroscopia, são também, situações de risco para o desenvolvimento deste tipo de infeção. Estudos revelam que, em artroscopias, a articulação femuropatelar apresenta maior incidência de desenvolvimento de artrite principalmente porque nesta articulação a incisão é de maior dimensão. O tamanho da incisão está diretamente relacionado com o aumento do risco de infeção pós-operatório, com incisões grandes (>40mm) a apresentarem maior incidência de artrite pós-cirúrgica que as médias (20-40mm) ou as pequenas (<20mm). Esta tendência parece estar associada ao maior grau de manipulação e disrupção de tecidos moles, maior produção e acumulação de fluidos subcutâneos e mais movimentos de entrada e saída dos instrumentos pelo portal. Outro fator de risco seria a proximidade das articulações do membro distal ao solo, que aumentaria a possibilidade de contaminação, mas, fatores como a dificuldade de realização de bandagens nas articulações proximais do membro e, como supracitado, a maior complexidade das cirurgias, parecem ultrapassar este fator sendo precisamente nestas articulações onde existe maior frequência de artrites pós-cirúrgicas (Brunsting et al., 2018). As cirurgias à bainha cárpica, apresentam maior probabilidade de contrair infeção que as outras estruturas sinoviais. O aumento está, provavelmente, associado às lesões encontradas na bainha do carpo que podem exigir um maior grau de rutura dos tecidos moles do que em outras estruturas sinoviais o que a torna mais propensa a extravasamento e hemorragia durante a cirurgia, assim como, à proximidade entre as incisões da pele e sinovial. Concluindo, as dificuldades de realização de bandagens, proximidade com o solo e tempo de recuperação pós-anestésica são fatores em tudo semelhantes aos supracitados para as articulações e são, do mesmo modo, ultrapassados pelos fatores envolvendo a técnica cirúrgica em si (Hawthorn et al., 2016).
1.6.
D
IAGNÓSTICOO diagnóstico precoce de sinovites sépticas é de grande importância no tratamento e prognóstico desta afeção. Para a sua realização são imprescindíveis uma história clínica detalhada, um exame físico completo e uma cuidadosa apreciação dos sinais clínicos como claudicação, calor, efusão e dor à palpação e/ou flexão (Bertone, 1995; Joyce, 2007; Ludwig & van Harreveld, 2018; Lugo, 2015; Lugo & Gaughan, 2006).
1.6.1.
S
INAIS CLÍNICOS/
E
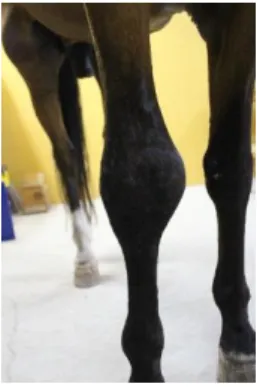
XAME FÍSICOSendo as sinovites sépticas uma doença de evolução extremamente rápida, os respetivos sinais devem ser encarados como uma emergência e o diagnóstico definitivo ser estabelecido o mais rápido possível, com o intuito de instaurar uma terapia adequada e agressiva o mais rapidamente possível, visto que melhorará o prognóstico. Inicialmente deve realizar-se uma boa história clínica do animal para tentar apurar a fonte e a duração da lesão. Seguidamente deve ser realizado um exame físico completo, sistemático e minucioso onde a efusão do compartimento sinovial, dor e calor à palpação e dor à manipulação e flexão articular são sinais clássicos que devem levantar desde logo suspeita (Joyce, 2007; Ludwig & van Harreveld, 2018). A claudicação pode variar de inexistente até muito acentuada, sem apoio do membro em apenas 24 horas. O grau de claudicação depende de vários fatores como a duração da lesão, administração de analgésicos e, principalmente, se o compartimento sinovial consegue ou não drenar o conteúdo resultante da inflamação. Em particular, se o compartimento sinovial se encontra aberto e a drenar o conteúdo, a claudicação será mínima ou inexistente, caso contrário ocorre aumento da pressão intrassinovial, hipersensibilidade da membrana sinovial e inflamação do tecido mole circundante que causará dor extrema ao animal com claudicação sem apoio do membro, nos piores casos (Ludwig & van Harreveld, 2018). A drenagem ocorre, normalmente, na abertura do compartimento para o exterior (ex. ferida) ou caso esta não exista, num espaço anatómico não confinado, como por exemplo entre as constrições causadas pelos ligamentos anular digital proximal e distal ou na bolsa proximal aos mesmos, nas bainhas digitais (Bertone, 1995). A claudicação tende a não se manifestar imediatamente (primeiras 6-8 horas) pois ainda não ocorreu o estabelecimento da infeção. Durante o exame físico deve-se observar se existe sangue ou exsudado na região do compartimento sinovial e a presença de celulite, hematoma ou edema na região. A palpação deve ser bilateral para se conseguir comparar se existe ou não efusão sinovial, que pode ser devida a edema dos tecidos peri-sinoviais afetados ou a acumulação de fluido nos espaços sinoviais. Por outro lado, se a sinovite for crónica a
palpação revela aumento de espessura, fibrose e diminuição da elasticidade (Bertone, 1995; Joyce, 2007; Ludwig & van Harreveld, 2018; Lugo, 2015; Tremaine, 2000). Em relação aos parâmetros vitais existe grande variância com a possível ocorrência de taquicardia e taquipneia devido ao grande nível de dor que pode estar associado. Do mesmo modo as análises sanguíneas não apresentam, na grande maioria dos casos, alterações dignas de registo, podendo apenas existir aumento do número de células brancas totais, neutrofilia moderada e hiperfibrinogenemia moderada. A leucocitose é mais comum em equinos jovens e deve proceder-se à quantificação plasmática de gamaglobulinas e cultura sanguínea sempre que estes apresentem sinais de septicemia (Joyce, 2007; Tremaine, 2000). Em feridas deve realizar-se palpação do interior da ferida que se inicia com tricotomia da região, evitando contaminação, e remoção dos exsudados e tecido morto. Em seguida realiza-se a assepsia da zona com solução antisséptica e lavagem agressiva com soro salino fisiológico sobre pressão para diminuir o número de bactérias e o risco de contaminação. Depois de colocar uma luva estéril efetua-se a avaliação digital, ou com sonda estéril maleável caso a dimensão da lesão assim o exija, da profundidade da ferida, exposição e condição dos tecidos sinoviais, presença de corpos estranhos e envolvimento ósseo. Para finalizar, e aumentar a fiabilidade da decisão, pode proceder-se, evitando zonas inflamadas, à inoculação de soro salino fisiológico no compartimento sinovial e averiguar se o mesmo extravasa pela lesão ou provoca distensão sinovial (Joyce, 2007; Ludwig & van Harreveld, 2018; Lugo, 2015).
1.6.2.
R
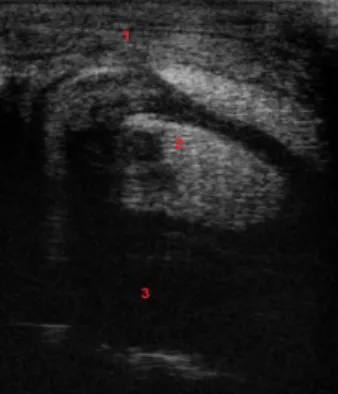
ADIOGRAFIAUma avaliação radiográfica completa, apesar de não confirmar o diagnóstico de espaço sinovial infetado, apresenta grande utilidade na avaliação dos tecidos envolventes, da existência de trajetos de drenagem ou do envolvimento de uma ferida com a estrutura sinovial, principalmente as radiografias com contraste. O exame radiográfico permite visualizar a presença de sinais de envolvimento ósseo e dano osteocondral como fraturas ósseas, osteomielite, osteoartrite ou osteíte (Bertone, 1995; Ludwig & van Harreveld, 2018). Em particular, nas sinovites sépticas, é mais importante averiguar os tecidos moles envolventes na procura de sinais como presença de ar e/ou tumefação dos mesmos, corpos estranhos, aderências ou massas na bainha tendinosa, ou ainda, avaliação do tamanho dos tendões e da ocorrência de desmites e ou constrições, especialmente dos ligamentos anulares. Os danos nos tecidos moles são visualizados preferencialmente com uma projeção latero-medial (Vanderperren & Saunders, 2009). A fim de aumentar e melhorar a informação adquirida é aconselhada a introdução de um meio de contraste no compartimento sinovial, pois permite aferir sobre a integridade da membrana e cápsula sinovial (figura 5) (Bryant et al., 2019).
Segundo Bryant et al. a radiografia por contraste positivo figura-se como um meio de diagnóstico com baixa sensibilidade (59,1%), e por isso sujeita a um elevado número de falsos negativos inviabilizando o seu uso isolado, mas com maior especificidade que a torna indicada para confirmar a positividade do diagnóstico e evitar cirurgias desnecessárias realizadas no tratamento de sinovites não sépticas (Bryant et al., 2019).
1.6.3.
E
COGRAFIAA ecografia é uma técnica imagiológica de grande valor na averiguação do estado de articulações, bainhas tendinosas e bursas articulares (Ludwig & van Harreveld, 2018). De um modo geral, são avaliados o envolvimento dos tecidos moles circundantes, o grau de inflamação/efusão sinovial, a existência de corpos estranhos, a comunicação de feridas com compartimentos sinoviais e a qualidade do líquido sinovial. Os sinais ecográficos principais indicativos de sinovite séptica são a efusão sinovial marcada com presença de partículas hiperecoicas em suspensão (figura 6C), espessamento da membrana sinovial (figura 6A e B) com aspeto edematoso marcado a moderado, presença de fibrina intrassinovial, fluido sinovial Figura 5. Avaliação da comunicação entre ferida e compartimento sinovial recorrendo a radiografia de contraste positivo. A- Infusão de meio de contraste em ferida caudal à tíbia e proximal ao tarso de equino; B- Infusão de meio de contraste diretamente na estrutura sinovial (adaptado de Ludwig & van Harreveld, 2018).
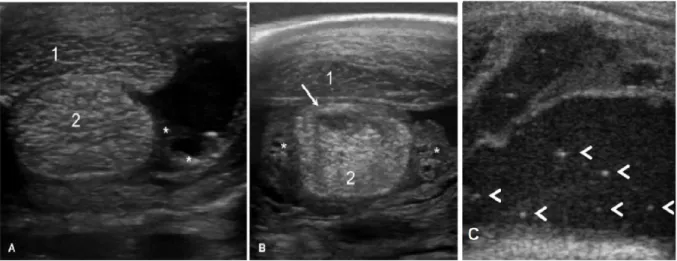
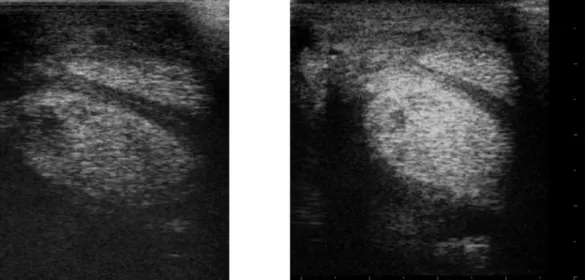
espessado com aspeto celular hipoecogenico/ecogenico (figura 6A), áreas hiperecoicas focais e espessamento da cápsula articular. As partículas hiperecoicas referidas podem, por exemplo, ser relativas a ar vindo do exterior pela comunicação com uma ferida ou produzido por bactérias, e ainda, detritos cartilagíneos. Relativamente à fibrina depositada esta está diretamente relacionada com o grau de contaminação e inflamação do sinovio. De todos os sinais supracitados, a efusão e espessamento sinovial, e o aspeto celular do líquido sinovial apresentam, em particular, grande valor diagnóstico na diferenciação entre sinovite séptica e sinovite transiente. Do mesmo modo, a existência de uma ferida comunicante ou de um trato de drenagem do compartimento sinovial afetado poderá influenciar o grau de efusão, pois o líquido sinovial pode estar a extravasar do respetivo espaço intrassinovial (Beccati et al., 2015). No caso particular das bainhas tendinosas a ecografia permite também avaliar possíveis danos nos tendões existentes (figura 6C) como espessamentos, ruturas, lesões focais e aderências à bainha. O espessamento do tecido subcutâneo e a presença de massas sinoviais e detritos sinoviais ecogénicos são também achados comuns em ecografia de bainhas tendinosas (Vanderperren & Saunders, 2009).
Figura 6. A- Imagem ecográfica transversal sem utilização de "standoff pad" do aspeto palmar do metatarso distal de cavalo com sinovite séptica da bainha do tendão flexor digital. Presença de espessamento moderado da membrana sinovial (asterisco) e efusão marcada com fluido sinovial anecogenico; B- Imagem ecográfica transversal com utilização de "standoff pad" do aspeto palmar do metatarso distal de cavalo com sinovite séptica da bainha do tendão flexor digital. Espessamento sinovial marcado (asterisco) e lesão hipoecogenica plantar no tendão flexor digital profundo; C- Imagem ecográfica longitudinal do aspeto dorso-medial da articulação tarsocrural com artrite séptica. Presença de acentuado grau de efusão sinovial com líquido sinovial ecogenico e partículas hiperecogenicas (setas); 1- Peroneus tertius; 2- Musculo extensor digital longo; 3- Tendão flexor digital superficial; 4- Tendão flexor digital profundo (adaptado de Beccati et al., 2015).
1.6.4.
A
NÁLISE DO LÍQUIDO SINOVIALA análise do líquido sinovial é a ferramenta mais importante e útil no diagnóstico de sinovites infeciosas. Fornece informações valiosas sobre a inflamação e distingue entre sinovites sépticas e sinovites não sépticas. Apresenta na variabilidade individual de valores e na ocorrência de, em cultura bacteriológica, um número de falsos negativos relativamente elevado, os principais desafios na chegada a um diagnóstico definitivo (Ludwig & van Harreveld, 2018; Steel, 2008). A sua recolha deve ser efetuada de forma asséptica e sempre o maior volume possível pois não só drena a estrutura sinovial, como também permite recolher quantidade suficiente para a realização de todos os testes e ainda cultura bacteriana, que é de grande importância e conveniência. O animal não deve ter recebido qualquer tratamento antibiótico ou anti-inflamatório antecedente à recolha pois irá influenciar e alterar os resultados da mesma, assim como, diminuir a probabilidade de uma cultura positiva (Bertone, 1995).
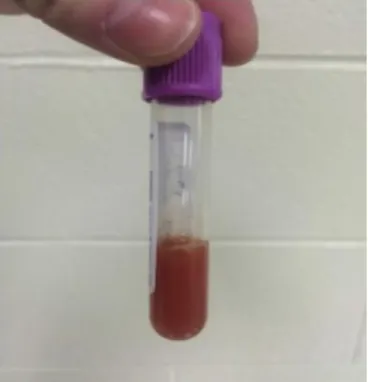
Macroscopicamente devemos avaliar o fluido sinovial pela sua viscosidade, turbidez e presença de detritos e sangue. Com efeito, o líquido normal apresenta uma coloração transparente a amarela pálida, elevada viscosidade e não apresenta fibrina, coágulos ou outro tipo de detritos. A inflamação sinovial leva a que o líquido sinovial se apresente com turbidez aumentada devido ao aumento da celularidade, viscosidade diminuída pela clivagem do ácido hialurónico (teste da qualidade precipitante da mucina), e ainda contendo fibrina e aglomerados celulares, assim como apresentar-se sanguinolento devido a trauma e disrupção da membrana sinovial (figura 7) (Bertone, 1995; Ludwig & van Harreveld, 2018). As sinovites inflamatórias, não infeciosas, como por exemplo por reação a injeções intra-articulares, causam alterações semelhantes no líquido sinovial sendo por isso necessária a sua avaliação microscópica a parâmetros como contagem de células nucleadas totais, proteínas totais, pH, lactato e diferença entre glicose sanguínea e sinovial, assim como realização de citologia e cultura bacteriana (Ludwig & van Harreveld, 2018).
Figura 7. Fluido sinovial séptico. Aparência serosanguinolenta, opaca e túrbida (adaptada de Ludwig & van Harreveld, 2018).