GUSTAVO SILVEIRA BREGUEZ
SÍNTESE DE PEPTÍDEOS RICOS EM PROLINA E ARGININA E ATIVIDADE INIBITÓRIA SOBRE O COMPLEXO PROTEOLÍTICO PROTEASSOMA 20S DE
MAMÍFEROS E DO PARASITO Schistosoma mansoni
UNIVERSIDADE FEDERAL DE OURO PRETO INSTITUTO DE CIÊNCIAS EXATAS E BIOLÓGICAS
DEPARTAMENTO DE CIÊNCIAS BIOLÓGICAS PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA
SÍNTESE DE PEPTÍDEOS RICOS EM PROLINA E ARGININA E ATIVIDADE INIBITÓRIA SOBRE O COMPLEXO PROTEOLÍTICO PROTEASSOMA 20S DE
MAMÍFEROS E DO PARASITO Schistosoma mansoni
AUTOR: Gustavo Silveira Breguez
ORIENTADOR: Prof. Dr. Milton Hércules Guerra de Andrade COORIENTADOR: Prof. Dr. William de Castro Borges
Ouro Preto – MG, março de 2012
ii
Este trabalho foi realizado no LABORATÓRIO DE ENZIMOLOGIA E
PROTEÔMICA – ICEB/NUPEB/UFOP, com auxílio da Coordenadoria de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Fundação
de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e
iii
Dedico esta dissertação aos
meus pais, fontes de força, amor,
carinho e apoio incondicional
iv
“Loucura é fazer a mesma coisa
e esperar um resultado diferente.”
v AGRADECIMENTOS
À Deus, pelo privilégio de alcançar mais essa conquista.
Aos meus pais, Geraldo e Marúcia, pelo amor, carinho e por toda
a dedicação. Obrigado por serem exemplos de pessoas dignas e
honestas, por me transmitirem os melhores valores e abrirem mão de
seus planos para a realização dos meus objetivos.
Às minhas irmãs, Gerúcia e Michele, e minha sobrinha Milena
pelo companheirismo, apoio e amizade ao longo dessa jornada.
À todos familiares, que mesmo distantes, sempre estiveram ao
meu lado.
Ao Prof. Dr. Milton Hércules Guerra de Andrade, pela confiança
depositada durante o desenvolvimento do mestrado. Obrigado pela
orientação e por todo o aprendizado.
Ao Prof. Dr. William de Castro Borges, pela coorientação e por
todos os ensinamentos. Obrigado por ser sempre solícito, paciente e
disposto a colaborar para a finalização deste trabalho.
Aos amigos/irmãos da gloriosa República Cruz Vermelha, por
fazerem parte do meu crescimento pessoal e minha formação
profissional nesses 7 anos (bem) vividos em Ouro Preto. Aos
cruzvermelhanos Katatau, Mr. Bin e Tomeli pela amizade durante a
convivência diária na república.
À Karina (LEP), que apesar de sermos apenas “colegas de trabalho”, mostrou-se ser uma grande amiga, suportando as minhas conversas e meus repetidos desabafos. Obrigado pelos inúmeros
vi
Aos demais amigos do laboratório, principalmente aqueles os
quais mais convivi (Jonathan, Igor, Marina, Lorran, Leandro, André,
Simone, Aline). Obrigado pelas conversas, risadas e festas (“poucas, é verdade”), por todo o auxílio e incentivo para o término dessa
dissertação.
Ao nosso técnico, José Henrique Braga Fortes, muito obrigado
por toda a ajuda e conselhos, principalmente nos momentos mais
difíceis desse mestrado.
À toda equipe do Laboratório de Caracterização Molecular da
UFOP, pela disponibilização de equipamentos e auxílio na execução de
alguns experimentos.
Aos laboratórios do NUPEB, pela permissão e ajuda no uso de
diversos aparelhos.
Por fim, agradeço a todos que de maneira direta ou indireta
vii ÍNDICE
Resumo...ix
Abstract...x
Lista de abreviaturas...xi
Lista de figuras...xiii
Lista de tabelas...xiv
1. Introdução...2
1.1. Proteólise intracelular...2
1.2. O complexo proteolítico proteassoma 20S...3
1.3. Reguladores do proteassoma 20S...5
1.4. Inibidores do proteassoma...9
1.5. O proteassoma em Schistosoma mansoni....12
1.6. Peptídeos ricos em prolina e arginina: PR-39 e análogos...14
1.7. Síntese de peptídeos em fase sólida (SPFS)...17
2. Justificativa...22
3. Objetivos...24
3.1. Objetivo geral...24
3.2. Objetivos específicos...24
4. Materiais e métodos...26
4.1. Síntese de peptídeos...26
4.1.1. Ativação da resina...26
4.1.2. Ativação e adição dos aminoácidos a serem acoplados...27
4.1.3. Clivagem do peptídeo...28
4.1.4. Ciclização dos peptídeos contendo cisteína...28
4.1.5. Purificação dos peptídeos por cromatografia de fase reversa em sistema HPLC...29
4.1.6. Caracterização dos peptídeos por espectrometria de massas LCMS-IT-TOF electrospray....29
4.2. Extração de proteínas solúveis...30
viii
4.2.2. Eritrócitos humanos...30
4.2.3. Vermes adultos do parasito Schistosoma mansoni...31
4.3. Cromatografia de filtração molecular em Sephacryl S-400...32
4.3.1. Identificação das frações enriquecidas com o proteassoma 20S pela medida da atividade quimotripsina-símile...33
4.4. Eletroforese unidimensional em gel de poliacrilamida (SDS-PAGE)...33
4.5. Obtenção de soro policlonal para a detecção de subunidades α do proteassoma 20S...34
4.6. Western Blotting...35
4.7. Ensaios de atividade peptidásica com os inibidores sintetizados...35
4.8. Análise estatística...36
5. Resultados e discussão...38
5.1. Síntese de peptídeos...38
5.1.1. Síntese em fase sólida e purificação em sistema HPLC...38
5.1.2. Caracterização dos peptídeos por espectrometria de massas...44
5.2. Identificação das frações enriquecidas com o proteassoma 20S submetidas à cromatografia de filtração molecular em Sephacryl S-400...45
5.2.1. Ensaios de atividade peptidásica quimotripsina-símile...45
5.2.2. Análise dos perfis proteicos e ensaios de Western Blotting...48
5.3. Medida da atividade peptidásica com os inibidores PR-11 e análogos...50
5.3.1. Avaliação da atividade quimotripsina-símile...50
5.3.1.1. Proteassoma 20S de camundongos e humanos...51
5.3.1.2. Proteassoma 20S de vermes adultos de S. mansoni...52
5.3.2. Avaliação da atividade tripsina-símile...52
6. Conclusões...56
7. Perspectivas...58
8. Referências bibliográficas...60
ix RESUMO
O proteassoma tem sido considerado um potencial alvo farmacológico devido ao seu envolvimento em processos vitais relacionados à proteólise celular, sendo a mais importante entre as vias de degradação. Recentemente, foi demonstrado que moléculas análogas ao peptídeo PR-11(RRRPRPPYLPR), que corresponde aos 11 primeiros aminoácidos da porção N-terminal do peptídeo PR-39, apresentam uma forte inibição sobre o proteassoma humano 20S, inibindo a atividade quimotripsina-símile em concentrações namolares (nM). Os peptídeos dessa classe desempenham importantes atividades anti-inflamatórias e angiogênicas. Novas moléculas envolvendo substituições conservativas de aminoácidos e sínteses de peptídeos cíclicos podem ser derivadas dessas estruturas, com o intuito de se encontrar melhores inibidores. Dessa forma, este trabalho teve como objetivos a síntese do peptídeo PR-11 e análogos para a realização de ensaios de atividade peptidásica in vitro, visando verificar o potencial inibitório dos peptídeos sintetizados em frações enriquecidas com proteassoma 20S de fígado de camundongos Swiss, eritrócitos humanos e vermes adultos de Schistosoma mansoni. Os peptídeos foram sintetizados empregando-se a estratégia Fmoc em fase sólida, purificados em sistema HPLC e identificados por espectrometria de massas. As frações com proteassoma 20S foram obtidas a partir de cromatografias de filtração molecular em Sephacryl S-400, as quais permitiram preparar satisfatoriamente enriquecidos de proteassoma livres de proteases de baixa massa molecular. Todos os análogos foram capazes de inibir a atividade quimotripsina-símile in vitro do proteassoma 20S das três espécies estudadas, utilizando a concentração final de 1μM de peptídeo. De um modo geral, as intensidades das atividades inibitórias foram similares para o proteassoma 20S de camundongos e humanos e menores para o de vermes adultos de Schistosoma mansoni. Os análogos cíclicos C8C15 e C9C15, quando comparados ao PR-11, apresentaram menor atividade sobre o proteassoma de humanos e atividade similar quanto à inibição em
x ABSTRACT
xi LISTA DE ABREVIATURAS
ACN – Acetonitrila
ADP –Adenosine diphospate
ALLN – Acetil-Leu-Leu-norleucinal ATP –Adenosine triphosphate
BCA –Bicinchoninic Acid
CEUA – Comissão de Ética no Uso de Animais
DCM – Diclorometano DMF – Dimetilformamida DMSO – Dimetilsulfóxido DTT – Ditiotreitol
E1 – Enzimas ativadoras E2 – Enzimas conjugadoras E3 – Enzimas ligases
FGF –Fibroblast growth factor
Fmoc – 9-fluorenilmetiloxicarbonil HF – Ácido fluorídrico
HIF-1α–Hypoxia inducible factor-1α
HOBt – 1-hidroxibenzotriazol
HPLC – High Performance Liquid
Chromatography
IC50 – Concentração inibitória 50%
ICAM-1 – Intercellular adhesion
molecule-1
IL – Interleucina
INF-γ–Interferon-gamma
kDa – KiloDaltons
LCMS-IT-TOF – Liquid
Chroma-tography Ion Trap Time Of Flight
mA – Miliampere MDa – MegaDaltons
MG115 – Cbz-Leu-Leu-norvalinal MG132 – Cbz-Leu-leucinal
MHC –Major histocompability complex
MPTs – Modificações pós-traducionais NBT/BCIP – Nitro Blue Tetrazolium/ 5-Bromo-4-Cloro-3-Indolil Fosfato
PA –Proteassome activator
Pbf – 2,2,4,6,7-pentamethyldihydro-benzofuran-5-sulfonyl
PBS – Tampão fosfato salino pI – ponto isoelétrico
PI31 –Protein inhibitor of 31 kDa
PSI – Cbz-Ile-Glu(O-t-Bu)-Ala-leucinal PVDF –Polyvinylidene Fluoride
qRT-PCR –Quantitative real-time PCR
RMN – Ressonância magnética nuclear Rpn –Regulatory particle non-ATPase
Rpt –Regulatory particle of triple-ATPase
SDS – Dodecil sulfato de sódio
SPFS – Síntese de peptídeos em fase sólida
t-Boc – tert-butiloxicarbonil TFA – Ácido trifluoracético
TNF-α–Tumor necrosis factor-αlpha
xii UAF – Unidades arbitrárias de fluorescência
Ub – Ubiquitina UV – Ultravioleta V – Volts
VCAM-1 – Vascular cell adhesion molecule-1
VEGF – Vascular endothelial growth factor
xiii LISTA DE FIGURAS
Figura 1: Estrutura do proteassoma 20S em eucariotos ...4
Figura 2: O sistema de ubiquitinação ...7
Figura 3: Quantidade relativa das diferentes formas do proteassoma 20S encontradas no citosol de células HeLa ...8
Figura 4: Sítios de ação dos inibidores do proteassoma ...11
Figura 5: Mecanismo de inibição reversível do bortezomib sobre a subunidade β5 do proteassoma 20S ...12
Figura 6: Regulação proteassomal do fator de transcrição NFκB ...16
Figura 7: Esquema geral da síntese de peptídeos em fase sólida (SPFS) ...18
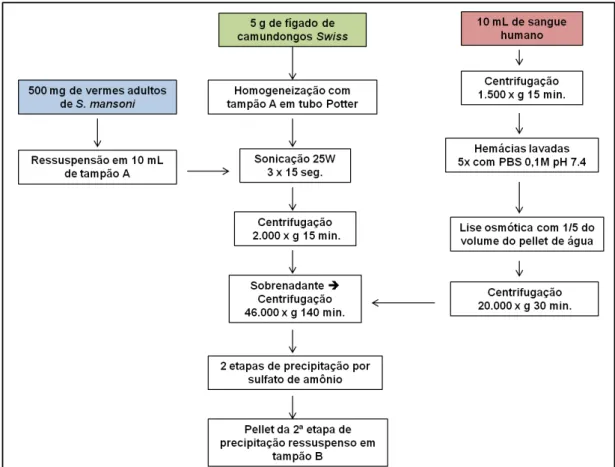
Figura 8: Etapas realizadas para a extração de proteínas solúveis a partir fígado de camundongos Swiss, eritrócitos humanos e vermes adultos de S. mansoni ...32
Figura 9: Perfis cromatográficos iniciais em sistema HPLC dos peptídeos sintetizados ...39
Figura 10: Estrutura dos aminoácidos derivatizados arginina e triptofano ...41
Figura 11: Estrutura do aminoácido derivatizado cisteína ...42
Figura 12: Perfis cromatográficos em sistema HPLC dos peptídeos nas condições cromatográficas que permitiram a purificação ...43
Figura 13: Espectros de massas obtidos por LCMS-IT-TOF electrosray dos análogos F8W12, I9F12 e I9W12 ...44
Figura 14: Cromatogramas a 280 nm e medidas da atividade peptidásica quimotripsina-símile dos extratos proteicos de fígado de camundongo Swiss, eritrócitos humanos e vermes adultos de Schistosoma mansoni submetidos à cromatografia em Sephacryl S-400 ...46
Figura 15: SDS-PAGE 10% e ensaios de Western Blotting das frações enriquecidas com proteassoma 20S identificadas pela medida da atividade quimotripsina-símile ...48
Figura 16: Perfil de enriquecimento com proteassoma 20S da amostra de fígado de camundongo submetido à cromatografia de filtração molecular em Sephacryl S-400 ...49
Figura 17: Atividade inibitória dos peptídeos sintetizados sobre o proteassoma 20S de camundongos, humanos e vermes adultos de S. mansoni...50
xiv
Figura 19: Avalição da atividade tripsina-símile de proteassomas 20S de fígado de camundongo na presença dos peptídeos PR-11, W12, F12 e C9C15 ...53 Figura 20: Recromatografias em sistema HPLC e caracterização por espectrometria de massas de todos os peptídeos purificados ...73
LISTA DE TABELAS
2 1. INTRODUÇÃO
1.1. Proteólise intracelular
A funcionalidade e viabilidade de uma célula são mantidas pelo seu conjunto de proteínas denominado proteoma (Wilkins et al., 1996). O proteoma é dependente do turnover
protéico, definido como o estado dinâmico de equilíbrio entre os processos de síntese e degradação. A síntese ocorre pela transcrição do DNA a RNA mensageiro acoplado a tradução a proteínas, enquanto a degradação envolve diferentes vias de proteólise, realizada por um grupo heterogêno de enzimas denominadas proteases (Turk, 2006; Jung et al., 2009).
Proteases são moléculas capazes de promover a hidrólise de ligações peptídicas, tendo ampla distribuição filogenética. De acordo com a posição da ligação a ser clivada, as proteases podem ser classificadas em exopeptidases e endopeptidases. As exopeptidases clivam ligações peptídicas nas extremidades amino e carboxi-terminal das proteínas, enquanto as endopeptidases realizam a clivagem no meio da cadeia polipeptídica. Considerando os diferentes mecanismos catalíticos de hidrólise envolvendo o sítio ativo, as proteases podem ser divididas em seis classes: metalo-proteases, serino-proteases, cisteíno-proteases, aspártico-proteases, glutâmico-proteases e treonino-proteases (Neurath, 1994; Turk, 2006).
A degradação de proteínas é essencial para a manutenção da homeostase celular. As células possuem diversos sistemas proteolíticos associados a complexos mecanismos regulatórios que juntos asseguram a degradação seletiva de substratos alvo. Falhas na degradação de proteínas de meia-vida curta ou uma proteólise desorganizada podem afetar drasticamente as funções celulares (Hargrove and Schmidt, 1989).
3
Dargelos et al., 2008). A proteólise dependente do proteassoma é formada por uma partícula central (proteassoma 20S) e várias proteínas reguladoras que podem alterar a atividade e a especificidade do complexo (Glickman and Ciechanover, 2002; Jung et al., 2009).
1.2. O complexo proteolítico proteassoma 20S
O proteassoma recebeu diferentes nomes ao longo dos anos, sendo a nomenclatura atual proposta por Arrigo et al., 1988, para indicar sua natureza proteolítica e particulada e, desde então, esta denominação tem sido amplamente utilizada. O proteassoma é altamente conservado, estando presente em todas as células eucarióticas (Voges et al., 1999) e em diferentes espécies de arquéias (Rivett, 1993) e bactérias (Tamura et al., 1995). Apresenta localização tanto citoplasmática quanto nuclear, podendo representar até 1% das proteínas totais de uma célula (Coux et al., 1996). Particularmente no citoplasma, a degradação pelo sistema proteassomal é a mais importante entre as vias de proteólise. Está envolvido nos mais distintos processos: degradação de proteínas oxidadas e/ou danificadas, regulação da meia-vida proteica, regulação do ciclo celular, expressão gênica, stress, reposta imune, carcinogênese, reparo de DNA (Jung et al., 2009).
4
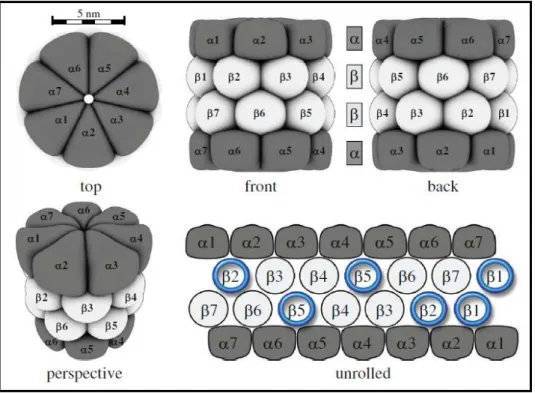
Figura 1: Estrutura do proteassoma 20S em eucariotos. Quatro anéis heptaméricos superpostos mantêm a estrutura cilíndrica ou em forma de barril do proteassoma 20S. Os anéis periféricos são compostos de 7 subunidades e os dois centrais por 7 subunidades , formando um arranjo . Em destaque, as subunidades catalíticas 1, 2 e 5 responsáveis pelas atividades proteolíticas semelhantes às de caspase, tripsina e quimotripsina, respectivamente. Fonte: Jung et al., 2009.
5
As subunidades componentes do proteassoma 20S variam entre as espécies. As arqueobactérias, por exemplo, contém anéis externos com apenas um tipo de subunidade alfa e anéis internos com subunidades beta, dispostos em um arranjo 7 7 7 7 (Dahlmann et al.,
1989). O proteassoma 20S de eucariotos exibem o mesmo arranjo de subunidades, mas contem 7 diferentes alfa e beta ( 1-7 1-7 1-7 1-7 ) (Baumeister et al., 1998).
Outra diferença entre proteassomas de diferentes espécies está relacionada com a atividade catalítica preferencial. Entre a maioria dos eucariotos, a atividade principal é a atividade semelhante à quimotripsina, enquanto que nos tripanossomatídeos a atividade principal é a semelhante à tripsina (Paugam et al., 2003). Já o proteassoma da arqueobactéria
Thermoplasma acidophilum possui as 14 subunidades proteoliticamente ativas, porém apresenta apenas a atividade semelhante à quimotripsina (Wenzel and Baumeister, 1993; Orlowski and Wilk, 2000).
1.3. Reguladores do proteassoma 20S
A degradação proteolítica pelo proteassoma é altamente eficaz, devendo ser estritamente regulada para evitar a proteólise descontrolada das proteínas celulares. A abertura ordenada do poro central do proteassoma 20S permite a entrada seletiva de substratos específicos. Ao longo da evolução, vários reguladores surgiram a fim de controlar o reconhecimento e a degradação das proteínas-alvo (Jung et al., 2009).
6
O complexo 19S édidaticamente dividido em dois subcomplexos denominados base e tampa. A base é formada por seis subunidades ATPásicas (Regulatory particle of t
riple-ATPase – Rpt1-Rpt6) e quatro subunidades não-ATPásicas (Regulatory particle non-ATPase – Rpn1, Rpn2, Rpn10 e Rpn13), possuindo três principais funções: reconhecimento e desenovelamento de proteínas poliubiquitinadas, e abertura do anel externo. Já o complexo tampa é composto por ao menos nove subunidades não-ATPásicas (Rpn3, Rpn5-Rpn9, Rpn11, Rpn12 e Rpn15), sendo responsável pela desubiquitinação de proteínas capturadas e, consequentemente, a reciclagem das moléculas de ubiquitina (Tanaka, 2009; Lasker et al., 2012).
7
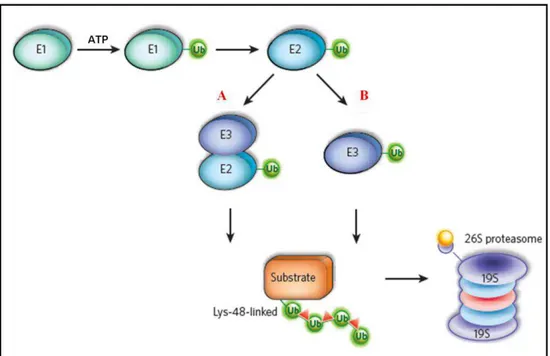
Figura 2: O sistema de ubiquitinação. Depois de uma ativação ATP-dependente da glicina C-terminal de uma molécula de ubiquitina (Ub) por E1, a Ub é transferida para E2, e, finalmente, após a ligação do complexo E2-ubiquitina a E3, a Ub é transferida diretamente para um resíduo de lisina do substrato alvo (A) ou primeiramente para E3 e desta para o substrato (B). O substrato poliubiquitinado com ao menos quatro moléculas de Ub é reconhecido e degradado pelo proteassoma 26S. Fonte: adaptado de Hoeller and Dikic, 2009.
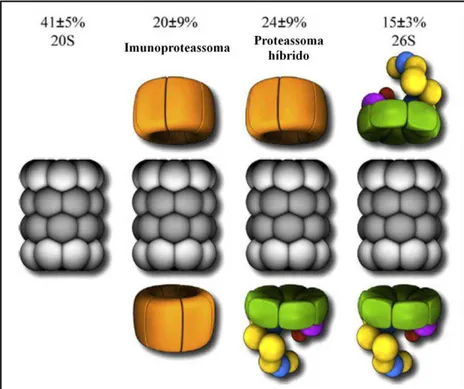
Outros importantes reguladores do proteassoma 20S são as partículas denominadas 11S ou PA28, capazes de se ligarem aos anéis , aumentado a taxa de proteólise de proteínas desenoveladas de uma maneira independente de ATP (Rechsteiner et al., 2000). Os reguladores PA28 são encontrados como complexos heterogêneos de seis ou sete subunidades (cadeias e ) ou complexos homogêneos de sete subunidades (cadeia γ). A distribuição intracelular de PA28αβ é preferencialmente no citoplasma, enquanto que o PA28γ é de localização nuclear. A partícula PA28αβ associada ao proteassoma 20S está envolvida na apresentação de antígenos via MHC de classe I, formando o complexo PA28αβ-20S-PA28αβ denominado imunoproteassoma. Durante a formação do imunoproteassoma, as subunidades β proteoliticamente ativas são substituídas por outras equivalentes (β1i, β2i e β5i) induzidas por sinais celulares como o INF-γ e TNF-α (Rivett et al., 2001; Lin et al., 2005). A função biológica do PA28γ é pouco compreendida, porém há estudos que relacionam este complexo com a regulação do ciclo celular e apoptose (Rechsteiner and Hill, 2005).
8
proteassoma híbrido (Tanahashi et al., 2000). A exata função deste complexo é desconhecida, estando envolvido com o processamento de antígenos e eficiência da taxa de proteólise (Hendil et al., 1998).
A figura 3 ilustra as quantidades relativas do proteassoma 20S associado a seus reguladores encontrados no citosol de células HeLa (Tanahashi et al., 2000), ilustrando a dinâmica e a heterogeneidade dos processos de regulação.
Um dos mais recentes ativadores do proteassoma 20S são as partículas PA200, localizadas exclusivamente nos núcleos celulares com uma massa molecular de 200 kDa. Foi proposto que o papel funcional do PA200 relaciona-se ao reparo de DNA (Ustrell et al., 2002).
Diferentemente dos reguladores citados até o momento, o PI31 (Protein Inhibitor of 31 kDa) atua como um inibidor endógeno do proteassoma 20S (Chu-Ping et al., 1992). O PI31, proteína rica em prolina, age como um modulador seletivo do proteassoma, mediando as vias de processamento de antígeno via MHC de classe I e a maturação dos precursores do imunoproteassoma (Zaiss et al., 2002).
9
Vários tipos de modificações pós-traducionais (MPTs) também regulam o proteassoma 20S. Em resposta a diferentes estímulos biológicos, as MPTs modulam a montagem, a meia-vida e a atividade do proteassoma 20S. Dentre outras modificações, a fosforilação, desfosforilação, glicosilação, nitrosilação, acetilação, glutationilação e ADP-ribosilação do proteassoma já foram documentadas (Kimura et al., 2000; Iwafune et al., 2002; Zong et al., 2008).
1.4. Inibidores do proteassoma
O proteassoma têm sido considerado um potencial alvo terapêutico em muitas patologias, dado o seu envolvimento em várias vias fisiológicas através da clivagem de numerosos reguladores do ciclo celular, antígenos proteicos e fatores de transcrição (Reinstein
and Ciechanover, 2006). Nos últimos 20 anos, investigações com inúmeros inibidores proporcionaram a descoberta de importantes mecanismos celulares envolvendo o proteassoma (Kisselev et al., 2012).
A primeira consequência da inibição do proteassoma é uma diminuição global do nível de proteólise celular, levando a um rápido acúmulo de proteínas de meia-vida curta, oxidadas e/ou danificadas. Este acumulado de proteínas desencadeia um aumento na expressão de proteínas heat shock como um mecanismo de proteção contra as condições tóxicas do ambiente celular (Kisselev and Goldberg, 2001).
Observa-se que, na maior parte das espécies, apenas a inibição da atividade semelhante à quimotripsina já causa uma grande diminuição nos níveis de degradação. Por outro lado, a inativação dos sítios das atividades semelhantes à caspase e tripsina tem pouco efeito sobre a proteólise total. Os inibidores da atividade quimotripsina-símile são hidrofóbicos, sendo mais permeáveis à membrana celular. De modo contrário, os inibidores das atividades tripsina- e caspase-símile contêm resíduos carregados que dificultam a captação pela célula (Heinemeyer et al., 1997; Kisselev et al., 1999).
10
reativo como, por exemplo, aldeídos, boronatos, vinilsulfonas, semicarbazonas, dentre outros (Bochtler et al., 1999). Os peptídeos aldeídicos foram os primeiros inibidores a serem identificados e, a partir destes, inúmeros outros têm sido desenvolvidos (Vinitsky et al., 1992; Rock et al., 1994). Dentre os peptídeos aldeídicos, os mais utlizados são o Cbz-Leu-leucinal (MG132), Cbz-Leu-Leu-norvalinal (MG115), acetil-Leu-Leu-norleucinal (ALLN) e Cbz-Ile-Glu(O-t-Bu)-Ala-leucinal (PSI). Estes agentes são análogos de substratos e potentes inibidores da atividade semelhante à quimotripsina do proteassoma (Rock et al., 1994).
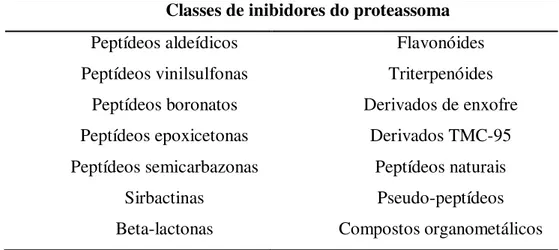
Tabela 1: Diferentes classes de inibidores do proteassoma. Fonte: adaptado de de Bettignies and Coux, 2010. Classes de inibidores do proteassoma
Peptídeos aldeídicos Flavonóides Peptídeos vinilsulfonas Triterpenóides
Peptídeos boronatos Derivados de enxofre Peptídeos epoxicetonas Derivados TMC-95 Peptídeos semicarbazonas Peptídeos naturais
Sirbactinas Pseudo-peptídeos Beta-lactonas Compostos organometálicos
Além dos inibidores sintéticos, existem vários inibidores naturais do proteassoma que exibem uma ampla variedade de grupos farmacofóricos. Epoxicetonas e beta-lactonas são as classes de inibidores naturais com mais compostos conhecidos, tendo como principais estruturas a epoximicina e a lactacistina, respectivamente. Assim como outras dezenas de inibidores, estas estruturas atuam diretamente sobre os resíduos de treonina (Thr-1) das subunidades β proteolíticas (Myung et al., 2001).
11
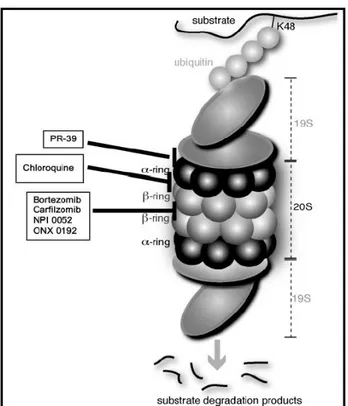
Figura 4: Sítios de ação dos inibidores do proteassoma. O inibidor reversível bortezomib e os inibidores irreversíveis carfilzomib, ONX 0192 e NPI 0052 (salinosporide A) se ligam diretamente à subunidade proteolítica β5. A cloroquina atua sobre o proteassoma pelo seu lado externo, através da interação com a interface entre as subunidades α e β. O peptídeo PR-39 liga-se às subunidades α dificultando a interação de partículas regulatórias. Fonte: Ruschak et al., 2011.
Nos últimos anos, têm sido demonstrado que inibidores do proteassoma são capazes de induzir a apoptose de algumas células malignas em cultura (Mitsiades et al., 2002; Poulaki
et al., 2007). Tal propriedade não é surpreendente, dado o importante papel do proteassoma na regulação dos níveis de muitas proteínas necessárias para a manutenção da homeostase celular. O que é intrigante é o fato da inibição ser preferencialmente tóxica para células tumorais, através de um padrão específico e coordenado de transcrição gênica direcionado a eventos pró-apoptóticos (Ruschak et al., 2011). A atividade anti-tumoral baseada na inibição do proteassoma tem encorajado muitos pesquisadores a desenvolver novas estruturas ativas (Baldisserotto et al., 2009). Dessa forma, encontram-se em fases clínicas I e II: CEP-18770, MLN-9708, carfilzomib (PR-171), NX 0912 e salinosporamide A (NPI 0052) (Ruschak et al., 2011).
12
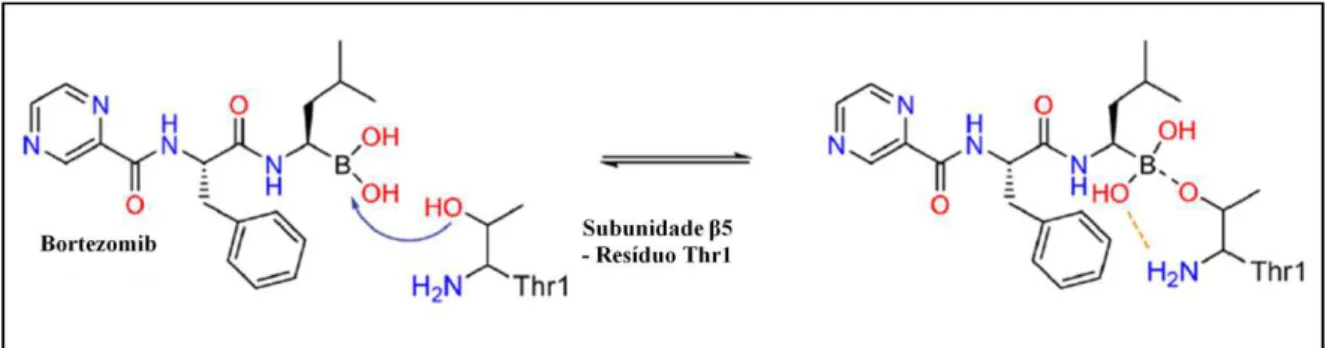
2010). O bortezomib é um inibidor competitivo do proteassoma, ligando-se reversivelmente à subunidade catalítica β5 (figura 5). Apesar da eficácia deste composto, inibidores do proteassoma com diferentes mecanismos de ação têm sido desenvolvidos no intuito de superar a resistência e a toxicidade ao bortezomib observada em alguns pacientes (Ruschak et al., 2011).
Figura 5: Mecanismo de inibição reversível do bortezomib sobre a subunidade β5 do proteassoma 20S. Fonte: adaptado de Moore et al., 2008.
Dezenas de estudos em animais têm indicado que os inibidores do proteassoma podem ser úteis no tratamento de outras neoplasias. Além disso, benefícios destes inibidores na terapêutica experimental de doenças cardiovasculares, distrofias musculares, pancreatite aguda, artrites, disfunção renal aguda, isquemia cerebral, dentre outras patologias, já foram destacadas pela literatura (Meiners et al., 2007).
1.5. O proteassoma em Schistosoma mansoni
13
devido ao clima tropical e condições favoráveis à transmissão da parasitose, também é um país endêmico, tornando-a um importante problema de saúde pública (Katz et al., 2003).
Uma vez que genes que codificam subunidades do proteassoma estão sendo identificados nos mais diversos organismos (Voges et al., 1999) e que a proteólise regulada por este influencia o ciclo celular, o controle transcricional e outros processos celulares críticos, é possível admitir que o proteassoma possa constituir um importante alvo de ação de drogas no combate a essa parasitose.
Em 2005, Guerra-Sá et al. descreveram pela primeira vez as evidências bioquímicas para a existência do proteassoma 20S em cercárias e vermes adultos deste parasito. Todas as três atividades proteolíticas mais bem caracterizadas do proteassoma estão presentes, com a predominância da atividade semelhante à quimotripsina. Essa principal atividade do proteassoma foi analisada em cercárias e vermes adultos na presença de alguns inibidores clássicos, como o MG-132, a epoximicina e a lactacistina, onde todos demostraram, em baixas concentrações, uma inibição em torno de 90%. Os perfis de atividades proteolíticas e inibição com inibidores clássicos dos proteassomas de Schistosoma mansoni e eucariotos se aproximam, diferenciando-se dos proteassomas de parasitos protozoários (Guerra-Sá et al., 2005). A via dependente de ubiquitina-proteassoma também está envolvida em outros estágios do ciclo biológico, como no desenvolvimento dos ovos eliminados pelo parasito (Mathieson et al., 2011). Além disso, a estrutura do inibidor PI31 é altamente conservada no parasito, sendo expressa em seus diferentes estágios biológicos (Botelho-Machado et al., 2010).
O uso de ferramentas de genômica e proteômica vem sendo utilizadas para a caracterização do proteassoma em Schistosoma mansoni (Nabhan et al., 2007; Castro-Borges
et al., 2007). A partir da comparação do genoma completo deste parasito e as sequências gênicas das subunidades do proteassoma de leveduras e humanos, foram identificadas 31 sequências homólogas, das quais 14 são referentes às subunidades e , indicando que a organização estrutural deste proteassoma 20S é similar entre as demais espécies. Pela análise de algumas dessas subunidades por qRT-PCR (quantitative real-time PCR), observou-se que as quantidades de proteassoma são diferentemente expressas entre as formas evolutivas do parasito(Nabhan et al., 2007).
14
bidimensional e espectrometria de massas do proteassoma isolado permitiu a caracterização das subunidades e , as quais possuem uma considerável diversidade de isoformas, provavelmente decorrentes de uma série de modificações pós-traducionais.
Os fatores que controlam o desenvolvimento do Schistosoma mansoni são de grande interesse para o entendimento dos processos metabólicos, associados com a biologia do parasito, envolvidos na esquistossomose (Guerra-Sá et al., 2005). Dessa forma, um melhor entendimento do proteassoma do Schistosoma mansoni, seu papel no desenvolvimento do parasito e os efeitos da ação de inibidores sobre este complexo podem levar à descoberta de novos agentes quimioterápicos (Nabhan et al., 2007).
1.6. Peptídeos ricos em prolina e arginina: PR-39 e análogos
PR-39 é um peptídeo da família das catelicidinas rico nos aminoácidos prolina e arginina (49% e 24%, respectivamente - RRRPRPPYLPRPRPPPFFPPRLPPRIPPGFPPRF PPRFP), tendo sido originalmente isolado do intestino de suínos por exibirem propriedades antimicrobianas (Agerberth et al., 1991; 1996). O PR-39 e homólogos são secretados por macrófagos, sendo encontrados em fluidos de feridas de muitos animais e em lesões de infarto agudo do miocárdio (Gallo et al., 1994). Assim como os demais compostos da família das catelicidinas, este peptídeo catiônico é sintetizado como um precursor inativo e estocado em grânulos celulares como um pró-peptídeo. Sob ativação celular e degranulação, o PR-39 maduro é liberado por uma rápida clivagem do peptídeo sinal N-terminal (Gudmundsson et al., 1995; Lehrer et al., 2002). Este peptídeo é capaz de atravessar rapidamente as membranas celulares (Chan and Gallo, 1998).
15
estrutural do PR-39 com uma porção do regulador 19S, a sua ligação inibe a montagem do proteassoma 26S. Esses efeitos do PR-39 foram observados tanto em proteassomas de leveduras quanto humanos (Gaczynska et al., 2003).
A maior parte dos inibidores do proteassoma em estudo são competitivos, os quais bloqueiam diretamente os sítios catalíticos, impedindo a clivagem de uma grande quantidade de substratos destinados à degradação pelo proteassoma e desencadeando a apoptose celular. Ao contrário destes, inibidores alostéricos oferecem um potencial de uso mais preciso, visto que a atividade sobre o proteassoma se manifesta de modo regulatório, não influenciando de forma significativa as taxas de proteólise por este complexo (Gaczynska et al., 2003).
Nos últimos anos, diferentes pesquisadores têm demonstrado os efeitos e as bases moleculares da inibição do PR-39 sobre o proteassoma, exibindo como principais atividades a diminuição de danos inflamatórios e a indução da angiogênese. Estes processos são parcialmente explicados pela inibição da degradação seletiva pelo proteassoma dos fatores IκB e HIF-1α (Hypoxia Inducible Factor -1α), respectivamente (Gao et al., 2000; Li et al., 2000; Bao et al., 2001)
16
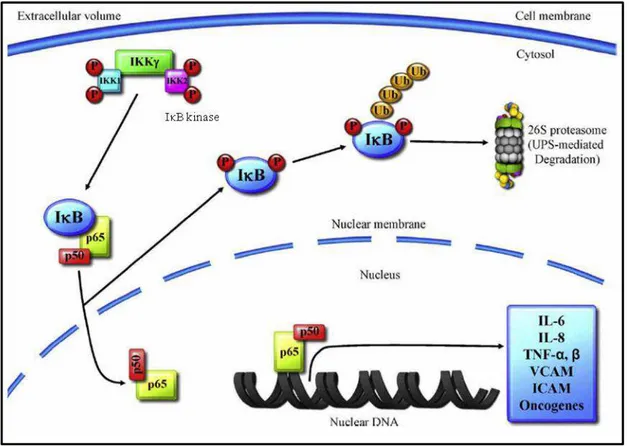
Figura 6: Regulação proteassomal do fator de transcrição NFκB. Após a fosforilação do IκB e sua degradação pelo proteassoma 26S, o NFκB, formado pelas subunidades p50 e p65, é liberado para o núcleo e ativa a expressão gênica (VCAM: Vascular Cell Adhesion Molecule; ICAM: Intercellular Adhesion Molecule). Fonte: adaptado Jung et al., 2009.
O PR-39 também é capaz de estimular a angiogênese, tanto in vitro quanto in vivo. Estudos demonstraram que a expressão transgênica do PR-39 em cardiomiócitos resultou no aumento do número de vasos, redução da resistência coronariana e hipertrofia miocárdica (Li
et al., 2000; Tirziu et al., 2007). Estes efeitos são explicados pela inibição da degradação via ubiquitina-proteassoma da proteína HIF-1α, a qual regula a expressão de muitos genes relacionados à angiogênese, incluindo o VEGF (Vascular Endothelial Growth Factor) e o seu receptor FLT1 (Chan and Gallo, 1998). Além disso, o PR-39 aumenta a expressão de receptores do fator FGF (Fibroblast Growth Factor), como o receptor FGFR-1, sugerindo a atividade angiogênica do peptídeo através desta via (Li et al., 1997; Volk et al., 1999).
17
sequência do PR-39 (PR-11 – RRRPRPPYLPR) inibe eficientemente o proteassoma in vitro
de maneira dose-dependente. Estes resultados observados in vitro estão de acordo com os dados in vivo, uma vez que a indução da angiogênese pelo PR-11 foi similar à observada pelo PR-39.
A partir de estruturas análogas de peptídeos sintéticos e estudos espectroscópicos de ressonância magnética nuclear (RMN), Anbanandam et al., 2008, identificaram alguns requisitos estruturais essenciais do PR-11 para a inibição do proteassoma 20S de humanos. Ao menos dois dos três resíduos da porção N-terminal carregados positivamente (arginina ou lisina) e resíduos hidrofóbicos na região C-terminal são imprescindíveis para a atividade inibitória. As propriedades requeridas pelo PR-11 para a inibição do proteassoma 20S in vitro
também alteram a expressão de fatores da via do NFκB, mantendo-se, assim, os efeitos anti-inflamatórios verificados in vitro. Além disso, Anbanandam et al., 2008, verificaram que alguns análogos ao PR-11 demonstraram ação inibitória superior sobre o proteassoma 20S, encorajando a busca por moléculas mais ativas. Dessa forma, modificações estruturais sutis envolvendo substituições por aminoácidos semelhantes e sínteses de peptídeos cíclicos poderiam gerar melhores inibidores e compostos com potenciais terapêuticos.
1.7. Síntese de peptídeos em fase sólida (SPFS)
A síntese de peptídeos em fase sólida (SPFS) foi desenvolvida por Bruce Merrifield (Merrifield, 1963), resultando em uma grande mudança nas perspectivas de síntese de peptídeos (Chan and White, 2000). A viabilização da síntese em fase sólida permitiu o estudo de peptídeos naturais de baixa abundância e a obtenção de análogos em quantidades suficientes para testes biológicos (Zasloff, 2002).
18
O mecanismo geral da SPFS consiste em ciclos repetidos de formação da ligação peptídica (etapa de acoplamento) e desproteção. Inicialmente, o primeiro aminoácido, modificado de maneira a proteger o N-terminal, reage pelo seu grupo carboxila a um ligante da fase sólida (amino, halogênio ou hidroxila). Em seguida, a proteção do N-terminal é removida, gerando um grupo amino livre, ao qual será acoplado a outro resíduo. Todos os aminoácidos a serem empregados na síntese possuem as cadeias laterais, quando reativas, também protegidas, impedindo a formação de reações secundárias durante a síntese da cadeia peptídica. As etapas de acoplamento e desproteção do N-terminal são alternadamente repetidas, até a obtenção da sequência peptídica desejada. Ao final da síntese, o peptídeo é liberado de seu suporte polimérico. Nesta mesma etapa, os grupos protetores das cadeias laterais também são removidos (figura 7). Geralmente, a resina e os grupos protetores das cadeias laterais dos aminoácidos são escolhidos de forma que ambos sejam removidos sob as mesmas condições (Chan and White, 2000).
19
As principais vantagens da SPFS sobre a síntese orgânica clássica em solução são a velocidade, praticidade e quimioseletividade, com a consequente diminuição de reações secundárias e formação de subprodutos. Sendo o suporte polimérico insolúvel em todos os sistemas de solventes orgânicos usados, cada etapa de reação é facilmente lavada por filtração. As reações de acoplamento devem ser realizadas na presença de excesso molar de aminoácidos para garantir melhores rendimentos. As lavagens com grandes volumes de solventes retiram de maneira adequada os excessos de reagentes e os produtos solúveis, promovendo uma purificação rápida e parcial a cada ciclo de acoplamento (Merrifield, 1997). A SPFS pode ser realizada manual ou automaticamente, utilizando-se mais comumente as estratégias tert-butiloxicarbonil (t-Boc) ou 9-fluorenilmetiloxicarbonil (Fmoc) (Alewood et al., 1997). Estas duas estratégias estão baseadas no sistema de proteção do N-terminal e das cadeias laterais reativas que são removidos em diferentes condições no meio reacional.
Na primeira estratégia, o grupo protetor t-Boc é removido rapidamente usando ácidos orgânicos e inorgânicos (usualmente TFA - ácido trifluoracético). Este protetor ligado ao grupo amino é removido após cada aminoácido ser incorporado na sequência, sendo denominado protetor temporário. Após o término dos ciclos de acoplamento, a clivagem do peptídeo da resina e a remoção dos protetores das cadeias laterais (protetores permanentes e estáveis ao TFA) são realizadas em condições extremamente ácidas, utilizando-se o ácido fluorídrico (HF) a 0oC ou ácido trifluorometanosulfônico a 25oC (Barany and Merrifield, 1979).
Na segunda estratégia, o protetor temporário do grupo amino Fmoc é removido por uma base fraca (usualmente piperidina ou um derivado). A clivagem do peptídeo da resina e a remoção dos protetores da cadeia lateral são realizadas por TFA à temperatura ambiente (Fields and Noble, 1990).
20
suprime a racemização, formando um intermediário altamente reativo que rapidamente reage com o N-terminal do aminoácido (Chan and White, 2000). O HOBt e derivados, tendo em vista suas propriedades explosivas, vêm sendo substituídos por oximas sem alterar a eficiência do procedimento (Subiros-Funosas et al., 2009).
22 2. JUSTIFICATIVA
Dado que o proteassoma está envolvido na regulação de uma série de funções, qualquer pertubação desse sistema pode comprometer a homeostasia celular. Nesse sentido, o proteassoma têm sido considerado um alvo potencial na terapêutica de diversas patologias.
Recentemente, foi demonstrado que análogos à porção N-terminal do peptídeo natural PR-39 (PR-11 - RRRPRPPYLPR) inibem fortemente o proteassoma humano 20S. A literatura demonstrou que a introdução de um resíduo de triptofano na posição C-terminal do PR-11 aumentou em mais de 100 vezes a potência inibitória do peptídeo sobre o proteassoma 20S humano, sendo similar à atividade observada para a sequência completa do PR-39 (Anbanandam et al., 2008). Dessa forma, novas moléculas podem ser derivadas destes análogos estudados, por modificações estruturais sutis, como a mudança conservativa da sequência de aminoácidos e a introdução de resíduos de cisteína para formação de peptídeos cíclicos com diferentes curvaturas. Além disso, as atividades inibitórias observadas para o proteassoma humano das estruturas propostas podem apresentar diferentes resultados em relação aos proteassomas de outros organismos como os parasitos.
23
24 3. OBJETIVOS
3.1. Objetivo geral
Obter análogos ao peptídeo PR-11 que possuam atividade sobre o proteassoma 20S de mamíferos e do parasito Schistosoma mansoni.
3.2. Objetivos específicos
1 – Sintetizar e purificar o peptídeo modelo PR-11 e análogos, através da substituição conservativa de aminoácidos e a introdução de pares de cisteína para obtenção de peptídeos cíclicos;
2 – Padronizar uma metodologia para obtenção de frações enriquecidas de proteassoma 20S de fígado de camundongo Swiss, eritrócitos humanos e vermes adultos de Schistosoma mansoni;
26 4. MATERIAIS E MÉTODOS
Este trabalho foi aprovado pela Comissão de Ética no Uso de Animais (CEUA) da Universidade Federal de Ouro Preto e catalogado sob o protocolo nº 2009/32.
4.1. Síntese de peptídeos
A síntese dos peptídeos propostos (tabela 2) foi realizada sob a forma solúvel, utilizando-se um protocolo de síntese em fase sólida estabelecido por Merrifield (1965), com algumas modificações. O processo adotado neste trabalho requer a utilização de aminoácidos derivatizados, através da proteção da porção amino com o grupo Fmoc. Caso sua cadeia lateral também seja reativa, ela estará igualmente protegida por um grupo que deva responder às exigências de ser adaptado à natureza da cadeia lateral e ser clivado na última etapa da síntese pelo TFA.
A síntese de peptídeos requer um suporte sólido insolúvel para o acoplamento dos aminoácidos. A resina utilizada foi a Rink Amide Resin HL (Merck, Alemanha) a 0,78 mmol/g, partindo-se de um rendimento máximo de 40 µmoles de peptídeo por síntese.
4.1.1. Ativação da resina
27
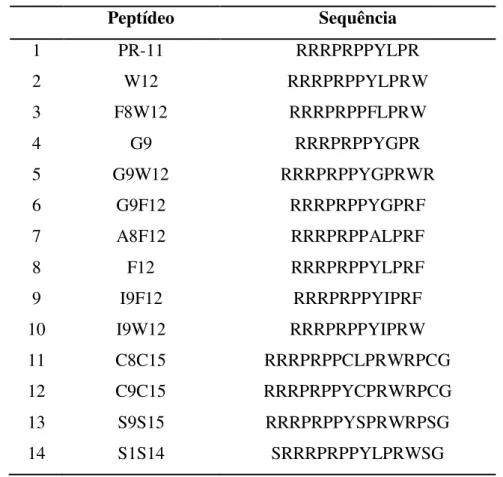
Tabela 2: Peptídeos sintetizados com suas respectivas sequências.
Peptídeo Sequência
1 PR-11 RRRPRPPYLPR
2 W12 RRRPRPPYLPRW
3 F8W12 RRRPRPPFLPRW
4 G9 RRRPRPPYGPR
5 G9W12 RRRPRPPYGPRWR
6 G9F12 RRRPRPPYGPRF
7 A8F12 RRRPRPPALPRF
8 F12 RRRPRPPYLPRF
9 I9F12 RRRPRPPYIPRF
10 I9W12 RRRPRPPYIPRW
11 C8C15 RRRPRPPCLPRWRPCG
12 C9C15 RRRPRPPYCPRWRPCG
13 S9S15 RRRPRPPYSPRWRPSG
14 S1S14 SRRRPRPPYLPRWSG
4.1.2. Ativação e adição dos aminoácidos a serem acoplados
Os aminoácidos e demais reagentes auxiliares foram adicionados em concentrações quatro vezes superiores (160 µmoles) à quantidade de resina para favorecer o acoplamento. Estes são ligados pelo seu grupamento carboxila ao grupamento amino da resina, formando uma ligação peptídica. O primeiro aminoácido foi adicionado ao tubo de síntese em um volume de 2 mL de DMF, acrescido de 25µL de DIPC (diisopropilcabodiimida) e 23 mg de
28
metanol e DMF. O grupamento amino desse primeiro aminoácido acoplado foi então desprotegido, lavando-se a resina com 3 mL de uma solução de 4-metilpiperidina 20% em DMF, por três vezes de 10 minutos cada, com agitação contínua à 37°C. Os demais aminoácidos foram processados conforme descrito para o acoplamento do primeiro aminoácido.
4.1.3. Clivagem do peptídeo
Após o término dos ciclos de acoplamento, o último grupamento Fmoc foi eliminado com 4-metilpiperidina 20% em DMF, como descrito previamente, e a resina lavada por quatro vezes, durante cinco minutos, com 3 mL de diclorometano (DCM). As cadeias laterais foram desprotegidas e o peptídeo dissociado da resina pelo uso de 5 mL de uma solução de clivagem contendo 95% de TFA. Para os peptídeos contendo cisteína, a solução de clivagem continha 2,5% de β-mercaptoetanol, a fim de se evitar a formação de pontes dissulfeto. O tubo de reação permaneceu sob agitação por quatro horas. A solução contendo os peptídeos foi coletada, transferida para tubos de ensaio e os produtos de síntese precipitados com 50 mL de éter etílico, permanecendo em repouso durante a noite à 4ºC. Posteriormente, os precipitados foram lavados com éter etílico e centrifugados por três vezes a 1.500 x g por 5 minutos. Na última etapa, o sobrenadante foi desprezado e o peptídeo ressuspenso em 3 mL de água milli-Q. Após a obtenção dos peptídeos, esses foram liofilizados, analisados em sistema HPLC (High Performance Liquid Chromatography) e caracterizados em espectrômetro de massas LCMS-IT-TOF operando via electrospray.
4.1.4. Ciclização dos peptídeos contendo cisteína
29
4.1.5. Purificação dos peptídeos por cromatografia de fase reversa em sistema HPLC
Os peptídeos sintetizados em fase sólida foram submetidos à cromatografia de fase reversa para a análise de sua pureza. As cromatografias foram realizadas em coluna C18 (250 mm x 4,6mm) (Shim-pack CLD-ODS (M)-Shimadzu®), em sistema HPLC da Shimadzu®. A coluna foi previamente equilibrada com uma solução de água mili-Q e TFA 0,1%. Inicialmente, eluiu-se alíquotas de todos os peptídeos (20 μL) em um gradiente de ACN (acetonitrila) de 0 a 80% e TFA 0,1% durante 30 minutos com um fluxo de 1 mL/minuto. A concentração de ACN atingiu 80% em 20 minutos e retornou a 0 em 25 minutos, monitorando-se a eluição a 280nm ou a 260nm para os peptídeos que não continham tirosina ou triptofano. Para aqueles cromatogramas que não possuíam uma resolução adequada, novas condições foram desenvolvidas até que a purificação do peptídeo se tornasse satisfatória. Estas outras condições cromatográficas abrangeram gradientes de ACN/TFA 0,1% variáveis entre 20% a 60%, durante até 35 minutos com um fluxo de 1 mL/minuto. Após a purificação, os peptídeos foram caracterizados e identificados por espectrometria de massas.
4.1.6. Caracterização dos peptídeos por espectrometria de massas LCMS-IT-TOF electrospray
Analisou-se os peptídeos purificados por espectrômetro de massas LCMS-IT-TOF (Liquid Chromatography Ion Trap Time Of Flight), que opera por ionização do tipo
electrospray (Shimadzu®). O equipamento foi calibrado utilizando trifluoroacetato de sódio. A voltagem capilar foi de 4500 V no modo positivo de ionização, com tempo de acumulação de 10 ms. Aplicou-se as amostras através de injeções diretas (alíquotas de 5 μL). A ferramenta
ExPASy – Compute PI/Mw tool (disponível em http://web.expasy.org/compute_pi/) foi utilizada para a predição das massas moleculares dos peptídeos.
30 4.2. Extração de proteínas solúveis
4.2.1. Fígado de camundongos Swiss
A extração de proteínas de fígado de camundongos Swiss foi realizada de acordo com um protocolo modificado de Abramova et al., 2004. Aproximadamente, 5.0 g de fígado foram lavados em PBS (tampão fosfato salino) 0,1 M, pH 7.4, e homogeneizados com tampão A (Tris-HCl 30 mM pH 7.5; NaCl 100 mM; ditiotreitol – DTT 1 mM; EDTA 1 mM; MgCl2 5
mM; glicerol 10%) em tubo Potter por 10 minutos em banho de gelo (100 mg de tecido/mL de tampão A). O homogenato foi transferido para tubos de ensaio (1 mL cada) e esses sonicados por 15 segundos, três vezes a 25 watts, com intervalo de 45 segundos entre cada ciclo (Sonifier 250 Branson). O homegenato foi reunido e centrifugado a 2.000 x g por 15 minutos para remoção de debris celulares (centrífuga Sorvall 5C). O sobrenadante contendo a fração solúvel foi novamente centrifugado, desta vez a 46.000 x g por 140 minutos. A seguir, o sobrenadante resultante foi reunido e submetido à precipitação por sulfato de amônio a 40% (20 minutos para adição contínua do sal; 20 minutos em repouso; 20 minutos de centrifugação a 16.000 x g). O precipitado foi descartado e as proteínas presentes no sobrenadante submetidas à precipitação com sulfato de amônio a 70%, conforme descrito anteriormente. Ao final, o sobrenadante foi descartado e o precipitado ressuspenso em 3 mL de tampão B (Tris-HCl 20 mM pH 7.5; NaCl 250 mM; DTT 1 mM; EDTA 1 mM; MgCl2 5 mM; glicerol 20%).
4.2.2. Eritrócitos humanos
31
líquido e o material resultante centrifugado a 20.000 x g por 30 minutos. O sobrenadante foi novamente centrifugado, desta vez a 46.000 x g por 140 minutos. A seguir, o sobrenadante resultante foi submetido à 2 etapas de precipitação por sulfato de amônio a 40% e 70%, conforme descrito no item 4.2.1. Por fim, ressuspendeu-se o precipitado obtido pela precipitação a 70% em 2 mL de tampão B.
4.2.3. Vermes adultos do parasito Schistosomamansoni
Aproximadamente, 500 mg de vermes adultos do parasito, gentilmente cedidos pelo Prof. Dr. William de Castro Borges (Laboratório de Enzimologia e Proteômica - UFOP), foram ressuspensos em 10 mL de tampão A. A seguir, o material foi sonicado por 15 segundos, três vezes a 25 watts, com intervalo de 45 segundos entre cada ciclo. O homegenato foi reunido e centrifugado a 2.000 x g por 15 minutos para remoção de debris celulares. O sobrenadante contendo a fração solúvel foi novamente centrifugado (46.000 x g por 140 minutos). Submeteu-se o sobrenadante resultante desta centrifugação à precipitação por sulfato de amônio a 30% (20 minutos para adição contínua do sal; 20 minutos em repouso; 20 minutos de centrifugação a 16.000 x g). O precipitado foi descartado e o sobrenadante precipitado por sulfato de amônio a 90%, conforme descrito anteriormente. Ao final, o sobrenadante foi descartado e o precipitado ressuspenso em 2 mL de tampão B.
32
Figura 8: Etapas realizadas para a extração de proteínas solúveis a partir fígado de camundongos Swiss, eritrócitos humanos e vermes adultos de S. mansoni.
4.3. Cromatografia de filtração molecular em Sephacryl S-400
Os extratos de proteínas solúveis das diferentes espécies, pré-enriquecidos como descrito no item 4.2, foram submetidos à uma cromatografia de filtração molecular em Sephacryl S-400 HR (Sigma Aldrich, Suécia). A coluna utilizada (dimensões: 60 x 1,5 cm) foi previamente equilibrada em tampão B (Tris-HCl 20 mM pH 7.5; NaCl 250 mM; DTT 1 mM; EDTA 1 mM; MgCl2 5 mM; glicerol 20%). As proteínas foram eluídas com um fluxo
33
4.3.1. Identificação das frações enriquecidas com o proteassoma 20S pela medida da atividade quimotripsina-símile
Alíquotas de 10 µL das frações eluídas para os extratos de fígado de camundongo e eritrócitos humanos e de 50 µL para o de vermes adultos de Schistosoma mansoni foram ensaiados quanto à atividade peptidásica em três diferentes condições: substrato; substrato e SDS 0,02%; substrato e MG-132 20 μM. Utilizou-se o substrato fluorogênico N-Suc-Leu-Leu-Val-Tyr-7-amido-4-metilcumarina (Sigma Aldrich, EUA) para a determinação da atividade quimotripsina-símile. Inicialmente, as alíquotas das frações proteicas foram pré-incubadas a 37ºC por 15 minutos em tampão 20S (Tris-HCl 50 mM pH 7,5; DTT 1 mM; MgCl2 5 mM). Após o período de pré-incubação, adicionou-se o substrato para uma
concentração final de 25 μM em um volume reacional de 125 μL. A reação permaneceu incubada por mais 1 hora, sendo interrompida pela adição de 2 mL de SDS 1%. Realizou-se a detecção fluorimétrica em espectrofluorímetro Shimadzu® RF-5301PC nos comprimentos de onda 380nm (excitação) e 440nm (emissão). As frações que possuíam maior quantidade de proteassoma 20S, ou seja, frações ativadas pelo SDS 0,02% e inibidas pelo MG-132, eram então agrupadas para os ensaios de atividade proteolítica com os inibidores sintetizados. A determinação da concentração proteica destas frações foi realizada utilizando-se o método do BCA (Smith et al., 1985) (Thermo Scientif, EUA), segundo recomendações do fabricante.
4.4. Eletroforese unidimensional em gel de poliacrilamida (SDS-PAGE)
Cerca de 10 µg das frações enriquecidas com proteassoma 20S provenientes da cromatografia de filtração molecular foram analisadas por eletroforese em gel de poliacrilamida. A eletroforese foi realizada segundo o método descrito por Laemmli (1970), utilizando géis de separação a 10% e géis de concentração a 5% em condições desnaturantes.
34
Molecular Weight Marker Kit (Sigma Aldrich, EUA). A amperagem adotada foi de 20 mA por gel. Após a corrida em tampão Tris-HCl 25 mM, glicina 0,19 M e SDS 0,1%, o gel foi corado com Coomassie Blue R-250 0,025% em 40% de etanol e 7% de ácido acético. Utilizou-se o software Quantity One (Bio-Rad®) versão 4.6.9 para a realização das análises densitométricas.
4.5. Obtenção de soro policlonal para a detecção de subunidades α do
proteassoma 20S
A produção de soro policlonal para detecção do proteassoma foi induzida utilizando-se como antígeno imunogênico o peptídeo TVWSPQGRLHQVEYAMEA, sintetizado conforme a metodologia descrita no item 4.1. Este peptídeo corresponde a uma sequência N-terminal presente nas subunidades α do proteassoma 20S, altamente conservada em eucariotos (Hendil
et al., 1995). O peptídeo foi ligado ao carregador proteico KLH (Keyhole Limpet Hemocyanin) (Sigma Aldrich, EUA) através de ligação com glutaraldeído. Para cada 1 mg de peptídeo, adicionou-se 1 mg de KLH em 200 μL de tampão borato pH 10 e 100 μL de glutaraldeído 0,3%, permanecendo a reação sob agitação contínua por 2 horas. Após este período, o glutaraldeído reativo foi inativado durante 30 minutos após adição de 25 μL de glicina 1M. A solução resultante foi dializada contra tampão borato pH 8,5 e posteriormente liofilizada.
35 4.6. Western Blotting
Realizou-se a técnica de Western Blotting (Towbin et al., 1979) para a detecção do proteassoma 20S nas frações enriquecidas com este complexo obtidas após a cromatografia de filtração molecular em Sephacryl S-400. Cerca de 10 μg das frações enriquecidas de proteassomas obtidas de fígado de camundongo, eritrócitos humanos e vermes adultos de
Schistosoma mansoni foram submetidas à eletroforeses em gel de poliacrilamida 10% e transferidas para membranas de PVDF (Polyvinylidene Fluoride) (Invitrogen) a 200 mA em tampão Tris-HCl 25 mM, glicina 192 mM, etanol 20% e SDS 0,02% sob refrigeração por duas horas. Em seguida, as membranas foram bloqueadas durante a noite em tampão Tris-HCl 50 mM pH 7,5, Tween-20 0,3% e leite em pó desnatado 5%, sendo posteriormente lavadas por três vezes com Tris-HCl 10 mM pH 7,5. Após essas lavagens, incubou-se a membrana em tampão imunoblotting (Tris-HCl 50 mM pH 7,5, NaCl 100 mM, Tween-20 0,013% e leite em pó desnatado 5%) sob agitação por 30 minutos. Soro contendo anticorpos policlonais anti-proteassoma, produzidos conforme descrito no item 4.5, foram adicionados ao tampão immunoblotting (1:500), reagindo por 3 horas à temperatura ambiente. Após o período de incubação, as membranas foram lavadas três vezes com Tris-HCl 10 mM pH 7,5 e novamente incubadas por 2 horas com tampão imunoblotting contendo o anticorpo secundário anti-IgG de camundongo conjugado com fosfatase alcalina (1:2000) (Sigma Aldrich, EUA). As membranas foram lavadas com Tris-HCl 10 mM pH 7,5 e reveladas com solução de NBT/BCIP (Nitro Blue Tetrazolium/5-Bromo-4-Cloro-3-Indolil Fosfato) (Sigma Aldrich, EUA), de acordo com as recomendações do fabricante.
4.7. Ensaios de atividade peptidásica com os inibidores sintetizados
36
foram utilizados para a determinação das atividades tripsina- e quimotripsina-símile, respectivamente. Para cada reação, utilizou-se entre 5 e 20 μg de proteínas. As alíquotas das frações proteicas foram pré-incubadas a 37ºC por 15 minutos em tampão 20S juntamente com 1 μM de cada peptídeo sintetizado. Em seguida, a reação iniciou-se pela adição de 25 μM do substrato fluorogênico e do ativador SDS 0,02% em um volume reacional de 125 µL, sendo interrompida após 1 hora com 2 mL de SDS a 1%. A detecção fluorimétrica foi realizada em espectrofluorímetro nos comprimentos de onda 380nm (excitação) e 440nm (emissão). Determinou-se a concentração dos peptídeos pelos coeficientes de extinção molar a 280 nm dos aminoácidos tirosina (1280 M-1 cm-1), triptofano (5700 M-1 cm-1) e cisteína (125 M-1 cm-1) ou a 260 nm para a fenilalanina (220 M-1 cm-1). As medidas de fluorescência foram realizadas
em quintuplicata para cada peptídeo sintetizado e os resultados expressos pela atividade inibitória em relação à obtida em um grupo controle na ausência de inibidores.
4.8. Análise estatística
A análise estatística dos resultados foi realizada com o software Graph Pad Prism
38 5. RESULTADOS E DISCUSSÃO
5.1. Síntese de peptídeos
5.1.1. Síntese em fase sólida e purificação em sistema HPLC
As sínteses do peptídeo PR-11 e de outras 13 estruturas análogas foram realizadas conforme especificado em materiais e métodos (item 4.1). Os peptídeos W12, F8W12 e G9 são análogos já descritos na literatura, os quais apresentaram um potencial de inibição superior ao PR-11 sobre o proteassoma 20S de humanos (Anbanandam et al., 2008). Os demais peptídeos foram propostos baseados na estrutura desses análogos, através da substituição conservativa de aminoácidos e a introdução de pares de cisteína para obtenção de peptídeos cíclicos. Assim sendo, alterou-se uma série de aminoácidos na região C-terminal: substituições de triptofano (W) por fenilalanina (F); leucina (L) por isoleucina (I); tirosina (Y) por alanina (A) e fenilalanina; tirosina, leucina e prolina (P) por cisteína (C) para a síntese de análogos cíclicos. As modificações concentraram-se na região C-terminal dos peptídeos, dado que a região N-terminal é importante para a manutenção da atividade inibitória sobre o proteassoma 20S (Gaczynska et al., 2003; Anbanandam et al., 2008).
39
Após a síntese em fase sólida, todos os peptídeos foram submetidos à cromatografia de fase reversa em sistema HPLC para a análise de pureza (figura 9).
40 Figura 9: Continuação.
Conforme observado na figura 9, os peptídeos sintetizados apresentaram diferentes perfis cromatográficos, dado que o rendimento e a pureza de síntese são dependentes do tamanho e da própria natureza da sequência de aminoácidos. As sínteses de peptídeos com um número elevado de aminoácidos ou envolvendo sequências que geram agregações justificam a maior impureza nos produtos de síntese e os cromatogramas mais complexos. A agregação impede uma completa solvatação do peptídeo ligado à resina e a acessibilidade de reagentes para permitir o acoplamento com os grupos amino N-terminais (Chan and White, 2000).
41
maiores dificuldades na etapa de purificação. Todavia, tal fato não impediu que todos os peptídeos fossem satisfatoriamente purificados.
Observou-se que todas as sínteses envolvendo o resíduo triptofano apresentaram cromatogramas complexos. Há duas reações laterais principais que ocorrem com esse aminoácido: oxidação durante a síntese e a alquilação do anel indólico por carbocátions gerados durante a etapa de clivagem (Stewart and Young, 1984). O grupo protetor Pbf
liberado durante a desproteção de argininas pode alquilar a cadeia lateral do triptofano gerando subprodutos sulfonados (Fields and Fields, 1993). A figura 10 ilustra os aminoácidos derivatizados arginina e triptofano utilizados durante a síntese.
Figura 10: Estrutura dos aminoácidos derivatizados arginina e triptofano, destacando-se os respectivos protetores das cadeias laterais Pbf e Boc.
42
Figura 11: Estrutura do aminoácido derivatizado cisteína com o protetor da cadeia lateral Trt.
As sínteses dos peptídeos contendo cisteína no C-terminal apresentam, frequentemente, baixos rendimentos. Desta maneira, as sínteses dos análogos C8C15 e C9C15 foram iniciadas com um resíduo de glicina para facilitar a adição de cisteína, sem alterar, presumidamente, a atividade dos peptídeos (Chan and White, 2000). Logo, a introdução de um aminoácido pouco volumoso (glicina) funciona apenas como um espaçador entre a sequência peptídica e a resina.
Os análogos S9S15 e S1S14 mimetizam as estruturas de peptídeos cíclicos pelas substituições de resíduos de cisteína por serina. Esses aminoácidos podem ser considerados equivalentes quanto ao volume e hidrofilicidade, diferindo-se apenas quanto aos grupos funcionais das cadeias laterais. As alterações de cisteínas por serinas visam à obtenção de peptídeos semelhantes aos cíclicos, porém com um arranjo estrutural estendido. Os análogos S9S15 e S1S14 também tiveram as sínteses iniciadas por um resíduo de glicina.
43
44
5.1.2. Caracterização dos peptídeos por espectrometria de massas
Os peptídeos purificados foram analisados por espectrômero de massas LCMS-IT-TOF do tipo electrospray. Todos os peptídeos sintetizados apresentaram massas moleculares condizentes com as preditas pela ferramenta ExPASy – Compute PI/Mw tool, confirmando o alto grau de pureza e suas identidades. A figura 13 apresenta os espectros de massas de alguns dos análogos identificados, destacando-se os picos correspondentes ao peptídeo de massa molecular esperada.
45
As recromatografias de todos os peptídeos purificados, juntamente com a caracterização por espectrometria de massas, estão apresentadas na seção apêndice.
5.2. Identificação das frações enriquecidas com o proteassoma 20S submetidas à cromatografia de filtração molecular em Sephacryl S-400
5.2.1. Ensaios de atividade peptidásica quimotripsina-símile
46
47
Baixas concentrações de SDS são capazes de ativar a atividade quimotripsina-símile in vitro. Embora o mecanismo de ativação não esteja claro, sugere-se que agentes caotrópicos como o SDS ou o calor podem seletivamente desnaturar a região N-terminal das subunidades α, facilitando o acesso do peptídeo ao núcleo catalítico (Kimura et al., 2000). Além disso, observa-se, in vivo, que os proteassomas interagem com várias proteínas intracelulares denominadas PIPs (Proteasome Interacting Proteins), responsáveis por regular a proteólise. A ruptura destas interações pelo SDS pode favorecer a entrada do peptídeo no núcleo catalítico, aumentando, assim, a taxa de hidrólise (Verma et al., 2000).
O MG-132, assim como outros peptídeos aldeídicos, são inibidores clássicos da atividade quimotripsina-símile do proteassoma. Apesar da alta seletivade para o proteassoma, o MG-132 também é capaz de inibir certas cisteíno-proteases lisossomais e calpaínas (Lee
and Goldberg, 1998).
A análise dos gráficos permitiu a identificação das frações enriquecidas com proteassoma 20S (ativadas por baixas concentrações de SDS e fortemente inibidas pelo MG-132): fração 15 para o extrato de fígado de camundongo Swiss, fração 16 para o extrato de eritrócitos humanos e frações 17 a 19 para o extrato de vermes adultos de S. mansoni (setas indicativas em vermelho). Observa-se que essas frações correspondem ao início dos picos cromatográficos, o que proporcionou uma separação satisfatória do proteassoma 20S das demais proteínas e proteases de menor massa molecular. Além disso, o fato dos 3 proteassomas apresentarem picos em frações aproximadamente equivalentes, indica que no enriquecimento predomina a forma 20S, de massa molecular altamente conservada entre os eucariotos.
Nas frações das amostras de eritrócitos humanos e S. mansoni, observa-se um menor conteúdo e heterogeneidade de proteases, uma vez que as mesmas foram fortemente inibidas pelo MG-132. Por outro lado, é possível notar que na amostra de fígado de camundongo, entre as frações 16 a 18, há uma maior proporção de outras proteases citossólicas, dado que a presença de SDS 0,02% no meio reacional diminuiu a atividade peptidásica e o MG-132 não a inibiu totalmente.