UNIVERSIDADE FEDERAL DO CEARÁ
REDE NORDESTE DE BIOTECNOLOGIA - RENORBIO PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA
JOSÉ JACKSON DO NASCIMENTO COSTA
EXPRESSÃO DE MARCADORES DE CÉLULAS GERMINATIVAS E DE OÓCITOS EM FIBROBLASTOS BOVINOS TRATADOS COM 5-AZA-CITIDINA E EM CÉLULAS-TRONCO ADULTAS CULTIVADAS IN VITRO NA PRESENÇA DE BMP-2,
BMP-4 OU FLUIDO FOLICULAR
JOSÉ JACKSON DO NASCIMENTO COSTA
EXPRESSÃO DE MARCADORES DE CÉLULAS GERMINATIVAS E DE OÓCITOS EM FIBROBLASTOS BOVINOS TRATADOS COM 5-AZA-CITIDINA E EM CÉLULAS-TRONCO ADULTAS CULTIVADAS IN VITRO NA PRESENÇA DE BMP-2,
BMP-4 OU FLUIDO FOLICULAR
Tese apresentada ao Curso de Doutorado em Biotecnologia da Rede Nordeste de Biotecnologia – RENORBIO da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Biotecnologia. Área de concentração: Biotecnologia em Agropecuária. Orientador: Prof. Dr. José Roberto Viana Silva Co-orientadora: Profa. Dra. Márcia Viviane Alves Saraiva
A Deus, pela minha existência, pela força, coragem e determinação que me foi dada para alcançar mais esse objetivo, porque nada nos é possível se não for de Sua vontade,
AGRADECIMENTOS
A Deus, pelo seu amor e pela sua infinita misericórdia manifestados a cada dia em minha vida. Pela proteção, força e coragem para enfrentar todas as dificuldades da vida pessoal e profissional. Senhor, a minha confiança descansa em tuas mãos. Sempre espero e confio em ti. Obrigado por mais essa vitória.
À minha esposa Amélia Araújo, agradeço pelo amor, amizade, companheirismo, apoio nos momentos mais difíceis e pela compreensão que me deram suporte na trajetória final deste trabalho. “Entre as coisas mais lindas que eu conheci, só reconheci suas cores belas quando eu te vi. Entre as coisas bem-vindas que já recebi, eu reconheci minhas cores nela então eu me vi.” Sou muito mais feliz com você e com nossa filha Val. Que o Senhor continue nos abençoando cada dia mais.
Aos meus pais José Ponte Costa e Maria de Fátima do Nascimento, por terem me dado a vida e por todo amor e dedicação fundamentais em todos os momentos da minha vida. Aos meus irmãos Janilson Costa e sua esposa Cristiane Santos Costa, Jailson Costa e Jamile Costa, com os quais dividi momentos de alegrias e tristezas, e que sempre estarão me incentivando e torcendo pelo meu sucesso. De forma especial, agradeço à minha sobrinha, Ana Clara Costa, uma das maiores alegrias da minha vida, você é muito especial.
Aos meus avós Pedro do Nascimento e Maria da Conceição do Nascimento, por todo o amor e carinho dedicados a mim, vocês são essenciais para a minha vida. E ainda agradeço a todos os meus tios(as) e primos(as), que longe ou perto sempre me ajudaram, torcem por mim e sempre estarão no meu coração. Em especial ao meu tio José Maria Costa e José Astélio Costa, por cuidarem de mim desde a infância, educando e sempre orientando os caminhos retos a seguir.
Ao orientador Prof. Dr. José Roberto Viana Silva, pela orientação deste trabalho, paciência, pela dedicação dispensada, confiança e profissionalismo demonstrados no decorrer de nossa convivência. Agradeço pela contribuição decisiva na minha formação e pelo muito que aprendi durante os anos de mestrado e doutorado.
À co-orientadora e amiga Profa. Dra. Márcia Viviane Alves Saraiva pela dedicação constante e por sempre estar disposta a ajudar em todos os momentos.
Aos queridos amigos integrantes do grupo de pesquisa de Reprodução e Cultura de Células: Ellen de Vasconcelos da Cunha, Francisco Taiã Gomes Bezerra, Laís Feitosa, Ana Kelry Carneiro Lopes, Éverton Pimentel, Adriel Pereira, Edilcarlos Max, Hozana Braga, Pedro Alves, Miguel Fernandes, Laryssa Barrozo, Bruno Matos Brito e Bianca Silva.
À querida amiga Juliane Passos e a toda família Passos, Cleuton Monteiro, tia Mazé e Neyla, agradeço pela amizade, companheirismo, apoio e incentivo desde o início e por me tratarem sempre com muito carinho, como se eu fosse um irmão. Obrigado pelo apoio e pelas palavras de carinho nos momentos mais difíceis.
Aos amigos e vizinhos Jordânia Marques, Clayrtiano Freire, João Arthur Freire e Maria das Graças Oliveira, agradeço de forma especial, pelo convívio, confiança, amizade e companheirismo durante todos esses anos. Que Deus continue abençoando nossa amizade.
Aos amigos Anderson Weiny Silva, Regislane Pinto Ribeiro, José Renato de Souza Passos e Glaucinete Borges, agradeço pela amizade, pelos conselhos, pelos momentos de trabalho e pelos momentos de descontração. Admiro a competência de vocês.
Aos amigos Tânia de Azevedo Lopes, Antônia Moemia Lucia Rodrigues Portela, Gisvani Lopes de Vasconcelos, Katianne dos Santos Freitas e Danielle Val, obrigado por me aguentarem todos esses anos, obrigado pela amizade, carinho e momentos de diversão e de trabalho também. Sem as risadas de vocês tudo teria sido mais difícil. É bom ter o privilégio da presença de vocês na minha vida. Sou grato a Deus por nossa amizade, vocês são especiais.
Ao prof. Dr. Rodrigo Maranguape pelo incentivo dado aos meus primeiros passos na pesquisa durante minha iniciação científica e a toda equipe do Laboratório de Genética Molecular do NUBIS, de forma especial a Auxiliadora Oliveira, João Garcia, Tatiana Farias, Nayane Hardy, Aurilene Cajado, Jedson Aragão, pela convivência durante todos esses anos.
Aos integrantes da banca examinadora, Profa. Dra. Ana Paula Ribeiro Rodrigues; Profa. Dra. Maria Helena Tavares de Matos; Profa. Dra. Valdevane Rocha Araújo; Prof. Dr. Igor Iuco Castro da Silva; Prof. Dr. Antonio Silvio do Egito; Profa. Dra. Juliana Jales De Hollanda Celestino; por terem gentilmente aceito o convite para participar da banca de defesa desta tese e pela solicitude em contribuir no engrandecimento deste trabalho.
Aos funcionários da Faculdade de Medicina de Sobral pela convivência, atenção e disponibilidade durante todos esses 10 anos de convívio.
A todos que de alguma forma me deram força e incentivo na realização do meu doutoramento, seja profissionalmente ou sentimentalmente e por participarem da minha vida.
RESUMO
ABSTRACT
This study aimed to investigate the effect of 5-Aza-cytidine during induction of pluripotency, and evaluate the effects of culture in medium containing BMP-2, BMP-4 or follicular fluid in the differentiation of fibroblasts in primordias germ cells (CGP) and oocytes (stage 1). Furthermore, isolation of stem cells from the bovine ovarian epithelium and evaluate the effects of BMP-2, BMP-4 or follicular fluid on the differentiation of these stem cells into structures similar to oocytes (stage 2). In phase 1, fibroblasts were treated with 0.5, 1.0 or 2.0 µM of 5-Aza for 18, 36 or 72 h. Morphology cell viability and gene expression (OCT-4, NANOG, SOX2 and REX), were assessed, for the selection of the concentration/time more efficient. The fibroblasts were then cultured in medium supplemented with 10 ng/mL BMP-2 or 10 ng/mL BMP-4 or 5% bovine follicular fluid by 7 or 14 days. Subsequently, evaluation of the morphology and cell viability was taken, and gene expression (VASA, DAZL, c-Kit, SCP3, ZPA and GDF -9). For phase 2, the stem cells of ovarian surface were isolated, expanded, grown in differentiation medium containing 50 ng/mL BMP-2 or 50 ng/mL BMP-4, or BMP-2+BMP-4 or 5% bovine follicular fluid for 14 days. Morphological characteristics, cell viability and expression of alkaline phosphatase and gene expression (VASA, DAZL, C-KIT, SCP3, ZPA and GDF -9), were evaluated. The gene expression results were analyzed using ANOVA followed by Kruskal-Wallis test (P <0.05). In stage 1, the culture with 2.0 µM of 5-Aza for 72 h caused changes in morphology and cell proliferation rate, and significantly increased the expression of pluripotency factors. The culture in medium containing BMP-2, BMP-4 or follicular fluid for 7 or 14 days, altered cellular morphology, and expression of specific genes for stem cells and oocytes. In stage 2, the ovarian stem cells expressed pluripotent genes, and after culture, this cells showed morphologic characteristics similar to PGC and oocytes, including the expression of alkaline phosphatase, and the expression of specific genes for PCG and oocytes. In conclusion, the present study describes the possibility of conversion of the skin fibroblasts and stem cells from ovarian surface of the bovine, in oocyte-like cells, similar oocyte cells, through the cell reprogramming process associated with the supplementation of BMP-2, BMP- 4 and follicular fluid.
LISTA DE ILUSTRAÇÕES
Figura 1 - Desenho esquemático do ovário de mamíferos com suas diversas
estruturas... 28
Figura 2 - Representação esquemática do desenvolvimento das CGP e dos sinais envolvidos na regulação da migração e colonização CGP em camundongos... 31
Figura 3 - Especificação da linhagem germinativa e eventos moleculares... 34
Figura 4 – Representação esquemática do papel da sinalização das BMPs e WNT durante a formação das células germinativas primordiais (CGPs) em embriões... 36
Figura 5 – Regulação da transcrição da especificação das CGPs... 37
Figura 6 – Isolamento e diferenciação das células-tronco embrionárias... 43
Figura 7 – Isolamento e diferenciação de células-tronco mesenquimais... 45
Figura 8 – Reprogramação de células adultas e formação das células iPS... 50
CAPÍTULO 1 Figure 1 - Schematic presentation of the development of stem cells into oocytes-like cells, and the stimulating substances and markers for each stage of differentiation…. 92 Figure 2 - Procedure for restoring fertility by differentiating iPS into oocytes... 93
CAPÍTULO 2 Figure 1 - Representative pictures of the morphological changes in bovine skin fibroblasts exposed to 5-Aza. (A) The fibroblast cells isolated from bovine fetal ear skin (untreated cells). (B) Fibroblasts exposed to 2.0 µM of 5-Aza for 72 h. (C) Fluorescence staining of viable cells for Calcein AM. (D) Fluorescence staining of apoptotic cells for ethidium homodimer-1. Scale bar = 100 µm……….………...……….. 133
Figure 2 - Levels of mRNA for SOX2 (A), NANOG (B), OCT4 (C) and REX (D) in fibroblasts cultured for 18 h in with different concentrations of 5-Aza (0.5, 1.0 or 2.0 µM)……….. 134 Figure 3 - Levels of mRNA for SOX2 (A), NANOG (B), OCT4 (C) and REX (D) in
µM)………... 135 Figure 4. Levels of mRNA for SOX2 (A), NANOG (B), OCT4 (C) and REX (D) in
fibroblasts cultured for 72 h in with different concentrations of 5-Aza (0.5, 1.0 or 2.0
µM)……… 136
Figure 5. Levels of mRNA for of pluripotency genes, (A) SOX2, (B) NANOG, (C) OCT4 and (D) REX, in fibroblasts cultured for 18 h, 36 h or 72 h in with different
concentrations of 5-Aza (0.5, 1.0 or 2.0 µM)……… 137 Figure 6. Representative pictures of the morphological characterization in bovine
skin fibroblasts exposed to 5-Aza and cultured in differentiation medium for 14 days. Fibroblast cultured for 14 days in differentiation medium supplemented with 10 ng/mL of BMP-2 (line 1), 10 ng/mL of BMP-4 (line 2), 5% follicular fluid (line 3), (A, D, G) cell analyzed by light microscopy, (B, E, H) Fluorescence staining of viable cells for Calcein AM; (C, F, I) Fluorescence staining of apoptotic cells for
ethidium homodimer-1. Scale bar = 100 µm………. 138 Figure 7. Levels of mRNA for markers of germ cells [VASA (A, B), DAZL (C, D),
C-KIT (E, F)] in cells cultured for 7 (A, C, E) or 14 (B, D, F) days in control medium or supplemented with BMP-2 (10 ng/mL), BMP-4 (10 ng/mL) and 5%
follicular fluid……… 139 Figure 8. Levels of mRNA for markers of oocytes [ZPA (A, B), GDF -9 (C, D),
SCP3 (E, F)] in cells cultured for 7 (A, C, E) or 14 (B, D, F) days in control medium or supplemented with BMP-2 (10 ng/mL), BMP-4 (10 ng/mL) and 5% follicular
fluid……… 140
Figure 9. Levels of mRNA for markers of germ cells [VASA (A), DAZL (B) and C-KIT (C)] and oocytes [ZPA (D), GDF -9(E), C-C-KIT (F)] after culture cells for 0 h
(5-Aza), 7 or 14 days in control medium………... 141 Figure 10. Levels of mRNA for markers of germ cells [VASA (A), DAZL (B) and
C-KIT (C)] and oocytes [ZPA (D), GDF-9(E), C-C-KIT(F)] after culture cells for 0 h
(5-Aza), 7 or 14 days in medium supplemented with 10 ng/mL of BMP-2………... 142 Figure 11. Levels of mRNA for markers of germ cells [VASA (A), DAZL (B) and
C-KIT (C)] and oocytes [ZPA (D), GDF-9(E), C-C-KIT(F)] after culture cells for 0 h
Figure 12. Levels of mRNA for markers of germ cells [VASA (A), DAZL (B) and C-KIT (C)] and oocytes [ZPA (D), GDF-9(E), C-C-KIT(F)] after culture cells for 0 h, 7 or
14 days in medium supplemented with 5% follicular fluid………... 144
CAPÍTULO 3
Figure 1. Fluorescence staining of ovarian stem cells before (A-B) and after 14 days culture in minimum essential medium (α-MEM) (C-D) or supplemented with BMP2 (E-F), BMP4 (G-H), both BMP2 and BMP4 (I-J) and follicular fluid (K-L). Scale bar = 100 µm. Green (calcein) staining cells are viable and red (ethidium
homodimer) staining cells are not……….. 167 Figure 2. Alkaline phosphatase activity in ovarian stem cells at day 0. Scale bar =
100 µm………... 168
Figure 3. Cycle threshold (CT) after amplification of mRNA for pluripotency stem
cell markers (OCT4 and SOX2) by real time qRT-PCR……… 168 Figure 4. Levels of mRNA for specific germline cell [VASA (A), DAZL (B)] and
oocyte [SCP3 (C), GDF9 (D) and ZPA (E)] markers in ovarian stem cells cultured for 14 days in MEM supplemented with BMP2, BMP4, BMP2 and BMP4 and
LISTA DE TABELAS
CAPÍTULO 1
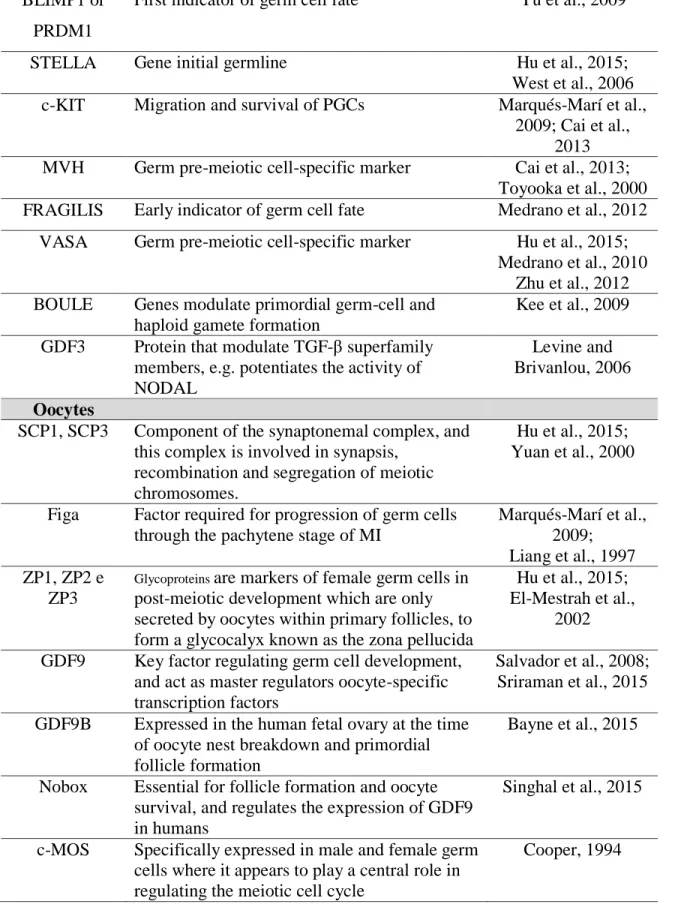
Table 1. Molecular markers for stem cells, PCGs, oocytes and their functions... 89
CAPÍTULO 2
Table 1. Primer pairs used in real-time PCR for quantification of markers of pluripotency, germ cells and oocytes genes expressed in cells cultured………... 132
CAPÍTULO 3
LISTA DE ABREVIATURAS E SIGLAS
Português Inglês
Alk2 Receptor de ativina semelhante à quinase tipo 2
Activin receptor-like kinase-2
AP Fosfatase alcalina Alkaline phosphatase
AP2g Proteína de ligação e ativação do regulador - 2 gama
Activating enhancer binding protein 2 gamma
ASC Células-tronco adultas Adult stem cells
AVE Endoderma visceral anterior Anterior visceral endoderm Blimp1 Proteína de maturação induzida por
linfócitos B - 1
B lymphocyte-induced maturation protein-1
BMP Proteína morfogenética óssea Bone morphogenetic protein BMP-15 Proteína morfogenética óssea - 15 Bone morphogenetic protein – 15 BMP-2 Proteína morfogenética óssea - 2 Bone morphogenetic protein – 2 BMP-4 Proteína morfogenética óssea - 4 Bone morphogenetic protein – 4 BMP-8b Proteína morfogenética óssea - 8b Bone morphogenetic protein - 8b
BOULE Proteína Boule Boule protein
BRG1 Brahma-Related Gene - 1
BSA Albumina sérica bovina Bovine serum albumin CD133 Antígeno também conhecido por
prominina-1
Antigen also known as prominin-1
CDH1 Caderina-1 Cadherin-1
CDX2 Caudal-related homeobox
CGP Célula Germinativa Primordial Primordial germ cell c-Kit Receptor para kit ligante Kit ligand receptor
c-MYC Myc proto-oncogene protein
COLA4 Colagenase microbiana Microbial collagenase
Cx43 Conexina 43 Connexin 43
DA Aorta dorsal Dorsal aorta
DDX-4 Polipeptídeo caixa DEAD 41 DEAD box polypeptide 4 Dmc1 Proteina de recombinação meiótica 1 DNA meiotic recombinase 1
DMEM/F12 Dulbecco's Modified Eagle Medium:
Nutrient Mixture F-12 DNA Ácido desoxirribonucleico Deoxyribonucleic acid
DNMT DNA metiltransferase Deoxyribonucleic acid
methyltransferase
DNMT1 DNA metiltransferase 1 Deoxyribonucleic acid
methyltransferase 1
Dpc Dias pós-concepção Days post coitum
Dppa3 Gene de pluripotência associada ao desenvolvimento – 3
Developmental pluripotency associated 3 pseudogene 2
DVE Endoderma visceral distal Distal visceral endoderm
EBs Corpos embrióides Embryoid bodies
EM Mesoderma embrionária Embryonic mesoderm
Epi Epiblasto Epiblast
ESC Células-tronco embrionárias Embryonic stem cells
Evx1 Even-Skipped Homeobox 1
ExE Ectoderma extra-embrionário Extra-embryonic ectoderm ExM Mesoderma extra-embrionário Extra-embryonic mesoderm FGSCs Células-tronco de linha germinativa
feminina
Female germline stem cell
FIGα Factor in the germline alpha
FOP Falha ovariana precoce Premature ovarian failure
FOXH1 Forkhead box protein H1
Fragilis Mouse interferon-induced protein like
gene-1
FSH Hormônio Folículo Estimulante Follicle-stimulating hormone FSHR Receptor do Hormônio Folículo
Estimulante
Follicle-stimulating hormone receptor
GDF3 Fator de diferenciação de crescimento tipo 3
Growth differentiation factor type 3
GDF-9 Fator de diferenciação de crescimento tipo 9
Growth differentiation factor type 9
GFP Proteína fluorescente verde Green fluorescent protein giPS Células-tronco de pluripotência
induzidas caprinas
Goats induced pluripotent stem cells
GV Vesícula germinativa Germinal vesicle
H2AX Histona membro da família X H2A histone family member X HDAC Histona deacetilase Histone deacetylase
HDM Histona demetilase Histone demethylase
hESC Células-tronco embrionárias de humanos
Human embryonic stem cells
Hg Intestino primitivo Hindgut
HGF Fator de crescimento de hepatócitos Hepatocyte Growth Factor HMT Histona metiltransferase Histone methyltransferase
Hoxa1 Homeobox protein Hox-A1
Hoxb1 Homeobox protein Hox-B1
ICM Massa celular interna Inner cell mass
Ifitm3 Proteína transmembranar induzida 3 Interferon-induced transmembrane protein 3
IGF2 Fator de crescimento semelhante à insulina-2
Insulin like growth factor-2
IM Mesoderma intermediário Intermediate mesoderm iPS Células-tronco de pluripotência
induzidas
Induced pluripotent stem cells
IVF Fertilização in vitro In vitro fertilization KLF4 Fator semelhante a Kruppel – 4 Kruppel-like factor 4
KRT7 Queratina 7 Keratin 7
KRT8 Queratina 8 Keratin 8
LIN28 Lin-28 homolog A
MAPK Proteína cinase ativada por mitógenos Mitogen-activated protein kinase MEM Meio essencial mínimo Minimal essential medium mESCs Células-tronco embrionárias de ratos Mouse embryonic stem cells mRNA Ácido Ribonucléico mensageiro Messenger Ribonucleic Acid MSC Células-tronco mesenquimais Mesenchymal stem cells
mTS Células-tronco do trofoblasto murinho Stem cells from murine trophoblast Mvh Proteína de rato homóloga a proteína
VASA
Mouse vasa homolog
NaB Butirato de sódio Sodium butyrate
Nanog Nanog Homeobox
NANOS3 Nanos Homolog 3
NeC Cordão nefrogênico Nephrogenic cord
NoC Notocorda Notochord
NODAL Fator de diferenciação de crescimento nodal
Nodal growth differentiation factor
NT Tubo neural Neural tube
Oct4 Fator de transcrição ligado ao octâmero 4
Octamer-binding transcription factor 4
OCT-4A Fator de transcrição ligado ao octâmero 4A
Octamer-binding transcription factor 4A
OGSCs Células-tronco germinativas do ovário Ovarian germ stem cells OLC Células semelhantes a oócitos Oocyte-like cells
OMS Organização Mundial de Saúde World Health Organization ORF Quadro aberto de leitura Open reading frame
OSC Células-tronco ovarianas Ovarian stem cells
OSE Epitélio de superficie do ovário Ovarian surface epithelium OSKM OCT4, SOX2, KLF4 e MYC OCT4, SOX2, KLF4 and MYC PGC Célula germinativa primordial Primordial germ cell
Pgc7 Proteína 7 em células germinativas primordiais
PGCLC Células semelhantes a células germinativas primordiais
Primordial germ cell-like cells
pH Potencial hidrogeniônico Potential hydrogen
PMSG Gonadotrofina de égua prenhe Pregnant mare serum gonadotropin Pou5f1 Domínio POU, classe 5, fator de
transcrição 1
POU domain, class 5, transcription factor 1
Prdm1 Proteína dedo de zinco de domínio PR1
PR domain zinc finger protein 1
Prdm14 Proteína dedo de zinco de domínio PR 14
PR domain zinc finger protein 14
REC8 Proteína de recombinação meiótica 8 Meiotic recombination protein 8 RG108 N - Ftalil – L – Triptofano N-Phthalyl-L-Tryptophan
RNA Ácido Ribonucléico Ribonucleic acid
RNAm Ácido Ribonucléico mensageiro Messenger ribonucleic acid R-Smads Receptor regulado dos mensageiros
intracelulares
Receptor-regulated mothers against decapentaplegic homolog
SCP1 Proteína 1 do complexosinaptonêmico Synaptonemal complex protein 1 SCP2 Proteína 2 do complexosinaptonêmico Synaptonemal complex protein 2 SCP3 Proteína 3 do complexosinaptonêmico Synaptonemal complex protein 3 Smad1 Mensageiro intracelular do tipo 1 Mothers against decapentaplegic
homolog 1
SMAD2 Mensageiro intracelular do tipo 2 Mothers against decapentaplegic homolog 2
Smad4 Mensageiro intracelular do tipo 4 Mothers against decapentaplegic homolog 4
Smad5 Mensageiro intracelular do tipo 5 Mothers against decapentaplegic homolog 5
Sox2 Região determinante do sexo no cromossomo Y - Caixa 2
Sex determining region Y-box 2
SSEA Antígeno embrionárioestágio-específico
SSEA-1 Antígeno embrionárioestágio-específico 1
Stage specific embryonic antigen 1
SSEA-3 Antígeno embrionárioestágio-específico – 3
Stage specific embryonic antigen – 3
SSEA-4 Antígeno embrionárioestágio-específico – 4
Stage specific embryonic antigen – 4
STAT3 Transdutor de sinal e ativador da transcrição - 3
Signal transducer and activator of transcription 3
Stella Gene de pluripotência associado ao desenvolvimento - 3
Developmental pluripotency-associated 3
STELLAR Pseudogene de pluripotência 2 associado ao desenvolvimento - 3
Developmental pluripotency associated 3 pseudogene 2
Stra8 Gene 8 estimulado pelo ácido retinóico
Stimulated by retinoic acid gene 8
SYCP3 Proteína 3 do complexosinaptonêmico Synaptonemal complex protein 3 Tcfap2c Fator de transcrição AP-2 gama Transcription factor AP-2, gamma
TEKT1 Tektina-1 Tektin-1
TERT Transcriptase inversa da telomerase Telomerase reverse transcriptase TGF-β Superfamília de fatores de
crescimento transformante beta
Transforming growth factor beta
Tnap Fosfatase alcalina não especifica a tecidos
Tissue non-specific alkaline phosphatase
TRA1-60 Gene semelhante a podocalixina 60 Podocalyxin like 60 TRA1-81 Gene semelhante a podocalixina 81 Podocalyxin like gene 80 TS Células-tronco do trofoblasto Trophoblast stem cells
TSA Tricostatina A Trichostatin A
UCB Sangue de cordão umbilical Umbilical cord blood
Vasa Proteína Vasa Vasa protein
VE Endoderma visceral Visceral endoderm
VEGF Fator de crescimento endotelial vascular
VPA Ácido valpróico Valproic acid VSEL Células-tronco semelhante à células
embrionárias pequenas
Small embryonic-like stem cells
WNT3 Wingless-Type MMTV Integration
Site Family, Member 3 XEN Células-tronco do endoderma
extra-embrionário
Extraembryonic endoderm stem cells
LISTA DE SÍMBOLOS
Português Inglês
% Percentagem Percentage
~ Aproximadamente Aproximately
± SEM Erro padrão da média Standard error of the mean
°C Graus Celsius Degrees Celsius
µg Micrograma Microgram
µ L Microlitro Microliter
µm Micrômetro Micrometer
µM Micromolar Micromolar
CO2 Dióxido de carbono Carbon dioxide
h Hora Hour
IU/mL Unidades internacionais por mL International units per mL
min Minuto Minute
mg Miligrama Milligram
mL Mililitro Milliliter
mM Milimolar Millimolar
mm Milímetro Millimeter
ng Nanograma Nanogram
nm Nanômetro Nanometer
P < 0,05 Probabilidade de erro menor do que 5%
Error probabilities is less than 5%
P > 0,05 Probabilidade de erro maior do que 5%
SUMÁRIO
1 INTRODUÇÃO... 25 2 REVISÃO DE LITERATURA... 28 2.1 Ovário mamífero... 28 2.2 Formação e desenvolvimento das células germinativas e de oócitos... 29
2.2.1 Mecanismos de especificação das CGPs... 32 2.2.1.1 Sinalização da especificação das CGPs... 35 2.2.2 Migração de células germinativas primordiais... 37 2.3 Células-tronco: definição, classificação e aplicações... 39
2.3.1 Células-tronco embrionárias... 42 2.3.2 Células-tronco adultas... 44
2.3.2.1 Células-tronco ovarianas... 47 2.3.3 Células-tronco de pluripotência e reprogramação celular... 49 2.4 Proteínas morfogenéticas ósseas e seu papel durante a formação das
CGPs... 53 2.5 Fluido folicular e seu papel durante a formação das CGPs e
oócitos... 56
3 CAPÍTULO 1
7.2 Objetivos específicos... 98
8 CAPÍTULO 2
ARTIGO II: Expression of markers for germ cells and oocytes in cow dermal fibroblast treated with 5-aza-cytidine and cultured in presence of BMP -2, BMP -4 and follicular fluid... 99
9 CAPÍTULO 3
1 INTRODUÇÃO
A infertilidade tem sido reconhecida pela Organização Mundial de Saúde (OMS), como um problema de saúde pública em todo o mundo, emergindo como um dos principais desafios do novo milênio para aqueles envolvidos no tratamento de infertilidade e da reprodução assistida (VAYENA et al., 2001). No mundo, estima-se que a infertilidade afete aproximadamente 14% dos casais (BOIVIN et al., 2007). Assim, nos últimos anos, novas tecnologias reprodutivas tem sido desenvolvidas na tentativa de ajudar a reduzir este problema. Entretanto, nos países em desenvolvimento, as tecnologias reprodutivas mais recentes não estão disponíveis ou tem elevado custo financeiro (OMBELET et al., 2008). Além disso, a elucidação de mecanismos e fatores envolvidos na biologia reprodutiva possibilitará o desenvolvimento de protocolos de preservação de gametas de animais de elevado patrimônio genético ou em risco de extinção. As biotécnicas reprodutivas devem garantir a manutenção da morfologia folicular e a obtenção de oócitos viáveis a serem utilizados em programas de criopreservação, cultivo e fecundação in vitro, melhorando a produtividade de animais de alto valor zootécnico ou em via de extinção.
especialmente em pacientes com leucemia que podem abrigar células malignas na corrente sanguínea.
Além dos tratamentos de reprodução assistida estabelecidos acima, os cientistas estão desenvolvendo novas abordagens baseadas em células-tronco para o tratamento da infertilidade (CHIRPUTKAR; VAIDYA, 2015), visto que as células-tronco têm a capacidade de reconstituir os diversos tecidos corporais. As células-tronco embrionárias (ESC) são isoladas a partir da massa celular interna, permanecendo em estado indiferenciado e capazes de diferenciar-se em células das três camadas germinativas in vitro e in vivo. Já as células-tronco adultas (ASC) são conhecidas por estar presentes em vários órgãos do corpo, como a pele, medula óssea, cérebro, coração, tecido adiposo, etc. Estas células embora presentes na fase quiescente, podem ser estimuladas pela secreção de fatores solúveis para a reconstituição tecidual (CHIRPUTKAR; VAIDYA, 2015). As células de pluripotência induzida (iPS) foram mencionadas pela primeira vez em 2006, por Takahashi e Yamanaka, sendo então intensamente estudadas. Através desta técnica, células somáticas adultas, são modificadas e adquirem comportamento muito semelhante ao das células-tronco embrionárias, inclusive molecularmente. O uso das iPS reduz questões éticas relacionadas ao uso de células-tronco de origem embrionária. No entanto, os mecanismos biológicos relacionados à formação e diferenciação das iPS bovinas ainda não foram completamente elucidados (TAKAHASHI; YAMANAKA, 2006; YAMANAKA, 2008). Além disso, durante muitos anos, acreditou-se que não haveria a possibilidade de renovação da a reserva oocitária. Porém, com o avanço dos estudos da oogênese, a teoria se tornou alvo de grande controvérsia (TILLY; JOHNSON, 2007). Diante do exposto, as pesquisas que visam solucionar os problemas de infertilidade em humanos, bem como aumentar a eficiência reprodutiva de animais de alto valor genético ou em via de extinção, são de grande importância. Assim, a possibilidade de formação de novos oócitos após o nascimento, utilizando-se células-tronco de diferentes origens, pode ter uma importante aplicação terapêutica reprodutiva, mas ainda não se sabe quais os mecanismos ideiais para a produção de gametas.
2 REVISÃO DE LITERATURA
2.1 Ovário mamífero
A palavra ovário é derivada do latim ovum que significa ovo. Este órgão, além de ser a gônada feminina que contém o suprimento de células germinativas para a produção da próxima geração, funciona também como uma glândula reprodutiva que controla diversos aspectos fisiológicos e do desenvolvimento das fêmeas (EDSON; NAGARAJA; MATZUK, 2009). Dessa forma, o ovário possui dois papéis primários: (i) a liberação de um oócito inteiramente competente para fertilização e desenvolvimento embrionário, caracterizando a função gametogênica e (ii) a preparação de órgãos reprodutivos acessórios para a gestação e o nascimento através da produção de hormônios esteroides, que retrata a função endócrina deste órgão (GOUGEON, 2004).
Figura 1 - Desenho esquemático do ovário de mamíferos com suas diversas estruturas.
Nos mamíferos, o tamanho e o formato do ovário variam de acordo com a espécie e com a fase do ciclo estral/menstrual (HAFEZ; HAFEZ, 2004). Em geral, os ovários dos mamíferos estão organizados em córtex e medula (Figura 1) (ARAKI, 2003; GARTNER; HIATT, 2007). O epitélio superficial, pode variar o formato de pavimento à cuboide (mais comum), que cobre o ovário é denominado epitélio germinativo. Imediatamente abaixo deste epitélio, fica a túnica albugínea, uma cápsula de tecido conjuntivo denso não modelado, que é pouco vascularizada (GARTNER; HIATT, 2007). O córtex do ovário, com uma alta densidade celular, é constituído por uma estrutura de tecido conjuntivo, o estroma, que contém células semelhantes a fibroblastos (GARTNER; HIATT, 2007), assim como folículos ovarianos e/ou corpos lúteos em vários estágios de desenvolvimento e regressão (HAFEZ; HAFEZ, 2004). A medula, por sua vez, é constituída principalmente por tecido conjuntivo frouxo, altamente vascularizado (vasos sanguíneos e linfáticos), e fibras nervosas (GARTNER; HIATT, 2007). Histologicamente, não há um limite bem definido entre essas duas regiões (GARTNER; HIATT, 2007).
Os eventos que marcam a morfogênese do ovário fetal incluem a colonização por células germinativas primordiais (CGP), interação das células germinativas primordiais com células somáticas, formação dos cordões ovígeros e, finalmente, o desaparecimento dos cordões ovígeros com concomitante estabelecimento de uma população de folículos primordiais e uma complexa rede vascular (JUENGEL et al., 2002). A cronologia no desenvolvimento desses eventos que culminam na formação dos folículos primordiais parece ser semelhante em todos os mamíferos (SAWYER et al., 2002).
Durante muitos anos, acreditou-se que a reserva folicular ovariana fosse formada na embriogênese e que não haveria a possibilidade de renovação. Porém, com o avanço da ciência e consequente aumento de metodologias para o estudo da foliculogênese, a teoria se tornou alvo de grande controvérsia, pois demonstrou-se, então, a possibilidade de renovação, todavia, ainda não se sabe se ela realmente ocorre naturalmente e em quais condições poderia ocorrer (TILLY; JOHNSON, 2007).
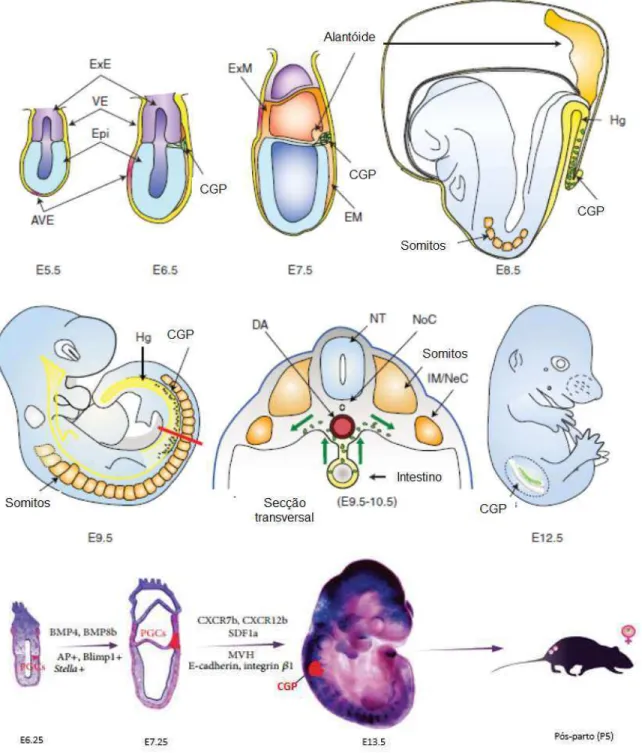
As CGP foram identificadas pela primeira vez em mamíferos por Chiquoine em 1954, que encontrou uma população de células capaz de gerar oócitos e espermatozoides (CHIQUOINE, 1954). As CGP, que se originam do epiblasto proximal, são os precursores embrionários dos gametas e a especificação destas células é uma das primeiras decisões do destino celular feita pelo embrião (YOUNG; DIAS; LOVELAND, 2010). Em camundongos, após cerca de 4,0-4,5 dias pós-concepção (dpc), o blastocisto é composto por três tipos de células, o trofectoderma, o ectoderma primitivo e a endoderme primitivo (ROSSANT; TAM, 2009). Após a implantação, em torno de 6,0 dpc, um pequeno grupo de células do epiblasto proximal, originado do ectoderma primitivo, é direcionado para entrar na linhagem germinativa e formar as CGPs (DE SOUSA LOPES et al., 2004; 2007) (Figura 2).
Figura 2 - Representação esquemática do desenvolvimento das CGP e dos sinais envolvidos na regulação da migração e colonização CGP em camundongos.
As oogônias são células-tronco germinativas que expandem sua população por meio de uma alta frequência de divisões mitóticas (PICTON; BRIGGS; GOSDEN, 1998). Devido às rápidas e consecutivas divisões mitóticas, as oogônias são muitas vezes unidas em aglomerados por pontes citoplasmáticas intercelulares, formando um sincício ou ninhos de oogônias, organizados em cordões ovígeros (PICTON, 2001; TINGEN; KIM; WOODRUFF, 2009). Durante a replicação do DNA, o ácido retinoico atua ativando proteínas responsáveis por desencadear o início da meiose, como por exemplo, STRA-8, REC-8, DMC-1 e SCP-3 (MARQUES-MARI et al., 2009; BOWLES et al., 2006; KOUBOVA et al., 2006). As oogônias apresentam um maior número de organelas intracelulares, antes de se diferenciarem em oócitos primários (SUH; SONNTAG; ERICKSON, 2002; ABIR et al., 2006). Os oócitos primários continuam a divisão meiótica passando pelos estágios de leptóteno, zigóteno e paquíteno da prófase I, até atingirem o estágio de diplóteno (ARAKI, 2003). Os oócitos permanecem nesse estágio até pouco antes da ovulação, em que após estimulação hormonal os oócitos completam a primeira divisão meiótica com a extrusão concomitante do primeiro corpo polar e param novamente na segunda divisão meiótica (oócito secundário), a qual será somente é concluída após a fertilização (BOWLES; KOOPMAN, 2007). Durante a fertilização pelo espermatozoide, o oócito completa a segunda divisão meiótica e extrusa o segundo corpo polar.
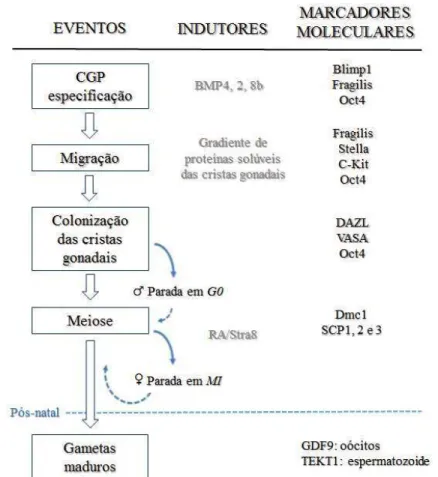
2.2.1 Mecanismos de especificação das CGPs
primordial germ cell 7, Pgc7, ou ainda conhecido como Developmental pluripotency-associated 3, Dppa3) (SATO et al., 2002) é uma pequena proteína que se transloca do citoplasma ao núcleo e ainda na direção oposta. F ragilis começa a ser expresso nas células no epiblasto proximal, com ~E6,25-E6,5, e sua expressão se intensifica no mesoderma extra-embrionário posterior. Já a expressão de Stella começa especificamente nas células que já estão expressando Fragilis no mesoderma extra-embrionário (~E7,0-E7,25), e continua a ser expressa na migração das CGP. Em aproximadamente E7, pequenos grupos de CGP, que são estabilizados por E-caderina, foram localizados posterior à linha primitiva no mesoderma extra-embrionário (HUMMITZSCH et al., 2015).
As células Stella-positivas mostram uma elevada expressão de fosfatase alcalina tecido não específica (Tnap), um gene para a atividade AP em CGP (MACGREGOR; ZAMBROWICZ; SORIANO,1995). As células com expressão positiva para Stella e altos níveis de RNAm para Fragilis reprimem a expressão de genes Homeobox tais como Hoxb1, Hoxa1, Evx1 e VL1, enquanto que as células Fragilis-positivas, mas Stella-negativas mantém a expressão de genes Hox (SAITOU; BARTON; SURANI, 2002). Saitou et al. (2002) propuseram que as células Stella-positivas e Homeobox-negativas são importantes para o estabelecimento das CGP. Além disso, estudos revelaram que nem Fragilis e nem Stella são genes essenciais para a especificação das CGP (PAYER et al., 2003; LANGE et al., 2008).
A análise do transcriptoma das CGP levou à identificação de dois genes reguladores chave para a especificação das CGP, Blimp1 (B lymphocyte-induced maturation protein-1, também conhecido como PR domain zinc finger protein 1 ou ainda PR domain containing 1, [Prdm1]) e Prdm14 (PR domain zinc finger protein 14 ou ainda PR domain containing 14) (OHINATA et al., 2005; VINCENT et al., 2005; YABUTA et al., 2006; KURIMOTO et al., 2008; YAMAJI et al., 2008). Ainda para a especificação de CGP em mamíferos, a expressão do gene Tcfap2c (também conhecido como AP2g) é necessária (WEBER et al., 2010). Todos os precursores de CGP Blimp1-positivas inicialmente expressam os genes Hox e reprimem Sox2 (YABUTA et al., 2006; KURIMOTO et al., 2008). No entanto, a partir E6.75, as células Blimp1-positivas começam a reprimir os genes Hox e expressam Sox2, Stella, e Nanog (YAMAGUCHI et al., 2005; KURIMOTO et al., 2008). As células Blimp1-positivas continuam a expressar Oct4, que regula o aumento da expressão de cerca de 500 genes de “especificação de células germinativas” e reduz a expressão de cerca de 330 genes “somáticos” (KURIMOTO et al., 2008).
Figura 3 - Especificação da linhagem germinativa e eventos moleculares.
direção ao cume gonadal, onde proliferam. Durante a migração destas células, há a expressão de genes como Stella e
c-Kit e iniciam a colonização do cume gonadal. Neste momento, as CGP expressam os marcadores pré-meióticos
Dazl e Vasa. As proteínas SCP1, SCP2 e SCP3 são específicas de células germinativas em meiose, assim como o gene Dmc1. Nas fêmeas, as células germinativas entram em meiose e param na prófase I. As células germinativas masculinas não entram em meiose, apenas após o nascimento. Os marcadores pós-meióticos GDF -9 e TEKT1 são específicos de gametas haplóides maduros. Fonte: adaptado de Marques-Mari (2009).
2.2.1.1 Sinalização da especificação das CGPs
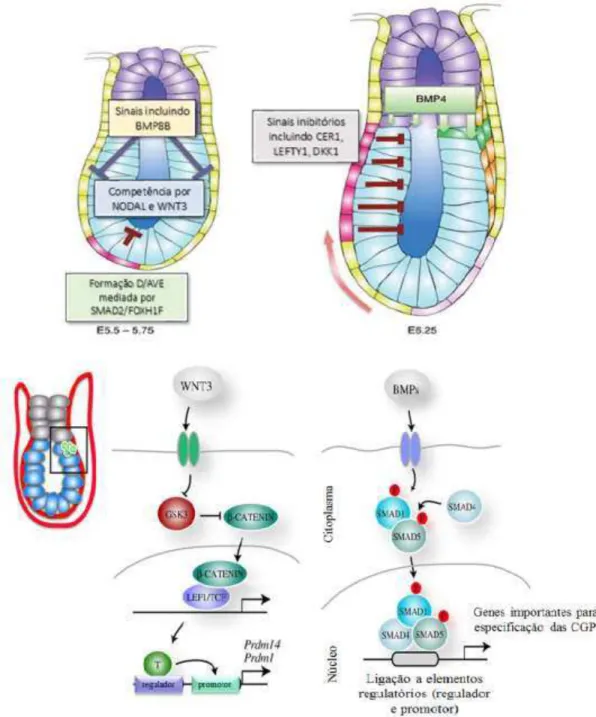
Por volta de 5,5 dias de desenvolvimento embrionário em camundongos, as células do epiblasto adquirem competência para responder a BMP-4 pelas atividades de NODAL e WNT3. Por outro lado, a sinalização NODAL mediada por SMAD2/FOXH1 específica de células da endoderme visceral distal, começam a fornecer sinais agonistas. Sinais do ectoderma extraembrionário, incluindo BMP8b, aparentemente previne o endoderma visceral proximal de diferenciar-se em endoderme visceral distal, restringindo assim, a atividade anti-agonista. Por volta dos dias 6,0-6,25, a endoderme visceral distal move-se para formar endoderme visceral anterior, e um subconjunto de células do epiblasto recebem altos níveis de sinais da BMP-4 a partir do ectoderma extraembrionário, os quais são especificados e iniciam a síntese de PRDM1 e PRDM14, que são marcadores positivos de CGPs (Figura 4). Desta forma, estes dois fatores têm sido utilizados para induzir a especificação de CGPs a partir de células-tronco embrionárias.
Figura 4 – Representação esquemática do papel da sinalização das BMPs e WNT durante a formação das células germinativas primordiais (CGPs) em embriões.
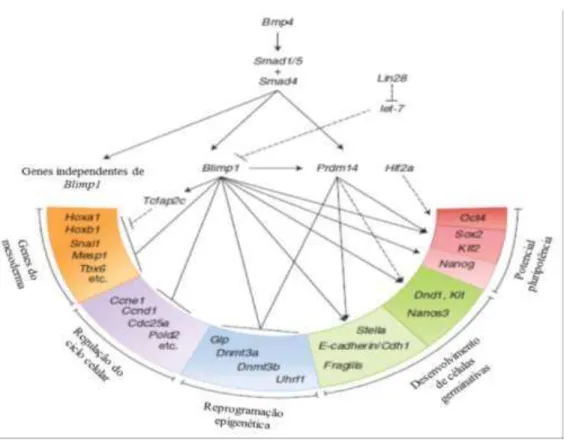
Figura 5 – Regulação da transcrição da especificação das CGPs.
Esquema das vias genéticas para a especificação das CGPs. Setas e linhas com barras de terminais as indicam vias de ativação e vias de repressão, respectivamente, conforme demonstrado por experimentos in vivo (KURIMOTO et al., 2008; YAMAJI et al., 2008); Setas e linhas pontilhadas com barras de terminais indicam vias de ativação e repressão, respectivamente, como proposto com base em experimentos in vitro (COVELLO et al., 2006; WEST et al., 2009; WEBER et al., 2010). Fonte: Adaptado de SAITOU; YAMAJI, (2012).
A sinalização WNT também é essencial para o destino das CGP (Figura 4), possívelmente através de interações pós-transcricionais, sugerindo que a expressão dos membros do sistema WNT podem atuar na sinalização das BMPs de maneira pós-transcricional (OHINATA et al., 2009). Em ~E9,5, as CGP migram para o intestino primitivo, e mais tarde através do mesentério dorsal, para os cumes genitais em desenvolvimento. Durante o processo de migração, CGPs ainda expressam Tnap, mas também Oct3/4, o proto-oncogene c-Kit, e SSEA (antígeno específico da fase embrionária) 1 e 3.
2.2.2 Migração de células germinativas primordiais
começam a apresentar morfologia polarizada e extensões citoplasmáticas (ANDERSON et al., 2000). Em roedores, o primeiro passo na migração das CGP é o movimento das células da linha primitiva para o endoderma posterior em E7,5. Entre E8,5 e E13,5, as CGP Tnap-positivas proliferam e migram para as cristas genitais, entrando em meiose nas fêmeas ou em mitose nos machos, e ainda iniciam a diferenciação em oócitos ou espermatozoides (MOLYNEAUX et al., 2001; TILGNER et al., 2008). Embriões de camundongos E13,5 devem conter cerca de 24.000 CGPs em suas cristas genitais (TAM; SNOW, 1981). Ainda na fase migratória, as CGPs passam por uma extensa reprogramação do genoma e alterações epigenéticas, tais como metilação do DNA e modificações das histonas, além disso, o imprinting genômico pode ser necessário para restaurar a totipotência das linhagens de células germinativas (TILGNER et al., 2008).
Atualmente, não há evidências sobre as diferenças específicas do sexo durante a migração das CGP em qualquer espécie. Na gônada, um subconjunto de células germinativas adquire a capacidade de funcionar como células-tronco de linhagem germinativa, que se submetem a meiose para produzir oócitos ou espermatozoides e promover a geração do desenvolvimento embrionário (NIKOLIC et al., 2016).
A proteína Vasa é um componente essencial de germoplasma e representa um complexo pool de RNA e proteínas que são necessários para a determinação de células germinativas. Mutações no gene para VASA leva à esterilidade em ratas resultante de defeitos graves na oogênese (SAFFMAN; LASKO, 1999). Nos seres humanos, a expressão de VASA começa no fim da fase migratória das CGP (CASTRILLON et al., 2000). Tilgner et al. (2010) demonstraram que a expressão específica de Vasa nas células-tronco de linhagens germinativas durante a colonização da crista gonadal sugerem que Vasa é requerido para manter as CGP funcionais. Por exemplo, ratos machos homozigotos para Mvh (Mouse vasa homologue) são estéreis e exibem defeitos graves na espermatogênese, enquanto as fêmeas homozigotas são férteis (MENKE; KOUBOVA; PAGE, 2003; LASKO; ASHBURNER, 1990). Outros sinais envolvidos na regulação da migração e colonização das CGPs são a molécula de adesão E-caderina (BENDEL-STENZEL et al., 2000) e a moléculas da matriz extracelular integrina β1 (ANDERSON et al., 1999; CHEN et al., 2013). Infelizmente, a função exata desses fatores e as vias de sinalização ainda não foram completamente elucidadas.
teratomas após a injeção em ratos (SAITOU; YAMAJI, 2012; CHUMA et al., 2005; HAYASHI; DE SOUSA LOPES; SURANI, 2007). Além disso, CGPs migratórias expressam antígeno embrionário específico da fase 1 (stage-specific embryonic antigen 1 - SSEA1) (TILGNER et al., 2008). Após a chegada na gônada, a proteína de ligação ao RNA específico de células germinativas Dazl (Deleted in azoospermia -like) é essencial para o desenvolvimento das CGP (LIN; PAGE, 2005).
Muitos estudos revelaram que o Dazl pode se ligar a proteínas específicas chamadas de fatores de transcrição e potencializar a transcrição gênica (REYNOLDS et al., 2005; 2007; ZENG et al., 2009). Diversos trabalhos indicam que a proteína DAZL pode ter papéis adicionais nas CGP, especialmente estando envolvido com a apoptose, regulando a expressão das enzimas caspases, agindo como um mecanismo que impede a formação de teratomas, eliminando as CGP aberrantes (COOKE et al., 1996; RUGGIU et al., 1997; TSUI et al., 2000; CHEN et al., 2014). Gill et al. (2011) indicam que na ausência de DAZL, as CGP não se desenvolvem para além do estágio de CGP, mostrado pela expressão contínua de marcadores de pluripotência.
A pós-migração das CGP é marcada pela expressão de várias proteínas de ligação ao RNA, tais como MVH, DAZL e NANOS3 (REYNOLDS et al., 2005; ZENG et al., 2009; RUGGIU et al., 1997; TSUI et al., 2000; COOKE et al., 1996; CHEN et al., 2014; GILL et al., 2011; MCLAREN, 2003). Em camundongos, as CGP femininas rapidamente iniciam a meiose e param no estágio diplóteno da prófase I da meiose I, enquanto em machos as células se dividem mitoticamente e entram em repouso quando passam a ser chamados de gonócitos (NIKOLIC et al., 2016). Especificamente, as CGP aumentam a expressão de genes que lhes permitam sofrer diferenciação sexual e a gametogênese, como Stra8 (gene requerido para a iniciação meiótica) junto com Rec8 e Dmc1, enquanto suprimem a pluripotência (LIN et al., 2008; BALTUS et al., 2006; KOUBOVA et al., 2014; HU et al., 2015).
2.3 Células-tronco: definição, classificação e aplicações
de medula. Essas colônias eram derivadas de uma única célula, a célula-tronco (TILL; MCCULLOCH; SIMINOVITCH, 1964).
As células-tronco são uma população de células indiferenciadas, caracterizadas pela capacidade de sofrer auto-renovação e diferenciação em vários tipos de tecido (KOŹLIK; WÓJCICKI, 2014). Com base no seu potencial de diferenciação, as células-tronco são classificadas como totipotentes, pluripotentes, multipotentes e unipotentes. As células-tronco totipotentes estão presentes nas primeiras fases da ontogênese e podem diferenciar-se em todos os tecidos embrionários e na placenta. As células pluripotentes podem ser coletadas a partir da camada interna do blastocisto, e podem originar células das 3 camadas germinativas (ectoderma, endoderma e mesoderma). As células-tronco multipotentes podem ser encontradas em quase todos os tecido. Durante muito tempo acreditou-se que elas poderiam se diferenciar em células de uma camada germinativa (por exemplo, as células-tronco hepáticas poderiam diferenciar-se apenas em hepatócitos ou células dos ductos biliares), mas estudos recentes têm revelado que algumas células multipotentes têm o mesmo potencial das células-tronco pluripotentes. Já as células-tronco unipotentes, com menor potencial de diferenciação, são capazes de originar apenas um tipo de célula (por exemplo, as células-tronco da epiderme podem diferenciar-se apenas em células epiteliais escamosas queratinizadas superficiais) (BECK; BLANPAIN, 2012; KOŹLIK; WÓJCICKI, 2014).
dilemas éticos e sociais envolvidos na coleta, cultivo e experimentação dessas células-tronco, além disso, o uso deste tipo celular é restrito em muitos países (ZARZECZNY; CAULFIELD, 2009). Wakitani et al. (2003) indicam que o uso de células-tronco embrionárias pode levar a formação de células cancerígenas e de teratomas. Isto provavelmente está relacionada a métodos falhos e a limitações tecnológicas (WAKITANI et al., 2003).
As ASC são específicas para cada órgão, e estão presentes em pequenas quantidades em todos os tecidos. Por exemplo, as células-tronco hematopoiéticas compõem cerca de 0,001-0,01% das células sanguíneas (DA SILVA MEIRELLES; CAPLAN; NARDI, 2008). A morfologia e os marcadores proteicos permitem que cada células-tronco adulta possa ser classificada de acordo com o tecido que a origina. As ASC foram previamente classificadas como multipotentes, mas atualmente são conhecidos por serem pluripotentes. Devido ao fenômeno conhecido como “plasticidade” ou “transdiferenciação”, algumas destas células-tronco adultas podem produzir um novo tipo célular, quando transferida para outros tecidos (KOŹLIK; WÓJCICKI, 2014). Em 2006, Takahashi e Yamanaka, demonstraram que, mesmo células somáticas maduras, quando expostas a genes associados a pluripotência específica, podem “recuperar” a pluripotência de maneira semelhante às células-tronco embrionárias, com capacidade de diferenciação em células de qualquer camada germinativa. Estes experimentos foram realizados primeiro com fibroblastos de camundongos, e posteriormente com fibroblastos humanos, sendo estas células denominadas de células-tronco de pluripotência induzida (TAKAHASHI; YAMANAKA, 2006; TAKAHASHI et al., 2007).
sendo capazes de induzir neovascularização do tecido a partir da liberação de fatores de crescimento, tais como fator de crescimento do endotélio vascular (VEGF), fator de crescimento transformante (TGF) e fator de crescimento de hepatócitos (HGF) (CAI et al., 2009).
2.3.1 Células-tronco embrionárias
As células-tronco embrionárias (ESC) são linhagens de células pluripotentes, geralmente derivadas a partir da massa celular interna do blastocisto. Estas células são consideradas como um modelo para estudar a embriogênese (Figura 6, DE PAEPE et al., 2014). Podem ser propagadas indefinidamente em cultura, permanecendo em estado indiferenciado. Essa pluripotência refere-se à capacidade de uma célula em diferenciar-se em células das três camadas germinativas in vitro e in vivo. Os fatores de transcrição OCT4 (POU5F1), SOX2 e NANOG desempenham um papel importante na manutenção deste estado indiferenciado (BOYER et al., 2005; 2006).
Em ratos, tronco embrionárias, as tronco do trofoblasto (TS) e células-tronco do endoderma extra-embrionário (XEN) foram derivadas do blastocisto (YAMANAKA et al., 2006). As linhagens de ESC e mTS (células-tronco do trofoblasto murinos) têm sido derivadas de blastômeros no estágio de 1 a 8 células (CHUNG et al., 2006).
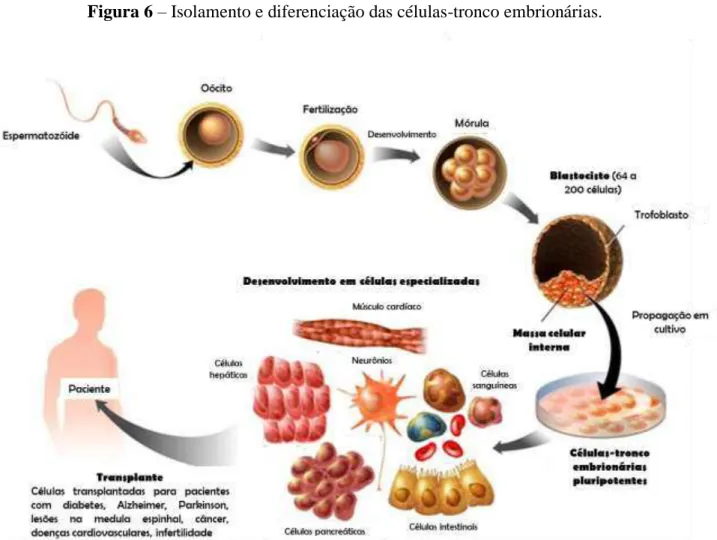
Figura 6 – Isolamento e diferenciação das células-tronco embrionárias.
As células-tronco embrionárias são removidas do blastocisto cerca de 4-5 dias após a fertilização. O processo ocorre quando o embrião em desenvolvimento apresenta aproximadamente 150 células. Essas células, quando estimuladas, apresentam o potencial de diferenciação de linhagens celulares. As células coletadas são cultivadas sob condições especiais de laboratório, podendo ser usadas para o tratamento de diferentes tipos de doenças, bem como para o
transplante em órgãos vitais. Fonte: Adaptado de
<http://sgugenetics.pbworks.com/w/page/38198357/Embryonic%20Stem%20Cells>.
células germinativas ainda é um processo falho (GEIJSEN et al., 2004; NAYERNIA et al., 2006; AFLATOONIAN et al., 2009).
2.3.2 Células-tronco adultas
Em organismos multicelulares, grupos de células semelhantes especializadas são agrupadas em tecidos e órgãos para executar funções específicas. No decorrer da vida adulta, estas células podem perder de maneira progressiva as suas funções. Para compensar essa perda contínua de células diferenciadas, novas células funcionais devem ser geradas de modo que tecidos permaneçam em homeostase. A manutenção e o reparo deste ciclo nos tecidos adultos, geralmente dependem de uma pequena população de células, as chamadas células-tronco adultas, que possuem a capacidade de se auto-renovar, dando origem a células diferenciadas, mantendo o seu número de células constante nos tecidos (WATT; HOGAN, 2000; FUCHS; CHEN, 2013).
A capacidade de auto-renovação tem sido considerada a definição característica de ASC (CLERMONT; LEBLOND, 1952, 1953; LEBLOND; STEVENS, 1948). Para a manutenção da homeostase, a proliferação e diferenciação de ASC deve ser perfeitamente equilibrada, de modo que, a divisão seguinte, uma das células- filha permanece como célula-tronco, ao passo que as outras se diferenciam diretamente, ou ainda através de uma série de divisões (KRIEGER; SIMONS, 2015).
O processo pelo qual as células-tronco dão origem a diferentes tipos celulares não é completamente compreendido e é denominado de diferenciação celular. Acredita-se que entre os fatores responsáveis por este fenômeno, estejam substâncias secretadas por células vizinhas, além de componentes do microambiente, presentes de forma solúvel ou ligados a matriz-extracelular (CARMO; SANTOS, 2009). As ASC estão presentes em praticamente todos os tipos de tecidos, no entanto, sua proporção em relação aos outros tipos celulares é baixa, o que torna estas células, difíceis de identificar, isolar e purificar (CARMO; SANTOS, 2009).
incluindo tecido adiposo, medula óssea, sangue do cordão umbilical (KERN et al., 2006; TAKEMITSU et al., 2012; STRIOGA et al., 2012), polpa dentária (XIAO; TSUTSUI, 2013), placenta e músculos (KISIEL et al., 2012). Ambas podem ser encontradas na medula óssea, mas a última também pode ser encontrada em outros tecidos (ZAGO; COVAS, 2006). A figura 7 ilustra um exemplo de diferenciação de células-tronco mesenquimais.
Devido a sua função de manutenção de tecidos adultos e de resposta a lesões do organismo, atribui-se as ASC um grande potencial terapêutico, no tratamento das mais variadas injúrias, como diabetes, doenças auto-imunes, na hematologia, na oftalmologia e na regeneração de lesões provocadas por acidentes. Devido a este provável potencial, tais células têm se tornado alvo de inúmeras pesquisas nos últimos anos, muitas das quais obtiveram resultados favoráveis (CARMO; SANTOS JÚNIOR, 2009).
Figura 7 – Isolamente e diferenciação de células-tronco mesenquimais.
As MSC podem ser isoladas de diferentes tecidos como adiposo, medula óssea, sangue do cordão umbilical, polpa dentária, placenta e músculos. Essas células, quando estimuladas podem se diferenciar tipos celulares, como adipócitos, condrócitos e osteócitos. Fonte: Disponível em: <http://www.eurostemcell.org/factsheet/mesenchymal-stem-cells-other-bone-marrow-stem-cells>.
manutenção de ESC (NICHOLS et al., 1998). Sox2 regula a expressão de Oct4, e mantém o estado pluripotente de ESC, enquanto Nanog é necessário para a manutenção do estado indiferenciado e para a auto-renovação das células-tronco (TAKEMITSU et al., 2012; ZOMER et al., 2015).
In vivo, as MSC proporcionam um suporte estrutural em diferentes órgãos e regulam o fluxo de algumas substâncias. Além disso, elas apresentam uma alta e rápida taxa de proliferação em meio de cultura simples, e podem ser mantidas in vitro, sem alterações do cariótipo por várias passagens (WEBSTER et al., 2012). As MSC têm a capacidade de se diferenciar em vários tipos de células, tais como adipócitos, osteócitos e condrócitos, a partir da camada germinativa mesodérmica (SACHS et al., 2012; DU et al., 2010). Esta plasticidade depende do ambiente da matriz extracelular e da presença de fatores de crescimento solúveis (VIDANE et al., 2013). Alguns autores induziram a diferenciação de MSC em células de outras camadas germinativas, como neurônios (KRAMPERA et al., 2007), que são originados do ectoderma, e hepatócitos que são derivados a partir do endoderma (AURICH et al., 2009). No entanto, a diferenciação em tecidos não-mesodérmicos ainda é controversa, devido a falta de resultados in vivo (STRIOGA et al., 2012).
Devido à sua plasticidade, as MSC são consideradas o tipo de célula mais importante para medicina regenerativa, e são as mais extensamente estudadas em ensaios pré-clínicos e clínicos. Suas vantagens para aplicação clínica incluem o fácil isolamento e alto rendimento, alta plasticidade, bem como a capacidade para mediar a inflamação e promover o crescimento e diferenciação celular, reparação de tecidos por imunomodulação e imunossupressão, e ainda, estão isentas de implicações éticas (LAGE-CONSIGLIO et al., 2013; PLOCK et al., 2013; INSAUSTI et al., 2014). Além disso, as MSC não formam teratomas após o transplante, garantindo a segurança para o receptor (ZOMER et al., 2015).
cultura e suplementação química (WEBSTER et al., 2012). Portanto, a identificação de fontes alternativas de MSC tem sido o ponto focal de pesquisas recentes. Entre diferentes fontes de MSC, o tecido adiposo destaca-se pela sua acessibilidade e pela abundância de células isoladas (LAM; LONGAKER, 2012; DU et al., 2010; HOUSMAN et al., 2002; CHERUBINO et al., 2011; KIM et al., 2011). Cada isolamento resulta em aproximadamente 100 vezes mais células do que o isolamento da medula óssea (DEY; EVANS, 2011), e o processo é muito menos invasivo (SACHS et al., 2012).
2.3.2.1 Células-tronco ovarianas
Diversos trabalhos indicam a existência das células-tronco ovarianas (OSC) nos ovários das fêmeas adultas (ZOU et al., 2009; WHITE et al., 2012; ZHANG et al., 2012; BHARTIYA et al., 2013; PARTE et al., 2014). Esta tese refuta as observações de Zuckerman et al. (1951), que postularam o dogma de que nos ovários de mamíferos na vida pós-natal não há OSC germinativas renováveis, assim, apoiando a hipótese de que durante a vida há um pool numericamente fixo de oócitos que serão direcionados para a fertilidade. Este pool contaria com cerca de 106 oócitos na puberdade. No entanto, esse número diminui com o envelhecimento até a completa exaustão na menopausa (ZUCKERMAN et al., 1951; SILVESTRIS et al., 2015). Esta hipótese foi posteriormente refutada por Johnson et al. (2004), que identificaram a presença de OSC mitoticamente ativas em ovários murinos jovens e adultos, capazes de garantir a disponibilidade de oócitos após o nascimento.
de camundongas fêmeas adultas, e depois transplantadas para a medula óssea de fêmeas adultas pré-esterilizadas com ciclofosfamida e bussulfan, detectando-se assim a geração significativa de novos folículos contendo oócitos e também a formação de corpo lúteo (JOHNSON et al., 2005). Assim, essas observações preliminares deram origem a novos estudos que visam o isolamento das OSC e sua transferência para animais estéreis com o intuito de recuperar a sua fertilidade (SILVESTRIS et al., 2015).
A primeira tentativa de isolar e cultivar as OSCs germinativas em mamíferos foi realizada por Zou et al. (2009) que purificaram OSCs de camundongas fêmeas neonatais e adultos, que foram infectadas com vírus GFP (proteína fluorescente verde) e transplantadas para ovários de camundongas inférteis. As células transplantadas participaram da oogênese e geraram descendentes (ZOU et al., 2009). White et al. (2012) isolaram e purificaram OSC humanas baseados na detecção imunológica de um marcador de superfície celular, o Dead box polypeptide 4 (Ddx-4). Essas células mostraram um padrão de expressão de genes de linhagens germinativas e, portanto, foram estabelecidas em cultura, injetadas em biópsias no tecido cortical de ovários humanos adultos. Foi observada a formação de novos folículos contendo oócitos do tecido transplantado (WHITE et al., 2012). Em contrapartida, Zhang et al. (2012) através de imagens de células vivas e de experimentos de neofoliculogênese, mostram que as células de ovários de ratas pós-natais, que expressam Ddx4, não entraram em mitose, e nem contribuem para renovação de oócitos durante a neofoliculogênese.
Virant-Klun et al. (2008; 2009) isolaram OSC a partir do epitélio de superfície do ovário (OSE) de mulheres normais, de mulheres na pós-menopausa e em mulheres com falha ovariana precoce (FOP). As células obtidas expressaram Ssea-4, Oct-4, Nanog, Sox-2 e c-Kit. Durante o cultivo, foi observada a diferenciação em células semelhantes à oócitos, que atingiram o diâmetro de até 95 µ m e expressaram Oct-4, c-Kit, Vasa e Zp2. Os resultados indicam que as células expressaram marcadores de células-tronco embrionárias, e esses dados podem ser usados para estudos que visem o tratamento autólogo da infertilidade ovariana e a cura doenças degenerativas como FOP (VIRANT-KLUN et al., 2008; 2009).
diferenciação espontânea em estruturas semelhantes à oócitos (BHARTIYA et al., 2013). Com base nestas observações, Parte et al. (2014) isolaram células-tronco do OSE de ovários de ovelhas usando SSEA-4 como marcador de superfície. Essas células foram analisadas por imunocitoquímica, imunofluorescência e por RT-PCR para detectar os marcadores específicos de linhagens de células-tronco e linhagens germinativas. Além disso, durante o cultivo, as células sofreram mudanças em suas características e diferenciaram-se espontâneamente em estruturas semelhantes à oócitos (PARTE et al., 2014). Hayashi e colaboradores (2012) induziram células-tronco embrionárias de camundongas para se diferenciarem em células semelhantes a células germinativas primordiais (PGCLC) que foram utilizadas para reconstituir o córtex ovariano. Após o transplante na bursa, os ovários foram reconstituídos, e em seguida, as PGCLCs foram isoladas e histologicamente analisadas, indicando que as PGCLCs contribuiram para a formação de oócitos. Os oócitos destes animais foram fertilizados, gerando filhotes que atingiram a idade adulta (HAYASHI et al., 2012).
Stimpfel et al. (2013) isolaram OSC no OSE de mulheres que expressavam marcadores de pluripotência como fosfatase alcalina, Ssea-4, Oct4, Ddx4. Essas células exibiram um elevado grau de plasticidade, uma vez que, quando adequadamente estimuladas, diferenciaram-se em várias células somáticas derivadas dos 3 folhetos germinativos (mesoderma, ectoderma e endoderma), e ainda sem formar teratomas em camundongos imunodeficientes (STIMPFEL et al., 2013).
2.3.3 Células-tronco de pluripotência induzidas e reprogramação celular
Figura 8 – Reprogramação de células adultas e formação das células iPS.
Na formação das células iPS, genes de pluripotêmcia são introduzidos nas células adultas de maneira a induzir a reprogramação. As células iPS resultantes se assemelham a células-tronco embrionárias e podem ser diferenciadas em qualquer tipo de célula, que podem ser utilizadas para estudos de doenças, teste de medicamentos ou correção de genes defeituosos e desenvolvimento de terapias com células. Fonte: Adaptado de <http://www.eurostemcell.org/factsheet/ips-cells-and-reprogramming-turn-any-cell-body-stem-cell>.
outras combinações de fatores foram testadas com sucesso, tais como a substituição de c-Myc e Klf4 por Nanog e Lin28 (YU et al., 2007), ou a exclusão de c-Myc (XU et al., 2013).
Nas células somáticas, os promotores de genes de pluripotência são altamente metilados, refletindo um estado transcricional reprimido (ZOMER et al., 2015). Mikkelsen et al., (2008) mostraram que a geração de células iPS envolve a ativação destes genes, e a sua desmetilação é utilizada para determinar o sucesso da reprogramação. Quando os genes de pluripotência exógenos são introduzidos na célula, induzem a expressão de genes pluripotência endógenos (JAENISCH; YOUNG, 2008). Por sua vez, o aumento da produção de fatores endógenos induz o silenciamento de genes exógenos por metilação dos promotores (HOTTA; ELLIS, 2008).
O valor terapêutico de células iPS é a presença de integrações provirais abrigando oncogenes conhecidos, especialmente c-Myc, bem como Oct4 e Klf4. c-Myc foi dispensável para a geração de iPS a partir de fibroblastos, e os camundongos quiméricos produzidos por células iPS que receberam esses três fatores (Oct4, Sox2 e Klf4), não apresentaram formação do tumor, enquanto as células derivadas dos quatro fatores (Klf4, Sox2, Oct4 e c-Myc) apresentaram características tumorigênicas (NAKAGAWA et al., 2008; WERNIG et al., 2007). As técnicas de reprogramação convencionais dependem da integração estável de transgenes, mas podem introduzir o risco de mutagênese de inserção. Assim, diversas técnicas de reprogramação não-integrativas foram desenvolvidas para melhorar a qualidade das células geradas (DIECKE et al., 2014). Os sistemas integrativos consistem em vetores virais, tais como retrovírus (TAKAHASHI; YAMANAKA, 2006) e lentivírus (PICANÇO-CASTRO et al., 2011). Já vetores não-integrativos também tem sido utilizados, tais como adenovírus (STADTFELD et al., 2008) ou sistemas não virais, como plasmídeos (OKITA; YAMANAKA, 2006), proteínas (ZHOU et al., 2009) e RNAm, que não promovem a integração de DNA complementar (DNAc) dos fatores OSKM para o genoma na célula (OKITA; YAMANAKA, 2006; WARREN et al., 2010; YU et al., 2009). Recentemente, novas abordagens foram testadas para induzir a pluripotência, usando moléculas químicas exógenas (HOU et al., 2013; PENNAROSSA et al., 2013) ou vetores epissomais (uso de DNA plasmidial) (YU et al., 2009; DIECKE et al., 2014).