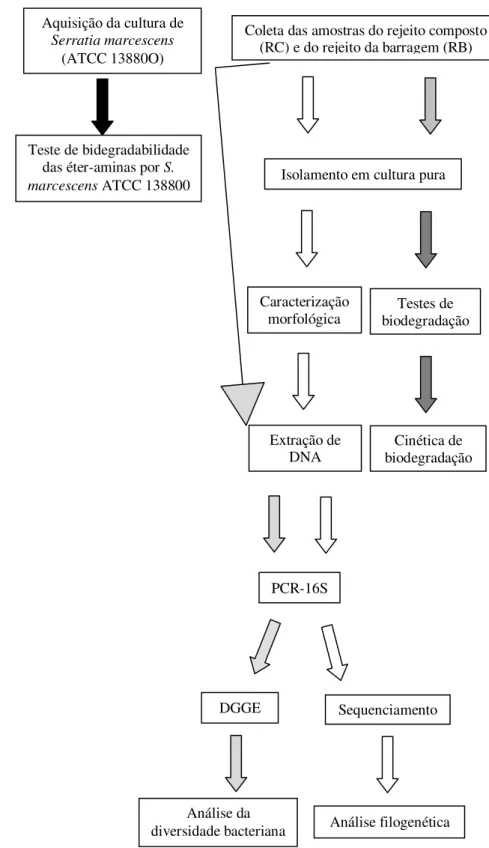
Universidade Federal de Ouro Preto
Programa de Pós-Graduação Engenharia Ambiental
Mestrado em Engenharia Ambiental
Heloísa Cristina França Cavallieri
ESTUDO DA BIODEGRADAÇÃO DE ÉTER-AMINAS
UTILIZADAS NA FLOTAÇÃO DO MINÉRIO DE FERRO
Dissertação apresentada ao programa de Pós-Graduação em Engenharia Ambiental da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para a obtenção do título de Mestre, em Engenharia Ambiental, área de concentração: Tecnologias Ambientais.
Orientador: Prof. Dr. Cornélio de Freitas Carvalho Co-orientador: Profª. Drª. Silvana de Queiroz Silva
ii
Universidade Federal de Ouro Preto
Programa de Pós-Graduação Engenharia Ambiental
Mestrado em Engenharia Ambiental
Heloísa Cristina França Cavallieri
ESTUDO DA BIODEGRADAÇÃO DE ÉTER-AMINAS
UTILIZADAS NA FLOTAÇÃO DO MINÉRIO DE FERRO
Dissertação de mestrado submetida à banca examinadora designada pelo Colegiado do mestrado em Engenharia Ambiental, como parte integrante dos requisitos necessários para a obtenção do grau em Mestre em Engenharia Ambiental.
Ouro Preto, 02 de março de 2011.
v
“É melhor tentar e falhar, que preocupar-se e ver a vida passar. É melhor tentar, ainda que em vão, que sentar-se, fazendo nada até o final. Eu prefiro na chuva caminhar, que em dias frios
em casa me esconder. Prefiro ser feliz embora louco, que em conformidade viver.”
vii Dedico este trabalho aos professores Cornélio
Carvalho e Silvana Queiroz, meus orientadores, pela
viii
AGRADECIMENTOS
A Deus, pois me reservou uma família, amigos e oportunidades maravilhosas. Ao Fabiano, pelo amor e compreensão em todos os momentos e por me fazer feliz. A toda minha família, pelo interesse e incentivo durante todo o curso.
Aos professores do curso por todo o conhecimento compartilhado e amizade e aos colegas
do mestrado pelo companheirismo durante as disciplinas cursadas.
A Ludmila von Randow e Luiz Henrique por toda ajuda e incentivo inicial. Vocês foram fundamentais para que tudo se tornasse realidade.
Aos parceiros de iniciação científica, Marcos, Kênia, Luiza e Wellington, pela boa vontade, dedicação ao trabalho, pela perseverança diante dos desafios e pela amizade. As amigas do Laboratório de Microbiologia, Débora e Keici, pelo companheirismo, amizade, carinho e ajuda incondicional.
A todos os colegas do Laboratório de Resíduos e Efluentes, em especial, a Cris, pela agradável convivência, auxílio e amizade.
Aos técnicos dos laboratórios, em especial à Marly, pelo apoio e amizade, e por tornar os dias de trabalho mas descontraídos.
Ao Prof. Lydston, uma pessoa especial que esteve presente na hora de grandes desafios. Sua participação foi muito importante para a conclusão deste trabalho.
ix A SAMARCO, especialmente ao Batisteli, pela confiança e atenção.
A IsabelaFrança pela ajuda na hora certa. Ao CETESC pela oportunidade e incentivo. A CAPES pela concessão da bolsa de estudo.
x
SUMÁRIO
LISTA DE FIGURAS ... xii
LISTA DE TABELAS ...xv
LISTA DE NOTAÇÕES ... xvii
RESUMO ... xix
ABSTRACT ... xxi
CAPÍTULO 1 - INTRODUÇÃO ... 1
CAPÍTULO 2 - OBJETIVOS ... 4
2.1. OBJETIVO GERAL ... 4
2.2. OBJETIVOS ESPECÍFICOS ... 4
CAPÍTULO 3 – REVISÃO BIBLIOGRÁFICA ... 5
3.1. ASPECTOS GERAIS DA MINERAÇÃO ... 5
3.2. BENEFICIAMENTO DO MINÉRIO DE FERRO ... 5
3.3. O PROCESSO DE FLOTAÇÃO ... 6
3.3.1. Reagentes utilizados na flotação de minério de ferro ... 10
3.3.1.1. Amido ... 11
3.3.1.2. Amina ... 12
3.3.2. Resíduos e efluentes gerados no processo de flotação de minério de ferro ... 18
3.4. UTILIZAÇÃO E REAPROVEITAMENTO DAS AMINAS ... 19
3.5. BIODEGRADABILIDADE DAS ÉTER-AMINAS ... 24
3.5.1. Modelos cinéticos de biodegradação de compostos orgânicos ... 28
3.5.2. Microrganismos degradadores de aminas...40
3.5.3. Metabolismo e bioquímica de degradação ... 46
3.6. RISCOS AMBIENTAIS ASSOCIADOS ÀS AMINAS...53
CAPÍTULO 4 – MATERIAIS E MÉTODOS ...56
4.1. DELINEAMENTO EXPERIMENTAL ... 56
4.2. CARACTERIZAÇÃO DAS ÉTER-AMINAS ... 56
4.3. QUANTIFICAÇÃO DAS ÉTER-AMINAS ... 56
4.3.1. Método Verde de Bromocresol (ARAÚJO et al., 2009) ... 56
4.3.2. Método do Orange II ... 58
4.3.2.1. Validação do método químico do Orange II (INMETRO, 2003) ... 59
4.4. TESTES DE BIODEGRADABILIDADE DAS ÉTER-AMINAS PELA SERRATIA MARCESCENS...61
4.5.COLETADASAMOSTRAS ... 62
4.6.ISOLAMENTO,CARACTERIZAÇÃOEIDENTIFICAÇÃODASBACTÉRIASISOLADAS ... 64
xi
4.6.2. Identificação dos isolados... 65
4.6.2.1. Extração de DNA ... 65
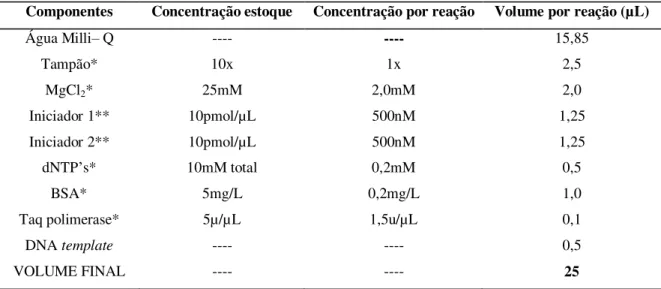
4.6.2.2. Reação em Cadeia da Polimerase (PCR) ... 66
4.7.ANÁLISEDADIVERSIDADEBACTERIANAPELATÉCNICADEPCR-DGGE ... 67
4.8. TESTE DE BIODEGRADABILIDADE DAS ÉTER-AMINAS PELAS BACTÉRIAS ISOLADAS ... 68
4.9. CINÉTICA DE BIODEDEGRADAÇÃO DAS ÉTER-AMINAS PELAS LINHAGENS ISOLADASEMDIFERENTESCONCENTRAÇÕESETEMPERATURAS ... 69
CAPÍTULO 5 – RESULTADOS E DISCUSSÃO ...71
5.1. QUANTIFICAÇÃO DAS ÉTER-AMINAS ... 71
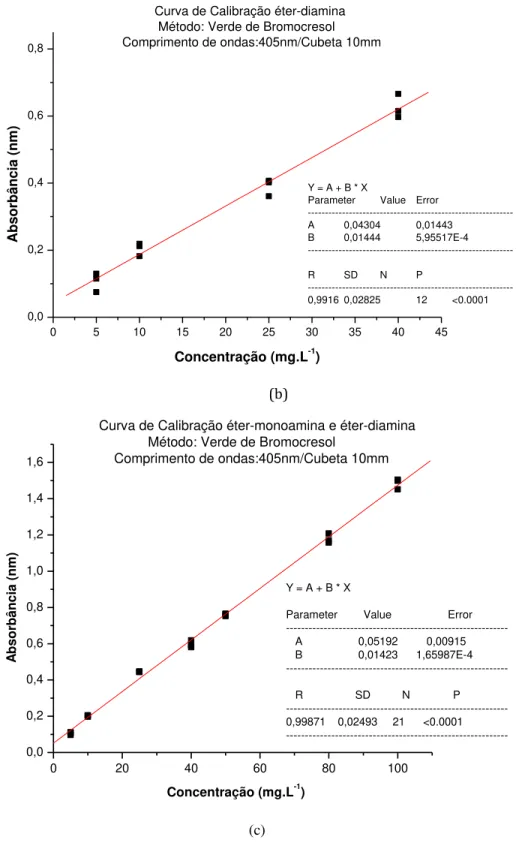
5.1.1. Método do Verde de Bromocresol ... 71
5.1.2. Método do Orange II ... 73
5.1.2.1. Faixa de Trabalho e Faixa Linear de Trabalho ... 73
5.1.2.2. Limite de Detecção...77
5.2. TESTES DE BIODEGRADABILIDADE DAS ÉTER-AMINAS PELA BACTÉRIA Serratia marcescens ... 81
5.3. CARACTERIZAÇÃO DAS AMOSTRAS ... 87
5.4. ISOLAMENTO, CARACTERIZAÇÃO E IDENTIFICAÇÃO DAS BACTÉRIAS PRESENTES NAS AMOSTRAS BRUTAS ... 90
5.5. COMPARAÇÃO DA DIVERSIDADE BACTERIANA NAS AMOSTRAS DE REJEITO COMPOSTO E DA BARRAGEM DE REJEITOS PELA TÉCNICA PCR-DGGE ... 106
5.6. TESTES DE BIODEGRADABILIDADE DAS ÉTER-AMINAS PELAS BACTÉRIAS ISOLADAS ... 111
5.7. CINÉTICA DE BIODEGRADAÇÃO DAS ÉTER-AMINAS PELAS LINHAGENS ISOLADAS EM DIFERENTES CONCENTRAÇÕES E TEMPERATURAS...121
5.7.1. Aspectos Gerais...121
5.7.2. Determinação do modelo cinético ... 123
CAPÍTULO 6 - CONCLUSÕES ... 131
CAPÍTULO 7 - SUGESTÕES PARA TRABALHOS FUTUROS ... 132
CAPÍTULO 8 – REFERÊNCIAS BIBLIOGRÁFICAS ... 133
CAPÍTULO 9 – ANEXOS ... 147
ANEXOI-COMPOSIÇÃOQUÍMICADOSMEIOSDECULTURA ... 147
ANEXOII-PROTOCOLODEPREPARAÇÃODASSOLUÇÕES... 149
ANEXOIII-BIODEGRADAÇÃODASÉTER-AMINAS ... 152
ANEXOIV-CURVASTEÓRICAS... 157
xii
LISTA DE FIGURAS
Figura 3.1. Fórmula estrutural simplificada de uma amina graxa primária...13 Figura 3.2. Rota de produção de éter-monoamina e éter-diamina (NEDER, 2005)...15 Figura 3.3. Espectro de massas com ionização por eletrospray da EDA 3B em modo positivo (ARAÚJO et al., 2008)...17 Figura 3.4. Espectro de massas com ionização por eletrospray da F 2835 em modo positivo (ARAÚJO et al., 2008)...17
xiv Figura 5.15. Gel de DGGE corado com brometo contendo fragmentos de DNA ribossomal
16S amplificado com iniciadores universais para
xv
LISTA DE TABELAS
Tabela 3.1. Equações utilizadas para avaliar a biodegradação do endosulfan com e sem
crescimento...37
Tabela 3.2. Parâmetros dos modelos de cinética de degradação de substrato adequados para as diferentes concentrações iniciais de endosulfan pela P. aeruginosa (HUSSAIN et al., 2009)...38
Tabela 3.3. Classificação nutricional das bactérias (TORTORA, 2005)...41
Tabela 3.4. Valores de referência da concentração de aminas nas águas para consumo humano e efluentes, de acordo com EPA/EUA (PERES et al., 2000)...55
Tabela 4.1. Soluções e volumes da extração de DNA pela técnica fenol/clorofórmio (GRIFFITHS et al., 2000)...65
Tabela 4.2. Reagentes utilizados para a preparação da mistura de reação da PCR para a amplificação do gene DNAr 16S. ...66
Tabela 5.1. Valores das Variâncias (S2) utilizadas para calcular LDM...80
Tabela 5.2. Limite de Detecção do Método Orange II...80
Tabela 5.3. Absorbâncias e concentrações encontradas nos testes sem a adição de éter-aminas...85
Tabela 5.4. Varredura dos meios de cultura, de 450 à 550nm...87
Tabela 5.5. Valores de pH das frações sólida e líquida das amostras de rejeito...88
Tabela 5.6. Origem e características das 22 colônias isoladas...93
xvii
LISTA DE NOTAÇÕES
ATP Adenosina Trifosfato
BSA Soro Albumina Bovina
CL50 Concentração letal
CO Monóxido de carbono
CO2 Dióxido de carbono
CO32- Carbonato
COS Sulfeto de carbonila COV Composto orgânico volátil CS2 Dissulfeto de carbono
DECBI Departamento de Ciências Biológicas DEQUI Departamento de Química
DL50 Dose letal
DNA Ácido Desoxirribonucléico
DNAr 16S Ácido Desoxirribonucléico da porção 16S ribossomal DNPM Departamento Nacional de Produção Mineral
dNTP Desoxirribonucleotídeo
DQO Demanda Química de Oxigênio
EPA Agência de Proteção Ambiental Americana (USA) HCO-3 Bicarbonato
INMETRO Instituto Nacional de Metrologia, Normalização e Qualidade Industrial LDE Limite de detecção do equipamento
LDM Limite de detecção do método MBR Minerações Brasileiras Reunidas MgCl2 Cloreto de magnésio
MIBK Metil iso-butil cetona NaOH Hidróxido de Sódio
NCBI National Center of Biotechonogy Information NH+
4 Íon amônio
xviii
NO3- Nitrato
OD Oxigênio dissolvido
Pb Pares de bases
PBS Tampão fosfato salino
PCR Reação em Cadeia da Polimerase
PCR-DGGE Reação em Cadeia da Polimerase -Eletroforese em Gel de Gradiente Desnaturante
pH Potencial Hidrogeniônico
PNP p-nitrofenol
PVPP Polivinilpolipirrolidona
RNAr16S Ácido Ribonucléico da porção 16S ribossomal
RC Rejeito Composto
RB Rejeito da Barragem
RPM Rotações por Minuto SDS Dodecil sulfato de sódio
SO42- Sulfato
TAE Solução Tampão com Tris-Acetato-EDTA Taq Termophilus aquaticus (Taq DNA polimerase) TNP 2,4,6-trinitrofenol
Tris Tris(hidroximetil)aminometano UFOP Universidade Federal de Ouro Preto
xix
RESUMO
xx insumo, temperaturas e volume de inóculo. Pode-se observar que à temperatura de 45°C não ocorreu consumo de substrato e que à 25mg.L-1, para o isolado K, também não houve degradação. A taxa de degradação foi maior na presença de maior volume de inóculo para o isolado K, mas não sofreu alterações quando estes estiveram em conjunto. Foram testados os modelos de Monod, primeira e segunda ordens para traduzir a cinética de degradação e o modelo de primeira ordem se mostrou mais adequado.
xxi
ABSTRACT
xxii higher inoculum volume for strain K, but did not change when they were together. The models of Monod, first and second order were tested to translate the degradation process and the first order model was more appropriate.
1
CAPÍTULO 1 - INTRODUÇÃO
O estilo de vida que se herda, pratica e que certamente se passa para as próximas gerações é inegavelmente dependente do uso e de aplicações de recursos minerais. São muitos os exemplos de situações cotidianas que viabilizam a base da extração de recursos minerais. Basta olhar atentamente ao ambiente em que se está para identificar uma série de objetos cuja fabricação envolve uma variedade de produtos derivados de bens minerais de todas as classes como metais, não-metálicos, combustíveis fósseis, metais preciosos, gemas. As atividades industriais modernas em diferentes áreas de metalurgia, química, fertilizantes, cimentos, construção civil e elétrica usam e transformam bens minerais, gerando produtos manufaturados, inimagináveis no passado, que permitem a execução das atividades com eficiência e certo conforto.
O minério de ferro é um metal essencial na indústria extrativa no Brasil, tanto em relação ao volume da produção quanto nos investimentos financeiros. É utilizado na fabricação de aço e ferro fundido, possui aplicações nas indústrias de ferro-liga e de cimento, e também é utilizado na construção e manutenção de estradas (DNMP, 2009). Ao se analisar os usos que a humanidade faz dos diversos bens minerais, percebe-se a dependência que se tem deles e, somando-se as quantidades utilizadas, pode-se chegar a números no mínimo curiosos em termos do consumo per capita desses bens, em particular nos países altamente industrializados.
2 se dispuser de fontes abundantes e baratas de energia, pois esta é um insumo essencial na extração e tratamento de bens minerais, assim como na fabricação de seus produtos variados.
O ferro é um metal de grande incidência na crosta terrestre, representando 4,2% em massa (DNPM, 2009). Os principais minerais que contêm ferro são hematita (Fe2O3), magnetita (Fe3O4), goethita (FeO/OH) e siderita (FeCO3). As formações ferríferas compostas de hematita e sílica, chamadas de itabiritos, estão presentes nos maiores depósitos de ferro (DNPM, 2009). Devido à grande utilização dos depósitos de minérios de altos teores de ferro (>64% Fe) (ROSIÈRE e CHEMALE JR., 2000) torna-se de fundamental importância a extração de jazidas de minérios com teores de ferro cada vez mais baixos, os quais contêm partículas de minério que não são de interesse, conhecidas como ganga (FARNESE e BARROZO, 2006). O minério itabirito não era explorado há alguns anos devido ao baixo teor de ferro (< 50-60%Fe), de acordo com os interres comerciais (ALVES, 2006) e granulometria fina (BATISTELI, 2007), mas tornou-se alternativa para as explorações atuais. As partículas de quartzo e sílica, presentes no minério itabirito, são indesejáveis e devem ser retiradas durante o processo de concentração do minério (COSTA, 2009).
Nos dias atuais, o processo de concentração de minérios mais utilizado pela indústria mineral, o qual torna possível o aproveitamento de minerais complexos e/ou com baixo teor é a flotação catiônica reversa, metodologia esta na qual é utilizado um coletor e um depressor dos óxidos de ferro (SILVA, 2004). Os principais reagentes utilizados processo de flotação são as éter-aminas e o amido. O primeiro possui a função de coletor dos minerais de quartzo e o segundo tem a função de deprimir os minerais de ferro, impedindo que eles sejam flotados (SAMARCO MINERAÇÃO, 2009). Durante a flotação, a maior parte das éter-aminas fica contida na polpa do rejeito, juntamente com a sílica. Esta polpa é descartada para as barragens de rejeito, as quais são fontes potenciais de contaminação das águas no meio ambiente.
3 barragens de rejeito, contendo éter-aminas, merecem mais atenção devido às alterações que podem causar no ambiente natural.
Não se sabe ao certo os produtos formados durante a decomposição das éter-aminas, mas estudos indicam que não são formados compostos inorgânicos e que estas éter-aminas são decompostas rapidamente na barragem de rejeitos (CHAVES, 2001). Os fatores que influenciam as etapas de degradação das éter-aminas também não são bem definidos (CHAVES, 2001).
O coletor orgânico possui elevado valor comercial e sua recuperação pode levar a uma grande economia para a indústria de minério de ferro. A reciclagem das éter-aminas com possível reutilização no processo de flotação do minério é uma das alternativas estudadas para evitar o lançamento junto aos rejeitos do processo e reduzir custos operacionais (BATISTELI, 2007). Estudos anteriores demostraram que a degradação das éter-aminas nas barragens de rejeito ocorre rapidamente; em 12 dias a quantidade de éter-aminas pode ser reduzida a menos da metade da quantidade inicial (CHAVES, 2001), o que dificulta o processo de recuperação e reuso desse coletor. Diante dessas informações, o presente trabalho foi proposto com o objetivo de estudar o processo de biodegradação das éter-aminas, visando, futuramente, elucidar a recuperação desse coletor orgânico.
Este trabalho analisou o processo de biodegradação das éter-aminas isolando e identificando bactérias potencialmente degradadoras, bem como a velocidade desta degradação. Os procedimentos experimentais para isolamento e identificação das bactérias foram realizados nos Laboratórios de Microbiologia do Departamento de Ciências Biológicas (DECBI/UFOP); já os procedimentos de análise das éter-aminas e de biodegradabilidade e cinética foram realizados no Laboratório de Resíduos e Efluentes do Departamento de Química (DEQUI/UFOP).
4
CAPÍTULO 2 - OBJETIVOS
2.1. OBJETIVO GERAL
Estudar os rejeitos da flotação do minério de ferro, buscando identificar as bactérias responsáveis pela biodegradação do coletor orgânico.
2.2. OBJETIVOS ESPECÍFICOS
Validar o método químico de quantificação das éter-aminas Orange II;
Realizar testes de biodegradação das éter-aminas pela bactéria Serratia marcescens;
Isolar bactérias em diferentes meios de cultura, caracterizá-las segundo suas características morfológicas e identificá-las com base na sequência do gene RNA ribossomal 16S;
Comparar a diversidade bacteriana presente nas amostras brutas do rejeito composto e rejeito da barragem utilizando a técnica do PCR-DGGE;
Realizar testes de degradabilidade das éter-aminas pelos isolados bacterianos;
5
CAPÍTULO 3
–
REVISÃO BIBLIOGRÁFICA
3.1. ASPECTOS GERAIS DA MINERAÇÃO
A Crosta Terrestre é constituída principalmente por oxigênio, silício, alumínio e ferro, sendo que este último é o quinto mais abundante, correspondendo a 4,2%. Os principais minerais que possuem ferro são: hematita (Fe2O3), goethita (FeO.OH), magnetita (Fe3O4) e siderita (FeCO3), sendo, portanto, o quarto mineral mais abundante da crosta terrestre (DNPM, 2009). Os recursos brasileiros de minério de ferro, reconhecidos oficialmente pelo Departamento Nacional de Produção Mineral (DNPM) são da ordem de 73,7 bilhões de toneladas. As reservas brasileiras representam 7,2% das reservas mundiais, o que coloca o Brasil em quinto lugar entre os países detentores das maiores quantidades de minério de ferro, sendo que os altos teores de ferro nos minérios brasileiros levam o país a ocupar um lugar de destaque no cenário mundial, em termos de ferro contido no minério (DNPM, 2009). No Brasil, as principais reservas de minério de ferro estão em Minas Gerais (66,97%), Pará (15,97%) e Mato Grosso do Sul (15,47%) (DNPM,2009) e são denominadas itabiritos, as quais compreendem formações ferríferas metamórficas e fortemente oxidadas apresentando descontinuamente corpos de minério de alto teor de ferro (>64% Fe), de morfologia mais ou menos lenticular e dimensões variáveis desde alguns centímetros até centenas de metros (ROSIÈRE e CHEMALE JR., 2000). De acordo com o DNPM, em 2008 o Brasil produziu 351,2 milhões de toneladas de minério de ferro, com teor médio de 60,9% de Fe (DNPM, 2009), o que representou 61,2% do valor total da produção mineral brasileira. Cerca de 66,0% da produção foram destinados ao mercado externo (DNPM, 2009).
3.2. BENEFICIAMENTO DO MINÉRIO DE FERRO
6 que se utiliza o beneficiamento dos minérios devido à escassez cada vez maior das reservas de minérios de altos teores de ferro, visando concentrar os minérios com baixos teores. A concentração mineral ocorre por meio da exploração das propriedades físicas ou físico-químicas diferenciadoras, específicas dos minerais, que não alterem a estrutura química dos minerais presentes, como cor, peso específico, densidade, forma, tamanho relativo das partículas, susceptibilidade magnética, condutividade elétrica e características de superfície (BATISTELI, 2007).
A flotação é o processo atualmente mais utilizado para o tratamento de quase todos os tipos de minérios, devido á grande versatilidade e seletividade (PAVLOVIC e BRANDAO, 2003; HOUOT, 1983). Este processo permite a obtenção de um produto final com elevados teores do mineral de importância e expressivas recuperações. A característica da superfície do mineral é a propriedade determinante neste processo, que ocorre em suspensão aquosa. Há utilização de reagentes químicos para que ocorra a recuperação seletiva dos minerais por adsorção em bolhas de ar.
3.3. O PROCESSO DE FLOTAÇÃO
7 chumbo-zinco, grafita, carvão, potássio, níquel, fluorita, magnesita, feldspato, barita, talco, tungstênio e resíduo hidrometalúrgico contendo prata, sendo o processo mais indicado para a produção de super-concentrados. (JAFELICCI JR. et al., 2008).
Desta forma, a flotação é uma técnica físico-química de separação de misturas baseada nas diferenças das características da superfície dos vários minerais presentes na polpa. Essas características estão relacionadas ao conceito de hidrofobicidade, que corresponde à dificuldade das partículas em se interagir com a água, sendo que uma partícula hidrofóbica tem aversão por água, e é pouco molhável, e uma partícula hidrofílica, é ávida por água, sendo mais molhável (COSTA, 2009). Esta técnica consiste na introdução de bolhas de ar produzidas, comumente, pela dispersão de ar comprimido (ENGLERT et al., 2009), a uma suspensão de partículas, sendo que no caso do minério de ferro, os minerais mais importantes são a hematita (Fe2O3), chamado underflow, e o quartzo (SiO2), considerado o mineral de ganga, que é o overflow (COSTA, 2009; PERES et al., 2000). Assim, as partículas se aderem às bolhas de ar formando uma espuma que deve ser removida da solução para separar os componentes efetivamente. Esta técnica ocorre devido à tensão superficial do meio de dispersão e ao ângulo de contato formado entre a bolha e as partículas (DE SOUSA et al., 2003).
8 na água. Assim, é possível a separação seletiva entre as espécies minerais, ocorrendo então, a concentração do minério de ferro (PERES et al., 2000; HOUOT, 1983).
A interação entre a amina e a superfície negativa do quartzo ocorre por atração eletrostática e com baixa transferência de calor (SMITH e AKHTAR (1976) apud BATISTELI, 2007; FUERSTENAU, 1991). As espécies H+ e OH- são íons determinantes do potencial para silicatos. Desta forma, a carga elétrica, na superfície do quartzo, e, consequentemente, a densidade de adsorção de amina dependem do pH do sistema. Em meio ácido, a espécie H+ é responsável pela redução de sítios negativos na superfície do quartzo, o que resulta na dessorção da amina (BLEIER et al., 1976). Por estas características, este processo de adsorção pode ser considerado reversível em condições alcalinas ou ácidas, não necessitando de condições extremas (OLIVEIRA et al., 1996).
Devido ao elevado custo de alguns reagentes utilizados no processo de flotação ou por, às vezes, não serem altamente eficazes na separação seletiva de minerais de baixo teor e constituírem prováveis poluentes, novas pesquisas estão sendo realizadas para a produção de novos reagentes de flotação, a fim de que estes apresentem maior seletividade de separação, não sejam agressivos ao meio ambiente e não modifiquem o fluxograma do processo (BOTERO et al., 2008).
9 Muitos microrganismos estão associados naturalmente aos depósitos de minerais e podem agir naturalmente sobre o processo de flotação, ou agentes floculantes, de maneira positiva ou negativa. Para atuarem nos processos, há necessidade de que estejam presentes em grandes quantidades (SMITH e MIETTINEN, 2006). Uma análise preliminar de amostras de água de jazidas de bauxita na Índia mostrou a presença de bactérias heterotróficas pertencentes ao gênero Bacillus (Bacillus polymyxa e Bacillus coagulans) (OGURTSOVA et al., 1990). A presença desses microrganismos associados aos minerais é importante para o processo de bioflotação, pois se sabe que, especialmente o B. polymyxa, remove tanto o cálcio como o ferro do sistema de separação de partículas (VASAN et al., 2001; ANAND et al., 1996).
DEO e NATARAJAN (1999, 1997) estudaram o comportamento dos polissacarídeos extracelulares e das proteínas das células de B. polymyxa na presença dos minerais calcita, hematita, coríndon e quartzo, e NATARAJAN e DEO (2001) e DEO e NATARAJAN (1998b) estudaram esse comportamento nos mesmo minerais e também na caulinita, com o mesmo microrganismo. A interação do B. polymyxa com os minerais levou a mudanças significativas na superfície tanto dos minerais como no microrganismo devido às moléculas presentes na parede celular bacteriana e produtos do metabolismo, o que facilitou o processo de flotação (BOTERO et al., 2008; DEO e NATARAJAN, 1999 e 1997). Uma característica importante, que auxiliou esse processo de separação é que uma maior quantidade de células de B. polymyxa adsorve nas partículas de hematita do que no quartzo (PATRA e NATARAJAN, 2003; SHASHIKALA e RAICHUR, 2002).
10 esses microrganismos para promover mudanças químicas na superfície da pirita e da calcopirita demonstraram que após um pré-condicionamento dos minerais com as bactérias, antes da adição do coletor, houve uma redução significativa na flotabilidade da pirita, mas não afetou essa característica na calcopirita (HOSSEINI et al., 2005).
Desulfovibrio desulfuricans NCIM 2047, uma bactéria que está naturalmente associada aos depósitos de minério de ferro e relacionada com a biomineralização de vários óxidos de ferro, foi utilizada no sistema quartzo/hematita. A presença dos minerais foi importante para a secreção de proteínas, que aumentaram a hidrofobicidade do quartzo, e de polissacarídeos, que deprimiu a hematita (PRAKASAN e NATARAJAN, 2010). Rhodococcus opacus foi utilizado como biocoletor de calcita e magnesita e foi observado que a bioflotação desses minerais na presença do microrganismo apresentou valores em torno de 93% utilizando 100mg.L-1 de R. opacus e 55% quando a concentração da bactéria foi de 200mg.L-1 (BOTERO et al., 2007). No sistema de flotação de quartzo/hematita com essa mesma bactéria, foi possível observar que os dois minerais apresentraram maior flotabilidade (MESQUITA et al., 2003). A bactéria Escherichia coli também é utilizada em processos de separação seletiva de minerais, atuando como agente coletor da flotação de quartzo em condições ácidas (FARAHATA et al., 2009).
3.3.1. Reagentes utilizados na flotação de minério de ferro
11 outras interações durante o processo de flotação como co-adsorver com o coletor na interface mineral/água, diminuindo a dosagem de coletor no sistema, pois ocorre a formação de hemi-micelas que promovem a flotação, ou serem usados intencionalmente para dissolver ou emulsificar alguns coletores insolúveis em água. O tipo e a dosagem de espumantes adicionados ao sistema controlam o tamanho e a distribuição das bolhas de ar na polpa (PEARSE, 2005).
3.3.1.1. Amido
Alguns coletores não são seletivos, tendendo a recobrir, indiferentemente, partículas de todas as espécies minerais presentes. No entanto, adicionam-se substâncias auxiliares com o objetivo de fazer com que a coleta torne-se seletiva, isto é, que o coletor escolha uma delas sem modificar as demais. Assim é possível realizar a flotação das partículas de determinada espécie e deixar todas as demais no interior da polpa. Esta substância auxiliar é denominada depressora, pois, tem a função de deprimir a ação do coletor nas partículas indesejadas. Na flotação catiônica reversa do minério de ferro é utilizado o amido de milho como depressor, sendo utilizado largamente devido à sua disponibilidade em grandes quantidades. O amido também pode ser extraído de outras espécies vegetais, como mandioca, batata, trigo, arroz e araruta (ARAÚJO et al., 2005). Todos os tipos de amido não modificados e de grande peso molecular podem ser utilizados para a flotação (ARAÚJO et al., 2010).
12 forma o amido é fortemente adsorvido na hematita, impondo forte hidrofilicidade, e também previne a adsorção das aminas nesse mineral (ARAÚJO et al., 2010).
3.3.1.2. Amina
Os coletores são compostos heterogêneos que contêm um grupo inorgânico ligado a uma cadeia de hidrocarboneto. Geralmente, o grupo inorgânico é a porção da molécula que se adsorve na superfície polar do mineral. A cadeia de hidrocarbonetos tem natureza não-iônica e promove a hidrofobicidade da superfície do mineral depois da adsorção do coletor. Existem vários coletores que são classificados pela composição, podendo existir em solução como cátion, ânion ou molécula neutra.
A flotação é realizada em uma faixa de pH que estabiliza tanto as espécies catiônicas, quanto as espécies moleculares de amina, tornando possível que as primeiras atuem como coletoras e as segundas como espumantes (ARAÚJO et al., 2005). As aminas são compostos orgânicos que reduzem a tensão superficial da água em função do número de carbonos na cadeia e contém o grupo NH2 vinculado a uma radical alquil ou um radical aromático, utilizadas em diversos setores industriais como aditivos de petróleo, emulsificantes de asfalto, germicidas, anti-sépticos e agentes da mineração (ARAÚJO et al., 2010), mas somente as alquilaminas são utilizadas na flotação de minérios (PERES et al., 2000). Desde 1939, as aminas são o único coletor catiônico industrial utilizado na flotação de minérios (NEDER, 2005). Sua ionização ocorre em solução aquosa por protonação, conforme a equação 3.1:
H O RNH OH
RNH2(aq) 2 3(aq) Equação 3.1
Equação de ionização da amina em água (FONTE: ARAÚJO, 2007).
13 As aminas graxas são compostos alifáticos derivados de amônia, cujas matérias primas principais são óleos ou gorduras, saturadas ou não. Podem ser classificadas como primárias, secundárias, terciárias ou sais quaternários e possuem uma cadeia carbônica com um número par de carbonos variando entre 8 e 22. Apenas as aminas primárias são utilizadas como coletores na flotação de minerais (PERES et al., 2000), sendo que quanto maior o comprimento da cadeia de hidrocarboneto, menor a solubilidade em água.
As aminas primárias, secundárias e terciárias são bases fracas, enquanto os sais quaternários são bases fortes. Esses são completamente ionizáveis em todos os valores de pH, mas as primeiras possuem a solubilidade dependente do pH (FUERSTENAU, 1982, apud ANDRADE et al., 2002). A fórmula estrutural simplificada de uma amina primária está representada na Figura 3.2 e pode-se observar que ela possui uma porção polar e outra apolar, caracterizando o caráter anfipático. A porção polar está relacionada ao nitrogênio, e apresenta características iônicas e hidrofílicas, e o grupo R, cuja cadeia carbônica é apolar, apresenta características hidrofóbicas (PERES, 2002).
Figura 3.1. Fórmula estrutural simplificada de uma amina graxa primária.
14 Existem diferentes rotas para a produção de variados tipos de aminas. A parte graxa das aminas (cadeia carbônica longa), que tem origem nos óleos e gorduras, é encontrada na natureza sob a forma de triglicerídeo. A partir da molécula do triglicerídeo é possível obter ácidos graxos e álcoois graxos, os quais são utilizados, principalmente na produção de éter-aminas (ARAÚJO, 2007). O ácido é obtido pela reação do triglicerídeo com a água enquanto o álcool é oriundo da reação do triglicerídeo com o metanol ou hidróxido de sódio. O radical de álcool graxo geralmente é constituído por 10 ou 12 átomos de carbono, sendo mais comum 12 átomos. Essa cadeia tem que ser, obrigatoriamente, sem dupla ligação e linear. Uma amima primária pode ser transformada em uma éter-amina através da introdução, entre os radicais alquil e o átomo de hidrogênio, de um grupo O-(CH2)3, conforme a equação 3.2. Para a flotação do minério de ferro, somente são utilizadas as éter-aminas (PERES et al., 2000).
2 2 2
3
)
(CH NH
O R
RNH Equação 3.2
Fórmula estrutural simplificada de uma éter-amina (Fonte: PERES et al., 2000).
A principal propriedade das éter-aminas utilizadas na flotação do minério de ferro, em soluções aquosas, é a hidrólise ou dissociação da molécula, sendo que as espécies moleculares são favorecidas pela acidez e estabilizadas pela alcalinidade (PERES et al., 2000). A equação 3.3 apresenta a dissociação de uma éter-amina.
RO(CH2)3 NH2 H RO(CH2)3 NH3 Equação 3.3
Dissociação de uma éter-amina (Fonte: PERES et al., 2000).
O equilíbrio nesta situação ocorre em pH 10,5, sendo que para um pH de 9,5, a concentração de cátions se aproxima de 100% e o mesmo ocorre com a espécie molecular para pH 11,5. A espécie iônica é solúvel em água e adsorve facilmente sobre a superfície do quartzo através da atração eletrostática, pois, a superfície deste mineral é carregada negativamente em valores de pH maiores que 2,5 (PERES et al., 2000).
éter-15 monoaminas na flotação é devido, principalmente, à presença da ligação covalente C-O. Esse grupo hidrofílico aumenta a solubilidade do reagente, facilitando o seu acesso às interfaces sólido-líquido e líquido-gás (PERES et al., 2004). Segundo NEDER (2005), as éter-monoaminas são obtidas em duas etapas a partir da reação de um álcool graxo com a acrilonitrila, conforme a reação de adição ilustrada na equação 3.4.
ROHCH2 CH NROCH2 C N Equação 3.4
Reação de adição do álcool graxo com a acrilonitrila (NEDER, 2005).
Posteriormente, o produto dessa reação, chamada de éter-nitrila, é hidrogenado cataliticamente a alta pressão, conforme a equação ilustrada na equação 3.5.
ROCH2CH2CNH2 ROCH2 CH2CH2NH2 Equação 3.5
Hidrogenação catalítica de éter-nitrila (NEDER, 2005).
As éter-diaminas são fruto da reação das éter-monoaminas com a molécula de acrilonitrila, formando uma éter-nitrila, posteriormente hidrogenada cataliticamente a alta pressão, conforme reações 3.6 (I) e (II).
2 3
2 3
2 2
2 3
2) ( ) ( )
(CH NH CH CH CH C N R O CH NH CH NH
O
R
Equação 3.6(I)
2 3
2 3
2 2
2 2 3
2) ( ) ( ) ( )
(CH NH CH C N H R O CH NH CH NH
O
R
Equação 3.6(II)
(I): Reação de éter-monoamina com acrilonitrila. (II): Hidrogenação catalítica de éter-monoamina (NEDER, 2005).
Dessa forma, as rotas de produção da éter-monoamina e da éter-diamina podem ser visualizadas na Figura 3.3.
16 As aminas coletoras são sempre adquiridas através de marcas comerciais, como a distribuidora Akzo Nobel e a empresa Clariant®, que divulgou em seu boletim informativo em 1999, segundo REIS (2004), que as éter-aminas são parcialmente neutralizadas para aumentar a solubilidade em água, pois, elas são insolúveis em água. Em relação ao grau de neutralização, a empresa divulgou que a éter-monoamina possui de 18 a 22% de neutralização, enquanto que a éter-diamina possui de 48 a 56%. Quanto maior o grau de neutralização maior a solubilidade da amina em água.
Dentre os compostos de amina utilizados na flotação do minério de ferro destacam-se as éter-monoaminas e éter-diaminas. Neste trabalho foi utilizado a éter-monoamina Flotigan EDA 3B e a éter-diamina Flotigam 2835, produzidas e distribuídas pela Empresa Clariant® e que são utilizadas nos processos de flotação por várias empresas.
De acordo com o boletim informativo da empresa Clariant (1999), as éter-aminas supra-citadas apresentam, respectivamente, as seguintes composições químicas:
O CH NH CH COO
R ( 2)3 3] 3
[ éter-monoamina Flotigan EDA 3B
O CH NH CH NH CH COO
R ( 2)3 ( 2)3 3] 3
[ éter-diamina Flotigam 2835
17
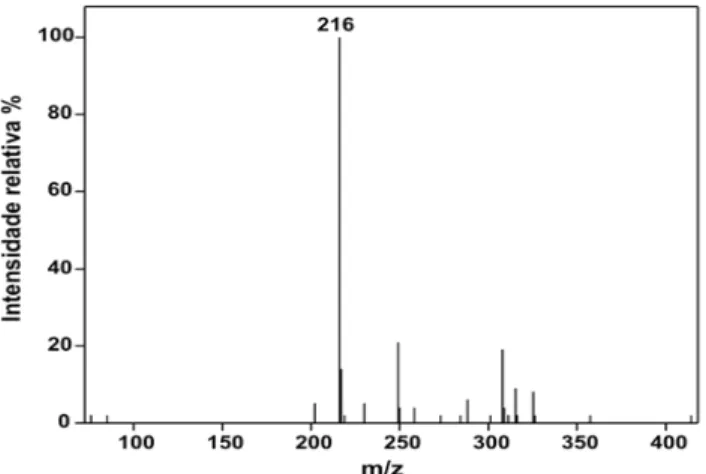
Figura 3.3. Espectro de massas com ionização por eletrospray da EDA 3B em modo positivo. (Fonte: ARAÚJO et al., 2008).
Segundo a empresa CLARIANT (1999), a éter-monoamina Flotigam EDA 3B teria o grupo R composto de 10 a 14 átomos de carbono. Assim, de acordo com o espectro obtido por ARAÚJO et al. (2008), o grupo R desta éter-amina possui predominantemente 10 átomos de carbono, o que resulta na seguinte fórmula estrutural: H3C(CH2)9-O-(CH2)3-NH3+. No espectro da Flotigam 2835, obtido também por ARAÚJO et al. (2008), Figura 3.5, a razão massa/carga (m/z) em 315 é predominante. Assim, essa éter-amina possui o grupo R composto predominantemente por 13 átomos de carbono. Mas há ainda cerca de 20% de m/z em 301, o que corresponde ao grupo R com 12 átomos de carbono. Então a fórmula estrutural da éter-diamina é: H3C(CH2)11-O-(CH2)3-NH3+ ou H3C(CH2)12-O-(CH2)3-NH3+.
Figura 3.4. Espectro de massas com ionização por eletrospray da F 2835 em modo positivo. (Fonte: ARAÚJO
18 As demais razões m/z presentes nos espectros anteriores são devidas às impurezas e aos produtos secundários presentes nas amostras, uma vez que estas amostras são amostras comerciais e contêm impurezas.
3.3.2. Resíduos e efluentes gerados no processo de flotação de minério de ferro
A flotação do minério de ferro gera dois produtos, o concentrado contendo minério de ferro, que é de interesse comercial, e o rejeito que é depositado em barragens. Na Samarco Mineração, o rejeito é encaminhado através de canaletas desde a usina até a barragem de Germano. A água, que carrega ainda algumas partículas sólidas, segue para a barragem de Santarém. Nesta barragem grande parte das partículas sólidas se decanta. Parte da água é reciclada pela empresa e a outra parte passa pelo vertedouro e deságua no Córrego Santarém. Os efluentes e resíduos gerados contêm, basicamente, sílica, compostos orgânicos constituídos de aminas alifáticas (primárias, secundárias e terciárias), e ainda alguma concentração de minério de ferro, além de outros metais (ARAÚJO, 2007). De acordo com REIS (2004), o rejeito da flotação que segue por gravidade para a barragem de rejeito, na usina da Samarco, em Germano, possui ainda cerca de 13% de ferro.
19
3.4. UTILIZAÇÃO E REAPROVEITAMENTO DAS AMINAS
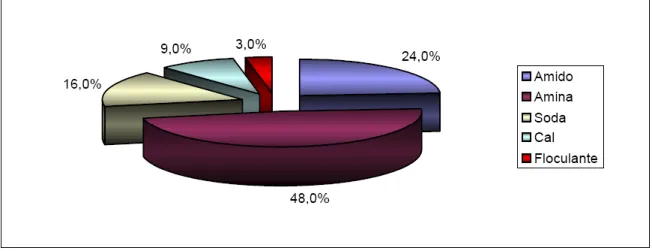
As éter-aminas são reagentes de grande importância no processo de concentração mineral, mas apresentam custo elevado. Estima-se que aproximadamente 6.000 toneladas de derivados de amina sejam utilizadas anualmente no Brasil em processos de flotação de minerais (NEDER, 2005). Segundo BATISTELI (2007), a mineradora Samarco utiliza, aproximadamente, 1.500 toneladas de éter-aminas por ano, para uma produção de 16 milhões de toneladas de concentrado por ano, o que, de acordo com a Figura 3.6, representou 48% dos gastos totais com reagentes da referida empresa em 2006 (BATISTELI e PERES, 2008; BATISTELI, 2007).
De acordo com PERES et al. (2000), dependendo da composição do minério e da qualidade desejada do concentrado, geralmente são utilizados de 20 a 200g de éter-aminas por tonelada de minério que alimenta o processo de flotação. Segundo BATISTELI (2007), alguns fatores propiciaram a redução do consumo de aminas pela Empresa Samarco entre os anos de 2005 e 2007, de 1.755 para 1.520t/ano, mesmo havendo um aumento nas metas de produção de concentrado para o ano de 2007. Podem-se destacar os seguintes fatores: • alterações de circuitos;
• aumento do volume de flotação com acréscimo de novas células mecânicas;
• alteração na relação éter-monoamina versus éter-diamina a partir de setembro de 2006, sendo substituída a proporção de 75% de éter-monoamina e 25% de éter-diamina por 25% e 75% respectivamente;
• controle da dosagem a partir da análise da concentração de éter-amina residual presente nos rejeitos da flotação;
20
Figura 3.5. Percentual de desembolso por insumo de uma mineradora de MG. (Fonte: BATISTELI, 2007).
Outra alternativa para reduzir o custo com os coletores, bem como reduzir o descarte deste composto no meio ambiente, é avaliar a possibilidade de reutilizar as éter-aminas contidas na água do rejeito de flotação como coletor para nova flotação de minério de ferro.
Em 1977, BAHR estudou a concentração de aminas em efluentes provenientes da flotação. Os estudos encontrados normalmente na literatura envolvem a reutilização das aminas em solução para uma nova flotação de minério de ferro (REIS, O. B., 2004; STAPELFELDT et al., 2002; OLIVEIRA et al.,1996).
21 dodecil-amina dessorvida. Os resultados indicaram que mais de 60% da dodecil-amina adicionada para recobrir o quartzo, pode ser recuperada.
Testes realizados internamente na Samarco Mineração com a água do rejeito de uma das quatro linhas da flotação convencional, objetivando verificar a influência da amina contida na água de rejeito no desempenho da flotação, concluíram que a água do rejeito não tem influência nos teores de sílica do concentrado e que a amina presente nesta água não é significativa para justificar o seu reaproveitamento na flotação convencional. (MANGABEIRA e TURRER, 2000)
Entretanto, resultados significativos foram obtidos por STAPELFELDT et al. (2002) que realizou testes de flotação em bancada com várias dosagens de coletor e a água do rejeito destes ensaios foi reutilizada em ensaios de flotação subseqüentes. Os resultados indicaram que 50% da amina que é descartada junto ao rejeito podem ser reaproveitadas para outro processo de flotação. Assim, as aminas que atualmente são descartadas nas barragens de rejeitos, podem ser reaproveitadas, possibilitando uma redução significativa no consumo do coletor sem que ocorram perdas na recuperação e na qualidade do concentrado final e também menor dano ao meio ambiee.
22 Estudos realizados por TEODORO et al. (2004) mostraram a possibilidade de remoção das aminas através da adsorção em zeólitas, seguidas da dessorção dos produtos adsorvidos e seu possível reuso. Zeólitas são aluminosilicatos de metais alcalinos e alcalinos terrosos que, devido ás suas características físicas, possuem propriedades ímpares como troca iônica, adsorção e hidratação/desidratação.
A vermiculita expandida também é uma opção de material adsorvente que possui propriedade de troca iônica, semelhante às zeólitas e algumas argilas, que pode se utilizada para a remoção de compostos orgânicos poluentes e na purificação de águas residuárias contendo sais dissolvidos (ANDRADE et al., 2002).
O caulim é o nome comercial da argila branca ou quase branca, constituída principalmente de caolinita, sendo um material argiloso, com baixo teor de ferro e de cor branca. Mesmo não possuindo histórico de aplicação como material adsorvente, este material apresenta características que permitem testá-lo para esta finalidade como área superficial e capacidade de troca catiônica (ANDRADE et al., 2002).
23 quantidade de cátions da amina em solução, já que a ionização da amina é dependente do valor do pH da solução. Estes resultados são promissores, pois, estes coletores são moléculas grandes e podem dificultar a atração eletrostática dos minerais com a parte iônica da molécula, por isso não foi encontrado recuperação de 100% das aminas (ANDRADE et al., 2002).
MAGRIOTIS et al. (2010) determinaram a influência de parâmetros físico-químicos na adsorção de um acetato de éter-amina (Flotigam EDA – Clariant) contendo um radical dodecil e neutralizada a 30% com ácido acético, na caulinita branca, rosa e amarela, sendo que esse mineral já foi retratado na literatura como adsorvente na remoção de azo corantes, polímeros, poluentes orgânicos e metais pesados. A caulinita foi selecionada como mineral adsorvente devido ao baixo custo e sua ampla ocorrência natural. A adsorção foi favorecida em pH10,0 para a concentração inicial de éter-amina de 200mg.L-1, provavelmente devido às formas iônica e molecular de éter-amina que ocorrem simultaneamente nesse pH, o que permite a formação de complexos iônico-molecular, os quais são mais ativos na superfície da caulinita. O equilíbrio da adsorção foi alcançado após 30 minutos e as eficiências de remoção da éter-amina na caulinita branca, rosa e amarela foi, respectivamente, 77%, 80% e 69%. Dessa forma, sabe-se que as caulinitas oferecem um potencial significativo no tratamento de efluentes provenientes do tratamento de ferro por flotação.
24 extração em pH de valor mais baixo que o do processo de flotação, pode ser devido ao fato de que na faixa de pH5, os compostos das éter-aminas tornam-se mais solúveis em solução aquosa, o que facilita a sua extração. A diluição das aminas resulta na quebra do equilíbrio eletroquímico do sistema, tendendo à dessorção da amina, cujo processo é refletido na brusca variação do potencial zeta do quartzo (OLIVEIRA et al., 1996).
Testes realizados por BATISTELI e PERES (2008) indicaram que quando a amina estiver presente na fase líquida do rejeito da flotação, esta pode ser reutilizada para um segundo processo de separação de quartzo e minério de ferro, necessitando da adição de uma menor quantidade de amina nova. A eficiência dessa reutilização está diretamente relacionada com a concentração da amina na água residual e o processo pode ser prejudicado caso partículas ultrafinas estejam presentes (BATISTELI e PERES, 2008).
REIS (2004) estudou sobre a reciclagem das aminas utilizadas no processo de flotação otimizando o uso da água do rejeito contendo aminas em uma segunda etapa de flotação. Os resultados foram satisfatórios, indicando que há possibilidade de se recuperar até 50% do reagente coletor. Desta forma, o uso da água contendo aminas junto a uma razão extra de amina nova pode gerar uma redução de custos com o reagente e também uma grande redução de descarte das aminas no meio ambiente.
No mesmo estudo, REIS (2004) observou que depois de 14 dias após a primeira extração de amina, não foi encontrado mais coletor no líquido da flotação e em 6 dias, a concentração de amina era de aproximadamente a metade da quantidade encontrada no primeiro dia de extração. De acordo com os autores, as aminas estão sendo degradadas na água de rejeito, por processos químicos ou biológicos ainda não conhecidos. Diante de tal resultado, adimitiu-se que as aminas devem ser utilizadas em um curto espaço de tempo para a segunda etapa de flotação, de forma a manter a eficiência do sistema de concentração do minério de ferro.
3.5. BIODEGRADABILIDADE DAS ÉTER-AMINAS
25 degradação e no caso das aminas pode ocorrer seguindo algumas rotas diferenciadas, como degradação térmica, degradação induzida por CO2, degradação causada pelo COS e CS2, degradação pelo CO, oxidação ou degradação sulfídrica (ABDI, 2000). A taxa de degradação das éter-aminas depende principalmente da estrutura destes compostos (KENNARD e MEISEN, 1985). Alguns autores inferem que aminas aromáticas são lentamente degradadas por evaporação e pela autoxidação na ausência de luz, enquanto que a presença de substâncias húmicas aumenta a velocidade de degradação destes insumos orgânicos (LYONS et al., 1984). Mas, segundo estudos de AFZAL KHAN et al. (2006), que analisaram a autoxidação do 4-aminofenol, as propriedades de autoxidação até existem para as aminas aromáticas, mas é muito pequena quando comparada à taxa de degradação biológica por microrganismos. Da mesma forma, LYONS et al. (1984) observaram que a remoção de anilinas por processos microbianos, foi de longe, o mecanismo de remoção mais eficaz.
ANDRADE et al. (2002) que estudaram sobre a recuperação das aminas pela adsorção em minerais industriais como a vermiculita e a zeólita, admitiram que as aminas presentes nas barragens de rejeitos se degradam naturalmente, seja de forma biológica ou química, em um período de 28 dias. Mas admitiram também que o assoreamento das barragens de rejeitos diminui o tempo de residência do efluente contendo os coletores na barragem, o que se torna insuficiente para que ocorra a completa degradação.
26 Alguns pesquisadores sugerem que a completa degradação da maioria dos compostos derivados de aminas graxas é atingida por grupos de microrganismos, nos quais um determinado microrganismo depende ativamente dos subprodutos gerados pelo metabolismo de uma espécie anterior (KROON e VAN GINKEL, 2001). Outros estudos com culturas puras demonstram que a degradação dos derivados de aminas graxas é iniciada por uma clivagem direta da ligação C-N, seguida pela utilização da cadeia de carbono, que resulta na liberação de moléculas polares (KROON et al., 1994; VAN GINKEL e KROON, 1993; VAN GINKEL et al, 1992). Assim, de acordo com estes autores a completa mineralização dos derivados de aminas graxas só pode ocorrer através da atividade de um consórcio de pelo menos dois microrganismos (VAN GINKEL, 1996). Quando lançadas no meio ambiente, as aminas estão sujeitas à ação de diversos microrganismos, pois os coletores são fonte de carbono e de nitrogênio. Esta biodegradação pode ser benéfica se houver a remoção desses compostos por parte dos microrganismos, gerando produtos menos tóxicos. Mas a biodegradação também pode gerar produtos mais tóxicos que os compostos iniciais.
Segundo ARAÚJO et al. (2010), não se sabe quais são os produtos gerados pela decomposição das éter-aminas nas barragens de rejeito. Análises in situ de nitrito, nitrato e amônio foram realizadas para avaliar a conversão das éter-monoamina e éter-diamina nesses compostos simples, mas os resultados mostraram baixas concentrações desses prováveis produtos. Mas sabe-se que os coletores são degradados na presença de microrganismos devido à redução da concentração encontrada após 40 dias de análise, sendo que após 5 dias, 34% das éter-aminas já havia sido consumida, e após 10 dias de observação, 75% da concentração inicial foi degradada (ARAÚJO et al., 2010).
27 CHAVES (2001). Estes resultados são muito importante pois evidenciam a velocidade do processo de degradação das aminas e que o reaproveitamento das mesmas, em um segundo processo de flotação, só poderá apresentar resultados satisfatórios se utilizadas imediatamente após a primeira etapa de flotação. Caso contrário, a quantidade de coletor presente no efluente é muito baixa e torna-se inviável economicamente realizar a reutilização na flotação.
ARAÚJO (2007) monitorou a biodegradabilidade das aminas e mostrou que em amostras reais com concentrações de amina de aproximadamente 30mg.L-1, após 5 dias de monitoramento, 34% da amina foi consumida, e em 10 dias 75% havia sido consumida. Para as amostras com aminas preparadas em laboratório, após 21 dias de monitoramento não houve degradação. Os autores sugeriram que a diferença observada nos resultados ocorreu pela presença de componentes provenientes do minério de ferro presentes nas amostras reais, o que favoreceu o crescimento das bactérias responsáveis pela biodegradação.
28 Avaliando a biodegradação das éter-aminas em amostras provenientes do processo de flotação de uma mineradora do Estado de Minas Gerais, SILVA (2009) observou a velocidade de degradação dos compostos à 30ºC e 35ºC, na concentração de 10mg.L-1 e também estudou sobre a degradação à 35ºC na presença de 10mg.L-1 e 25mg.L-1, estando sempre em agitação o sistema. Foi observado que para as temperaturas maiores, a reação possui maior velocidade de degradação, uma vez que o tempo de decomposição foi de 3 horas para 35ºC e 6 horas para 30ºC. Já para as diferentes concentrações de éter-aminas em uma mesma temperatura, a reação de degradação foi mais acelerada para os menores valores, tendo observado um tempo de 7 horas para 25mg.L-1 e 3 horas para a decomposição de 10mg.L-1 de coletor. Determinar a taxa de degradação de certo insumo, assim como a taxa de crescimento microbiano na presença desse mesmo composto é de suma importância para o modelamento da cinética de reação, que visa estabelecer, a velocidade das reações químicas e os fatores que as influenciam.
3.5.1. Modelos cinéticos de biodegradação de compostos orgânicos
Como o crescimento microbiano é resultado das atividades enzimáticas catabólicas e anabólicas, tais processos, ou seja, a utilização do substrato ou a formação do produto associada ao crescimento, também podem ser descritos em termos quantitativos, com base em modelos matemáticos de crescimento. Assim, a relação entre a taxa de crescimento específico (µ) de uma população de microrganismos e a concentração de substrato (S) é uma ferramenta valiosa nos processos de biodegradação (RAGHUVANSHI e BABU, 2010).
29 A cinética de Monod, um modelamento simples para o crescimento microbiano e adequado para tratar dados de crescimento, mas não considera a inibição pelo substrato. É diferente dos modelos clássicos na forma de introduzir o conceito de crescimento controlado pelo substrato. Ele relaciona a taxa específica de crescimento (µ) com um único substrato controlador do crescimento (S) através de dois parâmetros, a taxa máxima específica de crescimento (µmax) e a constante de afinidade pelo substrato (Ks), conforme a equação 3.7
(RAGHUVANSHI e BABU, 2010):
S K
S
s
max
Equação 3.7
mas essa equação apresenta dois parâmetros desconhecidos, µmax e Ks, e foi então
linearizada, sendo apresentada conforme a equação 3.8 (RAGHUVANSHI e BABU, 2010):
max max
1 1 1
S
Ks Equação 3.8
Assim, um gráfico de 1/µ versus 1/S tem como inclinação Ks/max e intercepto igual a 1/Max.
A presença de um composto facilmente metabolizável, misturado com alguns poluentes orgânicos, pode aumentar a biodegradação do substrato secundário, o que é vantajoso tanto no contexto ecológico, quanto na aplicação dos seres vivos no tratamento de resíduos, pois alguns organismos têm a capacidade de degradar os poluentes. Isso ocorre com freqüência em ecossistemas naturais, que geralmente são ambientes limitados de carbono e com uma variedade de substâncias orgânicas presentes em baixas concentrações (SALEHI et al., 2010). Nessa situação o modelo de Monod pode ser falho, pois, descreve apenas a dependência da taxa de biodegradação sobre a concentração de biomassa. A limitação desse modelo clássico é que a equação não leva em conta o fato de que células podem precisar de outro substrato ou podem sintetizar um produto mesmo quando elas não crescem.
30 K S m
S m
s
(max )
Equação 3.9
A relação entre o substrato e a taxa de crescimento microbiano (µ) durante a adaptação biológica dos microrganismos, a partir de um poluente orgânico, pode ser quantificado através da utilização de alguns modelos matemáticos que sofreram adaptações das equações de derivadas, a partir de teorias sobre a inibição de um único substrato (SALEHI et al., 2010).
A cinética de Haldane é outro modelo que trabalha com um crescimento indeterminado das células, sendo que na realidade, uma concentração definida do substrato exerce um limite acima do qual o crescimento microbiano cessa (SALEHI et al., 2010; LUONG, 1987). O modelo de Haldane (ANDREWS, 1968) considera a inibição do crescimento pelo substrato e é amplamente utilizado devido à simplicidade matemática (SHEN et al., 2009). A taxa específica de crescimento (µ) é representada pela equação 3.10:
I S
K S S K
S
2 max
Equação 3.10
onde KI é a constante de inibição do substrato (mg.L-1).
Para sistemas com altas concentrações do substrato inibitório, sendo S»Ks, a equação pode
ser simplificada conforme equação 3.11:
I
K S S
S
2 max
Equação 3.11
31 max max 1 1
g KI
S
Equação 3.12
Para os compostos auto-inibitórios, há também uma concentração crítica de substrato (Scrt)
acima da qual a taxa de remoção de substrato cai devido ao efeito de auto-inibição, que é definida pela equação 3.13:
) ( S I
srt K K
S Equação 3.13
Outro modelo que considera o efeito inibitório do substato foi proposto por LUONG (1987). Este modelo é baseado em certas suposições que incluem a fase lag e a de morte, respiração endógena, substrato utilizado como fonte de energia, manutenção ou inibição por produtos. Há incorporação da concentração crítica inibitória, Sm (mg.L-1), conforme
equação 3.14: n m S S S S K S max 1
Equação 3.14
onde n é o número inteiro positivo no modelo de Luong.
32 onde Ks é a constante de afinidade do substrato, KI é a
constante de inibição do substrato (mg.L-1) e K é uma constante positiva que aparece no modelo de Edward.
ZISSI et al. (1999) utilizaram uma cultura pura de Stenotrophomonas maltophilia, atualmente uma bactéria integrante do gênero Xanthomonas, capaz de utilizar a anilina como única fonte de carbono, para a realização de experimentos cinéticos, com o objetivo de desenvolver um modelo matemático que descrevesse, com precisão, as taxas de crescimento e a utilização do insumo. Essas taxas foram bem descritas usando as expressões de Monod, tendo o substrato como fator não limitante para o crescimento microbiano, uma vez que a presença de uma fonte alternativa de carbono não reprimiu o catabolismo da anilina, mas foi observada a utilização simultânea dos compostos.
SALEHI (2010) avaliou a taxa de degradação do p-nitrofenol (PNP), um composto muito utilizado na produção de pesticidas, herbicidas e explosivos e que tem grandes impactos na poluição ambiental, pela bactéria Rastonia eutropha. Considerando que o PNP na presença do microrganismo forma produtos simples, uma reação autocatalítica foi assumida gerando a equação 3.16:
P c
P kC C
dt dC
Equação 3.16
onde Cp e Cc são as concentrações de PNP e microrganismo, respectivamente, e k é um coeficiente de segunda ordem. Aplicando a equação proposta por LUONG (1987), µ=(µmS/Ks+S)(1−(S/Sm)n), mas considerando „n‟ igual a zero, esta equação foi reduzida, sugerindo uma equação de Monod, como segue a equação 3.17:
c p p c c
C K
C C dt
dC
max
Equação 3.17
onde Kc é a constante de Monod e µmax é a taxa máxima específica de crescimento. Ao
33 c p p c c c c C K C K KC C C 0 0 max 0 ln
1 Equação 3.18
onde Cc0 e Cp0 são as concentrações iniciais de bactérias e PNP, respectivamente.
Fazendo algumas substituições matemáticas nesta equação 3.18, foi encontrada a equação 3.19 para descrever a taxa de conversão do PNP em função apenas da concentração inicial desse composto e da concentração inicial de células:
c p c p p c p p C KC C K C K C dt dC 0 0
max ln
Equação 3.19
Nessa equação 3.19, os três parâmetros cinéticos, µmax, K, Kc, devem ser determinados
34 tendência exponencial, indicando um aparente efeito inibitório do substrato sobre os microrganismos.
Como a degradação do contaminante ocorreu por causa da atividade microbiana, sabe-se que a cinética de degradação do MIBK está intimamente relacionada com a cinética do crescimento microbiano. Assim, a concentração da biomassa obtida anteriormente e a concentração do substrato nos diferentes intervalos para as várias concentrações iniciais de MIBK, foram utilizados para calcular a taxa de crescimento específico (µ), determinada pela equação 3.20:
dt
dx x
1
Equação 3.20
onde µ representa a taxa de crescimento específico (h-1), x é a concentração da biomassa (g.L-1) no tempo t (h), e dt é mudança no tempo (h) para a alteração da concentração da biomassa, dx. Após a integração, a equação 3.20 pode ser apresentada pela equação 3.21, onde, x0 é a concentração inicial de biomassa (g.L-1) no t=0.
lnxlnx0 t Equação 3.21
Esses dados foram plotados em um gráfico de (1/µ) em função de (1/S), conforme o modelo de Monod, e o coeficiente de determinação (R2) obtido foi de 49,7%. Para o modelo de POWELL (1967), onde só foram analisados os dados da fase log através da regressão dos dados, o R2 obtido foi 53,3%. Já o modelo de Haldane (ANDREWS, 1968), que foi desenvolvido com os dados da fase log, o R2 encontrado foi de 70,2%. Utilizando os mesmos dados da fase log, as constantes cinéticas para o modelo de LUONG (1987) determinaram R2 de 90,4%, enquanto que para o modelo de EDWARD (1970), que possui a vantagem de incorporar o termo [1+ (S/K)] no denominador e incluir uma constante positiva K, o (R2) foi de 78,6%. Dessa forma o melhor modelo testado foi o de Luong, mas não se ajustou completamente aos dados.
35 concentração de substrato e do tempo. Considerando que a biomassa é diretamente proporcional ao tempo, tem-se a equação diferencial de ordem dois. Verificou-se então que tanto a cinética de ordem um e a de ordem dois não foram suficientes para explicar a cinética de biodegradação do MIBK. Estes conceitos e as dificuldades matemáticas levaram à determinação de outro modelo de ordem três, conforme mostrado na equação 3.22 (BRUNNER e FOCHT, 1984):
aES k
dt
dS
1
Equação 3.22
onde k1 é a constante de proporcionalidade (tempo-1), E é a concentração de células e a é a
constante de proporcionalidade (biomassa/concentração-1/tempo-1). Depois da integração e simplificação a equação 3.22 pode ser reduzida conforme equação 3.23:
2 2 1 t k k
Y Equação 3.23
onde
t aE
k2 ,
0 0 0 ln 1 S k P S t
Y t e
t t
k t k
O e k
S
P 2 0
2 2 1 1 .
P é a taxa de formação de produto (CO2), que está diretamente relacionada com a alteração da concentração de biomassa. O modelo de ordem três incluiu o termo para explicar a formação de biomassa, que pode ser medida em termos de P.k0 e S0, que são a taxa constante de ordem zero e a concentração do substrato no tempo zero, respectivamente. Assim, os valores obtidos dos R2 para a cinética de ordem três foi de 93,7-99,4%, indicando que o modelo cinético de ordem três é o mais adequado para explicar a taxa de biodegradação do MIBK (RAGHUVANSHI e BABU, 2010).