1 Zonas-tampão ripárias no planejamento e gestão de ecossistemas fluviais
em paisagens agrícolas.
TERENCIO REBELLO DE AGUIAR JUNIOR
ORIENTADORA: Profa. Dra. Maria Teresa Ferreira
TESE APRESENTADA PARA OBTENÇÃO DO GRAU DE DOUTOR EM RESTAURO E GESTÃO FLUVIAIS
LISBOA 2015
2 Zonas-tampão ripárias no planejamento e gestão de ecossistemas fluviais
em paisagens agrícolas.
TERENCIO REBELLO DE AGUIAR JUNIOR
ORIENTADORA: Profa. Dra. Maria Teresa Ferreira
TESE APRESENTADA PARA OBTENÇÃO DO GRAU DE DOUTOR EM RESTAURO E GESTÃO FLUVIAIS
Júri
Presidente: Doutor António José Guerreiro de Brito Professor Associado com Agregação Instituto Superior de Agronomia Universidade de Lisboa.
Vogais: Doutora Maria Teresa Marques Ferreira da Cunha Cardoso Professora Catedrática
Instituto Superior de Agronomia Universidade de Lisboa;
3 Professor Associado com Agregação
Instituto Superior de Agronomia Universidade de Lisboa;
Doutor Pedro Manuel Hora Santos Coelho Professor Auxiliar
Faculdade de Ciências e Tecnologia Universidade Nova de Lisboa;
Doutora Maria Manuela Queiroz Martins Mantero Morais Professora Auxiliar
Escola de Ciências e Tecnologia Universidade de Évora;
Doutor Ricardo Nuno da Fonseca Garcia Pereira Braga Professor Auxiliar
Instituto Superior de Agronomia Universidade de Lisboa.
Instituição financiadora
Conselho Nacional de Desenvolvimento Científico e Tecnológico – CNPq – Brasil.
4 Dedico essa tese ao Gabriel Terencio
5 Diversos estudos em gestão de ecossistemas agrícolas têm apontado para os possíveis benefícios de zonas-tampão ripária na melhoria da qualidade de rios em pequenas áreas agrícolas. No entanto sabemos muito pouco, sobre como estas pesquisas se relacionam com outras escalas espaciais, principalmente em grandes áreas de agricultura. No presente estudo foi avaliada a eficácia de remoção das diferentes composições de vegetação ripária e sua largura, além de estudar os seus mecanismos de fixação. Foram selecionadas áreas de vegetação ripária composta por grama, arbustos e vegetação lenhosa. Para cada tipo de vegetação foram testadas larguras diferentes com 12, 36 e 0-60m, através de poços de monitoramento a cada 12m. As coletas foram realizadas após a primeira chuva, depois da aplicação dos compostos. A largura e o tipo de vegetação foram um fator importante para a remoção dos nutrientes
N, NO3- e P e dos cinco pesticidas estudados. As larguras de 12m mostraram ter
uma proteção insuficiente para a concentração de nutrientes e pesticidas utilizados nos locais de estudo. Quanto ao tipo de vegetação, zonas tampão
composta por árvores têm uma taxa de remoção muito eficaz de N, P e NO3- e
pesticidas estudados em comparação com áreas de vegetação arbórea e grama. Palavras-chaves: Zonas ripárias; nutrientes agrícolas; pesticidas; bacias hidrográficas; aguas subterrânea.
7 Several studies about the management of agricultural ecosystems have pointed to the potential benefits of riparian buffer zones to improve the quality of rivers in small agricultural areas. However we know very little about how these studies relate to other spatial scales, especially in large areas of agriculture. In the present study we evaluated the effectiveness of removal of the different compositions of riparian vegetation, its width and study their setting mechanisms. Areas of riparian vegetation consisting of grass, shrubs and woody selected. For each type of vegetation has been tested with different widths 12, 36 and 0-60m through monitoring wells every 12m. Samples were collected after the first rain after application of the compounds. The width and type of vegetation was an important factor in the removal of the nutrients N, P and NO3-, and the five pesticides studied. The 12m-width usually implemented by farmers perform an insufficient protection for the removal of nutrients and pesticides used in the study sites. Regarding the type of vegetation, buffer zones composed of trees have a
more effective removal rate of N, P and NO3- and pesticides, in comparison with
areas of shrub vegetation and grass.
Keywords: riparian zones; agricultural nutrients; pesticides; watersheds; groundwater.
9 Desafio tão grande quanto escrever essa tese, foi a utilização de uma página para agradecer as pessoas que fizeram parte desta minha trajetória acadêmica. Agradeço aos meus pais Terencio Rebello de Aguiar e Antônia Barbosa de Aguiar, por além de me oferecer todo amor e carinho, propiciar o mais elevado grau de estudo acadêmico incentivando e tendo a paciência que só os pais tem por um filho.
A minha esposa Katia Rasera e meu filho Gabriel Terencio Rasera de Aguiar pelo simples fato de existirem na minha vida e torná-la muito feliz.
As minhas irmãs e sobrinhos pelo amor incondicional.
A minha orientadora Profa. Dra. Maria Teresa Ferreira por dividir seu conhecimento comigo e estar sempre acessível e disposta a orientar.
Aos meus colegas do ISA e de Évora pelo acolhimento que sempre tive durante minha estadia em Portugal.
Aos pesquisadores e amigos Ali Umut Sem, Fernando Rodrigo Bortolozo, Fabricio Augusto Hansel e Alexsandro Gregório pelas inúmeras noites perdidas no campo e no laboratório realizando as análises que pareciam infinitas.
Aos professores António Guerreiro de Brito, Lucilia Maria Parron Vargas e Ernani Francisco da Rosa Filho, pela discussão e correção dos artigos.
A EMBRAPA Florestas e todos os funcionários que colaboraram com este trabalho.
Ao CNPq - Conselho Nacional de Desenvolvimento Científico e Tecnológico pela bolsa concedida.
Que a força esteja com você. v
10 Resumo i Abstract iii Agradecimentos v
Parte 1 18
Capítulo 1. Introdução Geral 19
1.2 Pesticidas utilizados na área de estudo 21
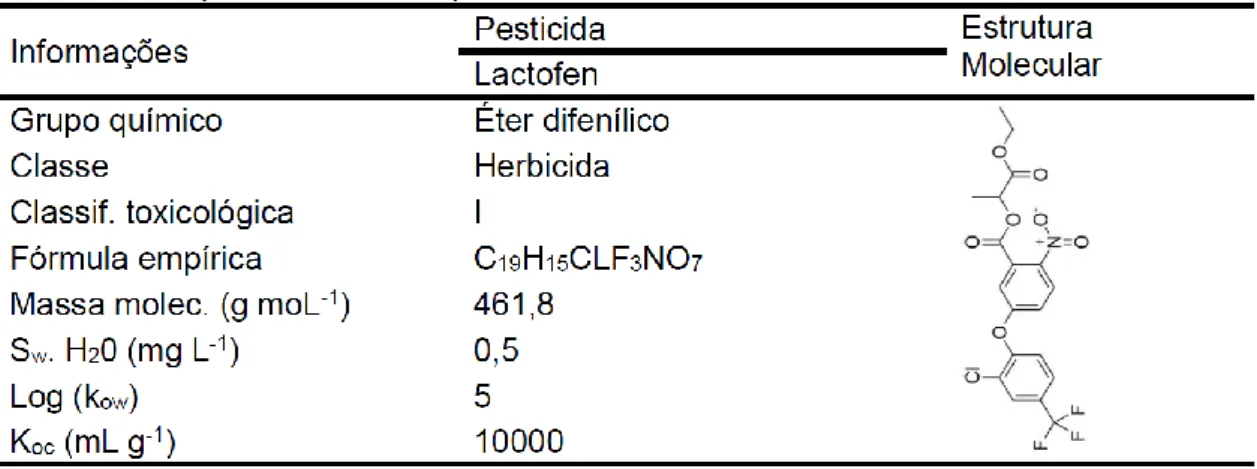
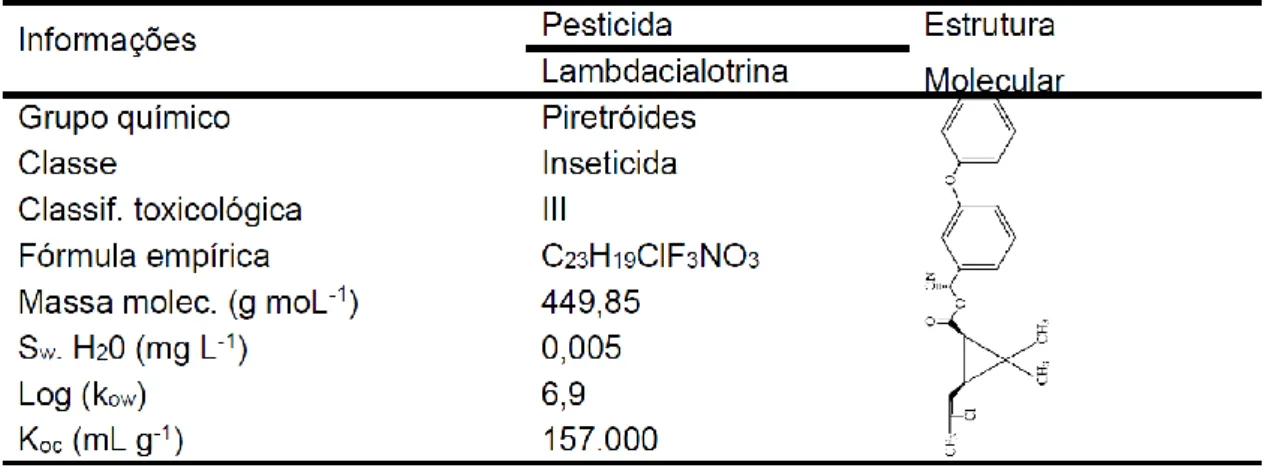
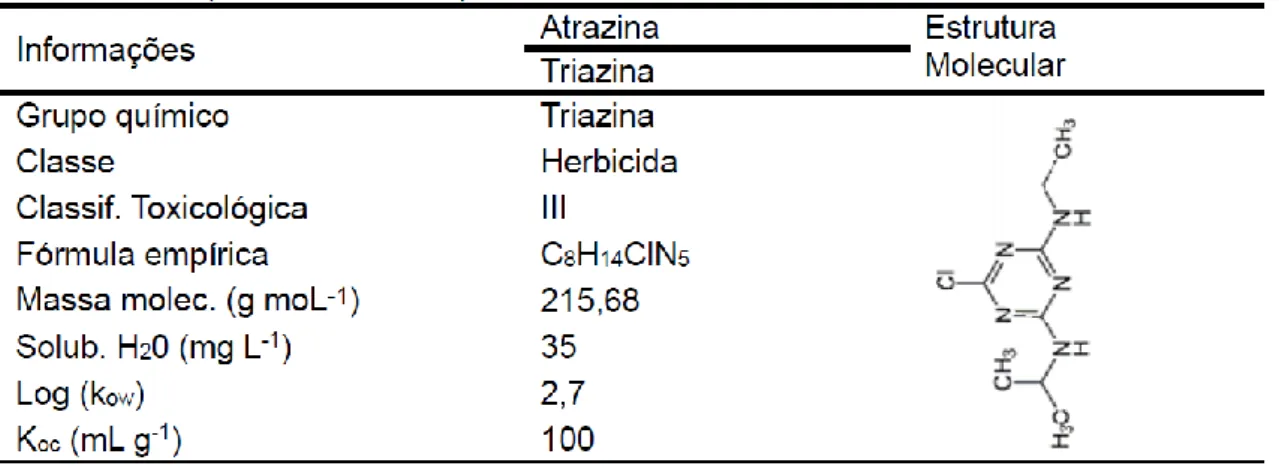
1.2.1 Fluazifop-p-butil 21 1.2.2 Lactofen 23 1.2.3 Lambdacialotrina 24 1.2.4 Clorpirifós 26 1.2.5 Atrazina 28 1.3 Nutrientes agrícolas 30
1.3.1 Nitrogênio e suas formas 30
1.3.2 Fósforo 33
1.4 Situação das áreas de estudo 34
1.5 Bacia Hidrográfica do Rio Cará-Cará 36
1.6 Objetivo geral e específicos 19
1.7Estrutura da tese 20
1.8 Referências 38
Parte 2 48
Capítulo 2. Eficácia da remoção de nutrientes pela vegetação ripária em bacias hidrográficas de clima temperadas: o impacto das práticas de
plantio direto em culturas agrícolas 49
2.1 Resumo 49
2.2 Abstract 50
2.4 Materiais e métodos 56
2.4.1 Caracterização da área de estudo 56
2.4.2 Método de coleta 57
2.4.3 Análises físico-químicas 59
2.4.4 Determinação do escoamento 60
2.5 Resultados 61
11
2.9 Referências 75
Parte 3 82
Capítulo 3. Vegetação ripária como filtros de pesticidas em culturas de
plantio direto 83 3.1 Resumo 83 3.2 Abstract 84 3.3 Introdução 85 3.4 Materiais e Métodos 88 3.4.1 Área de estudo 88
3.4.2 Coleta das amostras 90
3.4.3 Extração da Amostra 92
3.4.4 Cromatografia em fase gasosa - espectrometria de massa (GC-MS) 93
3.5 Resultados 95
3.6 Discussão 99
3.6.1 Largura e tipo de vegetação 99
3.6.1.O uso da terra e proteção dos ecossistemas 101
3.7 Conclusão 103
3.8 Agradecimentos 104
3.9 Referências 104
Parte 4 109
Capítulo 4. O destino de agrotóxicos em um aqüífero Karst tropical: um
estudo de cinco anos 110
4.1 Resumo 110
4.2 Abstract 111
4.3 Introdução 112
4.4 Material e métodos 115
4.4.1 Clima e contexto geológico 115
4.4.2 Métodos de coleta e análise 118
4.4.3 Extração da Amostra 119
4.4.4 Cromatografia em fase gasosa - espectrometria de massa (GC-MS) 120
4.5 Resultados 122
4.5.1 Características hidroquímicas das amostras 122
4.6 Discussão 128
4.7 Conclusão 131
12
Parte 5 135
Capítulo 5. Teor de matéria orgânica em solos de zonas ripária composta por vegetação lenhosa e grama e seus efeitos na adsorção de pesticidas
136
5.1 Resumo 136
5.2 Abstract 137
5.3 Introdução 138
5.4Metodologia 143
5.4.1 Características dos solos de estudo 143
5.4.2 Ensaios de adsorção 143
5.4.3 Ensaios de capacidade máxima de adsorção 144
5.4.4 Extração da Amostra 144
5.4.5 Cromatografia em fase gasosa - espectrometria de massa (GC-MS) 145
5.5 Resultados 147
5.6 Discussão 151
5.7 Conclusão 152
5.8 Referências 153
Parte 6 157
Capítulo 6. Discussão dos resultados 157
6.1 Zonas tampão ripárias como ferramenta para remoção de nutrientes
agrícolas e pesticidas 158
6.2 Destino de agroquímicos em aquífero kasrt sobre influência de uma área
ripária composta por árvores. 159
6.3 Adsorção de pesticidas em solos ripários 160
13 Figura 1.1. Consumo de pesticidas em kg para cada município do estado do
Paraná. 35
Figura 2.1. Mapa da bacia hidrográfica do rio Cará-Cará 56
Figura 2.2. Representação gráfica das áreas de coletas, sendo A área de
vegetação ripária, B área de vegetação arbustiva e C área de gramínea. 58
Figura 2.3. Remoção de N, P e NO3- em cada área de estudo, em que N (nitrogênio), P (fósforo) e Nit (nitrato), S (arbusto), G (gramas) e L (vegetação lenhosa). A eficiência foi calculada nas seguintes larguras da zona tampão (A) 0
- 12 m (B) 0 - 36m e (C) 0 - 60m. 64
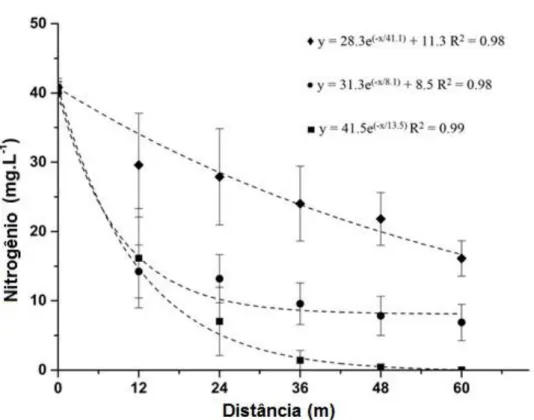
Figura 2.4. Relação entre a concentração de nitrato de (mg.L-1) e a distância dos pontos de amostragem nas zonas de amortecimento, usando larguras de entre 0 e 60m. A concentração de nitratos foi medida em áreas com zona tampão
composta por ♦ gramíneas, • arbusto ou ■ vegetação lenhosa. 66
Figura 2.5. Relação entre a concentração de nitrogênio (mg.L-1) e da distância
dos pontos de amostragem nas zonas tampão, utilizando larguras entre 0 e 60m, onde o ponto zero está localizado na é área agrícola e o ponto com 60m é o ponto as margens do rio. Concentração de nitrogênio foi medida em zonas
tampão composta por ♦ gramíneas, • arbusto ou ■ vegetação lenhosa. 67
Figura 2.6. Relação entre a concentração de fósforo (µg.L-1) e da distância dos
pontos de amostragem nas zonas tampão, utilizando larguras entre 0 e 60m, onde o ponto zero é localizado na zona agrícola e o 60m próximo ao leito do rio. Concentração de fósforo foi medida em zonas com zona tampão composta por
♦ gramíneas, • arbusto e ■ lenhosa. 69
Figura 3.1. Mapa do rio Cará-Cará (Aguiar et al., 2014). 89
Figura 3.2. Espectro de massa induzido por colisão parcial (MS / MS) a partir do ponto zero do transecto de zona tampão composta por vegetação lenhosa,
mostrando os íons quantitativos fragmentos m / z para cada pesticida. 96
Figura 3.3. Porcentagem de remoção de pesticidas em zonas tampão de 60 m, compostas por diferentes tipos de vegetação: lenhosas ▲, arbustos ● e grama ■, e os detalhes de correlação linear de remoção de pesticidas após os primeiros
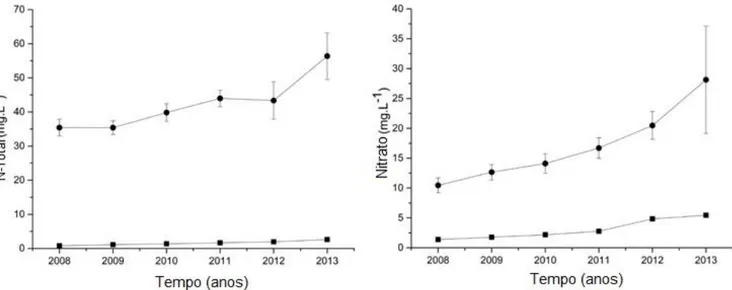
14 Figura 4.2. Análises de N-total e nitrato nos poços com profundidade de 8-9m ●
e 55-60m ■, entre Janeiro de 2008 e Janeiro de 2013. 126
Figura 4.3. Análises de pesticidas nos poços com profundidade de 8-9m ● e
55-60m ■, entre Janeiro de 2008 e Janeiro de 2013. 127
Figura 5.1. Eficiência de remoção dos pesticidas Atrazina (A), Clorpirifós (B), Fluazifop (C) e Lactofen (D) em solos contendo altas concentrações de matéria
15 Lista de tabelas
Tabela 1.1. Propriedades físico-químicas do Fluazifop-p-butyl 22
Tabela 1.2. Propriedades físico-químicas do Lactofen 24
Tabela 1.3. Propriedades físico-químicas do Lambdacialotrina 26
Tabela 1.4. Propriedades físico-químicas do Clorpirifós 28
Tabela 1.5. Propriedades físico-químicas da Atrazina 30
Tabela 2.1 Valores médios e desvio padrão para os parâmetros químicos obtidos em três diferentes estruturas de vegetação ripária e larguras (12, 36 e 60m), n = 9. As médias foram calculadas usando dados coletados em triplicado por 4
períodos de amostragem. 62
Tabela 3.1. Propriedades físico-químicas dos pesticidas estudados a 20-25ºC. 91 Table 3.2. Valores agroquímicos (µg L-1, n 12) de diferentes tamanhos de zona tampão
para os três tipos de vegetação estudados. 97
Tabela 4.1. Análise físico-química dos poços estudados, os dados recolhidos a partir de janeiro de 2008 a janeiro de 2013. Não houve diferença significativa para os parâmetros listados entre os resultados dos pontos de coleta localizados em profundidades de 8 - 9m e pontos de 55 - 60m, de acordo com o teste de
Tukey (p> 0,05). 124
Tabela 4.2. Análise físico-química dos poços estudados, os dados recolhidos a partir de janeiro de 2008 a janeiro de 2013. Foram observadas diferenças significativas para os parâmetros listados entre os resultados dos pontos de coleta localizados em profundidades de 8 - 9m e pontos de 55 - 60m, de acordo
com o teste de Tukey (p< 0,05). 125
Tabela 5.1. Caracterização das amostras analisadas quanto a concentração de
16
Símbolos Definição
Al+3 Íon alumínio
APHA American public health association
Atrazina-D5 Atrazina deuterada
BR Brasil
ºC min-1 Grau célsius por minuto
C18 Cartucho octadecyl
C8 Cartucho octyl
Ca+2 Ion Cálcio
CaCl2 Cloreto de Cálcio
CDPR California department of pesticide regulation
CEE Comunidade econômica europeia
Corg. Carbono orgânico
CONAMA Conselho nacional do meio ambiente
CTC Capacidade de troca catiônica
DL50 Dose letal 50 %
dm-3 Decímetro cubico
DS Densidade do solo
EDTA Ethylenediaminetetraacetic acid
EMBRAPA Empresa Brasileira de Pesquisa Agropecuária
EPA Environmental Protection Agency
g L-1 Grama por litro
g Grama
GC-MS Gas chromatography-mass spectrometry
GPS Global positioning system
H2O Água
H2SO4 Ácido sulfúrico
HA Health Advisories
HCl Ácido clorídrico
IBGE Instituto Brasileiro de Geografia e Estatística
IT Isolation time
IUPAC International Union of Pure and Applied Chemistry
KCl Cloreto de potássio
Kd Coeficiente de distribuição
Kg dm-3 Quilograma por decímetro cubico
kg Quilograma
KH Constante de henry
Koc Coeficiente de partição normalizado pelo carbono
orgânico
L dia-1 Litro por dia
L Litro
mg L-1 Miligrama por litro
mg kg-1 Miligrama por quilograma
mg+2 Ion Magnésio
mL min-1 Mililitros por minuto
MP Macroporosidade
NaOH Hidróxido de sódio
N-NO3- Nitrato
17
pKa Log da constante de dissociação ácida
pKb Log da constante de dissociação básica
PVC Policloreto de vinila
PT Porosidade total
SB Soma de bases
SPE Solid phase extraction
SW Solubilidade em água
TCP 3,5,6-Tricloro-2-Piridinol
UFPR Universidade Federal do Paraná
USEPA United States Environmental Protection Agency
18
Parte 1
_______________________________________________________________________________________________
19 Capítulo 1. Introdução Geral
Zonas ripárias podem ser entendidas como um mosaico
surpreendentemente diverso de acidentes geográficos, comunidades e ambientes compreendidos dentro de uma paisagem maior, e funcionam como estrutura básica conceitual a fim de se compreender a organização, diversidade e dinâmica das comunidades associadas aos sistemas fluviais (Naiman e Décamps, 1997). Estendendo esse conceito no tempo e espaço, essas zonas podem ser vistas em termos de padrões espaço-temporais levando em consideração a relação entre processos hidrológicos e geomorfológicos, sucessão de plantas terrestres e processos ecossistêmicos aquáticos (Gregory et al., 1991). Especificamente, essas áreas estão localizadas ao longo de rios e no entrono de nascentes, lagos e reservatórios (Rodrigues e Nave, 2000). O delineamento preciso de uma zona ripária se mostra muitas vezes difícil de ser determinado. Segundo Naiman & Décamps (1997), sua área abrange o canal do riacho entre o nível mais alto e o mais baixo, e a porção da paisagem terrestre que vai desde a marca de água mais alta até onde a vegetação é influenciada por cheias e o solo tem alta capacidade de reter água. Já segundo Gregory et al. (1991), a zona ripária se estende horizontalmente além dos limites das cheias, e verticalmente compreendendo o dossel da vegetação adjacente.
As formações florestais localizadas nestas áreas recebem diversas denominações: vegetação ripária, mata ciliar, mata de galeria, florestas ribeirinhas, entre muitas outras como bem discutido por Rodrigues (2009). A despeito de denominações generalistas, fica claro que essas formações não se constituem como um tipo vegetacional único, pois mesmo possuindo estrutura e função ecossistêmicas similares, elas diferem fundamentalmente em
20 composição taxonômica conforme o domínio morfoclimático e fitogeográfico do país (Ab’Sáber, 2009). A vegetação ripária ocupa uma das áreas mais dinâmicas de uma paisagem, sendo que a distribuição e composição dessa comunidade refletem tanto influências do ambiente fluvial na forma de cheias e vazantes, quanto influências das áreas terrestres adjacentes como fogo, vento, doenças e herbívoria (Gregory et al., 1991). Além disso, essas formações vegetais apresentam um elevado grau de complexidade estrutural e heterogeneidade ambiental devido principalmente às variações edáficas, topográficas e às características hidrológicas da bacia e do curso d’água (Rodrigues e Shepherd, 2009).
As florestas ripárias atuam na manutenção da integridade de uma bacia hidrográfica pela ação direta que têm em uma série de processos importantes para estabilidade da microbacia, para manutenção da qualidade e quantidade de água presente, assim como para manutenção da saúde ecológica dos próprios ecossistemas aquáticos (Lima e Zakia, 2009). Elas também são chamadas de zona tampão, justamente pelo fato de amortecerem os impactos provenientes das áreas que circundam o ecossistema aquático (Ferraz, 2001), representando um importante link de transição aquático-terrestre (Wallace et al., 1997; Naiman e Décamps, 1997). Além disso, esses ambientes têm grande importância ambiental e social, sendo inclusive considerados áreas de preservação permanente (APPs) pela legislação ambiental brasileira segundo o Código Florestal (Lei n° 4777/65), que limita sua ocupação e proíbe sua supressão. Dentre as muitas funções ecológicas importantes, está o funcionamento da vegetação ripária como corredores ecológicos para fauna e flora silvestres, sua atuação como filtro natural de sedimento e água, no controle de erosão das
21 margens, da incidência luminosa e um papel chave na ciclagem de nutrientes de riachos florestais (Gregory et al., 1991; Naiman e Décamps, 1997; Lima e Zakia, 2009).
Esse papel chave da vegetação ripária na ciclagem de nutrientes está diretamente relacionado com a dinâmica de energia dos ecossistemas aquáticos, principalmente de rios sombreados de pequenas ordens, que são sistemas predominantemente heterotróficos (Cummins et al., 1973; Vannote et al., 1980).
1.2 Pesticidas utilizados na área de estudo
1.2.1 Fluazifop-p-butil
O fluazifop-p-butil é um herbicida seletivo do grupo químico Aril oxi fenoxi propiônico, com formulação do tipo emulsão óleo em água. É utilizado para controle pós-emergência da aveia selvagem, cereais voluntários, e gramíneos anuais e perenes, colza, beterraba sacarina, beterrabas forrageiras, frutas com caroço, videiras, alfafa, plantas ornamentais, e outras colheitas de folhas largas. É um produto altamente tóxico para o meio ambiente (Classe II) e altamente biocumulável em peixes (ADAPAR, 2015).
O Fluazifop-p-butil tem um baixo potencial de lixiviação, apresentando maior potencial de contaminação de águas superficiais (Dores et al., 2001). A literatura apresenta variações no tempo de meia vida do produto no meio ambiente. Alguns estudos relatam que o tempo de meia vida do Fluazifop é de 15 dias (Nègre et al., 1993), sendo convertido a forma ácida (fluazifop Acid), que podem ter persistência de menos de um semana (EXTOXNET, 1996).
22 Entretanto, o produto comercial que é resultado da mistura entre o fluazifop-p-butil + fomesafen, o “Robust”, demonstrou alta persistencia no solo. Estudos conduzidos em argissolo vermelho-amarelo câmbico (PVAc) com cultivo de feijão em sistemas de plantio direto e convencional por Jakelaitis et al., (2006) permitiu que fosse encontrado resíduos de fluazifop após 72 dias após aplicação. Investigações sobre o efeito de transição (persistência) do herbicida da mistura comercial normalmente utilizada para a cultura do feijão, fluazifop-p-butil + fomesafen demonstrou que seu efeito residual pode chegar a mais de 150 dias após aplicação, afetando drasticamente as culturas subsequentes que não tem seu uso recomendado (Mancuso, 2011). No meio ambiente a degradação do fluazifop-p-butil pode ocorrer inicialmente por hidrólise, seguido da degradação por microrganismos (Negre et al., 1988; Nègre et al., 1993). Estudos realizados em condições controladas por Bordjiba et al., (2011) observou que fluazifop-p-butil pode ser degradado por espécies de bactéria gram-negativas chamadas
Aeromonas hydrophila. Esta é uma bactéria heterotrófica encontrada em
diversos ambientes, pois sobrevive tanto em condições aeróbicas como anaeróbicas. O estudo microbiológico permitiu identificar que está estirpe bacteriana foi capaz de usar o herbicida como fonte única de carbono. As propriedades físico-químicas do Fluazifop-p-butil estão na Tabela 1.1.
23 1.2.2 Lactofen
O Lactofen é outro herbicida do grupo químico Éter difenílico, com formulação do tipo concentrado emulsionável. É utilizado para controlar plantas daninhas de folhas largas na cultura de soja em pós-emergência, feijão entre outras culturas. Este pesticida é de uso restrito e está na Agência de Proteção Ambiental (EPA) com extrema toxicidade (classe I). Lactofen atende aos critérios de um composto com potencial carcinogênico para seres humanos baseado em diversos estudos que demonstraram que o fígado e nos rins são órgãos alvos para este pesticida.
Observou-se aumento do peso absoluto do fígado em ratos do sexo masculino expostos durante 78 semanas. Além disso, outros efeitos colaterais como a disfunção renal, diminuição dos níveis de hemoglobina, de hematócritos e as contagens de glóbulos vermelhos no sangue foram detectados em estudos de 1 ano em cães. Segundo a Agência de Defesa Agropecuária do Paraná (ADAPAR, 2015), com base nos critérios de classificação do EPA, há estudos suficientes para que o lactofen seja incluído na lista de pesticidas com potencial de carcinogenicidade, problemas hepáticos, renais e hematológicos. O Lactofen
24 meia-vida varia de 1 a 7 dias, possui baixa degradabilidade por hidrolise e fotolise e alta degradabilidade microbiana (EXTOXNET 1996). A aplicação do lactofen em solo argiloso e condições anaeróbicas, demonstrou que o processo de degradação ocorreu em aproximadamente 30 dias (Liang et al., 2010).
A baixa solubilidade em água faz com que o lactofen seja adsorvido ao sedimento e a matéria orgânica, ao invés de ficar dissolvido na solução do solo. Essa adsorção pode reduzir a toxicidade do pesticida, atenuando a ação do pesticida no meio ambiente (Liang et al., 2010). Estudos realizados por Diao et al. (2009), demonstraram que o lactofen é degrado principalmente por microrganismos, tanto em condições aeróbias como anaeróbias. Todavia, em função desta alta capacidade de formar resíduos ligados Diao et al. (2009) afirma que é necessário estudar com mais intensamente o comportamento do pesticida no meio ambiente. As propriedades físico-químicas do lactofen estão na Tabela 1.2.
Tabela 1.2. Propriedades físico-químicas do Lactofen
25 O pesticida lambdacialotrina é uma mistura de dois isômeros da cialotrina (Andreu e Picó, 2004). É um inseticida pertencente ao grupo dos piretróides, com formulação em suspensão. O inseticida pode ser usado para o controle de um amplo espectro de pragas, por exemplo, pulgões, besouros colorado, tripes, larvas de Lepidópteros larvas de Coleópteros, etc. Além do uso na agricultura, a lambdacialotrina é utilizada na saúde pública e animal, para o controle de um amplo espectro de insetos como carrapatos, baratas, moscas e mosquitos devido a sua ação residual em superfícies inertes. Resíduos desse pesticida também podem ser encontrados em produtos ricos em gordura, como o leite e o óleo de soja. Isso ocorre porque a lambdacialotrina é uma substância lipossolúvel (Muccio, et al., 1997). O lambdacialotrina apresenta meia-vida no solo variando de 1 a 6 semanas, alta toxicidade para peixes e invertebrados aquáticos, devido ao seu elevado coeficiente de partição-octanol-água (Kow). É um composto que atua na membrana nervosa, bloqueando os canais de sódio, interrompendo a transmissão dos impulsos nervosos e promovendo a perda do controle muscular e a morte (Barbosa et al., 2005). Cabrera et al. (2008), estudando o risco de contaminação de águas por pesticidas, constataram que o lambdacialotrina por apresentar baixa mobilidade no perfil do solo tem potencial de contaminação de águas superficiais. Tal potencial de contaminação é favorecido pela sua capacidade de adsorção ao sedimento e a matéria orgânica. Dores et al. (2008) investigaram este inseticida em águas superficiais na bacia do rio Miranda, no Pantanal Mato-Grossense, encontrando valores de 9,6 μg/kg. Estudos realizados em águas superficiais e subterrâneas na bacia do Itajaí em Santa Catarina revelaram a presença deste pesticida provavelmente ocasionada pelo transporte via escoamento superficial associado ao sedimento
26 (Pinheiro et al., 2010). O elevado valor de Koc do lambdacialotrina não permite a lixiviação, mas favorece as contaminações acidentais por lavagem de tanques e embalagens no córrego e via transporte escoamento superficial (Filizola et al., 2002). As propriedades físico-químicas do lambdacialotrina estão na Tabela 1.3.
Tabela 1.3. Propriedades físico-químicas do Lambdacialotrina
1.2.4 Clorpirifós
O clorpirifós é um inseticida do grupo químico dos organofosforados com formulação do tipo concentrado emulsionável. Este inseticida é altamente tóxico e amplamente usado no mundo e extremamente perigoso para meio ambiente (Agudelo et al., 2012), sendo utilizado em diversas culturas entre as quais milho, soja, trigo, sorgo, feijão, café, algodão, citros, maçã, banana, batata, cenoura, repolho, tomate, couve e fumo. Também pode ser usado para controle de pragas domésticas (Blattellidae, Muscidae, Isoptera), mosquitos (larvas e adultos) e em biotérios.
O uso para controle de pragas urbanas tem causado grande preocupação com a exposição aos seres humanos. Esse pesticida é um inibidor da
27 acetilcolinesterase e provoca a morte de insetos com potencial para prejudicar uma ampla gama de espécies já que a acetilcolinesterase está presente em todos os vertebrados (Sogorb et al., 2004). Devido à elevada lipossolubilidade, o clorpirifós é absorvido pelo organismo, especialmente pela pele, além de membranas mucosas e pela via respiratória, podendo também ser absorvido pelo trato gastrointestinal, normalmente, ocorre intoxicações acidentais, suicídios e homicídios (Pena et al., 2003).
Estudos demonstraram que a exposição ao clorpirifós desenvolvidos no Columbia Center for Children's Environmental Health está associada a problemas de desenvolvimento neurológico aos 3 anos de idade, além de problemas como defeitos de nascimento, baixo peso ao nascer, menor circunferência da cabeça, distúrbios do sistema nervoso e anormalidades do sistema imunológico (Rauh et al., 2011). Clorpirifós pode persistir no solo durante um período de 60-120 dias, tem uma solubilidade muito baixa em água sendo solúvel na maior parte dos solventes orgânicos (Singh et al., 2006).
Outro aspecto de grande relevância para o Clorpirifós é que a degradação do mesmo gera um subproduto denominado 3,5,6-tricloro-2-piridinol (TCP). Alguns estudos têm revelado que o TCP é conhecido pela sua atividade antimicrobiana, podendo desta forma, inibir a proliferação de microrganismos que degradada a molécula inicial do Clorpirifós (Coppola et al., 2007).
Na Califórnia, EUA, a detecção generalizada de Clorpirifós em águas superficiais e toxicidade associada aos macros invertebrados aquáticos como
Ceriodaphnia dúbia, determinou a reabilitação da qualidade de 25 corpos da
água superficiais. Tal comportamento, fez com o clorpirifós fosse colocado em reavaliação pelo Califórnia Department of Pesticide Regulation (CDPR) para
28 mitigar os problemas (Sullivan et al., 2007). As propriedades físico-químicas do Clorpirifós estão na Tabela 1.4.
Tabela 1.4. Propriedades físico-químicas do Clorpirifós
1.2.5 Atrazina
A atrazina é um dos herbicidas aplicados em pré-emergência que pertence ao grupo químico das triazinas com formulação do tipo Suspensão Concentrada. Este herbicida está entre uns dos mais utilizado no mundo, sendo caracterizada pela sua alta persistência no meio ambiente e capacidade de interferir no sistema neuroendócrino e reprodutivo e apresentar potencial carcinogênico (Coelho et al., 2012). A exposição a atrazina e seus subprodutos tem mostrado uma forte relação com anomalias pré-natais na população em geral, nascimentos prematuros, abortos espontâneos, interferência no ciclo menstrual e redução da fertilidade (Carmo et al., 2013). No Brasil a atrazina é intensamente utilizada no controle de plantas invasoras nas culturas de milho, soja e cana-de-açúcar.
29 A atrazina pode ser fortemente adsorvida nos solos que apresentaram maiores teores de carbono, indicando que a fração orgânica é o principal sorbente de atrazina no solo (Dick et al., 2011). A interação entre o pesticida atrazina e a matéria orgânica do solo é influenciada pelo pH do meio, que está diretamente ligado a ionização destas moléculas. Assim, quanto menor o pH do sistema solo maior será a probabilidade que a interação via troca iônica ocorra entre a atrazina e os grupos ácidos nas substâncias húmicas do solo (Javaroni et al., 1999). A degradação deste herbicida é governada pela hidrólise e pela ação de microrganismos no solo, sendo que a hidrólise ocorre mais rapidamente em ambientes fortemente ácidos ou básicos e mais lentamente em pH neutro (Urbanová et al., 1989). Segundo Peixoto et al., (2000) a atrazina pode ser degradada por hidrólise do carbono na posição 2 do anel heterocíclico da molécula, pela N-dealquilação das cadeias laterais, e pela clivagem do anel heterocíclico da molécula, sendo a N-dealquilação e a clivagem são processos biológicos de degradação subsequentes à hidrólise. Todavia, alguns estudos sugerem que a biodegradação é um dos mecanismos mais eficientes pela eliminação da atrazina do solo (Besse-Hoggan et al., 2009). Mesmo apresentando degradação por hidrólise e microbiana a intensidade de uso da atrazina torna esse herbicida um potencial poluidor de águas subterrâneas e superficiais. Este herbicida tem sido encontrado nos EUA e na Europa em mananciais em concentração variando de 2,9 a 89 μg.L-1 (Coelho et al, 2012).
A atrazina apresenta solubilidade moderada em água, moderada adsorção à matéria orgânica e argila, elevada persistência em solos, hidrólise lenta e facilidade de transporte via escoamento superficial (Maria et al., 2013). Assim ela tem sido encontrada em diversos compartimentos ambientais, como
30 águas subterrâneas, águas superficiais, chuvas e água de neblina, e seu tempo de meia vida tem sido estimado entre 1,5 a 5 anos (Besse-Hoggan et al., 2009). Segundo Nakagawa et al., (1996) verificou se em estudos realizados no Brasil a formação de 61% e 82% de resíduos ligados do herbicida atrazina, 400 dias após a aplicação em Gleissolo Húmico e Latossolo Vermelho-Escuro.
Estudos de campo realizados com o herbicida atrazina em época seca, demostraram que após 90 dias da aplicação o mesmo foi encontrado a 50 cm de profundidade. Sua concentração no escoamento superficial encontrou-se principalmente na fase líquida, com um percentual menor adsorvido nas partículas erodidas (Correia e Langenbach, 2006). Os autores reforçam que em função do potencial de poluição, esse não deve ser aplicado quando houver previsão de chuvas. As propriedades físico-químicas do Atrazina estão na Tabela 1.5.
Tabela 1.5. Propriedades físico-químicas da Atrazina
1.3 Nutrientes agrícolas
31 O N é um constituinte importante da terra, principalmente na litosfera, onde ocorre distribuído nas rochas, no fundo dos oceanos e sedimentos que
contém 1.1023 g de N, representando 98% do N existente (Plaster, 2013). O N
em forma gasosa ocorre em concentração de 78% da atmosfera terrestre a qual
tem um estoque estimado em 3,9.1021g N em forma não combinada (N2), sendo
o segundo maior reservatório de N na terra (Brady e Weil, 2007).
No solo o N encontra-se distribuído em vários compartimentos com o seguinte valores típicos em Kg ha-1: N
2 = 11.500, N-orgânico = 7.250, N-NH4+ =
10 e N-NO3- = 50 (Plaster, 2013). De todos os elementos químicos que circulam
no sistema solo-planta-atmosfera, o que sofre maior número de transformações bioquímicas no solo é o nitrogênio, cujo ciclo universal é resultante de três subciclos chamados: elementar, autotrófico e heterotrófico.
Os nutrientes, como nitrogênio e fósforo, são essenciais para o crescimento e nutrição de plantas e animais, mas o excesso de certos nutrientes na água pode causar uma série efeitos adversos e causar um desequilíbrio ecológico (Brady e Weil, 2007). Nitrogênio, sob a forma de nitrato, nitrito, ou de amónio, é um nutriente necessário para o crescimento das plantas.
O nitrogênio é usado abundantemente em todo o mundo na agricultura para o rápido crescimento do cultivo e melhorias na colheita, e em muitas fazendas a paisagem tem sido muito modificado, a fim de maximizar a produção agrícola. Campos foram nivelados e também modificado para drenar o excesso de água de forma eficiente que pode cair como precipitação ou para práticas de irrigação. Quando o excesso de nitrogênio é encontrado nos campos de cultivo, o escoamento superficial pode carreá-los para rios, lagos ou para água
32 subterrânea, nesses ambientes o excesso de nitrogênio pode levar a condições de hipóxia (falta de oxigênio) (Plaster, 2013).
O excesso de nitrogênio pode causar hiperestimulação do crescimento de plantas aquáticas e algas. O crescimento excessivo destes organismos, por sua vez, pode obstruir a passagem da luz, bloqueando a luz para zonas mais profundas utilizando o oxigénio dissolvido à medida que se decompõem (Brady e Weil, 2007). Dessa forma, o processo de eutrofização leva à morte de animais (especialmente peixes, pela falta de oxigênio para respiração) e plantas (pela falta de oxigênio e pela falta de luz para a realização da fotossíntese). Recursos hídricos eutrofizados geralmente são chamados de “mortos”, pois são raros os animais que ali conseguem sobreviver.
O N-orgânico contido nos aminoácidos ou outros monômeros produzidos pela ação das enzimas extracelulares sobre moléculas mais complexas, são imediatamente absorvidos pelos microrganismos e, dentro das células, sofrem
desaminação, sendo parte do grupo amino excretado como NH3/NH4+. Este, no
solo, continua a sofrer transformações, convertendo-se em NO2- que
imediatamente converte-se em NO3-, processo este chamado de nitrificação (Brady e Weil, 2007).
A nitrificação é a oxidação do amônio a nitrato sendo realizada por diferentes grupos de bactérias quimiautotróficas (Plaster, 2013).
O nitrato, na água potável pode ser prejudicial para crianças ou animais jovens. Nitrato em excesso pode resultar em restrição de transporte de oxigênio na corrente sanguínea, pois a hemácia na presença de nitrato o utiliza no lugar do ferro. Crianças com idade de 4 meses não possuem a enzima necessária para corrigir esta condição ("síndrome do bebê azul"). Em partes da Europa
33 Oriental, onde as águas subterrâneas são contaminadas com 50-100 miligramas por litro (mg/L) de nitrato, mulheres grávidas e crianças com menos de 1 ano de idade são abastecidas com água engarrafada (Brady e Weil, 2007).
1.3.2 Fósforo
O fósforo é um elemento importante a todas as formas de vida por fazer parte de biomoléculas como ácidos nucléicos e ATP. A maior parte do P do planeta encontra-se nos sedimentos oceânicos, sendo encontrado em menor parte na biosfera terrestre, na qual o solo é um enorme reservatório deste elemento (Plaster, 2013). O P é um recurso natural finito e sem sucedâneo e seu ciclo tende a converte-se a formas estáveis no solo e sedimentos, sendo, portanto, um ciclo aberto. Na maioria dos solos agrícolas, especialmente nos brasileiros, o P, juntamente com o N, representam os nutrientes que mais limitam a produção, sendo necessário a aplicação em grandes quantidades desse elemento nas culturas. Na maioria dos solos a maior parte deste ocorre em fração mineral ligada aos óxidos de Fe e Al nos solos ácidos, e ao Ca nos solos neutros ou alcalinos (Plaster, 2013). O P orgânico do solo varia de 3 a 90% do P total dependendo do tipo de solo, ou de 1 a 3% da matéria orgânica do solo, sendo encontrado principalmente na forma de fosfato de inositol, fosfolipídios e nucleotícos (Brady e Weil, 2007). Assim como o nitrogênio o P pode causar eutrofização de rios e lagos, além de contaminar a água subterrânea (Plaster, 2013).
O processo de “fixação” de P no solo ocorre com grande rapidez e intensidade, formando compostos com elevada estabilidade química, como fosfatos de Al e Fe nos solos ácidos e de Ca nos neutros ou alcalinos, limitando
34 a disponibilidade desse nutriente na solução do solo (Plaster, 2013). Vários grupos de microrganismos do solo ou da rizosfera são capazes, por meio de mecanismos diversos, de extrair ou solubilizar o P desses compostos, como também de fosfatos inorgânicos naturais pouco solúveis.
1.4 Situação das áreas de estudo
No Brasil a produção de grãos para o ano de 2012 foi de 193,5 milhões de toneladas e a área plantada de 42,6 milhões de hectares. O Paraná, com apenas 2,3% da área do país, é atualmente responsável por 20,8 % da produção nacional (IBGE, 2015).
O município de Ponta Grossa-PR, é um polo de produção agropecuária com altos índices de produtividade para lavouras de soja, milho e milho safrinha, contribuindo de maneira expressiva para economia da região que devido a grande produção agrícola viu o número de indústrias crescer de 12 para 28 em 4 anos, entre essas indústrias destacamos as multinacionais Bunge, Cargill, Heineken, MONSANTO e outras. Todavia, esses grandes ganhos de produtividade estão atrelados ao uso intenso de pesticidas, utilizados muitas vezes, em desacordo com receituário agronômico. O manejo inadequado das áreas agrícolas vem tornando-se uma fonte potencialmente poluidora das águas superficiais, subterrâneas e do próprio solo (Dores et al., 2001; Reis et al., 2014). O consumo de pesticidas dos municípios do estado do Paraná foi realizado pela Associação de defesa agropecuária do Paraná (Figura 1.1).
35 Figura 1.1. Consumo de pesticidas em kg para cada município do estado do Paraná.
Fonte: ADAPAR (2011).
No Brasil as grandes áreas agrícolas têm adotado o sistema de plantio direto (SDP) como o principal meio para melhoria da qualidade do solo.
O Sistema de Plantio Direto é uma tecnologia conservacionista que teve grande desenvolvimento a partir da década de 1990 no Brasil e já se encontra bastante difundida entre os agricultores, dispondo-se, atualmente, de sistemas adaptados a diferentes regiões e aos diferentes níveis tecnológicos. Os princípios do sistema de plantio direto seguem a lógica das florestas. Assim como o material orgânico caído das árvores se transforma em rico adubo natural, a palha decomposta de safras anteriores macro e microorganismos, transformando-se no “alimento” do solo. As vantagens são a redução no uso de insumos químicos e controle dos processos erosivos, uma vez que a infiltração
36 da água se torna mais lenta pela permanente cobertura no solo. O Brasil é líder mundial no uso do sistema, que ocupa mais da metade de sua área plantada.
O sistema de plantio direto apresenta inúmeras vantagens em relação ao sistema de plantio convencional, todavia, práticas muito eficientes para redução do escoamento superficial como o uso do terraço agrícola e o plantio em contorno estão sendo abandonados.
1.5 Bacia Hidrográfica do Rio Cará-Cará
A bacia hidrográfica do rio Cará-Cará está localizada na porção sudeste do município de Ponta Grossa, no Estado do Paraná. O rio Cará-Cará é afluente da margem direita do rio Tibagi, apresentando altitudes que variam de 780 a 1020 m.
A bacia em questão é de 4ª ordem e apresenta uma rede de drenagem densa e perene, onde ocorrem processos de erosão e o transporte de sedimentos de regiões mais elevadas para planícies a jusante da bacia (Godoy et al., 1994).
A bacia do rio Cara-Cará está situada no Segundo Planalto Paranaense, a 860 metros de altitude, sendo desta forma, embasada por rochas sedimentares do Paleozoico oriundas da Formação Furnas, Formação Ponta Grossa e sedimentos quaternários, grupo Paraná. Na margem esquerda das nascentes do Rio Cará- Cará, encontra-se a Formação Furnas, enquanto que na porção sudeste e noroeste da bacia, ocorre a formação Ponta Grossa. Além disso, na foz do Rio Cará-Cará ocorre deposição fluvial de sedimentos quaternários como areia, siltes e cascalhos. A predominância de rochas sedimentares com
37 intrusões de diabásio, definem o traçado dos rios nesse local (MINEROPAR, 2005).
O clima é do tipo Cfb, temperado, com temperatura média no mês mais frio abaixo dos 18ºC, com verões frescos, temperatura média no mês mais quente entorno de 25ºC e sem estação seca e chuvosas bem definida, sendo a precipitação anual de 1668,5 mm (Wrege et al., 2011).
1.6 Objetivo geral
O principal objetivo desse trabalho é avaliar a eficácia de diferentes configurações de zonas-tampão, suas dimensões e estrutura que mais beneficiam a retenção de nutrientes de zonas agrícolas.
1.6.1 Objetivos específicos
- Verificar o poder tampão de diferentes tipos de vegetação ripária como filtro de nutrientes agrícolas e pesticidas;
- Analisar a existência de relação entre a o tipo de vegetação e diferentes larguras como ferramenta para retenção de fertilizantes e pesticidas;
- Avaliar o destino de agroquímicos em uma área de aquífero karst sobre influência de áreas ripárias composta por árvores, e
38 - Avaliar o poder de retenção de pesticidas por solos de áreas ripárias compostas por árvores e grama.
1.7 Estrutura da tese
A tese está estruturada em cinco seções, sendo a primeira uma introdução onde o leitor ira compreender as obras aqui apresentadas, além de oferecer o conhecimento considerado essencial para permitir uma melhor compreensão do tema estudado. Além disso, os objetivos gerais e específicos da tese são apresentados, bem como, a estrutura e organização da tese.
As demais seções da tese (capitulos I, II, III, IV e V) a seguir são referentes aos estudos desenvolvidos para atingir os objetivos da tese, e são divididas em cinco capítulos cada.
Cada capítulo do II ao V, corresponde a uma questão científica e apresenta os resultados e as conclusões alcançadas: Eles são artigos autônomos que foram publicados, aceitos para publicação ou submetidos a um jornal peer-reviewed. Estes artigos são aqui apresentados de forma idêntica à versão publicada ou apresentada, mas tiveram ligeiras alterações para a formatação, a fim de criar uniformidade entre as obras.
Capitulo 2 - Nesse capítulo foi analisada a remoção de nutrientes agrícolas por diferentes composições e estruturas de vegetação ripária sobre influência de um sistema de plantio direto de clima temperado.
39 Aguiar, T.R.Jr., Rasera, K., Parron, L.M., Brito, A.G., Ferreira, M.T., 2014. Nutrient removal effectiveness by riparian buffer zones in rural temperate watersheds: The impact of no-till crops practices. Agricultural Water Management.149:74-80.
Capitulo 3 – No capitulo três foi avaliada a eficácia de remoção de cinco pesticidas utilizados em uma cultura de milho em sistema de plantio direto por diferentes tipos de vegetação e larguras de zonas ripárias.
Aguiar, T.R.Jr., Bortolozo, FR., Hansel, FA., Rasera, K., Ferreira, MT., 2015 Riparian buffer zones as pesticide filters of no-till crops. Environmental Science and Pollution Research. 22:7500-7510.
Capitulo 4 - No capitulo quatro foi investigado, durante cinco anos, o destino de nutrientes agrícolas e pesticidas em um aquífero kasrt sobre influência de uma área ripária composta por árvores.
Aguiar, T. R. Jr., Bortolozo F. R., Rosa Filho, E. F., Parron L. M., Rasera K., Brito A.G., Ferreira M. T. 2015. Fate of selected agrochemicals in a tropical karst aquifer: a five-year study. Environmental Science and Pollution Research (submetido).
Capitulo 5 – No capitulo cinco estudamos a adsorção de pesticidas em solos provenientes de áreas ripárias composta por vegetação de árvores e grama.
40 Aguiar, T. R. Jr., Rosa Filho, E. F., Rasera K., Hansel, F.A., Ferreira M. T. 2015. Organic matter content in wood and grass riparian soils and its effect in pesticide adsorption. Environmental Pollution Research (em submissão).
1.8 Referências
Ab’Saber A.N. 2009. O suporte ecológico das florestas beiradeiras (ciliares). In: Rodrigues, R.R. e Leitão-Filho, H.F. (eds.) Pp 15-25. Matas ciliares: conservação e recuperação. São Paulo: EDUSP, 2ª ed. 2ª reimp. 320p.
Adapar. Fusilade 250 ew. Registrado no Ministério da Agricultura, Pecuária e Abastecimento / MAPA sob no 005796, 1–10.
Agudelo C.R.M., Jaramillo M.L., Peñuela G. 2012. Comparison of the removal of chlorpyrifos and dissolved organic carbon in horizontal sub-surface and surface flow wetlands. The Science of the total environment, 431, 271–277.
Andreu V., Picó Y. 2004. Determination of pesticides and their degradation products in soil: critical review and comparison of methods. TrAC Trends in Analytical Chemistry, 23, p. 772–789.
Barbosa E., Roberto J., Parra P. 2005. Seletividade de lambdacialotrina a Trichogramma pretiosum Riley,1879 (Hymenoptera: Trichogrammatidae). Maringa, 27, 321–326.
Besse-Hoggan P., Alekseeva T., Sancelme M., Delort A.M., Forano C. 2009. Atrazine biodegradation modulated by clays and clay/humic acid complexes. Environmental pollution (Barking, Essex: 1987), 157, 2837–2844.
41 Bordjiba O., Merah N., Djeribi R. 2011. Biodegradation of herbicide: Fluazifop-p-butyl by a microbial consortium in biphasic system. Toxicology Letters, 205, S293–S294.
Brady N. C., Weil R. R. 2007. The Nature and Properties of Soils, 14th Edition, Prentice Hall, 980p.
Cabrera L., Costa F.P., Primel E.G. 2008. Risk estimate of water contamination by pesticide in south of Brazil. Química Nova, 31, 1982–1986.
Carmo A., Pires, J. 2013. Comportamento ambiental e toxidade dos herbicidas atrazina e simazina. An Interdisciplinary Journal of Applied Science, 8, 133–143.
Coelho E., Bernardo L. 2012. Remoção de atrazina e metabólitos pela filtração lenta com leito de areia e carvão ativado granular. Eng Sanit Ambient, 17, 269– 276.
Coppola L., Castillo M.D.P., Monaci E., Vischetti C. 2007. Adaptation of the biobed composition for chlorpyrifos degradation to Southern Europe conditions. Journal of agricultural and food chemistry, 55, 396–401.
Correia F. V., Langenbach T. 2006. Dinâmica da distribuição e degradação de atrazina em argissolo vermelho-amarelo sob condições de clima tropical úmid. Revista Brasileira de Ciência do Solo, 30, 183–192.
Cummins, K.W., Petersen, R.C., Howard, F.O., Wuycheck, J.C. & Holt, V.I. 1973. The utilization of leaf litter by stream detritivores. Ecology, 54, 336-345.
42 Diao J., Lv C., Wang X. 2009. Influence of soil properties on the enantioselective dissipation of the herbicide lactofen in soils. Journal of agricultural and food chemistry, 57, 5865–5871.
Dick D.D. P., Mozael M., Benvenuti S. 2011. Sorção de atrazina e de mesotriona em latossolos e estimativa do potencial de contaminação. Química Nova, 34, 1378–1384.
Dores E. F. G. C., Calheiros, D. F. 2008. Contaminação por agrotóxicos na bacia do rio Miranda, Pantanal (MS). Revista Brasileira de Agroecologia, 3, 202–205.
Dores, E.F.G.C., Lamonica Freire E. M. 2001. Contaminação do ambiente aquático por pesticidas. Estudo de caso: águas usadas para consumo humano em primavera do leste, Mato Grosso – Análise preliminar. Química Nova, v. 24, 27–36.
Extoxnet. 1996. Fluazifop-p-butyl. Pesticide Information Profiles. Extension
Toxicology. Extension Toxicology Network, 6–7, Disponível em:
<http://ace.orst.edu/info/extoxnet/.>.
Ferraz D.K. 2001. O papel da vegetação na margem de ecossistemas aquáticos. In: Primack, R. B. & Rodrigues, E. (eds.) Biologia da conservação. Londrina, 328p.
Filizola H., Ferracini V., Sans L. 2002. Monitoramento e avaliação do risco de contaminação por pesticidas em água superficial e subterrânea na região de Guaíra. Pesq. Agropec. Bras., 1,659–667.
43 Godoy L.C. 1994. Levantamento da atividade extrativa de areia do município de Ponta Grossa e suas implicações ambientais. Ponta Grossa-PR: Prefeitura Municipal de Ponta Grossa/Departamento de Meio Ambiente/GEOTEMA S/C.
Gregory S.V., Swanson F.J., Mckee W.A., Cummins K.W. 1991. An ecosystem
perspective of riparian zones – focus on links between land and water.
BioScience, 41, 540–551.
IBGE - Instituto Brasileiro de Geografia e Estatística. Estatística e indicadores agropecuários<http://www.ibge.gov.br/home/estatistica/indicadores/agropecuari a/lspa/lspa.htm> Acessado em 04 de abril de 2015.
Jakelaitis A., Vivian R., Santos J., Silva A., Silva A. 2006. Atividade residual no solo da mistura comercial dos herbicidas fluazifop-p-butil e fomesafen utilizados no cultivo convencional e direto do feijoeiro. Planta Daninha, 24, 533–540.
Javaroni R., Landgraf M., Rezende M. 1999. Comportamento dos herbicidas atrazina e alaclor aplicados em solo preparado para o cultivo de cana-de-açúcar. Química Nova, 22 (1), 58–64.
Liang B., Zhao Y.K., Lu P., Li S.P., Huang X. 2010. Biotransformation of the diphenyl ether herbicide lactofen and purification of a lactofen esterase from Brevundimonas sp. LY-2. Journal of agricultural and food chemistry, 58 (17), 9711–9715.
Lima, W.P. & Zakia, M.J.B. 2009. Hidrologia de matas ciliares. In: Rodrigues, R.R. & Leitão-Filho, H.F.L. (eds.). Matas ciliares: conservação e recuperação. São Paulo, Edusp, 2ª ed. 2ª reimp. 319p.
44 Mancuso M. 2011. Efeito residual de herbicidas no solo (“Carryover”). Revista Brasileira de Herbicidas, 151–164.
Maria J., Pires B., Oliveira J.L.M. 2013. Environmental behavior and toxicity of herbicides atrazine and simazine. Revista Ambiente & Água, 8 (1), 133–143.
MINEROPAR – MINERAIS DO PARANÁ S.A. 2005. Cartas Geológicas do
Estado do Paraná – Escala 1:250.000. Folha Ponta Grossa (SG.22-X-C).
Curitiba: Secretaria de Estado do Meio Ambiente e Recursos Hídricos, Zoneamento Ecológico-Econômico do Paraná, CD-ROM.
Muccio A. Di, Pelosi P., Barbini D. A. 1997. Selective extraction of pyrethroid pesticide residues from milk by solid-matrix dispersion. Journal of chromatography. A, 765 (1), 51–60.
Naiman R.J., Décamps H. 1997. The ecology of interfaces: Riparian zones.
Annual Review of Ecology, Evolution, and Systematics, 28, 621-658.
Nakagawa L. E., Andréa M. M. De. 2000. Degradação e formação de resíduos não-extraíveis ou ligados do herbicida atrazina em solo 1 or bound residues of the atrazine herbicide in soil. Pesq. Agropec. Bras, 35 (8), 1509–1515.
Negre M., Gennari M., Andreoni V., Ambrosoli R., Celi L. 1993. Microbial metabolism of fluazifop-butyl. Journal of environmental science and health. Part. B, Pesticides, food contaminants, and agricultural wastes, 28, 545–576.
Negre M., Gennari M., Cignetti A., Zanini E. 1988. Degradation of fluazifop-butyl in soil and aqueous systems. Journal of Agricultural and Food Chemistry, 36, 1319–1322.
45 Peixoto M., Lavorenti A., Regitano J. B., Tornisielo V. L. 2000. Degradação e formação de resíduos ligados de 14C-atrazina em Latossolo Vermelho Escuro e Glei Húmico. Scientia Agricola, 57, 147–151.
Pena M. F., Amaral E. H., Sperling E. Von, Cruz I. 2003. Método para determinação de resíduos de clorpirifós em alface por cromatografia a líquido de alta eficiência. Revista Ecotoxicologia e Meio Ambiente, 13, 37–44.
Pinheiro A., Silva D., Kraisch R. 2010. Presença de pesticidas em águas superficiais e subterrâneas na bacia do Itajaí, SC. REGA, 7, 17–26.
Plaster E. J. 2013. Soil Science and Management 6th Edition. Delmar Publishers Inc., Albany, NY. 544 p.
Rauh V., Arunajadai S., Horton M. 2011. Seven-year neurodevelopmental scores and prenatal exposure to chlorpyrifos, a common agricultural pesticide. Environmental health perspectives, 119, 1196–1201.
Rodrigues R.R., Nave A.G. 2000. Heterogeneidade florística das matas ciliares. In: Rodrigues, R.R. e Leitão Filho, H.F.L. (eds.), Pp. 45-71. Matas ciliares:
conservação e recuperação. São Paulo: EDUSP. 320p.
Rodrigues R.R. 2009. Uma discussão nomenclatural das formações ciliares. In: Rodrigues R.R., Leitão-Filho, H.F. (eds.), Pp 91-99. Matas ciliares: conservação
46 Singh B.; Walker A. 2003. Effects of soil pH on the biodegradation of chlorpyrifos and isolation of a chlorpyrifos-degrading bacterium. Applied and Environmental Microbiology, 69, 5198–5206.
Sogorb M. A; Vilanova E.; Carrera V. 2004. Future applications of phosphotriesterases in the prophylaxis and treatment of organophosporus insecticide and nerve agent poisonings. Toxicology letters, 151, 219–33.
Sullivan J. J., Chen Y. G., Goh K. S. 2007. Performance assessment and validation of a paramagnetic particle-based enzyme-linked immunosorbent assay for chlorpyrifos in agricultural runoff waters. Journal of agricultural and food chemistry, 55, 6407–6416.
Urbanová Z., Picek T., Bárta J. 2011. Effect of peat re-wetting on carbon and nutrient fluxes, greenhouse gas production and diversity of methanogenic archaeal community. Ecological Engineering, 37, 1017–1026.
Vannote R.L., Minshall G.W., Cummins K.W., Sedell J.R., Cushing C.E. 1980.The river continuum concept. Canadian Journal of Fisheries and Aquatic Sciences. 37, 130–137.
Wallace J.B., Eggert S.L., Mayer J.L., Webster J.R. 1997. Multiple trophic levels of a forest stream linked to terrestrial litter inputs. Science, 277,102-104.
Wrege M., Steinmetz, S., Júnior C. R., Almeida I. R. De. 2011. Atlas climático da Região Sul do Brasil: Estados do Paraná, Santa Catarina e Rio Grande do Sul. Embrapa Clima Temperado.
48
Parte 2
_______________________________________________________________________________________________
Eficácia da remoção de nutrientes pela
vegetação ripária em bacias hidrográficas de
clima temperadas: o impacto das práticas de
plantio direto em culturas agrícolas
Não há emoção, há a paz. Não há ignorância, há o conhecimento. Não há paixão, há serenidade. Não há caos, há harmonia. Não há morte, há a Força
49 Capítulo 2. Eficácia da remoção de nutrientes pela vegetação ripária em bacias hidrográficas de clima temperadas: o impacto das práticas de plantio direto em culturas agrícolas
2.1 Resumo
O sistema de plantio direto é uma práticas agrícolas amplamente utilizados em áreas temperadas devida ao seu grande potencial de reter a água no solo. Zonas tampão ripárias têm o potencial de reter contaminantes agroquímicos e atenuar os efeitos colaterais aos ecossistemas aquáticos, principalmente por derivados de fertilizantes que muitas vezes são aplicados em excesso na produção agro-alimentar. A este respeito, diferentes configurações e larguras das zonas ripárias (12, 24, 36, 48 e 60m) compostas por vegetação lenhosa, arbustos ou gramas foram avaliadas nesse estudo. A metodologia do trabalho foi composta da avaliação de um grande número de locais experimentais composto por diferentes composições de vegetação ripária e larguras a amostragem foi realizado após o primeiro período de chuva, após a aplicações de fertilizante. Os resultados apontam para o fato de que a eficácia é largamente influenciada pela largura da zona tampão e tipo de vegetação. Com efeito, as zonas ripárias com Largura de 60m composto por vegetação lenhosa foram mais eficazes para remoção do fósforo (99,9%) e nitrogênio (99,9%), quando comparada áreas com arbusto (66,4% e 83,9%, respectivamente) ou grama (52,9% e 61,6%, respectivamente). Vegetação lenhosa tem sistemas radiculares profundos, além desses solos terem um maior teor de matéria orgânica quando comparado com áreas de grama e arbustos.
Palavras-chave: Contaminação da água; nutrientes agricolas; sistemas de plantio direto; clima temperado; nitrogênio; fósforo.
50 2.2 Abstract
Riparian buffer zones have the potential to capture chemical contaminants and to mitigate detrimental side-effects in aquatic ecosystems derived from
excess fertilizers used in agro-food production. No-till farming systems are well
known agricultural practices and are widely used in temperate areas. In that regard, different settings and widths of riparian buffer zones (12, 24, 36, 48 and 60m) with woody vegetation, shrubs or grasses were assessed. The methodology was comprised of the evaluation of a large number of experimental sites and the sampling was conducted after the first rain period and respective fertilizer applications. The results point to the fact that effectiveness is largely controlled by buffer zone width and vegetation type. Indeed, buffer zones with 60m width composed of woody soils were more effective in phosphorus (99.9%) and nitrogen (99.9%) removal when compared to shrub (66.4% and 83.9% respectively) or grass vegetation (52.9% and 61.6%, respectively) areas. Woody vegetation has deep rooting systems and woody soils have a higher content of organic matter when compared to grass and shrubs areas.
Keywords: Water contamination; nutrients; no-till systems; temperate climate zones; nitrogen; phosphorus.
51 2.3 Introdução
Os avanços tecnológicos no setor de produção agrícola proporcionaram diversos ganhos na produção de alimentos e fibras no mundo todo. Entretanto o uso intensivo de agroquímicos, como o nitrogênio, fósforo e pesticidas vem se tornando a segunda maior causa de contaminação das águas subterrâneas e ecossistemas fluviais no mundo, perdendo apenas para a contaminação causada pelo esgoto doméstico (Mahler et al., 2008). Apesar de ocorrer em diversas regiões do mundo, desde países desenvolvidos da Europa e América do Norte, como em países em desenvolvimento como o Brasil, a intensificação com que se tem encontrado estes poluentes em diferentes compartimentos ambientais tem preocupado cientistas do mundo todo, tornando relevante a realização de pesquisas para que se forneça subsídios para a proteção de ambientes vulneráveis, como aquíferos cársticos, que são fonte de água para abastecimento da população mundial.
O sistema de plantio direto, tem sido intensamente utilizado no Brasil (Anghinoni, 2007), esse sistema proporciona um aumento nos teores de elementos químicos no solo, principalmente na camada superficial (Campbell et al., 2000; Schröder et al, 2004; Anghinoni, 2007). Isto pode contribuído para perdas de nutrientes através do escoamento superficial, tanto na forma solúvel quanto adsorvido a partículas coloidais em suspensão (Correll et al., 1999; Grismer et al., 2008).
As partículas em suspensão têm uma colaboração extremamente importante no transporte, tanto em quantidade, quanto na distância que os poluentes podem percorrer. Estas frações solúveis e particuladas são
52 comumente depositadas em outras áreas a jusante das áreas de produção (Pruski et al., 2005), podendo contaminar ambientes vulneráveis como águas superficiais e áreas de recarga de aquíferos.
Assim como os pesticidas, as elevadas concentrações de nutrientes agrícolas em águas superficiais e subterrâneas também podem ser consideradas contaminantes estando diretamente relacionadas com o transporte por meio do fluxo vertical, principalmente em rochas carbonárias, onde a circulação da água se faz nas fraturas e outras descontinuidades que resultaram da dissolução do carbonato pela água. O transporte de partículas coloidais pode ocorrer naturalmente em função das condições de relevo ou em maior intensidade pelas atividades antrópicas (Mahler et al., 2008).
Fertilizantes agrícolas como o NPK são a principal fonte de carga de nutrientes em aquíferos subterrâneos e bacias de grandes rios (Ribaudo et al, 2001; Turner e Rabalais, 2003; Schröder et al, 2004), contribuindo para a redução da quantidade de oxigênio dissolvido presente na água devido a eutrofização, e assim, podendo levar a redução da vida aquática nos ecossistemas fluviais e da redução de aquíferos que apresentam potabilidade. Práticas de gestão agrícola, tais como zonas tampão de vegetação ripária e lavoura de conservação, têm sido usados para reduzir o escoamento destes poluentes.
A lixiviação de compostos como o NO3- e P em áreas agrícolas é potencializada pelas propriedades físicas dos solos, pelas práticas agrícolas intensivas, pelas condições climáticas (pluviosidade) e pelo uso de irrigação, principalmente em culturas de ciclo rápido como olerícolas.
53
Quando na solução do solo o NO3- fica muito propenso ao processo de lixiviação,
favorecendo ao longo do tempo o incremento de seus teores em águas subterrâneas e aumentando os riscos potenciais à saúde humana (Bertol et al., 2005). Como os nitratos possuem carga negativa, eles não são atraídos pelas partículas do solo, ou seja, não são adsorvidos.
Já o fósforo é um elemento químico muito raro na natureza, quando comparado com as suas exigências por plantas terrestres e aquáticos (Correll et al., 1999; Anghinoni, 2007). Devido a isso, P é eficientemente retomado em biomassa e assim desempenha um papel fundamental no controlo da produtividade dos ecossistemas (Mahler et al., 2008). Interações de P com minerais do solo e estabilizado da matéria orgânica, levam a P relacionado com complexos organo-mineral resistentes à hidrólise, e, portanto, a persistência a longo prazo das P orgânica em solos (Sharpley et al., 1986; Syversen et al., 2005; Snyder et al., 2009). Esta dinâmica mais lenta é regulada por meio de processos de imobilização-mineralização, que ocorre através da adsorção específica aniónico, que pode facilitar o escoamento deste anião (Uusitalo and Jansson, 2002; Schröder et al., 2004)
Diversos estudos em gestão de ecossistemas agrícolas têm apontado para os possíveis benefícios de zonas-tampão no controle do transporte de poluentes difusos (Dillaha et al., 1989; Ahola, 1990; Syversen, 2002; Syversen, 2005; Syversen & Borch, 2005; Hefting et al., 2005, Stutter et al., 2009), contribuindo na melhoria da qualidade de rios em regiões com pequenas áreas agrícolas, além de aumentar a biodiversidade das paisagens rurais e reduzir a erosão (Jenssen et al, 1994; Dennis et al, 1994; Daniels e Gilliam, 1996; Ribaudo et al., 2001; Turner and Rabalais, 2003; Schröder et al., 2004; Grismer et al.,