Universidade de Trás-os-Montes e Alto Douro
ESTUDO DA INFEÇÃO POR TOXOPLASMA GONDII EM
ASININOS DE PORTUGAL
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA
VETERINÁRIA
CATARINA FERNANDES PEREIRA
Orientadora: Prof. Doutora Ana Patrícia Antunes Lopes
Coorientador: Prof. Doutor Sérgio Eduardo Ramalho de Sousa
i
Declaração de responsabilidade pessoal das ideias apresentadas
Nome: Catarina Fernandes Pereira
Endereço eletrónico: catarinafpereira@sapo.pt
Designação do mestrado: Mestrado Integrado em Medicina Veterinária Titulo: Estudo da infeção por Toxoplasma gondii em asininos de portugal Orientadora: Prof. Doutora Ana Patrícia Antunes Lopes
Coorientador: Prof. Doutor Sérgio Eduardo Ramalho de Sousa Ano de conclusão 2016
Declaro que todos os procedimentos neste estudo foram executados de acordo com a legistação portuguesa da proteção e do bem-estar animal (Decreto-lei nº 113/2013) e que esta dissertação de mestrado é resultado da minha própria pesquisa e trabalho pessoal e das orientações dos meus supervisores. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição.
iii
Agradecimentos
Agradeço ao Magnífico Reitor, e à Direção de Curso do Mestrado Integrado em Medicina Veterinária pelo trabalho que desenvolveram pelo curso, pela sua capacidade de inovar ouvindo e cooperando com os alunos. Agradeço toda essa cooperação ao longo dos últimos anos.
Agradeço toda a orientação e paciência da Professora Doutora Ana Patrícia Lopes assim como do Professor Doutor Sérgio Sousa.
Agradeço ao Professor Doutor Luís Cardoso pela ajuda prestada na análise estatística, mas também pela orientação e disponibilidade que prestou ao longo do curso.
Tenho de agradecer ao Doutor Miguel Quaresma pela sua contribuição para este trabalho com as recolhas de sangue que fez na Ilha Terceira mas quero também agradecer a simpatia e a amizade ao longo do curso e pela sua prontidão constante em ajudar e ensinar.
Tenho de agradecer à Dra. Sara Farrajota Mora pela contribuição para este estudo ajudando a fazer as recolhas no sul do país e facilitando o contacto com proprietários. Mas mais do que isso quero agradecer-lhe a fantástica amizade ao longo do curso, a disponibilidade em ajudar em todas as alturas de necessidade e também todo o conhecimento e confiança que me transmitiu. Quero também agradecer ao Luiz Fernando Junior por toda a simpatia e pelo acolhimento.
Tenho de agradecer ao Dr. Nuno Bernardes pela sua contribuição para este estudo ajudando a aumentar o número de amostras e facilitando a comunicação com proprietários. Mas mais do que isso quero agradecer a sua amizada e tudo o que me ensinou dentro e fora da veterinária. Agradecer o seu apoio, que em horas menos felizes foi crucial. Agradecer a ele mas também a toda a equipa do Centro Veterinário do Estuário do Tejo pela simpatia, acolhimento, apoio prestado e por tudo o que me ensinaram.
Agradeço também à equipa da AEPGA pela simpatia e acolhimento. Agradeço a todos os que se prontificaram a ajudar este estudo, em especial à AEPGA, ao Paulo Lero, à Associação Orelhas Sem Fronteiras, ao Burro Ville, à quinta pedagógica Lura, à Reserva de Burros, aos Amigos Orelhudos de Alcochete, à fundação Salinas do Samouco e também à exploração Asinus Atlanticus.
Agradeço ao meu pai e ao meu irmão. Agradeço à casa dos Mortos Bruxas e Outras Criaturas. Por último agradeço ao Bar 4 e ao Mavy por toda a paciência, cooperação, café e internet.
v
Resumo
O protozoário Toxoplasma gondii é um parasita intracelular obrigatório com distribuição mundial. Tem apenas felídeos, domésticos ou silváticos, como hospedeiros definitivos mas é capaz de infetar animais homeotérmicos incluindo aves e humanos.
A população de burros (Equus asinus) domésticos nos países desenvolvidos tem vindo a diminuir devido à mecanização da agricultura. Atualmente em Portugal o burro tem importância sócio económica em diferentes áreas.
O presente estudo consistiu no rastreio serológico da infeção por Toxoplasma gondii em burros de Portugal, utilizando o teste de aglutinação modificado (“modified agglutination test” – MAT). No total, 203 animais foram amostrados, dos quais 14 (6,9%) obtiveram resultados positivos.
De modo a a caracterizar a amostra foi realizado um inquérito que permitiu o registo de 18 variáveis independentes: classificação climática do distrito de proveniência do animal, género, estado reprodutivo das fêmeas, idade, raça, realização de atividades de trabalho, atividades em que participavam, tipo de alojamento e interação com outros animais (gatos, cães, outros burros, cavalos, muares, bovinos, caprinos, ovinos, aves de capoeira, fauna silática e roedores). O convívio com cães foi identificado como um fator de proteção (p = 0,033), com 17,2% de prevalência nos animais que não conviviam com cães e 5,2% nos animais que conviviam. A análise estatística das restantes variáveis não revelou resultados significativos.
Até ao momento de redação desta dissertação este é considerado o primeiro estudo sobre a prevalência de anticorpos para Toxoplasma gondii em asininos de Portugal, sendo um trabalho de extrema importância onde se pretende obter níveis de seroprevalência de infeção em Portugal numa espécie pouco estudada a nível mundial.
vii
Abstract
Toxoplasma gondii is an obligat intracellular protozoan with worldwide distribution. This parasite's definitive hosts are cats and other felidae but it can infect all homeothermic animals including birds and humans.
The population of domestic donkey (Equus asinus) in developed countries has been declining due to the agricultural mechanization. Currently in Portugal, the donkey has economic levereg in different fields.
The present study consisted in the serological screening of Toxoplasma gondii infection in donkey from Portugal using the modified agglutination test (MAT). In total, 203 animals were sampled out of which 14 (6.9%) were positive.
In order to characterize the samples a survey was performed allowing the record of 18 independent variables: climate classification of the district of origin, gender, in the case of females pregnancy or not, age, breed, performance of work activites, activities in which the donkeys participated, type of housing and interation with other animal species (cats, dogs, other donkeys, horses, mules, cattle, goats, sheep, poultry, wildlife and rodents). The interaction with dogs was identified as a protective factor (p = 0.033), with 17.2% of prevalence in donkeys that didn't coexisted with dogs and 5.2% in donkeys that interact with domestic canids. The other independent variables Statistical analysis of the remaining variables revealed no significant results.
Untill the redaction of this dissertation this is consider the first study on the prevalence of antibodies to Toxoplasma gondii in donkeys from Portugal. This is an extremely important work that alows us to know the prevalence of infection of this parasite in Portugal in a specie understudied in the world.
ix
Índice geral
Agradecimentos ... iii
Resumo ... v
Abstract ... vii
Lista de Figuras ... xiii
Lista de Gráficos ... xv
Lista de Tabelas ... xvii
Lista de siglas abreviaturas ... xix
1 Introdução geral ... 1
CAPÍTULO I - REVISÃO DA LITERATURA CIENTIFICA ... 3
1 O burro doméstico ... 3
1.1 Origem do burro doméstico ... 3
1.2 Efetivo asinino doméstico mundial ... 4
1.3 Efetivo asinino em Portugal ... 4
1.4 O burro como animal de produção ... 5
1.4.1 No mundo ... 5
1.4.2 Em Portugal ... 6
2 O protozoário Toxoplasma gondii ... 7
2.1 Formas parasitárias... 7
2.1.1 Taquizoíto ... 7
2.1.2 Bradizoíto e quistos tecidulares ... 8
2.1.3 Esporozoíto ...10 2.2 Ciclo biológico ...11 2.2.1 Transmissão ...11 2.2.1.1 Oocistos esporulados ……….12 2.2.1.2 Quistos tecidulares………..12 2.2.1.3 Taquizoítos………...12 2.2.2 Fase extraintestinal ...13 2.2.3 Fase enteroepitelial ...14
2.2.4 Excreção e esporulação de oocistos ...15
2.3 Patogenia e respostas imunitárias ...15
2.4 Variabilidade genética ...17
3 Diagnóstico laboratorial ...18
3.1 Deteção do agente ...18
x
4 A infeção por T. gondii no gato ...21
4.1 Sinais clínicos e lesões ...22
5 A infeção por T. gondii em cavalos ...23
5.1 Sinais clínicos e lesões ...26
6 A infeção por T. gondii em burros ...26
6.1 Sinais clínicos e lesões ...27
7 A infeção por T. gondii em cães ...28
7.1 Sinais clínicos e lesões ...29
8 A infeção por T. gondii em suínos ...29
8.1 Sinais clínicos e lesões ...31
9 A infeção por T. gondii em pequenos ruminantes ...31
9.1 Sinais clínicos e lesões ...34
10 A infeção por T. gondii em bovinos ...35
10.1 Sinais clínicos e lesões ...36
11 A infeção por T. gondii em galinhas ...36
11.1 Sinais clínicos e lesões ...37
12 A infeção por T. gondii em animais silváticos ...37
12.1 Sinais clínicos e lesões ...40
13 A infeção por T. gondii no homem ...40
13.1 Sintomas e lesões ...44
14 Tratamento ...45
15 Prevenção e controlo ...45
15.1 Medidas gerais aplicadas a animais ...45
15.2 Medidas gerais aplicadas aos seres humanos ...47
15.3 Vacinação ...48
CAPÍTULO II – COMPONENTE PRÁTICA ...51
1 Introdução ...51
2 Objetivos ...53
3 Material e métodos ...55
3.1 Animais e amostras ...55
3.2 Teste de aglutinação modificado ...56
3.2.1 Material e equipamento ...57
3.2.2 Metodologia laboratorial ...58
3.2.3 Leitura e interpretação dos resultados ...61
xi
4 Resultados ...65
4.1 Distribuição dos animais ...65
4.2 Seroprevalência ...78
5 Discussão ...89
6 Conclusão ...97
Bibliografia ...99
ANEXO I – Panfleto informativo sobre a toxoplasmose e o burro ... 125
xiii
Lista de Figuras
Figura 1: Ilustração de um taquizoíto de T. gondii com destaque para o complexo apical no interior do círculo. ... 8 Figura 2: Ilustração de um quisto tecidular contendo bradizoítos de T. gondii em tecido nervoso. ... 9 Figura 3: Ilustração de um bradizoíto de T. gondii com sobreposição de representação esquemática do citoesqueleto na zona apical. ...10 Figura 4: Ilustração de um oocisto esporulado de T. gondii, com 2 esporocistos, cada um com 4 esporozoítos. ...11 Figura 5: [A] Burro de raça Asininisa de Miranda preso pronto para recolha; [B] Tubo seco (esquerda) e Eppendorf® (direira). ...55 Figura 6: Reagentes constituintes do quite no teste comercial Toxo-Screen DA® (bioMérieux, Lyon, França). Fonte original. ...56 Figura 7: Placa de diluição com fundo em “U” com imagem de perfil de um poço no canto superior direito. ...57 Figura 8: Pipetas de pontas descartáveis: pipeta multicanal à esquerda com as respetivas pontas (amarelo). Pipetas monocanal para pipetar diferentes quantidades, no centro e à direira, com as respetivas pontas no canto inferior direito. ...58 Figura 9: Frasco de vidro com 2-ME reconstituído e envolido com papel de prata, para proteger o reagende da luz. ...59 Figura 10: [A] Câmara de fluxo laminar: colocação do antigénio no teste; [B] Placa de microtitulaçao com identificação dos diferentes poços; [C] Agitador de placas. ...60 Figura 11: Espelho de aumento para auxiliar a leitura. ...61 Figura 12: [A] Resultados positivos onde a aglutinação é visível pela formação de um véu que cobre o fundo do poço de uma forma homogénea; [B] Resultados negativos onde é visível a deposição de antigénio; [C] Resultados negativos que apresentam deposição do antigénio em anel com diâmetro inferior a metade do diâmetro do poço. [D] Resultados que poderão apresentar dificuldades de interpretação. Presença de aglutinação em pelo menos metade do diâmetro do poço revelando resultados positivos...62 Figura 13: Controlos positivo (+), negativo (-) e do antigénio (AG). ...62 Figura 14: Mapa de Portugal onde se encontram assinalados os locais onde foram efetuadas as recolhas. ...65 Figura 15: Mapa com as marcações de acordo com a classificação climática de Koppen-Geiger. ...66
xv
Lista de Gráficos
Gráfico 1: Número de asininos em Portugal entre 1972 e 2014 segundo a FAOSTAT, (2016)
... 4
Gráfico 2: Distribuição regional do efetivo de asininos e muares de Portugal em 2009, segundo os dados do INE (20101 animais). ... 5
Gráfico 3: Distribuição dos asininos incluídos no estudo de acordo com o distrito de proveniência (n=203). ...66
Gráfico 4: Distribuição dos asininos em estudo de acordo com a classificação climática da sua proveniência geográfica utilizando a classificação de Koppen-Geiger. ...67
Gráfico 5: Distribuição dos asininos em estudo de acordo com o género ...67
Gráfico 6: Distribuição dos asininos fêmeas de acordo com o estado reprodutivo...68
Gráfico 7: Distribuição dos animais incluídos no estudo de acordo com o grupo etário. ...68
Gráfico 8: Distribuição dos animais em estudo por género e grupo etário (n = 3). ...69
Gráfico 9: Distribuição dos animais em estudo de acordo com a raça. RA: raça Andaluz; RAM: raça Asinina de Miranda. ...69
Gráfico 10: Distribuição dos animais em estudo de acordo com a atividade realizada. ...70
Gráfico 11: Distribuição dos animais em estudo de acordo com o tipo de alojamento. ...71
Gráfico 12: Distribuição dos asininos em estudo de acordo com o contacto com gatos. ...71
Gráfico 13: Distribuição dos asininos em estudo de acordo com o contacto com cães ...72
Gráfico 14: Distribuição dos asininos em estudo de acordo com o contacto com outros burros. ...72
Gráfico 15: Distribuição dos asininos em estudo de acordo com o contacto com cavalos ....73
Gráfico 16: Distribuição dos asininos em estudo de acordo com o contacto com muares ....73
Gráfico 17: Distribuição dos asininos em estudo de acordo com o contacto com ovinos. ...74
Gráfico 18: Distribuição dos asininos em estudo de acordo com o contacto com caprinos ...74
Gráfico 19 - Distribuição dos asininos em estudo de acordo com o contacto com bovinos ...75
Gráfico 20: Distribuição dos asininos em estudo de acordo com o contacto com aves de capoeira ...75
Gráfico 21: Distribuição dos asininos em estudo de acordo com o contacto com fauna silvática ...76
Gráfico 22: Distribuição dos asininos em estudo de acordo com o contacto com roedores ..76
Gráfico 23: Distribuição dos asininos em estudo de acordo com o seu estado de saúde ...77
Gráfico 24: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com sua proveniência geográfica ...78
Gráfico 25: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo a classificação climática do seu distrito de proveniência (p=0,869). ...79
xvi Gráfico 26: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo o género (p=0,774) e o estado reprodutivo de fêmeas (p=0,075). ...79 Gráfico 27: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo o grupo etário (n=2) (p=0,077)...80 Gráfico 28: Prevalência de anticorpos para T. gondii em fêmeas e machos de diferentes grupos etários. ...80 Gráfico 29: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com a raça. ...81 Gráfico 30: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com a utilização em atividades tipo trabalho (p=0,268). ...81 Gráfico 31: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com as diferentes atividades de trabalho. ...82 Gráfico 32: Prevalência de anticorpos para T. gondii de acordo com o alojamento. ...82 Gráfico 33: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com o contacto com carnívoros domésticos: gatos (p=0,207) e cães (p=0,033) ...84 Gráfico 34: Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com o contacto com equídeos: cavalos (p=0,685), outros burros (p=0,120) e muares (p=0,619) .85 Gráfico 35 - Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com o contacto com ruminantes domésticos: bovinos (p=0,109), caprinos (p=0,554) e ovinos (p=0,121) ...85 Gráfico 36 - Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com o contacto com com aves de capoeira (p=0,249), fauna silvática (p=0,581) e roedores (p=0,076) ...86 Gráfico 37 - Prevalência de anticorpos para T. gondii nos asininos em estudo de acordo com o estado de saúde do animal...87
xvii
Lista de Tabelas
Tabela 1: Seroprevalência de infeção por Toxoplasma gondii em gatos ...22
Tabela 2: Seroprevalência de infeção por Toxoplasma gondii em cavalos. ...24
Tabela 3: Seroprevalência de infeção por Toxoplasma gondii em asininos. ...27
Tabela 4: Seroprevalência de infeção por Toxoplasma gondii em cães ...28
Tabela 5: Seroprevalência de infeção por Toxoplasma gondii em suínos ...30
Tabela 6: Seroprevalência de infeção por Toxoplasma gondii em pequenos ruminantes ...32
Tabela 7: Seroprevalência de infeção por Toxoplasma gondii em bovinos ...35
Tabela 8: Seroprevalência de infeção por Toxoplasma gondii em galinhas. ...36
Tabela 9: Seroprevalência de infeção por Toxoplasma gondii em animais silváticos ...38
Tabela 10: Seroprevalência de infeção por Toxoplasma gondii em seres humanos. ...42
Tabela 11: Prevalência de anticorpos para Toxoplasma gondii em asininos de acordo com as variáveis independentes classificação climática do distrito de proveniência, género, idade, estado reprodutivo das fêmeas, raça, atividades e tipo de alojamento. ...83
Tabela 12: Prevalência de anticorpos para Toxoplasma gondii em asininos de acordo com o convívio com outras espécies. ...88
xix
Lista de siglas abreviaturas
2-ME 2-mercaptoetanol Ac Anticorpo
AEPGA Associação de estudo e proteção do gado asinino Ag Antigénio Am Amazonas B Barcelona BCG Bacillus Calmette-Guérin C Centro Cat. Catalunha
CMIA "Chemiluminescent microparticle immunoassay" (imunoensaio de quimioluminescência)
DT “Dye Test” (teste de lise de Sabin e Feldman)
ELISA "Enzyme-linked immunosorbent assay” (ensaio imunoenzimático) Ext. Extremadura
FAO “Food and Agriculture Organization” (Organização das Nações Unidas para Alimentação e Agricultura)
FeLV "Feline leukemia virus" (vírus da leucemia felina)
FIV "Feline immunodeficiency virus" (vírus da imunodeficiência felina) G Mulher gestante
GALT “Gut-associated lymphoid tissue” (tecido linfoide associado ao intestino) IF Mulher em idade fértil
IFAT “Indirec fluorescence antybody test” (teste de imunofluorescência indireta) Ig Imunoglobulina
IHQ Imuno-histoquímica
IHT “Indirect hemogalutination test” (teste de hemaglutinação indireta) IL Interleucina
INE Instituto Nacional de Estatística L Lisboa
LAT “Latex aglutination test” (teste de aglutinação em latex) M Região autónoma da Madeira
MAT “Modified agglutination test” (teste de aglutinação modificado) MICs Micronemas
xx
N Norte
NE Nordeste
NR Não referido no artigo
OD “Optical density” (densidade óptica) OMS Organização Mundial de Saúde P População geral
p Valor de probabilidade
PAS “Periodic acid–Schiff” (ácido periódico de Schiff)
PBS “Phosphate buffered solution” (solução de tampão fosfato) PCR “Polymerase chain reaction” (reação em cadeia da polimerase) Rec. Recife
Rio. Rio de Janeiro
S Sul
SI Sistema imunitário Sic. Sicília
SIDA Síndrome da imunodeficiência adquirida Val. Valência
1
1 Introdução geral
O protozoário Toxoplasma gondii é um parasita intracelular obrigatório com distribuição mundial capaz de infetar animais homeotérmicos incluindo aves e humanos tendo apenas felídeos, domésticos ou silváticos, como hospedeiros definitivos. Este protozoário é considerado o modelo dos parasitas pertencentes ao filo Apicopmplexa. Os protocolos de manipulação deste parasita estão bem definidos e a sua genética bem estudada assim como a sua proliferação em tecidos in vivo e in vitro. Tudo isto torna esta espécie um bom modelo de estudo laboratorial (Kim e Weiss, 2004; Weiss e Kim, 2011).
T. gondii é um agente patogénico oportunista que causa doença em pacientes imunodeprimidos e em individuos com infeção congénita, podendo também manifestar-se em pacientes imunocompetentes de forma mais ou menos severa. Surtos da doença podem estar relacionados com água ou alimentos contaminados. O quadro clínico é inespecífico sendo importante conhecer o protozoário e os fatores de risco associados a cada espécie de modo a incluir, ou não, o parasita nos diagnósticos diferenciais. Nos pequenos ruminantes, sobretudo ovinos, T. gondii é responsável por perdas económicas devido a abortos epizoóticos, mas perdas reprodutivas podem ocorrer noutras espécies (Davidson, 2000; Dubey, 2010).
Por se tratar de um agente zoonótico este protozoário apresenta riscos para a saúde pública. É um importante papel do médico veterinário, na clínica de animais de companhia ou no ramo da produção animal, informar corretamente os proprietários sobre as medidas profiláticas de modo a evitar a infeção dos animais e dos humanos dando especial atenção aos grupos de risco (Davidson, 2000; Tenter et al., 2000).
O burro doméstico (Equus asinus) é um equídeo com grande capacidade de adaptação a condições adversas. A população de burros domésticos nos países desenvolvidos tem vindo a diminuir devido à mecanização da agricultura. Atualmente, o burro tem importância sócio económica em diferentes áreas, e em alguns países a sua carne destina-se ao consumo humano ou animal (Yang et al., 2013; de Oliveira et al., 2013; Alvarado-Esquivel et al., 2015; Gennari et al., 2015). O leite de burra é utilizado na indústria cosmética devido às suas propriedades singulares, mas é também destinado à indústria alimentar, apontado como um leite de substituição para humanos, ou como complemento dietético devido às suas qualidades nutricionais (Tafaro et al., 2007; Monti et al., 2012; Machado, 2015).
Estudos sobre a infeção por T. gondii em asininos são escassos e pouco se sabe sobre a situação do parasita nesta espécie. Com este trabalho pretende-se realizar um estudo sobre a infeção por Toxoplama gondii em asininos de Portugal. Para o efeito foram recolhidas amostras de sangue em diferentes zonas de Portugal. As recolhas foram
2 maioritariamente realizadas no período do estágio curricular. O estágio curricular dividiu-se em duas fases: de 15 de setembro a 30 de novembro de 2015 foi feito o acompanhamento do serviço ambulatório da Dra. Sara Mora centrado em Loulé, com acompanhamento da atividade clinica médico-veterinária de pequenos animais, equídeos e outras espécies. Este período incluiu uma viagem à Dinamarca no acompanhamento das atividades clinicas em equinos. A segunda fase de estágio foi realizada entre 1 de dezembro de 2015 e 28 de fevereiro de 2016, com a Associação para o Estudo e Proteção do Gado Asinino (AEPGA) sedeada em Miranda do Douro. Este estágio incluiu principalmente o acompanhamento de atividades clinicas e zootécnicas relativas ao gado asinino.
3
CAPÍTULO I - REVISÃO DA LITERATURA CIENTIFICA
1 O burro doméstico
O burro doméstico (Equus africanus asinus) é um equídeo com uma grande capacidade de adaptação a condições adversas, necessitando de alimentos ricos em fibra, energeticamente mais pobres do que o cavalo. Os asininos sobrevivem em situações inóspitas como regiões desertas ou montanhosas e têm conseguido o seu lugar em países desenvolvidos e em desenvolvimento (Wood et al., 2007).
1.1 Origem do burro doméstico
O burro é um membro da família Equidae, género Equus, espécie E. africanus asinus. É descendente do já extinto género Hyracotherium, oriundo da América do Norte, que viveu durante o Eoceno, há cerca de 55 milhões de anos. A análise filogenética mostra que o burro se separou do cavalo há cerca de 7,7 a 15,4 milhões de anos (Huang et al., 2015).
As primeiras ossadas de burros domesticados possuem cerca de 5000 anos e foram encontradas sepultadas no Egipto sugerindo que o burro foi domesticado há cerca de 5000 a 6000 anos, provavelmente no norte de África (Rossel et al., 2008). É possível que a sua domesticação tenha ocorrido em vários momentos (Aranguren-Méndez et al., 2001; Rossel et al., 2008; Marshall et al., 2014) e que a desertificação do Sahara, há cerca de 6000 anos, seja uma das causas da sua domesticação (Beja-Pereira et al., 2004; Rossel et al., 2008).
Sabe-se que duas populações de burros selvagens africanos estarão na origem do burro doméstico: Equus africanus africanus (burro selvagem da Núbia) e Equus africanus somaliensis (burro selvagem da Somália) (Beja-Pereira et al., 2004). Estudos recentes do ADN mitocondrial separaram os asininos domésticos modernos em dois ramos filogenéticos designados de Clades: o Clade 1 com origem mais provável no burro selvagem da Núbia e o Clade 2 com origem desconhecida. Suspeita-se que os ancestrais deste último possam ser parentes próximos extintos do burro selvagem da Somália e que estes animais possam ter influências genéticas do já extinto Equus africanus “atlanticus” (burro selvagem do Atlas) (Kimura et al., 2011).
Teorias filogenéticas separam os asininos domésticos em dois troncos ou linhagens (Houck et al., 1998). Equus asinus africanus, convencionado como o burro doméstico africano, que se desenvolveu na bacia do Nilo e deu origem a raças com aptidão de trabalho utilizadas em carga e transporte e estará na origem da raça Andaluz, do sul de Espanha. Equus asinus europeu, originário da bacia mediterrânica, é a subespécie que terá dado
4 origem às raças mediterrânicas de pelagem escura e ar mais pesado (Aranguren-Méndez et al., 2001, 2002).
1.2 Efetivo asinino doméstico mundial
A população de asininos tem crescido a nível mundial e a maior parte do efetivo concentra-se principalmente em países em desenvolvimento. Em 2014, o continente africano possuía 46% do efetivo (cerca de 44127429 asininos), 16% desse efetivo concentrado no Egito. O continente asiático detinha 37% e o continente americano 15% do efetivo mundial, sendo que cerca de 48% desses asininos se encontram concentrados no México (FAOSTAT, 2016).
Na Europa, a população de asininos diminuiu de 4,3% em 1980 para 1,6% em 2014. Muitas raças autóctones europeias, principalmente mediterrânicas, estão atualmente em vias de extinção. A estimativa da Organização das Nações Unidas para Alimentação e Agricultura (“The Food and Agriculture Organization” - FAO), relativamente à população de asininos na Europa, pode estar subestimada uma vez que a Inglaterra não se encontra representada e na Bélgica apenas se encontram referidos dois animais (Pearson et al., 2000;Barbosa, 2003; Machacova et al., 2014; Quaresma, 2015; FAOSTAT, 2016).
1.3 Efetivo asinino em Portugal
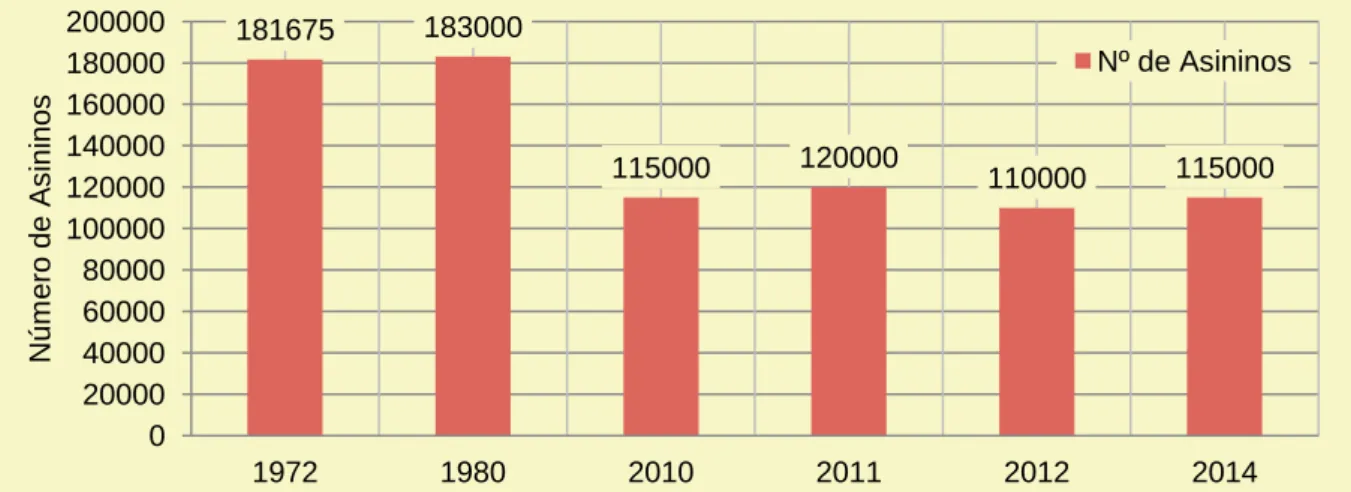
Em Portugal, todos os asininos são domésticos e, de ano para ano, o seu número tem vindo a diminuir. A industrialização da agricultura e o êxodo rural, entre outros fatores económicos e sociais, foram os principais apontados para esta quebra de efetivo na Europa e em Portugal (Aranguren-Méndez et al., 2001; Barbosa, 2003). O número estimado pela FAO de asininos em Portugal é superior ao do INE (Instituto Nacional de Estatística) mas, tal como o INE, apresenta uma tendência decrescente ao longo dos anos (Gráfico 1) (INE, 2011; FAOSTAT, 2016).
Gráfico 1: Número de asininos em Portugal entre 1972 e 2014 segundo a FAOSTAT, (2016). 181675 183000 115000 120000 110000 115000 0 20000 40000 60000 80000 100000 120000 140000 160000 180000 200000 1972 1980 2010 2011 2012 2014 Núm ero de A s ini no s Nº de Asininos
5 Segundo o último censo agrícola realizado pelo INE em 2009, o número de asininos e muares do nosso país diminuiu cerca de 60% entre 1999 e 2009 chegando aos 20 101 animais. A distribuição do efetivo asinino em Portugal pode apenas ser extrapolada pois asininos e muares forma analisados em conjunto. Estes animais concentram-se principalmente na região de Trás-os-Montes (57%). A Beira Interior é o segundo ponto do país com maior número de asininos e muares, com 19% do efetivo nacional. Segundo o INE existe uma discrepância acentuada na distribuição do efetivo equídeo não equino nacional que pode ser consultada no Gráfico 2 (INE, 2011).
Em Portugal estão reconhecidas duas raças autóctones de asininos domésticos, ambas em risco elevado de erosão genética (Portaria n.º 268/2015 - anexo IV). O Burro da Graciosa e a Raça Asinina de Miranda, cujo solar é o planalto mirandês, na região de Trás-os-Montes, tem características da linhagem europeia (Quaresma et al., 2005; Quaresma, 2015).
Gráfico 2: Distribuição regional do efetivo de asininos e muares de Portugal em 2009, segundo os dados do INE (20101 animais).
1.4 O burro como animal de produção
1.4.1 No mundoO burro tem um papel crucial no desenvolvimento agrícola de países em desenvolvimento, principalmente em países de clima quente, pela sua forte resistência à desidratação (Mason, 1996). É utilizado no transporte de pessoas e mercadorias, trabalhos de tração e trabalhos agrícolas (Mason, 1996; Mengjie e Yi, 1996; Pearson et al., 2000). Em alguns países como a China e o México, o burro é também utilizado para produção de carne, seja para consumo humano ou destinada a alimento de animais (Yang et al., 2013; Alvarado-Esquivel et al., 2015). Na China, a população de burros tem vindo a decrescer
3% 57% 6% 19% 3% 5% 4% 3% 0%
Entre Douro e Minho Trás-os-Montes Beira Litoral Beira Interior Ribatejo e Oeste Alentejo Algarve Açores Madeira
6 deste 1996, no entanto, existe procura de burros para produção de leite, carne e pelo (Xie et al., 2015; FAOSTAT, 2016).
Na Europa, para recuperar as raças quase extintas, medidas socioeconómicas foram tomadas e houve o esforço, por parte dos criadores e associações, para encontrar novas utilidades para os animais. Impulsionado pela necessidade de ser útil à sociedade europeia, o burro tornou-se animal de companhia, utilizado em terapias variadas e uma mais-valia no mercado crescente do ecoturismo (Malho, 2016). Na Europa, por exemplo em Itália, houve também espaço para a produção de carne de burro e leite para consumo humano (Machacova et al., 2014). Bioquimicamente semelhante ao leite humano e com propriedades hipoalérgicas, o leite de burra está indicado em crianças com alergia ao leite de vaca e em pessoas com problemas alérgicos ou inflamatórios, assim como a utilização como suplemento dietético em idosos imunodeprimidos, pois estimula a produção de mediadores inflamatórios (Monti et al., 2012; Jirillo e Magrone, 2014; Vincenzetti et al., 2014). Parece ainda haver vantagens na sua utilização no combate a neoplasias e na prevenção de doenças como a arteriosclerose (Tafaro et al., 2007).
1.4.2 Em Portugal
Antes da industrialização, o burro era utilizado para trabalhos no campo e transporte de mercadorias e pessoas. Foi também utilizado para proteger o gado de ataques de lobos e cães selvagens (Samões et al., 2000; Barbosa, 2003). O leite de burra era utilizado como alimento e adicionado a cataplasmas para efeitos de cicatrização (Samões et al., 2000).
No Nordeste Transmontano, o burro ainda é utilizado em alguns trabalhos agrícolas e em transporte de pessoas para acompanhar o gado ou para outro tipo de deslocações curtas. Nesta região, o burro surge também associado a uma população mais idosa e são tratados como animais de companhia sendo utilizados, ocasionalmente, em pequenas deslocações (Barbosa, 2003).
Os burros são utilizados em centros de ecoturismo, ou turismo rural em passeios e para promover mensagens relacionadas com biodiversidade e o cuidado a ter com os animais de modo a valorizar a biodiversidade local (Russo, 2015; Malho, 2016). A asinoterapia também é praticada em Portugal, onde os animais são utilizados como instrumento de estimulação cognitiva, física, motora e emocional com pessoas portadoras de vários tipos de deficiência ou problemas psicológicos (Malho, 2016).
Em Portugal também se produz leite de burra, embora nenhum dos casos conhecidos seja destinado ao consumo humano direto. O leite, pelas suas propriedades excecionais, é utilizado para fazer sabonetes, ou exportado liofilizado para ser utilizado na indústria cosmética (Machado, 2015).
7
2 O protozoário Toxoplasma gondii
Toxoplasma gondii é um protozoário parasita capaz de infetar a maioria dos animais homeotérmicos tendo apenas felídeos, domésticos ou silváticos, como hospedeiros definitivos (Dubey, 2010). Este parasita pertence ao filo Apicomplexa, classe Sporozoasida, sub-classe Coccidiasina, ordem Eimeriorina, família Toxoplasmatidae e género Toxoplasma (Gardiner et al., 1998). Atualmente T. gondii é a única espécie reconhecida (Dubey, 2010). Foi descoberto em 1908 por Charles Nicolle e Louis Manceaux num roedor do norte de África, denominado Ctenodactylus gundi e simultaneamente no Brasil, pelo italiano Alfonso Splendore que também descreveu as formas do parasita num coelho. O nome Toxoplasma foi proposto por Nicolle e Manceaux devido à forma do parasita (do Latim toxon: arco;
plasma: forma). O termo “gondii” parece ser o resultado de uma confusão ortográfica do
nome do hospedeiro original C. gundi (Ferguson, 2009).
2.1 Formas parasitárias
Ao longo do seu ciclo de vida T. gondii possui três formas infetantes: o taquizoíto, o bradizoíto e o esporozoíto. Estas formas, distintas entre si, estão adaptadas ao meio onde se desenvolvem e à função que têm a desempenhar para o correto desenrolar do ciclo de vida do parasita.
2.1.1 Taquizoíto
O taquizoíto é responsável pela fase aguda da infeção caracterizada por uma multiplicação rápida assexuada (do grego takhýs, rápido). Foi a primeira forma do parasita a ser observada e reconhecida em 1908 e é a forma infetante mais estudada por ser fácil de manter em culturas in vitro (Dubey, 2010). Mede cerca 2 por 6 µm e possui forma de meia-lua mantida por um citoesqueleto composto por dois anéis apicais, a conoide, dois anéis polares, dois microtúbulos intraconoidais e vinte e dois microtúbulos subpeliculares (Figura 1) (Dubey, 2010; Weiss e Kim, 2011). O taquizoíto desloca-se sem o auxílio de flagelos ou cílios, deslizando com o auxílio de um “motor” de actina-miosina.
Este estádio possui vários organelos. As roptrias, organelos secretores em forma de bastão que se estendem desde o interior da conoide em direção ao núcleo, participam na fase de penetração na célula hospedeira secretando o seu conteúdo, mas a sua função ainda não foi completamente esclarecida. Os micronemas são organelos redondos localizados na zona apical do parasita, posteriores à conoide. Os grânulos densos são estruturas igualmente esféricas que se encontram na porção posterior do parasita. Ambas
8 estas estruturas são facilmente percetíveis em imagens de microscopia eletrónica por serem electrodensas (Cérède et al., 2005; Lappin, 2006a; Dubey, 2010; Weiss e Kim, 2011). O apicoplasto é um plastídeo sem capacidade fotossintética com origem numa alga, (Sadovskaia e Selivestrov, 2009) é delimitado por quatro membranas, apresentando um conteúdo granular e filamentoso e alguns ribossomas. Este organelo é característico dos organismos pertencentes ao filo Apicomplexa com exceção do género Cryptosporidium (Dubey, 2010; Weiss e Kim, 2011).
Figura 1: Ilustração de um taquizoíto de T. gondii com destaque para o complexo apical no interior do círculo. Fonte original.
2.1.2 Bradizoíto e quistos tecidulares
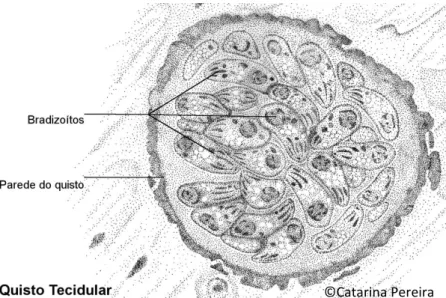
O bradizoíto é a forma latente do parasita com pouca ou nenhuma atividade que se encontra enquistada (do grego bradýs, lento). A designação de quistos tecidulares foi proposta em 1988 salvaguardando possíveis confusões com o termo “oocisto” (Dubey, 2010).
Os quistos variam em tamanho, podendo conter apenas dois ou centenas de bradizoítos, e em forma: em células musculares são alongados atingindo até 100 µm de
© Cata rin a Per eira
9 comprimento, no tecido cerebral têm forma esferoide até 70 µm de diâmetro (Figura 2). Apesar de poderem ocorrer em qualquer órgão ou tecido, os quistos possuem maior prevalência no tecido muscular esquelético e cardíaco, seguindo-se o tecido nervoso como cérebro e globo ocular (Gardiner et al., 1998;Kim e Weiss, 2004; Dubey, 2010).
Figura 2: Ilustração de um quisto tecidular contendo bradizoítos de T. gondii em tecido nervoso. Fonte original.
O bradizoíto está sujeito a longos períodos de inatividade e por isso os organelos variam em aspeto e número conforme a idade do parasita. Bradizoítos mais jovens apresentam um número menor de organelos e têm um aspeto mais arredondado; em quistos mais velhos podem mesmo apresentar um aspeto degenerado (Dubey, 2010). Os quistos têm uma parede elástica irregular com menos de 0,5 µm de espessura. A parede é percetível em microscopia ótica por reagir de forma ligeiramente mais intensa que os bradizoítos à coloração com ácido periódico de Schiff (“Periodic acid–Schiff”- PAS) (Dubey, 2010)
O bradizoíto é estruturalmente semelhante ao taquizoíto, com a mesma forma de meia-lua mas mais estreito. As suas dimensões variam entre diferentes bradizoítos podendo variar entre 5 e 8,5 µm de comprimento e 1 e 3 µm de largura. Nesta forma, o núcleo é mais posterior e as terminações das roptrias são preenchidas por material eletrodenso (Figura 3). Os bradizoítos possuem maior número de micronemas mas menos grânulos densos do que os taquizoítos (Kim e Weiss, 2004; Dubey, 2010). Apresentam ainda grânulos polissacáridos, que não existem nos taquizoítos. São estruturas apicais e basais ao núcleo, que albergam um hidrato de carbono bioquimicamente semelhante à amilopectina produzida por algas vermelhas. (Coppin et al., 2005) A função destes grânulos não é completamente conhecida, aparentam ser reservatórios de energia para suportar o período de latência ou
10 para permitir a reativação do parasita na transição de fases. Estes grânulos coram fortemente pelo PAS (Kim e Weiss, 2004; Dubey, 2010).
Figura 3: Ilustração de um bradizoíto de T. gondii com sobreposição de representação esquemática do citoesqueleto na zona apical. Fonte original.
2.1.3 Esporozoíto
O esporozoíto, a forma infetante que se encontra no interior de oocistos esporulados, tem forma de meia-lua, um núcleo basal e numerosos micronemas, grânulos densos e grânulos polissacáridos (Figura 4). Possui roptrias em elevado número com conteúdo de aparência labiríntica, semelhante aos taquizoítos. Esta forma infetante está adaptada para sobreviver em situações inóspitas por se encontrar no interior de oocistos (Dubey, 2010; Weiss e Kim, 2011).
11 Figura 4: Ilustração de um oocisto esporulado de T. gondii, com 2 esporocistos, cada um com 4 esporozoítos. Fonte original.
2.2 Ciclo biológico
A compreensão do ciclo de vida de T. gondii foi um marco importante que despoletou a compreensão e a descoberta de outros géneros de coccidias como Neospora.
T. gondii possui como hospedeiro definitivo os felídeos domésticos e silváticos. Os hospedeiros intermediários podem ser qualquer animal homeotérmico, incluindo os próprios felídeos (Dubey, 2010; Weiss e Kim, 2011; Dubey et al., 2014a).
2.2.1 Transmissão
T. gondii pode ser transmitido por via horizontal ou vertical (Dubey, 2010; Weiss e Kim, 2011). A transmissão galactófora também pode ocorrer (Dubey et al., 2014b).
Os hospedeiros podem ser infetados por qualquer uma das formas infetantes deste protozoário mas, nos felídeos, a infeção é mais eficiente quando a forma infetante é o bradizoíto (Dubey, 2001, 2006). As infeções são naturalmente condicionadas pelos padrões fisiológicos de cada espécie: os oocistos esporulados presentes no meio ambiente são a forma mais frequente de infeção em herbívoros, já os carnívoros têm maior probabilidade de se infetarem através da ingestão de quistos tecidulares presentes nos músculos e sistema nervoso das suas presas (Kijlstra e Jongert, 2009).
12
2.2.1.1 Oocistos esporulados
A ingestão de alimento ou água contaminados com oocistos esporulados é a principal via de infeção em várias espécies, principalmente herbívoros, incluindo asininos (Dubey, 2001; Kijlstra e Jongert, 2009; Boughattas et al., 2011; García-Bocanegra et al., 2012). Em nenhuma área geográfica estudada, a seroprevalência de anticorpos para T. gondii em populações de gatos foi negativa. Uma vez que a maioria dos gatos seroconvertem cerca de 3 semanas após a excreção de oocistos, a contaminação ambiental com oocistos assume-se elevada (Dubey, 2010). Associada a este fator está a capacidade do oocisto suportar condições ambientais adversas por longos períodos de tempo mantendo a viabilidade até 548 dias em fezes e resistindo aos desinfetantes convencionais (Dubey, 2010). Os oocistos podem ser disseminados mecanicamente através de invertebrados (Arkush et al., 2003; Lindsay et al., 2001, 2004) e vertebrados, podendo persistir no pelo dos animais (Frenkel et al., 2003) e sobreviver até dois anos em água do mar (Lindsay e Dubey, 2009).
2.2.1.2 Quistos tecidulares
A transmissão através dos bradizoítos ocorre por carnivorismo tendo pouco significado em herbívoros (Kijlstra e Jongert, 2009; Dubey, 2010) podendo ocorrer também através de órgãos transplantados (da Cunha et al., 1993; Dubey, 2010).
A ingestão de bradizoítos é a forma mais eficiente na infeção de gatos (Dubey, 2001, 2006), pois leva a um período pré-patente mais curto, entre 3 a 10 dias, do que nos gatos infetados com oocistos esporulados, onde este período pode ultrapassar os 18 dias (Dubey, 2001).
Os bradizoítos sobrevivem à refrigeração entre -4 e -6ºC, durante dois meses, e podem sobreviver vários dias após a morte do animal. Contudo perdem viabilidade a temperaturas iguais ou inferiores a -12ºC, durante 24 horas e iguais ou superiores a 67ºC, durante 3,5 minutos (Dubey, 2010).
2.2.1.3 Taquizoítos
O taquizoito é a forma infetante mais sensível, pois é incapaz de sobreviver fora do hospedeiro e é sensível a enzimas gástricas proteolíticas. A infeção por via oral com taquizoítos é pouco frequente, sendo mais frequente a infeção por via transplacentária. Ocorre quando há parasitemia durante a gestação e o parasita alcança a placenta causando uma placentite parasitária. O parasita desenvolve-se no tecido fetal causando alterações no desenvolvimento embrionário. Até ao momento, a infeção transplacentária não está descrita
13 em asininos, foi reportada experimentalmente em equinos, é muito rara em bovinos e bastante recorrente em ovinos e em humanos (Marques et al., 1995; Dubey, 2010).
Os estudos publicados referem que o taquizoíto é provavelmente a forma parasitária mais frequentemente envolvida na transmissão galactófora (Chiari et al., 1984; Dehkordi et al., 2013). ADN de T. gondii foi identificado no leite de várias espécies, como cabras, ovelhas e burras (Mancianti et al., 2014; Martini et al., 2014; de Santana Rocha et al., 2015; Luptakova et al., 2015). Está descrita a transmissão pela ingestão de leite cru de cabra, ovelha, camelo e búfalo, assim como queijo de cabra feito com leite cru (Dehkordi et al., 2013; Dubey et al., 2014b).
Durante a fase de parasitemia o transplante de órgãos e transfusão sanguínea também são consideradas vias de transmissão em humanos ou animais podendo ter consequências fatais nos recetores dos órgãos devido a imunodepressão (Weiss e Dubey, 2009; Dubey, 2010).
2.2.2 Fase extraintestinal
Esta fase ocorre em todos os hospedeiros. Após a ingestão de oocistos esporulados ou quistos, ocorre a digestão da parede dos mesmos permitindo aos esporozoítos e aos bradizoítos, respetivamente, serem libertados no lúmen intestinal e penetrarem em enterócitos ou diretamente na lâmina própria. Tal como na fase enteroepitelial, esta situação não se trata de fagocitose mas sim da entrada ativa do parasita na célula hospedeira com a formação de um vacúolo parasitóforo (Cérède et al., 2005; Dubey, 2010; Weiss e Kim, 2011).
Uma vez na célula hospedeira, o esporozoíto ou o bradizoíto, converte-se em taquizoíto e entra numa fase proliferativa rápida multiplicando-se por endodiogenia. Nesta mutilplicação duas células filhas são geradas no interior da célula mãe e consomem gradualmente os recursos desta antes de se separarem dela por completo (Dubey, 2010). O excesso de taquizoítos leva as células hospedeiras a ruturar, os parasítas entram no sistema vascular e ocorre parasitemia. Entre os dias 6 a 10 após a infeção, os taquizoítos podem ser encontrados em qualquer célula do organismo incluindo no cérebro.
É durante esta fase aguda da infeção que o animal pode desenvolver sinais clínicos variados e, no caso de fêmeas gestantes, o parasita pode atravessar a placenta e alcançar o feto, causando aborto ou alterando o desenvolvimento embrionário e fetal. No hospedeiro imunocompetente, o sistema imunitário (SI) do hospedeiro elimina os taquizoítos de circulação e aos 21 dias após a infeção estes já não são visíveis. Para sobreviver à resposta imunitária os taquizoítos convertem-se em bradizoítos ocorrendo a formação dos quistos tecidulares. Parece haver um tipo de tropismo específico para a formação dos quistos pois,
14 apesar de os taquizoítos na fase aguda poderem ser encontrados em qualquer célula do hospedeiro, os quistos predominam no músculo estriado, esquelético e cardíaco e no sistema nervoso central (Dubey, 2010; Cabral et al., 2016).
2.2.3 Fase enteroepitelial
Quando um felídeo seronegativo ingere quistos tecidulares, a parede externa destes é digerida por enzimas proteolíticas permitindo aos bradizoítos serem libertados no lúmen intestinal. Estes penetraram nos enterócitos iniciando a fase de desenvolvimento enteroepitelial. A entrada no enterócito é especializada não se tratando de fagocitose. T. gondii penetra na célula fundindo a sua membrana com a da célula hospedeira, apropriando-se desta para criar o vacúolo parasitóforo, com ambiente favorável ao seu desenvolvimento (Cérède et al., 2005; Dubey, 2010; Weiss e Kim, 2011).
Posteriormente, os bradizoítos entram numa fase proliferativa onde sofrem multiplicação assexuada originando esquizontes. Estes variam morfologicamente entre eles e também variam quanto ao local onde podem ser encontrados tendo sido classificados em esquizontes do tipo A, B, C, D e E (Dubey e Frenkel, 1972; Ferguson, 2009; Dubey, 2010).
Um esquizonte pode originar entre 8 a 30 merozoitos (Ferguson, 2009). Os merozoitos que emergem dos diferentes tipos são morfologicamente diferentes uns dos outros e mantêm a designação de A a E conforme o esquizonte que lhes deu origem. No interior da célula hospedeira vários merozoitos organizam-se em forma de hélice, prontos para serem libertados no lúmen intestinal. Quando libertados invadem novos enterócitos e podem entrar num novo ciclo de reprodução assexuada, ou dar inicio à gametogonia originando macrogametócitos e microgametócitos (Dubey, 2010; Weiss e Kim, 2011).
Os gametócitos aparecem nos enterócitos entre 3 a 15 dias após a ingestão do quisto tecidular e localizam-se preferencialmente no íleo, no topo das vilosidades intestinais. Sabe-se que os merozoitos do Tipo D e E dão origem a gametócitos, no entanto, não está confirmado que os restantes tipos não participem também na sua formação (Dubey, 2010).
Os macrogametas, ou gâmetas femininos, são células grandes, esféricas, mononucleadas com citoplasma abundante. Os microgâmetas são formados pela maturação dos microgametócitos, processo designado de microgametogonia. O merozoíto aumenta de tamanho tornando-se uma célula grande, ovoide ou elíptica, que sofre sucessivas divisões nucleares podendo originar entre 16 a 30 núcleos (Ferguson, 2009; Dubey, 2010). Os microgâmetas deslocam-se para a periferia ficando ligados à célula mãe apenas por um pequeno vínculo na terminação anterior. Nesta fase ocorre a maturação do microgâmeta que termina com a formação de dois flagelos e com a separação completa da célula mãe
15 que fica reduzida a um corpo residual citoplasmático. Este processo é transversal a outras coccídeas (Ferguson, 2009).
2.2.4 Excreção e esporulação de oocistos
Após libertação dos microgâmetas no lúmen intestinal, estes usam os seus flagelos para se deslocarem até aos macrogametas e penetrarem no seu interior onde ocorre a fecundação. Posteriormente forma-se a parede e o parasita passa a designar-se de oocisto que progride no lúmen intestinal sendo excretado nas fezes dos felídeos. Um gato pode excretar milhões de oocistos (Dubey, 2006; Ferguson, 2009).
A esporulação depende das condições do meio ambiente, humidade e temperatura. Um oocisto pode permanecer viável durante semanas no meio ambiente sem que a esporulação ocorra. No entanto, em situações favoráveis de humidade e temperatura, o oocisto esporula geralmente dois dias após a sua excreção (Dubey, 2010). Inicialmente forma-se uma massa citoplasmática indiferenciada designada de esporoblasto primário que entra numa fase proliferativa dando origem a uma célula com 4 núcleos. Esta célula divide-se em duas, formando dois esporoblastos divide-secundários, cada um com dois núcleos. Os esporoblastos secundários alongam-se adquirindo a forma de um charuto e desenvolvem uma parede em seu redor, passando a designar-se de esporocistos. Sucede-se a formação de 4 esporozoítos no interior de cada um dos esporocistos (Ferguson, 2009).
2.3 Patogenia e respostas imunitárias
A infeção por T. gondii é, na maior parte das vezes, assintomática. Os sinais clínicos são o resultado da multiplicação de taquizoítos no organismo do hospedeiro, sendo capazes de atravessar barreiras biológicas importantes como a hemato-encefálica e a placentária. As consequências da infeção materna variam conforme a espécie hospedeira, a fase da gestação e o genótipo do parasita (Dubey, 2010; Calero-Bernal et al., 2015; Castaño et al., 2016).
Os taquizoítos penetram ativamente nas células, ocorrendo a fusão de membranas da célula hospedeira com o plasmalema do parasita e posteriormente forma-se um vacúolo parasitóforo, onde a membrana é originalmente da célula hospedeira mas foi alterada pelo parasita tornando-a num habitáculo favorável à sua multiplicação e impedido a fusão com lisossomas (Cérède et al., 2005; Dubey, 2010; Weiss e Kim, 2011). A multiplicação do parasita leva a excesso de unidades parasitárias no interior da célula e causa a sua rutura. A resposta inflamatória celular é ativada pelo fenómeno e ocorre com a produção de interferão-gama (IFN-γ) levando à morte do parasita e posterior necrose da célula
16 hospedeira. T. gondii não produz nenhuma toxina que cause morte ou dano celular (Dubey, 2010; Cabral et al., 2016).
A resposta imunitária é direcionada contra um conjunto específico de antigénios de superfície (“surface antigen” - SAG) identificadas como SAG1, SAG2 e SAG3, e contra outros elementos do parasita como proteínas dos grânulos densos (GRA) e proteínas dos micronemas (MIC) (Cérède et al., 2005; Dubey, 2010; Hiszczyńska-Sawicka et al., 2014).
Na infeção por via oral a primeira linha de defesa é a mucosa intestinal. Esta conta com uma vasta população de células e mecanismos protetores pois é no intestino que o organismo está mais exposto a microrganismos que podem ser ou não patogénicos (Arosa et al., 2012; Cohen e Denkers, 2015).
Quando os enterócitos são invadidos pelo protozoário, as células do epitélio intestinal libertam citoquinas e quimioquinas pró-inflamatórias atraindo macrófagos, linfócitos, neutrófilos e células dendríticas ou células apresentadoras de antigénios. Os macrófagos e as células dendríticas, estimulados pela agressão, vão desencadear uma vasta resposta inflamatória. As principais citoquinas e quimioquinas produzidas são a Interleucina-15 (IL-15) (Schulthess et al., 2012), IL-12 (Tosh et al., 2016), IL-10 e o fator alfa de necrose tumoral (“Tumor necrosis factor α” - TNF-α) (Denkers e Gazzinelli, 1998). O equilíbrio entre estas moléculas estimula a produção de IFN-γ pelas células “natural killer” (NK) e pelos linfócitos T CD8 que potenciam a atividade parasiticida dos macrófagos e dão origem à resposta celular específica. O IFN-γ é indispensável para o combate da infeção inicial mas também no combate ao reaparecimento da patologia (Bhadra et al., 2011, 2013; Weiss e Kim, 2011; Hiszczyńska-Sawicka et al., 2014; Cohen e Denkers, 2015). Suspeita-se que a sua ação poderá estar envolvida com mecanismos reguladores de ferro (Dimier e Bout, 1998; Weiss e Kim, 2011).
As células dendríticas identificam os antigénios e estimulam os linfócitos B a desencadear uma resposta humoral específica com a produção de imunoglobulinas. Por ordem são produzidas IgA, IgM e IgG. Estas não são importantes no combate ao parasita quando este se encontra intracelular, atuando fora das células impedem nova invasão celular, facilitam a fagocitose e ativam o fator do complemento. São também importantes na proteção contra novas infeções. As IgA, produzidas principalmente pelos linfócitos B, presentes na lâmina própria, protegem o intestino contra futuras agressões (Arosa et al., 2012). As IgM surgem 1 a 2 semanas infeção e atingem o pico às 3 semanas pós-infeção, aos 6-9 meses as IgM vão diminuindo em número mas esta diminuição não é constante e podem permanecer em circulação durante um ano ou mais. As IgG são moléculas mais leves que as IgM surgem ao mesmo tempo que as IgM, (1-2 semanas) mas só aumentam a partir da 2ª semana (Dubey, 2010). Uma outra característica das IgG é a
17 avidez ou afinidade funcional, este termo traduz a força de ligação dos anticorpos (Ac) com antigénios (Ag). A avidez aumenta com o tempo de infeção (Siddiqui et al., 2014; Tanimura et al., 2015).
O SI do hospedeiro é incapaz de eliminar o parasita do organismo, mas é capaz de o controlar. O parasita consegue evadir-se do SI convertendo-se em bradizoito e enquistando. O mecanismo que leva à interconversão entre taquizoíto e bradizoíto não é totalmente conhecido. Após a formação do quisto, os bradizoítos entram em endodiogenia e o quisto aumenta de tamanho. O número de células em endodiogenia vai diminuindo ao longo do tempo e aos 28 dias após a infeção, são raras as células em multiplicação (Dubey, 2010). Quando um quisto rutura, o que pode acontecer por morte da célula hospedeira, ocorre uma grande resposta inflamatória com a chamada de monócitos, macrófagos e neutrófilos que fagocitam e eliminam os bradizoítos (Ferguson, 2009).
2.4
Variabilidade genética
Toxoplasma gondii é a única espécie conhecida do género Toxoplasma. Com base na genotipificação molecular de amostras provenientes da América do Norte e da Europa, o parasita demonstrou baixa variabilidade genética, tendo as populações de T. gondii sido agrupadas em três linhagens clonais predominantes designadas tipo I, II e III. O genótipo do tipo II é mais frequentemente reportado na Europa e na América do Norte. Todos os parasitas isolados, não pertencentes ao tipo I, II ou III foram consideradas estirpes atípicas. As estirpes atípicas são isoladas com mais frequência na fauna silvática e no hemisfério sul (Shwab et al., 2014) e estão muitas vezes associadas a fenómenos de elevada virulência (Dubey, 2010; Pomares et al., 2011).
Estudos indicam uma associação entre as características genéticas do parasita e a virulência ou a gravidade da toxoplasmose (Zenner et al., 1999; Grigg et al., 2001; Elbez-Rubinstein et al., 2009; Fekkar et al., 2011; Calero-Bernal et al., 2013; Shobab et al., 2013). No entanto, a manifestação clinica de toxoplasmose pode não depender exclusivamente da virulência do genótipo em questão, mas também de fatores ambientes e fatores inerentes ao hospedeiro (Wendte et al., 2010).
Em Portugal, o genótipo do tipo II tem sido isolado com frequência em ovinos, bovinos, suínos (de Sousa et al., 2006; Esteves, 2006; Lopes et al., 2015) e galinhas (Dubey et al., 2006b), assim como em seres humanos (Esteves, 2006).
Estirpes do genótipo tipo III e genótipos atípicos foram também isolados em galinhas de Portugal, nenhum apresentou virulência para o murganho (Dubey et al., 2006b; Verma et al., 2015). O tipo I foi isolado num feto bovino abortado e apresentou elevada virulência para murganho (Verma et al., 2015). Em Espanha, Calero-Bernal et al. (2013) isolaram de um
18 javali fêmea gestante, estirpes pertencentes ao tipo I e ao tipo III: duas crias estavam infetadas com o tipo I e uma com o tipo III.
3 Diagnóstico laboratorial
O diagnóstico da toxoplasmose é exclusivamente laboratorial, pois a doença manifesta- -se nas várias espécies de forma inespecífica. No contexto clínico é importante considerar sempre que T. gondii é um agente oportunista, manifestando-se principalmente em situações de imunossupressão sendo raras as situações de toxoplasmose primária.
3.1 Deteção do agente
A deteção de T. gondii pode ser realizada com recurso a várias técnicas de diagnóstico.
No exame anatomopatológico podem ser vistas lesões macroscópicas e microscópicas. O diagnóstico histológico permite associar o parasita a lesões causada pela infeção aguda e deste modo confirmar o diagnóstico de toxoplasmose. Quando degradado, o parasita pode ser confundido com células hospedeiras também elas em degeneração. O diagnóstico só deve ser feito se os taquizoítos forem visualizados com as suas características típicas já descritas. A presença de bradizoítos ou quistos tecidulares sem taquizoítos demostra apenas infeção cónica. A técnica imuno-histoquímica (IHQ) está recomendada pois facilita a visualização e identificação do parasita e permite o diagnóstico diferencial de outras coccídeas com características semelhantes como Neoespora caninum. A observação de esfregaços de material recolhido por biopsia, ou de amostras recolhidas post mortem, coradas com Giemsa, pode permitir um diagnóstico citológico rápido pela visualização direta do parasita (Dubey, 2010).
O diagnóstico biológico permite confirmar a presença do parasita mas também recuperar o parasita quando as amostras são pequenas ou estão comprometidas, como no caso de fetos macerados. Esta técnica permite manter a viabilidade do parasita para posteriores investigações como caracterização genética. Neste tipo de diagnóstico a amostra, recolhida ante mortem ou post mortem, é inoculada em murganhos ou em culturas celulares, geralmente fibroblastos. Inoculações sucessivas do parasita em murganhos comprometem as suas características biológicas originais, o mesmo não se verifica em culturas celulares. O material recolhido é importante sendo preferível cérebro ou placenta. O resultado positivo só pode ser confirmado pela visualização de taquizoítos recuperados posteriormente da cavidade peritoneal, ou bradizoítos recuperados de músculo cardíaco ou cérebro dos murganhos inoculados. É importante salientar que um resultado negativo não
19 exclui uma infeção pelo parasita, uma vez que este pode já não se encontrar viável no momento da recolha (Dubey, 2010).
As técnicas moleculares para a deteção de ADN de T. gondii incluem a reação em cadeia da polimerase (“polymerase chain reaction” - PCR). Esta é bastante sensível sendo capaz de detetar apenas um taquizoíto. A análise de fezes de felinos por PCR pode levar a resultados falsos positivos, devido a reações cruzadas com Hammondia hammondi, ou falsos negativos devido à dificuldade em aceder ao ADN no interior do oocisto (Dubey, 2010). O uso da PCR confirma a presença do parasita, mas não o implica na causa do aborto ou doença e resultados PCR negativos não excluem o parasita. Pode ser feito diagnóstico presuntivo em situações onde amostras são PCR positivas e existe lesões compatíveis com infeção por T. gondii embora não sejam visualizados parasitas na análise histológica. A PCR também permite o diagnóstico diferencial entre outros parasitas semelhantes como Neospora caninum (Dubey, 2010; Moreno et al., 2012).
3.2 Deteção de anticorpos
O diagnóstico serológico deteta a presença de anticorpos para T. gondii (IgM ou IgG) produzidos pelo hospedeiro. Uma amostra positiva prova apenas que o hospedeiro entrou em contacto com o parasita. A seropositividade para IgM sem a deteção de IgG permite o diagnóstico precoce da infeção por T. gondii na fase aguda. Embora raro, a deteção isolada de IgM pode não indicar a existência de uma infeção aguda visto que as IgM podem permanecer no organismo durante mais do que 12 meses em humanos, e durante vários meses em animais (Dubey, 2010).
A infeção aguda pode também ser diagnosticada serologicamente através da recolha de duas amostras com intervalo de 2 a 4 semanas. Um aumento nos títulos de IgG 16 vezes superior na segunda amostra é fortemente sugestivo de infeção aguda. No contexto veterinário esta situação raramente acontece pois quando o animal manifesta sinais clínicos as IgG já atingiram o pico ou estão perto de o fazer (Dubey, 2010).
Na toxoplasmose congénita em animais, principalmente ovinos, o diagnóstico serológico, com deteção de IgM, pode ser realizado, não na mãe, mas nos nados mortos ou recém-nascidos, antes da toma do colostro, uma vez que estes anticorpos maternos não atravessam a placenta. No entanto, a ausência de anticorpos não excluiu o diagnóstico, principalmente se os fetos tiverem lesões compatíveis com toxoplasmose, do mesmo modo que a presença de anticorpos sem lesões, não implica o parasita na causa de aborto. A presença de anticorpos fetais depende de fatores como o tempo de gestação no momento da infeção e do tempo decorrido entre a infeção e a análise.
20 Um dos principais objetivos dos estudos serológicos é determinar valores de seroprevalência permitindo assim estudos epidemiológicos entre regiões e países. Um dos critérios de escolha para o teste deve ser a acessibilidade deste para diferentes investigadores e a facilidade e rapidez de utilização, reduzindo as variáveis inerentes ao manipulador. Utilizar metodologias de diagnóstico que não possam ser recriadas em diferentes pontos do país e em diferentes países não tem fundamento científico, pois resultados de testes serológicos diferentes não podem ser comparados de forma objetiva. Vários testes serológicos encontram-se disponíveis. Os testes disponíveis no mercado são baseados na reação entre os anticorpos presentes em soros positivos e os antigénios presentes no teste. Os diferentes testes apresentam várias vantagens e desvantagens.
O teste de lise de Sabin e Feldman (“Dye Test”- DT) é o teste de referência para o diagnóstico da infeção em humanos. No entanto, possui baixa sensibilidade e especificidade para ruminantes e não funciona em aves. O ensaio imunoenzimático ("enzyme-linked immunosorbent assay” - ELISA) conta com uma reação enzimática em resposta à ligação Ag e Ac que produz uma mudança de cor, permitindo avaliar a quantidade de reações ocorridas no soro pela intensidade da cor. O teste de hemaglutinação indireta (“indirect hemogalutination test” - IHT) não está bem padronizado, tem baixa sensibilidade e especificidade e não deve ser utilizado na deteção de anticorpos fetais. O teste de imunofluorescência indireta (“indirec fluorescence antibody test” - IFAT) utiliza geralmente taquizoítos como antigénio e requer um microscópio de fluorescência, pelo que não é um teste acessível para qualquer estudo. O teste de aglutinação em latex (“latex aglutination test” - LAT) apresenta baixa sensibilidade e não deve ser utilizado na deteção de anticorpos fetais (Dubey, 2010). No Western blot o soro é incubado com antigénios de T. gondii e os anticorpos são separados por eletroforese, formando bandas que correspondem a diferentes pesos moleculares. Este teste exige material específico e não é utilizado normalmente como método de diagnóstico mas sim para comparar resultados entre diferentes técnicas (Ghazy et al., 2007) ou simplesmente confirmar resultados de uma técnica específica (Gupta et al., 2002; Jakubek et al., 2006).
O teste de aglutinação modificado (“modiffied agglutination test” - MAT) é uma modificação do teste de aglutinação direta criado por Fulton e Turk, (1959). Adaptações de Desmonts e Remington, (1980) conferiram ao teste maior sensibilidade e especificidade e quando Dubey e Desmonts, (1987) alteram a ordem de reagentes, tornou-se mais seguro e cómodo de usar, passando a designar-se pelo nome que é hoje conhecido. O teste deteta apenas IgG pelo que em fases precoces da infeção pode apresentar falsos negativos. É utilizado mundialmente em várias espécies (Dubey, 2010), permite o diagnóstico em aves (Dubey et al., 2006b) e está validado em suínos naturalmente infetados, não sofrendo