Obtenção de polímeros graftizados de quitosana e estudo das
propriedades físico-químicas para aplicação na indústria do petróleo
Keila dos Santos Alves
__________________________________
Tese de Doutorado
Natal/RN, dezembro de 2013
INSTITUTO DE QUÍMICA
OBTENÇÃO DE POLÍMEROS GRAFTIZADOS DE QUITOSANA E ESTUDO DAS
PROPRIEDADES FÍSICO-QUÍMICAS PARA APLICAÇÃO NA INDÚSTRIA DO
PETRÓLEO
Tese apresentada ao Programa de Pós-Graduação em
Química da Universidade Federal do Rio Grande do
Norte – UFRN, como parte dos requisitos para
obtenção do título de Doutor em Química.
Orientadora: Profa. Dra. Rosangela de Carvalho
Balaban (UFRN)
Natal/RN
UFRN / Biblioteca Central Zila Mamede. Catalogação da Publicação na Fonte.
Alves, Keila dos Santos.
Obtenção de polímeros graftizados de quitosana e estudo das propriedades físico-químicas para aplicação na indústria do petróleo. / Keila dos SantosAlves. – Natal, RN, 2013.
144 f.: il.
Orientadora: Profa. Dra. Rosangela de Carvalho Balaban.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Instituto de Química. Programa de Pós-Graduação em Química.
1. Quitosana - Tese. 2. Alquilação redutiva - Tese. 3. Método one-pot - Tese. 4. Solubilidade – Tese. 5. PH-responsivo – Tese. 6. Espalhamento de luz dinâmico – Tese. I. Balaban, Rosangela de Carvalho. II. Universidade Federal do Rio Grande do Norte. III. Título.
Ao meu querido irmão: Elizeu dos Santos Alves.
“Somente Deus tem a fórmula da vida
É a única saída, nEle eu posso descansar
Somente Deus, alimenta minha alma
Teu Espírito me acalma, meu socorro vem de Ti”.
Agradeço especialmente a Deus que me concedeu forças para a realização de mais uma
conquista, mesmo com todas as adversidades da vida.
Agradeço à minha família, sempre presente, pelo incentivo, apoio, paciência e carinho.
Agradeço a professora Rosangela Balaban pela oportunidade concedida para que eu
desenvolvesse este trabalho, pela amizade, apoio, carinho e dedicação a minha orientação.
Agradeço à minha amiga Bruna Lima pelo incondicional apoio, paciência e carinho.
Agradeço aos professores Marcos Villetti e Rosangela Vidal, pelo apoio, incentivo e
inúmeras discussões científicas compartilhadas.
Agradeço aos meus amigos Ana Maria, Ítalo, Lucianna, Maurício, Nívea, Oldemar e Ruza e
aos colegas que fazem parte da grande família LAPET, pela amizade, apoio, incentivo,
momentos de descontração e contribuição para a realização deste trabalho. Aos professores e
funcionários do Instituto de Química da Universidade Federal do Rio Grande do Norte.
Agradeço a professora Nádya Pesce da Silveira e ao José Daniel Souza do LIMDIM-
Universidade Federal do Rio Grande do Sul por gentilmente contribuir com todo apoio para
a realização das análises de DLS e potencial zeta.
A quitosana é um biopolímero derivado de carapaças de crustáceos, de baixo custo,
biodegradável, renovável, que apresenta propriedades físico-químicas importantes e, ainda,
proporciona diferentes possibilidades de modificações em sua estrutura química, gerando
novas propriedades, o que torna esse polissacarídeo muito atraente do ponto de vista de
aplicação. Os polímeros são utilizados em várias operações na produção do petróleo.
Entretanto, a crescente preocupação com as restrições ambientais têm promovido a busca por
materiais ambientalmente sustentáveis pela indústria do petróleo. Dessa forma, esse estudo
propôs a obtenção de quitosana graftizada com grupos hidrofílico (poli(etileno glicol), mPEG)
e/ou hidrofóbico (n-dodecila) por uma metodologia mais simples (one-pot) e a avaliação de suas propriedades físico-químicas em função da variação de pH, através das análises de
reologia, espalhamento de raios-X a baixos ângulos (SAXS), espalhamento de luz dinâmico
(DLS) e potencial zeta. Os derivados de quitosana foram preparados utilizando a reação de
alquilação redutiva em condições reacionais brandas e a estrutura química dos polímeros foi
caracterizada por ressonância magnética nuclear de hidrogênio (RMN 1H) e análise elementar
CHN. Considerando constante a razão molar mPEG/Quitosana na modificação química da
quitosana em diferentes metodologias, foi possível melhorar a solubilidade da quitosana em
uma ampla faixa de pH (ácido, neutro e básico) usando a metodologia one-pot, em que uma parte dos grupos amino foi reacetilada. Nesta condição, até mesmo com a inserção simultânea
do n-dodecila, a solubilidade se manteve. Por outro lado, a solubilidade dos derivados obtidos apenas com a incorporação de mPEG através de metodologia tradicional, ou com o grupo n -dodecila, foi similar ao seu precursor. O grupo hidrofílico promoveu a diminuição da
viscosidade das soluções poliméricas a 10 g/L em meio ácido. Entretanto, em pH básico, esse
grupo contribuiu para o aumento da viscosidade e da estabilidade térmica das soluções, assim
como, favoreceu um comportamento pseudoplástico mais acentuado, sugerindo fortes
associações intermoleculares no meio alcalino. Os resultados de SAXS apresentaram um
comportamento de polieletrólito com a diminuição do pH para os sistemas poliméricos. As
análises de DLS revelaram que as soluções diluídas dos polímeros a 1 g/L em pH 3, embora
apresentem uma alta densidade de grupos amino protonados ao longo da cadeia polimérica, o
alto grau de cargas contribuiu significativamente para a agregação, promovendo o aumento do
tamanho das partículas com a diminuição do pH. Além disso, o grupo hidrofóbico também
dependem apenas da carga da superfície da partícula, mas é resultante da carga líquida do
meio. Os sistemas poliméricos associativos em solução aquosa obtidos neste estudo
apresentam propriedades que podem ser atraentes em várias aplicações na indústria do
petróleo.
Chitosan is a biopolymer derived from the shells of crustaceans, biodegradable,
inexpensive and renewable with important physical and chemical properties. Moreover, the
different modifications possible in its chemical structure generate new properties, making it
an attractive polysaccharide owing to its range of potential applications. Polymers have been
used in oil production operations. However, growing concern over environmental constraints
has prompted oil industry to search for environmentally sustainable materials. As such, this
study sought to obtain chitosan derivatives grafted with hydrophilic (poly(ethylene glycol),
mPEG) and/or hydrophobic groups (n-dodecyl) via a simple (one-pot) method and evaluate their physicochemical properties as a function of varying pH using rheology, small-angle
X-ray scattering (SAXS), dynamic light scattering (DLS) and zeta potential. The chitosan
derivatives were prepared using reductive alkylation under mild reaction conditions and the
chemical structure of the polymers was characterized by nuclear magnetic resonance (1H
NMR) and CHN elemental analysis. Considering a constant mPEG/Chitosan molar ratio on
modification of chitosan, the solubility of the polymer across a wide pH range (acidic, neutral
and basic) could only be improved when some of the amino groups were submitted to
reacetylation using the one-pot method. Under these conditions, solubility is maintained even
with the simultaneous insertion of n-dodecyl. On the other hand, the solubility of derivatives obtained only through mPEG incorporation using the traditional methodology, or with the n -dodecyl group, was similar to that of its precursor. The hydrophilic group promoted decreased
viscosity of the polymer solutions at 10 g/L in acid medium. However, at basic pH, both
viscosity and thermal stability increased, as well as exhibited a pronounced pseudoplastic
behavior, suggesting strong intermolecular associations in the alkaline medium. The SAXS
results showed a polyelectrolyte behavior with the decrease in pH for the polymer systems.
DLS analyses revealed that although the dilute polymer solutions at 1 g/L and pH 3 exhibited
a high density of protonated amino groups along the polymer chain, the high degree of charge
contributed significantly to aggregation, promoting increased particle size with the decrease in
pH. Furthermore, the hydrophobic group also contributed to increasing the size of aggregates
in solution at pH 3, whereas the hydrophilic group helped reduce their size across the entire
pH range. Nevertheless, the nature of aggregation was dependent on the pH of the medium.
Zeta potential results indicated that its values do not depend solely on the surface charge of
Figura 3.1 Estruturas químicas da celulose, quitina e quitosana ... 17
Figura 3.2 Diagrama de produção comercial de quitina e quitosana ... 18
Figura 3.3 Espectro de RMN 1H de uma amostra de quitosana ... 24
Figura 3.4 Variação do pH crítico em função do grau de acetilação ... 27
Figura 3.5 Reações para obtenção de derivados de quitosana ... 31
Figura 3.6 Esquema de aminação redutiva ... 32
Figura 3.7 Reações de N-alquilação redutiva da quitosana com açúcares ... 33
Figura 3.8 Reações de N-alquilação redutiva da quitosana com diferentes grupos funcionais substituídos ... 34
Figura 3.9 Reação de N-alquilação redutiva da quitosana com grupo cetona ... 34
Figura 3.10 Reação de N-alquilação redutiva da quitosana com 3-O-dodecil-D-glucose ... 36
Figura 3.11 Representação de ligações cruzadas na quitosana ... 37
Figura 3.12 Reação de N-alquilação redutiva na superfície da quitosana ... 38
Figura 3.13 Reação de N-alquilação redutiva com aldeídos fotossensíveis ... 39
Figura 3.14 a) Relação entre razão molar Ac2O/OH mPEG e teor de aldeído de mPEG; b) Efeito do tempo de reação e teor de aldeído; c) Efeito de DMSO e teor de aldeído de mPEG; (T 22 °C; DMSO 30 mL - a, c; tempo de reação 9 h - a, c; razão molar 20 - b, c ... 43
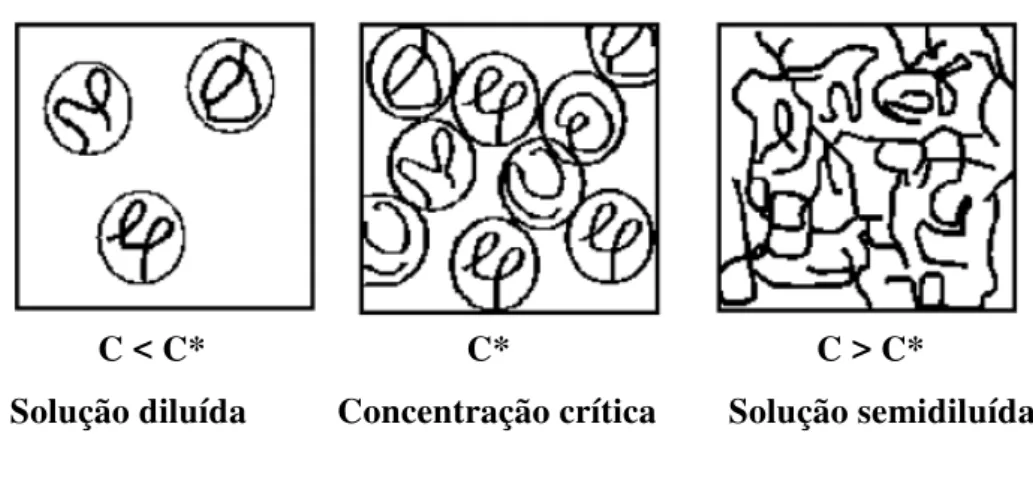
Figura 3.15 Representação dos regimes de concentração de polímero em solução e da concentração crítica (C*) ... 47
Figura 3.16 Modelo de placas paralelas: escoamento de fluido de Newton ... 52
Figura 3.17 Curvas de tensão (a) e viscosidade (b) versus taxa de cisalhamento para os fluidos newtonianos, pseudoplásticos e dilatantes ... 53
Figura 3.18 Esquema ilustrativo do efeito do pH para soluções de quitosana-CS e derivado-NPCS ... 55
Figura 3.19 Comportamento reológico do derivado-NPCS: viscosidade versus taxa de cisalhamento ... 55
Figura 3.20 Influência da temperatura na viscosidade das N-alquilquitosanas em solução de ácido acético 0,3 M/acetato de sódio 0,05 M; ω = 0,1 Hz .... 56
Figura 3.21 Esquema da medida da intensidade de luz espalhada (a) e a sua correspondente função de correlação (b) obtida por espalhamento de luz dinâmico ... 60
em 0,3 M de ácido acético/0,05 de acetato de sódio) ... 64
Figura 3.24 Modelo representativo de espécies de agregados de quitosana GA 30 % em solução com diferentes forças iônicas (concentração de
polímero 0,40 mg/mL, solução aquosa de ácido acético 0,10 M) ... 66
Figura 3.25 Distribuição dos raios hidrodinâmicos de oligômeros de quitosana
obtidos por DLS ... 69
Figura 3.26 Esquema da agregação e dissociação da quitosana-g-mPEG em meio
aquoso em função do pH... 72
Figura 3.27 Representação da agregação em função do pH para quitosana
graftizada com grupos hidrofóbicos e hidrofílicos ... 73
Figura 3.28 Representação do potencial zeta ... 74
mPEG CH GA GD GS pK RMN 1H RMN 13C RMN 15N
IV UV CLAE TG NaBH4 NaCNBH3 GS PEG
Quitosana-g-mPEG DMSO Ac2O
TEMPO NaClO BIAB DLS SAXS ηr ηsp ηred ηinh
[η] C*
ζ
metóxi-poli(etileno glicol) quitosana
grau de acetilação
grau de desacetilação grau de substituição constante de dissociação
espectroscopia de ressonância magnética nuclear de hidrogênio espectroscopia de ressonância magnética nuclear de carbono espectroscopia de ressonância magnética nuclear de nitrogênio espectroscopia na região do infravermelho
espectroscopia na região do ultravioleta cromatografia líquida de alta eficiência termogravimetria
borohidreto de sódio cianoborohidreto de sódio grau de substituição poli(etileno glicol)
quitosana graftizada com mPEG dimetilsulfóxido
anidrido acético
N-oxil-2,2,6,6-tetrametilpiperidina hipoclorito de sódio
bis(acetóxi)iodobenzeno espalhamento de luz dinâmico
RESUMO ABSTRACT
1 INTRODUÇÃO ... 13
2 OBJETIVOS ... 15
2.1 OBJETIVO GERAL ... 15
2.2 OBJETIVOS ESPECÍFICOS ... 15
3 REVISÃO BIBLIOGRÁFICA ... 16
3.1 QUITOSANA ... 16
3.1.1 Obtenção e Estrutura da Quitosana ... 16
3.1.2 Caracterização da Quitosana ... 21
3.1.2.1 Grau de Desacetilação/Acetilação ... 21
3.1.2.2 Solubilidade ... 24
3.1.3 Modificação Química ... 29
3.1.3.1 Aminação Redutiva (ou Alquilação Redutiva) da Quitosana ... 32
3.1.3.2 QUITOSANA-g-PEG ... 41
3.1.4 Estudo das Propriedades Físico-Químicas ... 45
3.1.4.1 REOLOGIA ... 46
3.1.4.2 Espalhamento de Luz Dinâmico (DLS) ... 57
3.1.4.3 Potencial Zeta (ζ ) ... 73
3.1.4.4 Espalhamento de Raios-X a Baixos Ângulos (SAXS) ... 76
REFERÊNCIAS BIBLIOGRÁFICAS ... 78
4 METODOLOGIA, RESULTADOS E DISCUSSÃO ... 89
5 CONCLUSÕES... ... 136
ANEXO I... ... 138
1
INTRODUÇÃO
Os desafios da sustentabilidade econômica com a preservação do meio ambiente vêm promovendo nos últimos anos um crescente interesse por pesquisas que proporcionem o desenvolvimento de novos materiais provenientes de polímeros naturais para o uso em diversas áreas. A importância dos biopolímeros está relacionada não apenas com as questões ambientais, mas também devido a sua origem renovável, abundância na natureza, variedade estrutural e propriedades funcionais. Tais características tornam esses polímeros sistemas alternativos e competitivos aos materiais clássicos (Alves e Mano, 2008; Casettari, Vllasaliu
et al., 2012; Kumar, 2000; Kurita, 2001; Mourya e Inamdar, 2008; Pillai, Paul et al., 2009;
Prashanth e Tharanathan, 2007; Rinaudo, 2006).
Dentre os polímeros naturais, destaca-se a quitosana, obtida através do processo de desacetilação da quitina, um dos polissacarídeos mais abundantes na natureza e comercialmente extraído das carapaças de crustáceos. A quitosana apresenta importantes propriedades, tais como biodegradabilidade, biocompatibilidade, atoxicidade, bioatividade, natureza policatiônica e possibilidade de diferentes formas de utilização (pó, filmes, gel, fibras, soluções). Essas propriedades estão relacionadas ao seu potencial em aplicações industriais, tecnológicas e biológicas. Sua utilidade se torna ainda mais extensa quando incluímos os diversos derivados de quitosana, os quais são obtidos através de modificações químicas em sua estrutura polimérica, permitindo adicionar outras propriedades e, portanto, novas aplicações. Assim, a quitosana é considerada muito versátil com uso nas indústrias farmacêutica, alimentícia, cosmética, têxtil, na agricultura, na medicina e em tratamento de efluentes (Alves e Mano, 2008; Casettari, Vllasaliu et al., 2012; Chen, Mi et al., 2011;
Craveiro, Craveiro et al., 1999; Kumar, 2000; Kumirska, Weinhold et al., 2011; Mourya e
Inamdar, 2008; Pillai, Paul et al., 2009; Prashanth e Tharanathan, 2007; Rinaudo, 2006;
Sashiwa e Haiba, 2004;).
destacar os polímeros resultantes da inserção de grupos hidrofílicos e/ou hidrofóbicos na cadeia polimérica, uma vez que é possível melhorar a solubilidade da quitosana e obter derivados pertencentes à classe de polímeros hidrossolúveis hidrofobicamente modificados. Esses polímeros apresentam propriedades associativas e são bastante atraentes em várias aplicações, principalmente, quando o controle reológico de fluidos é requerido, como no caso das tintas, dos cosméticos, dos alimentos, nos sistemas carreadores de fármacos e biomoléculas, dos fluidos de perfuração e dos processos de recuperação avançada de petróleo (Chiu, Chen et al., 2009; Desbrières, 2004; Kjniksen, Beheshti. et al., 2008; Philippova e
Korchagina, 2012; Yang, Chou et al., 2002).
No caso de aplicações de polímeros na indústria do petróleo, a goma xantana é um dos polissacarídeos mais usados nos processos de produção de petróleo. Esse polímero funciona como agente viscosificante do meio aquoso. No entanto, a goma xantana apresenta um alto custo como a principal limitação do seu uso. Além disso, a solução da goma xantana apresenta diminuição nos valores de viscosidade com o aumento da temperatura (Lucas, Mansur et al., 2009; Sorbie et al., 2009). Uma alternativa para superar essas limitações pode
surgir do estudo da quitosana, embora ela apresente limitação de solubilidade em meio neutro e alcalino. Já que a estrutura da quitosana permite modificação química que pode melhorar as suas propriedades e por ser um produto natural, biodegradável, renovável e de baixo custo, a quitosana apresenta um potencial para aplicação. Além disso, as carapaças de crustáceos são resíduos rejeitados pela indústria pesqueira, sendo em muitos casos considerados poluentes. Portanto, o aproveitamento desses resíduos ainda minimiza os impactos ambientais que podem ser causados pelo uso de um descarte inadequado (Reis, Silva et al., 2011; Saleah e
2
OBJETIVOS
2.1 OBJETIVO GERAL
O projeto de tese se constituiu na obtenção de quitosana graftizada com grupos hidrofílicos e/ou hidrofóbicos, a fim de melhorar a solubilidade da quitosana e promover características associativas em solução aquosa, e avaliação das propriedades físico-químicas dos derivados de quitosana.
2.2 OBJETIVOS ESPECÍFICOS
Obter quitosana graftizada com grupos hidrofílicos (metóxi-poli(etileno glicol) -
mPEG) e/ou hidrofóbicos (n-dodecila);
Caracterizar a estrutura dos derivados de quitosana (CHP, CHC e CHPC: quitosana
(CH) graftizada com mPEG, n-dodecila e mPEG/n-dodecila, respectivamente);
Avaliar as propriedades físico-químicas, tais como solubilidade, estabilidade e
viscosidade das soluções aquosas das amostras de quitosana;
Avaliar o comportamento reológico dos derivados de quitosana em solução aquosa;
Avaliar o comportamento de agregação dos derivados de quitosana e do precursor em
3
REVISÃO BIBLIOGRÁFICA
3.1 QUITOSANA
3.1.1 Obtenção e Estrutura da Quitosana
A quitosana é um biopolímero de cadeia linear obtida, principalmente, da N-desacetilação da quitina. A celulose e a quitina são os polissacarídeos mais abundantes na natureza, formam a base estrutural e de proteção de plantas e animais, respectivamente. Quitina é encontrada principalmente em carapaças de crustáceos (em especial no caranguejo, no camarão e na lagosta), insetos, moluscos e na parede celular de fungos. A estrutura química da quitina (Figura 3.1) é formada por unidades repetidas 2-acetamido-2-deoxi-D
-glicopiranose unidas por ligações glicosídicas do tipo β-(1→4). Sua composição é muito semelhante à estrutura da celulose (Figura 3.1), diferem apenas no substituinte do carbono 2 (C2), constituído pelo grupo acetamido na estrutura da quitina e pelo grupo hidroxila na celulose (Alves e Mano, 2008; Craveiro, Craveiro et al., 1999; Kumar, 2000; Kurita, 2001;
Pillai, Paul et al., 2009; Prashanth e Tharanathan, 2007; Rinaudo, 2006).
As fortes ligações de hidrogênio inter e intramoleculares existentes nas cadeias da quitina resultam na sua insolubilidade em meio aquoso e na maioria dos solventes orgânicos, consequentemente, minimiza o potencial da quitina em muitas aplicações. Apesar de suas limitações, quitina é usada, sobretudo, na indústria têxtil, alimentícia, cosméticos e tem aplicações médicas e farmacêuticas. Além disso, a grande importância da quitina refere-se à produção da quitosana (Craveiro, Craveiro et al., 1999; Kumar, 2000; Prashanth e
Tharanathan, 2007; Rinaudo, 2006).
de sementes através da sua ação bactericida e fungicida, além de atuar na retenção de umidade e nutrientes. É muito utilizada na indústria de alimentos em produtos dietéticos e aditivos alimentares; em formulação de cosméticos; na indústria farmacêutica, funciona como agentes de liberação controlada de fármacos e tem ação farmacológica em função das suas propriedades antimicrobiana, coagulante, assim como é utilizada na composição de biomateriais para regeneração de estrutura óssea e ferimentos, dentre outras aplicações (Alves e Mano, 2008; Casettari, Vllasaliu et al., 2012; Chen, Mi et al., 2011; Craveiro, Craveiro et al., 1999; Kumar, 2000; Kumirska, Weinhold et al., 2011; Mourya e Inamdar, 2008; Pillai,
Paul et al., 2009; Prashanth e Tharanathan, 2007; Rinaudo, 2006; Sashiwa e Haiba, 2004).
Figura 3.1 - Estruturas químicas da celulose, quitina e quitosana
Fonte: adaptado de (Kurita, 2001)
A estrutura química da quitosana (Figura 3.1) é constituída por unidades β-(1→ 4)-2-amino-2-deoxi-D-glicopiranose e β-(1→4)-2-acetamido-2-deoxi-D-glicopiranose, porém,
predominam os constituintes formados por grupos amino (unidades desacetiladas). Os principais parâmetros que diferenciam quitosana da quitina são o grau de desacetilação (GD -
fração de grupos amino em relação aos grupos acetamido (acetilados) presentes no Celulose
Quitina
biopolímero) e a solubilidade. Geralmente, a quitosana possui o grau de desacetilação acima de 50 % e apresenta-se solúvel em meio aquoso (pH ácido). Enquanto que a quitina tem GD abaixo de 50 %, além de ser insolúvel em meio aquoso (Brugnerotto, Lizardi et al., 2001;
Kurita, 2001; Pillai, Paul et al., 2009).
A reação de N-desacetilação da quitina é promovida em meio alcalino com hidróxidos de sódio ou potássio, à temperatura elevada (Canella e Garcia, 2001; Santos, 2004). Um exemplo das condições experimentais para obtenção comercial da quitina e quitosana é apresentado na Figura 3.2 (Santos, 2004).
Figura 3.2 - Diagrama de produção comercial de quitina e quitosana
Fonte: adaptado de (Santos, 2004)
regiões cristalinas não são completamente atingidas, as modificações estão mais sujeitas à ocorrência nas superfícies dos cristalitos. Assim, a N-desacetilação da quitina em solução aquosa de NaOH ocorre de modo heterogêneo e gera produto cujas cadeias são formadas por sequências de unidades modificadas quimicamente e unidades que não sofreram modificação química. Portanto, a quitosana é formada por unidades desacetiladas e acetiladas (Signini e Campana-Filho, 2001).
Os principais fatores que afetam a eficiência da N-desacetilação da quitina na obtenção da quitosana são: a) temperatura e tempo de reação; b) concentração da solução alcalina e adição de diluente (álcoois de cadeia curta e cetonas); c) razão quitina/solução alcalina; d) tamanho das partículas de quitina; e) atmosfera da reação e presença de agentes que evitam a despolimerização (Campana-Filho e Signini, 2001). As condições mais severas são geralmente empregadas no sentido de favorecer a eficiência da N-desacetilação, no entanto, resulta em acentuada despolimerização via hidrólise alcalina. A suposição de que o oxigênio molecular participe do processo tem suscitado o emprego de aditivos e de condições reacionais específicas para evitar seu efeito oxidante. O uso de gases inertes e a adição de agentes redutores no meio reacional são medidas relativamente eficazes no sentido de minimizar a despolimerização (Campana-Filho, Brito et al., 2007).
Canella e Garcia (2001) observaram que o processo de N-desacetilação da quitina realizado em meio heterogêneo pode gerar uma distribuição não aleatória dos grupos acetamido ao longo da cadeia polimérica. Este efeito ocasionou a solubilidade parcial da quitosana em solução aquosa de ácido acético, mesmo para amostras que já tinham alcançado um grau médio de desacetilação acima de 50 %, e que deveriam, portanto, ser solúveis em meio aquoso na presença de ácido (Canella e Garcia, 2001).
antraquinona e o borbulhamento de nitrogênio ou de argônio não surtiram qualquer efeito, indicando que a presença de oxigênio não foi um pré-requisito para a ocorrência de despolimerização (Campana-Filho e Signini, 2001).
A proporção de unidades acetiladas/desacetiladas nas estruturas da quitina e quitosana é dependente da origem e do modo de obtenção do biopolímero. A extração da quitina resulta em N-desacetilação parcial, mesmo quando são empregadas condições brandas nas etapas de desmineralização e desproteinização. A quitina nativa, que está associada a outros materiais constituintes das carapaças de caranguejos e de camarões, é um produto natural de composição variável quanto à dimensão das cadeias, teor e distribuição de unidades acetiladas/desacetiladas ao longo da cadeia do polímero. Estes fatores refletem diretamente nas características da quitosana comercial produzida da quitina (Campana-Filho, Brito et al.,
2007).
Youn e colaboradores demostraram que a composição química e algumas propriedades físico-químicas e funcionais de amostras de quitosana preparadas com as carapaças de caranguejos coletadas em três anos diferentes (2004, 2005 e 2007) exibiram variações. A amostra de 2004 apresentou um grau de acetilação maior e uma viscosidade menor em relação às outras amostras de quitosana. Enquanto que a espécie de 2007 teve o teor de proteína e de
quitina mais elevados (Youn, No et al., 2009).
A caracterização estrutural da quitosana é um aspecto importante para o estudo das suas propriedades e, consequentemente, para o direcionamento de aplicações. A influência de muitos fatores, desde a natureza da matéria-prima até as condições experimentais utilizadas nos tratamentos para a obtenção da quitosana, determina as diferentes características e propriedades físico-químicas da quitosana. As diferenças nas especificações de pureza, grau de desacetilação, solubilidade, viscosidade, massa molar e polidispersão também podem estar vinculadas à intrínseca variabilidade da matéria-prima empregada pelos produtores de quitina e quitosana. Nesse caso, as variações são razoáveis já que o polímero é proveniente essencialmente de uma indústria pesqueira, que coleta os animais diretamente da natureza, sem discriminação de espécie, idade e fase de desenvolvimento (Campana-Filho, Brito et al.,
2007; Craveiro, Craveiro et al., 1999; Domard, 2011; Kumirska, Weinhold et al., 2011; Youn,
3.1.2 Caracterização da Quitosana
3.1.2.1 Grau de Desacetilação/Acetilação
As propriedades da quitosana dependem intensamente da proporção relativa das
unidades 2-amino-2-deoxi-D-glicopiranose e 2-acetamido-2-deoxi-D-glicopiranose existentes
em sua estrutura polimérica. A fração de grupos acetamido em relação aos grupos amino
presente na quitosana determina o grau de acetilação (GA), grandeza complementar ao grau
de desacetilação (GA + GD = 1). Esse parâmetro é muito relevante, pois tem efeito marcante
nas propriedades físicas, químicas e biológicas da quitosana (Craveiro, Craveiro et al., 1999;
Kumirska, Weinhold et al., 2011; Kurita, 2001). Pesquisadores têm estudado, principalmente,
o seu efeito nas propriedades físico-químicas da quitosana em solução, uma vez que se faz necessário preparar soluções do polímero antes da obtenção de qualquer tipo de material como gel, filme, esponja, fibra, etc, assim como, para as aplicações da quitosana em sistemas
usuais através de solução (Chen, Hsu et al., 2011; Philippova, Korchagina et al., 2012;
Schatz, Viton et al., 2003; Sorlier, Denuzière et al., 2001; Sorlier, Viton et al., 2002).
A relação das unidades acetiladas e desacetiladas na quitosana governa o equilíbrio entre as propriedades hidrofílicas e hidrofóbicas em solução. A quantidade e a distribuição aleatória ou em bloco dos grupos acetamido na cadeia da quitosana afetam as interações intra e intermolecular, já que esses grupos contribuem na formação das ligações de hidrogênio e apresentam caráter hidrofóbico através dos grupos metílicos. Os grupos amino determinam as interações eletrostáticas em meio ácido através dos sítios amino protonados e as ligações de hidrogênio, assumindo uma natureza hidrofílica. O aumento das ligações de hidrogênio intra e intermolecular e das interações hidrofóbicas promovem a formação de agregados em solução aquosa, influenciando a solubilidade da quitosana (Chen, Hsu et al., 2013; Philippova, Korchagina et al., 2012; Rinaudo, 2006).
comportamentos diferentes de acordo com o valor do GA: i) quitosana com GA abaixo de 20 % comporta-se como polieletrólito catiônico e as interações eletrostáticas são predominantes; ii) as interações hidrofílicas e hidrofóbicas estão em equilíbrio para as amostras com valores de GA entre 20 e 50 %; iii) para quitosana com GA acima de 50 %, predominam as interações hidrofóbicas e surgem as associações entre as cadeias do polímero. Esses resultados confirmam conclusões prévias de Sorlier e colaboradores (2001, 2002), que encontraram
características semelhantes de comportamento da quitosana, quando estudaram a constante de
dissociação(pK) em função do GA (Schatz, Viton et al., 2003; Sorlier, Denuzière et al., 2001;
Sorlier, Viton et al., 2002).
Segundo Sorlier e colaboradores (2001), através do estudo do GA em função do grau de dissociação (densidade de cargas em solução), verificaram que uma amostra de quitosana com GA de 89 %, em pH 7 correspondeu a um grau de dissociação abaixo de 0,4, enquanto que uma quitosana de GA 20 % foi quase neutralizada nesse pH. Como consequência das diferentes estruturas da quitosana, as suas propriedades físico-químicas são diretamente afetadas, proporcionando aplicações de acordo com o seu comportamento específico para o tipo de estrutura. Nesse sentido, quitosana com baixo valor de GA apresenta alta densidade de cargas positivas em ambiente ácido, proveniente dos grupos amino protonados, sendo assim, favorece as propriedades de floculação e adsorção de partículas carregadas negativamente, enquanto a quitosana com elevado GA, predomina as interações hidrofóbicas e favorece a
formação de gel (Sorlier, Denuzière et al., 2001).
Contudo, podemos encontrar divergências sobre o efeito do GA relacionado ao
comportamento das agregações entre as cadeias da quitosana. Philippova e colaboradores
Existem várias metodologias para a determinação do grau médio de desacetilação da quitosana, tais como espectroscopia de ressonância magnética nuclear de hidrogênio (RMN
1H), carbono (RMN 13C) e nitrogênio (RMN 15N); espectroscopia na região do infravermelho
(IV) e do ultravioleta (UV); titulação condutimétrica e potenciométrica; difração de raios-X; análise elementar; cromatografia líquida de alta eficiência (CLAE) e termogravimetria (TG).
(Brugnerotto, Lizard et al., 2001; Fernandez-megia, Novoa-Carballal et al., 2005; Jiang, Chen
et al., 2003; Lavertu, Xia et al., 2003; Liu, Wei et al., 2006; Santos, Soares et al., 2003;
Zhang, Xue et al., 2005). Cada método tem suas vantagens e desvantagens, a escolha de uma
técnica dependerá da natureza da amostra (pureza, quantidade e solubilidade) e da disponibilidade do equipamento.
Um dos métodos usados para determinar o grau de desacetilação da quitosana é a espectroscopia de RMN 1H. A determinação do GD pode ser realizada através de diferentes
combinações entre as áreas dos picos do espectro de RMN 1H da quitosana. Exemplos dessas
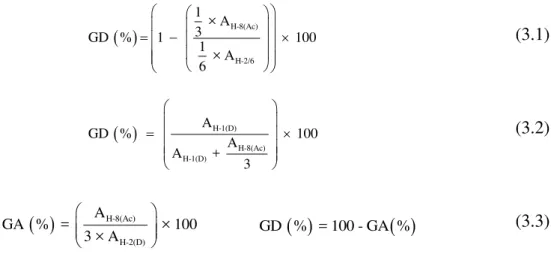
relações são apresentados nas seguintes equações: Equação 3.1 e Equação 3.2 (Lavertu, Xia et
al., 2003) e Equação 3.3 (Santos, Soares et al., 2003).
(3.1)
(3.2)
(3.3)
Em que, ―A” é a área dos picos equivalentes do espectro de RMN 1H da quitosana na Figura 3.3. Conforme os assinalamentos no espectro da quitosana, o pico que corresponde ao deslocamento químico 2,3 ppm é atribuído aos núcleos de hidrogênio da metila do grupo
acetamido (H-8(Ac)). Os sinais relacionados a 3,5 ppm e 5,2 ppm, respectivamente, são
atribuídos ao núcleo de hidrogênio na posição 2 do anel da unidade desacetilada, no qual o
grupo amino está presente (H-2(D)) e ao próton anomérico da unidade desacetilada (H-1(D)).
H-8(Ac) H-2(D)A
GA % = × 100 3 × A
H-8(Ac)
H-2/6
1 × A 3
GD % 1 100
1 × A 6
H-1(D)
H-8(Ac) H-1(D)
A
GD % 100
A
A +
3
A região mais larga do espectro, compreendida entre 3,8 e 4,2 ppm, é relativa aos demais hidrogênios pertencentes à estrutura da quitosana (H-2/6).
Figura 3.3 - Espectro de RMN 1H de uma amostra de quitosana
Fonte: Autor
3.1.2.2 Solubilidade
Do ponto de vista prático, a solubilidade permite a distinção entre a quitosana e o seu precursor de modo simples e rápido. A quitina apresenta uma afinidade limitada por solventes devido às fortes ligações de hidrogênio intra e intermoleculares. É solúvel especialmente em
N,N-dimetilacetamida contendo 5 a 10 % de cloreto de lítio e em alguns solventes que contêm
Os ácidos mais comuns usados para dissolver a quitosana são o ácido acético e o ácido clorídrico. Em soluções ácidas diluídas, a quitosana tem o comportamento típico de polieletrólito catiônico devido à protonação dos grupos amino (NH2). A reação de equilíbrio, que descreve o estado de ionização da quitosana, é apresentada na Equação 3.4.
(3.4)
A solubilidade da quitosana em meio ácido está relacionada com a quantidade de
grupos amino protonados (NH3+) na cadeia polimérica. Quanto maior a quantidade destes
grupos protonados, maior a repulsão eletrostática entre as cadeias e, consequentemente, maior
a solvatação do polímero em água, facilitando a dissolução. Para uma dada concentração de ácido, o grau de protonação depende do pK do ácido usado para solubilizar a quitosana (Rinaudo, Pavlov et al., 1999; Santos, Soares et al., 2003). A solubilização da quitosana em
solução de ácido acético ou ácido clorídrico ocorre para um grau de protonação de aproximadamente 0,5. Em meio ácido, os grupos amino da quitosana são protonados e o polímero torna-se solúvel em solução aquosa. Entretanto, após a dissolução em condições ácidas, quando o pH da solução é aumentado, os grupos amino têm suas cargas positivas reduzidas e ao atingir um pH em torno de 6,5 a quitosana precipita na solução aquosa (Pillai, Paul et al., 2009; Rinaudo, 2006; Sogias, Khutoryanskiy et al., 2010).
A remoção da maioria dos grupos acetilados da estrutura da quitina gera efeitos significativos para a solubilidade da quitosana em água. Essa condição reduz em parte as ligações de hidrogênio, já que os grupos acetilados também são potenciais em ligações de hidrogênio. Além disso, origina os grupos amino, os quais promovem as cargas positivas na macromolécula em meio ácido, causando repulsão entre os grupos vizinhos carregados e, consequentemente, inibindo as interações polímero-polímero que favorecem o aumento da natureza hidrofílica do biopolímero. Assim, a diminuição das ligações de hidrogênio entre as cadeias combinado com o aumento do caráter hidrofílico da macromolécula ocasiona o aumento da solubilidade da quitosana em solução aquosa. Como em sistemas de polieletrólitos catiônicos, bons solventes usados para a dissolução da quitosana devem ter a habilidade de impedir as ligações de hidrogênio entre as interações polímero-polímero e conferir acidez no ambiente de dissolução, aumentando as interações polímero-solvente (Weinhold, 2010).
+ +
2 3 3 2
Diversos parâmetros interferem na solubilidade da quitosana, tais como o grau de acetilação e sua distribuição ao longo da cadeia, a massa molar, as condições de extração e secagem do polissacarídeo, o pH da solução, a concentração de polímero e a força iônica do meio. Todos estes fatores citados acima são importantes para o estudo das propriedades da quitosana em solução (Casettari, Vllasaliu et al., 2012; Nyström, Kjøniksen et al., 1999;
Pillai, Paul et al., 2009; Rinaudo, 2006).
De acordo com Signini e Campana-Filho (2001), diferentes procedimentos de purificação de um mesmo tipo de quitosana podem resultar em amostras de quitosana distintas quanto à solubilidade, hidrofilicidade e características morfológicas. Há processos de purificação em que os sítios responsáveis pela formação de ligações de hidrogênio não são modificados, consequentemente, as interações intra e intermoleculares não são alteradas e o seu empacotamento não é modificado, deste modo, dificultando a solubilização da quitosana. Entretanto, há metodologias de purificação da quitosana em que a presença de cargas/contraíons dificulta as interações inter e intra-cadeias, minimizando o empacotamento entre as cadeias e, assim, favorecendo o processo de solubilização (Signini e Campana-Filho, 2001).
De um modo geral, a quitosana é insolúvel em soluções aquosas com pH neutro e alcalino, em álcool, acetona e na maior parte de solventes orgânicos, sendo estes sistemas importantes para os processos de precipitação e purificação da quitosana. A dificuldade de solubilização da quitosana está relacionada à sua regularidade estrutural (natureza cristalina), a ocorrência de intensas ligações de hidrogênio inter e intramoleculares entre as cadeias do biopolímero e a quantidade e distribuição não homogênea dos grupos acetamido ao longo da macromolécula. Esse comportamento pode ser atribuído à preservação parcial de domínios estruturais remanescentes da quitina, onde as interações associativas predominam na cadeia polimérica, favorecendo a agregação e diminuindo a solubilidade da quitosana (Craveiro, Craveiro et al., 1999; Peesan, Sirivat et al., 2006; Philippova, Korchagina et al., 2012; Sogias, Khutoryanskiy et al., 2010; Sugimoto, Morimoto et al., 1998).
hidrofóbico tem tendência a formar dispersões de agregados. À medida que o GA na quitosana aumenta, o comportamento eletrostático é menos acentuado (quantidade menor de cargas na cadeia) e, assim, diminui a dependência da solubilidade em função do pH devido à formação de uma conformação molecular menos sensível a variação de pH (Schatz, Pichot et
al., 2003).
Figura 3.4 – Variação do pH crítico em função do grau de acetilação
Fonte: (Schatz, Pichot et al., 2003)
O efeito do grau de acetilação na solubilidade da quitosana foi avaliado através da comparação de amostras em três condições diferentes, quitosana comercial com GA 14 %, completamente desacetilada e 52 % acetilada. Os resultados mostraram que a quitosana com 52 % acetilada permaneceu solúvel até o pH 7,4 e apresentou menor índice de cristalinidade. A quitosana com GA 14 % e a desacetilada precipitaram em solução em pH 6 e 5,8, respectivamente. A amostra completamente desacetilada teve o maior grau de cristalinidade. Segundo os colaboradores, a protonação dos grupos amino e a cristalinidade são os dois principais fatores que governam a solubilidade da quitosana. Entretanto, a cristalinidade da amostra foi o fator limitante na solubilidade. Além disso, a quitosana 52 % acetilada, quando em presença de ureia ou cloreto de guanidínio, permaneceu solúvel em ampla faixa de pH (1 - 12) (Sogias, Khutoryanskiy et al., 2010).
O efeito do grupo acetamido na variação da estrutura cristalina da quitosana indica que a modificação do GA pode ser usada para controlar a solubilidade da quitosana (Pillai, Paul et al., 2009). A quitosana pode ter a sua solubilidade ampliada através do controle do grau de
cadeia (Kubota, Tatsumoto et al., 2000; Lu, Song et al., 2004; Qin, Li et al., 2006). Kubota e
colaboradores (2000) propuseram uma metodologia para obter quitosana solúvel em água e em solventes orgânicos. A massa molar da quitosana foi reduzida usando borato de sódio, em seguida realizou-se uma N-acetilação controlada com anidrido acético em meio homogêneo. Obtiveram amostras com 50 % de unidades acetiladas distribuídas aleatoriamente cuja solubilidade também aumentou com a diminuição da massa molar (Kubota, Tatsumoto et al.,
2000).
Lu e colaboradores (2004) após terem obtido quitosana (GA 50%) solúvel em água, utilizaram duas rotas para recuperar a quitosana da solução, coagulação por etanol e precipitação alcalina, em seguida, analisaram a solubilidade em água. A quitosana regenerada por etanol foi solúvel posteriormente, mas o método alcalino resultou em insolubilidade. Dados de difratogramas de raios-X revelaram que a amostra insolúvel obteve um aumento do grau de cristalinidade (Lu, Song et al., 2004).
A literatura descreve diferentes modificações químicas na estrutura da quitosana, através da funcionalização dos grupos amino e/ou hidróxidos, para melhorar a afinidade da quitosana em água e em solventes orgânicos. Derivados de quitosana têm sido obtidos através de diversas reações, incluindo carboxilação (Chen e Park, 2003), quaternização, alquilação (Desbrières, 2004), acilação (Kubota, Tatsumoto et al., 2000; Qin, Li et al., 2006) e
graftização (Gorochovceva, Naderi et al., 2005; Mai-Ngam, 2006; Muslim, Morimoto et al.,
2001; Liu, Lu et al., 2009; Yang, Guo et al., 2010; Yuan, Zhao et al., 2011). A incorporação
de estruturas hidrofílicas ou de uma pequena quantidade de grupos hidrofóbicos à cadeia linear da quitosana pode alterar propriedades como a solubilidade e a flexibilidade do polímero, tornando seus derivados solúveis em solventes aquosos e/ou orgânicos. No entanto, estas propriedades dependem da estrutura molecular, do comprimento e da distribuição dos grupos laterais inseridos na cadeia polimérica (Desbrières, 2004; Yang, Chou et al., 2002).
Yang e colaboradores (2002) prepararam derivados de quitosana por N-alquilação
utilizando monossacarídeos e dissacarídeos, incluindo glucose, galactose, glicosamina, frutose, lactose, maltose e celobiose. Todos os derivados com monossacarídeos foram solúveis em pH abaixo de 7 com o comportamento de solubilidade similar à quitosana. No entanto, os derivados com dissacarídeos foram mais solúveis e estáveis em água destilada e em pH acima de 7. Portanto, a solubilidade da quitosana pode ser melhorada através da N-alquilação com dissacarídeos (Yang, Chou et al., 2002). Do mesmo modo, Tømmeraas e
colaboradores (2002) conseguiram derivados solúveis em toda faixa de pH através da modificação da quitosana com oligossacarídeos (Tømmeraas, Köping-Höggard et al., 2002).
Os derivados carboxilados de quitosana são polímeros anfóteros cuja solubilidade depende do pH. Esses derivados têm a solubilidade melhorada em água com pH acima de 7, porém pode ocorrer a separação de fases entre pH 2,5 e 6,5 em função do grau de substituição dos grupos carboxilados e da relação entre as cargas positivas e negativas no polímero em solução (Chen e Park, 2003).
3.1.3 Modificação Química
Ao longo dos últimos anos, a produção industrial da quitosana tem apresentado um elevado crescimento e as suas aplicações têm se desenvolvido em diversas áreas. O aumento da utilização da quitosana deve-se, principalmente, as suas propriedades, a sua natureza catiônica e a possibilidade de numerosas modificações em sua estrutura. A presença de grupos reativos na composição da quitosana, NH2 e OH, permitem diversas alterações estruturais as quais são responsáveis por mudanças no desempenho das propriedades físico-químicas do polímero e expansão dos seus campos de aplicação (Alves e Mano, 2008; Casettari, Vllasaliu
et al., 2012; Chen, Mi et al., 2011; Craveiro, Craveiro et al., 1999; Sashiwa e Haiba, 2004;
Kumar, 2000; Kurita, 2001; Kumirska, Weinhold et al., 2011; Mourya e Inamdar, 2008;
Philippova e Korchagina, 2012; Pillai, Paul et al., 2009; Prashanth e Tharanathan, 2007;
Rinaudo, 2006).
hidroxila secundário, este último requer um agente desprotonante para tornar-se pré-disponível à reação (Rinaudo, 2006; Xu, Mccarthy et al., 1996).
Na modificação química dos polímeros, a síntese pode ocorrer em condições reacionais homogêneas ou heterogêneas. Usualmente, o meio heterogêneo é acompanhado de diversos problemas, pode haver um menor grau de substituição, ocorrência de reação de forma localizada apenas nos sítios acessíveis da cadeia macromolecular, menor controle de reação e degradação parcial dos produtos provocada por condições mais severas empregadas durante o procedimento. Sendo assim, as propriedades dos produtos obtidos por uma modificação química podem ser bem diferentes em função da reação ocorrer em meio homogêneo ou heterogêneo, mesmo quando todas as demais condições reacionais são mantidas constantes (Kurita, 2001).
Há várias possibilidades de preparar derivados funcionais de quitosana, e muitos trabalhos têm sido propostos na literatura. As modificações típicas incluem reações de hidrólise, acetilação, carboxilação, acilação, formação de base de Schiff, sulfonação, alquilação, quaternização, oxidação, copolimerização por graftização, dentre outras (Casettari, Vllasaliu et al., 2012; Kurita, 2001; Philippova e Korchagina, 2012; Pillai, Paul et al., 2009;
Rinaudo, 2006).
Figura 3.5 - Reações para obtenção de derivados de quitosana
Fonte: (Santos, 2004)
A quitosana comporta-se como polímeros anfifílicos catiônicos, porém as suas características específicas relativas aos grupos anfifílicos podem ser potencializadas através da inserção de grupos hidrofóbicos, utilizando, por exemplo, a reação de alquilação redutiva. Os polímeros anfifílicos são constituídos de uma cadeia hidrofílica com uma pequena quantidade de grupos hidrofóbicos. Em meio aquoso, os grupos hidrofóbicos se associam para minimizar o seu contato com a água, gerando agregados intra e/ou intermoleculares. Os agregados formados pelas interações atrativas combinado com as repulsões eletrostáticas nos polieletrólitos levam a um aumento significativo da viscosidade da solução polimérica. Os polieletrólitos modificados hidrofobicamente têm sido usados em inúmeros processos tecnológicos (Barany e Szepesszentgyörgyi, 2004; Bratskaya, Avramenko et al., 2006; Desbrières, Martinez et al., 1996; Desbrières, 2004; Nyström, Kjoniksen et al., 1999;
3.1.3.1 Aminação Redutiva (ou Alquilação Redutiva) da Quitosana
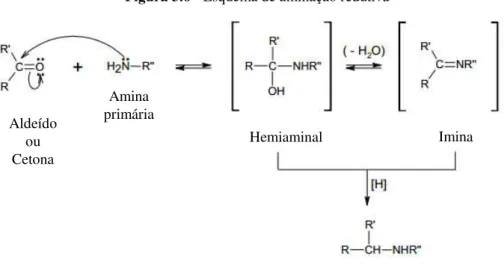
A reação de aminação redutiva ocorre quando o carbono da carbonila de aldeído ou cetona sofre um ataque nucleofílico da amina primária formando o intermediário hemiaminal ou imina, os quais, em seguida, sofrem redução para resultar em um produto N-alquila ou N
-arila. Uma representação para esta reação é mostrada na Figura 3.6. A formação de iminas (C=N), base de Schiff, geralmente ocorre mais rapidamente entre pH 4 e 5, pois a reação é processada por ataque nucleofílico do nitrogênio com caráter básico ao átomo de carbono do grupo carbonila. A reação segue mais lentamente em pH muito baixo ou muito alto. Para favorecer a reação, a solução deve ser suficientemente ácida para que o composto carbonílico se encontre protonado, tornando o carbono ainda mais suscetível ao ataque do nucleófilo, mais não tão ácida ao ponto da concentração de nitrogênio livre (nucleófilo) se tornar muito baixa, o que dificultaria a reação (Solomons e Fryhle, 2006).
Figura 3.6 - Esquema de aminação redutiva
Aldeído ou Cetona
Hemiaminal Amina
primária
Imina
Amina secundária
Fonte: (Solomons e Fryhle, 2006)
quitosana (Desbrières, Martinez et al., 1996; Kurita, 2001; Rinaudo, 2006). Alguns exemplos
de quitosana modificada obtidos pela reação de aminação redutiva são apresentados a seguir para ilustrar a diversificação de possibilidades de derivados.
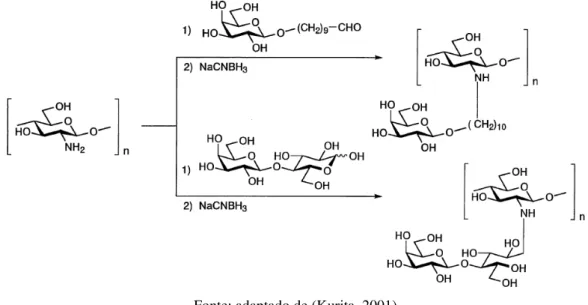
Kurita (2001) relatou trabalhos das décadas de 80 e 90 sobre derivados de quitosana por N-alquilação redutiva com substituintes que visam melhorar a solubilidade da quitosana e aumentar a sua capacidade seletiva de adsorção por metais. Na presença de açúcares redutores, incluindo glucose, galactose, lactose e celobiose, e cianoborohidreto de sódio (agente redutor), a N-alquilação redutiva ocorre através da reação dos grupos amino da quitosana e o grupo aldeído do açúcar, seja este na forma de cadeia aberta ou com o aldeído incorporado como substituinte nos açúcares. Do mesmo modo, outros compostos que contêm o grupo aldeído são capazes de reagir com os grupos amino da quitosana e, na presença de agente redutor, proceder à reação de N-alquilação redutiva (Kurita, 2001).
As Figuras 3.7 e 3.8, respectivamente, mostram alguns modelos de reação de N-alquilação redutiva da quitosana, utilizando açúcares e diferentes grupos funcionais
substituídos, contudo, o grupo aldeído está presente em todos os reagentes como grupo ativo
para a reação.
Figura 3.7 - Reações de N-alquilação redutiva da quitosana com açúcares
Figura 3.8 - Reações de N-alquilação redutiva da quitosana com diferentes grupos funcionais substituídos
Fonte: adaptado de (Kurita, 2001)
O grupo cetona também pode ser utilizado para a reação de N-alquilação redutiva da quitosana, como é o caso da obtenção dos derivados N-carboximetilquitosana e N
-carboxibutilquitosana (Figura 3.9), mediante a utilização do ácido glioxílico e ácido levulínico, respectivamente. Nestes casos, a reação se dá entre os grupos amino da quitosana e o grupo cetona. De modo similar, muitos outros derivados têm sido preparados com ácidos carboxílicos contendo um grupo cetona ou aldeído. A solubilidade desses polímeros em meio ácido, neutro e básico é explicada pelo caráter anfótero adquirido após a reação, resultando em derivados com ambos os grupos amino e carboxílico (Kurita, 2001).
Figura 3.9 - Reação de N-alquilação redutiva da quitosana com grupo cetona
Fonte: (Kurita, 2001)
Rinaudo e colaboradores (2001) obtiveram os derivados N-carboxibutilquitosana e N
ao derivado monocarboxilado linear, enquanto que uma adição lenta gerou a forma cíclica (Rinaudo, Desbrières et al., 2001).
Dos Santos e colaboradores (2005) descreveram uma metodologia para otimização da síntese da carboxibutilquitosana através do planejamento fatorial 32. Esse estudo verificou, que ao utilizar as proporções molares entre 1 e 3 mol de ácido levulínico por mol de quitosana e 0,5 a 1 mol de borohidreto de sódio por mol de quitosana, o aumento da concentração molar de ácido levulínico favoreceu a formação da N-carboxibutilquitosana, enquanto que o
aumento da concentração do agente redutor favoreceu a ciclização do grupo carboxílico para a formação da 5-metilpirrolidinona quitosana (Dos Santos, Silva et al., 2005).
Mais recentemente, Kurita e Isogai (2010), utilizando acetona e ácido levulínico como reagentes para a obtenção dos derivados de quitosana N-isopropil e 5-metil-pirrolidinona,
respectivamente, alcançaram um GS maior em meio reacional aquoso com pH inicial entre 4,5 e 5,0 e temperatura ambiente. Além disso, nenhuma despolimerização ocorreu na quitosana sob as condições usadas na reação de N-alquilação redutiva (Kurita e Isogai, 2010).
Para melhorar a afinidade da quitosana por solventes orgânicos, Kurita e colaboradores (2002) prepararam, inicialmente, bases de Schiff através da reação dos grupos amino da quitosana com os aldeídos formaldeído, acetaldeído e pentaldeído. As bases de Schiff foram reduzidas com NaCNBH3 para formar N-alquilquitosanas. Estes derivados foram posteriormente acetilados com anidrido acético visando aumentar o grau de grupos acetamido na cadeia polimérica. O grau de substituição foi calculado por análise elementar utilizando a relação C/N e variou de acordo com a quantidade de aldeído utilizado. O aumento de grupos hidrofóbicos na cadeia da quitosana favoreceu a interação com solventes orgânicos (Kurita, Mori et al., 2002).
amostras poliméricas em solução foram a natureza e o número de sítios hidrofóbicos, a
concentração do polímero, a temperatura e a força iônica do meio (Desbrières, Martinez et al.,
1996; Desbrières, 2004).
Donati e colaboradores (2005) reportaram propriedades biológicas da quitosana modificada por N-alquilação redutiva com a inserção de lactose. As proporções molares utilizadas na reação foram 0,8 e 2,5 de lactose, 2 e 6 de NaCNBH3 por unidade repetitiva de quitosana, os colaboradores conseguiram obter derivados com grau de substituição (GS) 9 e 64 %, respectivamente. A inserção de grupos flexíveis e hidrofílicos levou a uma diminuição da viscosidade intrínseca do polímero. No entanto, os colaboradores asseguraram que o procedimento de derivatização não induziu a degradação da cadeia polimérica, mesmo utilizando excesso de agente redutor (Donati, Stredanska et al., 2005).
Ngimhuang e colaboradores (2004) obtiveram derivados de quitosana com propriedades surfactantes e potencial aplicabilidade no controle e liberação de espécies bioativas. Os colaboradores empregaram a reação de N-alquilação redutiva da quitosana
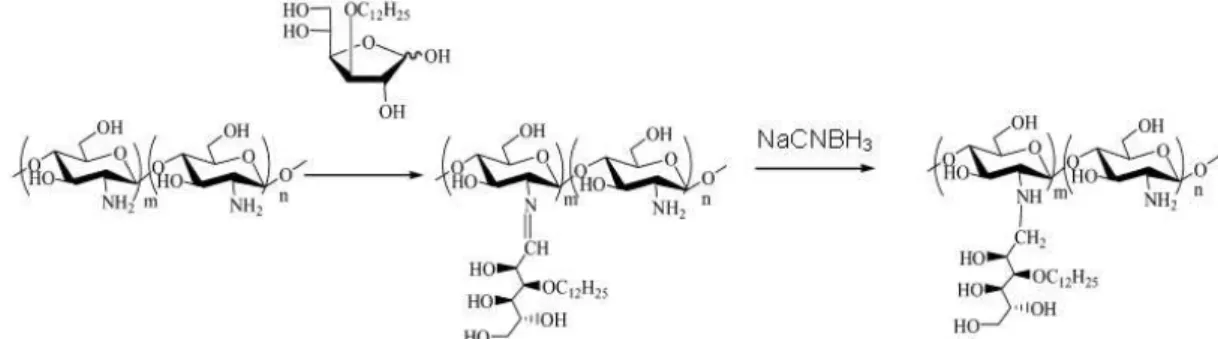
utilizando o composto 3-O-dodecil-D-glucose pré-sintetizado (Figura 3.10). Esses derivados
foram obtidos com valores de GS 9,8 e 27 %, sendo solúveis em meio aquoso e em solventes
orgânicos. O derivado com menor GS obteve maior solubilidade em água. Entretanto, o derivado com maior GS proporcionou maior estabilidade para a formação de micelas em solução aquosa de ácido acético 0,1 %. Esse resultado sugeriu que o balanço hidrofílico/hidrofóbico na estrutura da quitosana é essencial para a sua solubilidade em água, e um GS mais elevado de grupos hidrofóbicos na cadeia macromolecular facilita a agregação em micelas (Ngimhuang, Furukawa et al., 2004).
Figura 3.10 - Reação de N-alquilação redutiva da quitosana com 3-O-dodecil-D-glucose
No mesmo segmento com propriedades de surfactantes através da N-alquilação redutiva, Mai-Ngam (2006) obteve derivados de quitosana com atividade bactericida. O autor inseriu grupos hidrofóbicos na cadeia da quitosana utilizando aldeído alifático com seis carbonos e, simultaneamente, introduziu grupos hidrofílicos usando poli(óxido de etileno) com um grupo terminal aldeído. A incorporação das cadeias hidrofóbicas (C6), aparentemente, induziu as agregações moleculares, enquanto que as cadeias laterais dos grupos hidrofílicos facilitaram a solubilização no meio aquoso e funcionaram como uma barreira, prevenindo a adesão de bactérias na superfície de silicone (Mai-Ngam, 2006).
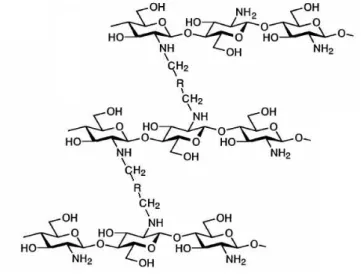
A reação de N-alquilação redutiva da quitosana com dialdeídos forma polímeros com ligações cruzadas. Essa reação ocorre entre dois grupos amino da quitosana com apenas uma molécula de dialdeído envolvendo ambos os grupos aldeídos da molécula, resultando na reticulação, um sistema de rede tridimensional que, nesse caso, são interligados por dois grupos N-alquil, quando em presença de agente redutor para a redução dos grupos imino
pré-formados (Figura 3.11).
Figura 3.11 - Representação de ligações cruzadas na quitosana
Fonte: Autor
aldeído livre, sendo comumente usado em reações subseqüentes; (b) formação de ligações cruzadas entre moléculas livres do glutaraldeído e a quitosana e (c) formação de ligações cruzadas entre moléculas maiores de glutaraldeído polimerizado (contendo ligações C=C) e a quitosana (Monteiro Jr. e Airoldi, 1999).
Ramos e colaboradores (2006) prepararam derivados de quitosana com ligações cruzadas utilizando poli(etileno glicol) ligados a grupos aldeído nos dois extremos da cadeia (OHC-PEG-CHO). Inicialmente, a quitosana foi modificada para quitosana-N-metilfosfônica
(NMPC). Em seguida, realizou-se a N-alquilação redutiva com o PEG-dialdeído de massas molares diferentes (200, 2000, 8000 g/mol) e o NaBH4 (agente redutor). A modificação produziu o inchamento do derivado de quitosana em água (pH neutro e alcalino) e foi solúvel em pH ácido. O grau de substituição foi de 9, 3 e 2 % para os derivados de quitosana-PEG-200, 2000 e 8000, respectivamente. O aumento da cadeia hidrofílica (PEG) elevou a absorção de água do polímero, no entanto, a retenção de água em função do tempo foi diminuída (Ramos, Rodríguez et al., 2006).
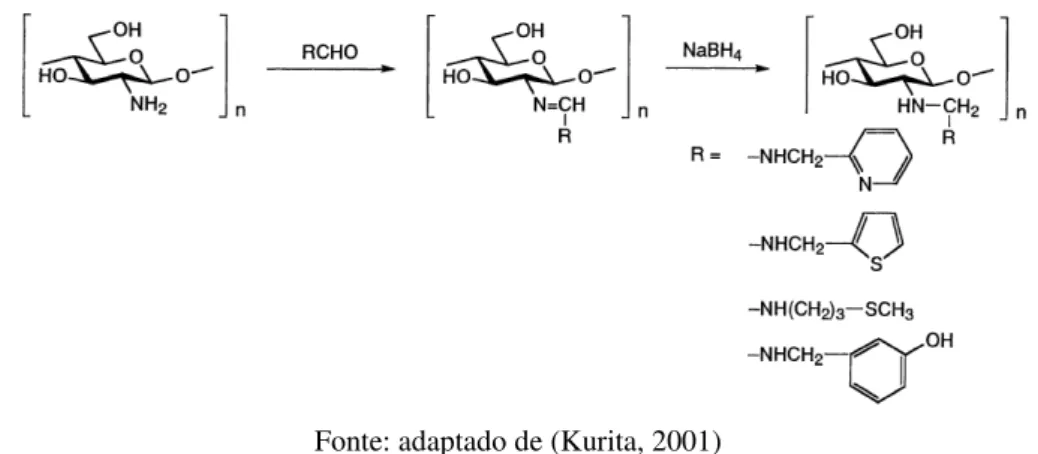
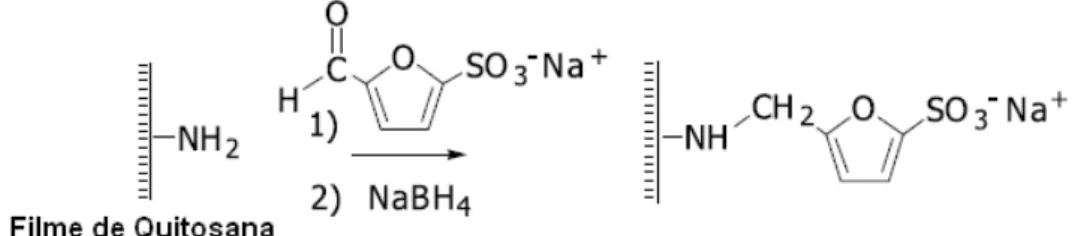
Hoven e colaboradores (2007) modificaram a superfície de filmes de quitosana com grupos sulfonato, carregados negativamente, reagindo os grupos amino da quitosana com o grupo aldeído, substituinte do ácido furano-2-sulfônico. A reação ocorreu à temperatura ambiente e as amostras foram reduzidas com NaBH4 (Figura 3.12). A extensão da modificação da superfície da quitosana em meio heterogêneo foi resultante da variação do tempo de reação e da concentração dos reagentes. Os filmes da quitosana modificada exibiram propriedades de adsorção seletiva por proteínas. A adsorção foi explicada em função das interações de atração e repulsão eletrostática (Hoven, Tangpasuthadol et al., 2007).
Figura 3.12 - Reação de N-alquilação redutiva na superfície da quitosana
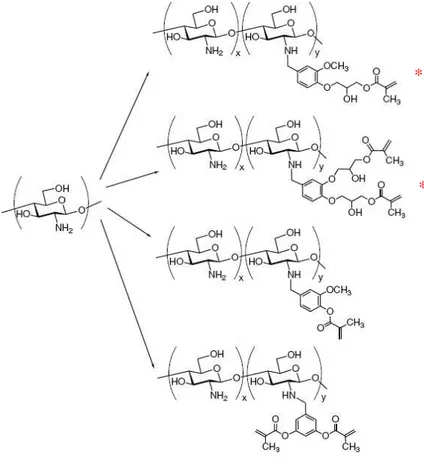
Renbutsu e colaboradores (2007) prepararam derivados de quitosana usando aldeídos fotossensíveis como grupos laterais inseridos na quitosana por N-alquilação redutiva (Figura 3.12). Durante a redução das bases de Schiff, parte dos grupos ésteres dos derivados assinalados (*) na Figura 3.13 sofre hidrólise quando utilizado o agente redutor NaBH4. Entretanto, esse comportamento não ocorreu quando foi usado NaCNBH3. Os demais derivados resistiram às condições de pH alto com a utilização de NaBH4, como agente redutor. Os derivados de quitosana foram transformados em gel quando submetidos à irradiação ultravioleta e alcançaram melhor solubilidade em solventes orgânicos do que a quitosana não modificada. Esses compostos apresentaram boa capacidade de adsorção de paládio em pH ácido, sendo útil para imobilizar catalisadores de paládio, também tiveram êxito como material de revestimento para galvanização, sem uso de eletrodos, em substâncias não condutoras (Renbutsu, Okabe et al., 2007, 2008).
Figura 3.13 - Reação de N-alquilação redutiva com aldeídos fotossensíveis
Fonte: adaptado de (Renbutsu, Okabe et al., 2007)
*
Concernente aos derivados de quitosana obtidos por aminação redutiva, maior atenção tem sido dada à ênfase da síntese de quitosana com substituintes N-alquila. No entanto, os
derivados N-arila também apresentam propriedades e aplicações importantes, conforme visto
acima. Sajomsanga e colaboradores (2008) investigaram a influência dos grupos doadores de elétrons e retiradores de elétrons substituídos em aldeídos aromáticos na síntese de N
-arilquitosana através da aminação redutiva. O grau de substituição foi dependente da razão molar entre o aldeído e as unidades amino da quitosana, do tempo de reação e do substituinte no anel aromático. Os polímeros apresentaram um grau de substituição menor quando foram utilizados os aldeídos aromáticos com substituintes doadores de elétrons (Sajomsanga, Tantayanon et al., 2008).
Rabea e colaboradores (2006) obtiveram quitosana com substituintes N-alquila e N
-arila que apresentaram atividades fungicidas e inseticidas superiores a da própria quitosana. Em pesquisas mais recentes (2009), os resultados mostraram que a modificação química da quitosana com os aldeídos aromáticos aumentou a atividade biológica contra bactérias e fungos patogênicos de plantas. Estes resultados trazem perspectivas de que os derivados de quitosana têm potencial de tornarem-se alternativas para o controle das doenças em plantas, em vez de alguns pesticidas nocivos (Rabea, Badawy et al., 2006, 2009).
Em estudos referentes à quitosana modificada por N-alquilação redutiva, publicamos em 2009 um artigo que relata a obtenção de derivados de quitosana usando glutaraldeído e 3-amino-1-propanol na presença de borohidreto de sódio. A modificação na estrutura da quitosana resultou em derivados com ação viscosificante. A solubilidade dos polímeros em solução aquosa ácida diminuiu com o aumento da razão molar de glutaraldeído e 3-amino-1-propanol em relação à quitosana. O agente redutor e a atmosfera inerte no meio reacional contribuíram para aumentar a solubilidade e a viscosidade da solução polimérica (Alves, Vidal et al., 2009).
uma das formas de inserir o PEG é através da reação de N-alquilação redutiva (Casettari, Vllasaliu et al., 2012).
3.1.3.2 QUITOSANA-g-PEG
PEG é um polímero sintético com fórmula estrutural H-(O-CH2-CH2)n-OH, onde n é o número médio de unidades repetidas, óxido de etileno, na estrutura química. Comercialmente, ele é encontrado em uma grande variedade de massas moleculares. É um polímero solúvel em água e em solventes orgânicos como acetona e etanol, sendo insolúvel em éter e hidrocarbonetos alifáticos. PEG é um polímero muito utilizado como produto farmacológico devido à sua biocompatibilidade, também é usado como agente dispersante (Abdel-Mohsen, Aly, et al., 2012; Casettari, Vllasaliu et al., 2012; Gorochovceva, Naderi et al., 2005).
Para a obtenção de quitosana ramificada com PEG (quitosana-g-PEG), as hidroxilas
terminais do PEG devem ser modificadas para um grupo funcional mais reativo que permita a funcionalização nos grupos amino ou hidroxilas da quitosana. A ativação do PEG pode ser obtida com diferentes funções químicas, tais como aldeído, ácido carboxílico, epóxido, tosilato, carbonato de p-nitrofenila, sulfonato, azida, maleimida e éster succinimida (Casettari, Vllasaliu et al., 2012; Gorochovceva, Naderi et al., 2005). Quando o PEG com a função
hidroxila bifuncional nas extremidades da sua cadeia é ativado para modificar a estrutura da quitosana, ocorre reticulação entre as cadeias e produto final reticulado tem a sua solubilidade reduzida em meio aquoso. Assim, o análogo monofuncional metóxi-poli(etileno glicol), mPEG, que apresenta uma metila e uma hidroxila como grupos terminais tem sido utilizado em vez do PEG para modificar a quitosana, pois evita a formação de ligações cruzadas durante a modificação química (Abdel-Mohsen, Aly, et al., 2012; Bentley, Roberts, et al.,
1998; Casettari, Vllasaliu et al., 2012; Gorochovceva, Naderi et al., 2005; Hu, Jiang et al.,
2005; Jeong, Kim et al., 2008; Yao, Zhang et al., 2007; Zhang, Zhang et al., 2008).
A reação de alquilação redutiva tem sido bastante empregada para a obtenção de quitosana-g-mPEG, pois várias vantagens envolvem o uso dessa metodologia
(Abdel-Mohsen, Aly, et al., 2012; Bentley, Roberts, et al., 1998; Du e Hsieh, 2007; Gorochovceva,
Naderi et al., 2005; Muslim, Morimoto et al., 2001; Sugimoto, Morimoto et al., 1998; Yao,
Zhang et al., 2007; Zhang, Zhang et al., 2008). A seletividade da reação com substituição
aquoso, pH da solução não agressivo (pH 5-6) e temperatura ambiente. Além disso, a reação ocorre em sistema homogêneo. A modificação química realizada em condições homogêneas evita uma distribuição não uniforme das unidades substituintes na cadeia da macromolécula (Casettari, Vllasaliu et al., 2012; Desbrières, Martinez, et al., 1996; Kurita, 2001; Rinaudo,
2006).
O processo de modificação da quitosana com PEG por alquilação redutiva inicia com a oxidação da hidroxila terminal do PEG para a função aldeído. Após a reação, o PEG-aldeído obtido é separado por (re)precipitações em solventes orgânicos, filtrações e secagem, para posterior inserção na quitosana (Abdel-Mohsen, Aly, et al., 2012; Bentley, Roberts, et al.,
1998; Du e Hsieh, 2007; Gorochovceva, Naderi et al., 2005; Muslim, Morimoto et al., 2001;
Sugimoto, Morimoto et al., 1998).
Em geral, a síntese de quitosana-g-mPEG através da alquilação redutiva resulta em
copolímeros com baixo grau de substituição. Porém, a maioria das outras metodologias de reação usada para aumentar o grau de incorporação de PEG na cadeia polimérica da quitosana é complexa. Muitos métodos utilizam várias etapas de reação, seja através da inserção de grupos protetores, a fim de obter quimioseletividade, ou na elaboração de PEG ativado com grupos funcionais mais reativos. Recursos como catalisadores também são utilizados, mais removê-los do produto final torna-se dificultoso (Abdel-Mohsen, Aly, et al., 2012; Casettari,
Vllasaliu et al., 2012; Sugimoto, Morimoto et al., 1998). No entanto, a obtenção de quitosana-g-PEG com baixo grau de substituição de elevada massa molar de mPEG favorece a
solubilidade em água e pode manter mais facilmente a estrutura da quitosana preservada, conservando importantes propriedades peculiar a natureza original. Nesse caso, um baixo grau de substituição na quitosana torna-se uma vantagem (Sugimoto, Morimoto et al., 1998).