ww w . r e u m a t o l o g i a . c o m . b r
REVISTA
BRASILEIRA
DE
REUMATOLOGIA
Artigo
original
Ácidos
graxos
ômega-3,
estado
inflamatório
e
marcadores
bioquímicos
de
pacientes
com
lúpus
eritematoso
sistêmico:
estudo
piloto
夽
Mariane
Curado
Borges
a,
Fabiana
de
Miranda
Moura
dos
Santos
b,
Rosa
Weiss
Telles
c,
Marcus
Vinícius
Melo
de
Andrade
c,
Maria
Isabel
Toulson
Davisson
Correia
de
Cristina
Costa
Duarte
Lanna
b,∗aSecretariadeEstadodeSaúdedoDistritoFederal,Coordenac¸ãoGeraldeSaúdedaCrianc¸aeAleitamentoMaterno(CGSCAM),Brasília,
DF,Brasil
bUniversidadeFederaldeMinasGerais(UFMG),FaculdadedeMedicina,DepartamentodoAparelhoLocomotor,BeloHorizonte,MG,
Brasil
cUniversidadeFederaldeMinasGerais(UFMG),FaculdadedeMedicina,DepartamentodeClínicaMédica,BeloHorizonte,MG,Brasil
dUniversidadeFederaldeMinasGerais(UFMG),FaculdadedeMedicina,DepartamentodeCirurgia,BeloHorizonte,MG,Brasil
informações
sobre
o
artigo
Históricodoartigo:
Recebidoem1deabrilde2016 Aceitoem30deagostode2016 On-lineem22desetembrode2016
Palavras-chave: Ômega-3 Citocinas Adipocinas ProteínaC-reativa
Lúpuseritematososistêmico
r
e
s
u
m
o
Introduc¸ão:Estudostêmmostradoqueosácidosgraxosômega-3reduzemasconcentrac¸ões deeicosanoides,citocinas,quimiocinas,proteínaC-reativa(PCR)eoutrosmediadores infla-matórios.
Objetivo:Investigar osefeitosdos ácidosgraxos ômega-3sobreos níveiscirculantesde mediadoresinflamatóriosemarcadoresbioquímicosemmulherescomlúpuseritematoso sistêmico(LES).
Métodos:Ensaio clínico randomizado (ensaio clínico: NCT02524795); randomizaram-se 49mulherescomLES(ACR1982/1997):22paraogrupoômega-3(dosediáriade1.080mg de EPA+200mg de DHA durante 12 semanas)e 27 para ogrupo controle. Os media-dores inflamatórios e marcadores bioquímicos em T0 e T1 no grupo ômega-3 foram comparadospelo teste deWilcoxon. OtesteUde Mann-Whitneyfoiusado para com-pararvariac¸õesdasvariáveismensuradas[V=concentrac¸õespré-tratamento(T0)menos concentrac¸õespós-tratamento(T1)]entreosgrupos.Ump<0,05foiconsiderado significa-tivo.
Resultados:Amediana(intervalointerquartil–IIQ)daidadefoide37anos(29-48),adurac¸ão dadoenc¸afoideseteanos(4-13)anoseoSystemicLupusDiseaseActivityIndex(Sledai-2K)foi de1(0-2).Amediana(IIQ)davariac¸ãonosníveisdePCRentreosdoisgruposmostrouum decréscimonogrupoômega-3,enquantohouveumaumentonogrupocontrole(p=0,008). Asconcentrac¸õesséricasdeIL-6eIL-10,leptinaeadiponectinanãosealteraramapósum tratamentode12semanas.
夽
EstudofeitonaUnidadedeReumatologiadoHospitaldasClínicas,DepartamentosdeSistemaLocomotor,CirurgiaeMedicinaInterna, FaculdadedeMedicina,UniversidadeFederaldeMinasGerais,BeloHorizonte,MG,Brasil.
∗
Autorparacorrespondência.
E-mail:duartelanna@gmail.com(C.C.Lanna).
http://dx.doi.org/10.1016/j.rbr.2016.08.002
0482-5004/© 2016 Publicado por Elsevier Editora Ltda. Este ´e um artigo Open Access sob uma licenc¸a CC BY-NC-ND (http://
Conclusões:Asuplementac¸ãodeômega-3nãoteveimpactosobreasconcentrac¸õesséricasde IL-6,IL-10,leptinaeadiponectinaemmulherescomLESebaixaatividadedadoenc¸a.Houve umadiminuic¸ãosignificativanosníveisdePCR,bemcomoevidênciasdequeoômega-3 podeimpactarsobreocolesteroltotaleLDL.
©2016PublicadoporElsevierEditoraLtda.Este ´eumartigoOpenAccesssobumalicenc¸a CCBY-NC-ND(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Omega-3
fatty
acids,
inflammatory
status
and
biochemical
markers
of
patients
with
systemic
lupus
erythematosus:
a
pilot
study
Keywords: Omega3 Cytokines Adipokines Creactiveprotein
Systemiclupuserythematosus
a
b
s
t
r
a
c
t
Background: Studieshaveshownthatomega-3 fattyacids reducetheconcentrationsof eicosanoids,cytokines,chemokines,C-reactiveprotein(CRP)andotherinflammatory medi-ators.
Objective: Toinvestigatetheeffectsofomega-3fattyacidsoncirculatinglevelsof inflam-matorymediatorsandbiochemicalmarkersinwomenwithsystemiclupuserythematosus (SLE).
Methods: Experimentalclinicalstudy (clinical trial:NCT02524795);49 womenwith SLE (ACR1982/1997) were randomized: 22 to the omega-3 group (daily intake of 1080mg EPA+200mgDHA,for12weeks)and27tothecontrolgroup.Theinflammatorymediators andbiochemicalmarkersatT0andT1inomega-3groupwerecomparedusingWilcoxon test.U-Mann-Whitneytestwasusedtocomparevariationsofmeasuredvariables[V= pre-treatment (T0) minuspost-treatment (T1)concentrations] betweengroups.p<0.05was consideredsignificant.
Results: Themedian(interquartilerange-IQR)ofagewas37(29-48)yearsold,ofdisease durationwas7(4-13)years,andofSLEDAI-2Kwas1(0-2).Themedian(IQR)ofvariationin CRPlevelsbetweenthetwogroupsshowedadecreaseinomega-3groupwhiletherewas anincreaseincontrolgroup(p=0.008).TheserumconcentrationsofIL-6andIL-10,leptin andadiponectindidnotchangeaftera12weektreatment.
Conclusions: Supplementationwithomega-3hadnoimpactonserumconcentrationsof IL-6,IL-10,leptinandadiponectininwomenwithSLEandlowdiseaseactivity.Therewasa significantdecreaseofCRPlevelsaswellasevidencethatomega-3mayimpacttotaland LDL-cholesterol
©2016PublishedbyElsevierEditoraLtda.ThisisanopenaccessarticleundertheCC BY-NC-NDlicense(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Introduc¸ão
Os ácidos graxos ômega-3 têm sido considerados lipídeos anti-inflamatórioscombaseemestudosepidemiológicosem esquimósda Groenlândia, cujadieta érica emácidos gra-xospoli-insaturadosdepeixe.Aprevalênciadedoenc¸ascom componenteinflamatório,comoinfartoagudodomiocárdio, diabetesmellitus,esclerosemúltipla,asmaetireotoxicose,foi menornosesquimósemcomparac¸ãocompopulac¸õesde paí-sesocidentais.1
Os ácidos graxos da família ômega-3(principalmente o ácido ␣-linolênico, eicosapentaenoico[EPA] e docosahexae-noico[DHA]),bemcomoosdafamíliaômega-6(representados principalmentepeloácidolinoleicoeácidoaraquidônico[AA]), sãoessenciaisparaasíntesede eicosanoides,leucotrienos, prostaglandinas, tromboxanos e outros fatores oxidantes, principaismediadoresereguladoresdainflamac¸ão.2,3Estudos têmdemonstradoqueosácidos graxosômega-3controlam a inflamac¸ão por meio da reduc¸ão na proteína C-reativa (PCR), citocinas pró-inflamatórias eicosanoides, quimioci-nase outrosmediadoresinflamatórios.4–7 Além disso, eles
apresentamefeitosbenéficosnaprevenc¸ãoenocontrolede doenc¸ascardiovasculares,dislipidemiasediabetesmellitus.8–13 Olúpuseritematoso sistêmico(LES)éumadoenc¸a infla-matóriaautoimunecaracterizadapelaperdadeequilíbriona regulac¸ão imune celular e aumento nos níveis circulantes de mediadoresinflamatórios.14 Assim,a suplementac¸ãode ômega-3poderepresentarumaterapiaadicionalaindivíduos comLES.Noentanto,poucosesabesobreopapeldesses áci-dosgraxosempacientescomLES,incluindoosefeitossobreas concentrac¸õesdecitocinasinflamatóriasesobreaatividade dadoenc¸a.
Oobjetivodeste estudofoiinvestigarosefeitosdos áci-dosgraxosômega-3sobreosníveiscirculantesdemediadores inflamatórios emarcadoresbioquímicos emmulherescom LES.
Pacientes
e
métodos
UniversidadeFederaldeMinasGerais,UFMG(ensaioclínico: NCT02524795).OComitêdeÉticadaUFMGaprovouoestudo. Todosospacientesforneceramoconsentimentoinformado porescrito.
Participantesdoestudo
Incluíram-sepacientesdosexofemininoqueatenderamaos critériosdeclassificac¸ãorevisadosparaLESdoAmerican Col-legeofRheumatology(ACR)(1982/1997),15comidadesuperior a18anoseinferiora60anosequetomavamdosesestáveis demedicamentosparaotratamentodoLESnosúltimostrês meses.Oscritériosdeexclusãoforam:gravidez,durac¸ãoda doenc¸ademenosdeumano,alergiaapeixe,óleodepeixe ouqualquerprodutocomômega-3,usodeômega-3nosseis mesesanterioresaoestudoediagnósticodediabetesmellitus,
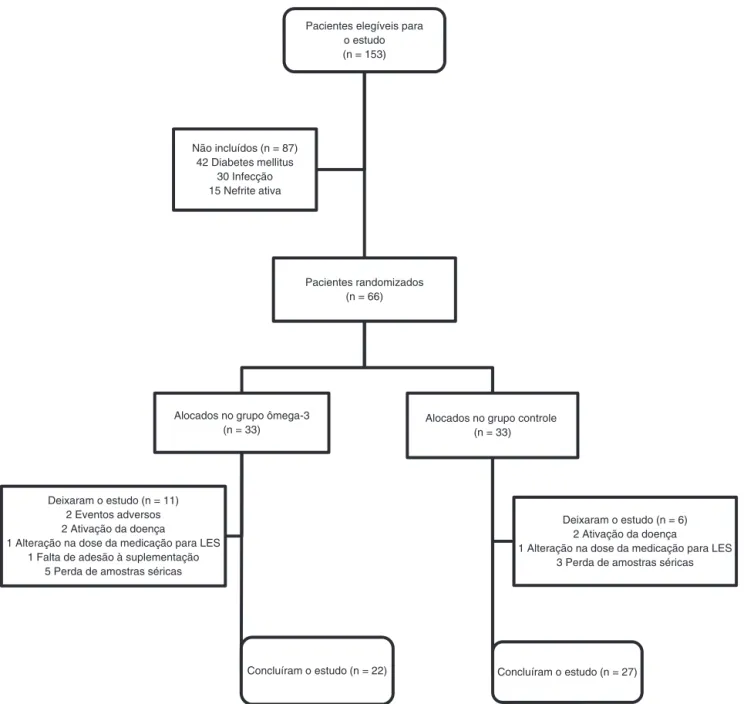
doenc¸a hepática, nefrite ativa, insuficiência renal crônica, qualquertipodeinfecc¸ãonoinícioe/oudurantetodooestudo. Selecionaram-separaoestudo153pacientes;foram incluí-dos66,com33randomizadosparacadagrupo;22mulheres dogrupo deestudoe27 dogrupocontrole completaram o protocolo eforam submetidasàavaliac¸ãonaprimeira ena 12a
semanas(fig.1).
Desenhodoestudo
Realizou-se um ensaio clínico de suplementac¸ão de áci-dos graxos ômega-3 por 12 semanas. As pacientes foram
randomizadas por sorteio em dois grupos: grupo de
estudo (n=22), que recebeu o suplemento Hiomega-3 da empresaNaturalis®(registronoMinistériodaSaúdenúmero 4.1480.0006.001-4), e grupo controle (n=27), que não rece-beu asuplementac¸ão nem placebo. Utilizaram-se cápsulas
Pacientes elegíveis para o estudo (n = 153)
Pacientes randomizados (n = 66)
Alocados no grupo ômega-3 (n = 33)
Concluíram o estudo (n = 22) Deixaram o estudo (n = 11)
2 Eventos adversos 2 Ativação da doença
1 Alteração na dose da medicação para LES 1 Falta de adesão à suplementação
5 Perda de amostras séricas
Alocados no grupo controle (n = 33)
Concluíram o estudo (n = 27) Deixaram o estudo (n = 6)
2 Ativação da doença
1 Alteração na dose da medicação para LES 3 Perda de amostras séricas Não incluídos (n = 87)
42 Diabetes mellitus 30 Infecção 15 Nefrite ativa
deômega-3contendo1gde óleode peixe(540mg deEPAe 100mgdeDHA),eforamorientadasaingerirduascápsulas pordia.Todasasparticipantesforaminstruídasanão consu-miralimentosfontedeômega-3duranteoperíododoestudo. Opesquisador(FMMS)quefezaavaliac¸ãoclínicaedosdados laboratoriaisera cego sobrearandomizac¸ão eintervenc¸ão. Todososeventosadversosobservadosduranteoestudoforam registradoseconduzidosdeacordocomapráticaclínicalocal. Osparticipantesforamanalisadosnoiníciodoestudo(T0)e nasemana12(T1)paraavaliac¸ãoclínica,laboratoriale nutri-cional.Osparticipantestambémforamcontatadosnasemana 6paraverificaraderênciaepresenc¸adeefeitoscolaterais.As variáveisavaliadasemcadaconsultaforam:índicede ativi-dadedadoenc¸a,comousodoSystemicLupusDiseaseActivity Index(Sledai-2K);16índicededano(índicededanodo Syste-micLupusInternationalCollaborationClinics/AmericanCollegeof Rheumatology–SLICC/ACR);17perfildelipídeoseglicemiaem jejum;exameslaboratoriaisconvencionaisparaavaliaroLES (contagemde eritrócitos eleucócitos dosangue,contagem de plaquetas, creatinina, exame de urina, relac¸ão de pro-teína/creatininanaurina,anti-dsDNA,anticardiolipina,níveis deC3 eC4);citocinas (IL-6, IL-10),adipocinas(leptina, adi-ponectina),proteínaC-reativa (PCR),avaliac¸ãonutricionale medicamentosemuso.
O estado nutricional foi avaliado pelo índice de massa corporal (IMC) e os pacientes foram classificados como desnutridos (IMC ≤ 18,5kg/m2), peso normal (IMC=18,6 a 24,9kg/m2),sobrepeso(IMC=25a29,9kg/m2)eobesos(IMC ≥30kg/m2).18 A avaliac¸ãodacomposic¸ão corporalfoi feita comabioimpedância(RJLQuantumX®)eospacientesforam classificadosdeacordocomGallagheretal.19 quantoa gor-duracorporalnormalouacimadopercentualrecomendado deacordocomosexoeaidade.
Avaliaram-se os níveis de IL-6 e IL-10 por citome-triadefluxoultrassensível(CytometricBeadArray)eosníveis deleptinaeadiponectinaporEnzyme-LinkedImmunosorbent Assay(Elisa).
Variáveisdedesfecho
Osdesfechosprimáriosforamamediana(intervalo interquar-til – IIQ) das variac¸ões (V=concentrac¸ões pré-tratamento [T0]menos pós-tratamento [T1])entre osgrupos nos níveis séricosdecitocinas,adipocinas,proteínaC-reativae marca-doresbioquímicos(glicoseelipídeos)apósumtratamentode 12semanas.
Análiseestatística
Usou-seo softwareStatistical Packageof SocialSciences(SPSS) versão19.0(SPSSInc.,Chicago,IL,EUA).Acomparac¸ãoentre osgruposnoiníciodoestudo(comversussemômega-3,com versussemexcessodepesoecomporcentagemdegordura corporalnormalversusacimadorecomendado)foifeitacomo testenãoparamétricoUdeMann-Whitneyparavariáveis con-tínuaseotestedequi-quadradodePearsonouotesteexato deFisherparavariáveiscategóricas.Amediana(IIQ)dos mar-cadoresinflamatóriosebioquímicosemT0eT1nosgrupos ômega-3econtrolefoicomparadapelotestenãoparamétrico deWilcoxon.
Para investigar o efeito do ômega-3 sobre os mediado-resinflamatórios emarcadores bioquímicos, analisaram-se as variac¸ões de variáveis laboratoriais (V=concentrac¸ões pré-tratamento[T0]menospós-tratamento[T1])entreos gru-pos ômega-3 e controle com o teste U de Mann-Whitney. Todasasanálisesforamconsideradasestatisticamente signi-ficativasquandopbicaudado<0,05.
Resultados
Dos66pacientesrandomizados,17nãoconcluíramoestudo (fig.1).Doisinterromperamasuplementac¸ãoemdecorrência de eventos adversos (um com diarreia eoutro querelatou sabor residual de peixe após o uso). Ambos os pacientes deixaram o estudo.A amostra-pilotofinal consistiu em 49 pacientes. As frequências cumulativas das manifestac¸ões clínicasesorológicassegundoaclassificac¸ãodoACRforam: manifestac¸õesmucocutâneasem86,3%dospacientes, hema-tológicasem80%,imunológicasem77,6%,artriteem66,7%, nefrite em56,9%,serositeem16%eneuropsiquiátricasem 11,8%.
Análisedosdadosiniciais
Amediana(IIQ)daidadefoide37anos(29-48),adurac¸ãoda doenc¸afoidesete(4-13)anos,oíndicedeatividadedadoenc¸a foide1(0-2)eoíndicededanofoide0(0-1).
Naavaliac¸ãoinicial(T0),ascaracterísticasclínicas, labo-ratoriais edotratamento, o índice de atividade da doenc¸a eoestadonutricionaldosparticipantes,nãoforam estatis-ticamente diferentes,comparando-se osgruposcom esem ômega-3(tabela1).
O estado nutricional de 49 pacientes,de acordocom o IMC,mostrouque13(26,5%)tinhampesonormal,19(38,8%) estavam acimado peso e17 (34,7%)estavam obesas. Essa distribuic¸ão foi semelhante nos dois grupos (p=0,875). A bioimpedância elétrica indicou que 29 (59,2%) apresenta-vampercentualdegorduracorporalacimadorecomendado: 12(54,5%)dogrupoômega-3e17(63,0%)dogrupocontrole (p=0,574).
As concentrac¸ões séricasde citocinas foram semelhan-tes nos participantes com peso normale excessode peso (IMC≥25kg/m2)(IL-6:1,38[0,48-3,13]pg/mLversus0,92 [0,40-1,95] pg/mL;p=0,429; IL-10:19,30 [7,85-53,35]pg/mL versus 21,42[9,40-51,16]pg/mL;p=0,956).OsníveisdeIL-10foram semelhantesemambososgrupos,seconsiderarmosos paci-entescomporcentagemdegorduracorporaladequadaeacima dorecomendado(16,26[5,51-22,25]pg/mLversus22,53 [9,78-55,79]pg/mL;p=0,192).Noentanto,asconcentrac¸õesséricas de IL-6 foram maiores nos pacientes com porcentagem de gorduracorporalacimadorecomendado,comtendênciaà sig-nificância(0,48[0,19-1,04]pg/mLversus1,22[0,47-2,38]pg/mL; p=0,053).
Tabela1–Característicasiniciais(T0)decadagrupo
Total(n=49) Grupoômega-3(n=22) Grupocontrole(n=27) pc
Manifestac¸õesmucocutâneasa 20(40,8) 9(40,9) 11(40,7) 0,829
Artritea 3(6,1) 1(4,5) 2(7,4) 0,724
Alterac¸õeshematológicasa 27(55,1) 13(59,1) 14(51,9) 0,340
Linfopeniaa 26(53,1) 13(59,1) 13(48,1) 0,233
Leucopeniaa 10(20,4) 3(13,6) 7(25,9) 0,390
Trombocitopeniaa 1(2,0) 0 1(3,7) 0,390
Nefritea 11(22,4) 5(22,7) 6(22,2) 0,861
C3diminuídoa 9(18,0) 2(9,1) 7(25,0) 0,146
C4diminuídoa 10(20,4) 3(14,3) 3(11,1) 0,102
Anti-DNAdecadeiaduplaa 6(12,5) 3(14,3) 3(11,1) 0,741
Dosedeesteroidesatual(mg)b 5,0(2,5-10,0) 5,0(0,6-10,0) 5,0(3,5-8,1) 0,745
Dosedeesteroidescumulativa(g)b 20,0(12,2-37,8) 22,0(12,7-56,7) 19,1(12,1-30,5) 0,178
SLEDAI-2kb 1(0-2) 0(0-2) 2(0-4) 0,072
IMC(kg/m2)b 28,4(25,7-30,9) 29,0(25,7-30,7) 28,1(25,2-31,4) 0,805
Gorduracorporal%b 36,9(33,7-41,1) 37,7(33,2-41,9) 36,0(33,1-38,8) 0,512
Obesidadea 17(34,7) 8(36,4) 9(33,3) 0,689
Usoatualdeimunossupressora 33(64,7) 13(59,1) 20(69,0) 0,465
IMC,índicedemassacorporal.
a N(%).
b Mediana(intervalointerquartil).
c Testedequi-quadradodePearson,testeexatodeFisheroutesteUdeMann-Whitney.
Tabela2–Concentrac¸õesséricasdecitocinas,adipocinasemarcadoresbioquímicosdepacientescomlúpuseritematoso sistêmiconoiníciodoestudo(T0)porgrupodetratamento
Grupoômega-3(n=22) Mediana(IIQ)
Grupocontrole(n=27) Mediana(IIQ)
pe
IL-6(pg/mL) 0,57(0,40-2,90)a 1,09(0,52-1,98)b 0,692
IL-10(pg/mL) 19,05(9,88-40,87)c 21,41(6,72-51,64)d 0,699
Leptina(ng/mL) 80,03(63,21-129,40) 58,12(36,65-109,20) 0,067
Adiponectina(g/mL) 42,30(24,88-58,01) 40,08(27,69-59,47) 0,817
Glicose(mg/dL) 77,5(75,2-82,8) 78,0(71,0-86,0) 0,958
Colesterol(mg/dL) 168,0(151,0-194,0) 182,0(155,5-192,2) 0,899
LDL-c(mg/dL) 95,0(80,0-116,0) 100,0(84,5-111,8) 0,926
HDL-c(mg/dL) 52,0(38,0-57,0) 53,0(37,8-63,2) 0,498
Triglicerídeos(mg/dL) 88,0(64,0-124,0) 79,5(59,5-114,0) 0,311
PCR(mg/dL) 5,0(4,9-8,1) 6,4(4,9-11,6) 0,370
IIQ,intervalointerquartil;IL,interleucina;LDL-c,lipoproteínadebaixadensidade;HDL-c, lipoproteínasdealta densidade;PCR,proteína C-reativa.
a n=21.
b n=26.
c n=14.
dn=21.
e TesteUdeMann-Whitney.
deadiponectinanãodiferiramentreosgrupos(pesonormal: 46,4[34,6-61]g/mLversusexcessodepeso:42,5 [24,7-58,0] g/mL;p=0,571;epercentualdegorduracorporalnormal:46,4 [35,1-59,4]g/mLversuspercentualdegorduracorporalacima dorecomendado:42,9[24,3-59,6]g/mL;p=0,365).
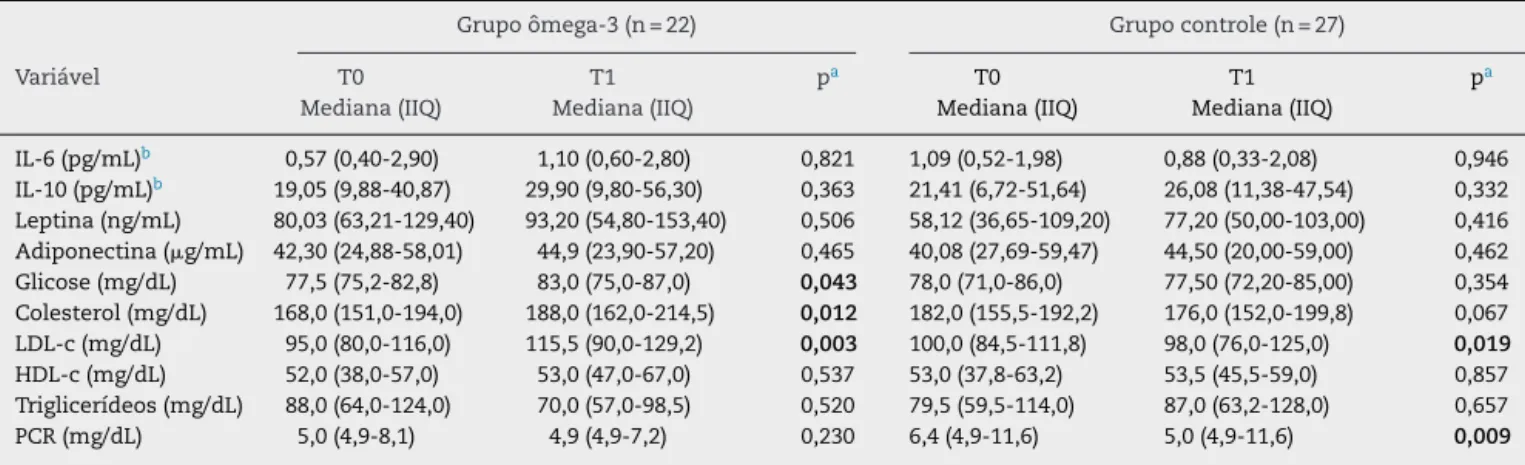
OsníveisséricosdeIL-6, IL-10eadipocinas,glicemiade jejum,perfillipídicoeproteínaC-reativanoiníciodoestudo foramsemelhantesnosgruposômega-3econtrole(tabela2). Osníveis séricosde IL-6 eIL-10, leptinae adiponectina não se alteraram após o tratamento de 12 semanas. As concentrac¸õesdeglicemiaemjejum,níveisdecolesteroltotal ecolesterolLDL aumentaramnogrupoômega-3;o coleste-rolLDLaumentounogrupocontrole,apesardepermanecer dentrodoslimitesnormais(tabela3).
Comparac¸ãodasvariac¸ões(V)entreosdoisgrupos
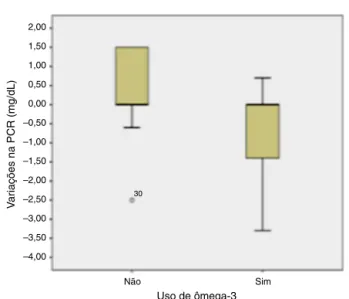
Amediana(IIQ)davariac¸ão(V=T1-T0)nasconcentrac¸ões decitocinas,adipocinas,glicemiadejejumelipídeosforam semelhantesnos doisgrupos(tabela4).Amediana(IIQ)da variac¸ãonosníveisdePCRentreosdoisgruposérepresentada
nafigura2,que mostraumdecréscimono grupoômega-3,
enquantohouveumaumentonogrupocontrole(p=0,008).
Discussão
Tabela3–Concentrac¸õesséricasdecitocinas,adipocinasemarcadoresbioquímicosemT0eT1emambososgrupos
Grupoômega-3(n=22) Grupocontrole(n=27)
Variável T0
Mediana(IIQ)
T1 Mediana(IIQ)
pa T0
Mediana(IIQ)
T1 Mediana(IIQ)
pa
IL-6(pg/mL)b 0,57(0,40-2,90) 1,10(0,60-2,80) 0,821 1,09(0,52-1,98) 0,88(0,33-2,08) 0,946
IL-10(pg/mL)b 19,05(9,88-40,87) 29,90(9,80-56,30) 0,363 21,41(6,72-51,64) 26,08(11,38-47,54) 0,332
Leptina(ng/mL) 80,03(63,21-129,40) 93,20(54,80-153,40) 0,506 58,12(36,65-109,20) 77,20(50,00-103,00) 0,416
Adiponectina(g/mL) 42,30(24,88-58,01) 44,9(23,90-57,20) 0,465 40,08(27,69-59,47) 44,50(20,00-59,00) 0,462
Glicose(mg/dL) 77,5(75,2-82,8) 83,0(75,0-87,0) 0,043 78,0(71,0-86,0) 77,50(72,20-85,00) 0,354
Colesterol(mg/dL) 168,0(151,0-194,0) 188,0(162,0-214,5) 0,012 182,0(155,5-192,2) 176,0(152,0-199,8) 0,067
LDL-c(mg/dL) 95,0(80,0-116,0) 115,5(90,0-129,2) 0,003 100,0(84,5-111,8) 98,0(76,0-125,0) 0,019
HDL-c(mg/dL) 52,0(38,0-57,0) 53,0(47,0-67,0) 0,537 53,0(37,8-63,2) 53,5(45,5-59,0) 0,857
Triglicerídeos(mg/dL) 88,0(64,0-124,0) 70,0(57,0-98,5) 0,520 79,5(59,5-114,0) 87,0(63,2-128,0) 0,657
PCR(mg/dL) 5,0(4,9-8,1) 4,9(4,9-7,2) 0,230 6,4(4,9-11,6) 5,0(4,9-11,6) 0,009
IL,interleucina;LDL-c,lipoproteínadebaixadensidade;HDL-c,lipoproteínasdealtadensidade;PCR,proteínaC-reativa.
a TestenãoparamétricodeWilcoxon.
b IL-6,grupoômega-3n=21;grupocontrolen=26;IL-10,grupoômega-3n=14;grupocontrolen=21.
Boldmeansstatisticallysignificant.
Tabela4–Variac¸ão(V)nascitocinasemarcadoresbioquímicosséricosconsiderandoofinal(T1)eoinício(T0) doestudoporgruposdetratamento
Grupoômega-3 Mediana(IIQ)
Grupocontrole Mediana(IIQ)
pe
VIL-6(pg/mL) 0,12(−1,19-1,45)a −0,05(−0,57-0,58)b 0,915
VIL-10(pg/mL) 1,32(−8,94-18,80)c 1,04(−7,17-12,19)d 0,920
VAdiponectina(g/mL) 0,6(−3,2-11,8) −3,4(−6,6-5,8) 0,171
VLeptina(ng/mL) 3,4(−18,2-22,6) 0,0(−16,3-28,0) 0,924
VPCR(mg/dL) 0,0(−1,5-0,0) 0,0(0,0-1,5) 0,008
Glicose(mg/dL) −4,0(−8,0-0,0) −1,0(−8,0-4,0) 0,496
Colesterol(mg/mL) 14,0(−2,5-27,2) 4,5(−8,5-23,8) 0,477
LDL-C(mg/dL) 17,0(3,0-27,0) 10,5(−2,5-20,8) 0,288
HDL-C(mg/dL) 0,0(−4,5-12,5) −0,5(−7,0-5,0) 0,536
Triglicerídeos(mg/dL) −1,0(−39,2-22,8) −4,5(−17,8-16,8) 0,867
IIQ,intervalointerquartil;IL,interleucina;LDL-c,lipoproteínadebaixadensidade;HDL-c,lipoproteínasdealtadensidade;PCR,proteína C-reativa.
a n=21.
b n=26.
c n=14.
d n=21.
e TesteUdeMann-Whitney.
sobreasadipocinas(leptinaeadiponectina)em49mulheres com LESe baixaatividade da doenc¸a. Belloet al.20 relata-ramresultadossemelhantes em85pacientes com LESque nãoapresentaramreduc¸ão nosníveisde mediadores infla-matórios (sICAM-1, sVCAM-1 e IL-6) após o uso de doses maiselevadasdesse ácido graxo(3g deômega-3: 1.800mg de EPA e1.200mg de DHA) durante 12 semanas.Em con-traste,emindivíduossaudáveis,estudosdeculturasdecélulas demonstraramqueoDHAeoEPApodeminibiraproduc¸ão deIL-6,TNF-␣,IL-1eIL-1.7,8,21,22Emumestudoderevisão, encontraram-seresultadosconflitantesacercadosefeitosdo ômega-3sobrea atividade da doenc¸a, sobreas citocinas e sobreosníveisdemarcadoresbioquímicos,emdecorrência dosdiferentesmétodosusados.23
O presente estudo indica um efeito do ômega-3 sobre os níveis de PCR, já que houve umavariac¸ão significativa dosníveis séricosentre os grupos: houve umadiminuic¸ão nogrupoômega-3,enquanto houveumaumentonogrupo
controle.Estudosfeitosemindivíduossaudáveiseem pacien-tescomdoenc¸asinflamatóriascrônicas,incluindodiabetes, doenc¸a cardíacacoronariana, coliteulcerativa, dislipidemia eartritereumatoide,24–30 demonstraramqueoconsumode ácidosgraxosômega-3estáinversamenteassociadoaoPCR sérico.Nãofoipossívelencontrarqualquerinformac¸ãona lite-raturasobreosefeitosdoômega-3sobreosníveisdePCRem pacientescomLES.
As maiores concentrac¸ões séricas de leptina descritas no presente estudo em indivíduos com excesso de peso e naqueles com percentual de gordura corporal acima
do recomendado também foram observadas por outros
–4,00
Não Sim
Uso de ômega-3
V
ar
iações na PCR (mg/dL)
–3,50 –3,00
–2,50 30
–2,00 –1,50 –1,00 –0,50 0,00 0,50 1,00 1,50 2,00
Figura2–Boxplotdamediana(intervalointerquartil)das variac¸ões(V)nosníveisdeproteínaC-reativaentreT0e T1nosgrupostratamentoecontrole.
importantesobrearespostainflamatóriadoLES.Emcontraste comaobesidadeeasdoenc¸asmetabólicas,níveissistêmicose locaiselevadosdeadiponectinaestãopresentesempacientes comdoenc¸asinflamatóriaseimunomediadas,comooLES.31 Umavezqueaadiponectinaapresentaatividadespróe anti--inflamatórias,observaram-seachadoscontroversossobreo papeldaadiponectinatotalnasdoenc¸asautoimunes sistêmi-caseinflamatórias.32
Segundonossoconhecimento, aanálise dosníveis séri-cos de leptina e adiponectina após a suplementac¸ão com ômega-3empacientescomLESéumdadooriginaldopresente estudo.Emindivíduossaudáveis,osresultadossão conflitan-tes.Rameletal.39verificaramqueoconsumodiáriode1,3g de EPA+DHA causou uma reduc¸ão significativanos níveis séricosdeleptinaenotaramquehouveperda depeso con-comitantedecercade1kgnessesindivíduos,oquepoderia representarumviésnessesresultados.Itohetal.40relataram que,após o tratamento com doses diáriasde 1,8g deEPA, houveumaumentosignificativonaproduc¸ãodeadiponectina emroedoresesereshumanosobesos.Estudosqueavaliaram asconcentrac¸õesdeômega-3eômega-6nasmembranasdas hemáciasdemonstraramassociac¸ãopositivaentreoômega-3 eoaumentonosníveisséricosdeadiponectinaediminuic¸ão daleptina,oqueindicaumpotencialefeitodesseácidograxo sobreocontroledainflamac¸ão.41,42Noentanto,outrosautores nãodemonstraramqualquerrelac¸ãoentreoconsumodesse nutrienteeasconcentrac¸õesséricasdessasadipocinas.43,44
O presente estudo observou também um aumento no
colesteroltotalsérico(p=0,012)eLDL-c (p=0,003)em paci-entesquereceberamoácidograxoômega-3,bemcomoum aumentonoLDL-csérico(p=0,019)emindivíduosdogrupo controle.Noentanto,asmedianasdasconcentrac¸õesséricas entreT1 eT0 permaneceram dentro dosníveis laboratori-aisnormais. Emconcordânciacomosachados dopresente estudo, Bello et al.20 e Wright et al.44 também descreve-ramumaumentono colesteroltotaleLDL-c empacientes comLESquereceberamômega-3.Estudosemindivíduossem
LES com hipertrigliceridemia demonstraram um aumento nosníveisséricosdeLDL-capósasuplementac¸ãocomesse ácidograxo.45,46Esseéumachadoclinicamenteimportante, umavez quepacientes com LEStêm umrisco aumentado de doenc¸a cardiovascular aterosclerótica, que é uma das principaiscausasdemortalidadenessesindivíduos.47–50 Curi-osamente,emduasmetanálisesdapopulac¸ãocomaltorisco dedoenc¸ascardiovascularesecerebrovascularesnãohouve reduc¸ãonafrequênciadeeventoscardiovasculares, corona-rianosecerebrovasculares,bemcomonamortalidadeglobal comessasuplementac¸ão.51,52
Nopresente estudo,os baixosníveis de inflamac¸ãodos pacientes com LES podem ter contribuído para a ausên-cia de alterac¸ões nos níveis séricos de citocinas após a suplementac¸ãocomômega-3.Portanto,nãoépossívelexcluir umpotencialdereduc¸ãonasconcentrac¸õesséricasem paci-entes com índices de atividade inflamatória moderados a elevados.Períodosmaislongosdesuplementac¸ãopoderiam produzirresultadosdiferentes?Dosesmaiorespoderiamser benéficassemriscosparaospacientes?Essasperguntassó podemserrespondidasporensaiosclínicosrandomizadosde longo prazoemque a adesãopudesse ser controladapela captac¸ãocelulardeômega-3,oquenãofoifeitonopresente estudo.
Em conclusão, este estudo de 12 semanas em
paci-entes com lúpus com baixa atividade da doenc¸a, a
suplementac¸ão com ácidos graxosômega-3nãofoi associ-ada aalterac¸ões nosníveisséricos deIL-6, IL-10, leptinae adiponectina,emboratenhasidoobservadaumadiminuic¸ão significativanasconcentrac¸õesdePCR.
Conflitos
de
interesse
Osautoresdeclaramnãohaverconflitosdeinteresse.
Agradecimentos
ÀFundac¸ãodeAmparoàPesquisadoEstadodeMinasGerais (Fapemig)pelaconcessãodeumabolsadepesquisa (CDS-APQ-02095-08).
r
e
f
e
r
ê
n
c
i
a
s
1.KronmannN,GreenA.Epidemiologicalstudiesinthe
Upernavikdistrict,Greenland:incidenceofsomechronic
diseases1950-1974.ActaMedScand.1980;208:401–6.
2.BhangleS,KolasinskiSL.Fishoilinrheumaticdiseases.
RheumDisClinNAm.2011;37:77–84.
3.LiK,HuangT,ZhengJ,WuK,LiD.Effectofmarine-derived
n-3polyunsaturatedfattyacidsonC-reactiveprotein,
interleukin6andtumornecrosisfactoralfa:ameta-analysis.
PLOSOne.2014;9:e88103.
4.SchwabJM,SerhanCN.Lipoxinsandnewlipidmediatorsin
theresolutionofinflammation.CurrOpinPharmacol.
2006;6:414–20.
5.ThiesF,MilesEA,Nebe-von-CaronG,PowellJR,HurstTL,
NewsholmeEA,etal.Influenceofdietarysupplementation
withlong-chainn-3orn-6polyunsaturatedfattyacidson
plasmasolubleadhesionmoleculesinhealthyadults.Lipids. 2001;36:1183–93.
6. TrebbleT,ArdenNK,StroudMA,WoottonSA,BurdgeGC,
MilesEA,etal.Inhibitionoftumornecrosisfactor-␣and
interleukin-6productionbymononuclearcellsfollowing
dietaryfish-oilsupplementationinhealthymenand
responsetoantioxidantco-supplementation.BritJNutr.
2003;90:405–12.
7. WallaceFA,MilesEA,CalderPC.Comparisonoftheeffectsof
linseedoilanddifferentdosesoffishoilonmononuclearcell
functioninhealthyhumansubjects.BrJNutr.2003;89:679–89.
8. CawoodAL,DingR,NapperFL,YoungRH,WilliamsJA,
WardMJ,etal.Eicosapentaenoicacid(EPA)fromhighly
concentratedn-3fattyacidethylestersisincorporatedinto
advancedatheroscleroticplaquesandhigherplaqueEPAis
associatedwithdecreasedplaqueinflammationand
increasedstability.Atherosclerosis.2010;20:252–9.
9. Skulas-RayAC,Kris-EthertonPM,HarrisWS,
VandenHeuvelJP,WagnerPR,WestSG.Dose-responseeffects
ofomega-3fattyacidsontriglycerides,inflammation,and
endothelialfunctioninhealthypersonswithmoderate
hypertriglyceridemia.AmJClinNutr.2011;93:243.
10.UdupaAS,NaharPS,ShahSH,KshirsagarMJ,GhonganeBB.
Studyofcomparativeeffectsofantioxidantsoninsulin
sensitivityintype2diabetesmellitus.JClinDiagnRes.
2012;6:1469–73.
11.BrowningLM,KrebsJD,MooreCS,MishraGD,O’ConnellMA,
JebbSA.Theimpactoflongchainn-3polyunsaturatedfatty
acidsupplementationoninflammation,insulinsensitivity
andCVDriskinagroupofoverweightwomanwithan
inflammatoryphenotype.DiabetesObesMetab.2007;9:70–80.
12.HartwegJ,FarmerAJ,HolmanRR,NeilA.Potentialimpactof
omega-3treatmentoncardiovasculardiseaseintype2
diabetes.CurrOpinLipidol.2009;20:30–8.
13.HeK,LiuK,DaviglusML,JennyNS,Mayer-DavisE,JiangR,
etal.Associationsofdietarylong-chainn-3polyunsaturated
fattyacidsandfishwithbiomarkersofinflammationand
endothelialactivation(fromtheMulti-EthnicStudyof
Atherosclerosis[MESA]).AmJCardiol.2009;103:1238–43.
14.HahnBH,EblingF,SinghRR,SinghRP,KarpouzasG,
LaCavaA.Cellularandmolecularmechanismsofregulation
ofautoantibodyproductioninlupus.AnnNYAcadSci.
2005;1051:433.
15.HochbergMC.UpdatingtheAmericanCollegeof
Rheumatologyrevisedcriteriafortheclassificationof
systemiclupuserythematosus.ArthritisRheum.
1997;40:1725.
16.GladmanDD,IbanezD,UrowitzMB.SystemicLupus
ErythematosusDiseaseActivityIndex2000.JRheumatol.
2001;29:288–91.
17.GladmanD,GoldsmithC,UrowitzMB.Thereliabilityofthe
SystemicLupusInternationalCollaboratingClinics/American
CollegeofRheumatologydamageindexforsystemiclupus
erythematosus.Arthritis&Rheum.1997;40:809–13.
18.WHO(WorldHealthOrganization).Obesity:preventingand managingtheglobalepidemic.ReportofWHOconsultation. Geneva:WHO1997;276p.
19.GallagherD,HeymsfieldSB,HeoM,JebbSA,MurgatroydPR,
SakamotoY.Healthypercentagebodyfatranges:anapproach
fordevelopingguidelinesbasedonbodymassindex.AmJ
ClinNut.2000;72:694–701.
20.BelloKJ,FangH,FazeliP,BoladW,CorrettiM,MagderLS,etal.
Omega-3inSLE:adouble-blind,placebo-controlled
randomizedclinicaltrialofendothelialdysfunctionand
diseaseactivityinsystemiclupuserythematosus.Rheumatol
Int.2013;33:2789–96.
21.SchubertR,KitzR,BeermannC,RoseMA,BaerPC,ZielenS,
etal.Influenceoflow-dosepolyunsaturatedfattyacids
supplementationontheinflammatoryresponseofhealthy
adults.Nutrition.2007;23:724–30.
22.FujiokaS,HamazakiK,ItomuraM,HuanM,NishizawaH,
SawazakiS,etal.Theeffectsofeicosapentaenoic
acid-fortifiedfoodoninflammatorymarkersinhealthy
subjects–arandomized,placebo-controlled,double-blind
study.JNutrSciVitaminol.2006;52:261–5.
23.BorgesMC,SantosFMM,TellesRW,CorreiaMITD,LannaCCD.
Polyunsaturatedomega-3fattyacidsandsystemiclupus
erythematosus:whatdoweknow?BrazJRheumatol.
2014;54:459–66.
24.FerrucciL,CherubiniA,BandinelliS,BartaliB,CorsiA,
LauretaniF,etal.Relationshipofplasmapolyunsaturated
fattyacidstocirculatinginflammatorymarkers.JCEM.
2006;91:439–46.
25.TsitourasPD,GucciardoF,SalbeAD,HewardC,HarmanSM.
Highomega-3fatintakeimprovesinsulinsensitivityand
reducesCRPandIL6,butdoesnotaffectotherendocrineaxes
inhealthyolderadults.HormMetabRes.2008;40:199–205.
26.MicallefMA,MunroIA,GargML.Aninverserelationship
betweenplasman-3fattyacidsandC-reactiveproteinin
healthyindividuals.EurJClinNutr.2009;63:1154–6.
27.Farzaneh-FarR,HarrisWS,GargS,NaB,WhooleyMA.Inverse
associationoferythrocyten-3fattyacidlevelswith
inflammatorymediatorsinpatientswithstablecoronary
arterydisease:theHeartandSoulStudy.Atherosclerosis.
2009;205:538–43.
28.KelleyDS,SiegelD,FedorDM,AdkinsY,MackeyBE.DHA
supplementationdecreasesserumC-reactiveproteinand
othermarkersofinflammationinhypertriglyceridemicmen.
JNutr.2009;139:495–501.
29.LiK,HuangT,ZhengJ,WuK,LiD.EffectofMarine-Derived
n-3PolyunsaturatedFattyAcidsonC-ReactiveProtein,
Interleukin6andTumorNecrosisFactor␣:ameta-analysis.
PLoSOne.2014;9:e88103.
30.JuliaC,TouvierM,MeunierN,PapetI,GalanP,HercbergS,
etal.IntakesofPUFAswereinverselyassociatedwithplasma
C-reactiveprotein12yearslaterinamiddle-agedpopulation
withvitaminEintakeasaneffectmodifier.JNutr.
2013;143:1760–6.
31.TilgH,MoschenAR.Adipocytokines:mediatorslinking
adiposetissue,inflammationandimmunity.NatRev
Immunol.2006;6:772–83.
32.Al-SuhaimiEA,ShehzadA.Leptin,resistin,andvisfatin:the
missinglinkbetweenendocrinemetabolicdisordersand
immunity.EurJMedRes.2013;18:12.
33.KershawEE,FlierJS.Adiposetissueasanendocrineorgan.J
ClinEndocrinolMetab.2004;89:2548–56.
34.VanHarmelenV,ReynisdottirS,ErikssonP,ThorneA,
HoffstedtJ,LonnqvistF,etal.Leptinsecretionfrom
subcutaneousandvisceraladiposetissueinwomen.
Diabetes.1998;47:913–7.
35.ChungCP,LongAG,SolusJF,RhoYH,OeserA,RaggiP,etal.
Adipocytokinesinsystemiclupuserythematosus:
relationshiptoinflammation,insulinresistanceandcoronary
atherosclerosis.Lupus.2009;18:799–806.
36.Garcia-GonzalezA,Gonzalez-LopezL,Valera-GonzalezIC,
Cardona-Mu ˜nozEG,Salazar-ParamoM,González-OrtizM,
etal.Serumleptinlevelsinwomenwithsystemiclupus
erythematosus.RheumatolInt.2002;22:138–41.
37.VadaccaM,MargiottaD,RigonA,CacciapagliaF,CoppolinoG,
AmorosoA,etal.Adipokinesandsystemiclupus
erythematosus:relationshipwithmetabolicsyndromeand
cardiovasculardiseaseriskfactors.JRheumatol.
2009;36:295–7.
38.KimHA,ChoiGS,JeonJY,YoonJM,SungJM,SuhCH.Leptin
andghrelininKoreansystemiclupuserythematosus.Lupus.
39.RamelA,ParraD,MartinézJA,KielyM,ThorsdottirI.Effects
ofseafoodconsumptionandweightlossonfastingleptinand
ghrelinconcentrationsinoverweightandobeseEuropean
youngadults.EurJNutr.2009;48:107–14.
40.ItohM,SuganamiT,SatohN,Tanimoto-KoyamaK,YuanX,
TanakaM,etal.Increasedadiponectinsecretionbyhighly
purifiedeicosapentaenoicacidinrodentmodelsofobesity
andhumanobesesubjects.ArteriosclerThrombVascBiol.
2007;27:1918–25.
41.AnWS,SonYK,KimSE,KimKH,BaeHR,LeeS,etal.
Associationofadiponectinandleptinwithserumlipidsand
erythrocyteomega-3andomega-6fattyacidsindialysis
patients.ClinNephrol.2011;75:195–203.
42.MinY,LowyC,IslamS,KhanFS,SwaminathanR.
Relationshipbetweenredcellmembranefattyacidsand
adipokinesinindividualswithvaryinginsulinsensitivity.Eur
JClinNutr.2011;65:690–5.
43.OlzaJ,MesaMD,AguileraCM,Moreno-TorresR,JiménezA,
PérezdelaCruzA,etal.Influenceofaneicosapentaenoicand
docosahexaenoicacid-enrichedenteralnutritionformulaon
plasmafattyacidcompositionandmediatorsofinsulin
resistanceintheelderly.ClinNutr.2010;29:31–7.
44.WrightSA,O’PreyFM,McHenryMT,LeaheyWJ,DevineAB,
DuffyEM,etal.Arandomisedinterventionaltrialofw-3
polyunsaturatedacidsonendothelialfunctionanddisease
activityinsystemiclupuserythematosus.AnnRheumDis.
2008;67:841–8.
45.PownallJH,BrauchiD,KilincC,OsmundsenK,PaoQ,
Payton-RossC,etal.Correlationofserumtriglycerideandits
reductionbyomega-3fattyacidswithlipidtransferactivity
andtheneutrallipidcompositionsofhigh-densityand
low-densitylipoproteins.Arteriosclerosis.1999;143:285–97.
46.HarrisWS,GinsbergHN,ArunakulN,ShachterNS,
WindsorSL,AdamsM,etal.SafetyandefficacyofOmacorin
severehypertriglyceridemia.JCardiovascRisk.1997;4:385–91.
47.UrowitzMB,BookmanAA,KoehlerBE,GordonDA,
SmytheHA,OgryzloMA.Thebimodalmortalitypatternof
systemiclupuserythematosus.AmJMed.1976;60:221–5.
48.ManziS,MeilahnEN,RairieJE,ConteCG,MedsgerTAJr,
Jansen-McWilliamsL,etal.Age-specificincidenceratesof
myocardialinfarctionandanginainwomenwithsystemic
lupuserythematosus:comparisonwiththeFramingham
Study.AmJEpidemiol.1997;145:408–15.
49.TellesRW,LannaCC,SousaAJ,NavarroTP,SouzaFL,
RodriguesA,etal.Progressionofcarotidatherosclerosisin
patientswithsystemiclupuserythematosus.ClinRheumatol.
2013;32:1293–300.
50.TellesRW,LannaCC,SouzaFL,RodriguesLA,ReisRC,
RibeiroAL.CausesandpredictorsofdeathinBrazilianlupus
patients.RheumatolInt.2013;33:467–73.
51.ChowdhuryR,StevensS,GormanD,PanA,WarnakulaS,
ChowdhuryS,etal.Associationbetweenfishconsumption,
longchainomega3fattyacids,andriskofcerebrovascular
disease:systematicreviewandmeta-analysis.BMJ.
2012;345:e6698.
52.KotwalS,JunM,SullivanD,PerkovicV,NealB.Omega3Fatty
acidsandcardiovascularoutcomes:systematicreviewand