Faculdade de Farmácia
EPIDEMIOLOGIA, PATOGÉNESE, CLÍNICA, IMUNOLOGIA, TRATAMENTO E PREVENÇÃO DA DIFILOBOTRIOSE – NOVOS TEMPOS, “NOVA" DOENÇA
Ana Filipa Fangueiro Duarte
Relatório de estágio orientado pela Professora Doutora Quirina dos Santos Costa e coorientado pela Doutora Isabel Freire e pela Professora Doutora
Maria Cristina Marques
Mestrado em Análises Clínicas
Prefácio
O enquadramento do trabalho.
O meu percurso académico teve início com a Licenciatura em Ciências das Saúde, que me proporcionou a formação necessária para o prosseguimento de estudos de ciclo superior em diversas áreas científicas e relacionadas com a saúde. Ao longo da Licenciatura, a Microbiologia Clínica foi uma das áreas que me despertou maior interesse e, uma vez que esta constitui uma das valências das Análises Clínicas, decidi ingressar no Mestrado em Análises Clínicas da Faculdade de Farmácia da Universidade de Lisboa. No âmbito do curso, foi realizado o estágio curricular, no Serviço de Patologia Clínica do Centro Hospitalar de Lisboa Ocidental (CHLO), sendo que o presente relatório pretende descrever as atividades acompanhadas no mesmo.
O relatório intitulado “Epidemiologia, patogénese, clínica, imunologia, tratamento e prevenção da Difilobotriose – novos tempos, “nova" doença”, apresenta-se dividido em quatro partes:
Na parte I, apresenta-se o prefácio, os resumos em Português e Inglês, a lista de abreviaturas e os índices;
Na parte II, expõe-se o relatório sumário das atividades desenvolvidas nas valências de Microbiologia, Imunologia, Hematologia e Química Clínica no Serviço de Patologia Clínica do Centro Hospitalar de Lisboa Ocidental (CHLO);
Na parte III, apresenta-se a monografia desenvolvida dentro do âmbito da valência de Microbiologia (Parasitologia Clínica), intitulada “Epidemiologia, patogénese, clínica, imunologia, tratamento e prevenção da Difilobotriose – novos tempos, “nova" doença”.
E por fim, na parte IV, apresentam-se as conclusões gerais e perspetivas futuras.
Este relatório está de acordo com o disposto no Artigo 37.º do Regulamento Geral do Ciclo de Estudos conducente ao Grau de Mestre da FFULisboa, nº 134/2016, DR, 2.ª série — N.º 26, de 8 de fevereiro de 2016.
Resumo
O presente relatório refere-se ao estágio realizado no âmbito do Mestrado em Análises Clínicas da Faculdade de Farmácia da Universidade de Lisboa. O estágio decorreu no Serviço de Patologia Clínica do Centro Hospitalar de Lisboa Ocidental (CHLO) e abrangeu as valências de Microbiologia, Imunologia, Hematologia e Química Clínica.
Este relatório tem como objetivo fazer a apresentação e caracterização do local de estágio e descrever as atividades desenvolvidas. Para cada uma das valências mencionadas, é feita uma descrição dos principais equipamentos e metodologias utilizados, e dos parâmetros analíticos determinados, realçando o seu interesse e significado clínico.
Abstract
This report refers to the internship carried out as part of the Master’s Degree in Clinical Analysis of the Faculty of Pharmacy of the University of Lisbon. The internship took place at the Clinical Pathology Service of the Lisboa Ocidental Hospital Center (CHLO) and encompassed the areas of Microbiology, Immunology, Hematology and Clinical Chemistry.
The aim of this report is to present and characterize the laboratory where the internship took place and to describe the activities developed. For each one of the areas mentioned, it is described the main equipment and methodologies used, and the analytical parameters determined, emphasizing their clinical interest and significance.
Lista de Abreviaturas
Parte II
Relatório de Estágio no Serviço de Patologia Clínica do Centro Hospitalar de
Lisboa Ocidental (CHLO)
AAT α1-Antitripsina
AEQ Avaliação Externa da Qualidade
AFP α-Fetoproteína
AGJ Anomalia da Glicemia de Jejum
AL Anticoagulante Lúpico
ALP Fosfatase Alcalina
ANA Anticorpos Antinucleares
APTT Tempo de Tromboplastina Parcial Ativado
AR Artrite Reumatoide
BAAR Bacilos Álcool-Ácido Resistentes
COS Gelose Columbia + 5% de sangue de carneiro
CDC Centers for Disease Control and Prevention
c-HDL Colesterol HDL
CHLO Centro Hospital de Lisboa Ocidental
CHGM Concentração de Hemoglobina Globular Média
CK Creatina Cinase
c-LDL Colesterol LDL
CLL Cadeias Leves Livres
CLSI Clinical and Laboratory Standards Institute
CQI Controlo de Qualidade Interno
CT Colesterol Total
DAI Doenças Autoimunes
DCV Doenças Cardiovasculares
DGS Direção Geral de Saúde
DM Diabetes Mellitus
DPCA Diálise Peritoneal Contínua Ambulatória
dsDNA DNA de cadeia dupla
EAM Enfarte Agudo do Miocárdio
EBV Vírus de Epstein-Barr
EC Eletroforese Capilar
ELISA Enzyme-Linked Immunosorbent Assay
ENA Antigénios Nucleares Extraíveis
EUCAST European Committee On Antimicrobial Susceptibility Testing
FR Fator Reumatoide
GGT γ-glutamiltransferase
HAE2 Gelose Chocolate Haemophilus 2
Hb Hemoglobina
Hb A1c Hemoglobina Glicada
Hb F Hemoglobina Fetal
HDL High Density Lipoprotein
HEKT Gelose Hektoen
HEM Hospital de Egas Moniz
HGM Hemoglobina Globular Média
HPLC Cromatografia Líquida de Alta Eficiência
HSFX Hospital de S. Francisco Xavier
Ht Hematócrito
IFI Imunofluorescência Indireta
Ig Imunoglobulina
INR Razão Normalizada Internacional
INSA Instituto Nacional de Saúde Dr. Ricardo Jorge
ISE Ion Selective Electrode
ISI Índice de Sensibilidade Internacional
IUSTI International Union against Sexually Transmitted Infections
LBA Lavado Broncoalveolar
LCR Líquido Cefalorraquidiano
LDL Low Density Lipoprotein
LES Lúpus Eritematoso Sistémico
MAC Gelose Mac Conkey
MGUS Monoclonal Gammopathy of Undetermined Significance
MHC Major Histocompatibility Complex
MHE Gelose Mueller Hinton
MHF Gelose Mueller Hinton + 5% sangue de cavalo + NAD
MM Mieloma Múltiplo
MNPT Média Normal do Tempo de Protrombina
MRSA Staphylococcus aureus Resistente à Meticilina
OMS Organização Mundial de Saúde
PBP2’ Penicillin-Binding Protein 2’
PCR Proteína C Reativa
PTGO Prova De Tolerância à Glucose Oral
PTH Hormona Paratiroide
PVX Gelose Chocolate + PolyViteX
RDW Indice de Dispersão Eritrocitária
RIA Radioimunoensaio
RPR Rapid Plasma Reagin
SPC Serviço de Patologia Clínica
T3L Triiodotironina Livre
T4L Tiroxina Livre
TACSP Técnico de Análises Clínicas e Saúde Pública
TDG Tolerância Diminuída à Glucose
TFG Taxa de Filtração Glomerular
TG Triglicéridos
TP Tempo de Protrombina
TRH Hormona Libertadora de Tirotrofina
TSA Teste de Suscetibilidade aos Antibióticos
TSH Hormona Estimulante da Tiroide
TT Tempo de Trombina
UFC Unidades Formadoras de Colónias
VGM Volume Globular Médio
VLDL Very-Low-Density Lipoprotein
Parte III
Epidemiologia, patogénese, clínica, imunologia, tratamento e prevenção da
Difilobotriose – novos tempos, “nova" doença
CDC Centers for Disease Control and Prevention
cob cytochrome b
cox1 cytochrome c oxidase subunit 1
Ig Imunoglobulina
IL Interleucina
INF- γ Interferão γ
ITS internal transcribed spacers
MEV Microscopia Eletrónica de Varrimento
nad3 NADH dehydrogenase subunit 3
OMS Organização Mundial de Saúde
PCR Polymerase Chain Reaction
PG Prostaglandina
PPi Pirofosfato
RFLP Restriction Fragment Length Polymorphism
Th1 T helper 1
Th2 T helper 2
Índice Geral
Parte I ... i
Prefácio ... v
Resumo ... vi
Abstract ... vii
Lista de Abreviaturas ... viii
Índice Geral ... xiii
Índice de Figuras ... xvii
Índice de Tabelas... xviii
Parte II ... 1
1. Introdução ... 3
2. Caracterização do Laboratório de Estágio ... 5
3. Fase Pré-Analítica ... 8
4. Microbiologia ... 10
4.1. Exame Cultural ... 11
4.2. Exame Microscópico ... 15
4.2.1. Exame a Fresco ... 15
4.2.2. Exame Após Coloração... 16
4.3. Testes de Identificação de Microrganismos ... 17
4.3.1. Provas Bioquímicas ... 17
4.3.2. Testes de Aglutinação ... 18
4.3.3. Teste de Sensibilidade à Optoquina ... 19
4.3.4. Teste da Necessidade dos Fatores X e V ... 19
4.4. Identificação de Microrganismos - Sistema Automatizado VITEK®2 ... 20
4.5. Testes de Suscetibilidade aos Antibióticos (TSA) ... 22
4.5.1. Método de Microdiluição – VITEK2 ... 23
4.5.2. Métodos Manuais ... 23
4.6. Processamento de Produtos Biológicos... 24
4.6.1. Urina ... 24
4.6.2. Sangue (Hemocultura) ... 25
4.6.3. Expetoração... 27
4.6.5. Exsudado Vaginal/Retal – Pesquisa de Streptococcus agalactiae ... 29
5. Imunologia ... 31
5.1. Proteínas ... 31
5.1.1. Nefelometria ... 31
5.1.1.1. Proteínas Doseadas ... 32
5.1.2. Eletroforese de Proteínas Séricas ... 35
5.1.3. Imunofixação ... 37
5.1.3.1. Pesquisa da Proteína de Bence Jones ... 38
5.2. Alergologia ... 39
5.3. Autoimunidade ... 41
5.3.1. Imunofluorescência Indireta ... 41
5.3.1.1. Anticorpos Antinucleares (ANA)... 42
5.3.2. Quimioluminescência ... 43
5.3.3. Immunoblot ... 43
6. Hematologia ... 45
6.1. Hemograma ... 45
6.1.1. Contador Hematológico Beckman Coulter UniCel DxH 800... 46
6.1.2. Eritrograma ... 47
6.1.3. Leucograma... 48
6.1.4. Plaquetograma... 49
6.1.5. Reticulócitos ... 50
6.2. Estudo Morfológico do Sangue Periférico – Esfregaço Sanguíneo ... 50
6.3. Velocidade de Sedimentação ... 52
6.4. Estudo das Hemoglobinopatias ... 53
6.4.1. HPLC ... 53
6.4.2. Eletroforese de Hemoglobinas ... 55
6.4.3. Teste da insolubilidade da Hb S... 55
6.5. Hemostase ... 56
6.5.1. Equipamentos Automáticos ACL TOP 750/500... 57
6.5.2. Testes de Screening/Rotina ... 58
6.5.3. Testes de Diagnóstico ... 60
7. Química Clínica... 62
7.1.2. ARCHITECT i1000SR ... 64
7.1.3. ADAMS A1C HA-8180T... 65
7.1.4. Aution MAX AX-4030 e sediMAX ... 65
7.1.5. Radioimunoensaio (RIA) ... 66
7.2. Proteínas ... 67
7.3. Metabolismo dos Hidratos de Carbono ... 68
7.3.1. Diagnóstico e Monitorização de Diabetes Mellitus ... 69
7.4. Metabolismo dos Lípidos ... 70
7.5. Função Renal ... 72 7.6. Função Hepática ... 73 7.7. Função Pancreática ... 75 7.8. Ionograma... 76 7.9. Função Cardíaca ... 77 7.10. Marcadores de Anemia... 78
7.11. Metabolismo Ósseo e Mineral... 80
7.12. Função Tiroideia ... 81
7.13. Marcadores Tumorais ... 82
7.14. Serologia Infeciosa ... 84
7.14.1. Toxoplasmose, Rubéola e Citomegalovírus – Grupo TORCH ... 84
7.14.2. Sífilis ... 85
7.15. Exame Sumário de Urina ... 87
7.15.1. Exame Físico-químico ... 87
7.15.2. Análise do Sedimento Urinário ... 88
8. Controlo de Qualidade ... 90
8.1. Controlo de Qualidade Interno ... 90
8.2. Avaliação Externa da Qualidade ... 92
9. Bibliografia ... 94 Parte III... 99 Resumo ... 101 Abstract ... 102 Objetivos ... 103 Material e Métodos ... 104 1. Introdução ... 105 2. Género Diphyllobothrium ... 107
2.1. Perspetiva Histórica... 107
2.2. Taxonomia e Principais Espécies Causadoras de Infeção no Homem ... 108
2.3. Morfologia ... 110 2.3.1. Parasita Adulto ... 110 2.3.2. Ovo ... 112 2.3.3. Formas Larvares... 113 3. Patogénese... 115 3.1. Hospedeiro Definitivo ... 117 3.2. Hospedeiros Intermediários... 118
3.2.1. Primeiro Hospedeiro Intermediário ... 118
3.2.2. Segundo Hospedeiro Intermediário ... 119
4. Manifestações Clínicas ... 121
5. Epidemiologia ... 123
5.1. Distribuição Mundial... 123
5.2. Parasitose Reemergente – a influência dos “novos” hábitos alimentares ... 128
5.3. Outros Fatores que Contribuem para a Transmissão, Expansão e Perpetuação da Difilobotriose ... 130
6. Imunologia ... 133
6.1. Resposta Imunitária nas Infeções Causadas por Helmintas ... 133
6.2. Mecanismos de Evasão ao Sistema Imunitário dos Hospedeiros ... 134
6.2.1. Papel das Prostaglandinas Produzidas por Diphyllobothrium spp. na Imunomodulação da Resposta Imunitária ... 135
7. Diagnóstico ... 138
7.1. Diagnóstico Baseado na Morfologia ... 139
7.2. Diagnóstico Molecular ... 142 8. Tratamento ... 145 8.1. Praziquantel ... 145 8.2. Niclosamida ... 146 9. Prevenção e Controlo... 147 10. Conclusão ... 149 11. Bibliografia ... 151 Parte IV ... 155
Índice de Figuras
Parte II
Relatório de Estágio no Serviço de Patologia Clínica do Centro Hospitalar de
Lisboa Ocidental (CHLO)
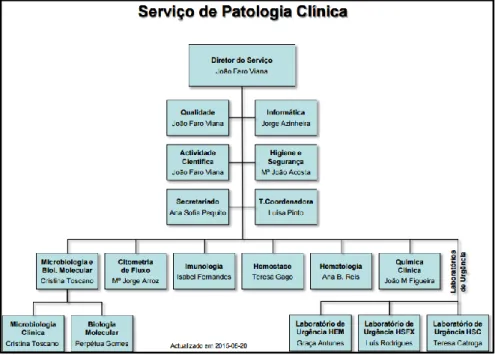
Figura 1 - Organograma do SPC... 5
Figura 2 - Cadeia pré-analítica Cobas 8000 (p 671 e p 612) ... 9
Figura 3 - Técnicas de sementeira por quadrantes (esquerda) e por estrias (direita)... 12
Figura 4 - Componentes do sistema VITEK®2 ... 21
Figura 5 - Cartas de Identificação VITEK 2 ... 22
Figura 6 - Frascos de cultura BacT/ALERT® ... 26
Figura 7 - Sistema BacT/ALERT® 3D ... 27
Figura 8 - Equipamento BN ProSpec ... 31
Figura 9 - Equipamento V8 E-Class ... 35
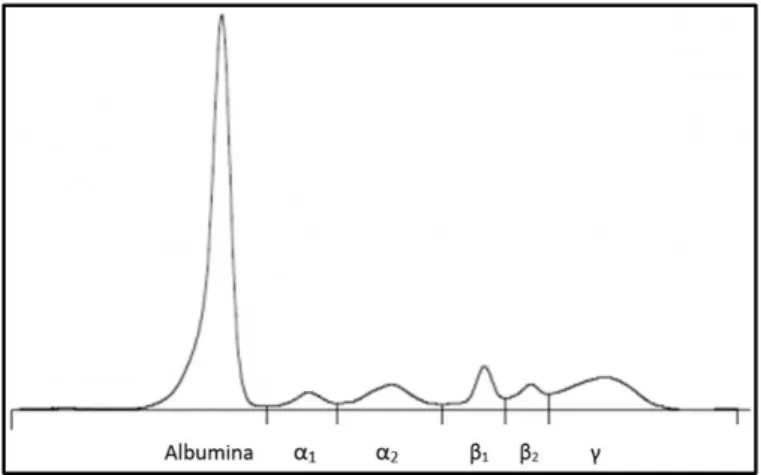
Figura 10 - Perfil eletroforético normal de proteínas séricas ... 36
Figura 11 - Equipamento Hydrasys Focusing ... 37
Figura 12 - Imunofixação em amostras de soro ... 38
Figura 13 - Equipamento Phadia 100 ... 40
Figura 14 - Equipamento Zenit SP ... 41
Figura 15 - Exemplos de padrões nucleares em células HEp-2 ... 42
Figura 16 - Equipamento Zenit RA ... 43
Figura 17 - Equipamento EUROBlotMaster ... 44
Figura 18 - Representação esquemática da técnica de execução de um esfregaço de sangue periférico ... 51
Figura 19 - Representação esquemática de um bom esfregaço de sangue periférico .... 51
Figura 20 - Equipamento ADAMS A1C HA-8180T ... 54
Figura 21 - Cobas 8000 modular analyzer series ... 63
Figura 22 - Equipamento ARCHITECT i1000SR ... 65
Figura 23 - Equipamentos sediMAX e Aution MAX AX-4030 ... 65
Figura 24 - Interpretação dos resultados da serologia para Toxoplasmose, Rubéola e CMV ... 85
Parte III
Epidemiologia, patogénese, clínica, imunologia, tratamento e prevenção da
Difilobotriose – novos tempos, “nova" doença
Figura 25 - Representação do parasita adulto de Diphyllobothrium spp. ... 110
Figura 26 - Escólex (esquerda) e estróbilo (direita) de Diphyllobothrium spp. ... 111
Figura 27 - Proglótis de Diphyllobothrium spp. ... 112
Figura 28 - Estrutura do ovo de Diphyllobothrium spp. ... 113
Figura 29 - Formas larvares de Diphyllobothrium spp. ... 113
Figura 30 - Plerocercóides de D. latum, D. dendriticum e D. pacificum ... 114
Figura 31 - Ciclo de vida de Diphyllobothrium spp. no Homem ... 116
Figura 32 - Distribuição da difilobotriose na Europa desde 1980 ... 124
Figura 33 - Distribuição mundial dos casos de difilobotriose causada por D. latum ... 125
Figura 34 - Distribuição mundial dos casos de difilobotriose causada por D. dendriticum ... 126
Figura 35 - Distribuição mundial dos casos de difilobotriose causada por D. pacificum ... 127
Figura 36 - Distribuição mundial dos casos de difilobotriose causada por D. nihonkaiense ... 128
Figura 37 – Observação Microscópica de ovos de Diphyllobothrium spp. em amostras de fezes ... 139
Figura 38 - Proglótis de Diphyllobothrium spp. ... 140
Figura 39 - Fotografias de ovos de diferentes espécies de Diphyllobothrium, obtidas através de MEV... 141
Índice de Tabelas
Parte II
Relatório de Estágio no Serviço de Patologia Clínica do Centro Hospitalar de
Lisboa Ocidental (CHLO)
Tabela 1 - Principais meios de cultura utilizados no Laboratório de Microbiologia e respetivas características ... 12 Tabela 2 - Frações proteicas e respetivas proteínas constituintes ... 36 Tabela 3 - Parâmetros determinados por RIA e amostras utilizadas ... 67 Tabela 4 - Marcadores tumorais determinados no laboratório, características, utilidade e correlação clínicas ... 83 Tabela 5 - Parâmetros determinados no exame físico-químico da urina e respetiva correlação clínica ... 88 Tabela 6 - Programas de AEQ em que o SPC participa... 93
Parte III
Epidemiologia, patogénese, clínica, imunologia, tratamento e prevenção da
Difilobotriose – novos tempos, “nova" doença
Tabela 7 - Principais marcos na história da difilobotriose ... 108 Tabela 8 - Espécies de Diphyllobothrium spp. válidas reportadas no Homem e respetivo número de casos ... 109 Tabela 9 - Hospedeiros definitivos de D. latum, D. nihonkaiense, D. dendriticum e D.
pacificum ... 118
Tabela 10 - Pratos de peixe cru/insuficientemente cozinhado consumidos mundialmente e respetiva distribuição ... 129
Relatório de estágio realizado no Seviço de Patologia Clínica do
Centro Hospitalar de Lisboa Ocidental (CHLO)
1. Introdução
Os exames laboratoriais, enquanto meio complementar de diagnóstico e terapêutica, desempenham hoje em dia um papel essencial nos cuidados de saúde, contribuindo para o diagnóstico, monitorização, prognóstico, tratamento e prevenção da doença. Assim, é fundamental que os laboratórios de análises clínicas/patologia clínica garantam a qualidade dos resultados fornecidos, que depende de todas as atividades executadas ao longo das três fases que integram o processo analítico: pré-analítica, analítica e pós-analítica.
A fase pré-analítica inclui todos os procedimentos que precedem a análise laboratorial das amostras. A fase analítica corresponde à execução da análise propriamente dita, sendo que o controlo de qualidade e validação técnica dos resultados estão compreendidos nesta fase. Por fim, a fase pós-analítica consiste na validação biopatológica e emissão dos resultados.
Nos últimos anos, os laboratórios de análises clínicas têm vindo a tornar-se cada vez mais automatizados, o que veio permitir uma diminuição do tempo de resposta perante o elevado fluxo de amostras e uma diminuição dos erros laboratoriais. (1)
O presente relatório de estágio é referente ao estágio laboratorial realizado no âmbito do Mestrado em Análises Clínicas da Faculdade de Farmácia da Universidade de Lisboa. O estágio foi efetuado no Serviço de Patologia Clínica (SPC) do Centro Hospitalar de Lisboa Ocidental, EPE (CHLO), sob a orientação da Drª Isabel Freire, Farmacêutica Especialista em Análises Clínicas (TSS – Técnico Superior de Saúde). Decorrido entre 1 de abril e 30 de novembro de 2016, num total de 1080 horas, o estágio abrangeu as áreas da Microbiologia, Imunologia, Hematologia e Química Clínica. Cada uma destas valências foi orientada, respetivamente, por Drª Teresa Baptista Fernandes, Drª Alexandra Mendes, Drª Flora Meireles e Drª Conceição Cardoso. Teve início no Laboratório de Microbiologia e Biologia Molecular, localizado no Hospital de Egas Moniz, prosseguindo depois no Hospital de S. Francisco Xavier com as restantes valências.
Durante o período de estágio integrei a rotina laboratorial de cada uma das áreas por onde passei, manuseando as diferentes amostras recebidas no SPC e os equipamentos
utilizados (tanto ao nível da sua manutenção como ao nível do processamento das amostras), e executando diferentes técnicas manuais. Tive ainda a possibilidade de acompanhar a validação biopatológica dos resultados.
Neste relatório será feita a caracterização e descrição do funcionamento do local de estágio, uma abordagem à fase pré-analítica e, para cada uma das valências, serão descritos os principais equipamentos, metodologias e técnicas utilizadas, abordando alguns dos testes efetuados e parâmetros analíticos determinados, bem como o seu interesse e significado clínico. Por fim, será também analisada sucintamente a área da gestão da qualidade, onde serão abordados o controlo de qualidade interno e a avaliação externa da qualidade.
Face à grande variedade de técnicas executadas e parâmetros determinados no SPC, o relatório centrar-se-á apenas naqueles que foram observados e/ou realizados mais frequentemente em cada área.
2. Caracterização do Laboratório de Estágio
O CHLO foi criado em 29 de dezembro de 2005, sendo resultante da fusão do Hospital de Egas Moniz (HEM), do Hospital de Santa Cruz (HSC) e do Hospital de S. Francisco Xavier (HSFX). O Centro Hospitalar tem como missão a prestação de cuidados de saúde humanizados, de qualidade e em tempo oportuno a todos os cidadãos, dispondo de todas as valências de cuidados de saúde diferenciados e beneficiando da reconhecida qualidade assistencial das três unidades hospitalares que o compõem. (2)
O SPC está inserido no departamento de Patologia e Medicina Laboratorial, que integra um dos muitos serviços do CHLO. A Direção do SPC está a cargo do Dr. João Faro Viana, sendo que o serviço se encontra organizado de acordo com o organograma representado na figura 1. A equipa de trabalho do SPC é constituída por Médicos Patologistas Clínicos, Técnicos Superiores de Saúde, Técnicos de Análises Clínicas e Saúde Pública (TACSP), Assistentes Técnicos e Assistentes Operacionais. (2)
O SPC resulta da fusão dos três serviços existentes nos hospitais que constituem o CHLO, sendo composto pelos seguintes polos:
Laboratório Central, situado no HSFX - realiza todas as rotinas do CHLO. Inclui os Laboratórios de Química Clínica, Hematologia, Hemostase, Imunologia e Citometria de Fluxo e ainda o Laboratório de Urgência do
HSFX, que partilha as mesmas instalações e assegura um apoio médico presencial 24h/24h;
Laboratório de Microbiologia Clínica e Biologia Molecular, situado no HEM;
Laboratórios de Urgência do HEM e do HSC.
O Laboratório Central encontra-se dividido em diferentes áreas de trabalho, sendo constituído por 2 espaços principais: a central de colheitas e o laboratório “propriamente dito” onde são efetuados os procedimentos analíticos.
No espaço da central de colheitas existe também uma sala de microscopia de fluorescência e uma sala onde é realizada a técnica de radioimunoensaio. Por sua vez, o espaço do laboratório é constituído por uma área de receção, um pequeno gabinete de colheitas, uma área de receção de amostras e triagem, um open-space onde são efetuados os procedimentos da fase pré-analítica e onde funcionam os Laboratórios de Química Clínica, Hematologia, Hemostase e o Laboratório de Urgência, e ainda duas salas onde funcionam o Laboratório de Imunologia e o Laboratório de Citometria de Fluxo.
O Laboratório de Microbiologia e Biologia Molecular é constituído pelos seguintes espaços principais: uma área de receção/atendimento e de triagem das amostras recebidas, sala de colorações e, no que diz respeito apenas ao espaço da Microbiologia, três salas destinadas ao exame bacteriológico, os laboratórios de parasitologia, micologia e virologia e um laboratório de acesso restrito (P3) onde é realizado o exame micobacteriológico.
Tanto no Laboratório Central como no Laboratório de Microbiologia são recebidas amostras provenientes das diferentes áreas dos três hospitais (serviços de internamento, consultas externas, serviços de urgência, entre outros), bem como amostras externas provenientes de alguns centros de saúde. O transporte de amostras entre os vários polos do SPC é efetuado por um serviço de transporte do CHLO. No Laboratório Central, as amostras das diversas áreas do HSFX chegam através de um sistema de transporte pneumático (ou sistema de vácuo) que permite realizar o transporte interno de amostras. As amostras são colocadas numa cápsula, que é transportada através de uma rede de tubos até ao laboratório e depois do laboratório até ao local (serviço) de proveniência.
No SPC, todo o circuito analítico encontra-se informatizado com o sistema Clinidata®XXI, um sistema inteligente de gestão global de laboratórios de análises clínicas. O ClinidataXXI permite gerir todo o processo analítico, desde a prescrição dos
exames laboratoriais até à validação final dos resultados, uma vez que abrange todas as áreas da Patologia Clínica, a ligação de equipamentos e o controlo de qualidade. (3)
O SPC encontra-se a implementar um Sistema de Gestão da Qualidade de forma gradual. O Laboratório de Biologia Molecular está já certificado (NP EN ISO 9001:2008), sendo que o objetivo passa por conseguir ter todo o serviço certificado no final de 2017.(2)
3. Fase Pré-Analítica
A fase pré-analítica compreende todos os procedimentos que antecedem a análise laboratorial das amostras. É a fase onde se verifica a maioria dos erros laboratoriais, que poderão originar alterações nos resultados e, consequentemente, interpretações incorretas. Entre os fatores pré-analíticos que podem afetar os resultados estão a preparação do doente para a colheita, a colheita, identificação, transporte, tratamento e conservação das amostras.(1)
Assim que os pedidos de análises laboratoriais são registados pelos clínicos no sistema ClinidataXXI, é atribuído um número ao processo de cada doente e às amostras, que são identificadas através de um código de barras. Quando as amostras chegam ao Laboratório Central (receção/zona de triagem) e ao Laboratório de Microbiologia (receção), procede-se à sua integração no sistema informático e à triagem, sendo impressas as etiquetas de identificação necessárias. Neste processo de triagem é necessário confirmar a correta identificação das amostras e verificar o cumprimento dos critérios para a aceitação destas. Após a triagem, as amostras são distribuídas pelas diferentes áreas do laboratório.
Para algumas amostras é necessário um tratamento prévio (centrifugação) antes de serem distribuídas e analisadas nas respetivas áreas, como é o caso das amostras de soro (para a Química Clínica e Imunologia) e de plasma (para a Hemostase), e das amostras de urina para a realização de doseamentos (Química Clínica).
No Laboratório Central é utilizado um equipamento de pré-analítica, o Cobas 8000, que possibilita o processamento automático das amostras, otimizando o fluxo de trabalho e o tempo no laboratório, e diminuindo os erros associados a esta fase. A cadeia pré-analítica do Cobas 8000 é constituída pelos módulos p 671 e p 612, representados na figura 2. O módulo p 671 é composto por duas centrífugas, onde são centrifugadas as amostras de sangue total para a obtenção de soro e de plasma e as amostras de urina, de acordo com as rpm (rotações por minuto) e o tempo definidos. O módulo p 612 permite identificar os tubos, avaliar a qualidade e o volume das amostras, detetar eventuais problemas nos tubos, fazer as alíquotas necessárias para tubos secundários identificados com código de barras, e separar e agrupar as amostras por áreas. A avaliação da qualidade (índice de hemólise, lipémia e icterícia) e volume das amostras é realizada através de fotografia, que é
comparada com uma base de fotografias existentes no software do equipamento, permitindo assim aceitar ou rejeitar os tubos. (4)
Neste equipamento são separadas as amostras de soro para o laboratório de Imunologia, as amostras de plasma para o laboratório de Hemostase e as amostras de sangue total para o laboratório de Química Clínica. As restantes amostras de soro e urina para a Química seguem diretamente para os outros módulos do Cobas 8000 (descritos no capítulo 7.1.1), onde é efetuada a maior parte dos doseamentos, que se encontram ligados à cadeia pré-analítica.
Figura 2 - Cadeia pré-analítica Cobas 8000 (p 671 e p 612)
Figura 2- Cadeia pré-analítica Cobas 8000 (p 671 e p 612)
4. Microbiologia
O Laboratório de Microbiologia tem um papel fundamental no diagnóstico, tratamento e controlo das doenças infeciosas. (5) O laboratório está dividido nas áreas de bacteriologia, micobacteriologia, micologia, parasitologia e virologia, nas quais é efetuada a pesquisa, identificação e caracterização dos agentes etiológicos da infeção, e ainda os testes de suscetibilidade aos antibióticos (TSA).
Ao laboratório de Microbiologia chegam diversos tipos de amostras: urina, sangue, fezes, amostras respiratórias (expetoração, lavado broncoalveolar, secreções respiratórias e brônquicas), exsudados (vaginal, retal, faríngeo, etc), exsudados purulentos profundos e superficiais, LCR e outros líquidos biológicos (pleural, ascítico, pericárdico, etc), cabelos, unhas, pele (escamas cutâneas), biópsias e pontas de cateter, entre outras.
Para um diagnóstico microbiológico com a máxima qualidade e sensibilidade, é essencial que as amostras sejam de boa qualidade, que sejam colhidas corretamente e em quantidade suficiente, transportadas de forma adequada para o laboratório e acompanhadas de informação clínica relevante. (5,6) Após a receção dos produtos biológicos no laboratório e triagem, estes são distribuídos pelas várias áreas acompanhados da requisição em papel (com informação acerca da situação clínica do doente, terapêutica antomicrobiana em curso, local anatómico da colheita e exames pretendidos), onde ao longo do processo de identificação dos microrganismos são anotados os testes efetuados e os resultados obtidos.
No laboratório de Microbiologia são utilizadas diferentes técnicas e metodologias para a identificação e caracterização dos microrganismos e para o estudo da suscetibilidade aos antimicrobianos. As metodologias utilizadas e a valorização dos resultados dependem do produto biológico em estudo, dos microrganismos pesquisados, da informação clínica fornecida e ainda do conhecimento da microbiota normal e dos microrganismos patogénicos nos diferentes locais anatómicos.
Neste capítulo serão apenas descritos os procedimentos realizados na área da bacteriologia, uma vez que é a área em que é processado um maior número de amostras e onde decorreu a quase totalidade do estágio no laboratório de Microbiologia.
A área da bacteriologia destina-se ao diagnóstico de infeções bacterianas tendo por base não só o exame cultural, mas também outras técnicas e metodologias como o exame
microscópico, provas bioquímicas, testes de aglutinação e imunocromatográficos, sistemas automatizados, entre outras. Neste setor são também efetuados os TSA, quando aplicáveis. Após a receção dos produtos biológicos neste setor, é feita uma nova triagem no sistema informático e em seguida estes são processados de acordo com os procedimentos do laboratório e com os pedidos efetuados, sendo que, para a maior parte das amostras, o processamento tem início com o exame cultural.
4.1. Exame Cultural
O exame cultural consiste na inoculação dos produtos biológicos em meios de cultura, de forma a promover o crescimento dos microrganismos presentes nas amostras. A cultura de microrganismos tem como objetivos não só a obtenção de um crescimento suficiente dos microrganismos de interesse, mas também o seu isolamento em culturas puras, que é essencial para a identificação e caracterização, bem como para os TSA.
Os meios de cultura utilizados podem ser sólidos (gelose) ou líquidos (caldo). Os meios sólidos permitem a observação de colónias de microrganismos, da sua morfologia e de reações bioquímicas específicas. Os meios líquidos são meios de enriquecimento utilizados para promover o crescimento de bactérias presentes em baixo número, sendo que neste caso o crescimento é detetado através da turvação do meio. (6,7)
A inoculação das amostras nos meios de cultura sólidos pode ser realizada através de diferentes técnicas, consoante o objetivo e o produto biológico. Para a maior parte dos produtos biológicos, é realizada a técnica de sementeira por esgotamento, ou por quatro quadrantes (figura 3), sendo para isso utilizada uma ansa de 10 μL. Esta técnica permite obter colónias isoladas e fazer uma análise semi-quantitativa das colónias no meio de cultura. Para as amostras de urina, é realizada a técnica de sementeira por estrias (figura 3), para a qual é utilizada uma ansa de 1 μL. Esta técnica permite quantificar as colónias existentes no meio, de forma a determinar o número de unidades formadoras de colónias (UFC) por mililitro na amostra. Para além destas, é ainda utilizada a técnica de sementeira por inundação para as amostras de LCR. (7)
O processamento das amostras e inoculação nos meios de cultura é sempre realizado em câmara de fluxo laminar vertical, de forma a proteger o operador dos aerossóis, minimizando a sua exposição, e também os produtos biológicos, protegendo-os de contaminação microbiológica. (6)
Os meios de cultura são escolhidos com base no produto biológico que se pretende semear e nos microrganismos possivelmente envolvidos no processo infecioso. Na tabela seguinte são apresentados os principais meios de cultura utilizados no Laboratório de Microbiologia, assim como as suas características.
Tabela 1 - Principais meios de cultura utilizados no Laboratório de Microbiologia e respetivas características (7,8)
Meio de Cultura Características
MEIOS SÓLIDOS
Gelose Columbia + 5% de sangue de
carneiro (COS)
- Meio de isolamento que permite o crescimento de microrganismos fastidiosos e a deteção dos diferentes tipos de hemólise: α-hemólise (parcial) - coloração esverdeada à volta das colónias; β-hemólise (total) - zona clara à volta ou por baixo das colónias; γ-hemólise (ausência de hemólise) - sem alterações no meio. - É altamente nutritivo devido à presença de sangue de carneiro e peptonas, sendo adequado para a cultura da maior parte das espécies bacterianas
Gelose Columbia ANC + 5% de
sangue de carneiro (CNA)
- Meio de isolamento seletivo que permite o crescimento de bactérias Gram +. - Contém uma mistura de peptonas adaptada à cultura de microrganismos exigentes, bem como ácido nalidíxico e colimicina, que inibem a maioria das bactérias Gram − e Bacillus.
- O sangue de carneiro permite fazer a determinação do tipo de hemólise Gelose
Chocolate + PolyViteX (PVX)
- Meio de isolamento indicado para o crescimento de estirpes fastidiosas dos géneros Neisseria e Haemophilus, e de Streptococcus pneumoniae.
- Composto por uma base nutritiva enriquecida com fatores X (hemina) e V (NAD), que são fornecidos pela hemoglobina e pelo PolyViteX
Gelose Chocolate + PolyViteX VCAT3 (VCA3)
- Meio seletivo para o isolamento de Neisseria gonorrhoeae e Neisseria meningitidis a partir de amostras polimicrobianas.
- Composto pela mesma base nutritiva do meio PVX.
- A seletividade do meio deve-se à combinação de antibióticos e antifúngicos, que inibem a maior parte das bactérias e das leveduras que não as pesquisadas. Figura 3 - Técnicas de sementeira por quadrantes (esquerda) e por estrias (direita)
Tabela 1 - Principais meios de cultura utilizados no Laboratório de Microbiologia e respetivas características
(continuação) (7,8)
Meio de Cultura Características
MEIOS SÓLIDOS Gelose Chocolate
Haemophilus 2 (HAE2)
- Meio seletivo para o isolamento das diferentes espécies de Haemophilus. - Composto pela mesma base nutritiva dos meios PVX e VCA3.
- A seletividade do meio deve-se à combinação de antibióticos e antifúngicos, que inibem a maioria das bactérias Gram + e das leveduras.
Gelose Mac Conkey (MAC)
- Meio de isolamento seletivo e diferencial para a deteção de Enterobacteriaceae em amostras de origem diversa.
- Permite evidenciar a fermentação da lactose através da mudança de cor para vermelho. Colónias lactose (+): rosas a vermelhas, por vezes contornadas por um halo de sais biliares. Colónias lactose (−): incolores ou ligeiramente beges. - Contém cristal violeta e sais biliares, que inibem a maioria das bactérias Gram+
Gelose Hektoen (HEKT)
- Meio seletivo e diferencial para a deteção de espécies de Salmonella e Shigella.
- Tem na sua composição 3 açúcares. Microrganismos fermentadores de pelo menos um açúcar: colónias amarelas ou rosa-amareladas.
- Colónias de Salmonella e de Shigella (não fermentadoras): verdes ou verdes-azuladas. As colónias de Salmonella poderão ou não apresentar um centro negro, devido à produção de sulfureto de hidrogénio (H2S)
Gelose Sabouraud Gentamicina Cloranfenicol 2
(SGC2)
- Meio seletivo para o isolamento de leveduras e fungos a partir de amostras polimicrobianas. A presença de peptonas, dextrose e o pH ligeiramente ácido da gelose favorecem o crescimento dos fungos.
- A gentamicina inibe a maioria das bactérias Gram − e Gram +, e o cloranfenicol melhora a seletividade para determinadas espécies que podem ser resistentes à gentamicina (Streptococcus, Proteus)
Gelose Granada (GRAN)
- Meio de isolamento seletivo utilizado para a identificação direta de Streptococcus agalactiae em mulheres grávidas.
- Colónias de S. agalactiae: cor alaranjada, devido à produção de um pigmento
Gelose Candida chromID (CAN2)
- Meio cromogénico para o isolamento seletivo de leveduras e para a identificação direta de Candida albicans.
- C. albicans: colónias azuis, devido à hidrólise de um substrato cromogénico. - Permite diferenciar culturas mistas onde estão presentes outras espécies de Candida, cujas colónias apresentam cor rosa
Gelose BCYE
- Meio enriquecido utilizado para o isolamento de Legionella.
- Contém: L-cisteína, um aminoácido nutritivo essencial ao crescimento das espécies de Legionella; carvão ativado, que decompõe o peróxido de hidrogénio, um produto metabólico tóxico para estas espécies
Gelose Campylosel
(CAM)
- Meio seletivo para o isolamento de Campylobacter (principalmente C. jejuni e C. coli). As colónias de Campylobacter são pequenas e acinzentadas. - Contém antibióticos e antifúngicos que inibem o crescimento da maior parte das bactérias e fungos
Gelose Mueller Hinton (MHE)
- Destina-se à realização de TSA por difusão em disco e por tiras E-test. - A sua composição permite o crescimento de bactérias não exigentes como Staphylococcus spp., Enterococcus spp., Enterobacteriaceae, entre outros Gelose Mueller
Hinton + 5% sangue de cavalo +
NAD (MHF)
- Destina-se à realização de TSA pelos métodos de difusão em disco e de tiras E-test, de microrganismos fastidiosos (Streptococcus pneumoniae e outras espécies de Streptococcus, Haemophilus e Moraxella)
Tabela 1 - Principais meios de cultura utilizados no Laboratório de Microbiologia e respetivas características
(continuação) (7,8)
Meio de Cultura Características
MEIOS LÍQUIDOS Caldo Brain Heart
Infusion (BHI)
- Meio nutritivo que contém tecido cerebral e cardíaco, e peptonas para fornecer proteínas e outros nutrientes necessários ao crescimento de microrganismos exigentes e não exigentes
Caldo de Selenito
- Meio enriquecido para o isolamento de Salmonella spp. e de algumas espécies de Shigella.
- O selenito de sódio inibe o crescimento de outras bactérias Gram + e Gram − presentes em amostras fecais
Caldo Todd-Hewitt
- Utilizado principalmente como meio de crescimento de Streptococcus β-hemolíticos. Contém peptonas, dextrose e sais, sendo altamente nutritivo. - A presença de antibióticos (gentamicina e ácido nalidíxico) inibe o crescimento de bacilos Gram − presentes
Tioglicolato
- Meio de enriquecimento para o crescimento de diversas bactérias aeróbias e anaeróbias.
- O tioglicolato de sódio e a cisteína presentes no meio atuam como agentes redutores. A pequena quantidade de agar adicionada impede a difusão do O2 para o fundo do tubo, permitindo o crescimento de anaeróbios nessa zona
Para que ocorra crescimento de microrganismos, para além dos nutrientes fornecidos pelo meio de cultura, é também necessário fornecer condições ambientais ótimas, sendo a temperatura e a atmosfera de incubação (O2 e CO2) dois dos principais
fatores. Assim, após a inoculação das amostras nos meios de cultura, estes são colocados numa estufa, sendo que as condições de incubação são determinadas pelo tipo de produto biológico e pelos microrganismos que se pretende pesquisar e que poderão ser detetados.
A maior parte dos meios de cultura é colocada numa estufa a cerca de 35°C (a temperatura ótima para o desenvolvimento da maioria dos microrganismos ronda os 35-37°C, embora para alguns microrganismos a temperatura seja diferente, sendo necessário colocar esses meios de cultura em estufas com temperaturas adequadas) e com uma atmosfera que contém cerca de 5% de CO2, permitindo assim o crescimento dos
microrganismos aeróbios e dos capnofílicos. Para o crescimento dos microrganismos anaeróbios e dos microaerófilos são necessárias atmosferas diferentes, criadas através da utilização de jarras que contêm geradores que permitem criar as atmosferas adequadas.
O tempo de incubação necessário para o crescimento depende dos microrganismos, sendo que, geralmente, os meios de cultura são incubados durante 24-48 horas. No caso dos anaeróbios, o tempo de crescimento pode ser superior, sendo necessária a incubação durante um maior período de tempo. (6–8)
Após a incubação, os meios de cultura são observados e é feita a análise da morfologia das colónias, em que são avaliadas características como o tamanho, cor, forma, aspeto, cheiro e alterações no meio de cultura provocadas pelo crescimento dos microrganismos. A valorização clínica das colónias presentes no meio baseia-se na compreensão da patogenia da infeção nos diferentes locais anatómicos.
Esta avaliação inicial das culturas tem grande importância, pois permite determinar quais os testes e procedimentos necessários para a identificação e caracterização definitivas dos microrganismos de interesse. Para a realização destes testes, assim como para os TSA, são necessárias culturas puras (todas as colónias são idênticas e têm origem na mesma célula parental) dos microrganismos que se pretende identificar. Os microrganismos isolados inicialmente a partir do produto biológico encontram-se muitas vezes em culturas mistas, sendo por isso necessário proceder ao seu reisolamento para outro(s) meio(s) de cultura, de forma a obter culturas puras. (6,8)
4.2. Exame Microscópico
O exame microscópico constitui uma das etapas iniciais do processo de identificação e caracterização de um microrganismo. Este pode ser utilizado para a deteção de microrganismos diretamente a partir dos produtos biológicos e para a caracterização dos microrganismos que cresceram nos meios de cultura.
A informação obtida através do exame microscópico permite fazer a identificação presuntiva do possível agente infecioso, sendo por vezes utilizada para direcionar a terapêutica inicial e também para determinar quais os testes de identificação subsequentes. O exame microscópico abrange o exame a fresco e o exame após coloração.(6)
4.2.1. Exame a Fresco
O exame a fresco é realizado entre lâmina e lamela, diretamente a partir do produto biológico. Este exame permite avaliar o número e tipo de células presentes na amostra, tais como células epiteliais, leucócitos e os microrganismos. No Laboratório de Microbiologia, a preparação de lâminas para exame a fresco é realizada para os exsudados endocervical, uretral e vaginal. (6)
4.2.2. Exame Após Coloração
O exame microscópico de preparações coradas permite determinar várias características das bactérias, tanto morfológicas como relativas ao modo de agrupamento e à afinidade para os corantes. Os esfregaços podem ser realizados diretamente a partir das amostras, ou das colónias obtidas nos meios de cultura (através da sua suspensão numa gota de água destilada). Após a secagem dos esfregaços, estes são fixados com metanol e em seguida procede-se à sua coloração, que é realizada num equipamento automático. As colorações utilizadas no Laboratório de Microbiologia são a coloração de Gram e a de Ziehl-Neelsen. (6,8)
Coloração de Gram
A coloração de Gram permite dividir as bactérias em Gram-positivo (Gram +) e Gram-negativo (Gram −) com base na afinidade para os corantes utilizados, que é determinada por diferenças na estrutura da parede celular das bactérias.
Nesta técnica, inicialmente é utilizado o corante cristal violeta (cor roxa), seguido de uma solução de lugol (iodo) que aumenta a ligação do corante à parede celular das bactérias, e depois uma solução descorante de álcool-acetona, que remove o corante. Por último, é adicionado um segundo corante, a safranina (cor rosa), que cora os microrganismos que não retiveram o cristal violeta. As bactérias Gram-positivo, devido a possuírem uma camada espessa de peptidoglicano, retêm o cristal de violeta, corando de violeta/roxo. As bactérias Gram-negativo, por outro lado, apresentam uma camada fina de peptidoglicano e uma membrana celular externa, pelo que não retêm o cristal violeta e por isso são coradas pela safranina, apresentando uma coloração rosa. (6,9)
A preparação de esfregaços para coloração de Gram diretamente a partir dos produtos biológicos é realizada para a maior parte dos exsudados, para os líquidos biológicos, amostras do aparelho respiratório, LCR e hemoculturas positivas.
Coloração de Ziehl-Neelsen
A coloração de Ziehl-Neelsen é utilizada na deteção de bactérias álcool-ácido resistentes, nomeadamente as bactérias do género Mycobacterium, como o M. tuberculosis. A parede celular das bactérias álcool-ácido resistentes contém ácidos micólicos, que as tornam resistentes à descoloração por soluções álcool-ácidas. Assim, após a aplicação do primeiro corante, a carbolfucsina (cora de vermelho), este é retido pelas bactérias
álcool-adicionado um corante de contraste, o azul de metileno (cora de azul), que cora as células e outros microrganismos que perdem a coloração pela carbolfucsina após a descoloração.
Desta forma, os bacilos álcool-ácido resistentes (BAAR) surgem corados de vermelho, enquanto os restantes elementos observados no esfregaço coram de azul. (6) A preparação de esfregaços diretamente a partir dos produtos biológicos é realizada para as amostras do aparelho respiratório inferior como a expetoração, LBA, secreções brônquicas e respiratórias, e ainda para o líquido pleural.
4.3. Testes de Identificação de Microrganismos
Após o isolamento dos microrganismos em culturas puras, procede-se à sua identificação. No laboratório de Microbiologia são utilizados vários testes que auxiliam este processo e que permitem fazer uma identificação presuntiva dos microrganismos em estudo, com base nas características metabólicas e nutricionais desses microrganismos e em reações antigénio-anticorpo (testes de aglutinação). Em seguida são apresentados alguns dos principais testes de identificação presuntiva realizados no laboratório e que foram observados e/ou realizados durante o estágio.
4.3.1. Provas Bioquímicas
Catalase
O teste da catalase é utilizado para distinguir dois géneros de bactérias Gram-positivo, os Staphylococcus spp. (catalase positiva) e os Streptococcus spp. (catalase negativa).
Esta prova baseia-se na deteção da presença da enzima catalase, que tem a capacidade de converter o peróxido de hidrogénio em oxigénio e água. O procedimento consiste em colocar uma gota de peróxido de hidrogénio numa lâmina e em seguida transferir uma colónia isolada do meio de cultura para a lâmina. A reação positiva, que indica a presença da catalase, é evidenciada pela rápida produção de bolhas de ar. (6)
Oxidase
O teste da oxidase permite detetar a presença da enzima citocromo oxidase, que participa no transporte de eletrões de um dador para um aceitador (normalmente o oxigénio). Esta prova é utilizada para a caracterização de bacilos Gram-negativo, permitindo diferenciar microrganismos da família das Enterobacteriaceae (oxidase
negativa) de outros bacilos pertencentes aos géneros Pseudomonas spp. e Aeromonas spp. (oxidase positiva).
Para a realização deste teste é utilizado o dihidrocloreto de tetrametil p-fenilenodiamina (composto que atua como aceitador de eletrões), que é colocado num disco fornecido com o kit, sobre o qual é seguidamente espalhada uma colónia isolada. Na presença da enzima oxidase, este reagente sofre oxidação e origina um composto de cor roxa. Na ausência de oxidase não ocorre mudança de cor, indicando uma reação negativa.(6,8)
Urease
O teste da urease é útil na identificação de algumas espécies pertencentes à família das Enterobacteriaceae, como o Proteus spp. (urease positiva), e também de outras bactérias importantes como o Helicobacter pylori.
Esta prova permite detetar a presença da enzima urease, que tem a capacidade de hidrolisar a ureia em amónia e CO2. Para este teste é utilizado o meio líquido ureia-indol
que tem na sua composição ureia e um indicador de pH (vermelho de fenol), no qual é colocada uma colónia isolada. A produção de amónia alcaliniza o meio, dando origem a uma mudança de cor do indicador de pH, de laranja para rosa, após incubação a 35-37°C em atmosfera de aerobiose durante 24h. A ausência de alteração da cor do meio corresponde a um resultado negativo, indicando assim a ausência da enzima urease. (6)
4.3.2. Testes de Aglutinação
Identificação Rápida de Staphylococcus aureus - SLIDEX® Staph Plus
O SLIDEX Staph Plus é um teste de aglutinação para a identificação de
Staphylococcus aureus. Neste teste são utilizadas partículas de látex sensibilizadas com
fibrinogénio humano e anticorpos monoclonais, para a deteção do fator de afinidade para o fibrinogénio (clumping factor), da proteína A e de antigénios de superfície específicos de
S. aureus.
O procedimento consiste em colocar uma gota do reagente num dos círculos dos cartões fornecidos com o kit, em seguida dissolver uma ou mais colónias e observar o resultado 30 segundos após ligeira rotação. A observação de aglutinação significa que o resultado é positivo, indicando assim a presença de Staphylococcus aureus.
desta prova são necessárias 4 a 24 horas de incubação, tendo por isso sido substituída pelo teste rápido de aglutinação, embora em alguns casos possa ser utilizada uma vez que é o método de referência. (9)
Deteção de Staphylococcus aureus Resistentes à Meticilina - SLIDEX® MRSA Detection
O SLIDEX® MRSA Detection é um teste de aglutinação com partículas de látex para a deteção de Staphylococcus aureus resistentes à meticilina (MRSA), com base na produção da proteína PBP2’. A resistência à meticilina é determinada pela aquisição de um elemento genético móvel do qual faz parte o gene mecA, que codifica a PBP2’. Esta proteína tem uma baixa afinidade para os antibióticos β-lactâmicos, nos quais se inclui a meticilina, o que permite a sobrevivência do S. aureus quando exposto a estes antibióticos. Neste teste, as partículas de látex encontram-se sensibilizadas com um anticorpo monoclonal contra a PBP2’ e vão reagir de forma específica com os MRSA, observando-se uma aglutinação que indica um resultado positivo. (7,9)
4.3.3. Teste de Sensibilidade à Optoquina
O teste de sensibilidade à optoquina permite fazer a identificação presuntiva de
Streptococcus pneumoniae, diferenciando-os de outros estreptococos α-hemolíticos,
nomeadamente os Streptococcus viridans. Este teste baseia-se no facto de o Streptococcus
pneumoniae ser sensível à optoquina, contrariamente aos restantes estreptococos
α-hemolíticos.
Para a realização desta prova é semeada uma gelose COS, com colónias isoladas cuja morfologia seja sugestiva de S. pneumoniae. Em seguida é colocado um disco impregnado com optoquina no centro da gelose e esta é incubada a 35°C em atmosfera com 5% CO2, durante 24h. Após a incubação, a presença de um halo de inbição de crescimento
à volta do disco, com um diâmetro igual ou superior a 14 mm ou 16 mm (dependendo do tamanho do disco utilizado), permite fazer a identificação presuntiva de S.
pneumoniae.(6,7)
4.3.4. Teste da Necessidade dos Fatores X e V
O teste da necessidade dos fatores X e V é utilizado para diferenciar as espécies de
Haemophilus, com base na necessidade dos fatores de crescimento X e/ou V. As diferentes
sangue para poderem crescer nos meios de cultura, nomeadamente os fatores X e V. Algumas espécies de Haemophilus necessitam apenas do fator X ou do fator V, enquanto outras necessitam de ambos os fatores para se desenvolverem.
Nesta prova é preparada uma suspensão em NaCl a 0,85% das colónias sugestivas de Haemophilus (isoladas em gelose de chocolate PVX ou HAE2), de 0,5 na escala de McFarland. A suspensão é inoculada numa gelose MHE com uma zaragatoa, através da técnica de espalhamento (distribuição uniforme da suspensão em toda a superfície da gelose). Em seguida, são colocados os três discos (X, V e X+V) no meio de cultura, de forma a ficarem o mais afastados possível, e este é incubado a 35°C em atmosfera com 5% CO2, durante 24h. Após a incubação é feita a observação dos resultados: (6,7)
Crescimento à volta do disco com fator V e do disco X+V - bactéria necessita apenas do fator V;
Crescimento à volta do disco com fator X e do disco X+V - bactéria requer apenas o fator X;
Crescimento apenas à volta do disco X+V – bactéria necessita de ambos os fatores em simultâneo.
Neste teste é ainda semeada uma gelose de chocolate PVX com a suspensão preparada, de forma a verificar a pureza das colónias isoladas.
4.4. Identificação de Microrganismos - Sistema Automatizado
VITEK®2
A identificação definitiva dos microrganismos em estudo é realizada através do sistema automatizado VITEK® 2. Este sistema é utilizado para a identificação de microrganismos e para a realização dos TSA, através de cartas de teste (identificação e antibiograma). Estas cartas têm vários poços, em que cada um contém um substrato bioquímico (cartas de identificação) ou um agente antimicrobiano (cartas de antibiograma). Este sistema é constituído por uma estação de carregamento das amostras (VITEK®2 Smart Carrier Station™) e por um módulo principal onde é efetuada a inoculação, incubação e leitura das cartas, que estão ligados através de um sistema informático (figura 4).
Esta suspensão é feita em 3 mL de NaCl a 0,50%, sendo a sua turvação ajustada a um padrão da escala de McFarland, que varia consoante a carta de identificação utilizada. A turvação da suspensão é medida através do dispositivo DensiCHEK™ (figura 4).
Após a preparação das suspensões, estas são colocadas na cassete Smart Carrier Station, onde são associadas informaticamente às respetivas cartas de teste. Em seguida, a cassete é colocada no módulo principal, onde é realizada a inoculação das suspensões nas cartas (através de um sistema de vácuo), a incubação a 35,5°C ± 1°C, e por fim a leitura dos resultados.
É também semeada uma gelose COS ou outro meio de cultura adequado ao crescimento da estirpe em estudo, com a suspensão preparada, de forma a verificar a pureza da mesma.
A tecnologia do VITEK 2 baseia-se na monitorização contínua do crescimento e da atividade dos microrganismos em cada poço de teste, medidos através de um sistema ótico de transmitância. A transmitância mede a intensidade da luz transmitida por um feixe que atravessa uma solução que absorve luz a um determinado comprimento de onda. É realizada uma leitura inicial da transmitância em cada poço e em seguida são efetuadas leituras com intervalos de 15 minutos, até ao fim do tempo de incubação das cartas.
O sistema VITEK2 permite assim reduzir o tempo de resposta, que varia entre 2 e 18 horas. (9,10)
Para a identificação dos vários microrganismos, no Laboratório de Microbiologia são utilizadas diferentes cartas de identificação (figura 5):
GP – Identificação de bactérias Gram-positivo (cocos e lactobacilos);
GN – Identificação de bactérias Gram- negativo (bacilos);
YST – Identificação de leveduras;
NH – Identificação de bactérias fastidiosas (Neisseria spp., Haemophilus spp., entre outras);
ANC – Identificação de bactérias anaeróbias
A identificação dos microrganismos é efetuada com base em ensaios colorimétricos, nos quais ocorrem reações metabólicas que envolvem os substratos presentes nos diferentes poços, originando produtos coloridos, que são depois medidos pelo sistema ótico. (9,10)
4.5. Testes de Suscetibilidade aos Antibióticos (TSA)
Após a identificação do microrganismo em estudo, é realizado TSA ou antibiograma, que permite medir in vitro a suscetibilidade do microrganismo aos agentes antimicrobianos, fornecendo informações essenciais para a escolha da terapêutica mais adequada. Os TSA devem ser realizados para qualquer microrganismo responsável por um processo infecioso e que necessite de terapêutica antimicrobiana, sempre que a suscetibilidade aos antimicrobianos não puder ser previsível após a identificação do microrganismo. (7,8)
Estes testes baseiam-se na determinação da Concentração Mínima Inibitória (CMI), que corresponde à menor concentração de antibiótico que inibe o crescimento de um microrganismo in vitro. O resultado dos antibiogramas é dado como sensível, resistente ou intermédio. (7) A realização dos TSA e a interpretação dos resultados seguem as recomendações do European Committee on Antimicrobial Susceptibility Testing (EUCAST) e também do Clinical and Laboratory Standards Institute (CLSI).
No laboratório de Microbiologia, a determinação da suscetibilidade aos antimicrobianos é realizada pelo método de microdiluição, através do sistema VITEK2, ou por métodos manuais, nomeadamente o método de difusão em disco (Kirby-Bauer) e o método de gradiente de difusão (Etest®). Os antibiogramas manuais são realizados para
Figura 5 - Cartas de Identificação VITEK 2
sistema VITEK2, e também quando os resultados obtidos com o equipamento VITEK2 não são consistentes. (7)
Para além destes métodos manuais, no laboratório de Microbiologia são ainda realizados outros testes manuais para a deteção de mecanismos de resistência, como a deteção de β-lactamases de largo espetro (ESBL) e a deteção de resistência induzida à clindamicina, entre outros.
Para todos os TSA é semeado um meio de cultura adequado ao crescimento do microrganismo em estudo com a suspensão bacteriana preparada, para verificar a sua pureza.
4.5.1. Método de Microdiluição – VITEK2
Tal como para os testes de identificação, nos TSA são também utilizadas cartas de teste (AST). Estas cartas permitem ober resultados de TSA para vários microrganismos clinicamente relevantes: cocos Gram-positivo, bacilos Gram-negativo e leveduras.
Os antibiogramas efetuados têm por base o princípio da turbidimetria, que é um método ótico que mede a redução da intensidade de luz transmitida, devido ao efeito de dispersão que resulta da interação de um feixe de luz com uma suspensão de partículas.
Após a incubação das cartas, são determinados os valores da CMI e a suscetibilidade do microrganismo em relação a cada um dos antimicrobianos presentes nos poços da carta.(7,9)
4.5.2. Métodos Manuais
Método de Difusão (Kirby-Bauer)
O método de difusão em disco, ou método de Kirby-Bauer, é utilizado para testar a suscetibilidade das bactérias de crescimento rápido e de alguns microrganismos exigentes. Neste método são utilizados discos impregnados com um determinado antibiótico, que são colocados numa gelose MHE ou MHF, previamente inoculada com uma suspensão padronizada (0,5 na escala de McFarland) do microrganismo a testar. A suspensão é inoculada no meio de cultura com uma zaragatoa, através da técnica de espalhamento.
Após a aplicação dos discos, as geloses são incubadas a 35°C em aerobiose (as geloses MHF são incubadas em atmosfera com 5% de CO2) durante 16 a 18 horas. Durante
o período de incubação, o antibiótico difunde-se radialmente e forma-se um halo de inibição de crescimento, cujo diâmetro é inversamente proporcional à CMI. O diâmetro do
halo de inibição é medido (em milímetros) e os resultados são interpretados de acordo com os critérios EUCAST e CLSI. (6,7)
Método de Gradiente de Difusão - Etest®
O método de gradiente de difusão (Etest®) combina o princípio do método de Kirby-Bauer com o método de diluição. Neste método são utilizadas tiras de plástico com um gradiente de concentrações do antibiótico, que permitem determinar a CMI.
A tira ou tiras Etest® que contêm o antibiótico de interesse são colocadas numa gelose MHE ou MHF previamente inoculada com uma suspensão do microrganismo a estudar. A preparação da suspensão e as condições de incubação das geloses são idênticas ao método de Kirby-Bauer. Após a incubação, forma-se uma elipse que interseta a escala de leitura da CMI (em µg/mL) na tira, onde a concentração do antibiótico testado inibe o crescimento do microrganismo.
Este método permite complementar os TSA automatizados e os TSA realizados pelo método de Kirby-Bauer, sendo útil para determinar a CMI de microrganismos fastidiosos ou de crescimento lento, detetar baixos níveis de resistência e ainda detetar ou confirmar mecanismos de resistência aos antimicrobianos. (8,9)
4.6. Processamento de Produtos Biológicos
Neste capítulo é abordado o processamento laboratorial de alguns dos produtos biológicos mais frequentes no Laboratório de Microbiologia, no que diz respeito ao exame cultural e ao exame microscópico. São também abordados alguns aspetos relevantes relativos à colheita e transporte das amostras.
4.6.1. Urina
As infeções do trato urinário constituem uma das infeções bacterianas mais frequentes no Homem. A infeção urinária é normalmente causada por bactérias da microbiota intestinal saprófita, que invadem o trato urinário por via ascendente, através da uretra.
Os agentes etiológicos mais comuns nas crianças e adultos sem outras doenças associadas são as Enterobacteriaceae, principalmente a Escherichia coli. Já nos doentes internados e com fatores de risco associados, existem outros agentes etiológicos que
poderão ser responsáveis pela infeção, como Pseudomonas spp, Staphylococcus aureus, entre outros. (6,8)
As amostras de urina podem ser colhidas por micção (jato médio), sendo preferível a primeira urina da manhã, por punção de cateter urinário (algália) ou por punção supra-púbica, entre outras, devendo a colheita ser realizada após limpeza e desinfeção locais.
Após a triagem das amostras de urina, estas são semeadas (urocultura) nas geloses COS e MAC, com uma ansa de 1 μL, através da técnica de sementeira por estrias. Como referido anteriormente, esta técnica permite determinar o número de UFC por mililitro (UFC/mL) na amostra. Após a inoculação das amostras, os meios de cultura são colocados na estufa a 35°C com uma atmosfera de 5% de CO2, durante 24h.
No dia seguinte os meios de cultura são observados e é feita a contagem do número de colónias, que é multiplicado por 103, obtendo-se assim o número de UFC/mL. De uma maneira geral, um valor ≥105 UFC/mL é considerado positivo e significativo de infeção
urinária.
Nas culturas em que se observa um ou dois tipos de colónias predominantes (≥105 UFC/mL) é realizada a identificação (após reisolamento, quando necessário) e TSA do(s) microrganismo(s) em questão. A presença de três ou mais tipos de colónias, sem predomínio de um tipo de colónia, indica uma provável contaminação, sendo normalmente pedida uma nova colheita. No entanto, a valorização dos resultados tem em conta uma série de parâmetros como o método de colheita da urina, o tipo de doente e a sintomatologia, entre outros. (7,8)
4.6.2. Sangue (Hemocultura)
O isolamento e deteção de microrganismos no sangue através de exame cultural (hemocultura) é útil no diagnóstico de bacteriémia. Alguns dos microrganismos mais frequentemente isolados a partir do sangue são: S. aureus, Staphylococcus coagulase-negativa, Streptococcus pneumoniae, E. coli e Enterococcus spp., entre outros.
O sangue é um produto biológico estéril, pelo que o isolamento de um microrganismo a partir de uma hemocultura é normalmente valorizado. No entanto, é importante distinguir infeção de contaminação por microrganismos da microbiota cutânea, com base no quadro clínico do doente e nos resultados das várias hemoculturas. Os microrganismos da microbiota cutânea (Staphylococcus coagulase-negativa, Bacillus spp.,