REVISTA
BRASILEIRA
DE
ANESTESIOLOGIA
PublicaciónOficialdelaSociedadeBrasileiradeAnestesiologia www.sba.com.brARTÍCULO
CIENTÍFICO
Evaluación
de
la
genotoxicidad
inducida
por
la
administración
repetida
de
anestésicos
locales:
un
estudio
experimental
en
ratones
Gisele
Alborghetti
Nai
a,∗,
Mariliza
Casanova
de
Oliveira
b,
Graziela
de
Oliveira
Tavares
c,
Laís
Fabrício
Fonseca
Pereira
c,
Nádia
Derli
Salvador
Lemes
Soares
dy
Patrícia
Gatti
Silva
daDepartamentodePatología,UniversidadedoOestePaulista,PresidentePrudente,SP,Brasil bUniversidadedoOestePaulista,PresidentePrudente,SP,Brasil
cFacultaddeOdontologíadePresidentePrudente,UniversidadedoOestePaulista,PresidentePrudente,SP,Brasil dFacultaddeMedicinadePresidentePrudente,UniversidadedoOestePaulista,PresidentePrudente,SP,Brasil
Recibidoel16demayode2013;aceptadoel25dejuliode2013
DisponibleenInternetel31deoctubrede2014
PALABRASCLAVE
Anestesia; Genotoxicidad; Testsde mutagenicidad; Testsde micronúcleos; Prilocaína
Resumen
Justificaciónyobjetivos: Estudiospreviossobrelosefectosdealgunosanestésicoslocaleshan mostradoqueesosagentespuedencausaralteracionesgenéticas.Sinembargo,esosagentes nosontestadosparalagenotoxicidadrelacionadaconlaadministraciónrepetida.Elobjetivo deesteestudiofueevaluarelpotencialgenotóxicodeanestésicoslocalesdespuésderepetidas administraciones.
Métodos: 80ratonesWistarmachossedividieronen:grupoA:16ratonesquerecibieron inyec-ciónporvíaintraperitoneal(IP)declorhidratodelidocaínaal 2%;grupo B:16 ratonesalos queselesadministróinyecciónIPconmepivacaínaal2%;grupoC:16ratonesquerecibieron inyecciónIPdearticaína al4%;grupoD:16 ratonesalosqueselesadministróinyecciónIP deprilocaínaal3%(6mg/kg);grupoE:8ratonesquerecibieroninyecciónsubcutáneaendosis única deciclofosfamida; grupoF:8ratones querecibieroninyecciónIPconsolución salina. OchoratonesdelosgruposAaDrecibieronunadosisúnicadeanestésicoelprimerdíadela experiencia;losratonesrestantessedosificaronunavezpordíadurante5días.
Resultados: La mediana del número demicronúcleos en los grupos con anestésicoslocales expuestos duranteunoo5díasvarióde0a1;enelgrupoexpuestoalaciclofosfamidafue de10yenelgrupocontrolnegativoenelprimeroyquintodíafuede1y0respectivamente (p<0,0001). Seobservó unadiferenciasignificativa enelnúmero de micronúcleosentre el grupo ciclofosfamida y todoslos grupos con anestésicoslocales (p=0,0001), perono entre elgrupocontrolnegativoylosgruposconanestésicoslocales(p>0,05).
∗Autoraparacorrespondencia.
Correoselectrónicos:patologia@unoeste.br,gica@muranet.com.br(G.A.Nai).
2255-4963/$–seefrontmatter©2013SociedadeBrasileiradeAnestesiologia.PublicadoporElsevierEditoraLtda.Todoslosderechosreservados.
Conclusión:Ningúnefectodegenotoxicidadfueobservadodespuésdelaexposiciónrepetida acualquieradelosanestésicoslocalesevaluados.
©2013SociedadeBrasileiradeAnestesiologia.PublicadoporElsevierEditoraLtda.Todoslos derechosreservados.
KEYWORDS
Anesthesia; Genotoxicity; Mutagenicitytests; Micronucleustests; Prilocaine
Evaluationofgenotoxicityinducedbyrepetitiveadministrationoflocalanesthetics: anexperimentalstudyinrats
Abstract
Backgroundandobjective: Previous studies regardingthe effects of some local anesthetics havesuggestedtheseagents maycause geneticdamage.However, theyhavenotbeen tes-tedforgenotoxicityrelatedtorepetitiveadministration.Theaimofthisstudywastoevaluate thegenotoxicpotentialoflocalanestheticsuponrepetitiveadministration.
Methods:80maleWistarratswereallocatedinto:groupA-16ratsinjectedintraperitoneally (IP)withlidocainehydrochloride2%;groupB-16ratsIPinjectedwithmepivacaine2%;group C- 16 rats IPinjected with articaine4%; group D -16 rats IPinjected with prilocaine 3% (6.0mg.kg---1);groupE-8ratssubcutaneouslyinjectedwithasingledoseofcyclophosphamide;
andgroupF-8ratsIPinjectedwithsaline.EightratsfromgroupsAtoDreceivedasingledose ofanaestheticonday1oftheexperiment;theremainingratswereinjected onceadayfor 5days.
Results:Themediannumberofmicronucleiinthelocalanestheticsgroupsexposedforoneor 5daysrangedfrom0.00to1.00,inthecyclophosphamide-exposedgroupwas10.00,andthe negativecontrolgroupfor1and5dayswas1.00and0.00,respectively(p<0.0001).Asignificant differenceinthenumberofmicronucleiwasobservedbetweenthecyclophosphamidegroup andalllocalanestheticgroups(p=0.0001),butnotbetweenthenegativecontrolgroupand thelocalanestheticgroups(p>0.05).
Conclusion:Nogenotoxicityeffectwasobserveduponrepetitiveexposuretoanyofthelocal anestheticsevaluated.
©2013SociedadeBrasileiradeAnestesiologia.PublishedbyElsevier EditoraLtda.Allrights reserved.
Introducción
Eldesarrollo deagentes anestésicos localessegurosy efi-cacesfueunodelosmásimportantesavancesdelaciencia odontológicaalolargodelsiglopasado.Losagentes odonto-lógicosdisponibleshoyporhoysonextremadamenteseguros yrespetanlamayoríadeloscriteriosdeunanestésicolocal ideal.Esosagentesanestésicoslocalesinducenunamínima irritacióndeltejidoypresentanunbajoriesgodeoriginar reaccionesalérgicas1.
Unanestésicolocalseusamásamenudoenla odontolo-gíaparacontrolareldolor,ademásdesermuyutilizadoen otroscamposdelamedicina.Entrelasvariasformulaciones deanestésicoslocales,lostiposmásutilizadossonlassales anestésicasdelidocaína,mepivacaínayprilocaína2.
Lacombinacióndevasoconstrictorydeanestésicolocal fueusadaporprimeravezen1901cuandoBraunadministró simultáneamenteadrenalinaycocaína3.Debidoalas
propie-dadesvasodilatadorasdelamayoríadelassalesanestésicas, laduración delaanestesia nosiempreeslaadecuada, lo quemuestralanecesidaddeadministraciónconcomitante de unvasoconstrictor. Algunas ventajas de la administra-ción combinada de vasoconstrictores y anestésicos son la lentaabsorcióndelasal anestésica(loquereducela toxi-cidadyaumentaladuracióndelaanestesia),lareducción dela cantidad de anestésiconecesaria para anestesiar al
paciente y el aumentode la eficacia delanestésico2.Los
vasoconstrictoresmásamenudousadosencombinacióncon losanestésicos locales pertenecenal grupode las aminas simpaticomiméticasqueincluye laadrenalina,la noradre-nalina,lalevonordefrina,fenilefrinayfelipresina2.
Losagentesgenotóxicosafectannegativamentela inte-gridaddelmaterialgenéticodeunacélulaysondefinidos comocualquier sustanciaoproductoquímicoque perjudi-queelADN.Aunquelacapacidaddeunasustanciaparada˜nar elADNnolaconviertaautomáticamenteenunpeligropara lasalud,loquenospreocupaessabersilasustanciapuede serpotencialmentemutagénicay/ocarcinógena4.
Algunosanestésicoslocalesnohansidotestadosparala carcinogenicidadogenotoxicidad.Laprilocaínaesun anes-tésicolocalquefueanalizadoporelProgramaNacionalde Toxicología(NTP,EE.UU.)desdeoctubrede20075.
El test de micronúcleos es muy usado para evaluar la capacidad de una sustancia para romper los cromosomas (suclastogenicidad)oparaafectarlaformacióndelaplaca metafásicay/ohuso mitótico,amboscapacesdeconducir a la distribución desigual de cromosomasdurante la divi-sióncelular6.Eltestdemicronúcleosgeneraresultadoscon
larealización deltestde micronúcleosposibilitósu adop-cióngeneralizadaentodoelmundocomountestestándar degenotoxicidadparamonitorizarlaseguridaddeagentes paraelusoenlapoblaciónhumana8.
Deacuerdo con nuestrainvestigación,noexisten estu-diosenlaliteraturasobreelpotencial genotóxicodeluso repetitivo de anestésicos locales. Los anestésicos locales sonampliamenteusadosenodontologíayenmedicina,ylos estudiosquecalculanelriesgodelaexposiciónrepetitivaa esassustanciaspuedencontribuirconunamejor compren-sióndesusefectospotencialmentetóxicossobreelmaterial genéticoysuspotencialesriesgosparalospacientes expues-tos.
El objetivo de este estudio fue investigar el potencial genotóxicodelusorepetitivodeanestésicoslocales,usando eltestdemicronúcleos.
Métodos
EsteestudiofueaprobadoporlaComisióndeÉticaenelUso deAnimales(Protocolon.o.930/11).
Paraesteestudio,80ratonesWistarmachosde12 sema-nasdeedad,conunpesodeentre200y250g,recibieron anestésicoslocales.Losratonesfuerondivididosengrupos de6ycolocadosengrandescajasrectangulares(quemedían 49×34×16cm),apropiadasparaacomodarhasta5ratones adultos.Losratonesfueroncolocadosenuncriaderoconuna temperaturayunahumedadcontroladas,equipadoconun ciclodeluzde12h paraluz/oscuridad. Antesdela admi-nistracióndelanestésico,todoslosanimalesfueronpesados paracalcularladosificaciónadecuada.
Los animales fuerondivididos en6grupos: grupoA: 16 ratonesque recibieroninyeccionesporvía intraperitoneal (IP)declorhidratodelidocaínayfenilefrina(Novocol® 100, SSWhite,RiodeJaneiro,Brasil)enunadosisde4,4mg/kg; grupo B:16 ratones recibieron inyeccionesIP de mepiva-caínaal2%(mepivacaína,DFL,Jacarepaguá,Brasil)enuna dosisde4,4mg/kg;grupoC:16ratonesrecibieron inyeccio-nesIPdeepinefrinayarticaínaal4%(Septanest®1:100.000, Septodont, Bruselas, Bélgica) en una dosis del 7mg/kg; grupo D: 16 ratones recibieron inyección IP de prilocaína al3%yfelipresina(Cytanest®,Astra,SãoPaulo, Brasil)en unadosisde6mg/kg;grupoE:8ratonesrecibieron inyeccio-nesporvíasubcutáneaenunadosisúnicadeciclofosfamida (Genuxal®, Baxter Oncology GmbH, Halle/Westfalen, Ale-mania)(50mg/kg)enelprimerdíadelexperimento(grupo controlpositivo)8;grupoF:8ratonesrecibieroninyecciones
IPde0,5mLdesuerofisiológico(grupodecontrolnegativo). Comoenuninformeanteriorquedódemostradala forma-cióndemicronúcleosenrespuestaaunadosisde50mg/kg deciclofosfamida,estadosisfueusadaparaelgrupocontrol positivo8.
Ocho ratones de losgrupos Aa D recibieron unadosis de anestésico el primer día del experimento. A los otros animalesdeesosgruposselesadministróunadosisdiariade anestésicodurante5días.LosratonesdelgrupoFrecibieron suerofisiológicodemodosimilar.
OchoratonesdelosgruposAaD,4ratonesdelgrupoFy todoslosratonesdelgrupoEfueronsometidosaeutanasia 24hdespuésdelaadministracióndelanestésico.Los anima-lesrestantesdelosgruposA,B,C,DyFfueronsacrificados
5díasmástarde.Laeutanasiafuerealizadacon pentobar-bitalsódico(Syntec,Cotia,SãoPaulo,Brasil)enunadosis de100mg/kgporvíaIP.
Las muestras de lamédula óseafueron recolectadasa partirdelfémurdecada ratónenelmomentodel sacrifi-cio,yfueronpreparadas2láminasporanimal8.Lasláminas
fueron coloreadas con Giemsa (Dolles, São Paulo, Brasil). Dosmil eritrocitospolicromáticos (1.000 por lámina) fue-roncontadosparacadaanimalconunaampliaciónde400× usandoun microscopio ópticopara determinar el número demicronúcleos8.Losmicronúcleos fuerondefinidoscomo
estructurasconposiblesaureolasalrededordelamembrana nuclearyconunvolumeninferioraunterciodelvolumen deldiámetrodelnúcleoasociado;laintensidaddela colo-ración delosmicronúcleos fue similara laintensidaddel núcleoasociadoyambasestructurasfueronobservadasen elmismoplanofocal9.El análisisdelasláminasfue
reali-zadodeformaenmascaradaporunasolapersona(MCO)y revisadaporunasegundapersona(GAN).Ambosresultados fueronconcordantes.
Análisisestadístico
Lavariaciónenlafrecuencia delosmicronúcleos notuvo unadistribuciónnormalcuandofueanalizadaporeltestde Kolmogorov-Smirnov(p=0,0001)ylasvarianciasnofueron homogéneas(p=0,004)porelanálisisdeltestdeLevene.Por tanto,optamosporusareltestdeKruskal-Wallis,seguidode comparacionesmúltiples conel test de Student-Newman-Keulsparadeterminarlasignificaciónestadística.Todoslos testestadísticosfueronrealizadosadoptándoseelnivelde significacióndeun5%.
Resultados
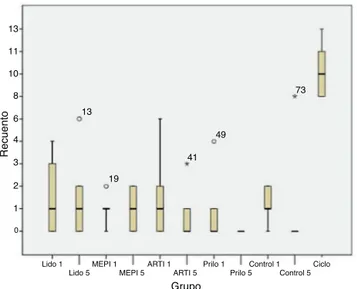
Lasmedianas delos númerosde micronúcleos observadas paracadagrupofueronlassiguientes:1y0,50paraelgrupo lidocaínaenelprimeroyquintodíasdeexposición, respec-tivamente;1paraelgrupomepivacaínatantoenelprimero comoen el quintodía deexposición; 1 y0 parael grupo articaínaenelprimeroyquintodíasdeexposición, respec-tivamente;0para elgrupoprilocaína tantoenel primero comoenelquintodíadeexposición.Enelgrupoexpuestoa laciclofosfamida(controlpositivo),lamedianadelnúmero demicronúcleosfue10.Lasmedianasdelosgruposde con-trolnegativoparalosdías1y5fueron1y0,respectivamente (p<0,0001)(figs.1y2ytabla1).
El número de micronúcleos en el grupo control posi-tivo (ciclofosfamida) fue diferente significativamente de losobservadospara todoslos anestésicos locales estudia-dos,tanto eneltipode anestésicoadministradocomoen el tiempo de exposición (p=0,0001). Sin embargo, no se observó ninguna diferencia significativa en el número de micronúcleos entre el grupo control negativo y los gru-poscon anestésicos locales, independientemente deltipo de anestésico administrado o del tiempo de exposición (p>0,05)(tabla1).
13
41
19 13
11
10
8
6
4
3
2
1
0
Recuent
o
Grupo
Lido 1 Lido 5
MEPI 1 MEPI 5
ARTI 1 ARTI 5
Prilo 1 Prilo 5
Ciclo Control 1
Control 5
49
73
Figura 1 Recuentos de micronúcleos por grupo de estudio
(mediana e intervalo intercuartílico). ARTI: articaína; Ciclo:
ciclofosfamida (control positivo); Control: control negativo;
Lido:lidocaína;MEPI:mepivacaína;Prilo:prilocaína;1:
exposi-ciónduranteundía;5:exposicióndurante5días.,outlier;
*,Eloutlierdeloutlier;lanumeraciónsobreeloutlier
corres-pondealanumeracióndelosanimales.
quintodía deexposiciónylossiguientesgrupos: lidocaína enelprimerdíadeexposición(p=0,0466),mepivacaínaen elprimero(p=0,0437)yquinto(p=0,0460)díasde exposi-ción,yarticaínaenelprimerdíadeexposición(p=0,0364) (tabla1).
Figura2 Ejemplosdeeritrocitopolicromáticocon
micronú-cleos(flechagrande)yeritrocitopolicromáticonormal(flecha
peque˜na);elanimalestuvoexpuestoalamepivacaínadurante
5días(coloracióndeGiemsa,1000×).
Tabla1 Medianaeintervalointercuartílicodela frecuen-ciademicronúcleosparacadagrupo(n=80)
Grupo Mediana Intervalo
intercuartílico
Lidocaína---1día 1a 3
Lidocaína---5días 0,50a,c 2
Mepivacaína---1día 1a 1
Mepivacaína---5días 1a 2
Articaína--- 1día 1a 2
Articaína--- 5días 0a,c 1
Prilocaína--- 1día 0a,c 1
Prilocaína---5días 0c 1
Controlnegativo---1día 1a,c 2 Controlnegativo---5días 0a,c 4
Ciclofosfamidaa 10d 3
a Control positivo. Los resultados con letras diferentes son
diferentessignificativamente(p<0,05).
Discusión
Lostest degenotoxicidadsonimportantesparacalcularla toxicidad celular e identificar potenciales agentes cance-rígenosymutagénicos.Paratestarlaactividadgenotóxica de un agente se usan varias técnicas, incluyendo ensa-yos que determinan el coeficiente devínculo cruzado del ADN/proteína,actividadenzimáticamitocondrial, prolifera-cióncelular,reparaciónderoturasdeADN,índicemitótico, tipo de da˜no sufrido, aberraciones cromosómicas, no dis-yuncióncromosómicaynivelesdeapoptosisynecrosis8.El
test de micronúcleos ha sido ampliamente utilizado para testarlagenotoxicidaddemuchosproductosquímicos.Los micronúcleos son fácilmente visualizados en muestras de eritrocitosysonunimportanteindicativo deaberraciones cromosómicas6.
Eltestdemicronúcleosfuerelatadoporprimeravezen 1970 por Boller ySchmid yposteriormente fue usadopor Heddle en 197710. El micronúcleo esun núcleoadicional,
separadodelnúcleoprincipaldeunacéluladurantela divi-sióncelularyestácompuestoporcromosomasenterosopor fragmentoscromosómicosquesobrandeotroscromosomas después de la conclusión de la mitosis. Los micronúcleos sonelresultadodeloscambiosestructuralesespontáneoso experimentalmenteinducidosenelcromosoma,oatravés deerroresdefusióncelular,quedandoportantoexcluidos delosnuevosnúcleosquesonreformadosenlatelofase11.
Las ventajas del ensayo de micronúcleos con relación a otros test usados para diagnosticar enfermedades y monitorizarcontaminantesambientalesincluyenelanálisis simplista,laaltasensibilidaddedetecciónylaexactitudde laspérdidascromosómicasyeventosdenodisyunción, capa-cidadde medirla extensiónyla progresiónde ladivisión nuclearyla capacidaddedetectareventosdereparación y resección8. Esas ventajas nos llevaron a elegir el test
de micronúcleos para evaluar los efectos genotóxicos de laadministraciónrepetitivadeanestésicoslocaleseneste estudio.
cualeslasconcentraciones elevadasylosgrandes volúme-nespueden conducira laintoxicación12. Portanto, el uso
devasoconstrictoresnoestáindicadoenalgunospacientes, especialmenteenpersonascondiabetesoconenfermedad cardíacaomujeresembarazadas.Enesoscasos,lasal anes-tésicamásamenudousadaenlafaltadeunvasoconstrictor es la mepivacaína12. Eneste estudio usamosmepivacaína
sinunvasoconstrictor.No hayrelatosenlaliteraturaque calculenlaaccióngenotóxicadelosvasoconstrictores.
Laprilocaínafueanteriormenterelatadaporteneruna actividad genotóxica en las células somáticas y por indu-ciraunarecombinaciónhomóloga.Sinembargo,seinformó que la lidocaína y la articaína (Septanest®) no indujeron una mutación cromosómica o recombinación13. No hubo
asociación entre la genotoxicidad y ninguna de los fár-macos analizados en este estudio. Esos resultados están parcialmentedeacuerdoconlaliteratura,siendo diferen-tessolorespectoalinformeanteriordegenotoxicidadpara laprilocaína13.
Quedó demostrado que el porcentaje de células con poliploidia y endorreduplicación aumenta después de la exposición al clorhidrato de procaína y el clorhidrato de prilocaína,tantoenpresenciacomoenausenciadela acti-vación metabólicaexógena14. Esos resultados indicanque
talesagentesquímicossonpotencialmentegenotóxicospara lascélulasdemamífero14.Sinembargo,esteestudiono
mos-tróningunaaccióngenotóxicadeprilocaína,talvezporque fueusadaenladosisrecomendadaporkilogramodepeso.
La condensaciónyfragmentación nuclear dela croma-tinafueronpreviamenteobservadasenlascélulastratadas con prilocaína15. La fragmentación del ADN también fue
inducida por tratamiento con prilocaína de forma dosis-dependiente ytiempo-dependiente, con efectos máximos observadosen concentración de 5mMdespués de 12-48h deexposición15.Conjuntamenteconeseestudio,esosdatos
nos indican que el uso de la prilocaína en la dosis reco-mendada,porkilogramodepesocorporal,nopuedecausar ningúnda˜nogenético.
La lidocaína y la prilocaína son metabolizadas prin-cipalmente en el hígado y por ende hidrolizadas por ésteres de amida,liberandolas aminas aromáticas mono-cíclicas, 2,6-dimetilanilina (DMA) y 2-metilalanina (MA) respectivamente5. Otros anestésicos que contienen una
fracción de DMA incluyen bupivacaína, mepivacaína y ropivacaína5.
Elprincipalmecanismocarcinogénicodelasaminas aro-máticas,como DMAyMA,sedacuandoel citocromoP450 metabolizaesos compuestosenderivadosdeN-hidroxila5.
DMA y MA pueden ser posteriormente metabolizadas por suconjugaciónconlosmetabolitosreactivos.Lalesióndel ADNfuedescrita paraDMA,peronoparaMA.Secreeque laformacióndeaductosdeADNseatal vezelmecanismo porelcualesoscompuestosejercenalgunosdesusefectos carcinogénicos16.
Sinembargo,laAgenciaInternacionalparaInvestigación en Cáncer(IARC) noha relatadoefectos cancerígenos de DMA en humanos, aunque no existan pruebas suficientes desucarcinogenicidadenratones5.Esopuede explicarel
mayornúmerodemicronúcleosobservadosenelgrupo lido-caína(independientemente deltiempo deexposición), en comparaciónconelgrupoprilocaína,yladiferencia signifi-cativaentrelosgruposexpuestosalalidocaínaduranteun
día ya la prilocaínadurante cincodías (p=0,0466). Aun-quelafrecuenciademicronúcleosenel grupoexpuestoa lalidocaínanohayasidosignificativamentediferentedela delgrupocontrolnegativo, lamayorfrecuenciade micro-núcleosenelgrupoexpuestoalalidocaína(encomparación conelgrupoprilocaína)puedeestarasociadaconlosefectos delaDMA,unproductometabólicodelalidocaína.
Enlaliteraturanohayinformessobreelpotencial geno-tóxicoomutagénicodelamepivacaína.Enesteestudio,la mepivacaínanomostrógenotoxicidad,independientemente deltiempodeexposición.Sinembargo,elgrupoexpuestoa lamepivacaínaduranteunoy5díasfuesignificativamente diferentedelgrupoexpuestoalaprilocaínadurante5días (p<0,05). La mepivacaína también contiene una fracción deDMA5,loquepuedeexplicarelmayornúmerode
micro-núcleosobservado enese grupo, aunquela frecuenciade micronúcleosnohayasido significativamentediferenteen elgrupocontrolnegativo.
Los estudios de mutagenicidad in vitro e in vivo no revelaronningúnpotencialgenotóxicodelaarticaína(CAS 23964-58-1),hasta alcanzarla dosis máxima tolerada. De acuerdoconlosdatosdeesteestudio,otrapreparaciónde articaína(Septanest® SP;4% articaína.HClyepinefrina1: 100.000)17nopresentaronefectosgenotóxicosenunestudio
invivousandoladosisrecomendadaporkilogramodepeso. Aunquelaarticaínapertenezcaalgrupoamidade anestési-coslocales(quetambiénincluyelalidocaína,laprilocaína y la mepivacaína), es metabolizada por la colinesterasa en el plasma en ácido articaínico vía hidrólisis. El ácido articaínicoesunmetabolito inactivo,parcialmente meta-bolizadoenelri˜nónenglucurónidodeácidoarticaínico,en vezdeunaaminaaromáticapotencialmentegenotóxica18.
Eseresultado puede explicar parcialmentela ausenciade genotoxicidaddespués delaexposición ala articaína. Sin embargo,el grupo expuesto ala articaína durante undía fuesignificativamentediferentedelgrupoexpuestoala pri-locaínadurante5días(p=0,0364).Esopuededeberseala presenciadeunoutlieren elgrupo articaína, queestaba bastante porencima de lafrecuencia promedioglobal de micronúcleos.
Conclusiones
Enelpresenteestudionohuboaumentodelafrecuenciade micronúcleosdespuésdelaexposiciónacualquiera delos anestésicoslocalestestados(lidocaína, mepivacaína, arti-caínayprilocaína)cuandoseusaronenladosisrecomendada porkilogramo depeso corporal,con unaúnica exposición oconla administraciónrepetitiva.Sinembargo,sedeben realizar otros ensayos que evalúan la genotoxicidad y la mutagenicidadparadeterminardefinitivamentequeeluso repetitivodeesosanestésicosnopresentaningunaactividad mutagénicaogenotóxica.
Conflicto
de
intereses
Losautoresdeclarannotenerningúnconflictodeintereses.
Bibliografía
2.MarianoRC,SantanaSI,CouraGS.Análisecomparativadoefeito anestésicodalidocaína2%edaprilocaína3%.BCIRevBrasCir Implantodont.2000;7:15---9.
3.Jastak JT, Yagiela JA. Vasoconstritors and local anesthe-sia: a review and rationale for use. J Am Dent Assoc. 1983;107:623---30.
4.Smith MT. The mechanism of benzene-induced leukemia: a hypothesisandspeculationsonthecausesofleukemia.Environ HealthPerspect.1996;104:1219---25.
5.Duan JD, Jeffrey AM, Williams GM. Assessment of the medicines lidocaine, prilocaine, and their metabolites, 2,6-dimethylaniline and 2-methylaniline, for DNA adduct formation in rat tissues. Drug Metab Dispos J. 2008;8: 1470---5.
6.FloresM,YamaguchiUM.Micronucleustest:anevaluationfor genotoxicscreening.JHealthRes.2008;1:337---40.
7.FenechM,HollandN,ChangWP,etal.TheHUmanMicroNucleus Project---aninternationalcollaborativestudyontheuseofthe micronucleustechniqueformeasuringDNAdamageinhumans. MutatRes.1999;428:271---83.
8.MacGregor JT, Heddle JA, Hite M,et al. Guidelines for the conduct ofmicronucleus assays in mammalianbone marrow erythrocytes.MutatRes.1987;189:103---12.
9.TolbertPE, Shy CM,AllenJW. Micronucleiand othernuclear anomaliesinbuccalsmears:methodsdevelopment.MutatRes. 1992;271:69---77.
10.Evans HJ. Historical perspectives on the development of the in vitro micronucleus test: a personal view. Mutat Res. 1997;392:5---10.
11.Ramírez A, Saldanha PH. Análise crítica de grupos controle no teste de micronúcleo na mucosa bucal. Genet Mol Biol. 1998;21:140.
12.PerusseR, GouletJP, TurcotteJY.Contraindicationsto vaso-constrictorsindentistry:partI.OralSurgOralMedOralPathol. 1992;74:679---86.
13.SchneiderLE,doAmaralVS,DihlRR,etal.Assessmentof geno-toxicityoflidocaine,prilonestandseptanestinthedrosophila Wing-Spottest.FoodChemToxicol.2009;47:205---8.
14.HagiwaraM,WatanabeE,BarrettJC,etal.Assessmentof geno-toxicityof14chemicalagentsusedindentalpractice:abilityto inducechromosomeaberrationsinSyrianhamsterembryocells. MutatRes.2006;603:111---20.
15.NakamuraK,KidoH,MorimotoY,etal.Prilocaineinduces apop-tosisinosteoblasticcells.CanJAnaesth.1999;46:476---82.
16.Preston RJ, Williams GM. DNA-reactive carcinogens: mode of action and human cancer hazard. Crit Rev Toxicol. 2005;35:673---83.
17.Leuschner J, Leblanc D. Studies on the toxicological pro-fileofthelocalanaestheticarticaine.Arzneimittelforschung. 1999;49:126---32.