ww w . r e u m a t o l o g i a . c o m . b r
REVISTA
BRASILEIRA
DE
REUMATOLOGIA
Artigo
de
revisão
Papel
da
via
de
sinalizac¸ão
do
HIF-1
␣
na
osteoartrite:
revisão
sistemática
Javier
Fernández-Torres
a,b,∗,
Gabriela
Angélica
Martínez-Nava
a,
María
Concepción
Gutiérrez-Ruíz
b,
Luis
Enrique
Gomez-Quiroz
be
Marwin
Gutiérrez
a,baInstitutoNacionaldeRehabilitación“LuisGuillermoIbarraIbarra”,LaboratoriodeLíquidoSinovial,CidadedoMéxico,México bUniversidadAutónomaMetropolitanaIztapalapa,ProgramadeDoctoradodeCienciasBiológicasydelaSalud,CidadedoMéxico,
México
informações
sobre
o
artigo
Históricodoartigo:
Recebidoem11defevereirode2016 Aceitoem28deabrilde2016
On-lineem12dejulhode2016
Palavras-chave:
Fatorinduzívelporhipóxia1-␣ Viadesinalizac¸ãodoHIF-1␣ Polimorfismosgenéticos Osteoartrite
r
e
s
u
m
o
Aosteoartrite(OA)éaformamaiscomumdeartriteefrequentementeédiagnosticadae gerenciadanaatenc¸ãoprimária;écaracterizadaporperdadacartilagemarticularhialina, umtecidoconjuntivoúnicoquefisiologicamentecarecedevasossanguíneos.Acartilagem articularsobreviveemummicroambientedesprovidodeoxigênio,queéreguladopelofator induzívelporhipóxia-1␣(HIF-1␣).OHIF-1␣éconsideradooprincipalregulador transcrici-onaldarespostacelularededesenvolvimentoàhipóxia.Naatualidade,arelevânciado HIF-1␣naavaliac¸ãodacartilagemtemaumentado,jáqueasuaparticipac¸ãoéessencial nahomeostasedessetecido.ConsiderandoasnovasperspectivasemergentesdoHIF-1␣na literaturacientíficanosúltimosanos,foca-seapresenterevisãonopotencialpapeldavia desinalizac¸ãodoHIF-1␣nodesenvolvimentodaOA,especialmentenomodocomoalguns fatoresgenéticospodeminfluenciarnamanutenc¸ãoourupturadacartilagemarticular.
©2016ElsevierEditoraLtda.Este ´eumartigoOpenAccesssobumalicenc¸aCC BY-NC-ND(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Role
of
HIF-1
␣
signaling
pathway
in
osteoarthritis:
a
systematic
review
Keywords:
Hypoxiainduciblefactor-1␣ HIF-1␣signalingpathway Geneticpolymorphisms Osteoarthritis
a
b
s
t
r
a
c
t
Osteoarthritis(OA)isthemostcommonformofarthritisandisfrequentlydiagnosedand managedinprimarycare;itischaracterizedbylossofarticularhyalinecartilage,whichisa uniqueconnectivetissuethatphysiologicallylacksbloodvessels.Articularcartilage survi-vesinamicroenvironmentdevoidofoxygen,whichisregulatedbyhypoxiainduciblefactor (HIF-1␣).HIF-1␣isconsideredthemaintranscriptionalregulatorofcellularand develop-mentalresponsetohypoxia.Todate,therelevanceofHIF-1␣intheassessmentofcartilage hasincreasedsinceitsparticipationisessentialinthehomeostasisofthistissue.Takinginto
∗ Autorparacorrespondência.
E-mail:javierastrofan@hotmail.com(J.Fernández-Torres).
http://dx.doi.org/10.1016/j.rbr.2016.04.006
accountthenewemerginginsightsofHIF-1␣inthescientificliteratureinthelastyears, wefocusedthepresentreviewonthepotentialroleofHIF-1␣signalingpathway inOA development,especiallyinhowsomegeneticfactorsmayinfluencethemaintenanceor breakdownofarticularcartilage.
©2016ElsevierEditoraLtda.ThisisanopenaccessarticleundertheCCBY-NC-ND license(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Introduc¸ão
Aosteoartrite(OA)éumacondic¸ãocrônicacomumqueafeta milhõesdepessoasemtodoomundoeéumacausa impor-tantede incapacidade.1 Trata-sedadoenc¸areumáticamais
comumenteencontrada, pode afetar todas as idades; con-tudo,suaprevalênciaaumentadrasticamentecomaidade, com uma maior incidência em indivíduos entre 40 e 50 anos.2
Asarticulac¸õesenvolvidassãocaracterizadasporuma rup-tura e perda da cartilagem articular, que levam a uma diminuic¸ão noespac¸o articular eatrito entreos ossosque causainchac¸o,dorcrônica,prejuízofuncional,deformidade eincapacidade.3–6
Atéomomento,ofatorinduzívelporhipóxia-1␣(HIF-1␣) temaumentado asuarelevânciaparaaavaliac¸ãoda carti-lagem,jáqueasuaparticipac¸ãoéessencialnahomeostase desse tecido.7 A cartilagem articular é um tecido
hipó-xico em que o HIF-1␣ é de importância crucial para a sobrevivênciaeocrescimentodecondrócitosduranteo desen-volvimento da cartilagem, bem como para a gerac¸ão de energia e síntese de matriz de condrócitos em condic¸ões fisiológicas e patológicas.8,9 Com microarrays, mostrou-se
também que o HIF-1␣ é expresso em condrócitos fetais humanos, o que significa que esse fator de transcric¸ão é essencial para o desenvolvimento e manutenc¸ão da cartilagem.10
Aviabilidadedoscondrócitosécomprometidaporvários fenômenos, como o estresse oxidativo, mediadores infla-matórios, lesões bioquímicas e condic¸ões de hipóxia. O avascularidadedotecidocartilaginosopossibilitouo estabe-lecimentodemecanismosbemconservados,comcondic¸ões sobasquaisoscondrócitospodemsobreviver.Éimportante ressaltar que sob condic¸ões fisiológicasa concentrac¸ão de oxigênio nacartilagem articularvaria de 0,5a 10% (∼ 4 a 70mmHg, respectivamente).11,12 Quando a concentrac¸ão
de oxigênio diminui e o ambientetorna-se cada vez mais hipóxico,o HIF-1␣ desempenha umpapel fundamental na manutenc¸ãodahomeostase,pormeiodainduc¸ãoda expres-são de uma variedade de genes que codificam proteínas paraaumentaradisponibilidadedeoxigênioenutrientesaté níveishomeostáticos.8,13
Considerando essas informac¸ões e o recente interesse crescentesobreoHIF-1␣emdoenc¸as reumáticas,14,15
foca--seapresenterevisãonopotencial papeldoHIF-1␣ naOA, especialmente em como alguns fatores genéticos podem
influenciarnamanutenc¸ãooudegradac¸ãodacartilagem arti-cular.
Métodos
Critériosderevisãodaliteraturaeestratégiadebusca
Revisou-se toda a literatura relevante na área do HIF-1␣ e OA publicada nos últimos15 anos. Abuscaincluiu artigos originais relativos a seres humanos e/ou modelos animais publicados entrejaneiro de2000edezembro de2015. Para identificartodososestudosdisponíveis,fez-seumapesquisa detalhadapertinenteaoHIF-1␣eOAdeacordocomas dire-trizes doPreferred Reporting Items forSystematic Reviews and Meta-Analyses (Prisma).16 Fez-se uma busca sistemática na
basede dadoseletrônicaPubMed comos seguintes descri-tores de busca Mesh em todas as combinac¸ões possíveis: “HIF-1␣”ou“osteoartrite”ou“cartilagemarticular”ou “poli-morfismosdoHIF-1␣”ou“viadesinalizac¸ãodoHIF-1␣”ou “hipóxia”ou“doenc¸asreumáticas”easfrasescombinadas,a fimdelevantartodososestudosgenéticossobrearelac¸ãode polimorfismosgenéticosdaviadesinalizac¸ãodoHIF-1␣ asso-ciados àosteoartrite. Alémdisso, aslistasdereferência de todososartigosrecuperadosforamrevisadasmanualmente. Dois autoresindependentes (JFTeGAMN)analisaramcada artigoefizeramaextrac¸ãodedadosdemodoindependente. Asdiscrepânciasforamresolvidasporconsenso.
Critériosdeinclusãoeexclusão
Foram excluídos desta revisão os seguintes tipos de publicac¸ões: artigos não publicados em inglês, relatos de casos, ensaios clínicosrandomizados ecartas aoeditor queerampuramentecomentários.Osresultadosdapesquisa foram selecionadosde modoa evitar duplicac¸ões. Títulos, resumoserelatórioscompletosdeartigosidentificadosforam sistematicamenteselecionadoseconsideraramoscritériosde inclusãoeexclusão.
Resultados
Termos de pesquisa inseridos na base de dados PubMed:“HIF-1α” ou “osteoartrite” ou “cartilagem articular” ou “polimorfismos do HIF-1α” ou “via de sinalização do HIF-1α” ou “hipóxia” ou “doenças reumáticas” e as frases combinadas a fim de levantar todos os estudos genéticos sobre a relação de polimorfismos genéticos da via de sinalização do HIF-1α associados
à osteoartrite.
5.599 estudos identificados na busca na base de dados
383 potenciais estudos elegíveis identificados
76 artigos em texto completos submetidos à avaliação da
elegibilidade
5.214 estudos excluídos: não publicados em inglês, relatos de casos, ensaios clínicos, cartas ao editor
que eram puramente comentários, artigos publicados antes de 2.000.
309 estudos excluídos, não relacionados com o tópico de interesse
Figura1–Representac¸ãodaestratégiadebusca.
resultados da estratégia de busca estão ilustrados na
figura1.
ConceitosgeraisdagêneseegenéticadaOA
Nosúltimos anos, osconhecimentos acerca da OA cresce-ramexponencialmente;no entanto,ainda existemlacunas quenãofoipossívelabordar.Atualmente,oscasosdeOAem pessoasmuitojovenssãomaisfrequentementerelatados,o quegradualmenteinduzamudaroconceitodequeaOAé umadoenc¸aapenasdeidosos.Alémdisso,existemfenótipos intermediáriosmuitoheterogêneosquedefinemosdiferentes grausdegravidadeda OA,desdelevescrepitac¸ões articula-resaté perdatotal da cartilagem articular.Esse processo é complexo,masseacreditaqueainterac¸ãoentreoestresse bio-mecânico,citocinaspró-inflamatóriasefatoresmetabólicos, ambientaiseprincipalmentegenéticossejamos orquestrado-resquepromovemarupturadahomeostasedacartilageme ainiciac¸ãodaviacatabólica.6,17–22
EmboraafisiopatologiadaOAnãoestejacompletamente caracterizada,váriosgenescandidatosforamdescritoscomo associadosàsuscetibilidadeàOA.Fernandez-Moreno,etal. determinaramque,apesardanaturezamultifatorialdaOA,ela nãosegueospadrõesdeheranc¸amendeliana,provavelmente pelasalterac¸õesnasinterac¸õesgenéticas.20 Elesanalisaram
diferentesgeneslocalizadosemcromossomosdistintoseos resultadosrevelaramacomplexidadedaárea.Atabela1 mos-traalgunsgeneseasuarelac¸ãocomosdiferentesfenótipos daOAdescritosnesteestudo.Meulenbeltpublicouumestudo quetevecomoobjetivodeterminarquaisviasdesinalizac¸ão
eram maisimportante parao desenvolvimentoda OA.6 As
viasougenesmaiscomunsforamolócus7q22,quecontém váriosgenes potenciais,ogene fator5de diferenciac¸ãode crescimento(GDF5),ogeneproteínarelacionadacomofrizzled
(FRZB),ogeneiodotironinadeiodinasetipoII(DIO2)eogene
Smad3.
AsbasesgenéticasnaOApodemrefinaraindamaisa com-preensãodarelac¸ãogenótipo-fenótipo,pormeiodapresenc¸a de polimorfismosde nucleotídeoúnico(SNP). Um polimor-fismo genéticopode serum pivô entreum mecanismo de resistênciaouasuscetibilidadeaumadoenc¸a.Polimorfismos genéticosqueafetamumacodificac¸ãoousequência regulató-riaeproduzemgrandesmudanc¸asnaestruturaoumecanismo de regulac¸ão da expressãoda proteína podem resultarem diferentesfenótipos.23,24 Atabela2mostraalgunsSNPcom
fenótiposbemestabelecidos.
Func¸ãoeestruturadacartilagemarticular
Tabela1–GenesassociadosaodesenvolvimentodaOA
Gene Cromossomo Manifestac¸ãofenotípica
COL2A1, COL11A1, COL11A2
1,6,12 OAdeinícioprecoce
COL9A1 6 OAdeinícioprecocedo joelho
MATN3 2 OAdeinícioprecoceda mãoejoelho
COMP 19 OAdeinícioprecocedo quadril
COL1A1 17 Reduc¸ãodaOAde quadrilemmulheres BMP2 20 Reduc¸ãodaOAde
joelhoemmulheres
TGFB1 19 OA
FRZB,IL4R 2,16 OAdequadrilem mulheres
IL1,ASPN,TIMP3 2,9,22 OAdequadrilejoelho
IL6 7 OAdequadril
AGC1 15 OAdemão
VDR 12 Artriteemvárias
articulac¸ões
ERA 6 OAemmulheres
ADAM12,LRCH1, TNA
3,10,13 OAdejoelho
CILP 15 OAdejoelhoem
homens CALM1 14 OAdequadrilna
populac¸ãojaponesa IGF-1 12 AumentodoriscodeOA IL17 6 Suscetibilidadepara
desenvolverOA
RetiradodeFernandez-Morenoetal.20emodificado.
Acartilagemarticularéoprincipaltecidoalvonoprocesso degenerativo;existemcaracterísticasmuitoparticularesque atornamdiferentedosoutrostecidos,principalmenteasua ausênciaderedecapilar.Acartilagemarticularconsisteem matrizextracelular(MEC),proteoglicanos,condrócitos, colá-genoeágua;recebeseusnutrientesesuprimentodeoxigênio pordifusãoapartirdofluxodinâmicodolíquidosinoviale ossosubcondral.Aregulac¸ãodometabolismodacartilagem
articular envolve uma vasta rede de vias de sinalizac¸ão; no caso da osteoartrite, o delicado equilíbrio entre a sín-tese e degradac¸ão de MEC é fortemente afetado. Assim, o processo osteoartrítico comec¸a com uma resistência dimi-nuída ao estresse extrínseco dos condrócitos, juntamente comalterac¸õesnaatividadedeproliferac¸ão,nometabolismo energético enarespostaaosfatoresdecrescimento.41–46 A
degradac¸ãoda cartilagem duranteapatogênesedaOA não serelacionaapenascomaperdadeMEC,mastambémcoma mortedecondrócitos.Amortedecondrócitosporapoptose, necrose,condroptoseouumacombinac¸ãodessesprocessos temsidoimplicadanapatogênesedaOA.47
Sistema
HIF-1
␣
OHIF-1␣éumfatordetranscric¸ãocodificadopelogeneHIF1A
localizadonointeriordocromossomo14q21-24,formadopor 15 exons;oHIF-1␣consiste em826aminoácidosetemum peso molecular de 120kDa.48 O HIF-1␣ é umheterodímero
de duas cadeias,a cadeiaalfa (reguladapelo oxigênio)ea cadeiabeta,ambasdispostasemumaduplahélice (hélice--volta-hélicebásico,bHLH).Existemdoissinaisdelocalizac¸ão nuclear (NLS), mas apenas aquele encontrado na posic¸ão C-terminaléresponsávelpeloacúmulodeHIF-1␣nonúcleo. NaregiãoN-terminal,estãolocalizadososdomíniosbHLHe PER-ARNT-SIM A(PASA),necessáriosparaadimerizac¸ãoe ligac¸ãoaoDNAporelementosderespostaàhipóxia(HRE).Por fim,osítioativodessaproteínaéumdomíniodedegradac¸ão dependentedeoxigênio(ODDD)queatuacomoumsensorde oxigênio(fig.2).49–51
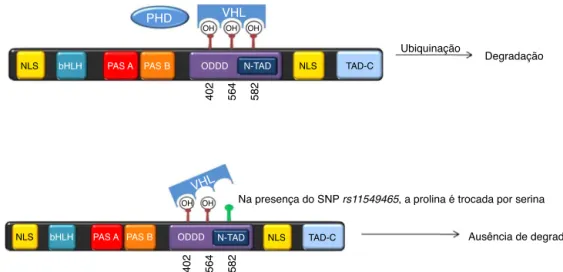
Sob condic¸ões de normóxia e na presenc¸a de Fe2+ e
2-oxoglutarato,osresíduosespecíficosdeprolina402e564 sãohidroxiladosnodomínioODDDpelasprolil-hidroxilases (PHD)dependentesdeoxigênio,formamumcomplexocomo fatordeVonHippel-Lindau(BVS);porsuavez,essecomplexo seligaàubiquitina(Ub)esubsequentementesedegradano proteassoma(fig.3).
Um estímulo celular externo, como um fator de cres-cimento que se liga ao seu receptor de tirosina-quinase, desencadeiaumacascatadeviasdesinalizac¸ãonointerior da célula. Por exemplo, o fator de crescimento endotelial vascular (VEGF) ativaasvias da fosfatidilinositol-3-quinase
Tabela2–Polimorfismosdenucleotídeoúnico(SNP)associadosaosprocessosdaOA
Gene/dbSNPrsId Fenótipo Primeiroautor[Referência]
WISP1rs2929970 SuscetibilidadeàOAdacolunavertebralnamulher Uranoetal.25
RAGErs2070600 SuscetibilidadeàOAdejoelho Hanetal.26
DVWArs7639618 SuscetibilidadeàOAdejoelho Zhangetal.27
ACErs4343,rs4362 SuscetibilidadeàOAdejoelho Qingetal.28
MATN3rs8176070 SuscetibilidadeàOA Guetal.29
DIO2rs225014 SuscetibilidadeàOA Meulenbeltetal.30
ADAMTS14rs4747096 OAdejoelhonamulher(populac¸ãotailandesa) Poonpetetal.31
ADAM12rs1871054 AumentonoriscodeOA Wangetal.;32Kernaetal.33
HIF1Ars11549465 Papelprotetornaperdadecartilagemarticular Fernández,etal.34
IL6rs1800796 PapelprotetorparaOAdequadrilejoelhoemidosos Fernandesetal.35
IL16rs11556218,rs4072111,rs4778889 Diminuic¸ãonoriscodeOAdejoelho Luoetal.;36Liuetal.37
Cadeia α
Cadeia β
N NLS bHLH NLS TAD-C C
bHLH
PAS A
PAS A transcricionalAtividade
HRE
Dimerização P300/CBP
PAS B ODDD N-TAD
OH OH OH OH
402 564 582 803
Figura2–Estruturadofatorinduzívelporhipóxia-1␣(HIF-1␣).ONH2-terminaldoHIF-1␣eHIF-1consistenosdomínios
bHLH(hélice-alc¸a-hélice)ePAS(homologiaPer-ARNT-Sim),quesãonecessáriosparaaheterodimerizac¸ãoeligac¸ãodoDNA.
OterminalCOOHdoHIF-1␣(resíduos531-826)contémdoisdomíniosdetransativac¸ão(TAD).Ameia-vidacurtadoHIF-1␣
sobcondic¸õesnãohipóxicasepós-hipóxicasédecorrentedarápidaubiquitinac¸ãoedegradac¸ãoproteossomal.Aregiãodos
resíduos400-600doHIF-1␣foidesignadadomíniodedegradac¸ãodependentedeoxigênio(ODDD).
Normóxia
Ubiquinação
Hidroxilação
O
2PHD OH
OH
HIF-1α VHL HIF-1α HIF-1α VHL
OH Ub
Ub
OH
Proteossoma
Degradação
Figura3–AtividadedoHIF-1␣sobcondic¸õesdenormóxia.Sobcondic¸õesdenormóxia,osresíduosespecíficosdaprolina
402e564nodomínioODDDsãohidroxiladosporprolil-hidroxilasesdependentesdeoxigênio(DPS),oquelevaàformac¸ão
deumcomplexocomofatordevonHippelLindau(BVS);porsuavez,essecomplexoseligaàubiquitina(Ub)eé
subsequentementedegradadopeloproteassoma.
(PI3K) eda proteína quinase ativada pormitógeno (MAPK) (ERK1 e ERK2).52 O PI3K ativa a serina/treonina quinase
(AKT) e a AKT ativa a proteína associada a FKBP12-rapamicina,mTOR,RAFT(FRAP), queinduzàexpressãode HIF-1␣.
Sobcondic¸õesdeoxigênioreduzido(hipóxia),aatividade das PHD diminui, o que estabiliza o HIF-1␣ e o acumula nocitoplasmaparaserfosforiladopelaMAPK.53–55Umavez
fosforilado,o HIF-1␣ setransloca parao núcleo eseliga à subunidade HIF-1 (também conhecida como translocador nuclear receptor aril hidrocarboneto, ARNT) para formaro complexo[HIF-1␣/HIF-1].Pormeio doHRE, essecomplexo
seligaasequênciasdeDNA5’TAGCGTGH3’específicas pre-sentesnasregiõespromotorasdegenesparaasubsequente expressão.47,55,56
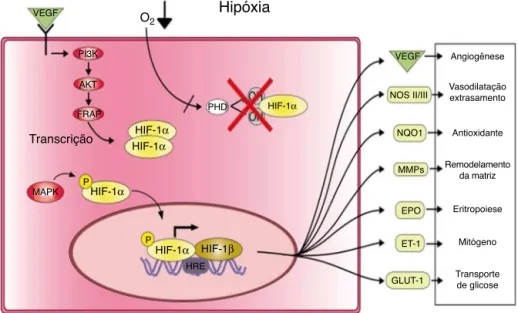
Algunsdestesgenesalvoincluemoóxidonítricosintase 2(NOS2),ofatordecrescimentoendotelialvascular(VEGF),a eritropoietina(EPO),algunstransportadoresdeglicose(GLUT1, GLUT3),o fator de crescimento semelhante àinsulina tipo 2(IGF2),quepotencialmenteatuaafimdemanterasfunc¸ões condroprotetoras desafiadas pelas condic¸ões prejudiciais queocorremnoambientearticularnaOA(fig.4).8,54–59Essa
VEGF
PI3K
AKT
FRAP PHD
P
P MAPK
HIF-1α HIF-1α Transcrição
HIF-1α
HIF-1α HRE
HIF-1β
HIF-1α
VEGF
NOS II/III
NQO1
MMPs
EPO
ET-1
GLUT-1 Transportede glicose Mitógeno Eritropoiese Remodelamento
da matriz Antioxidante Vasodilatação extrasamento Angiogênese
O2
Hipóxia
Figura4–AtividadedoHIF-1␣sobcondic¸õeshipóxicas.Sobcondic¸õeshipóxicas,oHIF-1␣éestabilizadoefosforiladopelo
MAPK;umavezfosforilado,oHIF-1␣setranslocaparaonúcleoeseligaàsubunidadeHIF-1eformaocomplexo
[HIF-1␣/HIF-1].Essecomplexo,pormeiodoHRE,seligaàsequênciadeDNAespecífica5’TAGCGTGH3’presentenas
regiõespromotorasdosváriosgenesparaasubsequenteativac¸ãodestes.
Polimorfismos
genéticos
no
sistema
HIF-1
␣
e
sua
importância
na
OA
Paratentarexplicardemodosimplificadoainterac¸ãoentre os polimorfismos genéticos associados ao HIF-1␣ com a importânciana OA, dividiu-se esse sistema em três fases: 1) genes que ativam o HIF-1␣; 2) proteínas que intera-gemdiretamentecomoHIF-1␣;e3)genescontroladospelo HIF-1␣.
GenesqueativamosistemaHIF-1˛
Aativac¸ãodoHIF-1␣podecomec¸arpelaligac¸ãode diferen-tesproteínasaseusreceptoresnamembranacelular;essas proteínaspodemserenzimas,fatoresdecrescimento, inter-leucinasououtrostiposdemoléculas;aquelaspodemser afe-tadaspelapresenc¸adepolimorfismosgenéticosquepodem estarassociadosaodesenvolvimentodeOA.Yangetal. anali-saramoefeitodepolimorfismosdereceptoresparaprodutos finaisdeglicac¸ãoavanc¸ada(RAGE)nasuscetibilidadeàOAe gravidadedessadoenc¸aemumapopulac¸ãoHanchinesa.O geneRAGEparticipanaregulac¸ãodainflamac¸ãoeatémesmo naproduc¸ãodemetaloproteinasesdematriz(MPM).AMPM-1 degradaacartilagem,oquepoderesultaremdesenvolvimento deOA.Descobriu-se quedois polimorfismosnogeneRAGE
(rs1800625ers2070600)mostraramumaassociac¸ão significa-tivaentrepacientescomOAecontrolessaudáveis(OR=0,42, p=0,016,eOR=2,78,p=0,047,respectivamente).65Noestudo
feitoporHan etal.,26 eles encontraramque apresenc¸a do
polimorfismo rs2070600 no gene RAGE em interac¸ão com a obesidade podem determinar a suscetibilidade à OA de joelho.
Swellam et al. relataram uma potencial influência do polimorfismo genético do antagonista do receptor de
interleucina-1(IL-1RA)noriscodeOAdejoelho.Acredita-se queo geneIL-1estejaenvolvidonoprocesso dedestruic¸ão da cartilagem. A esse respeito, o antagonista do recep-tor de interleucina-1(IL-1RA) competecom a IL-1 para se ligar ao seu receptor e pode atuar como um inibidor da degradac¸ãodacartilagem.Essesautoresfizeramumestudo decaso-controlecompacientescomOAdejoelhoe concluí-ram que o alelo IL-1RN*2 representa um importante fator a influenciar a gravidade e a evoluc¸ão da OA de joelho (p=0,002).66
Fernandesetal.analisaramainfluênciada citocina pró--inflamatória IL-6 na gravidade e no estado funcional da OAemindivíduosidosos;determinaramqueopolimorfismo
rs1800796 éumfator de protec¸ãopara a presenc¸ae gravi-dadedaOAdequadrilejoelhoemidosos.Osindivíduosque apresentavam oalelo Ctinhammenor prevalênciae gravi-dadeda OA quando comparadoscom indivíduos semesse polimorfismo.35
Enquanto isso, a interleucina-16 (IL-16), uma cito-quina pleiotrópica, desempenha um papel fundamental nas doenc¸as inflamatórias. Liu et al. determinaram que, em comparac¸ão com o genótipo C/C, o genótipo C/T
aumentou o risco de OA de joelho primária no polimor-fismo rs4072111 do gene IL-16 (OR=1,83); no entanto, em comparac¸ão com o genótipo T/T, o genótipo T/L dimi-nuiu o risco de OA de joelho primária no polimorfismo
rs11556218 (OR=0,37).37 Damesma maneira,Luo etal.
ava-liaram os mesmospolimorfismos eencontraram omesmo comportamento.36Essesresultadossugeremqueos
polimor-fismos do gene IL-16 estão associados ao risco de OA de joelho.
PHD
bHLH
bHLH
PAS A
PAS A PAS B
PAS B
ODDD
ODDD
N-TAD
N-TAD
VHL
VHL NLS
NLS
NLS
NLS
Na presença do SNP rs11549465, a prolina é trocada por serina
Ausência de degradação 402 564 582
402 564 582 OH
OH OH OH OH
TAD-C
TAD-C
Ubiquinação
Degradação
Figura5–Apresenc¸adopolimorfismors11549465produzumamudanc¸adeprolinaporserina,oqueconfereumamaior
estabilidadeàproteínaHIF-1␣emdecorrênciadafracainterac¸ãoentreoVHLeoslocaisdehidroxilac¸ãonoODDD.
ProteínasqueinteragemdiretamentecomoHIF-1˛
Aestabilizac¸ãodoHIF-1␣nocitoplasmadependebasicamente da hidroxilac¸ão em locais específicos dentro do domínio ODDD. Noentanto,a presenc¸ade polimorfismos genéticos podealteraraspropriedadesestruturaisdostranscritoseisso podeinfluenciarnasuscetibilidadeouresistênciaadoenc¸as, conformeanalisadoporUchanzkaetal.emdoenc¸as autoimu-nesassociadasaoaleloHLA-B*27.67
Em2003,Tanimotoetal.demonstraramqueasubstituic¸ão da prolina pela serina na posic¸ão 582 (P582S), em decor-rênciada presenc¸a de polimorfismosde nucleotídeo único (rs11549465)nointeriordogeneHIF1A,aumentaasua ativi-dadedetranscric¸ão56;issoocorreemrazãodeumaalterac¸ão
nascaracterísticasepropriedadesdossítiosdeligac¸ãocomos genes-alvo.67,68Recentemente,osautoresdopresenteestudo
avaliaram a presenc¸a dessepolimorfismo em amostras de pacientes com OA e descobriram que ele estava positiva-menteassociadoaofatordeprotec¸ãonaperdadecartilagem (genótipoCTOR=0,2,p=0,003,oualeloTOR=0,2,p=0,004).34
Essefenômenopodeserexplicadopelofatodequeapresenc¸a desse polimorfismo confere maior estabilidade à proteína HIF-1␣,emdecorrênciadafracainterac¸ãoentreoVHLeos locaisdehidroxilac¸ãonoODDD(fig.5).
Outro polimorfismo clinicamente importante, com aumento na atividade de transcric¸ão no interior do gene
HIF1A, que também foi testado por Tanimoto et al. foi o Ala588Thr (rs11549467). Similarmente, o presente estudo avaliou esse polimorfismoempacientes com OA,mas não encontrou associac¸ão. No entanto, isso abre a possibili-dadede queseja avaliadaem outraspopulac¸ões, afim de compreendermelhorasuainfluêncianaOA.
Alémdisso,foramdescritospolimorfismosparaosgenes
EGLN1(tambémconhecidocomoPHD2,prolil-hidroxilase2),
BVSeHIF1AN(fatorinibidordoHIF1A),queinteragem dire-tamentecomoHIF-1␣,masquenãoforamavaliadosnaOAe quepodemserdeimportânciaclínicanessadoenc¸a.Alguns estudosnaartritereumatoide(AR)demonstraramaexpressão eregulac¸ãodeenzimasdodomínioprolil-hidroxilase(PHD)e
fatorinibidordoHIF-1␣(FIH-1),queregulaosníveiscelulares deHIF-1␣.Sabe-sequeaARécaracterizadaporhipóxiaepela expressão de fatores de transcric¸ãoinduzíveis por hipóxia (HIF),quecoordenamasrespostascelularesàhipóxia. Muz
etal.conduziramesseestudoemsinoviócitossemelhantesa fibroblastos;concluíramqueaPHD-2éaprincipalhidroxilase queregulaosníveisdeHIFeaexpressãodegenes angiogêni-cosemcélulasartríticas.OPHD-2pareceregularasrespostas relevantes à artrite via HIF-␣, destaca a grande importân-cia dessa enzima nas doenc¸as inflamatórias dependentes da hipóxia e da angiogênese.69 Isso nos faz supor que a
presenc¸adepolimorfismosgenéticosdessesgenespode afe-taraestabilidadedoHIF-1␣econtribuirdemodoimportante paraaOA.
GenescontroladospeloHIF-1˛
Na OA,oscondrócitossãometabolicamenteativos,exibem aumentonasíntesedecolágenotipoII.Emcomparac¸ãocoma cartilagemsaudável,naOAoscondrócitosarticularesexibem aumentonasínteseinvivodecolágenotipo IIpelaenzima prolil-hidroxilase-4, umaenzimaessencial naformac¸ão da tripla hélice docolágeno.70 Umavez estabilizado o HIF-1␣
no citoplasma, váriosgenes ajusante sãoexpressos a fim derestaurardiversoscomponentesdamatrizextracelular.A presenc¸adepolimorfismosgenéticosnessesgenespode alte-rarafunc¸ãodeproteínasespecíficasquerestauramtecidos articularesepromovemodesenvolvimentodeOA.
Rodríguez-Fontenlaetal.fizeramumametanálisedenove GWASparaavaliargenescandidatosàassociac¸ãoàOA; ape-nasdoisdos199genescandidatos(COL11A1eVEGF)estiveram associadosàOAnametanálise.Doispolimorfismosnogene
COL11A1(rs4907986ers1241164)mostraramassociac¸ãocoma OAdequadrilnaanálisecombinada(OR=1,12,p=1,29×10−5, e OR=0,82, p=1,47×10−5, respectivamente); o rs4908291 esteveassociadonaanáliseestratificadaporsexoapenasno casodasmulheres(OR=0,87,p=1,29×10−5).Outro polimor-fismonogeneVEGF(rs833058)mostrouassociac¸ãocomaOA dequadrilapenasemhomens(OR=0,85,p=1,35×10−5).72
Osuprimentodeoxigênioenutrientesàcartilagem articu-larsedápordifusãoapartirdolíquidosinovial.Opapeldo fatordecrescimentodoendotéliovascular(VEGF)éessencial paraaangiogênesenoossosubcondral.8Há apenasalguns
estudosrelacionadoscomvariantesgenéticasdogeneVEGF
quepodem contribuir para o desenvolvimentoe progresso daOA.
Sánchez et al. avaliaram dois polimorfismos do gene
VEGF, -460T/C e+405C/G, empacientes comOA de joelho ecompararamacontrolessaudáveis,masnãoencontraram associac¸ão.73 Yuan et al. fizeram umametanálise a fim de
entender a relac¸ão entre a patogênese da OA e os níveis de expressão do VEGF em vários tecidos lesionados nes-sespacientes.Onzeestudosdecaso-controle,queenglobam 302pacientes com OA e 195controles saudáveis, demons-tramqueosníveisdeexpressãodoVEGFempacientescom OAsãosignificativamentemaiselevadosdoqueem contro-lessaudáveis(médiadadiferenc¸apadronizada=1,18,IC95%: 4,91∼9,11,p<0,001)eesses níveissecorrelacionam forte-mentecomapatogênesedaosteoartrite.74
Umdosmecanismosdedegradac¸ãodacartilagemnaOA éaproteóliseenzimáticadamatrizextracelularpor metalo-proteinases. AMPM-1, produzida porcondrócitosecélulas sinoviais, é uma das principais proteases da família das MPM.
Barlas et al. avaliaram três polimorfismos no promotor dosgenesdasmetaloproteinasedematriz-1(MPM-1),MPM-2
e MPM-9 em pacientes com OA de joelho e compararam a controles etnicamente correspondentes. Eles encontra-ram diferenc¸as significativas entre os grupos em relac¸ão à distribuic¸ão dos genótipos do polimorfismo do MPM-1
(p=0,001). As frequências dos genótipos 1G/1G e 1G/2G
foramsignificativamentemaioresnospacientescomOAde joelho do que nos controles (p=0,002, e p=0,006, respec-tivamente). Além disso, a frequência do alelo 1G dogene
MPM-1 foi maior nos pacientes do que no grupo controle (p=0,0001).Asdistribuic¸õesdegenótiposefrequências alé-licas dos polimorfismos dos genes MPM-2 e MPM-9 não diferiramentreosgruposOAecontrole(p>0,05).Esses acha-dossugeremqueopolimorfismo-1,6071G/2G(rs1799750)no geneMPM-1podecontribuirparaasuscetibilidadeàOAde joelho.75
Similarmente, Lepestos et al. avaliaram o polimorfismo
rs1799750nogeneMPM-1,masnãoencontraramassociac¸ão significativanaanálisegeral;noentanto,após aanálisede regressãologísticamúltipla,o1G/2Gesteveassociadoa chan-cesreduzidasdeOAdejoelhoem75%nosexomasculino,em comparac¸ãocomosgenótipos1G/1G+2G/2G,ajustandopara idadeeIMC(ORajustado=0,25,p=0,035).76
Porfim,Honsaweketal.analisaramopolimorfismonogene
MPM-3(Rs3025058,-1612)empacientescomOAdejoelho.A frequênciadoalelo5Afoiindicadacomo15,5%eadoalelo
6Afoide84,5%empacientescomOA,aopassoqueerade 10 e 90%, respectivamente, no grupo controle. Assim, o presente estudo indicou que o genótipo do polimorfismo −1612 5A/5G do promotor do gene MPM-3 não atua no desenvolvimentodaOA.77
EssesresultadossugeremqueaatividadedafamíliaMPM éinfluenciadapelapresenc¸adevariac¸õesgenéticas,que que-brariam oequilíbrioentreasínteseedegradac¸ãodamatriz extracelular,eessacondic¸ãopodecontribuirparaa suscetibi-lidadeàOA.
O óxido nítrico (NO) é essencial para a manutenc¸ão do tônus vascular; a presenc¸a de disfunc¸ão endotelial (relaxamento vascular reduzido) pode sugerir um pro-blemarelacionadocomaviadoNO.ONOéproduzidopela NO-sintaseendotelial(eNOS)easuaproduc¸ãopodeser influ-enciadaporpolimorfismosnogeneeNOS.78Atéomomento,
não foram feitos estudos relacionados com a OA e poli-morfismosdogeneeNOS;noentanto,váriospolimorfismos genéticosnogeneeNOSestãoassociadosàpatogênesedaAR. O nível de NO é aumentado em pacientes de AR; um estudosugerequeoNOpoderegularoequilíbriodascitocinas Th1/Th2emdoenc¸asautoimunesequeissoéum mediador--chave naapoptose no interior de articulac¸õescom artrite reumatoide.Anetal.estudaramdoispolimorfismosdogene
eNOS(rs2070244,T-786C;ers1799983,G894T)empacientes com AReobservaram que osindivíduos como genótipo -786CCtinhamumriscoaumentadodeAR.79
Brenoletal.avaliaramopolimorfismoT-786Cempacientes comARemcomparac¸ãocommanifestac¸õesextra-articulares. ElesdescobriramqueoaleloCestevesignificativamente asso-ciado (p corrigido=0,032), o que sugere a participac¸ão do polimorfismoT-786CdogeneeNOSnaAR.80
Esses resultados nosfazem suporque ospolimorfismos nogeneeNOSpodemterumimpactoimportanteno desen-volvimentodaOA;seránecessárioexploraressasvariantes genéticasparacorroborarisso.
Arespostaàanemiadamedulaósseamediadapela eritro-poietinaestásobocontroledefatoresinduzidosporhipóxia (HIF), osprincipais reguladoresda homeostasede oxigênio eferro. Ascaracterísticashipóxicas da cartilagem articular fazemcomqueoHIF-1␣participeativamentedatranscric¸ão degenes-alvo.Ogeneeritropoietina(EPO)éexpressodepois de umaumentodoHIF-1␣nocitoplasma.81,82 Contudo, até
o momento, nenhumaevidência científicaapoiaapossível associac¸ãoentreaeritropoietinaeaperdadecartilagemna OA; além disso, apresenc¸a de polimorfismosno gene EPO
poderiarepresentarumimportantefatorassociadoaorisco deOA.
Relevância
clínica
dos
inibidores
de
PHD
como
potenciais
alvos
terapêuticos
na
OA
Em decorrência dos resultados descritos, o objetivo prin-cipal de alcanc¸ar um efeito terapêutico no tratamento da OA no nível da cartilagem pode ser estabilizar o HIF-1␣ no citoplasmade modoque possa induzir à expressãode genesderestaurac¸ão.Naturalmente,existempolimorfismos genéticosqueaumentamaatividadedetranscric¸ãodoHIF-1␣ emcomparac¸ão com aisoforma comum. Emnível experi-mental,avaliou-seadimetilalilglicina(DMOG),umpotente inibidor das prolil-hidroxilases.84 Os níveis endógenos de
HIF-1␣ podemseraumentados pelasupressãodaatividade do PHD, quer reduzindo o nível de oxigênio celular ou se combinandoaoFe(II)demodocompetitivo.ADMOGéum inibidorcompetitivo permeávelàcélula dosPHD.A DMOG éumaanálogado2-oxoglutaratoedessemodoinibenãosó oHIFprolil,mastambémasasparaginilohidroxilases.Além disso,prediz-sequeinibiaoutrosmembrosdasdioxigenases dependentes de 2-oxoglutarato. Existem três hidroxilases HIF-prolilconhecidas emmamíferose elassão codificadas porgenesdistintos:PHD1,PHD2ePHD3.Comotodasas dio-xigenasesdependentesde2-oxoglutarato,osPHDrequerem oxigênioparaahidroxilac¸ão,bemcomoácidotricarboxílico deciclointermediário,2-oxoglutarato(␣-cetoglutarato),ferro (Fe 2+) e ascorbato como cofatores. Quando os níveis de
oxigênio estão baixos, o HIF-1␣ escapa da hidroxilac¸ão do PHDereconhecimentopeloVHL.85,86
OutrosinibidoresdoPHDcompotenciaisefeitosbenéficos sãoadeferoxamina(DFO)eocloretodecobalto(CoCl2),um
quelantedoferroeuminibidorcompetitivodoferro, respec-tivamente;elessãorotineiramenteusadostantoinvitrocomo
invivoparainibir aatividadedoPHD,competempeloferro endógeno(II).Outrosquelantesdoferro,comoaciclopirox ola-mina,einibidorescompetitivosdoferro,comooCu2+,Zn2+e
Mn2+,tambémsãousadoscomoinibidoresdoPHD.53
Domesmomodo,existemestudosquedemonstramque o HIF-1␣ eo seu gene alvo VEGF são reguladores essenci-ais do acoplamento angiogênico-osteogênico.7,87 Além dos
condrócitos,ososteoblastostambémexpressamoHIF-1␣ e promovemavascularizac¸ãodoesqueletoduranteaformac¸ão doossoendocondral;amanipulac¸ãodosistemaHIFpormeio deabordagensfarmacológicasougenéticaséumaestratégia atrativaparaotratamentodedoenc¸ashipóxicas,incluindoas doenc¸asesqueléticas,comoainflamac¸ãodoossosubcondral duranteaOA.53
Conclusão
Valeressaltarqueosdiversosestudosdeassociac¸ãoentreo SNPeaOApermanecemnãoconfirmadosoucontroversosem decorrênciadoviésnoscritériosdeselec¸ãodospacientesem relac¸ãoàsarticulac¸õesafetadaspelaOA,classificac¸ãoemodo deestadiamento.
Adestruic¸ãoda cartilagemnaOA mediadaporenzimas catabólicas e morte de condrócitos, incluindo a apoptose e/ouautofagia,tambémcontribuiuparaapatogênese. Estu-dosdemonstraram queaexpressãodoHIF-1 éaumentada na cartilagem acometida pela OA para mediar a resposta doscondrócitosà hipóxia; oHIF-1 atuacomo um fatorde sobrevivência, melhora a síntese de matriz extracelular e inibeaapoptose88;o HIF-1regulatanto aautofagiaquanto
aapoptoseeoHIF-1édeimportânciacrucialnahomeostase dacartilagem.89Alémdisso,tambémseránecessário
explo-raroutrasisoformasdoHIF,comoaHIF-2␣,queparecemter oefeitoopostoaodoHIF-1␣.AproteínaHIF-2atuacomoum freionafunc¸ãodeaceleradordaautofagiadoHIF-1epromove ahipertrofiadoscondrócitos,umestadodediferenciac¸ão ter-minalcaracterizadoporumprogramadeexpressãodogene original, incluindoo colágeno tipo X e a protease MPM-13 degradantedecolágenotipoII.9
Embora outros estudosprecisem elucidaro mecanismo exatodoHIF-1naOA,asevidênciasatuaislevama considerá--locomoumaabordagempromissoraparaotratamentoda OA.Noentanto,osresultadosrelatadosindicamqueos mar-cadoresgenéticospodemcontribuirparaacompreensãoda histórianaturaldessadoenc¸a.
Conflitos
de
interesse
Osautoresdeclaramnãohaverconflitosdeinteresse.
Agradecimentos
ACarlosAguilar-Gonzálezporseuvaliosoapoionaconcepc¸ão dafiguras3e4.
r
e
f
e
r
ê
n
c
i
a
s
1.VosT,FlaxmanAD,NaghaviM,LozanoR,MichaudC, EzzatiM,etal.Yearslivedwithdisability(YLDs)for1160 sequelaeof289diseasesandinjuries1990-2010:asystematic analysisfortheGlobalBurdenofDiseaseStudy2010.Lancet. 2012;380:2163–96.
2.FicheraC,PappalardoA,TrioloG,GalloM,ValentiniG, BagnatoG.Epidemiologyandriskfactorsinosteoarthritis: literaturereviewdatafromOASISstudy.Reumatismo. 2004;56:169–84.
3.KomatsuM,KamimuraM,NakamuraY,MukaiyamaK, IkegamiS,UchiyamaS,etal.Rapidbonedestructionina patientwithkneeosteoarthritis.Acasereportandreviewof theliterature.ClinCasesMinerBoneMetab.2014;11:232–5.
4.SchiphofD,vanMiddelkoopM,deKlerkBM,OeiEH, HofmanA,KoesBW,etal.Crepitusisafirstindicationof patellofemoralosteoarthritis(andnotoftibiofemoral osteoarthritis).OsteoarthritisCartilage.2014;201:631–8.
5.MusumeciG,AielloFC,SzychlinskaMA,DiRosaM, CastrogiovanniP,MobasheriA.OsteoarthritisintheXXIst century:riskfactorsandbehavioursthatinfluencedisease onsetandprogression.IntJMolSci.2015;16(3):6093–112.
6.MeulenbeltI.Osteoarthritisyear2011inreview:genetics. OsteoarthritisCartilage.2012;20:218–22.
7.SchipaniE,RyanHE,DidricksonS,KobayashiT,KnightM, JohnsonRS.Hypoxiaincartilage:HIF-1alphaisessentialfor chondrocytegrowtharrestandsurvival.GenesDev. 2001;15:2865–76.
8.PfanderD,CramerT,HypoxiaSwobodaB.HIF-1alphain osteoarthritis.IntOrthop.2005;29(1):6–9.
9.CoimbraIB,JimenezSA,HawkinsDF,Piera-VelazquezS, StokesDG.Hypoxiainduciblefactor-1alphaexpressionin humannormalandosteoarthriticchondrocytes.
OsteoarthritisCartilage.2004;12(4):336–45.
differentiatedanddedifferentiatedhumanfetalchondrocytes bymicroarrayanalysis.ArthritisRheum.2002;46(2):404–19.
11.PfanderD,SwobodaB,CramerT.TheroleofHIF-1alphain maintainingcartilagehomeostasisandduringthe
pathogenesisofosteoarthritis.ArthritisResTher.2006;8:104. Epub2006Jan18.
12.StröbelS,LoparicM,WendtD,SchenkA,CandrianC, LindbergR,etal.Anabolicandcatabolicresponsesofhuman articularchondrocytestovaryingoxygenpercentages. ArthritisResTher.2010;12:R34.
13.GrimmerC,PfanderD,SwobodaB,AingnerT,MuellerL, HenningF,etal.Hypoxia-InducibleFactor1␣isinvolvedinthe prostaglandinmetabolismofosteoarthriticcartilagethrough up-regulationofmicrosomalprostaglandinEsynthase1in articularchondrocytes.ArthritisRheum.2007;56:4084–94.
14.DistlerK.Hypoxiaandangiogenesisinrheumaticdiseases. ZRheumatol.2003;62Suppl2:II43–5.
15.WuL,HuangX,LiL,HuangH,XuR,LuytenW.Insightson biologyandpathologyofHIF-1␣/-2␣,TGF/BMP,
Wnt/-catenin,andNF-(Bpathwaysinosteoarthritis.Curr PharmDes.2012;18(22):3293–312.
16.MoherD,LiberatiA,TetzlaffJ,AltmanDG,GroupPRISMA. Preferredreportingitemsforsystematicreviewsand meta-analyses:thePRISMAstatement.PLOSMed. 2009;6:e1000097.
17.GuilakF.Biomechanicalfactorsinosteoarthritis.BestPract ResClinRheumatol.2011;25:815–23.
18.LeeKM,ChungCY,SungKH,LeeSY,WonSH,KimTG,etal. Riskfactorsforosteoarthritisandcontributingfactorsto currentarthriticpaininSouthkoreanolderadults.Yonsei MedJ.2015;56:124–31.
19.DeFilippisL,GulliS,CaliriA,RomanoC,MunaóF, TrimarchiG,etal.Epidemiologyandriskfactorsin osteoarthritis:literaturereviewdatafromOASISstudy. Reumatismo.2004;56:169–84.
20.FernándezM,RegoF,BlancoF.Geneticsinosteoarthritis. ReumatolClin.2007;3Supl3:S13–8.
21.ChapmanK,ValdesAM.GeneticfactorsinOApathogenesis. Bone.2012;51:258–64.
22.ShiD,ZhengQ,ChenD,ZhuL,QinA,FanJ,etal.Association ofsingle-nucleotidepolymorphisminHLAclassII/IIIregion withkneeosteoarthritis.OsteoarthritisCartilage.
2010;18:1454–7.
23.SealA,GuptaA,MahalaxmiM,AykkalR,SinghTR,
ArunachalamV.Tools,resourcesanddatabasesforSNPsand indelsinsequences:areview.IntJBioinformResApp. 2014;10:264–96.
24.KnezK,SpasicD,JanssenKP,LammertynJ.Emerging technologiesforhybridizationbasedsinglenucleotide polymorphismdetection.Analyst.2014;139:
353–70.
25.UranoT,NarusawaK,HosoiT,OuchiY,NakamuraT,InoueS. Associationofasinglenucleotidepolymorphisminthe WISP1genewithspinalosteoarthritisinpostmenopausal Japanesewomen.JBoneMinerMetab.2007;25:253–8.
26.HanZ,LiuQ,SunC,LiY.Theinteractionbetweenobesityand RAGEpolymorphismsontheriskofkneeosteoarthritisin Chinesepopulation.CellPhysiolBiochem.2012;30:898–904.
27.ZhangR,YaoJ,XuP,JiB,VoegeliG,HouW,etal.Association betweengeneticvariantsofDVWAandosteoarthritisofthe kneeandhip:acomprehensivemeta-analysis.IntJClinExp Med.2015;8(6):9430–7.
28.QingZ,YeJ.AssociationbetweenACEpolymorphismsand osteoarthritissusceptibility.IntJClinExpPathol.
2015;8(6):7391–6.
29.GuJ,RongJ,GuanF,JiangL,TaoS,GuanG,etal.MATN3Gene PolymorphismIsAssociatedwithOsteoarthritisinChinese
HanPopulation:ACommunity-BasedCase-ControlStudy. ScientificWorldJournal.2012;2012:656084.
30.MeulenbeltI,MinJ,BosS,RiyaziN,HouwingJ,SlagboomE, etal.IdentificationofDIO2asanewsusceptibilitylocusfor symptomaticosteoarthritis.HumMolGenet.2008;17:1867–75.
31.PoonpetT,HonsawekS,TammachoteN,KanitnateS, TammachoteR.ADAMTS14genepolymorphismassociated withkneeosteoarthritisinThaiwomen.GenetMolRes. 2013;12:5301–9.
32.WangL,GuoL,TianF,HaoR,YangT.Analysisofsingle nucleotidepolymorphismswithinADAM12andriskofknee osteoarthritisinaChineseHanpopulation.BiomedResInt. 2015;2015:518643.
33.KernaI,KisandK,TammAE,KummJ,TammAO.Two single-nucleotidepolymorphismsinADAM12geneare associatedwithearlyandlateradiographicknee osteoarthritisinEstonianpopulation.Arthritis. 2013;2013:878126.
34.Fernández-TorresJ,Hernández-DíazC,Espinosa-MoralesR, Camacho-GalindoJ,Galindo-SevillaNdelC,López-MacayA, etal.Polymorphicvariationofhypoxiainduciblefactor-1A (HIF1A)genemightcontributetothedevelopmentofknee osteoarthritis:apilotstudy.BMCMusculoskeletDisord. 2015;16:218.
35.FernandesMT,FernandesKB,MarquezAS,CólusIM,Souza MF,SantosJP,etal.Associationofinterleukin-6gene polymorphism(rs1800796)withseverityandfunctional statusofosteoarthritisinelderlyindividuals.Cytokine. 2015;75:316–20.
36.LuoSX,LiS,ZhangXH,ZhangJJ,LongGH,DongGF,etal. Geneticpolymorphismsofinterleukin-16andriskofknee osteoarthritis.PLoSOne.2015;10:e0123442.
37.LiuZ,MaL,QiuS,JiaT.Geneticpolymorphismsof interleukin-16areassociatedwithsusceptibilitytoprimary kneeosteoarthritis.IntJClinExpMed.2015;8:1401–5, eCollection2015.
38.PanF,TianJ,WinzenbergT,DingC,Jones.Association betweenGDF5rs143383polymorphismandknee osteoarthritis:anupdatedmeta-analysisbasedon23,995 subjects.BMCMusculoskeletDisord.2014;15:404.
39.TawonsawatrukT,ChangthongT,PingsuthiwongS,Trachoo O,SauraT,WajanavisitW.Ageneticassociationstudy betweengrowthdifferentiationfactor(GDF5)polymorphism andkneeosteoarthritisinThaipopulation.JOrthopaedSurg. 2011;Res6:2–5.
40.SophiaFoxAJ,BediA,RodeoSA.Thebasicscienceofarticular cartilage:structure,composition,andfunction.SportsHealth. 2009;1:461–8.
41.MarianiE,PulsatelliL,FacchiniA.Signalingpathwaysin cartilagerepair.IntJMolSci.2014;15:8667–98.
42.ChenJL,DuanL,ZhuW,XiongJ,WangD.Extracellularmatrix productioninvitroincartilagetissueengineering.JTransl Med.2014;12:88.
43.FindlayDM,AtkinsGJ.Osteoblast-chondrocyteinteractionsin osteoarthritis.CurrOsteoporosRep.2014;12:127–34.
44.IwamotoM,OhtaY,LarmourC,Enomoto-IwamotoM.Toward regenerationofarticularcartilage.BirthDefectsResCEmbryo Today.2013;99:192–202.
45.MaldonadoM,NamJ.Theroleofchangesinextracellular matrixofcartilageinthepresenceofinflammationonthe pathologyofosteoarthritis.BiomedResInt.2013;2013:284873.
46.vanderKraanPM.Osteoarthritisyear2012inreview:biology. OsteoarthritisCartilage.2012;20:1447–50.
47.ZhangFJ,LuoW,LeiGH.RoleofHIF-1␣andHIF-2␣in osteoarthritis.JointBoneSpine.2015;82:144–7.
49.GörlachA.RegulationofHIF-1alphaatthetranscriptional level.CurrPharmDes.2009;15:3844–52.
50.SemenzaGL.HIF-1:mediatorofphysiologicaland pathophysiologicalresponsestohypoxia.JApplPhysiol. 2000;88:1474–80.
51.MaxwellPH.Hypoxia-induciblefactorasaphysiological regulator.ExpPhysiol.2005;90:791–7.
52.FukudaR,HirotaK,FanF,JungYD,EllisLM,SemenzaGL. Insulin-likegrowthfactor1induceshypoxia-induciblefactor 1-mediatedvascularendothelialgrowthfactorexpression, whichisdependentonMAPkinaseandphosphatidylinositol 3-kinasesignalingincoloncancercells.JBiolChem. 2002;277:38205–11.
53.FanL,LiJ,YuZ,DangX,WangK.Thehypoxia-inducible factorpathway,prolylhydroxylasedomainproteininhibitors, andtheirrolesinbonerepairandregeneration.BiomedRes Int.2014;2014:239356.
54.CatrinaSB,OkamotoK,PereiraT,BrismarK,PoellingerL. Hyperglycemiaregulateshypoxia-induciblefactor-1alpha proteinstabilityandfunction.Diabetes.2004;53:3226–32.
55.ZhouJ,HaraK,InoueM,HamadaS,YasudaH,MoriyamaH, etal.Regulationofhypoxia-induciblefactor1byglucose availabilityunderhypoxicconditions.KobeJMedSci. 2008;53:283–96.
56.TanimotoK,YoshigaK,EguchiH,KaneyasuM,UkonK, KumazakiT,etal.Hypoxia-induciblefactor-1a
polymorphismsassociatedwithenhancedtransactivation capacity,implyingclinicalsignificance.Carcinogenesis. 2003;24:1779–83.
57.YamadaN,HorikawaY,OdaN,IizukaK,ShiharaN,KishiS, etal.GeneticvariationintheHypoxia-InducibleFactor-1␣
geneisassociatedwithtype2diabetesinJapanese.JClin EndocrinolMetab.2005;90:5841–7.
58.TzouvelekisA,NtoliosP,KaramerisA,KoutsopoulosA, BoglouP,KoulelidisA,etal.Expressionofhypoxia-inducible factor(HIF)-1a-vascularendothelialgrowthfactor
(VEGF)-inhibitorygrowthfactor(ING)-4-axisinsarcoidosis patients.BMCResNotes.2012;5:654.
59.Sartori-CintraAR,MaraCS,ArgoloDL,CoimbraIB.Regulation ofhypoxia-induciblefactor-1␣(HIF-1␣)expressionby interleukin-1(IL-1),insulin-likegrowthfactorsI(IGF-I)and II(IGF-II)inhumanosteoarthriticchondrocytes.Clinics(São Paulo).2012;67:35–40.
60.KonacE,DoganI,OnenHI,YurdakulAS,OzturkC,VarolA, etal.Geneticvariationsinthehypoxia-inducible
factor-1alphageneandlungcancer.ExpBiolMed. 2009;234:1109–16.
61.LiP,CaoQ,ShaoPF,CaiHZ,ZhouH,ChenJW,etal.Genetic polymorphismsinHIF1Aareassociatedwithprostatecancer riskinaChinesepopulation.AsianJAndrol.2012;14: 864–9.
62.AlidoostiM,GhaediM,SoleimaniA,BakhtiyariS,Rezvanfard M,GolkhuS,etal.Studyontheroleofenvironmental parametersandHIF-1Agenepolymorphismincoronary collateralformationamongpatientswithischemicheart disease.ClinBiochem.2010;44:1421–4.
63.BahadoriB,UitzE,MayerA,HarauerJ,DamK, Truschnig-WildersM,etal.Polymorphismsofthe
hypoxia-induciblefactor1geneandperipheralarterydisease. VascMed.2010;15:371–4.
64.NagyG,KovacsR,KereszturiE,SomogyiA,SzekelyA,Nemeth N,etal.Associationofhipoxiainduciblefactor-1alphagene polymorphismwithbothtype1andtype2diabetesina Caucasian(Hungarian)sample.BMCMedGenet.2009;10:79.
65.YangHY,ChuangSY,FangWH,HuangGS,WangCC,Huang YY,etal.EffectofRAGEpolymorphismsonsusceptibilityto andseverityofosteoarthritisinaHanChinesepopulation:a case-controlstudy.GenetMolRes.2015;14:11362–70.
66.SwellamM,MahmoudMS,SamyN,GamalAA.Potential influenceofinterleukin-1receptorantagonistgene polymorphismonkneeosteoarthritisrisk.DisMarkers. 2010;28:299–305.
67.Uchanska-ZieglerB,LollB,FabianH,HeeCS,SaengerW, ZieglerA.HLAclassI-associateddiseaseswithasuspected autoimmuneetiology:HLA-B27subtypesasamodelsystem. EurJCellBiol.2012;91:274–86.
68.HongJM,KimTH,ChaeSC,KooKH,LeeYJ,ParkEK,etal. Associationstudyofhypoxiainduciblefactor1alpha(HIF-1 alpha)withosteonecrosisoffemoralheadinaKorean population.OsteoarthritisCartilage.2007;15:688–94.
69.MuzB,LarsenH,MaddenL,KiriakidisS,PaleologEM.Prolyl hydroxylasedomainenzyme2isthemajorplayerin regulatinghypoxicresponsesinrheumatoidarthritis. ArthritisRheum.2012;64:2856–67.
70.GrimmerC,BalbusN,LangU,AignerT,CramerT,MüllerL, etal.RegulationoftypeIIcollagensynthesisduring osteoarthritisbyprolyl-4-hydroxylases:possibleinfluenceof lowoxygenlevels.AmJPathol.2006;169:491–502.
71.RaineEV,DoddAW,ReynardLN,LoughlinJ.Allelicexpression analysisoftheosteoarthritissusceptibilitygeneCOL11A1in humanjointtissues.BMCMusculoskeletDisord.2013;14:85.
72.Rodriguez-FontenlaC,CalazaM,EvangelouE,ValdesAM, ArdenN,BlancoFJ,etal.Assessmentofosteoarthritis candidategenesinameta-analysisofninegenome-wide associationstudies.ArthritisRheumatol.2014;66:940–9.
73.Sánchez-EnríquezS,Torres-CarrilloNM,Vázquez-Del MercadoM,Salgado-GoytiaL,Rangel-VillalobosH, Mu ˜noz-ValleJF.Increaselevelsofapo-A1andapoBare associatedinkneeosteoarthritis:lackofassociationwith VEGF-460T/Cand+405C/Gpolymorphisms.RheumatolInt. 2008;29:63–8.
74.YuanQ,SunL,LiJJ,AnCH.ElevatedVEGFlevelscontributeto thepathogenesisofosteoarthritis.BMCMusculoskelet Disord.2014;15:437.
75.BarlasIO,SezginM,ErdalME,SahinG,AnkaraliHC,Altintas ZM,etal.Associationof(-1,607)1G/2Gpolymorphismof matrixmetalloproteinase-1genewithkneeosteoarthritisin theTurkishpopulation(kneeosteoarthritisandMMPsgene polymorphisms).RheumatolInt.2009;29:383–8.
76.LepetsosP,PampanosA,KanavakisE,TzetisM,KorresD, PapavassiliouAG,etal.AssociationofMMP-1-16071G/2G (rs1799750)polymorphismwithprimarykneeosteoarthritis intheGreekpopulation.JOrthopRes.2014;32:1155–60.
77.HonsawekS,MalilaS,YuktanandanaP,TanavaleeA, DeepaisarnsakulB,ParviziJ.AssociationofMMP-3(-1612 5A/6A)polymorphismwithkneeosteoarthritisinThai population.RheumatolInt.2013;33:435–9.
78.CookeGE,DoshiA,BinkleyPF.Endothelialnitricoxide synthasegene:prospectsfortreatmentofheartdisease. Pharmacogenomics.2007;8:1723–34.
79.AnJD,LiXY,YuJB,ZhaoY,JinZS.Associationbetweenthe eNOSgenepolymorphismsandrheumatoidarthritisriskina northernChinesepopulation.ChinMedJ(Engl).
2012;125:1496–9.
80.BrenolCV,ChiesJA,BrenolJC,MonticieloOA,FranciscattoP, BirrielF,etal.EndothelialnitricoxidesynthaseT-786C polymorphisminrheumatoidarthritis:associationwith extraarticularmanifestations.ClinRheumatol.2009;28:201–5.
81.HaaseVH.Regulationoferythropoiesisbyhypoxia-inducible factors.BloodRev.2013;27:41–53.
82.TortiL,TeofiliL,CapodimontiS,NuzzoloER,IachininotoMG, MassiniG,etal.Hypoxia-induciblefactor-1␣(Pro-582-Ser) polymorphismpreventsirondeprivationinhealthyblood donors.BloodTransfus.2013;11:553–7.
84.YuanQ,BleizifferO,BoosAM,SunJ,BrandlA,BeierJP,etal. PHDsinhibitorDMOGpromotesthevascularizationprocess intheAVloopbyHIF-1aup-regulationandthepreliminary discussiononitskineticsinrat.BMCBiotechnol.2014;14:112.
85.BrocatoJ,ChervonaY,CostaM.Molecularresponsesto hypoxia-induciblefactor1␣andbeyond.MolPharmacol. 2014;85:651–7.
86.SmithTG,TalbotNP.Prolylhydroxylasesandtherapeutics. AntioxidRedoxSignal.2010;12:431–3.
87.DanisA.MechanismofbonelengtheningbytheIlizarov technique.BullMemAcadRMedBelg.2001;156(1-2):107–12.
88.KohMY,PowisG.Passingthebaton:theHIFswitch.Trends BiochemSci.2012;37:364–72.