www.jped.com.br
ARTIGO
ORIGINAL
Rapid
antigen
detection
test
for
respiratory
syncytial
virus
diagnosis
as
a
diagnostic
tool
夽
,
夽夽
Flávio
da
Silva
Mesquita
a,
Danielle
Bruna
Leal
de
Oliveira
a,∗,
Daniela
Crema
b,
Célia
Miranda
Nunes
Pinez
b,
Thaís
Cristina
Colmanetti
a,
Luciano
Matsumia
Thomazelli
a,
Alfredo
Elias
Gilio
c,
Sandra
Elisabeth
Vieira
c,
Marina
Baquerizo
Martinez
b,d,
Viviane
Fongaro
Botosso
ee
Edison
Luiz
Durigon
aaUniversidadedeSãoPaulo,InstitutodeCiênciasBiomédicas,DepartamentodeMicrobiologia,SãoPaulo,SP,Brasil bUniversidadedeSãoPaulo,HospitalUniversitário,LaboratórioClínico,SãoPaulo,SP,Brasil
cUniversidadedeSãoPaulo,HospitalUniversitário,DivisãodePediatria,SãoPaulo,SP,Brasil dUniversidadedeSãoPaulo,EscoladeCiênciasFarmacêuticas,SãoPaulo,SP,Brasil
eInstitutoButantan,LaboratóriodeVirologia,DivisãodeDesenvolvimentoCientífico,SãoPaulo,SP,Brasil
Recebidoem26deoutubrode2015;aceitoem19dejunhode2016
KEYWORDS
Respiratoryviruses; Respiratorysyncytial virus---RSV;
Rapidantigen detectiontest---RADT
Abstract
Objective: TheaimofthisstudywastoevaluatetheQuickVue® RSVTestKit(QUIDELCorp,CA,
USA)asascreeningtoolforrespiratorysyncytialvirusinchildrenwithacuterespiratorydisease
incomparisonwith theindirect immunofluorescenceassayasgoldstandard.In Brazil,rapid
antigendetectiontestsforrespiratorysyncytialvirusarenotroutinelyutilizedasadiagnostic
tool,exceptforthediagnosisofdengueandinfluenza.
Methods: Theauthorsretrospectivelyanalyzed486nasopharyngealaspiratesamplesfrom
chil-drenunderage5withacuterespiratoryinfection,betweenDecember2013andAugust2014,
thesampleswereanalyzedbyIFIandQuickVue® RSVTestkit.Sampleswithdiscordantresults
wereanalyzedbyRT-qPCRandnucleotidesequencing.
Results: From313positivesamplesbyimmunofluorescenceassays,282(90%)werealsopositive
bytherapidantigen detectiontest,twowerepositiveonlybyrapidantigen detectiontest,
33werepositiveonlybyimmunofluorescenceassays,and171werepositivebybothmethods.
The35sampleswithdiscordantresultswereanalyzed byRT-qPCR;thetwosamplespositive
onlybyrapidantigendetectiontestandthefivepositiveonlybyimmunofluorescenceassays
werealso positive byRT-qPCR.Therewas norelationbetweenthenegativityby QuickVue®
RSVTestandviralloadorspecificstrain.TheQuickVue® RSVTestshowedsensitivityof90%,
specificityof98.8%,PPVof99.3%,andnegativepredictivevalueof94.6%,withaccuracyof
93.2%andagreementindexof0.85incomparisontoIFA.
DOIserefereaoartigo:
http://dx.doi.org/10.1016/j.jped.2016.06.013
夽 Comocitaresteartigo:MesquitaFS,OliveiraDB,CremaD,PinezCM,ColmanettiTC,ThomazelliLM,etal.Rapidantigendetectiontest
forrespiratorysyncytialvirusdiagnosisasadiagnostictool.JPediatr(RioJ).2017;93:246---52.
夽夽TrabalhodesenvolvidonaUniversidadedeSãoPaulo,InstitutodeCiênciasBiomédicasII,DepartamentodeMicrobiologia,Laboratório
deVirologiaClínicaeMolecular,SãoPaulo,SP,Brasil.
∗Autorparacorrespondência.
E-mail:danibruna@gmail.com(D.B.Oliveira).
Conclusions: ThisstudydemonstratedthattheQuickVue®RSVTestKitcanbeeffectiveinearly
detectionofRespiratorysyncytialvirusinnasopharyngealaspirateandisreliableforuseasa
diagnostictoolinpediatrics.
©2016SociedadeBrasileiradePediatria.PublishedbyElsevierEditoraLtda.Thisisanopen
accessarticleundertheCCBY-NC-NDlicense(http://creativecommons.org/licenses/by-nc-nd/
4.0/).
PALAVRAS-CHAVE
VirosesRespiratórias; VirusSincicial Respiratório---VSR; TesteRápidode Detecc¸ãode Antígeno---TRDA
Testerápidodedetecc¸ãodeantígenosparaodiagnósticodoVírusSincicial Respiratóriocomoferramentadediagnóstico
Resumo
Objetivo: AvaliarotesteQuickVue®
RSVTestKit(QUIDELCorp,CA,EUA)paraodiagnóstico
rápidodovírussincicialrespiratórioemcrianc¸ascomdoenc¸arespiratóriaaguda,comparandoo
comaimunofluorescênciaindiretacomopadrãoouro.Vistoque,noBrasil,testesrápidospara
detecc¸ãodeantígenosparavírussincicialrespiratórionãosãorotineiramenteutilizadoscomo
ferramentadediagnóstico,excetoparaDengueeInfluenza.
Métodos: Umtotalde486amostrasdeaspiradodenasofaringedecrianc¸asmenoresde5anos
comdoenc¸arespiratóriaaguda,coletadasentredezembrode2013eagostode2014,foram
ana-lisadasporimunofluorescênciaepelotesteQuickVue®
.Amostrascomresultadosdiscordantes
entreosmétodosforamsubmetidasaPCRemtemporealesequenciamento.
Resultados: Das313 amostras positivas por IFI, 282foram positivas no teste rápido (90%),
2amostrasforampositivas apenas notesterápido(0.6%),33 apenas naimunofluorescência
(10.5%)e171foramnegativasemambososmétodos.As35amostrascomresultados
discordan-tesforamtestadasporPCRemtemporeal,sendoqueduasqueforampositivasapenasnoteste
rápidoe5apenasnaimunofluorescênciaconfirmaram-sepositivas.Nãohouverelac¸ãoentrea
ausênciadepositividadenotesteQuickVue®
comacargaoucomacepaviral.OtesteQuickVue®
mostrousensibilidadede90.1%,especificidade98.9%,valorpreditivopositivo99.3%,valor
pre-ditivonegativode94.6%,acuráciade93.2%eíndicedeconcordânciade0.85emcomparac¸ão
àimunofluorescência.
Conclusões: NossoestudodemonstrouqueotesteQuickVue® RSVpodeserefetivonadetecc¸ão
precoce dovírussincicialrespiratórioemamostrasdeaspiradodenasofaringeeéconfiável
comoumaferramentadediagnósticosempediatria.
©2016SociedadeBrasileiradePediatria.PublicadoporElsevierEditoraLtda.Este ´eumartigo
OpenAccesssobumalicenc¸aCCBY-NC-ND(http://creativecommons.org/licenses/by-nc-nd/4.
0/).
Introduc
¸ão
O vírus sincicial respiratório (VSR) é conhecido como um importante agente infecciosodeinfecc¸õesdo trato respi-ratórioem crianc¸asem todoomundo.1Amaiorparte das
crianc¸aséinfectadanoprimeiroanodevida,porém prati-camentetodasestarãoexpostasatéos2anos.2Reinfecc¸ões
sãocomunsao longodavida, dependemdonívelde anti-corpos neutralizadores no soro, porém complicac¸ões em infecc¸õesdotratorespiratórioinferiorsãomaiscomunsna infecc¸ão primária.3 O VSR é basicamente reproduzido em
partessuperficiaisdotratorespiratórioatéseespalharpelo epitélioeformarumefeitocitopáticosemelhanteaum sin-cício.OVSRtemdoissubgruposconhecidos, AeB,epode causarvários quadros clínicos, desde umagripecomum a bronquioliteepneumonia,causadaspelanecrosedos brôn-quiosebronquíolos.AOrganizac¸ãoMundialdeSaúde(OMS) estima que o VSR infecta 64 milhões de pessoas e causa 160.000óbitosporanoemtodoomundo.4Asazonalidade
dovírus variae normalmenteé detectadadurante todoo ano. Contudo, sabe-se que a maior incidência ocorre no inverno.
Odiagnóstico viraldoVSRpodeseratingido porvários métodos, incluindo: cultura de células, ensaios de imu-nofluorescência(IFI),ensaiosimunocromatográficos(testes rápidos de detecc¸ão de antígenos: TRDAs) e reac¸ão em cadeiadapolimerase(PCR),incluindoensaiosdePCR con-vencionaiseemtemporeal.Naúltimadécada,osmétodos moleculares são usados como padrão ouro devido à sua especificidade e capacidade de detecc¸ão simultânea de diferentes vírus.5 No Brasil, embora existam no mínimo
quatro testes rápidos de detecc¸ão de antígenos (TRDAs) disponíveisparaadetecc¸ãodoVSR:BD-DirectigenTMEZ-RSV (Becton,DickinsonandCompany®,NJ,EUA);SASTMRSValert (Medivax®,RJ,Brasil),AlereTMBinaxNow®RSV(AlereTM,EUA) eQuickVue® RSV TestKit (QUIDELCorp., CA,EUA),testes rápidosnãosãousadosrotineiramentenopaíscomo diagnós-ticoconfiáveldeinfecc¸õesvirais,comooVSR,comexcec¸ão dostestesdeHIVeDengue,6,7quesãoamplamenteusados.
etiológico das doenc¸as respiratórias, como bronquite e bronquiolite,éumpassoimportanteemdirec¸ãoàreduc¸ão do uso de antimicrobianos, principalmente em crianc¸as hospitalizadas,9 e também pode levar ao método mais
adequadodeisolamentoetratamento.
O Quidel® QuickVue® RSV Test é um imunoensaio com varetas que permite a detecc¸ão rápida e qualitativa do antígenoVSR (proteínadefusão viral)diretamentea par-tirdeespécimesdeesfregac¸odenasofaringe,aspiradode nasofaringe ou lavagem nasal/nasofaríngea de pacientes pediátricossintomáticos.Otesteé destinadoaousocomo auxílionodiagnósticodeinfecc¸õesviraissinciciais respira-tóriasagudas.
Oobjetivodesteestudoéavaliarasensibilidade, espe-cificidade e importância do teste QuickVue® RSV Test Kit (QUIDELCorp.CA,EUA)comoumtesterápidodedetecc¸ão de antígenos (TRDA) para exame e melhoria do diagnós-tico do vírus sincicial respiratório (VSR) em aspirado de nasofaringeemcrianc¸ascomdoenc¸arespiratóriaagudaem comparac¸ão com ensaios de imunofluorescência indireta (IFI)parausoemhospitaiseclínicaspediátricas.
Material
e
métodos
Analisamos retroativamente amostras de aspirado de nasofaringe (AN) de 486 crianc¸as --- 274 meninos (56,4%) e 212 meninas (43,6%) --- com menosde 5 anos com sin-tomas de infecc¸ão respiratória aguda (IRA), incluindo a doenc¸a do trato respiratório superior e inferior, entre dezembro de 2013 e agosto de 2014, que apresentavam IRAe foram atendidas nopronto socorro, noambulatório ou internadas na Pediatria do Hospital Universitário da UniversidadedeSãoPaulo(HU-USP).
Asamostrasclínicasforamcoletadasduranteosurtode VSR de 2014 com aspirador nasal. Imediatamente após a coleta,asamostrasforamenviadasaoLaboratório Hospita-lardaUniversidadedeSãoPauloeexaminadasporensaiosde imunofluorescênciaindireta(IFI)comokitcomercialLight DiagnosticsTMRespiratoryPanelViralScreeningand Identifi-cation(IFAChemicon®,MerkMilliporeCorp.,EUA)deacordo
comasinstruc¸õesdofabricante.Essasamostrasforam envi-adas ao Laboratório de Virologia Clínica e Molecular no Instituto de Ciências Biomédicas da Universidade de São Paulo,ondeforamcongeladasporcriogeniaearmazenadas a-80◦Catéomomentodoteste.Todasasamostrasforam
registradas no Biorrepositório do Laboratório deVirologia etodasasdiretrizes deéticaparaexperimentoshumanos foram estritamente observadas e aprovadas pelo Comitê de Ética sobre Pesquisa com Seres Humanos da Universi-dadedeSãoPaulo(USP).
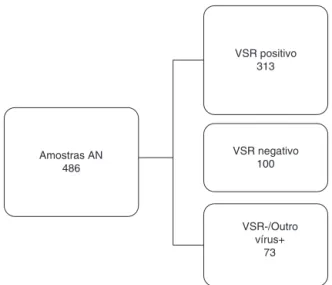
Com base nos resultados da IFI, foram selecionadas 486amostrasdeANdistribuídasdurantetodososmesesda temporadaecorresponderama50,4%detodasasamostras analisadas.Elasforamclassificadas em três grupos distin-tosconformemostradonafigura1.Parareduziroueliminar qualquerviés,oensaioQuickVue® RSVfoifeitoeanalisado emumperíodocegodetesteeosresultadosforam compa-radoscomosresultadosoriginaisdoKitIFI.
Para confirmarosresultados, asamostrascom resulta-dosdiscrepantesforamtestadasposteriormenteporPCRda Transcric¸ãoReversaQuantitativaemTempoReal(regiãoda
Amostras AN 486
VSR positivo 313
VSR negativo 100
VSR-/Outro vírus+
73
Figura 1 Fluxogramade trabalho.Asamostrasde aspirado
denasofaringeforamdivididasemtrêsgruposdiferentes
exa-minadospeloensaiodeimunofluorescênciaecomparadascom
otesterápidodedetecc¸ãodeantígenosparaovírussincicial
respiratório.VSR,vírussincicialrespiratório;AN, aspiradode
nasofaringe;+, positivo;-,negativo.
proteína F) e por PCR tradicional (regiões das proteínas GeF).
As amostras foram extraídas na plataformaNuclisens®
easyMag® (bioMerieux®,MA, EUA)e a PCRem temporeal
foifeitaem umainstrumentac¸ãoABI7300 comokit prin-cipaldemisturaAgPath-IDOne-StepRT-PCR(Ambion®,TX,
EUA)deacordocomasinstruc¸õesdofabricante.
Na PCR tradicional, usamos uma mistura de reac¸ão com 10L de DNA complementar (cDNA), 5Lde reac¸ão
colchãodePCRcomconcentrac¸ão10X[50mMTris---HCl(pH 9,0)],1LdeMgCl2[50mMKCl,20mM(NH4)2SO4],2,5mM
de cada desoxirribonucleotídeofosfatado (dNTP), 10pmol decadainiciadorparaVSR(tabela1),0,6UdeTaqDNA poli-merase(taqDNApolimeraseplatina,Invitrogen,CA,EUA)e Água,resultouemumvolumefinalde50L.Aamplificac¸ão dasproteínasGeFfoifeitaemumtermocicladorGeneAmp PCR System 9700 (Applied Biosystems, Inc., CA, EUA) de acordocom aseguinteprogramac¸ão: 95◦C por5minutos,
seguidode40ciclosde95◦Cpor30segundos,54◦Cpor30
segundos, 72◦C por 1 minuto e 30 segundos e um último
ciclode72◦Cpor7minutos.Aproximadamente1.894
pro-dutosdeparesdebase(bp)dogeneG10---12e1685produtos
bp do gene F13 foram purificados com um kit comercial
(Exosap, GE®Tech, CA, EUA) deacordo com as instruc¸ões do fabricante. As reac¸ões em sequência do geneG10---13 e
dogeneF13,14foramsubmetidasàseparac¸ãoeletroforética
paracoletadedadosbásicosem umsequenciadordeDNA 3130 (Applied Biosystems, Inc., CA, EUA) com um kit de finalizadorescomcorantefluorescente(AppliedBiosystems, Inc.CA,EUA).As sequênciasobtidasforameditadascoma versão1.0doprogramadenavegadordesequências(Applied Biosystems, Inc., CA, EUA) e alinhadas com o programa Megalign (Lacergene, DNASTAR, Inc., WI, EUA). A filoge-niapormáximaverossimilhanc¸adaproteínaGfoiestimada comoMEGA6(AnálisedaGenéticaEvolutivaMolecular)15,16
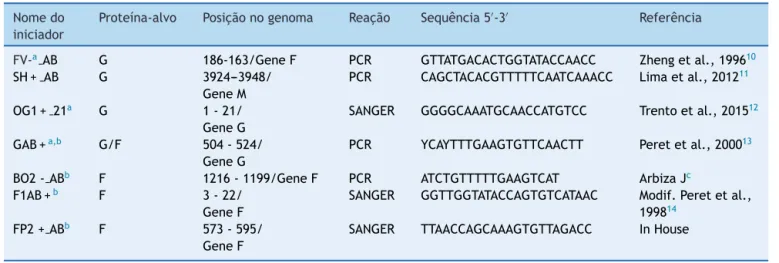
Tabela1 IniciadoresusadosnaPCRtradicionalenosequenciamentodasproteínasGeFdoVSR
Nomedo
iniciador
Proteína-alvo Posic¸ãonogenoma Reac¸ão Sequência5′-3′ Referência
FV-aAB G 186-163/GeneF PCR GTTATGACACTGGTATACCAACC Zhengetal.,199610
SH+ AB G 3924---3948/
GeneM
PCR CAGCTACACGTTTTTCAATCAAACC Limaetal.,201211
OG1+ 21a G 1-21/
GeneG
SANGER GGGGCAAATGCAACCATGTCC Trentoetal.,201512
GAB+a,b G/F 504-524/
GeneG
PCR YCAYTTTGAAGTGTTCAACTT Peretetal.,200013
BO2-ABb F 1216-1199/GeneF PCR ATCTGTTTTTGAAGTCAT ArbizaJc
F1AB+b F 3-22/
GeneF
SANGER GGTTGGTATACCAGTGTCATAAC Modif.Peretetal.,
199814
FP2+ABb F 573-595/
GeneF
SANGER TTAACCAGCAAAGTGTTAGACC InHouse
F,Proteínadefusão;G,Glicoproteína;M,Proteínadematriz.
a IniciadorusadonosequenciamentodogeneG. b IniciadorusadonosequenciamentodogeneF.
c CortesiadoDr.JuanArbiza,LaboratóriodeVirologia,FaculdadedeCiências,UniversidadedaRepública,Montevidéu,Uruguai.
conjuntodedadosVSRHB.17Aárvorefilogenéticaresultante
foitraduzidaemumcladogramavertical.
Os critérios usados na avaliac¸ão de desempenho do ensaio com QuickVue® RSV foram sensibilidade, especificidade, valores preditivos positivos e negati-vos e razões de verossimilhanc¸a de diagnóstico (DLRs) positivas/negativas.18,19 Consideramoso IFIo padrão ouro
nessasanálises.As amostrasavaliadascomopositivas pelo IFIforamconsideradasverdadeiros positivoseasamostras avaliadas como negativas pelo IFI foram consideradas verdadeiros negativos. Para uma avaliac¸ão precisa da concordância entre os métodos, também foi calculado o índicekappa().
Resultados
Testerápidodedetecc¸ãodeantígenos(TRDA)
Das313amostrasdeANpositivasparaVSRpeloIFI,282(90%) também foram positivas de acordo com o teste rápido (Quidel®QuickVueRSVTest);assim,oTRDArevelou31
resul-tadosfalsonegativos.Todasas100amostrasdeANpositivas paraVSRpeloIFItambémforamconsideradasnegativaspelo teste rápido (100%). Das 73 amostras de ANconsideradas negativasparaVSR,porém positivasparaoutrosvírus res-piratórios(adenovírus(AdV)ouvírusdaparainfluenza(PIV) 1,2, 3ouinfluenzaA e influenzaB)peloIFI, 71 (97,26%) foramconfirmadas pelo testerápido e duas (2,74%) apre-sentaramresultadosdivergentes,revelaramdoisresultados falsopositivos(tabela2A).
ResultadosdiscrepantestestadosporPCRem temporeal
As 33 amostras com resultados discordantes entre os dois métodos foram analisadas por PCR em tempo real (tabela2B).
Vinte e seis amostrasde ANpreviamente consideradas positivaspeloIFIenegativaspelotesterápido foram con-firmadaspositivasparaVSRporPCRemtemporeal.Asduas
amostrasdeANconsideradasnegativaspeloIFIepositivas pelo teste rápido eram de fato positivas por PCRq. E as cincoamostrasdeANconsideradaspositivaspeloIFIe nega-tivaspelotesterápidoeramdefatonegativasporPCRq.Os
Tabela 2 Resultados de VSR positivos e negativos por
ensaio de imunofluorescência indireta (IFI)e teste rápido
de detecc¸ão de antígenos (TRDA) e totalidade de
amos-tras divergentes testadasneste estudo. (A)Resultados do
teste rápido de detecc¸ão de antígenos comparados com
osdoIFI.(B)Resultadosdiscrepantes.(C)Comparac¸ãodos
parâmetrosdeavaliac¸ãodotesterápido,incluindo
sensibi-lidade,especificidade,valorpreditivopositivo(VPP),valor
preditivonegativo(VPN)erazãodeverossimilhanc¸ade
diag-nósticopositivo/negativo(DLR)doQuickVue® RSVTestem
comparac¸ãocomoIFI,usadocomopadrãoouro
TRDA(teste) Númerodeamostras
IFI(padrãoouro) Total
Positivo Negativo
Positivo 282 2 284
Negativo 31 171 202
Total 313 173 486
Resultados Númerodeamostras
IFI+,TRDA-,qPCR+ 26
IFI-,TRDA+,qPCR+ 2
IFI+,TRDA-,qPCR- 5
IFI-,TRDA+,qPCR- 0
Parâmetro ICde95%
Sensibilidade(%) 90,1(86,8-93,4%)
Especificidade(%) 98,8(97,2-100)
VPP(%) 99,3(98,3-100%)
VPN(%) 94,6(79,6-89,6)
DLRpositivo 77,9(19,6-309,26)
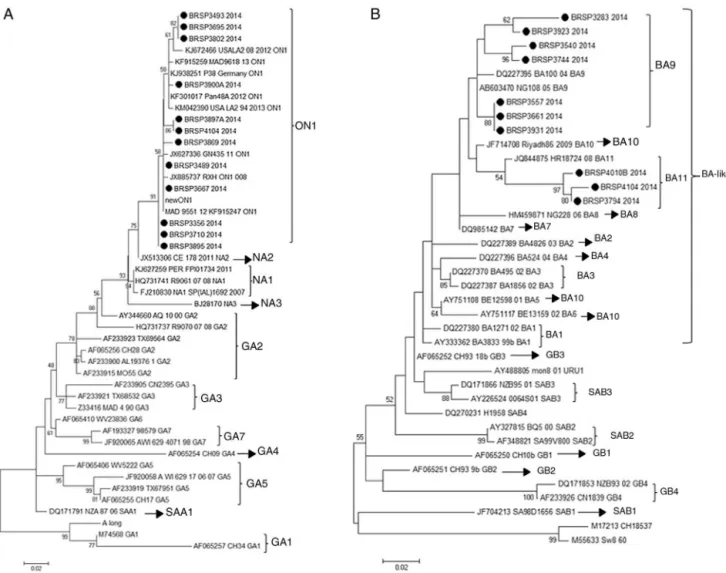
Figura2 Árvorefilogenéticadamáximaverossimilhanc¸adoVSRHcombasenassequênciasdonucleotídeodaproteínaGdas
amostrasdiscrepantesdestetrabalho,indicadascomoBRSP,edecepasmundialmentedistribuídasobtidasdoGenBank.Osnúmeros
deacessoaoGenBanksãoapresentadosemcadatáxon,seguidospelonomecorrespondentedacepa.A(s)árvore(s)inicial(is)da
buscaheurísticafoi(ram)obtida(s)comométododeagrupamentodevizinhosaumamatrizdedistânciaspareadasestimadaspela
abordagemdemáximaverossimilhanc¸acomposta(MCL).Asárvoresforamdesenhadasemescala,comoscomprimentosdostroncos
mensuradosemnúmerodesubstituic¸õesporlocal.Osnúmerosnosnósinternosrepresentamasprobabilidadesbootstrap(5.000
réplicas).Somentevaloresdebootstrap>50sãoapresentados.A)VSRHA. Ohistóricodeevoluc¸ãofoiinferidocomométodode
máximaverossimilhanc¸acombasenomodelodeTamura-Nei.15,16Aárvorecomamaiorprobabilidadelogarítmica(-1303.6711)é
apresentada.B)VSRHB.Ohistórico deevoluc¸ãofoiinferidocomométododemáximaverossimilhanc¸acombasenomodelode Hasegawa-Kishino-Yano.17Aárvorecomamaiorprobabilidadelogarítmica(-1207.4096)éapresentada.Asanálisesforamfeitasno MEGA6.15
valoresdociclo delimiar (Ct)doPCR em temporealdas 26amostraspositivasvarioude14a37ciclos.
Paraentenderseasdiferenc¸asentreostestesestavam relacionadasaumgenótipoespecífico(VSRAouVSRB)ou aumavariabilidadegenéticanaproteínaFdovírus,a pro-teínaGdetodasas26amostrascomresultadosdivergentes foram sequenciadas e tivemos 22 consensos para análise posterior.Depoisdosequenciamento,osresultados mostra-ramquetodasas12sequênciasVSRAsãodogenótiponovo ON1etodasas10sequênciasVSRBsãodosgenótiposnovos BA11(3)eBA9(7)(fig.2).
Para verificar se a negatividade no TRDA de amostras positivas com alta carga viral estava associada a uma mutac¸ão específica na fusão (F) da proteína de VSR, os
primeiros1200nucleotídeosdogenedas 26amostrascom resultadosdivergentesforamsequenciadosenãorevelaram umamutac¸ãoespecíficaquepoderiaserassociadaà negati-vidadedasamostrasnoTRDA(dadosnãoapresentados).
Análiseestatística
A feitura do QuickVue® RSV Test em comparac¸ão com o
A análise dos resultados discordantes e concordantes entre as metodologias não mostrou relevância (p=0,62, p=0,065noqui-quadrado,respectivamente).
Discussão
Oobjetivodesteestudofoiprovarqueotesterápidoé efi-cienteparadetecc¸ãodeVSReincentivarseuusonoBrasil, jáqueéatualmentefeitoparadengue,gripeeHIV.
Amarcaregistradadainfecc¸ãoporVSRéabronquiolite,21
eseudiagnósticonormalmenteéfeitopeloquadroclínico.22
Embora não recomendada, a prescric¸ão de antibióticos para bronquiolite é uma prática extremamente comum em crianc¸as internadas9,23 e seu uso está associado a
um aumento no custo e tempo de internac¸ão24 e a um
aumentodoriscodedesenvolvimentodecepasbacterianas resistentes.25 Em casosgraves, principalmente nas
unida-desdeterapiaintensiva,antibióticossãocomumenteusados paraevitar umapossível infecc¸ãobacteriana, apesardeo risco em neonatos saudáveisser incomum.26 Uma análise
sistemáticadequatroestudosqueenvolveramcrianc¸asna emergênciasugeriuquetestesdediagnósticopodemreduzir aprescric¸ãodeantibióticos,24 conformeverificado emum
estudocomneonatoscommenosde1anointernadoscom bronquiolitepositivosparaVSRpeloIFI,quedescreveuuma reduc¸ãosignificativanousodeantibióticos.27 Casooteste
diagnósticosejapositivo,elepodecontribuirparaevitaro usodeantibióticos.Emcasosduvidosos,emboranãograves, opacientedeveficaremobservac¸ão.
Comooresultadoqueusaumtesterápidoestá disponí-velem15minutoseéfeitopelomédicosemanecessidade deequipamentos laboratoriais, oteste rápido seriausado paraesseexame,comoumpontodecuidado.
Nessecontexto,nossotrabalhomostrouqueoQuickVue® RSVTestéconfiávelparaessatarefa,comopodeservisto pelos resultados do desempenho em comparac¸ão com os ensaios de imunofluorescência indireta (IFI) usados como padrãoouronesteestudo.Todososparâmetrosanalisados eramaltos(acimade90%−Sensibilidadede90%, especifici-dadede98,8%,VPPde99,3%eVPNde94,6%)esemelhantes aosdeoutrosestudosquecompararamoTRDAcomIFIcomo padrão ouro, que variou de 73 a 93% de sensibilidade e 84a100%deespecificidade.28 Emcontrapartida,Leonardi
etal.,29 avaliaram quatroensaios diretosde detecc¸ão de
antígenoVSReseusresultadosapresentaramapenas57,5% de sensibilidade para QuickVue®, embora essa diferenc¸a possaserdevidaàcomparac¸ãocomRT-qPCR,quetemuma sensibilidadeeespecificidademaioresdoqueoIFI.
Além disso, a concordância geral (índice kappa) e a acurácia entre os dois testes foram consideradas boas e a concordânciapercentual negativa e positiva(173/202 e 284/313, respectivamente) não apresentou diferenc¸a sig-nificativa (p>0,05). Somente 33 amostras apresentaram resultadosdivergentesentreostestes,foramanalisadaspor RT-qPCRparaconfirmarosresultadosecorrelacionara sen-sibilidade do testecom baixa carga viral,como visto em Tuttleetal.30Vinteeseisamostrascontinuamnão
resolvi-dasapós essaanálisee tambémnãoconseguimosexplicar asdiferenc¸asdecargaviral,poisociclodelimiardoqPCR variou de14 a 37.Talvez esses resultadosfalso negativos
possamestarrelacionadosaoarmazenamentodeespécimes congeladosantesdesuaanálise.
Depois,paraentenderseessasdiferenc¸asestavam rela-cionadas aum genótipoespecífico (RSVA ouRSVB) oua umavariabilidade genética na proteína F dovírus, foram sequenciadososgenesGeF.AanálisedassequênciasdeG mostrouqueelaspertenciamaosgenótiposON1eBAcomo inserc¸ão(variantesBA11eBA9).Contudo,outrasamostras deste estudo que apresentaram resultados positivos pelo QuickVue® RSV Test foram sequenciadas(dados não apre-sentados)e pertenciam aos mesmos genótipos, provaram queanegatividadenãoestárelacionadaaessesgenótipos. Nãoidentificamosmutac¸ãonogeneFquepoderiaser res-ponsávelpelosresultados.Nossaabordagemfinalbuscoua inibic¸ão causada pelos elementos químicos nas amostras, porém osespécimes falso negativosforam diluídos(1:5 e 1:10)econtinuaramnegativos.
Concluindo, oQuickVue® RSVTest Kit (QuidelCorp.CA, EUA) apresentou altos valores preditivos e razões de verossimilhanc¸aeprovousereficaznadetecc¸ãoprecocedo vírussincicialrespiratório.Contudo,adependerda melho-riadopaciente, recomendamosque oteste sejarepetido emcaso denegatividade.Portanto,nossoestudo demons-trouque o QuickVue® RSV Test Kit (Quidel Corp.CA,EUA) podesereficaznadetecc¸ãoprecocedovírussincicial respi-ratórioemespécimescongeladosdeaspiradodanasofaringe eéadequadoparausocomoferramentadediagnósticoem crianc¸as.
Financiamento
UniversidadedeSãoPaulo(USP).
Conflitos
de
interesse
Osautoresdeclaramnãohaverconflitosdeinteresse.
Agradecimentos
ÀQuidelCorp.pordoaroskitsdotesterápidodedetecc¸ão deantígenos,essenciaisparaodesenvolvimentodeste tra-balho.AGustavoRezendeMelopelaanáliseestatísticaeao Sr.JoséMariaLopespeloapoiotécnico.
Referências
1.Domachowske JB, Rosenberg HF. Respiratory syncytial virus infection:immuneresponse,immunopathogenesis,and treat-ment.ClinMicrobiolRev.1999;12:298---309.
2.MohapatraSS,BoyapalleS.Epidemiologic,experimental,and clinicallinksbetweenrespiratorysyncytialvirusinfectionand asthma.ClinMicrobiolRev.2008;21:495---504.
3.GlezenWP,TaberLH,FrankAL,KaselJA.Riskofprimary infec-tionandreinfectionwithrespiratorysyncytialvirus.AmJDis Child.1986;140:543---6.
4.Openshaw PJ. Potential therapeutic implications of new insights into respiratory syncytial virus disease. Respir Res. 2002;3:S15---20.
admit-ted in Santa Casade São Paulo Hospital. Braz J Infect Dis. 2008;12:476---9.
6.Ferreira Junior OC, Ferreira C, Riedel M, Widolin MR, Barbosa-JúniorA, HIV Rapid TestStudyGroup. Evaluationof rapidtestsforanti-HIVdetectioninBrazil.Aids.2005;19:S70---5. 7.LimaMdaR,NogueiraRM,SchatzmayrHG,dosSantosFB. Com-parison ofthree commerciallyavailable dengue NS1antigen captureassaysforacutediagnosisofdengueinBrazil.PLoSNegl TropDis.2010;4:e738.
8.RayCG,MinnichLL.Efficiencyofimmunofluorescenceforrapid detection of common respiratory viruses. J Clin Microbiol. 1987;25:355---7.
9.American Academy of PediatricsSubcommittee on Diagnosis and ManagementofBronchiolitis.Diagnosisand management ofbronchiolitis.Pediatrics.2006;118:1774---93.
10.Zheng H, PeretTC, RandolphVB, Crowley JC, Anderson LJ. Strain-specificreversetranscriptasePCRassay:meansto dis-tinguishcandidatevaccinefromwild-typestrainsofrespiratory syncytialvirus.JClinMicrobiol.1996;34:334---7.
11.LimaHN,BotossoVF,OliveiraDB,CamposAC,LealAL,SilvaTS, et al. Molecularepidemiology oftheSH(small hydrophobic) geneofhumanrespiratorysyncytialvirus(HRSV),over2 conse-cutiveyears.VirusRes.2012;163:82---6.
12.Trento A, Ábrego L, Rodriguez-Fernandez R, González-SánchezMI,González-MartínezF,DelfraroA,etal.Conservation ofg-proteinepitopesinrespiratorysyncytialvirus(groupA) des-pitebroadgeneticdiversity:isantibodyselectioninvolvedin virusevolution?JVirol.2015;89:7776---85.
13.Peret TC, Hall CB, Hammond GW, Piedra PA, Storch GA, SullenderWM, et al. Circulation patterns of group A and B humanrespiratorysyncytialvirusgenotypesin5communities inNorthAmerica.JInfectDis.2000;181:1891---6.
14.PeretTC,HallCB,SchnabelKC,GolubJA,AndersonLJ. Circu-lationpatternsofgeneticallydistinctgroupAandBstrainsof humanrespiratorysyncytialvirusinacommunity.JGenVirol. 1998;79:2221---9.
15.TamuraK,StecherG,PetersonD,FilipskiA,KumarS.MEGA6: molecularevolutionarygeneticsanalysisversion6.0.MolBiol Evol.2013;30:2725---9.
16.NeiM,KumarS.Molecularevolutionandphylogenetics.New York,USA:OxfordUniversityPress;2000.
17.HasegawaM,KishinoH,YanoT.Datingofthehuman-ape split-tingbya molecular clockofmitochondrial DNA. JMol Evol. 1985;22:160---74.
18.MacKinnon DP, Krull JL, Lockwood CM. Equivalence of the mediation, confounding and suppression effect. Prev Sci. 2000;1:173---81.
19.AltmanDG,BlandJM.Quartiles,quintiles,centiles,andother quantiles.BMJ.1994;309:996.
20.LandisJR,KochGG.Themeasurementofobserveragreement forcategoricaldata.Biometrics.1977;33:159---74.
21.ShayDK,HolmanRC,NewmanRD,LiuLL,StoutJW,Anderson LJ.Bronchiolitis-associatedhospitalizationsamongUSchildren, 1980---1996.JAMA.1999;282:1440---6.
22.ZorcJJ,HallCB.Bronchiolitis:recentevidenceondiagnosisand management.Pediatrics.2010;125:342---9.
23.ChristakisDA,CowanCA,GarrisonMM,MolteniR,MarcuseE, ZerrDM.Variationininpatientdiagnostictestingand manage-mentofbronchiolitis.Pediatrics.2005;115:878---84.
24.DoanQ,EnarsonP,KissoonN,KlassenTP,JohnsonDW.Rapid viraldiagnosisfor acutefebrilerespiratoryillnessinchildren in theEmergency Department. Cochrane Database Syst Rev. 2012;5:CD006452.
25.Wang EE, Einarson TR, Kellner JD, Conly JM. Antibiotic prescribingforCanadianpreschoolchildren:evidenceof over-prescribing for viral respiratory infections. Clin Infect Dis. 1999;29:155---60.
26.RandolphAG,RederL,EnglundJA.Riskofbacterialinfection inpreviouslyhealthyrespiratorysyncytialvirus-infectedyoung childrenadmittedtotheintensivecareunit.PediatrInfectDis J.2004;23:990---4.
27.FerronatoÂE,GilioAE,FerraroAA,PaulisMD,VieiraSE. Etio-logicaldiagnosisreducestheuseofantibioticsininfantswith bronchiolitis.Clinics(SaoPaulo).2012;67:1001---6.
28.ChartrandC,TremblayN,RenaudC,PapenburgJ.Diagnostic accuracyofrapidantigendetectiontestsforrespiratory syncy-tialvirusinfection:systematicreviewandmeta-analysis.JClin Microbiol.2015;53:3738---49.
29.LeonardiGP,WilsonAM,DauzM,ZurettiAR.Evaluationof res-piratorysyncytialvirus (RSV)directantigendetection assays for use in point-of-care testing. J Virol Methods. 2015;213: 131---4.