M
ARIA
L
UÍSA
L
OBO
F
ERREIRA DA
C
OSTA
(Bolseira de Doutoramento pela Fundação para a Ciência e a Tecnologia,
Aluna de Doutoramento pelo Instituto de Higiene e Medicina Tropical, da Universidade Nova de Lisboa)
E
PIDEMIOLOGIA E
C
ARACTERIZAÇÃO DE
E
SPÉCIES
I
MPLICADAS NA
M
ICROSPORIDIOSE
H
UMANA EM
P
ORTUGAL POR
A
NÁLISE
P
ARASITOLÓGICA E
M
OLECULAR
L
ISBOA“Posso ter defeitos, viver ansioso e ficar irritado algumas vezes mas não esqueço de que minha vida é a maior empresa do mundo, e posso evitar que ela vá à falência. Ser feliz é reconhecer que vale a pena viver apesar de todos os desafios, incompreensões e períodos de crise. Ser feliz é deixar de ser vítima dos problemas e se tornar um autor da própria história. É atravessar desertos fora de si, mas ser capaz de encontrar um oásis no recôndito da sua alma. É agradecer a Deus a cada manhã pelo milagre da vida. Ser feliz é não ter medo dos próprios sentimentos. É saber falar de si mesmo. É ter coragem para ouvir um "não". É ter segurança para receber uma crítica, mesmo que injusta. Pedras no caminho? Guardo todas, um dia vou construir um castelo…”
Fernando Pessoa
iii
Dissertação de candidatura ao grau de Doutor em Ciências Biomédicas, especialidade de Parasitologia, pela Universidade Nova de Lisboa, Instituto de Higiene e Medicina Tropical.
v
A presente dissertação foi realizada sob a orientação da Professora Doutora Olga Maria Guerreiro de Matos, na Unidade de Protozoários Oportunistas/VIH e Outras Protozooses, do Instituto de Higiene e Medicina Tropical, da Universidade Nova de Lisboa, e na “Division of Parasitic Diseases” do “Centers for Disease Control and Prevention”, EUA. A doutoranda usufruiu de uma Bolsa de Doutoramento da Fundação para a Ciência e a Tecnologia e Fundo Social Europeu no âmbito do Quadro Comunitário de Apoio (referência SFRH/BD/34674/2007).
vii
Aos meus pais,
cujos corações guardo para sempre, junto ao meu.
Adriano e Adília
ix
Agradecimentos
À Professora Doutora Olga Matos, que amavelmente aceitou orientar o presente trabalho, expresso não só a minha gratidão pela maneira como desde o início apoiou e incentivou a minha formação e valorização profissional e a todas as oportunidades que me proporcionou, mas também pela sua compreensão e amizade ao longo do período complicado que atravesso nos últimos anos.
Ao Professor Doutor Francisco Antunes, agradeço a amabilidade de ter acedido fazer parte da comissão tutorial deste trabalho de doutoramento, mas principalmente agradeço todos os valiosos ensinamentos, profissionais ou de vida em geral, sempre com a boa disposição que o caracteriza, assim como a confiança que tem em mim depositado e todo o apoio e oportunidades que me concedeu.
Ao Doutor Lihua Xiao, agradeço a extraordinária oportunidade de me ter recebido no seu laboratório, em Atlanta, os ensinamentos, a pronta disponibilidade e a preciosa ajuda que me concedeu, durante o decorrer deste trabalho.
Ao Professor Doutor Jorge Gaspar, agradeço a amabilidade de ter acedido fazer parte da comissão tutorial deste trabalho de doutoramento, e de toda a disponibilidade e apoio que sempre demonstrou ao ser solicitado, acrescentando sempre uma visão humorística às questões científicas.
À Professora Doutora Maria Amélia Grácio, que muito contribuiu para despertar o interesse pela Parasitologia Médica, um obrigado especial pela amabilidade que sempre me votou.
Ao Professor Doutor Virgilio de Rosário, agradeço a consideração e disponibilidade que me concedeu.
Ao Doutor Bruno de Souza, da UEI de Epidemiologia Biostatística pelo tempo e simpatia que amavelmente me disponibilizou para esclarecer as minhas dúvidas no tratamento estatístico dos dados obtidos neste estudo.
A todos os colegas que passaram pela Unidade de Protozoários Oportunistas/VIH e Outras Protozooses, que partilharam comigo alegrias e tristezas, que aturaram o meu mau humor pela manhã, em especial ao residente e amigo Engenheiro Francisco Esteves, e às minhas amigas Margarida Alves e Marina Costa agradeço todo o apoio, carinho e amizade. Ao Dr. António Amorim, e à Dr.ª Vera
x
Codices o meu reconhecimento pela ajuda, e pela amizade e votos de um óptimo trabalho de doutoramento.
Aos meus familiares que tenho vindo a “negligenciar”, em especial à Ana, à Tia Carmo e ao Luís, agradeço todo o carinho e apoio moral que me têm dado durante este longo período.
A todos os que, de algum modo, contribuíram para a minha chegada ao fim desta etapa e que, por falha não intencional, não foram aqui mencionados, o meu sincero agradecimento.
xi
Publicações
A partir do conjunto de resultados, obtidos no decurso do presente projecto de doutoramento, foram publicados os seguintes trabalhos, em revistas de circulação internacional com arbitragem científica:
LOBO ML,TELES A, BARÃO DA CUNHA M,HENRIQUES J,LOURENÇO AM,ANTUNES F,
MATOS O. Microsporidia detection in stools from pets and animals from the Zoo.
Journal of Eukariotic Microbiology, 2003 , vol 50, suppl,:581-582
SULAIMAN IM, MATOS O, LOBO ML, XIAO L. Identification of a new microsporidian
parasite related to Vittaforma corneae in humans in Portugal. Journal of Eukariotic
Microbiology, 2003, vol 50, suppl.:586-590
MATOS O, LOBO ML,TELES A, ANTUNES F. Is Microsporidial infection in animals a
potencial source for human microsporidiosis?. Southeast Asian Journal of Tropical
Medicine and Public Health ,2004, 35 (Suppl 1): 48-53
LOBO ML,XIAO L, CAMA V, MAGALHÃES N,ANTUNES F, MATOS O. Identification of
potentially human-pathogenic Enterocytozoon bieneusi genotypes in various birds. Appl
Environ Microbiol. 2006 Nov; 72(11):7380-2.
LOBO ML, XIAO L, CAMA V, STEVENS T, ANTUNES F, MATOS O. Genotypes of
Enterocytozoon bieneusi in Mammals in Portugal. J Eukaryot Microbiol. 2006 Nov; 53
Suppl 1:S61-4.
LOBO ML,SILVEIRA H, RAMOS S,XIAO L, MATOS O. Characterization of a Pathogen
Related to Vavraia culicis Detected in a Laboratory Colony of Anopheles stephensi. J
xii
MagalhãesN, Lobo ML, Antunes, F, Matos, O. Aves e cães como potencial fonte de infecção zoonótica por microsporídeos para o homem. Revista Portuguesa de Ciências
Veterinárias. 2006; 101 (557-558): 69-75.
A partir dos resultados desta dissertação, foram apresentados trabalhos em reuniões científicas, cujos resumos foram publicados em livros de resumos ou em revistas nacionais, ou internacionais, com comité de leitura:
LOBO ML,TELES A, MATOS O, BARÃO DA CUNHA M,HENRIQUES J, LOURENÇO AM,
ANTUNES F. Infecção por Microsporidia em animais em Portugal.[Abstract CO37] Acta
Parasitológica Portuguesa, 2003; 10(1): 68-69
MATOS O, LOBO ML,TELES A, ANTUNES F. Is Microsporidial infection in animals a
potencial source for human microsporidiosis?. [Abstract] 4th Seminar on Food and Water-borne Parasitic Zoonoses. 2nd International Meeting on Gnathostomiasis. Joint International Tropical Medicine Meeting 2003, 221
MATOS O, LOBO ML, XIAO L, MAGALHÃES N, TELES A, ANTUNES F. Human and
animal microsporidiosis, in Portugal. NATO Advanced Research Workshop “Emergent Pathogens in the 21st Century: First United Workshop on Microsporidia from Invertebrate and Vertebrate Hosts”. Folia Parasitologica, 2005, 52(1/2): S7A
LOBO ML, MAGALHÃES N, HENRIQUES J, ANTUNES F, MATOS O. Animais de
companhia como potenciais fontes de infecção zoonótica por microsporídeos para o homem [resumo CO - 16]. Acta Parasitológica Portuguesa, 2005, 12 (1-2): 47-48.
LOBO ML,XIAO L,CAMA V,ANTUNES F,MATOS,O. Frequency of microsporidian spores
among HIV-positive and HIV-negative patients. [resumo 62.044]. International Journal of
Infectious Diseases, 2006, 10 (Suppl 1): S298.
LOBO ML, XIAO L, CAMA V, ANTUNES F, MATOS, O. Genotypes of Enterocytozoon
xiii
Opportunistic Protists (IWOP-9) and International Conference on Anaerobic Protists (ICAP), Lisboa, Portugal, 2006. Livro de resumos: 66-67.
LOBO ML, SILVEIRA H, RAMOS S, XIAO L, MATOS O. Occurrence of Vavraia culicis
related pathogen in a laboratory colony of Anopheles stephensi [PO20]. Nineth International Workshops on Opportunistic Protists (IWOP-9) and International Conference on Anaerobic Protists (ICAP), Lisboa, Portugal, 2006, Livro de resumos: 40.
LOBO ML, XIAO L, CAMA V, STEVENS T, ANTUNES F, MATOS O. Mamíferos como
potenciais fontes de infecção zoonótica por Enterocytozoon bieneusi (Microsporidia) [Abstract CO 14] Acta Parasitológica Portuguesa, 2006; 13 (1-2): 92-93
LOBO ML, XIAO L, CAMA V, STEVENS T, ANTUNES F, MATOS O. Genotypes of
Enterocytozoon bieneusi in Mammals in Portugal [Abstract 138A]. J Eukaryot Microbiol. 2007 Mar-Apr; 54 (2): 47S.
LOBO ML, XIAO L, ANTUNES F, MATOS O. Species and Genetic Diversity of
Microsporidian Parasites among HIV-Positive and HIV-Negative Patients [Abstract P-1885] 47th Interscience Conference on Antimicrobial Agents and Chemotherapy,
Chicago, Illinois, USA., 2007, Livro de resumos: 473.
MATOS O., LOBO ML.,TELES A.&ANTUNES F. Is microsporidial infection in animals a
potential source for human microsporidiosis? In: Proceedings of the workshop on waterborne human microsporidia. Frank W. Schaefer III e H. D. Alan Lindquist (editores). U. S. Environmental Protection Agency, 2007, Cap 3: 57-66.
LOBO ML,XIAO L, ANTUNES F, MATOS O. “Enterocytozoon bieneusi and
Vittaforma-like: Detection and genotyping in HIV-positive and negative patients from Portugal.” [resumo PO54]. X International Workshops on Opportunistic Protists (IWOP-10), Boston, Massachusetts, USA, 2008. Livro de resumos: 84.
xiv
LOBO ML,XIAO L,ANTUNES F,MATOS O. “Occurrence of Cryptosporidium, Giardia,
and Microsporidia in water supplies in Portugal.” [resumo PO28]. X International Workshops on Opportunistic Protists (IWOP-10), Boston, Massachusetts, USA, 2008. Livro de resumos: 49.
LOBO ML XIAO L,ANTUNES F, MATOS O. “Enterocytozoon bieneusi e Vittaforma-like
(Microsporidia): Detecção e genotipagem em doentes seropositivos para VIH e em imunocompetentes, em Portugal.” [resumo OA08] Congresso Nacional de Doenças Infecciosas e Microbiologia Clínica, SIDA e Parasitologia (IX Congresso Nacional de Doenças Infecciosas/Microbiologia Clínica, 7º Congresso Nacional sobre Sida, XII Congresso Português de Parasitologia), Vilamoura, Portugal, 2008. Livro de resumos: 15.
LOBO ML F, XIAO L, WAAP H, GASPAR J, ANTUNES F, MATOS O. MATOS O.
“Ocorrência de Cryptosporidium, Giardia, Microsporidia, e Besnoitia spp. Em água de consumo, em Portugal.” [resumo OA13] Congresso Nacional de Doenças Infecciosas e Microbiologia Clínica, SIDA e Parasitologia (IX Congresso Nacional de Doenças Infecciosas/Microbiologia Clínica, 7º Congresso Nacional sobre Sida, XII Congresso Português de Parasitologia), Vilamoura, Portugal, 2008. Livro de resumos: 18.
MARTINHO, F, LOBO ML, MATOS O. “Aves silvestres como reservatórios de alguns
agentes com potencial zoonótico em Portugal” [resumo PA32] Congresso Nacional de Doenças Infecciosas e Microbiologia Clínica, SIDA e Parasitologia (IX Congresso Nacional de Doenças Infecciosas/Microbiologia Clínica, 7º Congresso Nacional sobre Sida, XII Congresso Português de Parasitologia), Vilamoura, Portugal, 2008. Livro de resumos: 52.
LOBO ML, XIAO L, ANTUNES F, MATOS O. “Microsporidia as Potential Pathogens in
HIV-positive and Immunocompetent Portuguese.” [resumo P-377]. 49th Interscience
Conference on Antimicrobial Agents and Chemotherapy (ICAAC), San Francisco, CA, USA., 2009. Abstract book.
xv
LOBOML,XIAO L.,ANTUNESF.,MATOS O. Human pathogenic microsporidia: detection
and genotyping in HIV-positive and negative patients from Portugal [abstract PO6]. Eleventh International Workshops on Opportunistic Protists (IWOP-11), Hilo, Hawaii, USA, 2010. Abstract book: 26.
xvii
Resumo
Os agentes responsáveis pela microsporidiose e, designados, genericamente, por microsporidia são parasitas intracelulares obrigatórios, ubíquos na natureza. Os microsporidia inicialmente reconhecidos como agentes patogénicos de insectos e peixes, emergiram nas últimas décadas como um importante grupo de microrganismos responsáveis por infecção no Homem, associada à pandemia da sida. Encontram-se descritas na literatura mais de 1200 espécies de microsporidia, mas apenas um número reduzido é considerado infectante para o Homem. Entre os microsporídios mais prevalentes, responsáveis por infecção humana, encontram-se as espécies
Enterocytozoon bieneusi, Encephalitozoon intestinalis, Encephalitozoon hellem e Encephalitozoon cuniculi. Recentemente foi identificada em Portugal, uma nova espécie
patogénica para o Homem - Vittaforma-like, em doentes seropositivos para VIH e em imunocompetentes.
No Homem, os microsporídios causam desde patologia gastrintestinal a infecções disseminadas variando os aspectos patogénicos da doença consoante a espécie envolvida assim como com a resposta imunitária do hospedeiro. Já foram descritos portadores assintomáticos de microsporídios, quer em imunodeficientes quer em imunocompetentes
Actualmente, são ainda escassos os dados epidemiológicos sobre esta parasitose, e poucos os estudos disponíveis sobre os animais identificados como potenciais hospedeiros dos parasitas infectantes para o Homem. Mais recentemente, o contacto com água infectada passou a ser considerado um factor de risco associado à microsporidiose humana.
A recente aplicação de técnicas moleculares ao diagnóstico e caracterização dos microsporidia, permitindo o reconhecimento de diferenças intraespecíficas, tem contribuído para uma melhor compreensão da epidemiologia destes parasitas.
O presente trabalho tem como objectivos: (i) determinar a frequência de infecção de microsporidia patogénicos para o Homem, numa população de seropositivos e seronegativos para VIH, em animais em estreito contacto com humanos e em água de abastecimento público, a fim de identificar, não só os parasitas infectantes para o Homem, como, também, os seus possíveis reservatórios zoonóticos e ambientais; (ii)
xviii
caracterizar geneticamente as espécies e genótipos de microsporidia identificados na população humana, animal e em amostras de água de consumo público; (iii) avaliar a importância dos microsporidia na Saúde Pública Humana em Portugal.
No intuito de dar prossecução ao presente estudo, de modo a cumprir os objectivos propostos, foram adoptadas metodologias de diagnóstico e caracterização genética dos microsporidia, seleccionadas após extensa pesquisa bibliográfica. Todas as amostras foram analisadas simultaneamente pela técnica parasitológica de coloração Gram-Chromotrope e por PCR, com excepção das amostras fecais de animais silváticos de vida livre e da água de consumo público, que atendendo às reduzidas quantidades de amostra disponíveis, só foram estudadas pelas técnicas moleculares.
Para o presente trabalho foi efectuado um estudo retrospectivo e prospectivo, englobando 1989 amostras fecais de 856 doentes (adultos e crianças) seropositivos e seronegativos para VIH. A percentagem de doentes seropositivos para VIH estudados foi de 65,5% (561/856) e seronegativos para VIH foi de 34,5% (295/856). Do total de doentes (586 do sexo masculino e 270 do sexo feminino), 675 eram adultos e 181 crianças. Dos doentes analisados 57,6% apresentavam diarreia e 42,4% não apresentavam quadro diarreico. Nove (3,1%) dos 295 seronegativos para VIH apresentavam outras causas de imunossupressão. Uma frequência de infecção por microsporidia de 12,0% (103/856) foi observada nas fezes da população humana estudada, sendo que 13,9% e 8,5% das amostras fecais pertenciam a seropositivos e a seronegativos para VIH, respectivamente. A percentagem de crianças e adultos positivos para microsporidia foi de 18,8% e 10,2%, respectivamente. Os resultados obtidos permitiram determinar uma associação significativa entre a presença de infecção por microsporidia e os seropositivos para VIH, facto este que não constituiu um dado surpreendente em virtude do carácter oportunista largamente atribuído a esta doença, por outros autores. Foram identificados esporos de microsporídios nas fezes de doentes, que, embora sendo seronegativos para VIH, apresentam outro tipo de deficit imunológico. Através das técnicas de PCR, identificaram-se duas espécies de microsporídios nas amostras fecais dos doentes estudados no presente trabalho. E.
bieneusi foi detectada em 6,3% (54/856) e Vittaforma-like em 6,8% (58/856) dos
doentes estudados. Na análise dos dados obtidos, não se verificou que a infecção por microsporidia, em geral, nem, especificamente, por nenhuma das duas espécies
xix
identificadas nas fezes estivesse, significativamente, associada a doentes com quadro diarreico. A caracterização genética da região ITS rRNA de 48 isolados de E. bieneusi obtidos de humanos, de um total de 54 amplificados por PCR, permitiu identificar seis genótipos diferentes, Tipo IV (37,5%), Peru 6 (29,2%), D (12,5%), A (8,3%), C (6,3%) e PtEbII (6,3%). Até à data os genótipos A e C só foram identificados no Homem. Em contrapartida os genótipos Tipo IV, Peru 6 e genótipo D já foram descritos numa vasta gama de hospedeiros, incluído o Homem e outros animais (inclusive em cães, gatos e ruminantes em Portugal). A caracterização genética dos 58 isolados de Vittaforma-like revelou a presença de dois genótipos diferentes, previamente descritos em humanos: Isolado 5830 (39 amostras) e Isolado 5843 (19 amostras), com frequências de 67,2% e 32,8%, respectivamente.
Para o estudo de microsporidia em amostras de urina, foram recolhidos 69 amostras, retrospectivamente e durante o decurso do trabalho, pertencentes a 69 doentes (59 doentes seropositivos para VIH [85,5%] e 10 doentes seronegativos para VIH [14,5%] sendo 44 adultos (63,8%) e 25 crianças (36,2%). Do total de amostras de urina 48 (69,6%) eram de doentes do sexo masculino e 21 (30,4%) de doentes do sexo feminino. Foram identificados microsporídios em 1,5% (1/69) das amostras de urina, correspondente a um seropositivo para VIH (1,7%). A espécie identificada na urina foi
E. intestinalis e a caracterização da sequência de um fragmento da região SSU rRNA
revelou total homologia com diversas sequências previamente descritas em humanos e outros animais.
Para a identificação e caracterização de microsporídios em secreções pulmonares, foram analisadas 200 amostras, recolhidas retrospectivamente e durante o decorrer do estudo correspondentes a 124 expectorações induzidas (EI) e 76 lavados broncoalveolares (LBA). As amostras pertenciam a 150 doentes seropositivos para VIH (75%) e a 50 seronegativos para VIH (25%), sendo 129 (64,5%) do sexo masculino e 71 (35,5%) do sexo feminino. A percentagem de infecção por microsporidia foi de 1,0% (2/200) em secreções pulmonares da população estudada. Dois seropositivos (1,3%) apresentavam microsporídios, nomeadamente num LBA e numa EI. E. cuniculi e
Vittaforma-like foram identificadas nos referidos espécimes. A caracterização da SSU rRNA para E. cuniculi revelou 99% de homologia genética nesta sequência com outras
xx
Vittaforma-like registou-se homologia genética com o Isolado 5830, previamente
descrito em humanos em Portugal. Ambos os achados constituem os primeiros registos desta espécie em secreções pulmonares no Homem em Portugal.
A detecção e caracterização dos microsporidia em animais, incluiu estudos retrospectivos e prospectivos em amostras fecais de: 66 animais de companhia (oito cães e 58 gatos) e 50 cães errantes albergados em canis; 100 bovinos, provenientes de explorações leiteiras de várias regiões de Portugal; 103 animais cativos no Jardim Zoológico de Lisboa (75 espécies de mamíferos, 9 espécies de répteis e 9 espécies de aves); 134 pequenos mamíferos capturados nos concelhos de Moura e Aljustrel, Baixo Alentejo (52 insectívoros de espécie Crocidura russula e 80 roedores Mus spretus e dois Apodemus sylvaticus); 39 aves exóticas de gaiola de diversas espécies pertencentes às Ordens Psittaciformes e Passeriformes (31 de um criador de aves e oito de agregados familiares) e 52 pombos urbanos (Ordem Columbiformes), da região da grande Lisboa. A maioria dos animais dos diversos grupos estudados não apresentava sintomatologia. Nos diversos grupos de animais estudados foram identificados microsporidia em amostras fecais de 8,6% de cães, 15,5% de gatos 40,7% de aves de gaiola e pombos urbanos, 6,0% de bovinos e 1,9% de animais silváticos em cativeiro (Jardim Zoológico).
E. bieneusi foi identificada nas amostras fecais de cães e gatos analisados, cuja
caracterização das sequências ITS rRNA dos 14 isolados de E. bieneusi, amplificados por PCR, veio revelar a presença de seis genótipos distintos: TipoIV, PtEbIV, Peru6, D, PtEbVIII e PtEbIX. Os genótipos PtEbIV, PtEbVIII e PtEbIX, foram descritos pela primeira vez no decurso deste estudo. Nos cães foram identificados os genótipos D (20%; 1/5), Peru6 (60,0%; 3/5) e PtEbIX (20%;1/5) e nos gatos os genótipos TipoIV (77,8%), PtEbIV (11,1%) e PtEbVIII (11,9%). Verificou-se associação com significância estatística da infecção pelo genótipo Tipo IV ao grupo dos gatos, relativamente aos cães estudados. Também nos bovinos, a espécie E. bieneusi foi identificada nas seis amostras positivas estudadas registando-se três genótipos diferentes (dois dos quais já previamente reportados): TipoIV (50%; 3/6), PtEbXI (33,3%; 2/6) e J (16,7%; 1/6) (AF135837). O genótipo PtEbXI foi caracterizado pela primeira vez no decurso deste estudo. A espécie E. bieneusi foi identificada nas amostras fecais de dois mamíferos do jardim Zoológico: o saguim de face branca (Callithrix geoffroyi) e o
xxi
cavalo de Timor (Tragelaphus strepsiceros strepsiceros) e a genotipagem através da região ITS rRNA dos isolados de E. bieneusi permitiu caracterizar, pela primeira vez, durante o decurso deste trabalho, dois genótipos distintos: PtEbV (cavalo de Timor) e PtEbXII (saguim de face branca). A análise da diversidade genética da região ITS rRNA dos 10 genótipos diferentes de E. bieneusi identificados num total de 22 isolados de cães, gatos, bovinos e animais do Jardim Zoológico (um primata não humano e um bovídeo) estudados permitiu verificar a presença na maioria destes mamíferos (cães, gatos e bovídeos) de genótipos patogénicos para o Homem e de outros genótipos específicos de hospedeiro (cão, gato, bovinos e primata não humano), que, possivelmente, não terão impacte na saúde pública humana. Nos 134 pequenos mamíferos (Crocidura russula, Mus spretus e Apodemus sylvaticus não foi observado nenhum animal com infecção por microsporidia.
As espécies E. bieneusi e E. hellem foram identificadas, em 35,2% (32/91) e 13,2% (12/91), respectivamente, das aves de gaiola e pombos de parques públicos de Lisboa estudadas. Registou-se co-infecção por ambas as espécies. Ambos os microsporidia foram identificados nas três Ordens de aves: Psittaciformes (E. bieneusi- 12,5%; E. hellem- 12,5%); Passeriformes (E. bieneusi- 14,3%; E. hellem- 42,9%) e Columbiformes (E. bieneusi- 51,9%; E. hellem- 6,9%). Contudo, nos pombos (Columbiformes) registou-se uma elevada frequência de infecção por E. bieneusi, estatísticamente significativa, comparativamente à observada nas outras duas Ordens de aves. Para a espécie E. hellem a percentagem mais elevada de infecção nos Passeriformes (42,9%; 3/7), não apresentou significância estatística. A caracterização do
locus ITS rRNA, dos 32 isolados, pertencentes à espécie E. bieneusi, revelou a presença
do genótipo Peru6 descrito pela primeira vez em humanos, no Peru, e foi caracterizado pela primeira vez o genótipo PtEbII muito semelhante ao Peru6, com uma única alteração nucleotídica (G para A) junto da extremidade 3’ do fragmento amplificado por PCR. Em pombos registou-se a presença simultânea dos dois genótipos. Nos 12 isolados de E. hellem identificados nas amostras fecais e/ou conteúdo intestinal e numa raspagem da traqueia da população de aves analisada, e caracterizados com recurso à sequenciação nucleotídica do fragmento do gene da SSU rRNA, verificou-se 99% a 100% de homologia genética das sequências obtidas com sequências do gene da SSU
xxii
regiões alvo, registaram-se três locais polimórficos, que permitem agrupar em três tipos diferentes as 12 sequências dos isolados de E. hellem obtidos neste estudo: PtEhI (genótipo1, previamente descrito); PtEhII (99% homologia genética com genótipo 2) e PtEh III (99%de homologia genética com PtEhII).
No presente trabalho, também com o intuito de determinar a presença de esporos de microsporídios, foram analisadas 184 amostras de água, de locais de amostragem envolvidos no processo conducente ao abastecimento de água da cidade de Lisboa (175 amostras processadas de acordo com o método 1623 da USEPA e purificadas por separação imunomagnética [IMS] para os géneros Cryptosporidim spp. e Giardia e nove sem IMS). Cento e seis eram amostras de água tratada (42 captações subterrâneas, 25 captações superficiais, 39 de água de abastecimento), provenientes de três Estações de Tratamento e reservatórios de água de abastecimento da cidade de Lisboa, e 69 eram amostras de águas não tratadas, obtidas em captações superficiais (30 amostras) e na captação subterrânea (30 amostras com IMS e nove sem IMS). As espécies E. bieneusi e
Vittaforma-like foram identificadas em água de abastecimento da cidade de Lisboa,
tanto na água de origem superficial como subterrânea. A genotipagem de Vittaforma-like revelou a presença de um genótipo Isolado 5830, descrito em humanos, em Portugal. Também o genótipo Tipo IV de E. bieneusi, potencialmente infectante para o homem e outros animais, foi identificado em água tratada com origem subterrânea.
Em conclusão, o presente trabalho permitiu demonstrar a presença de espécies e/ou genótipos de microsporidia patogénicos para o Homem em seropositivos e seronegativos para VIH, em animais e em águas de consumo público, em Portugal. Também na nossa população humana, tal como descrito na literatura, a infecção por estes parasitas, , parece afectar os grupos mais susceptíveis, como os doentes com imunossupressão, crianças e idosos. Por outro lado, a identificação dos mesmos genótipos de microsporidia, com destaque para os genótipos de E. bieneusi, em humanos e animais, sugere a ocorrência de transmissão zoonótica através de animais em estreito contacto com o Homem. Dos resultados obtidos verificou-se que, quer para os humanos, quer para os animais não foi observada associação directa entre a infecção por microsporidia e a presença de sintomatologia, nomeadamente de diarreia, sugerindo a existência, em ambos os grupos populacionais estudados, de portadores crónicos assintomáticos e salientando a sua importância no ciclo de transmissão destes parasitas.
xxiii
Em suma a análise dos dados deste estudo sugere um papel relevante a nível da Saúde Pública, para os microsporidia circulantes, entre a população portuguesa, evidenciando a necessidade de implementar a pesquisa de microsporídios no diagnóstico de rotina, com recurso a métodos de referência bem definidos e adequados à sua utilização nos laboratórios de rotina. A metodológica adoptada neste estudo, nomeadamente as técnicas de PCR e sequenciação de DNA, traduziu-se numa abordagem eficaz para atingir os objectivos propostos.
Esperamos que os resultados obtidos neste estudo, contribuam para clarificar a epidemiologia da microsporidiose em Portugal, mais precisamente, os processos envolvidos na circulação e transmissão destes microrganismos oportunistas à população susceptível
xxv
Abstract
Microsporidia are small eukaryotic, obligate intracellular parasites with a widespread occurrence in animals. There are over 1200 species of microsporidia, but only a few have been identified as cause of human diseases. Before onset of the AIDS pandemic, microsporidia infections had only been described in few cases, but by the expansion of the pandemic, microsporidia came increasingly under attention.
The most frequent human infecting microsporidia species are Enterocytozoon
bieneusi, Encephalitozoon intestinalis, Encephalitozoon hellem and Encephalitozoon. cuniculi. Recently it has been identified in Portugal, a new species pathogenic to
humans - Vittaforma-like, in HIV-positive patients and in immunocompetent persons. These emerging opportunistic organisms have now become important pathogens that can cause a broad spectrum of intestinal and disseminated pathologies depending on the infectious species involved and also on the immune status of the host. Microsporidia asymptomatic carriage was already described among both imunossupressed and immunocompetent population.
The epidemiology of human microsporidia infections is still unclear in many aspects. Routes of transmission and sources of human microsporidia infections have been difficult to ascertain. However, the four most common human microsporidian species have been reported in a wide range of domestic and wild animals. Thus, it has been debated for some time now whether animals could be a source of infection of microsporidiosis to humans. More recently, a risk factor consistently associated with human microsporidiosis in epidemiological studies is the contact with water.
The use of molecular methods has provided new tools to detect and characterize microsporidia, and the finding of previously unrecognized intraspecific genetic differences has improved our understanding of the epidemiology and zoonotic transmission of microsporidia.
This study intended to: (i) confirm the occurrence and determine the frequency of infection of human patogenic microsporidia in HIV-positive and negative patients, in several animals species with close contact with humans (pet dogs, cats and birds, bovines, captive animals from the zoo and pigeons from public parks) and in environmental samples (water), in order to identify, not only the microsporidian species
xxvi
enrolled in Portuguese human infection, but also to determine potential animal reservoirs and environmental sources of infection; (ii) to characterize the parasites found at the genotype level; (iii) to evaluate the public health significance of microsporidia in Portugal.
The frequency of microsporidia, genetic diversity, distribution of genotypes and the relationship between observed genotypes and different parameters of infection among humans, animals and environmental samples enrolled in the study were investigated using SSU rRNA and ITS-based PCR, followed by DNA sequencing.
In order to achieve the objectives proposed in this study were adopted methodologies for diagnosis and genetic characterization of microsporidia, selected after an extensive literature search. All samples were analyzed by both the parasitological Gram-Chromotrope staining and PCR-techniques, with the exception of fecal samples from free-living animals and water for public consumption. Water samples due to the small amount of samples available, have only been studied by molecular techniques..
For the present work it was carried out a retrospective and prospective study, comprising 1989 fecal samples from 856 patients (adults and children), HIV-positive and negative. The percentage of HIV-positive and negative patients studied was 65.5% (561/856) and 34.5% (295/856), respectively. Of all patients (586 males and 270 females), 675 were adults and 181 children. Of the patients studied 57.6% had diarrhea and 42.4% had no diarrhea. Nine (3.1%) of the 295 HIV-negative had other causes of immunosuppression. A frequency of infection with microsporidia of 12.0% (103/856) was observed in the feces of human population studied; being 13.9% and 8.5% of the fecal samples from HIV-positive and HIV-negative patients, respectively. Percentages of 18.8% and 10.2% of positive children and adults, respectively were observed. The results obtained indicated a significant association between the presence of microsporidia infection and HIV-positive patients. This data was not a surprising fact due to the opportunistic nature attributed to this disease. Microsporidia infection was identified in the feces of patients, which, although HIV-negative, have another type of immunedeficiency. Overall, the infection with microsporidia was significantly associated with patients with diarrhea. E. bieneusi was identified in 6.3% (54/856) and
xxvii
characterization of the ITS rRNA region was performed on 48 isolates of E. bieneusi obtained from humans, from a total of 54 amplified by PCR. Six different genotypes were identified, Type IV (37.5%), Peru 6 (29.2%), D (12.5%), A (8.3 %), C (6.3%) and PtEbII (6.3%). So far, the genotypes A and C were identified only in humans. In contrast, Type IV, Peru 6 and D genotypes have been described in a wide range of hosts, including humans and other animals (including dogs, cats and ruminants in Portugal). A total of 58 isolates of Vittaforma-like were characterized genetically revealing the presence of two different genotypes, previously described in humans: Isolated 5830 (39 samples) and isolate 5843 (19 samples), with frequencies of 67.2% and 32.8 %, respectively.
Urine samples both collected retrospectively and during the course of the study were obtained from 69 patients corresponding to 59 (85.5%) HIV-positive patients and 10 (14.5%) HIV-negative patients. Of the total sample, 48 (69.6%) were males and 21 (30.4%) females and 44 (63,8%) were adults and 25 (36,2%) children. Microsporidia were identified in 1.5% (1/69) of the urine samples, corresponding to one HIV-positive patient (1.7%; 1/59). The species identified in the urine was E. intestinalis, and characterization of the sequence of a fragment of the SSU rRNA showed total homology with several sequences previously described in humans and other animals.
For the identification and characterization of microsporidia were analyzed 200 pulmonary secretions, collected retrospectively and during the course of the study, corresponding to 124 induced sputa (IS) and 76 bronchoalveolar lavage (BAL) fluids. The samples were collected from 150 (75%) HIV-positive patients and from 50 (25%) HIV-negative patients. The proportion of men and women corresponding to the samples studied was 64.5% and 35.5% respectively. The percentage of microsporidia infection was 1.0% in pulmonary secretions of the population studied. Two HIV-positive patients (1.3%) had microsporidia in a BAL and an EI. E. cuniculi and Vittaforma-like were identified in these specimens. Characterization of SSU rRNA for E. cuniculi revealed 99% homology in this gene sequence with other sequences previously described in humans for E. cuniculi, and for the species Vittaforma-like there was genetic homology with the isolate 5830 that was previously described in humans in Portugal. Both findings are the first records of this species in pulmonary secretions in humans in Portugal.
xxviii
The detection and characterization of microsporidia in animals, included retrospective and prospective studies in fecal samples: 66 companion animals (eight dogs and 58 cats) and 50 stray dogs housed in kennels, 100 cattle from dairy farms in various regions of Portugal, 103 captive animals in Lisbon Zoo (75 species of mammals, nine species of reptiles and nine9 species of birds), 134 small mammals captured in the municipalities of Aljustrel and Moura and Baixo Alentejo (52 insectivores Crocidura Russula and rodents 80 Mus spretus and two Apodemus
sylvaticus) and 39 exotic birds cage of several different species belonging to the orders
Psittaciformes and Passeriformes (31 from a poultry farmer and eight pets) and 52 urban pigeons (order Columbiformes), from the Lisbon area. Most animals in each group did not display symptoms. In the several groups of animals studied microsporidia were identified in fecal samples from dogs (8.6%), cats (15.5%), caged birds and pigeons (40.7%), bovine (6.0%) and silvatic animals (zoo)(1.9%). E. bieneusi was identified in fecal samples from cats and dogs. The characterization of the ITS rRNA sequences of 14 isolates of E. bieneusi, has revealed the presence of six different genotypes: TypeIV, PtEbIV, Peru6, D, and PtEbVIII PtEbIX. Genotypes PtEbIV, PtEbVIII and PtEbIX were first described during this study. Genotypes D (20%, 1/5), Peru6 (60.0%, 3/5) and PtEbIX (20%, 1/5) were identified in dogs, and TypeIV (77.8%), PtEbIV (11.1%) and PtEbVIII (11.9%) were identified in cats. There was a statistically significant association of infection with genotype Type IV to the group of cats. In cattle, E.
bieneusi was identified in the six positive samples. The genetic characterization
revealed three different genotypes (including two previously reported): TypeIV (50%, 3/6), PtEbXI (33.3%, 2/6) and J (16.7% 1/6). Genotype PtEbXI was characterized for the first time during this study. The species E. bieneusi was identified in feces of two mammals from the zoo: the white-fronted marmoset (Callithrix geoffroyi) and horse Timor (Tragelaphus strepsiceros strepsiceros). ITS rRNA genotyping of the two E.
bieneusi isolates allowed characterizing for the first time during the course of this work,
two distinct genotypes: PtEbV (horse Timor) and PtEbXII (white-fronted marmoset). Analysis of genetic diversity of the ITS rRNA of 10 different genotypes of E. bieneusi identified in 22 isolates from dogs, cats, cattle and animals from the zoo (a non-human primate and bovid) demonstrated the presence in most of these mammals (dogs, cats and cattle), of genotypes pathogenic to humans and other host specific genotypes (dog,
xxix
cat, cattle, and nonhuman primate), which possibly have no impact on human health. In the fecal samples of the 134 small mammals (Crocidura Russula, Mus spretus and
Apodemus sylvaticus) studied no microsporidian spores were detected.
The species E. bieneusi and E. hellem were identified in 35.2% (32/91) and 13.2% (12/91), respectively, of caged birds and pigeons from public parks in Lisbon studied. Co-infection by both microsporidia species were observed in avian samples. Both microsporidia were identified in three orders of birds studied: Psittaciformes (E.
bieneusi-12.5%; E. hellem-12.5%), Passeriformes (E. bieneusi-14.3%; E. hellem-42,
9%) and Columbiformes (E. bieneusi-51.9%; E. hellem-6.9%). However, in pigeons (Columbiformes) there was a high frequency of infection by E. bieneusi, statistically significant compared to that observed in the other two orders of birds. For E. hellem the highest percentage of infection in the Passeriformes (42.9%; 3/7) was not statistically significant. The characterization of the ITS rRNA locus of the 32 isolates belonging to the species E. bieneusi, revealed the presence of genotype Peru6 first described in humans in Peru, and it has been characterized for the first time PtEbII genotype, very similar to Peru6, with a single nucleotide change (G to A) near the 3 'end of the fragment amplified by PCR. The simultaneous presence of the two genotypes was observed in two pigeons. The genetic sequences obtained from the 12 isolates of E.
hellem identified in fecal samples and/or intestinal contents and a scraping of the
trachea of the bird population, analyzed and characterized using the nucleotide sequencing of the gene fragment of SSU rRNA, showed 99% to 100% homology with sequences of the SSU rRNA gene, previously reported in humans and birds (genotypes 1 and 2). Within the target regions, there were three polymorphic sites, which allow to group the 12 isolates of E. hellem from this study into three different sequences: PtEhI (genotype1 previously described); PtEh II (99% genetic homology with genotype 2) and PtEh III (99% of genetic homology with PtEhII).
In the present study 184 water samples were analyzed. These water samples corresponded to sampling sites involved in the process leading to the water supply of Lisbon (175 samples processed according to the USEPA 1623 method and purified by immunomagnetic separation [IMS] and nine without IMS): 106 treated water samples collected at water treatment plants (25 surface and 42 groundwater source and 39 finished water samples from six main entrance points to the city of Lisbon water
xxx
supply), as well as 69 raw water samples, obtained in the surface (30 samples) and groundwater source (30 and nine samples with IMS and without IMS treatment, respectively). The species E. bieneusi and Vittaforma-like were identified in water supply of the city, both on the surface and groundwater sources. Genotyping of
Vittaforma-like revealed the presence of a genotype (Isolate 5830), described in humans
in Portugal. The Type IV E. bieneusi genotype, potentially pathogenic for man and other animals, was detected in treated water from groundwater source.
In conclusion, this study confirmed the presence of species or genotypes of microsporidia pathogenic to humans in HIV-positive and negative patients, in animals and in water for public consumption in Portugal. Microsporidia infection, as described in the literature in this study, also appears to affect the most susceptible population, such as patients with immunosuppression, children and the elderly. The identification of human infecting microsporidia genotypes, both in humans and animals, in what concerns the species E. bieneusi suggests zoonotic transmission from animals in close contact with humans. It was not observed a direct association between infection with microsporidia and the presence of symptoms, including diarrhea (for both humans and animals), suggesting the existence in both populations of asymptomatic chronic carriers, and emphasizing their importance in the transmission cycle of these parasites.
In summary, the analysis of data from this study suggests an important role at Public Health for the microsporidia circulating among the Portuguese population, highlighting the need to implement the diagnosis of microsporidia in routine laboratories, using standard methods well-defined and suitable for use in these laboratories. The methodology adopted in this study, namely the PCR and DNA sequencing techniques, resulted in an effective approach to achieve the proposed objectives. We hope that the results of this study will contribute to clarify the epidemiology of microsporidiosis in Portugal, more precisely, the processes involved in the circulation and transmission of opportunistic microorganisms to susceptible population.
xxxi
Lista de abreviaturas
% – Percentagem
% (m/v) – Percentagem massa/volume
ºC – Grau Celsius
5S rRNA – Sequência pequena do RNA ribossómico da subunidade grande
ribossomal
5.8S rRNA – Sequência pequena do RNA ribossómico da subunidade grande
ribossomal
18S rRNA – Subunidade pequena do RNA ribossómico
26S rRNA – Sequência grande do RNA ribossómico da subunidade grande ribossomal
A, C, G, T – Bases orgânicas constituintes dos nucleótidos (adenina, citosina, guanina e timina)
α TUB – Alfa tubulina
AcM – Anticorpo monoclonal ADP – Adenosina difosfato
ASD – Estudo do espectro do vírus da imunodeficiência humana em adultos e adolescentes, do inglês Adult and Adolescent Spectrum of HIV Disease ATP – Adenosina trifosfato
β TUB – Beta tubulina
BSA – Albumina sérica bovina, do inglês bovine serum albumin
CDC – Centro de controlo e prevenção de doenças dos Estados Unidos da
América, do inglês Centers for Disease Control and Prevention.
CT – Ciclo limite de amplificação, do inglês threshold cycle
DNA – Ácido desoxirribonucleico, do inglês desoxiribonucleic acid dNMP – Desoxirribonucleótido monofosfato
ddNTP – Didesoxirribonucleótido trifosfato dNTP – Desoxirribonucleótido trifosfato
dsDNA – Ácido desoxirribonucleico em cadeia dupla, do inglês double strand
xxxii
EDTA – Ácido etilenodiaminotetracético
EF3 – Factor de elongação 3, do inglês elongation factor 3 EI – Expectoração induzida
ELISA – Teste imunoenzimático especifico, do inglês enzyme-linked immunosorbent assay
E.U.A. – Estados Unidos da América EXO – Exonuclease I
g – Grama
g – Aceleração gravitacional (unidade de força centrífuga relativa)
H+ – Ião hidrogénio
HAART – Terapêutica anti-retrovírica potente, do inglês Highly Active AntiRetroviral Therapy
HCl – Ácido clorídrico IF – Imunofluorescência
IFI – Imunofluorescência indirecta IgG – Imunoglobulina do tipo G IgM – Imunoglobulina do tipo M IL-1β – Interleucina 1 beta
IL-6 – Interleucina 6 IL-8 – Interleucina 8 IFN-γ – Interferão gama
ITS – Espaçadores internos transcritos, do inglês internal transcribed spacers, do operão nuclear do RNA ribossómico
Kb – Quilobases kDa – Quilodaltons
kV – Quilovolt
L – Litro
λ – Lambda
LBA – Lavado broncoalveolar LO – Lavado oral
mg – Miligrama
xxxiii
Mb – Milhões de pares de bases MgCl2 – Cloreto de magnésio
ml – Mililitro
MLG – Genótipo multilocus, do inglês multilocus genotype
mm – Milímetro
mM – Milimolar
mm3 – Milímetro cúbico mmHg – Milímetros de mercúrio
mRNA – Ácido ribonucleico mensageiro, do inglês messenger ribonucleic acid MSG – Glicoproteínas major de superfície, do inglês major surface
glycoproteins
LSU rRNA – Subunidade grande do RNA ribossómico, do inglês mithocondrial large subunit ribossomal RNA
SSU rRNA – Subunidade pequena do RNA ribossómico, do inglês mithocondrial small subunit ribossomal RNA
N – Número
NJ – Método de análise de semelhanças, do ingles Neighbour Joining
ng – Nanograma nm – Nanómetro nmol – Nanomol nt – Nucleótido O2 – Oxigénio molecular OH – Grupo hidroxilo
OMS – Organização Mundial de Saúde
P – Probabilidade
PaO2 – Pressão parcial do oxigénio
pb – Pares de base
PBS – Tampão fosfato salino, do inglês phosphate buffered saline
PCA – Análise de componentes principais, do inglês principal componente
analysis
PCR – Reacção de polimerização em cadeia, do inglês polymerase chain
xxxiv
PFGE – Electroforese em campo pulsado, do inglês pulsed-field gel electrophoresis
RFLP – Análise de fragmentos de restrição, do inglês restriction fragment length polymorphism
RNA – Ácido ribonucleico, do inglês ribonucleic acid
rRNA – Ácido ribonucleico ribossómico, do inglês ribosomal ribonucleic acid RT-PCR – Reacção de polimerização em cadeia em tempo real, do inglês real time polymerase chain reaction
SCID – Imunodeficiência severa combinada, do inglês Severe combined immunodeficiency
Sida – Síndroma de imunodeficiência adquirida
SNP – Polimorfismo de base única, do inglês single nucleotide polymorphim SPSS – Programa informático de análise estatística, do inglês statistical
package for social sciences
SSCP – Análise de polimorfismos por conformação de DNA em cadeia simples, do inglês single strand conformation polymorphysm TA – Temperatura de hibridação, do inglês annealing temperature
TAE – Tampão tris-acetato-EDTA
TATA – Sequência característica da região promotora de genes, constituída por timina e adenina
TBE – Tampão tris-Borato-EDTA
TCD4+ – Linfócitos T com receptores do agrupamento de diferenciação 4, do inglês cluster of differentiation 4
TCD8+ – Linfócitos T com receptores do agrupamento de diferenciação 8, do inglês cluster of differentiation 8
TE – Tampão tris-HCl-EDTA
TLR2 – Receptor do tipo toll 2, do inglês toll-like receptor 2 TNF-α – Factor de necrose tumoral alfa
Tris-HCL – Tris(hidroximetilo)aminometano-ácido clorídrico
tRNA – Ácido ribonucleico de transcrição, do inglês transcription ribonucleic acid
xxxv
UDG – Uracilo-DNA glicosidase
UCS – Região conservada, do inglês upstream conserved region UTR – Região não transcrita, do inglês untranslated region UV – Ultravioleta
V – Volt
VIH – Vírus da imunodeficiência humana
W – Watt
χ2
– Teste do Chi-quadrado μl – Microlitro
xxxvii
Índice geral
Página Agradecimentos ……... ix Publicações …………... xi Resumo ……... xvii Abstract ……... xxv Lista de abreviaturas ……... xxxi Índice geral ……...…... xxxvii Índice de figuras ……... xlv Índice de quadros …... xlviiPRIMEIRA PARTE
(Introdução Geral aos Microsporidia) .………...1 1. Perspectiva histórica …..………..…... 3 2. Classificação taxonómica e biologia dos microsporídios... 7
2.1. Taxonomia ………... 7 2.1.1 A descoberta e visão inicial sobre a evolução dos
microsporídios ………..…..….12 2.1.2 Os Archezoa e primeiros dados moleculares dos
microsporídios ……….….……...…13 2.1.3 Uma ligação aos fungos ……….…..…15 2.2 Morfologia e Ciclo de vida ………....18 2.2.1 Morfologia dos microsporídios ………....18 2.2.2 Ciclo de Vida ……….……..21
3. Espectro clínico e patogenia no Homem ……….……….28
3.1 Infecções por espécies de microsporidia mais frequentes ...28 3.1.1 Infecção por Enterocytozoon bieneusiI ………..……...30 3.1.2 Infecção por Encephalitozoon intestinalis ……….…..….31 3.1.3. Infecção por Encephalitozoon hellemi ……….31 3.2. Infecções por espécies de microsporidia menos frequentes …………...33 3.2.1 Infecção por Anncaliia spp. ………..……….33
xxxviii
3.2.2. Infecção por Microsporidium spp. ………...34 3.2.3. Infecção por Nosema ocularum ………..….34 3.2.4 Infecção por Pleistophora sp. ………...34 3.2.5. Infecção por Trachipleistophora spp. ……….….35 3.2.6. Infecção por Vittaforma corneae ……….35
4. Imunologia ………...37
4.1.Resposta Imunológica ...………...38 4.1.1 Relações parasita-hospedeiro ………....39 4.1.2 Mecanismos de resistência do hospedeiro ……..………..…40 4.1.2.1 Imunidade humoral ………...40 4.1.2.2 Imunidade celular ………..41 4.1.3 Especificidade de hospedeiro ………42 5. 5. Diagnóstico da microsporidiose ………...44 5.1. Diagnóstico presuntivo ………..………...44 5.2. Diagnóstico definitivo ………...44 5.2.1 Microscopia electrónica de transmissão ………...45 5.2.2 Microscopia óptica ……….46 5.2.2.1 Exame histológico ao microscópio óptico ……….…46 5.2.2.2 Diagnóstico citológico e exame de fezes ………...47 5.2.2.2.1 Coloração pelo tricrómio modificado ……….…48 5.2.2.2.2 Coloração pelo Gram – Chromotrope ………...49 5.2.2.2.3 Coloração por fluorocromos ………...49 5.2.3. Técnicas de imunofluorescência indirecta com anticorpos
mono e policlonais ……….50 5.2.4 Testes serológicos ………51 5.2.5 Isolamento em culturas celulares ………...53 5.2.6 Modelos animais ……….….54 5.2.7 Métodos moleculares ………..….55
6. Tratamento da microsporidiose humana …………...67
6.1. Tratamento da infecção intestinal ……. …..………...68 6.2. Tratamento da infecção ocular ...70
7. Controlo e prevenção da microsporidiose ………...71
xxxix
8. Epidemiologia da microsporidiose Diagnóstico ……...73
8.1.Distribuição geográfica e prevalência no Homem .………...73 8.1.1 Distribuição geográfica e prevalência no Homem
da espécie Entrocytozoon bieneusi ………...74 8.1.2 Distribuição geográfica e prevalência no Homem
da espécie Encepalitozoon intestinalis……….78 8.1.3 Distribuição geográfica e prevalência no Homem
da espécie Encephalitozoon cuniculi ……….79 8.1.4 Distribuição geográfica e prevalência no Homem
da espécie Encephalitozoon hellem ………81 8.1.5 Grupos específicos da População humana, em
risco de microsporidiose ……….81 8.2. A microsporidiose noutros animais ………...86 8.2.1. Mamíferos ………..86 8.2.2. Aves ………..….89 8.3. Fontes de Infecção e Modos de transmissão …...91 8.3.1. Transmissão inter-humana (vertical e horizontal) ...91 8.3.2. Transmissão Zoonótica ...93 8.3.3. Transmissão hídrica ………..……...96 8.3.4. Transmissão através de alimentos contaminados ...98 8.3.5. Transmissão aérea ………..99 8.3.6. Transmissão por vectores (insectos) ……….100
9. Epidemiologia Molecular ………...102
9.1. Identificação da diversidade genética de Enterocytozoon
bieneusi ……….102
9.2. Identificação de diversidade genética de Encephalitozoon
cuniculi ……….107
9.3. Identificação de diversidade genética de Encephalitozoon
hellem ………108
9.4. Identificação de diversidade genética de Encephalitozoon
xl
SEGUNDA PARTE
(Caracterização Epidemiológica de Microsporidiose em Portugal ) .... 111 CapítuloI – Objectivos Gerais………...113 Capítulo II – Material e Métodos …...117
1. População estudada ………...118 1.1. População humana ………....118 1.1.1. Amostras Fecais ...118 1.1.2. Amostras de Urina ………..119 1.1.3. Secrecções pulmonares ………...120 1.2. População animal ………...……...………...121 1.2.1. Cães e gatos ………...121 1.2.2. Gado bovino de explorações leiteiras ...122 1.2.3 Animais silváticos em cativeiro ………...122 1.2.4 Animais silváticos de vida livre ……..………...124 1.2.5 Aves exóticas de gaiola e pombos urbanos ...125 1.3. Amostras ambientais ...126 1.4. Definição do critério de positividade ...128 2. Processamento e concentração de amostras fecais, urina e secrecções
pulmonares (expectoração induzida e lavados broncoalveolares) ….….128 2.1. Amostras fecais ...128
2.2 Amostras de urina ………...129 2.3 Secreções pulmonares ...129 2.3.1 Expectoração induzida (EI) ...130 2.3.2 Lavado broncoalveolar (LBA) ………...130 2.4 Obtenção do conteúdo intestinal e exsudado traqueal post mortem
de um grupo de aves ………..……...…...131
3. Coloração diferencial ...132
3.1 Coloração pelo Gram-Chromotrope (GC) ………...132 3.1.1 Quantificação da carga parasitária ………...133 4. Extracção de DNA ...134
xli
5. Diagnóstico molecular das espécies Enterocytozoon bieneusi,
Encephalitozoon intestinalis, Encephalitozoon cuniculi,
Encephalitozoon hellem e Vittaforma-like .... 136
5.1 Amplificação de DNA genómico de microsporídios no geral ...138 5.2 Amplificação de DNA genómico de Encephalitozoon intestinalis,
Encephalitozoon cuniculi, Encephalitozoon hellem ...139
5.3 Amplificação e caracterização genética de DNA genómico de
Enterocytozoon bieneusi ………...141 5.3.1 Amplificação de DNA genómico de Enterocytozoon
bieneusi ……….……141
5.3.2 Desenvolvimento e optimização de uma nova técnica de PCR nested …...142
5.3.3 Caracterização génetica dos isolados de Enterocytozoon
bieneusi ……….144
5.4 Caracterização Genética de uma nova espécie de microsporídio - Vittaforma-like ...145
5.4.1 Detecção da espécie Vittaforma-like ……….………….145 5.4.2 Amplificação de DNA genómico de Vittaforma-like ...146 5.5 Visualização do DNA amplificado ………...147 6. Purificação e Sequenciação dos fragmentos amplificados
por PCR ………..148
6.1 Análise da diversidade genética da região ITS rRNA de
E. bieneusi de animais (mamíferos) ……...152
7. Análise estatística ...153 Capitulo III - Detecção e caracterização genética de microsporidia
em humanos (seropositivos e seronegativos para VIH) ...155 1. Introdução ……….………..………..….…………...157 2. Resultados ………...……….………...………….158 2.1 Detecção e identificação de microsporídios em amostras fecais,
amostras de urina e secreções pulmonares de doentes infectados por VIH ...158
xlii
2.1.1.1 Seropositivos para o VIH ...……….162 2.1.1.2 Seronegativos para VIH .……….…164 2.1.1.3 Caracterização genética dos isolados de
Enterocytozoon bieneusi e Vittaforma-like ……….…165
2.1.2 Microsporidia em amostras de urina …..……….171 2.1.2.1 Seropositivos para ..VIH ………...171 2.1.2.2 Seronegativos para VIH ………….………...172
2.1.3 Microsporidia em secreções pulmonares ……….….172
2.1.3.1 Seropositivos para VIH …..………...173
3. Discussão ………...……….………..……….175 Capitulo IV - Detecção e caracterização genética de microsporidia
em animais ………...187 1. Introdução ……….……….……….….…………...….….189 2. Resultados ………...……….……….190
2.1 Detecção e identificação de microsporídios em animais ...190
2.1.1 Ocorrência e identificação de microsporídios
em animais domésticos - cães e gatos e cães errantes ...190 2.1.2 Ocorrência e identificação de microsporídios em bovinos .….191 2.1.3 Ocorrência e identificação de microsporídios em animais
silváticos em cativeiro (Jardim Zoológico de Lisboa) ……….192 2.1.4 Ocorrência e identificação de microsporídios em animais
silváticos de vida livre ……….……….193 2.1.5 Diversidade genética da região ITS rRNA de
Enterocytozoon bieneusi na população de animais estudada ...195
2.2 Microsporidia em aves exóticas de gaiola e pombos
urbanos de Lisboa .………...197 2.2.1 Ocorrência e identificação de microsporídios ………..197 2.2.2 Caracterização genética dos isolados de Enterocytozoon
bieneusi e Encephalitozoon hellem ...………...199
xliii
Capitulo V - Detecção e caracterização genética de microsporidia
em amostras ambientais ………...…..213
1. Introdução ……….……….……….….………….…...215 2. Resultados ………...……….…..………….…...216
2.1 Detecção e identificação de microsporídios em água
subterrânea e superficial, tratada e não tratada ...216
3. Discussão ………...………...….………...217 Capitulo VI – Conclusão ……….………...221 Capitulo VII – Referências bibliográficas ………..229
xlv
Índice de figuras
Página Figura 1. Fotografia de Karl Wilhelm von Nägeli (1817-1891) e capa
da publicação aludindo à sua palestra sobre N. bombysis,
em 1857 ... 3
Figura 2. Fotografia de microscopia electrónica de varrimento de esporos de
microsporidia em cultura in vitro ... 7
Figura 3. Diagrama e fotografia de microscopia electrónica de transmissão
da estrutura interna de um esporo de microsporídio ... 19
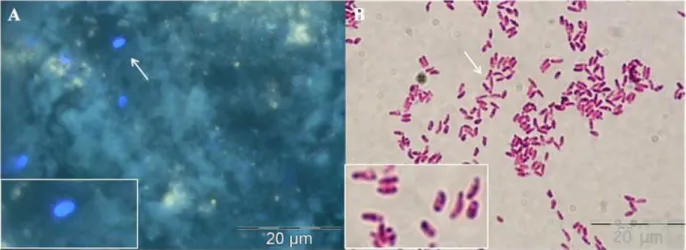
Figura 4. Fotografias de microscopia electrónica de varrimento do
esporo de microsporida com o filamento polar exteriorizado
injectando o esporoplasma na célula ... 21
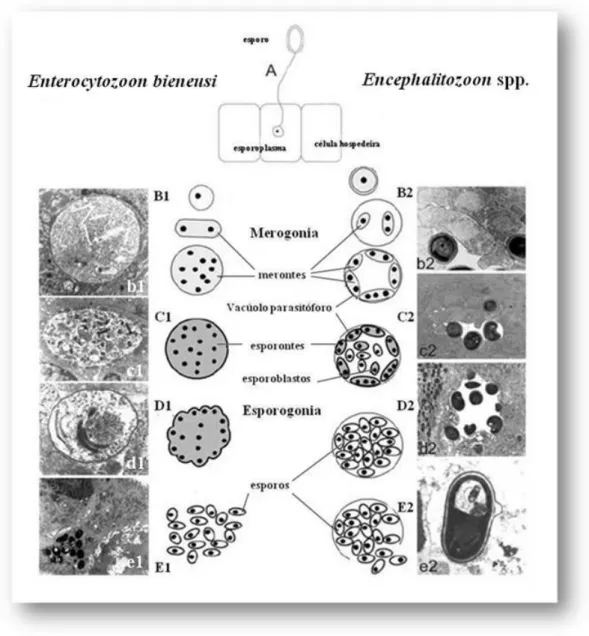
Figura 5. Representação esquemática do ciclo de vida de dois géneros de
Microsporidia patogénicos para o Homem (Enterocytozoon
bieneusi e Encephalitozoon spp.) ... 24
Figura 6. Secção de jejuno intestinal infectado por E. bieneusi. ... 30 Figura 7. Fotografia de esporos de Encephalitozoon cuniculi em esfregaço
de secreção pulmonar, corados pela técnica do calcoflúor; Fotografia de esporos de Encephalitozoon. intestinalis, em esfregaço de cultura, corados por Gram-Chromotrope ... 47
Figura 8. Fotografia de esporos de microsporidia, em esfregaço fecal,
corado por Gram-Chromotrope ………... 159
Figura 9. Fotografias dos produtos de PCR de isolados de E. bieneusi e
Vittaforma-like, após separação por electroforese em gel de agarose .... 160
Figura 10. Fotografia do produto de PCR do isolado de E. intestinalis após
separação por electroforese em gel de agarose ………...171
Figura 11. Fotografias de esporos de E. cuniculi, em esfregaço de lavado
xlvi
Figura 12. Fotografia do produto de PCR do isolado de E. cuniculi ... 174 Figura 13. Relação filogenética entre os genótipos de E. bieneusi
identificados nos mamíferos e outros genótipos de E. bieneusi,
inferida pela análise de sequências do gene ITS rRNA ... 196
Figura 14. Fotografia de esporos de Encepalitozoon hellem em esfregaço da
Mucosa traqueal de um papagaio cinzento (Psittacus erithacus).
xlvii
Índice de quadros
Página Quadro I. Espécies de microsporidia mais frequentes descritas como
infectantes para o Homem ………... 8
Quadro II. Espécies de microsporidia menos frequentes descritas como
infectantes para o Homem …... 9
Quadro III. Microsporídios patogénicos para o Homem, e respectivos
locais de infecção …... 29
Quadro IV. Revisão de primers utilizados no diagnóstico molecular de
Microsporidia …... 61
Quadro V. Terapêutica das microsporidioses ……....………... 68 Quadro VI. Diversos estudos de prevalência de E. bieneusi em seropositivos
para VIH, em África, América, Austrália e Ásia ………... 75
Quadro VII. Diversos estudos de prevalência de E. bieneusi em
seropositivos para VIH, na Europa ... 76
Quadro VIII. Casos exporádicos de infecção por E. cuniculi, confirmados
por técnicas de biologia molecular ……...………... 80
Quadro IX. Casos reportados de infecção por microsporidia em doentes
transplantados .. ………...84
Quadro X. Alguns reservatórios animais das espécies de microsporidia mais
frequentes infectantes para o Homem ... 94
Quadro XI. Alguns reservatórios animais das espécies de
microsporidia menos frequentes infectantes para o Homem ……... 95
Quadro XII. Genótipos de E. bieneusi caracterizados pela sequência da
região ITS rRNA, decritos no Homem ... 104
Quadro XIII. Genótipos de Enterocytozoon bieneusi caracterizados pela


![Figura 4. Fotografias de microscopia electrónica de varrimento do esporo de microsporida com o filamento polar exteriorizado injectando o esporoplasma na célula Adaptado de [Franzen 2008].](https://thumb-eu.123doks.com/thumbv2/123dok_br/19258559.978507/77.892.178.684.704.884/fotografias-microscopia-electrónica-varrimento-microsporida-exteriorizado-injectando-esporoplasma.webp)